
rtritídou (RA) alebo Crohnovou chorobou (CD) liečených adalimumabom aspoň počas prvého trimestra a 120 žien s RA alebo CD neliečených adalimumabom. Primárnym koncovým ukazovateľom bola prevalencia
závažných vrodených chýb. Miera gravidít, ktoré sa skončili najmenej jedným živonarodeným dieťaťom so závažnou vrodenou chybou, bola 6/69 (8,7 %) u žien liečených adalimumabom s RA
a 5/74 (6,8 %) u neliečených žien s RA (neupravený OR 1,31, 95 % CI 0,38 – 4,52) a 16/152 (10,5 %)
u žien liečených adalimumabom s CD a 3/32 (9,4 %) u neliečených žien s CD (neupravený OR 1,14,
95 % CI 0,31 – 4,16). Upravený OR (vzhľadom na východiskové rozdiely) bol 1,10 (95 % CI 0,45 –
2,73) u pacientov s RA a CD spolu. Medzi ženami liečenými a neliečenými adalimumabom neboli žiadne výrazné rozdiely v sekundárnych koncových ukazovateľoch zahŕňajúcich spontánne potraty, menšie vrodené chyby, predčasné pôrody, veľkosť dieťaťa pri pôrode a vážne alebo oportúnne infekcie a neboli hlásené žiadne mŕtvonarodené deti alebo malignity. Interpretácia údajov môže byť ovplyvnená metodologickými obmedzeniami štúdie vrátane malej veľkosti vzorky
a nerandomizovaného charakteru štúdie.
V štúdiách vývojovej toxicity, uskutočnených na opiciach, neboli zistené náznaky toxicity u matky, embryotoxicity alebo teratogenity. Predklinické údaje o účinku adalimumabu na postnatálnu toxicitu nie sú dostupné (pozri časť 5.3).
Adalimumab, podávaný v gravidite, môže vzhľadom na inhibíciu TNFa ovplyvniť normálne imunitné odpovede novorodenca. Adalimumab sa má používať počas tehotenstva, iba ak je to jednoznačne potrebné.
Adalimumab môže prechádzať placentou do séra detí, narodených ženám, ktoré boli počas gravidity liečené adalimumabom. Následkom toho môžu mať tieto deti zvýšené riziko vzniku infekcie. Podávanie živých vakcín (napr. BCG vakcína) dojčatám, ktoré boli in utero vystavené účinku adalimumabu sa neodporúča počas 5 mesiacov po poslednej injekcii adalimumabu, podanej matke počas gravidity.
Dojčenie
Obmedzené informácie z publikovanej literatúry naznačujú, že adalimumab sa vylučuje do materského
mlieka vo veľmi nízkych koncentráciách, adalimumab prítomný v materskom mlieku je v koncentráciách 0,1 % až 1 % zo sérovej hladiny matky. Perorálne podávané proteíny
imunoglobulínuG prechádzajú proteolýzou v čreve a majú zlúbiologickú dostupnosť. Nepredpokladajú
sa žiadne účinky na dojčených novorodencov/dojčatá. Z toho vyplýva, že Idacio sa môže používať počas dojčenia.
Fertilita
Nie sú dostupné údaje o vplyve adalimumabu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Idacio môže mať mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní Idacia sa
môže vyskytnúť závrat a porucha zraku (pozri časť 4.8).
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Adalimumab sa skúmal u 9506 pacientov v kľúčových kontrolovaných a otvorených štúdiách počas
60 mesiacov alebo dlhšie. Tieto štúdie zahŕňali pacientov s krátkodobou a dlhodobou reumatoidnou
artritídou, juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou
a artritídou spojenou s entezitídou), ako aj s axiálnou spondylartitídou (ankylozujúcou spondylitídou
a axiálnou spondylartitídou bez rádiologického dôkazu AS), psoriatickou artritídou, Crohnovou chorobou, ulceróznou kolitídou, pacientov so psoriázou, s hidradenitis suppurativa a uveitídou. Kľúčové kontrolované štúdie zahŕňali 6089 pacientov dostávajúcich adalimumab a 3801 pacientov dostávajúcich placebo alebo účinnýkomparátor počas kontrolovanej fázy.
Podiel pacientov, ktorí prerušili liečbu v dôsledku vedľajších účinkov počas dvojitozaslepených, kontrolovaných častí kľúčových štúdií bol 5,9 % u pacientov liečených adalimumabom
a 5,4 % pacientov, ktorým sa podávala kontrola.
Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (napr. zápal nosohltana, infekcia horných dýchacích ciest a zápal prinosových dutín), reakcie v mieste vpichu injekcie (erytém, svrbenie, krvácanie, bolesť alebo opuch), bolesť hlavy a muskuloskeletálna bolesť.
U adalimumabu boli hlásené závažné nežiaduce reakcie. Antagonisty TNF, ako je adalimumab, pôsobia na imunitný systém a ich používanie môže ovplyvniť obranyschopnosť organizmu voči infekciám a nádorovým ochoreniam.
Pri použití adalimumabu boli tiež hlásené fatálne a život ohrozujúce infekcie (vrátane sepsy, oportúnnych infekcií a TBC), reaktivácia HBV a rôzne malignity (vrátane leukémie, lymfómu a HSTCL).
Boli hlásené aj závažné hematologické, neurologické a autoimunitné reakcie. Patria k nim zriedkavé hlásenia pancytopénie, aplastickej anémie, centrálne a periférne prípady demyelinizácie a hlásenia lupusu, lupusu podobných stavov a Stevensovho-Johnsonovho syndrómu.
Pediatrická populácia
Vo všeobecnosti boli nežiaduce účinky u pediatrických pacientov podobné vo frekvencii a type tým,
ktoré boli pozorované u dospelých pacientov.
Tabuľkový zoznamnežiaducichreakcií
Nasledujúci zoznam nežiaducich účinkov je založený na výsledkoch z klinických skúšaní
a postmarketingových skúsenostiach a je zoradený podľa triedy orgánových systémov a frekvencie
v tabuľke 6: veľmi časté(³ 1/10); časté(³ 1/100 až < 1/10); menej časté(³ 1/1000 až < 1/100); zriedkavé(³ 1/10 000 až < 1/1000) a neznáme (nedajú sa odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Uvedená je najvyššia frekvencia pozorovaná pri rôznych indikáciách. V stĺpci „trieda orgánových systémov“ je vyznačená hviezdička (*), ak sa ďalšie informácie vyskytujú aj na inom mieste
v častiach 4.3, 4.4 a 4.8.
T
abuľka 6
N
ežiaduce účinky
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Infekcie a nákazy* Veľmi časté
Časté
Menej časté
Infekcie dýchacej sústavy (vrátane infekcií dolných a horných dýchacích ciest, pneumónie, sinusitídy, faryngitídy, nazofaryngitídy
a pneumónie spôsobenej vírusom herpesu)
Systémové infekcie (vrátane sepsy, kandidózy
a chrípky),
črevné infekcie (vrátane vírusovej gastroenteritídy),
infekcie kože a mäkkých tkanív (vrátane
paronychie, celulitídy, impetiga, nekrotizujúcej
fasciitídy a herpes zoster), infekcie ucha,
infekcie ústnej dutiny (vrátane herpes simplex, orálneho herpesu a infekcií zubov),
infekcie reprodukčného systému (vrátane vulvovaginálnej mykotickej infekcie), infekcie močovej sústavy (vrátane
pyelonefritídy), hubové infekcie,
infekcie kĺbov
Neurologické infekcie (vrátane vírusovej meningitídy),
oportúnne infekcie a tuberkulóza (vrátane
kokcidioidomykózy, histoplazmózy
a systémovej infekcie Mycobacterium avium),
bakteriálne infekcie, infekcie oka, divertikulitída1
Benígne a malígne nádory,
vrátane nešpecifikovaných
novotvarov (cysty a polypy)*
Časté
Menej časté
Zriedkavé
Neznáme
Karcinóm kože okrem melanómu (vrátane
bazocelulárneho karcinómu
a skvamocelulárneho karcinómu), benígne novotvary
Lymfóm**,
solídne orgánové tumory (vrátane karcinómu prsníka, pľúc a štítnej žľazy),
melanóm**
Leukémia1
Hepatosplenický T-bunkový lymfóm1, karcinóm z Merkelových buniek (neuroendokrinný karcinóm kože)1
Poruchy krvi a lymfatického
systému*
Veľmi časté
Časté
Leukopénia (vrátane neutropénie
a agranulocytózy), anémia
Leukocytóza,
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
trombocytopénia
Menej časté
Zriedkavé
Idiopatická trombocytopenická purpura
Pancytopénia
Poruchy imunitného systému* Časté
Menej časté
Zriedkavé
Hypersenzitivita,
alergie (vrátane sezónnej alergie)
Sarkoidóza1,
vaskulitída
Anafylaxia1
Poruchy metabolizmu a výživy Veľmi časté
Časté
Zvýšenie hladiny lipidov
hypokaliémia, hyperurikémia,
abnormálne hladiny nátria v krvi,
hypokalciémia, hyperglykémia,
hypofosfatémia,
dehydratácia
Psychické poruchy Časté Poruchy nálady (vrátane depresie),
úzkosť,
nespavosť
Poruchy nervového systému* Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť hlavy
Parestézie (vrátane hypestézie), migréna,
kompresia nervového koreňa
Cerebrovaskulárna príhoda1, tremor,
neuropatia
Sclerosis multiplex,
demyelinizačné ochorenie (napr. optická neuritída, Guillain-Barrého syndróm)1
Poruchy oka Časté
Menej časté
Poruchy videnia,
zápal spojiviek, blefaritída, opuch oka
Dvojité videnie
Poruchy ucha a labyrintu Časté
Menej časté
Závraty
Strata sluchu, tinnitus
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Poruchy srdca a srdcovej
činnosti*
Časté
Menej časté
Zriedkavé
Tachykardia
Infarkt myokardu1, arytmia,
kongestívne srdcové zlyhanie
Zastavenie srdca
Poruchy ciev Časté
Menej časté
Hypertenzia,
návaly horúčavy, hematóm
Aneuryzma aorty,
vaskulárna arteriálna oklúzia, tromboflebitída
Poruchy dýchacej sústavy,
hrudníka a mediastína*
Časté
Menej časté
Zriedkavé
Astma,
dyspnoe,
kašeľ
Pľúcna embólia1,
intersticiálna pľúcna choroba, chronická obštrukčná choroba pľúc,
pneumonitída, pleurálny výpotok1
Pľúcna fibróza1
Poruchy gastrointestinálneho
traktu
Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť brucha,
nauzea a vracanie
Gastrointestinálna hemorágia,
dyspepsia,
gastroezofageálna refluxná choroba, Sjögrenov syndróm
Pankreatitída, dysfágia, opuch tváre
Intestinálna perforácia1
Poruchy pečene a žlčových
ciest*
Veľmi časté
Menej časté Zriedkavé Neznáme
Zvýšenie hladín pečeňových enzýmov
Zápal žlčníka a žlčové kamene, steatóza pečene,
zvýšenie hladiny bilirubínu v krvi,
Hepatitída,
reaktivácia hepatidídy B1,
autoimunitná hepatitída1
Zlyhanie pečene1
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Poruchy kože a podkožného
tkaniva
Veľmi časté
Časté
Menej časté
Zriedkavé
Neznáme
Exantém (vrátane exfoliatívneho exantému)
Zhoršenie alebo novovzplanutie psoriázy (vrátane palmoplantárnej pustulárnej psoriázy)1, žihľavka,
tvorba modrín (vrátane purpury), dermatitída (vrátane ekzému),
onychoklázia,
hyperhidróza, alopécia1, svrbenie
Nočné potenie,
jazvy
Multiformný erytém1,
Stevensov-Johnsonov syndróm1,
angioedém1,
kutánna vaskulitída1,
lichenoidná kožná reakcia1
Zhoršenie príznakov dermatomyozitídy1
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť kostrových svalov
Svalové spazmy (vrátane zvýšenej hladiny
kreatínfosfokinázy v krvi)
Rabdomyolýza,
systémový lupus erythematosus
Syndróm podobný lupusu1
Poruchy obličiek a močových
ciest
Časté
Menej časté
Poškodenie obličiek,
hematúria
Noktúria
Poruchy reprodukčného
systému a prsníkov
Menej časté Erektilná dysfunkcia
Celkové poruchy a reakcie
v mieste podania*
Veľmi časté
Časté
Menej časté
Reakcia v mieste vpichu (vrátane erytému
v mieste vpichu)
Bolesť na hrudníku,
opuch,
horúčka1
Zápal
Laboratórne a funkčné
vyšetrenia*
Časté Poruchy koagulácie a krvácania (vrátane
predĺženia aktivovaného parciálného tromboplastínového času),
pozitívny test na autoprotilátky (vrátane
protilátok proti dvojvláknovej DNA),
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
zvýšená hladina laktátdehydrogenázy v krvi
Úrazy, otravy a komplikácie
liečebného postupu
Časté Zhoršené hojenie
* ďalšie informácie sa nachádzajú v častiach 4.3, 4.4 a 4.8
** vrátane otvorených rozšírených klinických skúšaní
1 vrátane údajov zo spontánneho hlásenia
Hidradenitis suppurativaBezpečnostný profil u pacientov s HS liečených adalimumabom jedenkrát za týždeň bol v súlade so
známym bezpečnostným profilom adalimumabu.
UveitídaBezpečnostný profil u pacientov s uveitídou liečených adalimumabom každý druhý týždeň bol
v súlade so známym bezpečnostným profilom adalimumabu.
Opis vybranýchnežiaducichreakciíReakcie v mieste podania injekcieV kľúčových kontrolovaných štúdiach u dospelých a u detí sa u 12,9 % pacientov liečených adalimumabom objavili reakcie v mieste podania injekcie (erytém a/alebo svrbenie, krvácanie, bolesť alebo opuch) v porovnaní so 7,2 % pacientov, ktorým sa podávalo placebo alebo účinná kontrola. Reakcie v mieste vpichu všeobecne nevyžadovali prerušenie podávania lieku.
InfekcieV kľúčových kontrolovaných štúdiach sa u dospelých a u detí liečených adalimumabom vyskytla infekcia vo frekvencii 1,51 prípadu na pacienta za rok a u pacientov, ktorým sa podávalo placebo a účinná kontrola vo frekvencii 1,46 prípadu na pacienta za rok. Infekcie predstavovali najmä zápal sliznice nosohltana, infekciu horných dýchacích ciest a sinusitída. Poodznení infekcie väčšina pacientov pokračovala v liečbe adalimumabom.
Incidencia závažných infekcií bola 0,04 prípadov na pacienta za rok u pacientov liečených adalimumabom a 0,03 prípadu na pacienta za rok u pacientov, ktorým sa podávalo placebo a účinná kontrola.
V kontrolovaných a otvorených štúdiách s adalimumabom u dospelých a detí sa hlásili závažné infekcie (vrátane zriedkavo sa vyskytujúcich fatálnych infekcií), ktoré zahŕňali hlásenia o výskyte tuberkulózy (vrátane miliárnych a extrapulmonálnychlokácií) a invazívnych oportúnnych infekcií (napr. diseminovaná alebo extrapulmonárna histoplazmóza, blastomykóza, kokcidioidomykóza, pneumocystóza, kandidóza, aspergilóza a listerióza). Väčšina prípadov tuberkulózysa vyskytla
v priebehu prvých ôsmich mesiacov od začiatku liečby a môže odrážať opätovné vzplanutie latentného
ochorenia.
Malignity a lymfoproliferatívne poruchyV štúdii s adalimumabom v liečbe pacientov s juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou a artritídou spojenou s entezitídou)neboli u 249 pediatrických pacientov pri expozícii 655,6 pacientorokov pozorované žiadne malignity. Naviac sa nezaznamenali žiadne malignity u 192 pediatrických pacientov pri expozícii 498,1pacientorokov v štúdiách s
adalimumabom u pediatrických pacientov s Crohnovou chorobou. V klinickom skúšaní adalimumabu u pediatrických pacientov s chronickou ložiskovou psoriázou neboli pozorované u 77 pediatrických pacientov pri expozícii 80,0 pacientorokov žiadne malignity.V štúdii s adalimumabom v liečbe pediatrických pacientov s uveitídou neboli u 60 pediatrických pacientov pri expozícii 58,4 pacientorokov pozorované žiadne malignity.
Počas kontrolovaných častí kľúčových skúšaní adalimumabu trvajúcich minimálne 12 týždňov u dospelých pacientov so strednou až ťažkou aktívnou reumatoidnou artritídou, ankylozujúcou spondylitídou, axiálnou spondylartritídou bez rádiografického dôkazu AS, psoriatickou artritídou, psoriázou, hidradenitis suppurativa, Crohnovou chorobou, ulceróznou kolitídou a uveitídou sa malignity, iné ako lymfóm a nemelanómová rakovina kože, zistili s frekvenciou (95 % interval spoľahlivosti) 6,8 (4,4; 10,5) na 1000 pacientorokov medzi 5291 pacientmi liečenými adalimumabom v porovnaní so 6,3 (3,4; 11,8) na 1000 pacientorokov medzi 3444 kontrolnými pacientmi (stredná dĺžka trvania liečby adalimumabom bola 4,0 mesiacov a v kontrolnej skupine pacientov
3,8 mesiacov). Frekvencia (95 % interval spoľahlivosti) nemelanómového druhu rakoviny kože bola
8,8 (6,0; 13,0) na 1000 pacientorokov medzi pacientmi liečenými adalimumabom a 3,2 (1,3; 7,6) na
1000 pacientorokov medzi kontrolnými pacientmi. Z karcinómov kože sa skvamózne bunkové karcinómy vyskytli s frekvenciou (95 % interval spoľahlivosti) 2,7 (1,4; 5,4) na 1000 pacientorokov
medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na 1000 pacientorokov medzi kontrolnými
pacientmi. Frekvencia (95 % interval spoľahlivosti) lymfómov bola 0,7 (0,2; 2,7) na
1000 pacientorokov medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na 1000 pacientorokov
medzi kontrolnými pacientmi.
Ak sa skombinujú kontrolované časti týchto skúšaní a prebiehajúce a ukončené otvorené rozšírené štúdie so strednou dobou trvania približne 3,3 roka zahŕňajúce 6427 pacientov a viac ako
26 439 pacientorokov liečby, pozorovaná frekvencia malignít, iných ako lymfóm a nemelanómový druh rakoviny kože, je približne 8,5 na 1000 pacientorokov. Pozorovaná frekvencia nemelanómovej
rakoviny kože je približne 9,6 na 1000 pacientorokov a pozorovaná frekvencia lymfómov je približne
1,3 na 1000 pacientorokov.
V postmarketingovej praxi od januára 2003 do decembra 2010, prevažne u pacientov s reumatoidnou artritídou, je hlásená frekvencia malignít približne 2,7 na 1000 pacientorokov liečby. Hlásené frekvencie nemelanómového druhu rakoviny kože a lymfómov sú približne 0,2 a 0,3 na
1000 pacientorokov liečby (pozri časť 4.4).
U pacientov liečených adalimumabom boli v postmarketingovej praxi hlásené zriedkavé prípady
hepatosplenického T-lymfómu (pozri časť 4.4).
Autoprotilátky
U pacientov sa robilo vyšetrenie vzoriek séra na autoprotilátky v rôznych časových intervaloch
v štúdiách I - V s reumatoidnou artritídou. V týchto štúdiách sa u pacientov, ktorí mali negatívne východiskové titre antinukleových protilátok, zistili pozitívne titre v 24. týždni liečby
u 11,9 % pacientov liečených adalimumabom a u 8,1 % pacientov, ktorým sa podávalo placebo
a aktívna kontrola. Vo všetkých štúdiách s reumatoidnou artritídou a psoriatickou artritídou sa vyvinuli u dvoch z 3441 pacientov liečených adalimumabom klinické príznaky poukazujúce na
novovzniknutý lupusu podobný syndróm. Po prerušení liečby sa stav pacientov zlepšil. U žiadneho
pacienta sa nerozvinula lupózna glomerulonefritída alebo symptómy postihnutia centrálneho nervového systému.
Poruchafunkcie pečene a žlčových ciest
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s reumatoidnou
artritídou a psoriatickou artritídou s kontrolným obdobím v rozmedzí 4 až 104 týždňov prišlo
k zvýšeniu ALT ≥ 3 x horná hranica normálnej hodnoty (upper limit of normal – ULN) u 3,7 %
pacientov liečených adalimumabom a u 1,6 % pacientov, ktorým sa podávala kontrola.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 4 až 17 rokov, a u pacientov s artritídou spojenou s entezitídou, ktorí boli vo veku 6 až 17 rokov, prišlo k zvýšeniu hladiny ALT ≥ 3 x ULN u 6,1 % pacientov liečených adalimumabom a u 1,3 % pacientov, ktorým sa podávala kontrola. Väčšina prípadov zvýšenia hladiny ALT sa vyskytla pri súbežnom používaní metotrexátu. Žiadne zvýšenie hladiny ALT ≥ 3 x ULN sa nevyskytlo v skúšaní fázy 3 s adalimumabom u pacientov
s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 2 až < 4 roky.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s Crohnovou chorobou a ulceróznou kolitídou s kontrolným obdobím v rozmedzí 4 až 52 týždňov prišlo k zvýšeniu
ALT ≥ 3 x ULN u 0,9 % pacientov liečených adalimumabom a u 0,9 % pacientov, ktorým sa podávala
kontrola.
V štúdii fázy3 s adalimumabom u pediatrických pacientov s Crohnovou chorobou, ktorá hodnotila účinnosť a bezpečnosť dvoch udržiavacích dávkovacích režimov po dobu až 52 týždňov liečby, ktoré boli upravené podľa telesnej hmotnosti a ktoré nasledovali po úvodnej liečbe, upravenej podľa telesnej hmotnosti, prišlo k zvýšeniu ALT ≥ 3 x ULN u 2,6 % (5/192) pacientov, z ktorých 4dostávali súbežne imunosupresíva na začiatku liečby.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s ložiskovou psoriázous kontrolným obdobím v rozmedzí 12 až 14 týždňov prišlo k zvýšeniu ALT ≥ 3 x ULN u 1,8 % pacientov liečených adalimumabom a u 1,8 % pacientov, ktorým sa podávala kontrola.
V klinickom skúšaní fázy 3 s adalimumabom u pediatrických pacientov s ložiskovou psoriázou sa nevyskytli žiadne zvýšenia ALT ≥ 3 x ULN.
V kontrolovaných štúdiách s adalimumabom (počiatočné dávky 160 mg v týždni 0 a 80 mg
v 2. týždni, následne 40 mg jedenkrát za týždeň počínajúc 4. týždňom) u pacientov s hidradenitis suppurativa s trvaním kontrolného obdobia v rozmedzí 12 až 16 týždňov, nastalo zvýšenie
ALT ≥ 3 x ULN u 0,3 % pacientov liečených adalimumabom a u 0,6 % kontrolných pacientov.
V kontrolovaných klinických skúšaniach s adalimumabom (úvodné dávky 80 mg v týždni 0, potom
40 mg každé dva týždne od 1. týždňa) u dospelých pacientov s uveitídou, ktoré trvali až 80 týždňov s mediánom expozície 166,5 dňa u pacientov liečených adalimumabom a 105,0 dňa u pacientov, ktorým sa podávala kontrola, nastalo zvýšenie ALT ≥ 3 x ULN u 2,4 % pacientov liečených adalimumabom a 2,4 % pacientov, ktorým sa podávala kontrola.
U všetkých indikácií v klinických štúdiách boli pacienti so zvýšenou ALT asymptomatickí a zvýšenia boli vo väčšine prípadov prechodné a upravili sa v priebehu liečby. Avšak aj po uvedení na trh boli
u pacientov, liečených adalimumabom, hlásené prípady zlyhania pečene, ako aj menej závažné
poruchy pečene, ktoré môžu predchádzať zlyhaniu pečene, ako je hepatitída, vrátane autoimunitnej hepatitídy.
Súbežná liečbasazatioprínom/6-merkaptopurínom
V štúdiách s Crohnovou chorobou u dospelých bol vyšší výskyt malignít a nežiaducich udalostí
súvisiacich s vážnymi infekciami pri kombinácii adalimumabu a azatioprínu/6-merkaptopurínu
v porovnaní s adalimumabom samotným.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v PríloheV.
4.9 Predávkovanie
V klinických štúdiách nebola pozorovaná žiadna toxicita obmedzujúca dávku. Najvyššou hodnotenou dávkou bola opakovaná intravenózna dávka 10 mg/kg, čo je približne 15-násobok odporúčanej dávky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: imunosupresíva, inhibítory tumor nekrotizujúceho faktora alfa (TNF-α).
ATC kód: L04AB04
Idacio je biosimilárny liek. Podrobné informácie sú dostupné na webovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.
MechanizmusúčinkuAdalimumab sa špecificky viaže na TNF a neutralizuje biologickú funkciu TNF blokovaním jeho
interakcie s p55 and p75 receptormi TNF na povrchu bunky.
Adalimumab tiež moduluje biologické odpovede, ktoré sú navodené alebo regulované TNF, vrátane zmien hladín adhezívnych molekúl, ktoré zodpovedajú za migráciu leukocytov (ELAM-1, VCAM-1 a ICAM-1 pri IC50 z 0,1 – 0,2 nM).
Farmakodynamické účinkyU pacientov s reumatoidnou artritídou sa po liečbe adalimumabom pozoroval rýchly pokles hladín
reaktantov akútnej fázy zápalu (C-reaktívny proteín (CRP) a sedimentácia erytrocytov (FW))
a sérových cytokínov (IL-6) oproti východiskovému stavu. Po podaní adalimumabu sa znížili aj sérové koncentrácie matrixových metaloproteináz (MMP-1 a MMP-3), ktoré vyvolávajú remodeláciu tkaniva,
zodpovednú za deštrukciu chrupky. U pacientov liečených adalimumabom zvyčajne došlo k zlepšeniu
hematologických príznakov chronického zápalu.
Rýchly pokles hladín CRP sa pozoroval počas liečby adalimumabom aj u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, Crohnovou chorobou, ulceróznou kolitídou a hidradenitis suppurativa. U pacientov s Crohnovou chorobou sa pozorovalo zníženie počtu buniek, exprimujúcich zápalové markery v čreve, vrátane signifikantnej redukcie expresie TNFα. Endoskopické štúdie na intestinálnej mukóze preukázali dôkaz hojenia sliznice u pacientov liečených adalimumabom.
Klinická účinnosťabezpečnosťReumatoidná artritídaAdalimumab bola hodnotený u viac ako 3000 pacientov vo všetkých klinických štúdiách zameraných na reumatoidnú artritídu. Účinnosť a bezpečnosť adalimumabu bola hodnotená v piatich randomizovaných, dvojito zaslepených a dobre kontrolovaných štúdiách. Niektorí pacienti boli liečení až 120 mesiacov.
V RA štúdii I bolo hodnotených 271 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, vo veku ≥ 18 rokov, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom a liečba metotrexátom v dávkach od 12,5 do 25 mg (10 mg v prípade neznášanlivosti metotrexátu) každý týždeň pri konštantnej dávke 10 až 25 mg každý týždeň mala nedostatočnú účinnosť. Pacienti dostávali dávky 20, 40 alebo 80 mg adalimumabu alebo placebo každý druhý týždeň počas 24 týždňov.
V RA štúdii II sa hodnotilo 544 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom. Pacientom boli každý druhý týždeň po dobu 26 týždňov podávané subkutánne dávky 20 alebo 40 mg adalimumabu a placebo v týždňoch bez podania aktívnej liečby alebo bolo rovnakú dobu podávané každý týždeň placebo. Nebolo povolené podávanie žiadneho iného chorobu modifikujúceho antireumatického lieku.
V RA štúdii III sa hodnotilo 619 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, a ktorí mali nedostatočnú odpoveď na metotrexát v dávkach od 12,5 do 25 mg alebo netolerovali dávku 10 mg metotrexátu každý týždeň. V tejto štúdii boli tri skupiny. Prvá skupina dostávala injekcie placeba raz týždenne počas 52 týždňov. Druhá skupina dostávala 20 mg adalimumabu každý týždeň počas 52 týždňov. Tretia skupina dostávala
40 mg adalimumabu každý druhý týždeň a placebo v týždňoch bez podania aktívnej liečby. Po uplynutí prvých 52 týždňov bolo 457 pacientov zaradených do otvorenej predĺženej fázy štúdie,
v ktorej sa podávalo 40 mg adalimumabu/MTX každý druhý týždeň až po dobu 10 rokov.
V RA štúdii IV sa primárne hodnotila bezpečnosť u 636 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac. Štúdie sa zúčastnili pacienti, ktorí ešte neboli liečení chorobu modifikujúcim antireumatickým liekom alebo pacienti
s predchádzajúcou reumatoidnou liečbou, v ktorej naďalej pokračovali, pod podmienkou, že liečba bola stabilná minimálne 28 dní. Tieto terapie zahrňujú metotrexát, leflunomid, hydroxylchlorochín,
sulfasalazín a/alebo soli zlata. Pacienti boli randomizovaní na 40 mg adalimumabu alebo placebo,
ktoré dostávali každý druhý týždeň počas 24 týždňov.
V RA štúdii V sa hodnotilo 799 dospelých pacientov so stredne ťažkou až ťažkou aktívnou včasnou reumatoidnou artritídou doposiaľ neliečených metotrexátom (priemerné trvanie ochorenia menej ako
9 mesiacov). Táto štúdia hodnotila účinnosť 40 mg adalimumabu každý druhý týždeň/kombinovanú
terapiu s metotrexátom, adalimumabu 40 mg každý druhý týždeň v monoterapii a metotrexátu
v monoterapii na zníženie prejavov a príznakov a rýchlosti progresie poškodenia kĺbov u reumatoidnej
artritídy počas 104 týždňov.Po dokončení prvých 104 týždňov bolo 497 pacientov zaradených do otvorenej predĺženej fázy štúdie, v ktorej sa podávalo 40 mg adalimumabu každý druhý týždeň po
dobu až 10 rokov.
Primárnym koncovým ukazovateľom v RA štúdiách I, II a III a sekundárnym koncovým ukazovateľom v RA štúdii IV bolo percento pacientov, u ktorých sa dosiahla odpoveď ACR 20 v 24. alebo 26. týždni. Primárnym koncovým ukazovateľom v RA štúdii V bolo percento pacientov, ktorí dosiahli odpoveď ACR 50 v 52. týždni. RA štúdie III a V mali ďalší primárny koncový ukazovateľ po 52 týždňoch, a to spomalenie progresie ochorenia (hodnotené pomocou výsledkov röntgenu). RA štúdia III mala primárny koncový ukazovateľ aj zmenu v kvalite života.
ACR odpoveď
Percento pacientov liečených adalimumabom, u ktorých sa dosiahla odpoveď ACR 20, 50 a 70, bolo
konzistentné v RA štúdiách I, II a III. Výsledky pre dávku 40 mg každý druhý týždeň sú zhrnuté
v tabuľke 7.
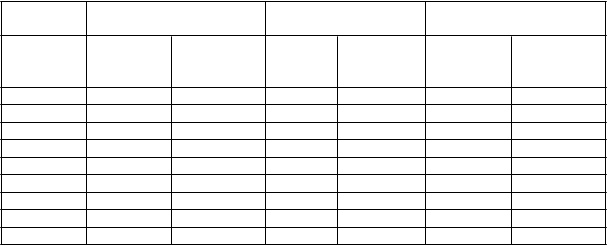
T
abuľka 7
AC
R odpovede v placebom kontrolovaných štúdiách
(
percento pacientov)
Odpoveď RA štúdia Ia** RA štúdia IIa** RA štúdia IIIa**
ACR 20
Placebo/
MTXc
n = 60
Adalimumabb/
MTXc
n = 63
Placebo
n = 110
Adalimumabb
n = 113
Placebo/
MTXc
n = 200
Adalimumabb/
MTXc
n = 207
6 mesiacov 13,3 % 65,1 % 19,1 % 46,0 % 29,5 % 63,3 %
12 mesiacov NA NA NA NA 24,0 % 58,9 % ACR 50
6 mesiacov 6,7 % 52,4 % 8,2 % 22,1 % 9,5 % 39,1 %
12 mesiacov NA NA NA NA 9,5 % 41,5 % ACR 70
6 mesiacov 3,3 % 23,8 % 1,8 % 12,4 % 2,5 % 20,8 %
12 mesiacov NA NA NA NA 4,5 % 23,2 %
a RA štúdia I po 24 týždňoch, RA štúdia II po 26 týždňoch a RA štúdia III po 24 a 52 týždňoch
b 40 mg adalimumabu podávaného každý druhý týždeň
c MTX = metotrexát
**p < 0,01; adalimumab verzus placebo
V RA študiách I - IV sa po 24 alebo po 26 týždňoch v porovnaní s placebom zlepšili všetky jednotlivé
zložky kritérií odpovede ACR (počet bolestivých a opuchnutých kĺbov, hodnotenie aktivity ochorenia a bolesti lekárom a pacientom, skóre indexu postihnutia (HAQ) a hodnoty CRP (mg/dl)). V RA štúdii III tieto zlepšenia pretrvávali počas 52 týždňov.
V otvorenej predĺženej fáze RA štúdie III si väčšina pacientov s ACR odozvou udržala odozvu pri sledovaní až po dobu 10 rokov. Z 207 pacientov, ktorí boli randomizovaní na adalimumab40 mg každý druhý týždeň, pokračovalo 114 pacientov s adalimumabom 40 mg každý druhý týždeň po dobu
5 rokov. Medzi týmito pacientmi malo 86 pacientov (75,4 %) odpoveď ACR 20, 72 pacientov
(63,2 %) odpoveď ACR 50 a 41 pacientov (36 %) odpoveď ACR 70. 81 pacientov z 207 pokračovalo
s adalimumabom 40 mg každý druhý týždeň po dobu 10 rokov. Medzi týmito pacientmi malo
64 pacientov (79,0 %) odpoveď ACR 20, 56 pacientov (69,1 %) odpoveď ACR 50 a 43 pacientov
(53,1 %) odpoveď ACR 70.
V RA štúdii IV bola odpoveď ACR 20 u pacientov liečených adalimumabom spolu so štandardnou liečbou štatisticky signifikantne lepšia ako u pacientov, ktorým sa podávalo placebo spolu
so štandardnou liečbou (p < 0,001).
V RA štúdiách I - IV dosiahli pacienti liečení adalimumabom štatisticky významné odpovede ACR 20
a 50 v porovnaní s placebom a to už o jeden až dva týždne od začiatku liečby.
V RA štúdii V u pacientov s včasnou reumatoidnou artritídou, ktorí doposiaľ neboli liečení metotrexátom, viedla kombinovaná terapia adalimumabom a metotrexátom k rýchlejšej a významne väčšej odpovedi ACR ako monoterapia metotrexátom a monoterapia adalimumabom v 52. týždni
a odpoveď pretrvávala aj v 104. týždni (pozri tabuľku 8).
T
abuľka 8
AC
R odpoveď v RA štúdii V
(
percento pacientov)
O
dpoveď
MTX
n = 257
Adalimumab n = 274
Adalimumab/
MTX
n = 268
Hodnota pa
Hodnota pb
Hodnota pc

ACR 20
Týždeň 52 62,6 % 54,4 % 72,8 % 0,013 < 0,001 0,043
Týždeň 104 56,0 % 49,3 % 69,4 % 0,002 < 0,001 0,140
ACR 50
Týždeň 52 45,9 % 41,2% 61,6 % < 0,001 < 0,001 0,317
Týždeň 104 42,8 % 36,9 % 59,0 % < 0,001 < 0,001 0,162
ACR 70
Týždeň 52 27,2 % 25,9 % 45,5 % < 0,001 < 0,001 0,656
Týždeň 104 28,4 % 28,1 % 46,6 % < 0,001 < 0,001 0,864
a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabu a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
chodnota p pochádza z párového porovnania monoterapie adalimumabu a monoterapie metotrexátom
pomocou Mannovho-Whitneyho U testu
V predĺženej otvorenej RA štúdii V sa odpovede ACR udržali počas obdobia sledovania až 10 rokov.
Z 542 pacientov, ktorí boli randomizovaní na liečbu adalimumabom40 mg každý druhý týždeň,
170 pacientov pokračovalo v liečbe adalimumabom 40 mg každý druhý týždeň po dobu 10 rokov. Spomedzi týchto pacientov malo 154 pacientov (90,6 %) odpoveď ACR 20, 127 pacientov (74,7 %) malo odpoveď ACR 50 a 102 pacientov (60,0 %) malo odpoveď ACR 70.
V 52. týždni dosiahlo 42,9 % pacientov liečených kombináciou adalimumab/metotrexát klinickú remisiu (DAS28 (CRP) < 2,6) v porovnaní s 20,6 % pacientov liečených metotrexátom v monoterapii a 23,4 % pacientov liečených adalimumabom v monoterapii. Kombinovaná terapia adalimumab/metotrexát bola klinicky a štatisticky lepšia ako monoterapia metotrexátom (p < 0,001)
a adalimumabom (p < 0,001) z hľadiska dosiahnutia stavu nízkej aktivity ochorenia u pacientov
so stredne ťažkou až ťažkou formou reumatoidnej artritídy diagnostikovanou v nedávnom období. Odpoveď v dvoch monoterapeutických ramenách štúdie bola podobná (p = 0,447).Z 342 pacientov
pôvodne randomizovaných na liečbu adalimumabom v monoterapii alebo na kombinovanú liečbu
adalimumab/metotrexát, ktorí boli zaradení do otvorenej predĺženej štúdie, 171 pacientov dokončilo
10 rokov liečby adalimumabom. Spomedzi týchto pacientov bola u 109 pacientov (63,7 %) hlásená
remisia po 10 rokoch.
Rádiografi cká odpove ďV RA štúdii III, kde priemerná dĺžka trvania reumatoidnej artritídy u pacientov liečených
adalimumabom bola približne 11 rokov, bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky
a vyjadrené ako zmena modifikovaného celkového Sharpovho skóre (Total Sharp Score- TSS) a jeho komponentov, skóre erózie a skóre zúženia kĺbovej štrbiny. U pacientov liečených adalimumabom/metotrexátom sa zistila významne menšia rádiografická progresia v 6. a 12. mesiaci liečby ako u pacientov liečených metotrexátom v monoterapii (pozri tabuľku 9).
V otvorenom predĺžení RA štúdie III zníženie stupňa progresie štrukturálneho poškodenia
v podskupinách pacientov pretrvávalo 8 a 10 rokov. Po 8 rokoch bolo rádiograficky vyhodnotených
81 z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich u 48 nedošlo k progresii štrukturálneho poškodenia, čo sa definovalo ako zmena modifikovaného TSS (mTSS) z východiskovej hodnoty o 0,5 alebo menej. Po 10 rokoch bolo rádiograficky vyhodnotených
79 z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich u 40
nedošlo k progresii štrukturálneho poškodenia, definovaného ako zmena modifikovaného TSS (mTSS)
z východiskovej hodnoty o 0,5 alebo menej.
Tabuľka 9
Priemerné rádiografické zmeny po 12 mesiacoch v RA štúdii III

Placebo/MTXa
Adalimumab/MT X 40 mg každý druhý týždeň
Placebo/MTX-
Adalimumab/MT X (95 % interval spoľahlivostib)
Hodnota p
Celkové Sharpovo skóre 2,7 0,1 2,6 (1,4; 3,8) < 0,001c
Skóre erózie 1,6 0,0 1,6 (0,9; 2,2) < 0,001
Skóre JSNd 1,0 0,1 0,9 (0,3; 1,4) 0,002
a metotrexát
b 95 % intervaly spoľahlivosti pre rozdiely zmeny skóre medzi metotrexátom a adalimumabom.
c na základe analýzy poradia
d zúženie kĺbovej štrbiny(Joint Space Narrowing – JSN)
V RA štúdii V bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky a vyjadrené ako zmena modifikovaného celkového Sharpovho skóre (pozri tabuľku 10).
Tabuľka 10
Priemerné rádiografické zmeny v týždni 52 v RA štúdii V
MTX
n = 257
(95 % interval
spoľahlivosti)
Adalimumab
n = 274
(95 % interval
spoľahlivosti)
Adalimumab/MTX
n = 268
(95 % interval
spoľahlivosti)
Hodnota pa
Hodnota pb
Hodnota pc
Celkové Sharpovo skóre
5,7 (4,2-7,3) 3,0 (1,7-4,3) 1,3 (0,5-2,1) < 0,001 0,0020 < 0,001

Skóre erózie 3,7 (2,7-4,7) 1,7 (1,0-2,4) 0,8 (0,4-1,2) < 0,001 0,0082 < 0,001
JSN skóre 2,0 (1,2-2,8) 1,3 (0,5-2,1) 0,5 (0-1,0) < 0,001 0,0037 0,151
a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabom a kombinovanej terapie
adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
c hodnota p pochádza z párového porovnania monoterapie adalimumabom a monoterapie metotrexátom
pomocou Mannovho-Whitneyho U testu
Po 52 a 104 týždňoch terapie bolo percento pacientov bez progresie (zmena modifikovaného
Sharpovho skóre oproti východiskovej hodnote £ 0,5) významne vyššie pri kombinovanej terapii adalimumab/metotrexát (63,8 %, resp. 61,2 %) v porovnaní s monoterapiou metotrexátom (37,4 %, resp. 33,5 %, p < 0,001) a monoterapiou adalimumabom (50,7 %, p < 0,002, resp. 44,5 %, p < 0,001).
V otvorenej predĺženej štúdii RA V bola priemerná zmena modifikovaného Sharpovho skóre oproti východiskovým hodnotám na konci 10. roka 10,8; 9,2 a 3,9 u pacientov pôvodne randomizovaných na liečbu metotrexátom v monoterapii, adalimumabom v monoterapii a na kombinovanú liečbu adalimumabom/metotrexátom, a to v uvedenom poradí. Zodpovedajúci percentuálny podiel pacientov bez progresie bol 31,3 %, 23,7 % a 36,7 % v uvedenom poradí.
Kval it a ži vot a a t el esné f unkc i eKvalita života súvisiaca so zdravím a telesné funkcie boli hodnotené v štyroch pôvodných
adekvátnych a dobre kontrolovaných štúdiách indexom obmedzenia pomocou Dotazníka
v RA štúdii III primárnym koncovým ukazovateľom v 52. týždni. U všetkých dávok/schém podávania adalimumabu vo všetkých štyroch štúdiách sa preukázalo štatisticky významné zlepšenie indexu obmedzenia HAQ medzi východiskovými hodnotami a hodnotami v 6. mesiaci v porovnaní
s placebom. Rovnaké výsledky boli pozorované v RA štúdii III v 52 týždni. Výsledky z dotazníka Krátka forma prieskumu zdravotného stavu (Short Form Health Survey - SF 36) pre všetky dávky/schémy adalimumabu vo všetkých štyroch štúdiách podporujú tieto nálezy, so štatisticky významným zlepšením skóre súhrnu telesnej zložky (physical component summary - PCS) a rovnako aj štatisticky významným zlepšením skóre súhrnu zložiek bolesti a vitality pre dávku 40 mg každý druhý týždeň. Vo všetkých troch štúdiách, v ktorých bola posudzovaná únavnosť (RA štúdie I, III, IV), bolo pozorované štatisticky významné zníženie jej skóre, stanovené Funkčným hodnotením liečby chronickej choroby (Functional Assessment of Chronic Illness Therapy - FACIT).
Väčšina jedincov, ktorá dosiahla zlepšenie fyzických funkcií v RA štúdii III a ktorá pokračovala v liečbe v otvorenej fáze štúdie, si udržala zlepšenie až do týždňa 520 (120 mesiacov). Zlepšenie kvality života sa hodnotilo až do týždňa 156 (36 mesiacov) a pretrvávalo počas tejto doby.
V RA štúdii V zlepšenie indexu obmedzenia HAQ a skóre súhrnu telesných komponentov v SF 36 preukázalo väčšie zlepšenie (p < 0,001) pri kombinovanej liečbe adalimumab/metotrexát ako pri monoterapii metotrexátom a monoterapii adalimumabom v týždni 52 a zostalo väčšie až do týždňa
104. 250 pacientov, ktorí dokončili otvorenú rozšírenú štúdiu, si počas 10 rokov liečby zachovalo zlepšenie telesných funkcií.
Juvenilná idiopatická artritída (JIA) Poly arti kul árna j uvenil ná idi opat ick á art rit í da (pJI A) Bezpečnosť a účinnosť adalimumabu bola hodnotená v dvoch štúdiách (pJIA I a II) u detí s aktívnou
polyartikulárnou artritídou alebo s polyartikulárnym priebehom artritídy, ktoré mali rôzne typy vzplanutia JIA (najčastejšie polyartritída s negatívnym alebo pozitívnym reumatoidným faktorom
alebo rozšírená oligoartritída).
pJIA I
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito zaslepenej štúdii s paralelnými skupinami u 171 detí (vo veku 4 – 17 rokov) s polyartikulárnou JIA.
V otvorenej úvodnej fáze (OL LI) boli pacienti rozdelení do dvoch skupín, liečení MTX (metotrexát)
alebo neliečení MTX. Pacienti, ktorí boli v skupine neliečených MTX neboli nikdy MTX liečení alebo bola liečba MTX u nich prerušená najmenej dva týždne pred podaním lieku v štúdii. Pacienti ostávali na stálych dávkach NSAID a/alebo prednizónu (≤ 0,2 mg/kg/deň alebo maximálne 10 mg/kg). Vo fáze OL LI dostávali všetci pacienti adalimumab v dávke 24 mg/m2 až do maxima 40 mg každý druhý týždeň počas 16 týždňov. V tabuľke 11 je rozdelenie pacientov podľa veku a minimálnej, strednej
a maximálnej dávky, ktorú dostávali vo fáze OL LI.
Tabuľka 11Rozdelenie pacientov podľa veku a dávky adalimumabu, ktorú dostávali vo fáze OL LIVeková skupina Počet pacientov na vstupe n (%) Minimálna, stredná a maximálna dávka
4 až 7 rokov 31 (18,1) 10, 20 a 25 mg

8 až 12 rokov 71 (41,5) 20, 25 a 40 mg
13 až 17 rokov 69 (40,4) 25, 40 a 40 mg
Pacienti, ktorí v 16. týždni vykázali odpoveď Pediatric ACR 30 boli vhodní na randomizáciu do
dvojito zaslepenej (DB) fázy a dostávali každý druhý týždeň počas ďalších 32 týždňov alebo do vzplanutia ochorenia buď adalimumab v dávke 24 mg/m2 až do maxima 40 mg alebo placebo. Kritériá vzplanutia ochorenia boli definované ako zhoršenie ≥ 3 zo 6 hlavných kritérií Pediatric ACR
o ≥ 30 % oproti vstupnej úrovni, ≥ 2 aktívnych kĺbov a zlepšenie nie viac ako 1 zo 6 kritérií o ≥ 30 %. Po 32 týždňoch alebo po vzplanutí ochorenia boli pacienti vhodní na zaradenie do predĺženej
otvorenej fázy.
T
abuľka 12
P
ed ACR 30 odpovede v JIA štúdii
Skupina MTX bez MTX
Fáza
OL LI 16 týždeň
Ped ACR 30
odpoveď (n/N)
94,1 % (80/85) 74,4 % (64/86)

Hodnotenie účinnosti
Dvojito zaslepená,
32 týždňov
Adalimumab/MTX (N = 38)
Placebo/MTX (N = 37)
Adalimumab
(N = 30)
placebo
(N = 28)
Vzplanutie ochorenia na konci
32. týždňaa (n/N)
36,8 % (14/38) 64,9 % (24/37)b
43,3 % (13/30) 71,4 % (20/28)c
Priemerný čas do vzplanutia ochorenia
> 32 týždňov 20 týždňov > 32 týždňov 14 týždňov
a odpovede Ped ACR30/50/70 boli v 48. týždni významne vyššie ako u pacientov liečených placebom
b p = 0,015
c p = 0,031
U pacientov, ktorí boli počas celej štúdie liečení adalimumabom a odpovedali v 16. týždni (n = 144),
pretrvávali odpovede Pediatric ACR30/50/70/90 počas šiestich rokov fázy OLE. Všetkých
19 pacientov, z ktorých 11 bolo na začiatku štúdie vo veku 4 až 12 rokov a 8 vo veku 13 až 17 rokov,
bolo liečených počas 6 rokov alebo dlhšie.
Celkové odpovede boli všeobecne lepšie a protilátky sa vyvinuli u menšieho počtu pacientov, ak boli liečení kombináciou adalimumobom a MTX v porovnaní s adalimumabom samotným. Berúc do úvahy tieto údaje, Idacio sa odporúča na používanie v kombinácii s MTX a na používanie ako monoterapia iba u pacientov, u ktorých je podávanie MTX nevhodné (pozri časť 4.2).
pJIA II
Bezpečnosť a účinnosť adalimumabu bola hodnotená v otvorenej multicentrickej štúdii u 32 detí (vo veku 2 - < 4 roky alebo vo veku 4 roky a viac s hmotnosťou < 15 kg) so stredne ťažkou až ťažkou aktívnou polyartikulárnou JIA. Pacienti dostávali 24 mg adalimumabu/m2 telesného povrchu (Body Surface Area, BSA) až maximálne 20 mg každý druhý týždeň v jednej dávke subkutánnou injekciou aspoň po dobu 24 týždňov. V priebehu štúdie väčšina subjektov používala súbežne MTX, menej bolo hlásené používanie kortikosteroidov alebo NSAIDs.
Z pozorovaných údajov vyplýva, že v 12. týždni a 24. týždni bola odpoveď PedACR30 93,5 % resp.
90,0 %. Pomer subjektov s PedACR50/70/90 v 12. týždni a v 24. týždni bol 90,3 %/61,3 %/38,7 %
resp. 83,3 %/73,3 %/36,7 %. Medzi tými, ktorí odpovedali (pediatrická ACR30) v 24. týždni (n = 27
z 30 pacientov), sa pediatrická ACR odpoveď 30 zachovala po dobu až 60 týždňov vo fáze OLE
u pacientov, ktorí dostávali adalimumab po celé toto obdobie. Celkovo bolo 20 subjektov liečených po dobu 60 týždňov alebo dlhšie.
Art ri tí da spojená s entezi tí dou
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito
zaslepenej štúdii u 46 pediatrických pacientoch (vo veku 6 až 17 rokov) so stredne ťažkou artritídou
spojenou s entezitídou. Pacienti boli randomizovaní buď na podávanie adalimumabu v dávke
24 mg/m2 BSA až do maximálnej dávky 40 mg, alebo na podávanie placeba každý druhý týždeň po
dobu 12 týždňov. Po dvojito zaslepenej fáze nasledovala otvorená (open-label – OL) fáza, počas ktorej pacienti dostávali 24 mg/m2 BSA adalimumabu až do maximálnej dávky 40 mg každý druhý týždeň subkutánne po dobu ďalších až 192 týždňov. Primárnym koncovým ukazovateľom bola percentuálna zmena od východiskovej hodnoty do 12. týždňa v počte aktívnych kĺbov s artritídou (opuch nie pre deformáciu alebo kĺby so stratou pohyblivosti plus bolesť a/alebo citlivosť), ktorá bolo dosiahnutá
s priemerným percentuálnym poklesom o - 62,6 % (medián percentuálnej zmeny - 88,9 %)
u pacientov v skupine liečenej adalimumabom v porovnaní s - 11,6 % (medián percentuálnej
zmeny - 50,0 %) u pacientov v skupine, ktorá dostávala placebo. Zlepšenie v počte aktívnych kĺbov
s artritídou sa udržalo v priebehu otvorenej fázy až do 156. týždňa štúdie u 26 z 31 (84 %) pacientov liečených adalimumabom, ktorí zotrvali v štúdii. Aj keď to nie je štatisticky významné, u väčšiny pacientov sa prejavilo klinické zlepšenie sekundárnych koncových ukazovateľov, ako je počet miest entezitídy, počet bolestivých kĺbov (tender joint count- TJC), počet opuchnutých kĺbov (swollen joint count- SJC), pediatrická odpoveď ACR 50 a pediatrická odpoveď ACR 70.
Axiálna spondylartritída
Ankyl ozujúca spondyli tí da (AS)
V dvoch randomizovaných 24 týždňových, dvojito zaslepených, placebom kontrolovaných štúdiách
u pacientov s aktívnou ankylozujúcou spondylitídou (priemerné skóre pred začiatkom liečby [Bath
Ankylosing Spondylitis Disease Activity Index (BASDAI)] vo všetkých skupinách bolo 6,3) sa hodnotilo podávanie adalimumabu v dávke 40 mg každý druhý týždeň u 339 pacientov, ktorí neodpovedali adekvátne na konvenčnú liečbu. 79 (20,1 %) pacientov sa liečilo súčasne chorobu modifikujúcimi antireumatickými liekmi a 37 (9,4 %) pacientov glukokortikoidmi. Po zaslepenej časti štúdie nasledovala otvorená fáza štúdie, počas ktorej sa pacientom podával adalimumab 40 mg subkutánne každý druhý týždeň ďalších 28 týždňov. Pacienti (n = 215; 54,7 %), ktorí nedosiahli
ASAS 20 v týždňoch 12 alebo 16 alebo 20, prešli do otvorenej fázy skôr a podával sa im subkutánne
adalimumab 40 mg každý druhý týždeň. Následne boli v dvojito zaslepených štatistických analýzach pokladaní za non-respondérov.
Vo väčšej AS štúdii I s 315 pacientmi výsledky ukázali štatisticky významné zlepšenie prejavov
a príznakov ankylozujúcej spondylitídy u pacientov liečených adalimumabom v porovnaní s tými, ktorým sa podávalo placebo. Signifikantná odpoveď sa prvýkrát pozorovala v týždni 2 a pretrvávala
počas 24 týždňov (tabuľka 13).
Tabuľka 13
Účinnosť v placebom kontrolovanej AS Štúdii – Štúdia I
redukcia prejavova príznakov
O
dpoveď Placebo
 N = 107
A
dalimumab
N = 208
N = 107
A
dalimumab
N = 208
ASASa 20
Týždeň 2 16 % 42 %*** Týždeň 12 21 % 58 %*** Týždeň 24 19 % 51 %***
ASAS 50
Týždeň 2 3 % 16 %*** Týždeň 12 10 % 38 %*** Týždeň 24 11 % 35 %***
ASAS 70
Týždeň 2 0 % 7 %** Týždeň 12 5 % 23 %*** Týždeň 24 8 % 24 %***
BASDAIb 50
Týždeň 2 4 % 20 %***
Týždeň 12 16 % 45 %***

Týždeň 24 15 % 42 %***
***,** Štatisticky signifikanné v rozsahu p < 0,001; < 0,01 pre všetky porovnania medzi
adalimumabom a placebom v týždňoch 2, 12 a 24
a Assessments in Ankylosing Spondylitis
b Bath Ankylosing Spondylitis Disease Activity Index
Pacienti liečení adalimumabom vykazovali signifikantne významnejšie zlepšenie v týždni 12
a pretrvávalo do týždňa 24 ako u SF36 tak aj v dotazníku Ankylosing Spondylitis Quality of Life
Questionnaire (ASQoL).
Podobné trendy (ale nie štatisticky signifikantné) sa zistili v menšej randomizovanej, dvojito zaslepenej, placebom kontrolovanej AS štúdii II u 82 dospelých pacientov s aktívnou ankylozujúcou spondylitídou.
Axi ál na spondyl art ri tí da bez r ádi ograf ick ého dôkazu AS Bezpečnosť a účinnosť adalimumabu sa hodnotila v dvoch randomizovaných, dvojito zaslepených,
placebom kontrolovaných štúdiách u pacientov s nerádiografickou axiálnou spondylartritídou (nr-
axSpA). Štúdia nr-axSpA I hodnotila pacientov s aktívnou nr-axSpA. Štúdia nr-axSpA II bola štúdia s vysadením liečby u pacientov s aktívnou nr-axSpA, ktorí dosiahli remisiu počas otvorenej liečby adalimumabom.
Štúdia nr-axSpA I
Štúdia nr-axSpA I bola randomizovaná, 12-týždňová dvojito zaslepená, placebom kontrolovaná štúdia, ktorá hodnotila adalimumab 40 mg podávanú každý druhý týždeň 185 pacientom s aktívnou nr- axSpA(priemerné východiskové skóre aktivity ochorenia [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] bolo 6,4 u pacientov liečených adalimumabom a 6,5 pre pacientov
s placebom), ktorí mali nedostatočnú odpoveď na ³ 1 NSAIDs alebo ich netolerovali alebo boli u nich
NSAIDs kontraindikované.
Tridsaťtri (18 %) pacientov bolo súbežne liečených chorobu modifikujúcimu antireumatickými liekmi,
a 146 (79 %) pacientov s NSAIDs na začiatku. Po dvojito zaslepenej fáze nasledovala otvorená fáza,
v ktorej dostávali pacienti adalimumab 40 mg každý druhý týždeň subkutánne počas ďalších
144 týždňov. Výsledky v týždni 12 ukázali štatisticky významné zlepšenie prejavov a príznakov aktívnejnr-axSpA u pacientov liečených adalimumabom v porovnaní s placebom (tabuľka 14).
Tabuľka 14Účinnosť v placebom kontrolovanej štúdii nr-axSpA I
D
vojito zaslepenáodpoveď v týždni 12 Placebo
 N = 94
A
dalimumab
N = 91
N = 94
A
dalimumab
N = 91
ASASa 40 15 % 36 %*** ASAS 20 31 % 52 %** ASAS 5/6 6 % 31 %*** ASAS čiastočná remisia 5 % 16 %* BASDAIb 50 15 % 35 %** ASDASc,d,e - 0,3 - 1,0*** ASDAS neaktívna choroba 4 % 24 %*** hs-CRPd,f,g - 0,3 - 4,7*** SPARCCh MRI krížovodriekové kĺbyd,i - 0,6 - 3,2** SPARCC MRI chrbticad,j - 0,2 - 1,8**
a Hodnotenie podľa Medzinárodnej spoločnosti pre spondylartritídu
b Bath Ankylosing Spondylitis Disease Activity Index
c Ankylosing Spondylitis Disease Activity Score

d priemerná zmena od východiskovej hodnoty
e n = 91 placebo a n = 87 adalimumab
f CRP test s vysokou citlivosťou (mg/l)
g n = 73 placebo a n = 70 adalimumab
h Spondyloarthritis Research Consortium of Canada
i n = 84 placebo a adalimumab
j n = 82 placebo a n = 85 adalimumab
***, **, * štatisticky signifikantné v rozsahu p < 0,001; < 0,01, resp.< 0,05 pre všetky porovnania
medzi adalimumabom a placebom
V otvorenom predĺžení skúšania sa zlepšenie prejavov a príznakov udržalo pri liečbe adalimumabom
do 156. týždňa. Inhibícia zápalu
Významné zlepšenie príznakov zápalu meraného testom hs-CRP a MRI u krížovodriekových kĺbov aj
u chrbtice sa u pacientov liečených adalimumabom udržalo do 156. resp. 104. týždňa.
Kvalita života a telesné funkcie
Kvalita života súvisiaca so zdravím a telesné funkcie boli hodnotené pomocou dotazníkov HAQ-S
a SF-36. Adalimumab preukázal štatisticky významne väčšie zlepšenie v celkovom skóre v HAQ-S
a v skóre fyzickej zložky (Physical Component Score, PCS) v SF-36 od začiatku do 12. týždňa
v porovnaní s placebom. Zlepšenie kvality života súvisiacej so zdravím a fyzickými funkciami sa udržalo v priebehu otvoreného predĺženia štúdie až do 156. týždňa.
Štúdia nr-axSpA II
673 pacientov s aktívnou nr-axSpA (priemerná východisková aktivita ochorenia [BASDAI] bola 7,0), ktorí mali nedostatočnú odpoveď na ³ 2 NSAIDs alebo ich netolerovali alebo boli u nich NSAIDs kontraindikované, bolo zaradených do otvorenej časti štúdie nr-axSpA II, počas ktorej dostávali adalimumab 40 mg každý druhý týždeň (every other week – eow) počas 28 týždňov.
Títo pacienti mali aj objektívny dôkaz o zápale krížovodriekových kĺbov alebo chrbtice získaný pomocou MRI alebo na základe zvýšenej hladiny hs
-CRP. Pacienti, ktorí dosiahli pretrvávajúcu remisiu počas najmenej 12 týždňov (N = 305) (ASDAS < 1,3 v týždňoch 16, 20, 24 a 28) počas otvoreného obdobia, boli následne randomizovaní na pokračovanie liečby adalimumabom 40 mg každý druhý týždeň (every other week – eow) (N = 152) alebo na podávanie placeba (N = 153) počas ďalších 40 týždňov v dvojito zaslepenom, placebom kontrolovanom období (celkové trvanie štúdie 68 týždňov). Pacienti, u ktorých došlo počas dvojito zaslepeného obdobia k vzplanutiu, mali dovolenú
záchrannú liečbu adalimumabom 40 mg každý druhý týždeň (every other week – eow) počas najmenej
12 týždňov.
Primárnym koncovým ukazovateľom účinnosti bol podiel pacientov bez vzplanutia do týždňa 68
štúdie. Vzplanutie bolo definované ako ASDAS ≥ 2,1 pri dvoch po sebe idúcich návštevách
v rozmedzí štyroch týždňov. Väčší podiel pacientov používajúcich adalimumab nezaznamenal počas dvojito zaslepeného obdobia žiadne vzplanutie ochorenia v porovnaní s pacientmi, ktorí dostávali
placebo (70,4 % vs 47,1 %, p < 0,001) (obrázok 1).
O
brázok 1: Kaplanove-Meierove krivky znázorňujúce čas do vzplanutia ochorenia v štúdii
nr-axSpA II

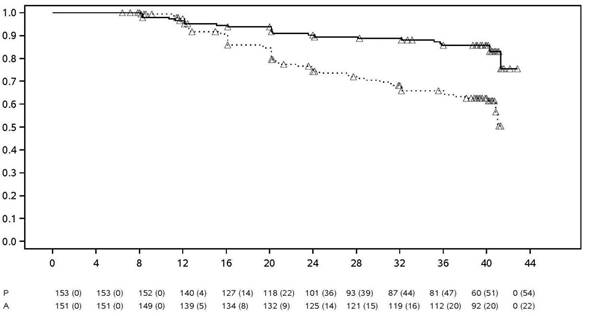 štúdia nr-axSpA II
ČA
S (TÝŽDNE)
štúdia nr-axSpA II
ČA
S (TÝŽDNE)


Liečba Placebo Adalimumab ∆ Cenzurované
Poznámka: P = placebo (počet rizikových účastníkov (so vzplanutím)); a = Adalimumab (počet rizikových účastníkov (so vzplanutím)).
Spomedzi 68 pacientov, u ktorých došlo k vzplanutiu v skupine pridelenej na vysadenie liečby, 65 pacientov dokončilo 12 týždňov záchrannej liečby adalimumabom, z ktorých 37 (56,9 %) opäť dosiahlo remisiu (ASDAS < 1,3) po 12 týždňoch opätovného začiatku otvorenej liečby.
Do týždňa 68 pacienti, ktorí dostávali kontinuálnu liečbu Idaciom, vykazovali štatisticky významné zlepšenie prejavov a príznakov aktívnej nr-axSpA v porovnaní s pacientmi pridelenými na vysadenie liečby počas dvojito zaslepeného obdobia štúdie (tabuľka 15).
Tabuľka 15Účinnosť v placebom kontrolovanom období štúdii nr-axSpA II
D
vojito zaslepená odpoveď v týždni 68 Placebo
 N = 153
A
dalumumab
N = 152
N = 153
A
dalumumab
N = 152
ASASa,b 20 47,1 % 70,4 %*** ASASa,b 40 45,8 % 65,8 %*** ASASa čiastočná remisia 26,8 % 42,1 %** ASDASc neaktívne ochorenie 33,3 % 57,2 %*** Čiastočné vzplanutied 64,1 % 40,8 %*** a Hodnotenie podľa Medzinárodnej spoločnosti pre spondylartritíd
b Východisková hodnota je definovaná ako východisková hodnota otvorenej fázy, keď majú pacienti aktívne ochorenie.
c Ankylosing Spondylitis Disease Activity Score
d Čiastočné vzplanutie je definované ASDAS ≥ 1,3, ale < 2,1 počas 2 po sebe idúcich návštev.
***, ** Štatisticky významné pri p < 0,001 resp. < 0,01 pre všetky porovnania medzi
adalimumabom a placebom.
Psoriatická artritída
Adalimumab x 40 mg, podávaná každý druhý týždeň, bola študovaná u pacientov so stredne ťažkou
a ťažkou aktívnou psoriatickou artritídou v dvoch placebom kontrolovaných štúdiách, PsA štúdiách I a II. V PsA štúdii I, trvajúcej 24 týždňov, bolo liečených 313 dospelých pacientov s nedostatočnou odpoveďou na nesteroidové antireumatiká a z nich približne 50 % užívalo metotrexát. V PsA štúdii II, trvajúcej 12 týždňov, bolo liečených 100 pacientov s nedostatočnou odpoveďou na liečbu DMARD. Po ukončení oboch štúdií bolo 383 pacientov vybraných do otvorenej rozšírenej štúdie, v ktorej sa pacientom podávalo 40 mg adalimumabu každý druhý týždeň.
V dôsledku nízkeho počtu pacientov so psoriatickou artropatiou podobnou ankylozujúcej spondylitíde
v štúdii nie sú k dispozícii dostatočné dôkazy účinnosti Idacia u týchto pacientov.
Tabuľka 16
ACR odpoveď v placebom kontrolovaných štúdiách u pacientov so psoriatickou artritídou
(percento pacientov)
PsA štúdia I PsA štúdia II
Odpoveď Placebo
N = 162
Adalimumab

N = 151
Placebo
N = 49
Adalimumab
N = 51
ACR 20
Týždeň 12 14 % 58 %*** 16 % 39 %*
Týždeň 24 15 % 57 %*** N/A N/A ACR 50
Týždeň 12 4 % 36 %*** 2 % 25 %***
Týždeň 24 6 % 39 %*** N/A N/A ACR 70
Týždeň 12 1 % 20 %*** 0 % 14 % *
Týždeň 24 1 % 23 %*** N/A N/A
*** p < 0,001 pre všetky porovnania medzi adalimumabom a placebom
* p < 0,05 pre všetky porovnania medzi adalimumabom a placebom
N/A nevzťahuje sa
ACR odpovede v PsA štúdii I boli podobné pri súbežnom podávaní metotrexátu, aj bez neho.
V otvorenej rozšírenej štúdii pretrvávali odpovede ACR až 136 týždňov.
V štúdiách so psoriatickou artritídou boli hodnotené rádiografické zmeny. Röntgenové snímky rúk, zápästí a nôh sa urobili na začiatku a v týždni 24 počas dvojito zaslepenej fázy, keď sa pacientom podával adalimumab alebo placebo a v týždni 48, keď sa všetkým pacientom v otvorenej fáze podával adalimumab. Použilo sa modifikované celkové Sharpovo skóre (modified Total Sharp Score, mTSS), ktoré hodnotí aj distálne interfalangeálne kĺby (t. j. nie je identické s TSS používaným pre
reumatoidnú artritídu).
V porovnaní s liečbou placebom znížila liečba adalimumabom rýchlosť progresie poškodenia periférnych kĺbov, keď sa to hodnotilo zmenou medzi východiskovými hodnotami mTSS (priemer ± SD) a hodnotami 0,8 ± 2,5 v skupine s placebom (v týždni 24) v porovnaní s hodnotami 0,0 ± 1,9;
(p < 0,001) v skupine s adalimumabom (v týždni 48).
Z pacientov liečených adalimumabom, ktorí boli bez rádiografickej progresie od východiskového stavu po týždeň 48 (n = 102), 84 % nepreukázalo žiadnu rádiografickú progresiu počas 144 týždňov liečby.
Hodnotenie pomocou HAQ a Stručného formulára prieskumu zdravia (SF 36) preukázalo v týždni 24
u pacientov liečených adalimumabom štatisticky významné zlepšenie fyzickej funkcie v porovnaní
s liečbou placebom. Zlepšená fyzická funkcia pokračovala počas otvorenej rozšírenej fázy až do týždňa 136.
Psoriáza
Bezpečnosť a účinnosť adalimumabu bola študovaná v randomizovaných, dvojito zaslepených štúdiách u dospelých pacientov s chronickou ložiskovoupsoriázou (postihnutie ³ 10 % BSA a index plochy postihnutia a závažnosti psoriázy (Psoriasis Area and Severity Index, PASI) ³ 12 alebo ³ 10), ktorí boli kandidátmi na systémovú liečbu alebo fotoliečbu. 73 % pacientov zahrnutých do štúdií I a II so psoriázou bolo predtým liečených systémovou liečbou alebo fotoliečbou. Bezpečnosť a účinnosť adalimumabu sa študovala aj u dospelých pacientov so stredne ťažkou až ťažkou chronickou ložiskovou psoriázou so súčasnou psoriázou na rukách a/alebo chodidlách, ktorí boli kandidátmi na systémovú liečbu, v randomizovanej dvojito zaslepenej štúdii (štúdia III so psoriázou).
V štúdii I (REVEAL) so psoriázou bolo počas troch liečebných intervalov hodnotených 1212 pacientov. V intervale A dostali pacienti placebo alebo adalimumab v úvodnej dávke 80 mg a po uplynutí jedného týždňa od úvodnej dávky 40 mg každý druhý týždeň. Pacienti, ktorí dosiahli aspoň odpoveď PASI 75 (skóre zlepšenia PASI aspoň 75 % v porovnaní s počiatočným stavom), pokračovali po 16 týždňoch liečby v intervale B a v otvorenej fáze dostávali 40 mg adalimumabu každý druhý týždeň. Pacienti, ktorí si aj v týždni 33 udržali odpoveď ³ PASI 75 a v intervale A boli randomizovaní na aktívnu liečbu, boli v intervale C znovu randomizovaní na podanie 40 mg adalimumabu každý druhý týždeň alebo placeba počas ďalších 19 týždňov. Vo všetkých liečebných skupinách bolo na začiatku liečby priemerné skóre PASI 18,9 a skóre celkového hodnotenia lekárom (Physician’s Global Assessment,PGA) sa pohybovalo od „stredne ťažkého“ (53 % hodnotených pacientov) po „ťažké“
(41 %) až „veľmi ťažké“ (6 %).
V štúdii II (CHAMPION) so psoriázou sa porovnávala účinnosť a bezpečnosť adalimumabu
v porovnaní s metotrexátom a placebom u 271 pacientov. Pacienti dostávali počas 16 týždňov placebo, úvodnú dávku MTX 7,5 mg, ktorá sa potom zvyšovala do 12. týždňa na maximálnu dávku 25 mg
alebo dostali úvodnú dávku 80 mg adalimumabu a potom 40 mg každý druhý týždeň (po 1. týždni od
úvodnej dávky). K dispozícii nie sú údaje porovnávajúce adalimumab a MTX po liečbe trvajúcej viac
ako 16 týždňov. Pacientom, ktorým sa podával MTX, a ktorí v týždni 8 a/alebo 12 mali odpoveď
³ PASI 50, sa nepodali ďalšie zvýšené dávky. Vo všetkých liečebných skupinách bolo na začiatku liečby priemerné skóre PASI 19,7 a skóre PGA sa pohybovalo od „mierneho“(< 1 %) po „stredne ťažké“ (48 %), „ťažké“ (46 %) až „veľmi ťažké“ (6 %).
Pacienti, ktorí sa zúčastnili klinických skúšaní fázy 2 aj fázy 3 zameraných na psoriázu, boli vhodní na zaradenie do otvoreného rozšíreného klinického skúšania s podávaním adalimumabu najmenej ďalších
108 týždňov.
V štúdiách I a II so psoriázou bol primárnym koncovým ukazovateľom pomer pacientov, ktorí
v porovnaní so stavom na začiatku liečby dosiahli v týždni 16 odpoveď PASI 75 (pozri tabuľky 17
a 18).
Tabuľka 17
Štúdia I so psoriázou (REVEAL) Účinnosť v týždni 16
 Placebo N = 398 n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 814
n (%)
Placebo N = 398 n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 814
n (%)
³ PASI 75a 26 (6,5) 578 (70,9)b PASI 100 3 (0,8) 163 (20,0)b PGA: čisté/minimálne 17 (4,3) 506 (62,2)b
a percento pacientov, ktorí dosiahli odpoveď PASI 75, bolo vypočítané akopriemerná hodnota
b p < 0,001; adalimumab verzus placebo
T
abuľka 18
Štúdia II so psoriázou (CHAMPION) Účinnosť v týždni 16
 Placebo N = 53 n (%)
MTX N = 110 n (%)
A
dalimumab
40 mg každý druhý týždeň
N = 108
n (%)
Placebo N = 53 n (%)
MTX N = 110 n (%)
A
dalimumab
40 mg každý druhý týždeň
N = 108
n (%)
³ PASI 75 10 (18,9) 39 (35,5) 86 (79,6) a, b
PASI 100 1 (1,9) 8 (7,3) 18 (16,7) c, d
P
GA
:
čisté/minimálne
6 (11,3) 33 (30,0) 79 (73,1) a, b
a p < 0,001 adalimumab verzus placebo
b p < 0,001 adalimumab verzus metotrexát
c p < 0,01 adalimumab verzus placebo
d p < 0,05 adalimumab verzus metotrexát
V štúdii I so psoriázou u pacientov, ktorí mali odpoveď PASI 75 a v týždni 33 boli znovu
randomizovaní na placebo, stratilo adekvátnu odpoveď 28 % v porovnaní s 5 %, ktorým sa ďalej podával adalimumab, p < 0,001 (skóre PASI po týždni 33 a v týždni 52 alebo pred ním vyústilo do odpovede < PASI 50 v porovnaní s počiatočným stavom s minimálne 6–bodovým zvýšením skóre PASI v porovnaní s týždňom 33). Z pacientov, ktorí po opätovnej randomizácii na placebo stratili schopnosť adekvátne odpovedať, a ktorí boli potom zaradení do otvorenej rozšírenej štúdie, 38 % (25/66) znova získalo odpoveď PASI 75 po 12 týždňoch liečby a 55 % (36/66) po 24 týždňoch liečby.
Celkovo 233 pacientov, ktorí dosiahli skóre PASI 75 v 16. a 33. týždni, dostávalo kontinuálnu liečbu
adalimumabom v trvaní 52 týždňov v štúdii I so psoriázou a v liečbe adalimumabom pokračovali
v otvorenom rozšírenom skúšaní. Po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní 160
týždňov) dosiahlo skóre PASI 75 74,7 % týchto pacientov a skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke 59,0 % pacientov. V analýze sa všetci pacienti vylúčení zo skúšania kvôli nežiaducim udalostiam alebo nedostatočnej účinnosti a tí, ktorým sa zvýšila dávka, považovali za pacientov bez odpovede, po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní
160 týždňov) skóre PASI 75 dosiahlo 69,6 % pacientov a skóre PGA zodpovedajúce čistej pokožke
alebo minimálne postihnutej pokožke 55,7 %.
V otvorenom rozšírenom skúšaní sa hodnotilo pri vysadení liečby a pri pokračovaní v liečbe celkovo
347 pacientov so stálou odpoveďou na liečbu. V období vysadenia liečby sa príznaky psoriázy časom vrátili, s mediánom času po relaps (pokles skóre PGA na „stredne ťažká psoriáza“ alebo horšie skóre) približne 5 mesiacov. Žiadny z týchto pacientov nezaznamenal zhoršenie po náhlom vysadení liečby. Celkovo 76,5 % (218/285) pacientov, ktorí sa zúčastnili pokračujúcej liečby, malo po 16 týždňoch pokračujúcej liečby skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke, bez ohľadu na to, či u nich počas vysadenia liečby došlo k relapsu (69,1% [123/178] pacientov, u ktorých došlo k relapsu, a 88,8% [95/107] pacientov, u ktorých nedošlo k relapsu v období s vysadenou liečbou). Bezpečnostný profil počas pokračujúcej liečby bol podobný ako pred vysadením.
Pri hodnotení indexu DLQI (Dermatology Life Quality Index) sa preukázali významné zlepšenia
v týždni 16 v porovnaní so stavom na začiatku liečby a s placebom (štúdie I a II) a MTX (štúdia II). Zlepšenia vo fyzickej a mentálnej zložke súhrnných skór SF-36 v porovnaní s placebom v štúdii I boli
tiež významné.
V otvorenej rozšírenej štúdii u pacientov, ktorých dávka bola kvôli odpovedi PASI pod 50 % stupňovaná zo 40 mg každý druhý týždeň na 40 mg týždenne, dosiahlo v 12. týždni 26,4 % (92/349) a v 24. týždni 37,8 % (132/349) pacientovodpoveď PASI 75.
Štúdia III so psoriázou (REACH) porovnávala účinnosť a bezpečnosť adalimumabu v porovnaní
s placebom u 72 pacientov so stredne ťažkou až ťažkou chronickou ložiskovou psoriázou a psoriázou na rukách a/alebo chodidlách. Pacienti dostali úvodnú dávku 80 mg adalimumabu, po ktorej nasledovala dávka 40 mg každý druhý týždeň (počínajúc prvým týždňom po úvodnej dávke) alebo placebo po dobu 16 týždňov. V týždni 16 dosiahol PGA "čisté" alebo "takmer čisté" pre ruky a/alebo chodidlá štatisticky signifikantne vyšší podiel pacientov, ktorí dostávali adalimumab v porovnaní
s pacientmi, ktorí dostávali placebo (30,6 % verzus 4,3 %, respektíve [P = 0,014]).
Štúdia IV so psoriázou porovnávala účinnosť a bezpečnosť adalimumabu v porovnaní s placebom
u 217 dospelých pacientov so stredne ťažkou až ťažkou psoriázou nechtov. Pacientom bola podaná úvodná dávka 80 mg adalimumabu, po ktorej nasledovala 40 mg dávka každý druhý týždeň (počínajúc
prvým týždňom po úvodnej dávke) alebo placebo po dobu 26 týždňov, po ktorých nasledovala liečba
adalimumabom v otvorenej fáze štúdie v trvaní ďalších 26 týždňov. Hodnotenie závažnosti psoriázy nechtov zahŕňalo Modifikovaný index závažnosti psoriázy nechtov (Modified Nail Psoriasis Severity
Index (mNAPSI)), Celkové hodnotenie psoriázy nechtov na rukách lekárom (Physician’s Global
Assessment of Fingernail Psoriasis (PGA-F)) a Index závažnosti psoriázy nechtov (Nail Psoriasis Severity Index (NAPSI)) (pozri tabuľku 19). Adalimumab preukázal liečebný prínos u pacientov so psoriázou nechtov s rôznym rozsahom postihnutia kože (BSA ≥ 10 % (60 % pacientov) a BSA < 10 % a ≥ 5 % (40 % pacientov)).
Tabuľka 19
Účinnosť v štúdii IV so psoriázou v týždni 16, 26 a 52
Koncový ukazovateľ 16. týždeň
placebom kontrolovaná štúdia
26. týždeň placebom kontrolovaná štúdia
52. týždeň otvorená fáza liečby
Placebo
N = 108
Adalimumab
40 mg eow
N = 109
Placebo
N = 108
Adalimumab
40 mg eow
N = 109
Adalimumab
40 mg eow
N = 80
≥ mNAPSI 75 (%) 2,9 26,0a 3,4 46,6a 65,0
PGA-F čisté/minimálne a ≥ 2 stupne zlepšenia (%)
Percentuálna zmena v celkovom indexe NAPSI (%)
2,9 29,7a 6,9 48,9a 61,3
-7,8 -44,2 a -11,5 -56,2a -72,2

a p < 0,001, adalimumab
verzus placebo
Pacienti liečení adalimumabom preukázali v 26. týždni štatisticky významné zlepšenie DLQI
(Dermatology Life Quality Index) v porovnaní s placebom.
Ložisková psoriáza u pediatrických pacientovÚčinnosť adalimumabu bola hodnotená v randomizovanej, dvojito zaslepenej, kontrolovanej štúdii zahŕňajúcej 114 pediatrických pacientov vo veku od 4 rokov s ťažkou chronickou ložiskovou
psoriázou (definovanou hodnotami PGA ≥ 4 alebo postihnutím > 20 % BSA alebo postihnutím > 10 % BSA s veľmi hrubými léziami alebo PASI ≥ 20 alebo ≥ 10 s klinicky relevantným postihnutím tváre, pohlavných orgánov alebo rúk/nôh), ktorí boli nedostatočne kontrolovaní lokálnou liečbou
a helioterapiou alebo fototerapiou.
Pacienti dostávali adalimumab 0,8 mg/kg každý druhý týždeň (maximálne 40 mg); 0,4 mg/kg každý druhý týždeň (maximálne 20 mg) alebo metotrexát 0,1 – 0,4 mg/kg jedenkrát týždenne (maximálne
25 mg). V týždni 16 malo viac pacientov randomizovaných do skupiny liečenej adalimumabom
0,8 mg/kg pozitívnu reakciu, pokiaľ ide o účinnosť, (napr. PASI 75) v porovnaní s pacientmi, ktorí boli randomizovaní do skupiny liečenej 0,4 mg/kg každý druhý týždeň (every other week- eow) alebo MTX.
T
abuľka 20: Výsledky účinnosti liečby ložiskovej psoriázy u pediatrických pacientov
v týždni 16

MTXa
N = 37
Adalimumab 0,8mg/kg eow
N = 38
PASI 75b 12 (32,4 %) 22 (57,9 %)
PGA: čisté/minimálnec 15 (40,5 %) 23 (60,5 %)
a MTX = metotrexát
b P = 0,027; adalimumab 0,8 mg/kg verzus MTX
c P = 0,083; adalimumab 0,8 mg/kg verzus MTX
Pacienti, ktorí dosiahli PASI 75 a PGA čisté alebo minimálne, boli vysadení z liečby po dobu najviac
36 týždňov a boli sledovaní z hľadiska straty kontroly nad ochorením (t. j. zhoršenie PGA aspoň
o 2 stupne). Pacienti boli potom znova liečení adalimumabom 0,8 mg/kg každý druhý týždeň (every other week – eow) počas ďalších 16 týždňov a miera odpovede pozorovaná pri opakovanej liečbe bola podobná ako v predchádzajúcom dvojito zaslepenom období: PASI 75 odpoveď 78,9 % (15 z 19 subjektov) a PGA čisté alebo minimálne 52,6 % (10 z 19 subjektov).
V otvorenom období štúdie boli odpovede PASI 75 a PGA čisté alebo minimálne zachované až počas ďalších 52 týždňov bez nových bezpečnostných zistení.
Hidradenitis suppurativa
Bezpečnosť a účinnosť adalimumabu boli hodnotené v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách a v otvorenej predĺženej štúdii u dospelých pacientov so stredne ťažkou až ťažkou hidradenitis suppurativa (HS), ktorí netolerovali, mali kontraindikáciu alebo nedostatočnú odpoveď na aspoň 3-mesačnú skúšobnú systémovú antibiotickú terapiu. Pacienti v HS-I a HS-II mali štádium ochorenia II alebo III podľa Hurleyho a mali aspoň 3 abscesy alebo zápalové uzlíky.
V štúdii HS-I (PIONEER I) bolo hodnotených 307 pacientov počas 2 liečebných fáz. Vo fáze A dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0; 80 mg v 2. týždni a 40 mg každýtýždeň počínajúc 4. týždňom a končiac 11. týždňom. Súčasné používanie antibiotík v priebehu štúdie nebolo dovolené. Po 12 týždňoch liečby pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do 1 z 3 liečebných skupín (adalimumab
40 mg každý týždeň, adalimumab 40 mg každý druhý týždeň alebo placebo od 12. týždňa do
35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny s placebom, dostávali vo fáze B
adalimumab 40 mg každý týždeň.
V štúdii HS-II (PIONEER II) bolo hodnotených 326 pacientov počas 2 liečebných fáz. Vo fáze A
dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0 a 80 mg
v 2. týždni a 40 mg každýtýždeň počínajúc 4. týždňom a končiac 11. týždňom. 19,3 % pacientov
pokračovalo v priebehu štúdie v základnej perorálnej liečbe antibiotikami. Po 12. týždňoch liečby pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do 1 z 3
liečebných skupín (adalimumab 40 mg každý týždeň, adalimumab 40 mg každý druhý týždeň alebo
placebo od 12. týždňa do 35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny
s placebom, dostávali vo fáze B placebo.
Pacienti, ktorí sa zúčastnili štúdií HS-I a HS-II, boli vhodní na zaradenie do otvorenej predĺženej štúdie, v ktorej bol adalimumab 40 mg podávanýkaždýtýždeň. Priemerná expozícia v celej populácii s adalimumabom bola 762 dní. Počas všetkých 3 štúdií pacienti používali lokálny antiseptický prípravok na každodenné umývanie.
Kl i ni ck á odpoveď
Zníženie zápalových lézií a prevencia zhoršenia abscesov a vytekajúcich fistúl boli hodnotené
pomocou klinickej odpovede pri hidradenitis suppurativa (Hidradenitis Suppurativa Clinical Response
-HiSCR, najmenej 50 % zníženie celkového počtu abscesov a zápalových uzlíkov bez nárastu počtu
abscesov a bez nárastu počtu vytekajúcich fistúl v porovnaní s východiskovým stavom). Zníženie bolesti kože súvisiacej s HS bolo hodnotené pomocou číselnej hodnotiacej stupnice u pacientov, ktorí vstúpili do štúdie s počiatočným východiskovým skóre 3 alebo viac na 11-bodovej stupnici.
V 12. týždni významne vyšší podiel pacientov liečených adalimumabom v porovnaní s pacientmi liečenými placebom dosiahol HiSCR. V 12. týždni významne vyšší podiel pacientov v štúdii HS-II dosiahol klinicky relevantné zníženie bolesti kože súvisiacej s HS (pozri tabuľku 21). U pacientov liečených adalimumabom sa významne znížilo riziko vzplanutia ochorenia v priebehu prvých 12 týždňov liečby.
Tabuľka 21: Výsledky hodnotenia účinnosti po 12 týždňoch, štúdie HS I a II
Štúdia HS I Štúdia HS II
Placebo
A
dalimumab
40 mg raz
t
ýždenne Placebo
A
dalimumab
40 mg raz
t
ýždenne
Klinická odpoveď pri hidradenitis suppurativa (HiSCR)a
N = 154
40 (26,0 %)
N = 153
64 (41,8 %) *
N = 163
45 (27,6 %)
N = 163
96 (58,9 %) ***
≥ 30 % zníženie bolesti kožeb N = 109
27 (24,8 %)
N = 122
34 (27,9 %)
N = 111
23 (20,7 %)
N = 105
48 (45,7 %) ***

*
P < 0,05, ***
P < 0,001, adalimumab verzus placebo
a →U všetkých randomizovaných pacientov.
b →U pacientov s východiskovou hodnotou bolesti kože súvisiacej s HS ≥ 3, založené na číselnej
hodnotiacej stupnici 0 – 10; 0 = žiadna bolesť kože, 10 = najhoršia bolesť kože, akú si dokážete predstaviť.
Liečba adalimumabom 40 mg každý týždeň významne znížila riziko zhoršenia abscesov a
vytekajúcich fistúl. V prvých 12 týždňoch štúdií HS-I a HS-II približne dvakrát vyšší podiel pacientov
v skupine s placebom v porovnaní s tými, ktorí boli v skupine liečenej adalimumabom, zaznamenal
zhoršenie abscesov (23,0 % verzus 11,4 %) a vytekajúcich fistúl (30,0 % verzus 13,9 %).
Výraznejšie zlepšenia v 12. týždni oproti východiskovému stavu v porovnaní s placebom bolo preukázané v kvalite života súvisiacej so zdravím kože, ktorá bola meraná Dermatologickým indexom kvality života (Dermatology Life Quality Index - DLQI; štúdie HS-I a HS-II), v celkovej spokojnosti pacienta s medikamentóznou liečbou, ktorá bola meraná Dotazníkom na zisťovanie spokojnosti
s liečbou - medikamentózna liečba (TSQM; štúdie HS-I a HS-II), a vo fyzickom zdraví, ktoré bolo merané pomocou skóre súhrnnej hodnoty fyzických komponentov SF-36 (štúdia HS-I).
Spomedzi pacientov, u ktorých bola v 12. týždni zaznamenaná aspoň čiastočná odpoveď na adalimumab 40 mg raz týždenne, bola hodnota HiSCR v 36. týždni vyššia u pacientov, ktorí pokračovali v liečbe adalimumabomraztýždenne, ako u pacientov, u ktorých bola frekvencia dávkovania zredukovaná na každý druhý týždeň alebo u ktorých bola liečba vysadená (pozri tabuľku
22).
T
abuľka 22: Podiel pacientov
a
, ktorí dosiahli HiSCR
b
v 24. a 36. týždni po zmene liečby
adalimumabomraz týždenne v 12. týždni
Placebo (liečba vysadená) N = 73
A
dalimumab
40 mg
každý druhý týždeň
 N = 70
A
dalimumab
40 mg
raz týždenne
N = 70
N = 70
A
dalimumab
40 mg
raz týždenne
N = 70
24. týždeň 24 (32,9 %) 36 (51,4 %) 40 (57,1 %)
36. týždeň 22 (30,1 %) 28 (40,0 %) 39 (55,7 %) aPacienti, u ktorých bola po 12 týždňoch liečby zaznamenaná aspoň čiastočná odpoveď na adalimumab 40 mg raz týždenne.
bPacienti spĺňajúci kritériá protokolu týkajúce sa straty odpovede alebo žiadneho zlepšenia boli požiadaní, aby ukončili účasť na štúdiách a boli
počítaní medzi pacientov bez odpovede.
U pacientov, u ktorých bola zaznamenaná aspoň čiastočná odpoveď v 12. týždni a ktorí dostávali aj
naďalej týždennú liečbu adalimumabom, bola hodnota HiSCR v 48. týždni 68,3 % a v 96. týždni
65,1%. Pri dlhodobejšej týždennej liečbe adalimumabom 40 mg v trvaní 96 týždňov neboli identifikované žiadne nové bezpečnostné zistenia.
U pacientov, ktorým bola liečba adalimumabom vysadená v 12. týždni v štúdiách HS-I a HS-II, sa hodnota HiSCR 12 týždňov po opätovnom zavedení adalimumabu 40 mg raz týždenne vrátila na úrovne podobné tým, ktoré boli pozorované pred vysadením (56,0 %).
Hidradenitis suppurativa u dospievajúcich
Neuskutočnili sa žiadne klinické skúšania s adalimumabom u dospievajúcich pacientov s HS. Účinnosť adalimumabu pri liečbe dospievajúcich pacientov s HS sa predpovedá na základe preukázanej účinnosti a vzťahu expozície a odpovede u dospelých pacientov s HS a pravdepodobnosti, že priebeh ochorenia, patofyziológia a účinky lieku sú do značnej miery podobné ako u dospelých pacientov s rovnakou úrovňou expozície. Bezpečnosť odporúčanej dávky adalimumabu
v dospievajúcej populácii s HS je založená na bezpečnostnom profile adalimumabu naprieč indikáciami u dospelých i pediatrických pacientov s podobnou alebo vyššou frekvenciou dávok (pozri
časť 5.2).
Crohnova choroba
Bezpečnosť a účinnosť adalimumabu sa hodnotila u viac ako 1500 pacientov s miernou až ťažkou aktívnou Crohnovou chorobou (index aktivity Crohnovej choroby: Crohn’s Disease Activity Index - CDAI ³ 220 a £ 450) v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách. Boli povolené súbežné stabilné dávky aminosalicylátov, kortikosteroidov a/alebo imunomodulačných liekov a 80 % pacientov pokračovalo v užívaní najmenej jedného z týchto liekov.
Indukcia klinickej remisie (definovaná ako CDAI < 150) sa hodnotila v dvoch štúdiách, CD štúdii I (CLASSIC I) a v CD štúdii II (GAIN). V CD štúdii I boli 299 pacienti bez predchádzajúcej liečby antagonistami TNF randomizovaní do jednej zo štyroch liečebných skupín; placebo v týždňoch 0 a 2,
160 mg adalimumabu v týždni 0 a 80 mg v týždni 2, 80 mg v týždni 0 a 40 mg v týždni 2, a 40 mg
v týždni 0 a 20 mg v týždni 2. V CD štúdii II bolo 325 pacientov, ktorí stratili schopnosť odpovedať alebo mali neznášanlivosť infliximabu, randomizovaných tak, že dostávali buď 160 mg adalimumabu v týždni 0 a 80 mg v týždni 2 alebo placebo v týždňoch 0 a 2. Primárne na liečbu neodpovedajúci pacienti boli zo štúdií vylúčení a preto neboli ďalej hodnotení.
Pretrvávanie klinickej remisie sa hodnotilo v CD štúdii III (CHARM).V otvorenej fáze CD štúdie III
dostalo 854 pacientov 80 mg v týždni 0 a 40 mg v týždni 2. V týždni 4 boli pacienti v štúdii
s celkovým trvaním 56 týždňov randomizovaní do skupín so 40 mg každý druhý týždeň, 40 mg každý týždeň alebo placebo. Pacienti s klinickou odpoveďou na liečbu v týždni 4 (pokles v CDAI ≥ 70) boli
stratifikovaní a analyzovaní oddelene od tých, ktorí boli do týždňa 4 bez klinickej odpovede. Znižovanie kortikosteroidu bolo povolené po týždni 8.
Indukcia remisie a percento odpovede v CD štúdii I a CD štúdii II sú uvedené v tabuľke 23.
T
abuľka 23
Indukcia klinickej remisie a odpovede
(
percento pacientov)
C
D štúdia I: Pacienti doteraz neliečení
i
n
fli
x
i
m
abom
C
D štúdia II: Pacienti
s predchádzajúcou liečbou
i
n
fli
x
i
m
abom
Týždeň 4
Placebo
N = 74
Adalimumab
80/40 mg
N = 75
Adalimumab
160/80 mg N
= 76
Placebo
N = 166
Adalimumab
160/80 mg
N = 159
Klinická remisia 12 % 24 % 36 %* 7 % 21 %*
Klinická odpoveď
(CR-100)
24 % 37 % 49 %** 25 % 38 %**

Všetky hodnoty p sú párové porovnania adalimumabu verzus placebo
* p < 0,001
** p < 0,01
V oboch úvodných dávkovacích režimoch, 160/80 mg a 80/40 mg, sa do týždňa 8 pozorovali podobné
počty remisií a nežiaduce účinky boli častejšie pozorované v skupine so 160/80 mg.
V CD štúdii III malo 58 % (499/854) pacientov v týždni 4 klinickú odpoveď a boli hodnotení v primárnej analýze. Z tých s klinickou odpoveďou na liečbu v týždni 4 bolo 48 % predtým vystavených liečbe iným antagonistom TNF. Doba trvania remisie a počty pacientov s odpoveďou na liečbu sú uvedené v tabuľke 24.
Výsledky klinickej remisie zostali pomerne nemenné bez ohľadu na predchádzajúcu expozíciu
antagonistovi TNF.
Počet hospitalizácií a chirurgických zákrokov súvisiacich s ochorením bol v 56. týždni štatisticky signifikantne znížený pri používaní adalimumabu v porovnaní s placebom.
T
abuľka 24
P
r
etrvávanie klinickej remisie a odpovede
(
percento pacientov)
 Placebo
40 mg
adalimumabu každý druhý týždeň
40 mg adalimumabu každý týždeň
Placebo
40 mg
adalimumabu každý druhý týždeň
40 mg adalimumabu každý týždeň
T
ýždeň 26 N = 170 N = 172 N = 157
Klinická remisia 17 % 40 %* 47 %*
Klinická odpoveď (CR-100) 27 % 52 %* 52 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
3 % (2/66) 19 % (11/58)** 15 % (11/74)**
T
ýždeň 56 N = 170 N = 172 N = 157
Klinická remisia 12 % 36 %* 41 %*
Klinická odpoveď (CR-100) 17 % 41 %* 48 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
5 % (3/66) 29 % (17/58)* 20 % (15/74)**
* p < 0,001 pre adalimumab verzus placebo, porovnania párových hodnôt
** p < 0,02 pre adalimumab verzusplacebo, porovnania párových hodnôt
a u tých, ktorí užívali kortikosteroidy na začiatku liečby
Z pacientov, ktorí boli v týždni 4 bez odpovede, do týždňa 12 odpovedalo 43 % pacientov liečených
adalimumabom v porovnaní s 30 % pacientov, ktorým sa podávalo placebo. Tieto výsledky naznačujú, že niektorí pacienti, ktorí neodpovedajú na liečbu do týždňa 4, majú prínos z pokračujúcej udržiavacej
liečby do týždňa 12. Liečba, pokračujúca po 12. týždni, neviedla k signifikantne vyššiemu počtu
odpovedí (pozri časť 4.2).
117 z 276 pacientov zo štúdie CD I a 272 zo 777 pacientov zo štúdií CD II a III bolo sledovaných počas otvorenej liečby adalimumabom minimálne 3 roky. 88 pacientov z CD I a 189 pacientov z CD II a III pokračovalo v liečbe až do klinickej remisie. Klinická odpoveď (CR-100) sa udržala
u 102 pacientov z CD I a 233 pacientov z CD II a III.
Kval it a ži vot a
V CD štúdii I a CD štúdii II sa v týždni 4 dosiahlo štatisticky signifikantné zlepšenie celkového skóre
v dotazníku pre zápalového ochorenia čreva (Inflammatory bowel disease questionnaire - IBDQ)
u pacientov randomizovaných do skupín adalimumab 80/40 mg a adalimumab 160/80 mg v porovnaní
s placebom a v týždňoch 26 a 56 sa pozorovalo v CD štúdii III vo všetkých skupinách liečených
adalimumabom v porovnaní so skupinou s placebom.
Crohnova choroba u pediatrických pacientov
Adalimumab sa hodnotil v multicentrickom, randomizovanom, dvojito zaslepenom klinickom skúšaní zameranom na hodnotenie účinnosti a bezpečnosti úvodnej a udržiavacej liečby dávkami závislými od telesnej hmotnosti (< 40 kg alebo ≥ 40 kg) u 192 pediatrických jedincov vo veku od 6 do 17 rokov (vrátane) s mierne ťažkou až ťažkou Crohnovou chorobou (CD), definovanou indexom aktivity Crohnovej choroby u detí (Pediatric Crohn’s Disease Activity Index- PCDAI) so skóre > 30. U týchto jedincov musela zlyhať konvenčná liečba CD (vrátane kortikosteroidov a/alebo imunomodulátorov). Jedinci mohli tiež predtým stratiť odpoveď na infliximab alebo ho netolerovať.
Všetci jedinci dostávali v otvorenej fáze úvodnú liečbu dávkou založenou na ich východiskovej telesnej hmotnosti: 160 mg v týždni 0 a 80 mg v týždni 2 jedinci ≥ 40 kg, prípadne 80 mg a 40 mg, jedinci< 40 kg.
V týždni 4 boli jedinci randomizovaní 1:1 na základe ich telesnej hmotnosti v tom čase buď na dávkovací režim s nízkou dávkou alebo štandardnou udržiavacou dávkou, ako je uvedené v tabuľke
25.
Hm
o
t
nosť
pacienta
T
abuľka 25
 U
držiavací režim
N
í
z
ka dávka Štandardná dávka
U
držiavací režim
N
í
z
ka dávka Štandardná dávka
< 40 kg 10 mg každý druhý týždeň
≥ 40 kg 20 mg každý druhý týždeň
20 mg každý druhý týždeň
40 mg každý druhý týždeň
Výsl edky účinnost i
Primárny koncový ukazovateľ v štúdii bola klinická remisia v týždni 26, definovaná ako skóre PCDAI
≤ 10.
Klinická remisia a klinická odpoveď na liečbu (definovaná ako zníženie skóre PCDAI o najmenej
15 bodov v porovnaní s východiskovou hodnotou) sú uvedené v tabuľke 26. Percentá vysadenia kortikosteroidov alebo imunomodulátorov sú uvedené v tabuľke 27.
Tabuľka 26
Pediatrická CD štúdia
Klinická remisia PCDAI a odpoveď
T
ýždeň 26
Štandardná dávka
40/20 mg každý
druhý týždeň
 N = 93
N
í
z
ka dávka
20/10 mg každý druhý týždeň N = 95
H
odnota p
N = 93
N
í
z
ka dávka
20/10 mg každý druhý týždeň N = 95
H
odnota p*
Klinická remisia 38,7 % 28,4 % 0,075
Klinická odpoveď 59,1 % 48,4 % 0,073
Týždeň 52
Klinická remisia 33,3 % 23,2 % 0,100
Klinická odpoveď 41,9 % 28,4 % 0,038
* porovnanie hodnoty p štandardná dávka verzus nízka dávka
 T
abuľka 27
P
ediatrická CD štúdia
V
ysadenie kortikosteroidov alebo imunomodulátorov a remisia fistúl
T
abuľka 27
P
ediatrická CD štúdia
V
ysadenie kortikosteroidov alebo imunomodulátorov a remisia fistúl
Štandardná dávka
40/20 mg každý
druhý týždeň
N
í
z
ka dávka
20/10 mg každý druhý týždeň
H
odnota p
1
V
ysadenie kortikosteroidov N = 33 N = 38
Týždeň 26 84,8 % 65,8 % 0,066
Týždeň 52 69,7 % 60,5 % 0,420
Vysadenie imunomodulátorov2 N = 60 N = 57
Týždeň 52 30,0 % 29,8 % 0,983
Remisia fistúl3 N = 15 N = 21
Týždeň 26 46,7 % 38,1 % 0,608
Týždeň 52 40,0 % 23,8 % 0,303
1 porovnanie hodnoty p štandardná dávka verzus nízka dávka
2 imunosupresívna liečba mohla byť zastavená len v týždni 26 alebo neskôr na základe uváženia skúšajúceho lekára o tom, či jedinec spĺňa kritéria klinickej odpovede
3 definované ako uzavretie všetkých fistúl, ktoré secernovali na začiatku liečby, prinajmenšom
pri 2 po sebe nasledujúcich návštevách po východiskovej návšteve
Štatisticky významné zvýšenia (zlepšenie) indexu telesnej hmotnosti a rýchlosti rastu
z východiskového stavu do týždňa 26 a 52 boli pozorované u oboch liečebných skupín.
Štatisticky a klinicky významnézlepšenia v porovnaní s východiskovým stavom boli pozorované
u oboch liečebných skupín aj pre parametre kvality života (vrátane IMPACT III).
Sto pediatrických pacientov (n = 100) zo štúdie s Crohnovou chorobou pokračovalo v otvorenej dlhodobej predĺženej štúdii. Po 5 rokoch liečby adalimumabom pretrvala klinická remisia u 74,0 % (37/50) z 50 pacientov, ktorí zotrvali v štúdii a u 92,0 % (46/50) pacientov pretrvala klinická odpoveď podľa PCDAI.
Ulcerózna kolitída
Bezpečnosť a účinnosť viacnásobného podania adalimumabu sa overila u dospelých pacientov so stredne ťažkou až ťažkou aktívnou ulceróznou kolitídou (Mayo skóre 6 až 12 vrátane endoskopického podskóre 2 až 3) v randomizovaných dvojito zaslepených placebom kontrolovaných štúdiách.
V štúdii UC-I bolo zaradených 390 pacientov v minulosti neliečených antagonistami TNF, ktorí boli randomizovaní do skupín, v ktorých im bolo podávané buď placebo v týždni 0 a 2 a 160 mg adalimumabu v týždni 0 a následne 80 mg v týždni 2 alebo 80 mg adalimumabu v týždni 0 a následne
40 mg v týždni 2. Po týždni 2 dostávali pacienti v oboch ramenách s adalimumabom dávku 40 mg
každý druhý týždeň. Klinická remisia (definovaná ako Mayo skóre ≤ 2 bez podskóre > 1) sa hodnotila v týždni 8.
V štúdii UC-II dostávalo 248 pacientov dávku 160 mg adalimumabu v týždni 0, 80 mg v týždni 2
a následne 40 mg každý druhý týždeň a 246 pacientov dostávalo placebo. U klinických výsledkov sa
hodnotila indukcia remisie v týždni 8 a udržanie remisie v týždni 52.
Pacienti, u ktorých sa liečba začala dávkou 160/80 mg adalimumabu, dosiahli klinickú remisiu v týždni 8 v signifikantne vyššom percente v porovnaní s placebom v štúdii UC-I (18 % vs. 9 %,
p = 0,031) a v štúdii UC-II (17 % vs. 9 %, p = 0,019). U 21 zo 41 subjektov (51 %), ktorým sa v štúdii
UC-II podával adalimumab a ktorí dosiahli remisiu v týždni 8, bola dosiahnutá remisia aj v týždni 52. Výsledky z celej populácie štúdie UC-II sú zobrazené v tabuľke 28.
T
abuľka 28
O
dpoveď, remisia a hojenie sliznice v štúdii UC-II (percento pacientov)
Placebo
A
dalimumab 40 mg
každý druhý týždeň
T
ýždeň 52 N = 246 N = 248
Klinická odpoveď 18 % 30 %* Klinická remisia 9 % 17 %* Hojenie sliznice 15 % 25 %*
Remisia bez steroidov po ≥ 90
dnía
6 %

(N = 140)
13 %* (N = 150)
T
ýždeň 8 a 52
Udržanie odpovede 12 % 24 %** Udržanie remisie 4 % 8 %* Udržanie hojenia sliznice 11 % 19 %* Klinická remisia je definovaná ako Mayo skóre ≤ 2 bez podskóre > 1;
Klinická odpoveď je definovaná ako zníženie Mayo skóre o ≥ 3 body a ≥ 30 % v porovnaní
s východiskovým stavom plus pokles podskóre rektálneho krvácania [rectal bleeding subscore, RBS]
o ≥ 1 alebo absolútny RBS 0 alebo 1;
* p < 0,05 párové porovnanie hodnôt u adalimumabu v porovnaní s placebom
** p < 0,001 párové porovnanie hodnôt u adalimumabu v porovnaní s placebom.
a Z tých, ktorí pôvodne dostávali kortikosteroidy.
Z tých pacientov, ktorí mali odpoveď v týždni 8, malo v 52. týždni 47 % odozvu, 29 % bolo v remisii, u 41 % sa hojila sliznica a 20 % bolo v remisii bez steroidov počas ≥ 90 dní.
Približne u 40 % pacientov v štúdii UC-II zlyhala predtým liečba antagonistom TNF infliximabom. Účinnosť adalimumabu u týchto pacientov bola znížená v porovnaní s pacientmi, ktorí neboli liečení antagonistom TNF. Medzi pacientmi, u ktorých zlyhala predchádzajúca liečba antagonistom TNF, dosiahli v týždni 52 remisiu 3 % pacientov na placebe a 10 % pacientov na adalimumabe.
Pacienti zo štúdie UC-I a UC-II mali možnosť prejsť do otvorenej dlohodobej rozšírenej štúdie
(UC-III). Po 3 rokoch liečby adalimumabom 75 % pacientov (301/402) zotrvalo v klinickej remisii
podľa parciálneho Mayo skóre.
Frek venci a hospit ali zácií
Počas 52-týždňového sledovania v štúdiách UC-I a UC-II bola v ramene s adalimumabom pozorovaná
nižšia frekvencia hospitalizácií z akejkoľvek príčiny a hospitalizácií súvisiacich s UC v porovnaní
s ramenom s placebom. Počet hospitalizácií z akejkoľvej príčiny v skupine liečenej adalimumabom
bol 0,18 pacientorokov v porovnaní s 0,26 pacientorokov v skupine s placebom a zodpovedajúce údaje pre hospitalizácie súvisiace s UC boli 0,12 pacientorokov v porovnaní s 0,22 pacientorokov.
Kval it a ži vot a
V štúdii UC-II viedla liečba adalimumabom k zlepšeniu skóre v dotazníku pre zápalového ochorenia
čreva (Inflammatory bowel disease questionnaire - IBDQ).
Uveitída
Bezpečnosť a účinnosť adalimumabu sa hodnotili u dospelých pacientov s neinfekčnou intermediárnou a posteriórnou uveitídou a panuveitídou, s vylúčením pacientov s izolovanou anteriórnou uveitídou, v dvoch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách (UV I a II). Pacienti dostávali placebo alebo adalimumab v úvodnej dávke 80 mg, potom
nasledovala dávka 40 mg každý druhý týždeň po uplynutí jedného týždňa od úvodnej dávky. Povolené bolo súčasné podávanie stabilných dávok jedného nebiologického imunosupresíva.
V štúdii UV I sa hodnotilo 217 pacientov s aktívnou uveitídou napriek liečbe kortikosteroidmi
(perorálny prednizón v dávke 10 až 60 mg/deň). Na začiatku štúdie dostávali všetci pacienti
2-týždňovú štandardizovanú dávku prednizónu 60 mg/deň, potom nasledoval harmonogram povinného znižovania dávky s úplným vysadením kortikosteroidov do 15. týždňa.
V štúdii UV II sa hodnotilo 226 pacientov s neaktívnou uveitídou vyžadujúcich chronickú liečbu kortikosteroidmi (perorálny prednizón v dávke 10 až 35 mg/deň) na začiatku liečby na kontrolu ich ochorenia. Pacienti následne absolvovali povinný harmonogram znižovania dávky s úplným vysadením kortikosteroidov do 19. týždňa.
Primárnym koncovým ukazovateľom v oboch štúdiách bol „čas do zlyhania liečby“. Zlyhanie liečby bolo definované ako viaczložkový výsledok založený na zápalových chorioretinálnych a/alebo zápalových retinálnych vaskulárnych léziách, hodnotení buniek prednej komory (anterior chamber - AC), hodnotení zákalu sklovca (vitreous haze -VH) a najlepšej korigovanej ostrosti videnia (best corrected visual acuity -BCVA).
Kl i ni ck á odpoveď
Výsledky oboch štúdií preukázali štatisticky významné zníženie rizika zlyhania liečby u pacientov
liečených adalimumabom oproti pacientom, ktorí dostávali placebo (pozri tabuľku 29). V oboch
štúdiách sa preukázal skorý a pretrvávajúci účinok adalimumabu na mieru zlyhania liečby v porovnaní
s placebom (pozri obrázok 2).
Tabuľka 29
Čas do zlyhania liečby v štúdiách UV I a UV II
 A
nalýza
L
i
ečba
N Zlyhanie
N (%)
Medián času do
z
l
yhania
(m
e
siace)
H
R
a
IS 95 %
pre HR
a
H
odnota
P
A
nalýza
L
i
ečba
N Zlyhanie
N (%)
Medián času do
z
l
yhania
(m
e
siace)
H
R
a
IS 95 %
pre HR
a
H
odnota
P
b
 Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Primárna analýza (ITT)

Placebo 107 84 (78,5) 3,0 -- -- -- Adalimumab 110 60 (54,5) 5,6 0,50 0,36; 0,70 < 0,001
Čas do zlyhania liečby v 2. týždni alebo neskôr v štúdii UV IIPrimárna analýza (ITT)
Placebo 111 61 (55,0) 8,3 -- -- --
Adalimumab 115 45 (39,1) NOc 0,57 0,39; 0,84 0,004 Poznámka: Ako udalosť sa započítavalo zlyhanie liečby v 6. týždni alebo neskôr (štúdia UV I), alebo
v 2. týždni alebo neskôr (štúdia UV II). Prípady ukončenia liečby z iných dôvodov ako zlyhanie liečby
sa vyradili v čase ukončenia.
a HR adalimumabu oproti placebu z regresného modelu relatívneho rizika s liečbou ako faktorom.
b 2-stranná hodnota
P z logaritmického testu poradí.
c NO = nemožno odhadnúť. Udalosť sa vyskytla u menej než polovice rizikových účastníkov.
Obrázok 2: Kaplanove-Meierove krivky znázorňujúce čas do zlyhania liečby v 6. týždni alebo neskôr (štúdia UV I), alebo v 2. týždni alebo neskôr (štúdia UV II)
 ČAS (MESIACE)
ČAS (MESIACE)Štúdia UV I Liečba

Placebo

Adalimumab

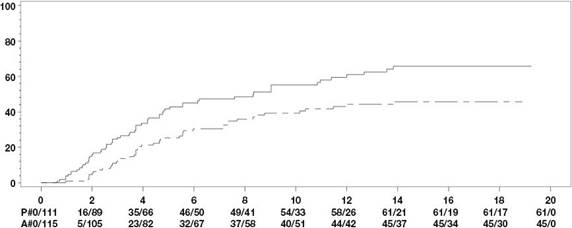 ČAS (MESIACE)
ČAS (MESIACE)Štúdia UV II Liečba

Placebo

Adalimumab
Poznámka: P# = placebo (počet udalostí/počet rizikových účastníkov); A# = Adalimumab (počet udalostí/počet rizikových účastníkov).
V štúdii UV I sa pozorovali štatisticky významné rozdiely v prospech adalimumabu v porovnaní s placebom pre každú zložku zlyhania liečby. V štúdii UV II sa pozorovali štatisticky významné rozdiely len v prípade ostrosti videnia, ale aj ostatné zložky boli číselne v prospech adalimumabu.
Zo 417 pacientov zahrnutých do nekontrolovaného dlhodobého predĺženia štúdií UV I a UV II bolo 46
pacientov považovaných za nevhodných (napr. vyvinuli sa u nich sekundárne komplikácie k
diabetickej retinopatii v dôsledku operácie sivého zákalu alebo vitrektómii) a boli vylúčení z primárnej analýzy účinnosti. Z 371 zostávajúcich pacientov 276 hodnotiteľných pacientov dosiahlo 78 týždňov otvorenej liečby adalimumabom. Z pozorovaných údajov vyplýva, že 222 (80,4 %) pacientov bolo
v pokojovej fáze (bez aktívnych zápalových lézií, stupeň hodnotenia buniek prednej komory ≤ 0,5 +,
stupeň hodnotenia zákalu sklovca ≤ 0,5 +) so súčasnou dávkou steroidov ≤ 7,5 mg denne a 184
(66,7 %) sa nachádzalo v pokojovej fáze bez steroidov. Hodnota BCVA sa v týždni 78 buď zlepšila,
alebo udržala (zhoršenie o < 5 písmen) u 88,4 % očí. Spomedzi pacientov, ktorí prerušili účasť na štúdii pred týždňom 78, 11 % prerušilo v dôsledku nežiaducich účinkov a 5 % v dôsledku nedostatočnej odpovede na liečbu adalimumabom.
Kval it a ži vot a
V oboch klinických štúdiách sa merali výsledky súvisiace s funkciou videnia hlásené pacientmi
s použitím dotazníka NEI VFQ-25. Výsledky adalimumabu boli číselne priaznivejšie pre väčšinu vedľajších skóre so štatisticky významnými priemernými rozdielmi pre celkové videnie, bolesť oka,
videnie na blízko, duševné zdravie a celkové skóre v štúdii UV I a pre celkové videnie a duševné
zdravie v štúdii UV II. Účinky súvisiace s videním neboli číselne priaznivejšie pre adalimumab
v prípade farebného videnia v štúdii UV I a farebného videnia, periférneho videnia a videnia na blízko
v štúdii UV II.
Uveitída u pediatrických pacientov
Bezpečnosť a účinnosť adalimumabu sa hodnotila v randomizovanej, dvojito zaslepenej, kontrolovanej štúdii s účasťou 90 pediatrických pacientov vo veku od 2 do < 18 rokov s aktívnou neinfekčnou anteriórnou uveitídou spojenou s JIA, ktorí nereagovali na najmenej 12-týždňovú liečbu metotrexátom. Pacienti dostávali buď placebo alebo 20 mg adalimumabu (ak < 30 kg), alebo 40 mg adalimumabu (ak ≥ 30 kg) každý druhý týždeň v kombinácii s východiskovou dávkou metotrexátu.
Primárnym koncovým ukazovateľom bol „čas do zlyhania liečby“. Kritériami zlyhania liečby boli zhoršenie alebo trvalé nezlepšenie očného zápalu, čiastočné zlepšenie s rozvojom trvalých očných komorbidít alebo zhoršenie očných komorbidít, nepovolené používanie súbežne podávaných liekov a prerušenie liečby na dlhší čas.
Kl i ni ck á odpoveď
Adalimumab významne oddialil čas do zlyhania liečby v porovnaní s placebom (pozri obrázok 3,
P < 0,0001 z logaritmického testu poradí).Medián času do zlyhania liečby bol 24,1 týždňa u pacientov liečených placebom, zatiaľ čo medián času do zlyhania liečby u pacientov liečených adalimumabom nebolo možné stanoviť, pretože zlyhanie liečby zaznamenalo menej ako polovica týchto pacientov. Adalimumab výrazne znížil riziko zlyhania liečby o 75 % v porovnaní s placebom, ako je to vidieť
z pomeru rizika (HR = 0,25 [95 % IS: 0,12; 0,49]).
O
brázok 3: Kaplanove-Meierove krivky znázorňujúce čas do zlyhania liečby v štúdii uveitídy
u pediatrických pacientov

 ČA
S (TÝŽDNE)
ČA
S (TÝŽDNE)
Liečba

Placebo Adalimumab
Poznámka: P = placebo (počet rizikových účastníkov); A = Adalimumab (počet rizikových účastníkov).
ImunogenicitaPočas liečby adalimumabom sa môžu tvoriť protilátky proti adalimumabu. Tvorba protilátok proti
adalimumabu je spojená so zvýšeným klírensom a zníženou účinnosťou adalimumabu. Nie je zrejmý vzťah medzi prítomnosťou protilátok proti adalimumabu a výskytom nežiaducich účinkov.
Pediatrická populáciaEurópska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným
liekom obsahujúcim adalimumabv jednej alebo viacerých podskupinách pediatrickej populácie, ulceróznou kolitídou, informácie o pediatrickom použití, pozri časť 4.2.
5.2 Farmakokinetické vlastnostiAbsorpcia a distribúciaPo subkutánnom podaní jednorazovej dávky 40 mg bola absorpcia a distribúcia adalimumabu pomalá.
Maximálne sérové koncentrácie sa dosiahli asi 5 dní po podaní. Priemerná absolútna biologická dostupnosť adalimumabu, na základe troch štúdií, bola 64 % po podaní jednorazovej subkutánnej
dávky 40 mg. Po jednorazových intravenóznych dávkach v rozpätí od 0,25 do 10 mg/kg boli
koncentrácie lieku úmerné dávke. Po dávkach 0,5 mg/kg (~ 40 mg) bol klírens v rozsahu od 11 do
15 ml/hodinu, distribučný objem (Vss) v rozsahu od 5 do 6 litrov a priemerný polčas terminálnej fázy bol približne dva týždne. Koncentrácie adalimumabu v synoviálnej tekutine, stanovené u niekoľkých pacientov s ťažkou reumatoidnou artritídou, boli v rozsahu od 31 do 96 % sérových koncentrácií.
Po subkutánnom podávaní 40 mg adalimumabu každý druhý týždeň u dospelých pacientov
s reumatoidnou artritídou (RA) boli najnižšie priemerné sérové koncentrácie v rovnovážnom stave
približne 5 mg/ml (bez súbežnej liečby metotrexátom) a 8 až 9 mg/ml (pri súbežsnej liečbe metotrexátom). Najnižšie sérové koncentrácie adalimumabu v rovnovážnom stave sa zvyšovali približne úmerne s dávkou pri subkutánnom podávaní 20, 40 a 80 mg každý druhý týždeň aj každý týždeň.
Po podávaní dávky 24 mg/m2 (až do maxima 40 mg) subkutánne každý druhý týždeň pacientom
s polyartikulárnou juvenilnou idiopatickou artritídou (JIA), ktorí mali 4 až 17 rokov, bola najnižšia priemerná sérová koncentrácia adalimumabu v rovnovážnom stave (hodnoty merané v týždňoch 20 až
48) 5,6 ± 5,6 μg/ml (102 % CV) pri adalimumabe bez súbežného metotrexátu a 10,9 ± 5,2 μg/ml
(47,7 % CV) so súbežným metotrexátom.
U pacientov s polyartikulárnou JIA, ktorí boli vo veku 2 až < 4 roky alebo 4 roky aviac a mali hmotnosť < 15 kg, ktorým bol podávané dávky adalimumabu 24 mg/m2, boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 6,0 ± 6,1 µg/ml (101 % CV) pri adalimumabe bez súbežného metotrexátu a 7,9 ± 5,6 µg/ml (71,2 % CV) so súbežným metotrexátom.
Po podávaní dávky 24 mg/m² (až do maxima 40 mg) subkutánne každý druhý týždeň pacientom s artritídou spojenou s entezitídou, ktorí mali 6 až 17 rokov, boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 8,8 ± 6,6 mg/mlpri adalimumabe bez súbežného metotrexátua 11,8 ± 4,3 mg/ml so súbežným metotrexátom (hodnoty meranév 24. týždni).
Po subkutánnom podávaní 40 mg adalimumabu každý druhý týždeň dospelým pacientom
s nerádiografickou axiálnou spondylartritídou bola v týždni 68 priemerná (± SD) najnižšia koncentrácia v rovnovážnom stave 8,0 ± 4,6 µg ml.
U dospelých pacientov so psoriázou bola priemerná najnižšia rovnovážna koncentrácia 5 mg/ml počas liečby adalimumabom v monoterapii v dávke 40 mg každý druhý týždeň.
Po podávaní dávky 0,8 mg/kg (až do maxima 40 mg) subkutánne každý druhý týždeň pediatrickým pacientom s chronickou ložiskovou psoriázou priemerná najnižšia (± SD) sérová koncentrácia adalimumabu v rovnovážnom stave približne 7,4 ± 5,8 µg/ml (79 % CV).
U dospelých pacientov s hidradenitis suppurativa sa pri dávke 160 mg adalimumabu v týždni 0 nasledovanej dávkou 80 mg v 2. týždni dosiahla počas indukčného obdobia najnižšia hodnota sérových koncentrácií adalimumabu približne od 7 do 8 μg/ml v 2. a 4. týždni. U pacientov, ktorí dostávali udržiavaciu dávku 40 mg adalimumabu každý týždeň, sa pozorovali od 12. do 36. týždňa priemerné minimálne rovnovážne hladiny približne od 8 do 10 μg/ml.
Expozícia adalimumabu u dospievajúcich pacientov s HS sa predpovedala s použitím populačného farmakokinetického modelovania a simulácie na základe farmakokinetických parametrov zistených naprieč indikáciami u iných pediatrických pacientov (s pediatrickou psoriázou, juvenilnou idiopatickou artritídou, pediatrickou Crohnovou chorobou a artritídou spojenou s entezitídou). Odporúčaná dávkovacia schéma u dospievajúcich s HS je 40 mg každý druhý týždeň. Pretože expozícia adalimumabu môže byť ovplyvnená telesnou hmotnosťou, u dospievajúcich s vyššou telesnou hmotnosťou a nedostatočnou odpoveďou môže byť prospešné dávkovanie 40 mg každý týždeň, ktoré je odporúčané predospelých.
U pacientov s Crohnovou chorobou úvodná dávka 80 mg adalimumabu v týždni 0 nasledovaná dávkou
40 mg adalimumabu v týždni 2 dosahuje počas indukčného obdobia najnižšiu hodnotu sérových koncentrácií adalimumabu približne 5,5 mg/ml. Úvodná dávka 160 mg adalimumabu v týždni 0
nasledovaná 80 mg adalimumabu v týždni 2 dosahuje počas indukčného obdobia najnižšiu hodnotu sérových koncentrácií adalimumabu približne 12 mg/ml. U tých pacientov s Crohnovou chorobou, ktorí dostávali udržiavaciu dávku 40 mg adalimumabu každý druhý týždeň, sa pozorovali priemerné rovnovážne najnižšie hladiny približne 7 mg/ml.
V otvorenej liečbe detských pacientov so stredne ťažkou až ťažkou CD bola úvodná dávka
adalimumabu 160/80 alebo 80/40 mg v týždni 0 a 2, a to v závislosti od hranice telesnej
hmotnosti40 kg. V týždni 4 boli pacienti randomizovaní 1:1 do skupín s udržiavacou liečbou buď so štandardnou dávkou (40/20 mg každý druhý týždeň (every other week - eow)) alebo nízkou dávkou
(20/10 mg každý druhý týždeň (every other week - eow)) v závislosti od telesnej hmotnosti. Priemerné
najnižšie (± SD) sérové koncentrácie adalimumabu dosiahnuté v týždni 4 boli 15,7 ± 6,6 mg/ml u pacientov ≥ 40 kg (160/80 mg) a 10,6 ± 6,1 mg/ml u pacientov < 40 kg (80/40 mg).
U pacientov, ktorí ostali na randomizovanej liečbe, boli v týždni 52 priemerné najnižšie (±SD) koncentrácie adalimumabu 9,5 ± 5,6 mg/ml pre skupinu so štandardnou dávkou a 3,5 ± 2,2 mg/ml pre skupinu s nízkou dávkou. Priemerné najnižšie koncentrácie sa udržali u pacientov, ktorí pokračovali v liečbe adalimumabom každý druhý týždeň počas 52 týždňov. U pacientov, u ktorých sa dávka zvýšila z režimu každý druhý týždeň na raz týždenne boli v týždni 52 priemerné (±SD) sérové koncentrácie adalimumabu 15,3 ± 11,4 μg/ml (40/20 mg, raz týždenne) a 6,7 ± 3,5 μg/ml (20/10 mg, raz týždenne).
U pacientov s ulceróznou kolitídou, ktorým sa podávala úvodná dávka 160 mg adalimumabu v týždni
0, po ktorej nasledovala dávka 80 mg adalimumabu v týždni 2, sa dosiahli najnižšie sérové koncentrácie adalimumabu 12 μg/ml počas obdobia indukcie. Priemerne najnižšie hladiny
v rovnovážnom stave s hodnotou približne 8 μg/ml sa pozorovali u pacientov s ulceróznou kolitídou, ktorým sa podávala udržovacia dávka 40 mg adalimumabu každý druhý týždeň.
U dospelých pacientov s uveitídou, ktorým sa podávala úvodná dávka 80 mg adalimumabu v týždni 0, po ktorej nasledovala dávka 40 mg adalimumabu každý druhý týždeň od 1. týždňa, sa zistili priemerné koncentrácie v rovnovážnom stave približne 8 až 10 mg/ml.
Expozícia adalimumabu u pediatrických pacientov s uveitídou sa predpovedala s použitím
populačného farmakokinetického modelovania a simulácie na základe farmakokinetických parametrov zistených naprieč indikáciami u iných pediatrických pacientov (s pediatrickou psoriázou, juvenilnou idiopatickou artritídou, pediatrickou Crohnovou chorobou a artritídou spojenou s entezitídou). Nie sú dostupné žiadne klinické údaje o expozícii týkajúce sa použitia úvodnej dávky u detí < 6 rokov. Predpokladané expozície naznačujú, že za neprítomnosti metotrexátu môže viesť úvodná dávka
k počiatočnému zvýšeniu systémovej expozície.
Populačné farmakokinetické a farmakokinetické/farmakodynamické modelovanie a simulácia predpovedali porovnateľnú expozíciu a účinnosť adalimumabu u pacientov liečených 80 mg každý druhý týždeň v porovnaní so 40 mg každý týždeň (vrátane dospelých pacientov s RA, HS, UC, CD alebo Ps, dospievajúcich pacientov s HS a pediatrických pacientov ≥ 40 kg s CD).
Vzťah expozícia–odpoveďupediatrickejpopulácie
Na základe údajov z klinických štúdií u pacientov s JIA (pJIA a ERA) sa stanovil vzťah expozícia –
odpoveď medzi plazmatickými koncentráciami a odpoveďou PedACR 50. Zrejmá plazmatická koncentrácia adalimumabu, ktorá produkuje polovicu maximálnej pravdepodobnosti odpovede
PedACR, 50 (EC50), bola 3 μg/ml (95 % IS: 1 - 6 μg/ml).
Vzťahy expozícia – odpoveď medzi koncentráciou adalimumabu a účinnosťou u pediatrických pacientov s ťažkou chronickou ložiskovou psoriázou boli stanovené pre PASI 75 resp. PGA čisté alebo minimálne. Hodnoty PASI 75 aj PGA čisté alebo minimálne rástli so zvyšujúcimi sa koncentráciami adalimumabu s podobnou zrejmou EC50 približne 4,5 μg/ml (95 % IS 0,4 - 47,6 resp.
1,9 - 10,5).
Eliminácia
Populačná farmakokinetická analýza údajov od viac ako 1300 pacientov s RA odhalila tendenciu
k vyššiemu zdanlivému klírensu adalimumabu so zvyšujúcou sa telesnou hmotnosťou. Po úprave vzhľadom na hmotnostné rozdiely, pohlavie a vek sa preukázal minimálny vplyv na klírens adalimumabu. Sérové hladiny voľného adalimumabu (neviazaného na protilátky proti adalimumabu, anti-adalimumab antibodies- AAA) boli nižšie u pacientov s merateľným AAA.
Porucha funkciepečenealeboobličiek
Adalimumab nebol študovaný u pacientov s poruchou funkcie pečene alebo obličiek.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje, na základe štúdií toxicity po jednorazovej dávke, toxicity po opakovanom podávaní a genotoxicity, neodhalili žiadne osobitné riziko pre ľudí.
V štúdii embryofetálnej toxicity/perinatálneho vývoja, uskutočnenej u opíc rodu Cynomolgus, ktorým sa podávali dávky 0, 30 a 100 mg/kg (9 - 17 opíc/skupina), sa nezistil žiadny dôkaz poškodenia plodov, spôsobený adalimumabom. Ani štúdie karcinogenity ani štandardné hodnotenie fertility
a postnatálnej toxicity adalimumabu sa neuskutočnili pre nedostatok vhodných modelov pre protilátku
s obmedzenou skríženou reaktivitou na TNF hlodavcov a na rozvoj neutralizačných protilátok
u hlodavcov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Manitol
Chlorid sodný
Monohydrát kyseliny citrónovej
Trinátriumcitrát
Polysorbát 80
Hydroxid sodný (na úpravu pH)
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, a preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C – 8°C).
Neuchovávajte v mrazničke.
Jednorazovú naplnenú injekčnú striekačku alebo naplnené pero uchovávajte vo vonkajšej škatuľke na
ochranu pred svetlom.
Naplnená injekčná striekačka alebo naplnené pero sa môže uchovávať pri teplote do maximálne 25 °C
po dobu až 14 dní. Naplnená injekčná striekačka alebo naplnené pero sa musí chrániť pred svetlom
a zlikvidovať, ak sa nepoužije v priebehu tohto 14-dňového obdobia.
6.5 Druh obalu a obsah balenia
I
dacio 40 mg
i
n
j
ekčný
r
oztok
v
naplnenej injekčnej
striekačke
0,8 ml roztoku v naplnenej injekčnej striekačke (sklo typu I) s tenkou 29G, 12 mm (1/2 inch) ihlou s bezlatexovým krytom, piestovou zátkou (syntetická guma), predĺženou prstencovou obrubou a
a pasívnym ochranným krytom ihly.
Balenie obsahuje:
- 2 naplnené injekčné striekačky s 2 alkoholom napustenými tampónmi
- 6 naplnených injekčných striekačiek so 6 alkoholom napustenými tampónmi
Idacio 40 mginjekčnýroztokvnaplnenom pere
0,8 ml roztoku v naplnenom PhysiojectTM pere pozostávajúcim z naplnenej injekčnej striekačky (sklo
typu I) s tenkou 29G, 12 mm (1/2 inch) ihlou s bezlatexovým krytom a piestovou zátkou (syntetická
guma). Pero je ručné, mechanické, injekčné zariadenie na jednorazové použitie.
Balenie obsahuje:
- 2 naplnené perá s 2 alkoholom napustenými tampónmi
- 6 naplnených pier so 6 alkoholom napustenými tampónmi
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia nalikvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Fresenius Kabi Deutschland GmbH Else-Kröner-Straße 1
61352 Bad Homburg v.d. Höhe
Nemecko
8. REGISTRAČNÉ ČÍSLA
Idacio 40 mginjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/19/1356/002
EU/1/19/1356/004
Idacio 40 mginjekčnýroztokvnaplnenom pere
EU/1/19/1356/003
EU/1/19/1356/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. apríl 2019
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUIdacio 40 mg/0,8 ml injekčný roztok na pediatrické použitie
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá 0,8 ml jednodávková injekčná liekovka obsahuje 40 mg adalimumabu.
Adalimumab je rekombinantná ľudská monoklonálna protilátka, produkovaná ovariálnymi bunkami čínskeho škrečka.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA Injekčný roztok (injekcia). Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieJuvenilná idiopatickáartritídaPolyartikulárna juvenilná idiopatická artritídaIdacio je v kombinácii s metotrexátom indikovaný na liečbu aktívnej polyartikulárnej juvenilnej idiopatickej artritídy u pacientov vo veku od 2 rokov, ktorí mali neadekvátnu odpoveď na jedno alebo viac ochorenie modifikujúcich antireumatík (Disease-Modifyig Antirheumatic Drugs- DMARDs). Idacio sa môže podávať ako monoterapia v prípade intolerancie metotrexátu alebo ak je pokračovanie v liečbe metotrexátom nevhodné (účinnosť v monoterapii, pozri časť 5.1). Adalimumab sa neskúmal
u pacientov mladších ako 2 roky.
Artritída spojená s entezitídouIdacio je indikovaný na liečbu aktívnej artritídy spojenej s entezitídou u pacientov vo veku 6 rokov
a starších, ktorí mali neadekvátnu odpoveď na konvenčnú liečbu alebo ju netolerujú (pozri časť 5.1).
Ložisková psoriázaupediatrickýchpacientovIdacio je indikovaný na liečbu ťažkej chronickej ložiskovej psoriázy u detí a dospievajúcich vo veku
od 4 rokov, ktorí mali nedostatočnú odpoveď na lokálnu liečbu a fototerapie alebo sú nevhodnými kandidátmi na tieto terapie.
Crohnova choroba u pediatrických pacientovIdacio je indikovaný na liečbu stredne ťažkej až ťažkej aktívnej Crohnovej choroby u pediatrických
pacientov (vo veku od 6 rokov), ktorí mali neadekvátnu odpoveď na konvenčnú liečbu vrátane
primárnej nutričnej liečby a kortikosteroidov a/alebo imunomodulátorov, alebo ktorí takúto liečbu netolerujú alebo je u nich kontraindikovaná.
Hidradenitis suppurativa (HS) u dospievajúcichIdacio je indikovaný na liečbu aktívnej stredne ťažkejaž ťažkej hidradenitis suppurativa (acne inversa)
u dospievajúcich vo veku od 12 rokov, ktorí mali nedostatočnú odpoveď na konvenčnú systémovú HS
terapiu (pozri časti 5.1 a 5.2).
Uveitída u pediatrických pacientovIdacio je indikovaný na liečbu chronickej neinfekčnej anteriórnej uveitídy u pediatrických pacientov
vo veku od 2 rokov, ktorí mali nedostatočnú odpoveď na konvenčnú liečbu alebo ju netolerujú, alebo
u ktorých je konvenčná liečba nevhodná.
4.2 Dávkovanie a spôsob podávaniaLiečbu Idaciom má začať a monitorovať odborný lekár so skúsenosťami v diagnostike a liečbe ochorení, na ktoré je Idacio indikovaný. Oftalmológom sa odporúča, aby sa pred začatím liečby Idaciom poradili s príslušným špecialistom (pozri časť 4.4).Pacientom, ktorí sú liečení Idaciom, sa má poskytnúť informačná kartička pre pacienta.
Po riadnom zaškolení v injekčnej technike si pacienti môžu sami podávať Idacio, ak ich lekár rozhodne, že je to vhodné a ak je v prípade potreby zaistená lekárska pomoc.
Počas liečby Idaciom sa má optimalizovať iná sprievodná liečba (napr. kortikosteroidy a/alebo imunomodulačné lieky).
DávkovaniePediatrickápopuláciaJuvenilná idiopatická artritída Poly arti kul árna j uvenil ná idi opat ick á art rit í da vo vek u od 2 rokovOdporúčaná dávka Idacia u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou vo veku od
2 rokov je založená na telesnej hmotnosti (tabuľka 1). Idacio sa podáva každý druhý týždeň vo forme subkutánnej injekcie.
 Tabuľka 1. Dávkovanie Idacia u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou
Tabuľka 1. Dávkovanie Idacia u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou Hmotnosť pacienta Dávkovací režim
Hmotnosť pacienta Dávkovací režim
10 kg až < 30 kg 20 mg každý druhý týždeň

≥ 30 kg 40 mg každý druhý týždeň
Dostupné údaje naznačujú, že klinická odpoveď sa zvyčajne dosiahne v priebehu 12 týždňov liečby.
Ak pacient v tomto období neodpovedá na liečbu, má sa pokračovanie v liečbe starostlivo zvážiť.
Neexistuje žiadne relevantné použitie adalimumabu u pacientov mladších ako 2 roky pre túto
indikáciu.
Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb.
Art ri tí da spojená s entezi tí dou
Odporúčaná dávka Idacia u pacientov s artritídou spojenou s entezitídou vo veku od 6 rokov je
založená na telesnej hmotnosti (tabuľka 2). Idacio sa podáva každý druhý týždeň vo forme subkutánnej injekcie.

 Tabuľka 2. Dávkovanie Idacia u pacientov s artritídou spojenou s entezitídouHmotnosť pacienta Dávkovací režim
Tabuľka 2. Dávkovanie Idacia u pacientov s artritídou spojenou s entezitídouHmotnosť pacienta Dávkovací režim
15 kg až < 30 kg 20 mg každý druhý týždeň

≥ 30 kg 40 mg každý druhý týždeň
Adalimumab sa neskúmal u pacientov s artritídou spojenou s entezitídou vo veku menej ako 6 rokov.
Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb.
Ložisková psoriáza u pediatrických pacientovOdporúčaná dávka Idacia u pacientov s ložiskovou psoriázou vo veku od 4 do 17 rokov je založená na
telesnej hmotnosti (tabuľka 3). Idacio sa podáva vo forme subkutánnej injekcie.

 Tabuľka 3. Dávkovanie Idacia u pediatrických pacientov s ložiskovou psoriázouHmotnosť pacienta Dávkovací režim
Tabuľka 3. Dávkovanie Idacia u pediatrických pacientov s ložiskovou psoriázouHmotnosť pacienta Dávkovací režim15 kg až < 30 kg Úvodná dávka 20 mg, potom nasleduje 20 mg každý druhý
týždeň po uplynutí jedného týždňa od úvodnej dávky

≥ 30 kg Úvodná dávka 40 mg, potom nasleduje 40 mg každý druhý
týždeň po uplynutí jedného týždňa
od úvodnej dávky Pokračovanie liečby po 16 týždňoch sa má starostlivo zvážiť u pacienta, ktorý v tomto časovom
intervale na liečbu neodpovedal.
Ak je indikovaná opätovná liečba Idaciom, je potrebné dodržiavať vyššie uvedené pokyny týkajúce sa dávkovania a dĺžky liečby.
Bezpečnosť adalimumabu u pediatrických pacientov s ložiskovou psoriázou bola hodnotená
v priemere počas 13 mesiacov.
Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 4 roky pre túto indikáciu. Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb.
Hidradenitis suppurativa u dospievajúcich (vo veku od 12 rokov, s hmotnosťou aspoň 30 kg)Neuskutočnili sa žiadne klinické skúšania s adalimumabom u dospievajúcich pacientov s HS. Dávkovanie adalimumbu u týchto pacientov sa stanovilo na základe farmakokinetického modelovania a simulácie (pozri časť 5.2).
Odporúčaná dávka Idacia je 80 mg v týždni 0 nasledovaná dávkou 40 mg každý druhý týždeň od
1. týždňa, podávaná subkutánnou injekciou.
U dospievajúcich pacientov s nedostatočnou odpoveďou na dávku Idacia 40 mg každý druhý týždeň možno zvážiť zvýšenie dávkovania na 40 mg jedenkrát za týždeňalebo 80 mg každý druhý týždeň.
V priebehu liečby Idaciom môžu byť v prípade potreby aj naďalej podávané antibiotiká. Odporúča sa, aby pacient počas liečby Idaciom používal lokálny antiseptický prípravok na každodenné umývanie lézií HS.
Pokračovanie liečby po 12. týždni sa má starostlivo zvážiť u pacienta, ktorého stav sa v tomto
časovom intervale nezlepšil.
Ak by bolo potrebné liečbu prerušiť, podávanie Idacia je možné podľa potreby znovu zaviesť. Prínos a riziko pokračujúcej dlhodobej liečby sa má pravidelne vyhodnocovať (pozri údaje
o dospelých pacientoch v časti 5.1).
Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 12 rokov pre túto indikáciu. Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb. Crohnova choroba u pediatrických pacientov
Odporúčaná dávka Idacia u pacientov s Crohnovou chorobou vo veku od 6 do 17 rokov je založená na
telesnej hmotnosti (tabuľka 4). Idacio sa podáva vo forme subkutánnej injekcie.
Tabuľka 4. Dávkovanie Idacia u pediatrických pacientov s Crohnovou chorobou
Hm
o
t
nosť
pacienta
Ú
vodná dávka Udržiavacia
dávka začínajúca
t
ýždňom 4
< 40 kg 40 mg v týždni 0 a 20 mg v týždni 2

V prípade, že je potrebná rýchlejšia odpoveď na liečbu s vedomím možnosti vyššieho rizika nežiaducich udalostí pri vyššej úvodnej dávke môžu byť použité nasledujúce dávky:
80 mg v týždni 0 a 40 mg v týždni 2
≥ 40 kg 80 mg v týždni 0 a 40 mg v týždni 2
V prípade, že je potrebná rýchlejšia odpoveď na liečbu s vedomím možnosti vyššieho rizika nežiaducich udalostí pri vyššej úvodnej dávke môžu byť použité nasledujúce dávky:
160 mg v týždni 0 a 80 mg v týždni 2
20 mg každý druhý týždeň
40 mg každý druhý týždeň
Pacienti s nedostatočnou odpoveďou môžu mať úžitok zo zvýšenia dávkovania:
< 40 kg: 20 mg každý týždeň
≥ 40 kg: 40 mg každý týždeň alebo 80 mg každý druhý týždeň
U pacientov, ktorí neodpovedali na liečbu do 12. týždňa, sa má starostlivo zvážiť pokračovanie
v liečbe.
Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 6 rokov pre túto indikáciu. Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb.
U
veitída upediatrických pacientov
Odporúčaná dávka Idacia u pediatrických pacientov s uveitídou vo veku od 2 rokov je založená na
telesnej hmotnosti (tabuľka 5). Idacio sa podáva vo forme subkutánnej injekcie.
V prípade uveitídy u pediatrických pacientov nie sú žiadne skúsenosti s liečbou adalimumabom
bez súbežnej liečby metotrexátom.

 Tabuľka 5. Dávkovanie Idacia u pediatrických pacientov s uveitídouHmotnosť pacienta Dávkovací režim
Tabuľka 5. Dávkovanie Idacia u pediatrických pacientov s uveitídouHmotnosť pacienta Dávkovací režim
< 30 kg 20 mg každý druhý týždeň v kombinácii s metotrexátom

≥ 30 kg 40 mg každý druhý týždeň v kombinácii s metotrexátom
Keď sa liečba Idaciom začína, je možné podať úvodnú dávku 40 mg u pacientov < 30 kg alebo 80 mg
u pacientov ≥ 30 kg jeden týždeň pred začiatkom udržiavacej liečby. Nie sú dostupné žiadne klinické údaje o použití úvodnej dávky adalimumabu u detí < 6rokov (pozri časť 5.2).
V tejto indikácii nie je relevantné použitie Idacia u detí mladších ako 2 roky.
Odporúča sa každý rok vyhodnocovať prínos a riziko pokračujúcej dlhodobej liečby (pozri časť 5.1). Idacio môže byť k dispozícii aj v iných formách v závislosti od individuálnych liečebných potrieb.
Porucha funkcie obl i či ek a/al ebo pečeneÚčinky Idacia sa neskúmali u týchto skupín pacientov. Nie je preto možné uviesť žiadne odporúčania
pre dávkovanie.
Spôsob podávani aIdacio sa podáva subkutánnou injekciou. Úplný návod na použitie je uvedený v písomnej informácii
pre používateľa.
Idacio je k dispozícii aj v iných formách.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Aktívna tuberkulóza alebo iné závažné infekcie, ako je sepsa a oportúnne infekcie (pozri časť 4.4). Stredne ťažké až ťažké srdcové zlyhanie (trieda III/IV podľa NYHA) (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaníSledovateľnosťZa účelom zlepšenia sledovateľnosti biologických liekov je potrebné presne zaznamenať názov a číslo
šarže podávaného lieku.
I
nfekcie
Pacienti používajúci antagonisty TNF sú náchylnejší na vznik závažných infekcií. Porucha funkcie
pľúc môže zvýšiť riziko vzniku infekcií. Pacienti musia byť preto dôkladne sledovaní z hľadiska výskytu infekcií vrátane tuberkulózy, a to pred, počas a po ukončení liečby Idaciom. Vzhľadom na to, že vylučovanie adalimumabu môže trvať až štyri mesiace, sledovanie má pokračovať počas celého tohto obdobia.
Liečba Idaciom sa nemá začať u pacientov s aktívnymi infekciami, vrátane chronických alebo lokalizovaných infekcií, až kým nie sú tieto infekcie zvládnuté. U pacientov, ktorí boli exponovaní tuberkulóze a u pacientov, ktorí cestovali do oblastí s vysokým rizikom tuberkulózy alebo endemických mykóz, ako sú histoplazmóza, kokcidioidomykóza alebo blastomykóza je potrebné pred začiatkom liečby zvážiť riziko a benefit liečby Idaciom (pozri Inéoportúnne infekcie).
Pacienti, u ktorých sa počas liečby Idaciom objaví nová infekcia, majú byť dôkladne sledovaní
a podstúpiť kompletné diagnostické vyšetrenie. Ak sa u pacienta rozvinie nová závažná infekcia alebo sepsa, má sa začať vhodná antimikrobiálna alebo antimykotická liečba a podávanie Idacia sa má prerušiť dovtedy, kým sa infekcia nezvládne. Lekári majú byť opatrní pri zvažovaní použitia Idacia
u pacientov s anamnézou rekurentnej infekcie alebo za podmienok, ktoré pacientov predisponujú
k vzniku infekcie, vrátane použitia súčasnej imunosupresívnej liečby.
Ťažké infekcie
Ťažké infekcie, vrátane sepsy, spôsobené bakteriálnymi, mykobakteriálnymi, invazívnymi mykotickými, parazitárnymi, vírusovými alebo ďalšími oportúnnymi infekciami ako sú listerióza, legionelóza a pneumocystóza boli hlásené u pacientov liečených adalimumabom.
Ďalšie ťažké infekcie zaznamenané v klinických skúšaniach zahŕňajú zápal pľúc, pyelonefritídu, septickú artritídu a septikémiu. V súvislosti s infekciami boli hlásené prípady hospitalizácie alebo úmrtia.
Tuberkulóza
Tuberkulóza, vrátane reaktivácie a nového nástupu tuberkulózy, bola hlásená u pacientov liečených
adalimumabom. Hlásenia zahŕňali prípady pľúcnej a mimopľúcnej (t.j. diseminovanej) tuberkulózy.
Pred začatím liečby Idaciom musia byť všetci pacienti vyšetrení na aktívnu aj neaktívnu („latentnú“) tuberkulóznu infekciu. Toto vyšetrenie má obsahovať podrobné lekárske posúdenie anamnézy pacienta, zamerané na výskyt tuberkulózy alebo na možný predchádzajúci kontakt s osobami
s aktívnou tuberkulózou a na predchádzajúcu a/alebo súčasnú imunosupresívnu liečbu. U všetkých pacientov sa majú urobiť príslušné skríningové vyšetrenia (t. j. kožný tuberkulínový test a röntgen
hrudníka) (môžu sa použiť lokálne odporúčania). Odporúča sa, aby sa do informačnej kartičky pre
pacienta zaznamenalo vykonanie týchto testov a ich výsledky. Predpisujúcim lekárom je potrebné pripomenúť riziko falošne negatívnych výsledkov kožného tuberkulínového testu, zvlášť u ťažko chorých alebo imunokompromitovaných pacientov.
Liečba Idaciom sa nesmie začať u pacientov s diagnostikovanou aktívnou tuberkulózou (pozri časť
4.3).
Vo všetkých nižšie opísaných situáciách sa má veľmi starostlivo zvážiť pomer prínosu a rizika liečby. Ak je podozrenie na latentnú tuberkulózu, má sa konzultovať s lekárom so skúsenosťami v liečbe
tuberkulózy.
V prípade diagnózy latentnej tuberkulózy sa musí ešte pred začatím liečby Idaciom začať vhodná antituberkulózna preventívna liečba v súlade s lokálnymi odporúčaniami.
Použite antituberkulóznej liečby pre začatím podávania Idacia sa má zvážiť aj u pacientov, ktorí majú viaceré alebo významné rizikové faktory pre tuberkulózu aj napriek tomu, že majú negatívny test na tuberkulózu, a u pacientov s latentnou alebo aktívnou tuberkulózou v anamnéze, u ktorých nie je možné overiť adekvátny priebeh liečby.
Napriek preventívnej antituberkulóznej liečbe sa u pacientov liečených adalimumabom vyskytli prípady reaktivácie tuberkulózy. U niektorých pacientov, ktorí boli úspešne liečení na aktívnu tuberkulózu, sa počas liečby adalimumabom znova rozvinula tuberkulóza.
Pacientov je potrebné poučiť o tom, aby vyhľadali lekára, ak sa počas liečby Idaciom alebo po jej ukončení objavia prejavy/príznaky, ktoré poukazujú na tuberkulóznu infekciu (napr. pretrvávajúci kašeľ, chradnutie/úbytok telesnej hmotnosti, mierna horúčka, ochabnutosť).
Iné oportúnne infekcie
U pacientov dostávajúcich adalimumab sa pozoroval výskyt oportúnnych infekcií, vrátane invazívnych mykotických infekcií. Tieto infekcie neboli presne identifkované u pacientov používajúcich antagonisty TNF, čo malo za následok oneskorenie vhodnej liečby, niekedy až s fatálnym dôsledkom.
U pacientov, u ktorých sa rozvinú prejavy a príznaky ako horúčka, nevoľnosť, chudnutie, potenie, kašeľ, dýchavičnosť a/alebo pľúcne infiltráty alebo iné závažné systémové ochorenia so súčasným šokom alebo bez neho, sa má myslieť na invazívnu mykotickú infekciu a podávanie Idacia sa má okamžite prerušiť. Diagnostika a podávanie empirickej antimykotickej liečby týmto pacientom sa má konzultovať s lekárom, špecializujúcim sa nastarostlivosť o pacientov s invazívnymi mykotickými infekciami.
Reaktivácia hepatitídy B
U pacientov dostávajúcich antagonisty TNF, vrátane adalimumabu, ktorí sú chronickí nosiči vírusu
hepatitídy B (HBV; t.j. majú pozitívny povrchový antigén), sa vyskytla reaktivácia hepatitídy B. Niektoré prípady sa skončili smrteľne. Pred začiatkom liečby Idaciom by pacienti mali byť vyšetrení na prítomnosť infekcie HBV. U pacientov s pozitívnym testom na hepatitídu B sa odporúča konzultácia s odborníkom na liečbu hepatitídy B.
U nosičov HBV, u ktorých je potrebná liečba Idaciom, sa majú podrobne sledovať prejavy a príznaky aktívnej infekcie HBV počas liečby a počas niekoľkých mesiacov po ukončení liečby. K dispozícii nie sú dostatočné údaje od pacientov, ktorí sú nosičmi HBV, liečených antivirotikami spolu
s antagonistami TNF na zabránenie reaktivácie HBV. U pacientov s reaktiváciou HBV sa má ukončiť podávanie Idacia a má sa začať účinná antivírusová liečba s primeranou podpornou liečbou.
Neurologické príhody
Podávanie antagonistov TNF, vrátane adalimumabu, bolo v zriedkavých prípadoch spojené s novým
objavením sa alebo exacerbáciou klinických príznakov a/alebo rádiografickým nálezom demyelinizačného ochorenia centrálneho nervového systému, vrátane sklerózy multiplex a optickej
neuritídy a periférneho demyelinizačného ochorenia, vrátane Guillain-Barrého syndrómu. Predpisujúci
lekári majú opatrne postupovať pri zvažovaní použitia Idacia u pacientov s už existujúcimi alebo novovzniknutými demyelinizačnými poruchami centrálneho alebo periférneho nervového systému. Ak sa vyskytne niektorá z uvedených porúch, má sa uvažovať o ukončení liečby Idaciom. Existuje známe spojenie medzi intermediárnou uveitídou a centrálnymi demyelinizačnými poruchami. U pacientov
s neinfekčnou intermediárnou uveitídou sa má pred začatím liečby Idaciom a pravidelne počas nej vykonávať neurologické vyšetrenie na posúdenie existujúcich alebo rozvíjajúcich sa centrálnych
demyelinizačných porúch.
A
l
ergické reakcie
Závažné alergické reakcie v súvislosti s adalimumabom boli počas klinických štúdií zriedkavé.
V klinických štúdiách s adalimumabom sa menej často vyskytli nezávažné alergické reakcie. Boli prijaté hlásenia o závažných alergických reakciách vrátane anafylaxie po podaní adalimumabu. Ak sa vyskytne anafylaktická reakcia alebo iná závažná alergická reakcia, treba okamžite prerušiť podávanie Idacia a začať príslušnú liečbu.
Imunosupresia
V štúdii u 64 pacientov s reumatoidnou artritídou, ktorí boli liečení adalimumabom, nebolo dokázané
potlačenie oneskoreného typu precitlivenosti, zníženie hladín imunoglobulínov alebo zmena v počte efektorových T-, B, -NK buniek, monocytov/makrofágov a neutrofilov.
Malignity a lymfoproliferatívne poruchy
V kontrolovaných častiach klinických skúšaní s antagonistami TNF bolo medzi pacientmi
používajúcimi antagonisty TNF pozorovaných viac prípadov malignít, vrátane lymfómov v porovnaní
s kontrolnou skupinou. Napriek tomu bol tento výskyt zriedkavý. V postmarketingových skúšaniach boli hlásené prípady leukémie u pacientov liečených antagonistami TNF. Existuje zvýšené riziko vzniku lymfómu a leukémie u pacientov s reumatoidnou artritídou s dlhodobým, vysoko aktívnym zápalovým ochorením, ktoré komplikuje odhad rizika. Podľa súčasných poznatkov nemôže byť eventuálne riziko vzniku lymfómov, leukémií a iných malignít u pacientov liečených antagonistami TNF vylúčené.
Malignity, vrátane fatálnych, boli hlásené v skupine detí, dospievajúcicha mladých dospelých (do
22 rokov) liečených v rámci postmarketingového skúšania antagonistami TNF (začiatok liečby vo veku ≤ 18 rokov), vrátane adalimumabu. Približne v polovici prípadov sa jednalo o lymfómy. Ďalšie
prípady zahŕňali rôzne iné malignity, vrátane zriedkavých malignít, zvyčajne spojených
s imunosupresiou. Nie je možné vylúčiť riziko vzniku malignít u detí a dospievajúcichliečených
antagonistami TNF.
U pacientov liečených adalimumabom boli v postmarketingovej praxi zaznamenané zriedkavé prípady hepatosplenického T-lymfómu. Tento zriedkavý typ T-lymfómu má veľmi agresívny priebeh a je zvyčajne smrteľný. Niektoré z týchto hepatosplenických T-lymfómov sa pri liečbe adalimumabom vyskytli u mladých dospelých pacientov liečených pri zápalovom ochorení čreva súčasne
azatioprínom alebo 6-merkaptopurínom. Je potrebné starostlivo zvážiť možné riziko kombinovanej liečby azatioprínom alebo 6-merkaptopurínom a adalimumabom.Riziko vzniku hepatosplenického T-
lymfómu u pacientov liečených Idaciom nie je možné vylúčiť (pozri časť 4.8).
Neboli vykonané žiadne štúdie, zahrnujúce pacientov s malignitou v anamnéze alebo pacientov,
u ktorých sa pokračovalo v liečbe s adalimumabom po rozvinutí malignity. Preto sa má pri zvažovaní liečby Idaciom u týchto pacientov postupovať s mimoriadnou opatrnosťou (pozri časť 4.8).
Všetci pacienti, a najmä pacienti s anamnézou extenzívnej imunosupresívnej liečby alebo pacienti so psoriázou s liečbou PUVA v anamnéze, sa majú vyšetriť na prítomnosť nemelanómovej kožnej rakoviny pred a počas liečby Idaciom. U pacientov liečených antagonistami TNF vrátane adalimumabu bol hlásený aj melanóm a karcinóm z Merkelových buniek (pozri časť 4.8).
Vo výskumnom klinickom skúšaní hodnotiacom používanie iného antagonistu TNF, infliximabu, sa hlásilo u pacientov so stredne ťažkou až ťažkou chronickou obštrukčnou chorobou pľúc (CHOCHP) viac malignít, predovšetkým v pľúcach alebo hlave a hrdle, u pacientov liečených infliximabom
v porovnaní s pacientmi v kontrolnej skupine. U všetkých pacientov sa v anamnéze uvádzalo silné fajčenie. Preto je potrebná obozretnosť pri používaní akéhokoľvek antagonistu TNF u pacientov
s CHOCHP, ako aj u pacientov so zvýšeným rizikom malignity kvôli silnému fajčeniu.
Podľa súčasných údajov nie je známe, či liečba adalimumabom ovplyvňuje riziko vzniku dysplázie alebo kolorektálneho karcinómu. Všetci pacienti s ulceróznou kolitídou, u ktorých existuje riziko vzniku dysplázie alebo kolorektálneho karcinómu (napr. pacienti s dlhotrvajúcou ulceróznou kolitídou alebo primárnou sklerotizujúcou cholangitídou), u ktorých sa v minulosti vyskytla dysplázia alebo kolorektálny karcinóm, by mali byť vyšetrení na možný rozvoj dysplázie alebo kolorektálneho karcinómu ešte pred začatím liečby a ďalej v pravidelných intervaloch v jej priebehu. Toto vyšetrenie má, v súlade s miestnymi požiadavkami, zahŕňať kolonoskopiu a biopsiu.
Hematologické reakcie
S antagonistami TNF sa zriedkavo hlásila pancytopénia vrátane aplastickej anémie. Pri podávaní
adalimumabu boli hlásené nežiaduce účinky hematologického systému vrátane liečebne signifikantnej cytopénie (napr. trombocytopénia, leukopénia). Všetci pacienti používajúci Idacio musia byť
upozornení na nutnosť ihneď vyhľadať lekársku pomoc, ak spozorujú prejavy a príznaky naznačujúce krvnú dyskráziu (napr. pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť). U pacientov
s potvrdenými signifikantnými hematologickými abnormalitami sa má zvážiť ukončenie liečby
Idaciom.
Očkovanie
Podobné protilátkové odpovede po očkovaní štandardnou 23-zložkovou pneumokokovou vakcínou
a trojzložkovou chrípkovou vakcínou sa pozorovali v štúdii u 226 dospelých jedincov s reumatoidnou
artritídou, ktorí boli liečení adalimumabom alebo placebom. Nie sú dostupné žiadne údaje
o sekundárnom prenose infekcie živými vakcínami u pacientov liečených adalimumabom.
Odporúča sa, aby sa, pokiaľ sa dá, aktualizovali všetky imunizácie pediatrických pacientov v súlade
so súčasnými smernicami pre imunizáciu ešte pred začatím liečby adalimumabom.
Pacientov, dostávajúcich adalimumab, je možné súčasne očkovať, s výnimkou živých vakcín. Podávanieživýchvakcín(napr. BCG vakcína) dojčatám, ktoré boliin uterovystavené adalimumabu sa neodporúčapočas 5 mesiacov po poslednejinjekcie adalimumabu, podanej matke počas gravidity.
Kongestívne srdcovézlyhanie
V klinickej štúdii s ďalším antagonistom TNF sa pozorovalo zhoršenie kongestívneho srdcového
zlyhania a zvýšenie úmrtnosti na srdcové zlyhanie. U pacientov dostávajúcich adalimumab boli hlásené tiež prípady zhoršenia kongestívneho srdcového zlyhania. U pacientov s miernym srdcovým zlyhaním (trieda I/II podľa NYHA) sa má Idacio použiť s opatrnosťou. Idacio je kontraindikovaný pri stredne ťažkom alebo ťažkom srdcovom zlyhaní (pozri časť 4.3). U pacientov, u ktorých sa rozvinuli nové alebo sa zhoršili príznaky kongestívneho srdcového zlyhania, sa musí liečba Idaciom prerušiť.
Autoimunitné procesy
Liečba Idaciom môže viesť k tvorbe autoimunitných protilátok. Účinok dlhodobej liečby s
adalimumabom na rozvoj autoimunitných ochorení nie je známy. Ak sa u pacienta po liečbe Idaciom rozvinú príznaky naznačujúce syndróm podobný lupusu a má pozitívne protilátky proti dvojreťazcovej DNA, nemá sa Idacio ďalej podávať (pozri časť 4.8).
Súbežné podávaniebiologickýchDMARDsaleboantagonistovTNF
V klinických štúdiách sa pri súčasnom použití anakinry a etanerceptu, antagonistu TNF, vyskytli
závažné infekcie bez dosiahnutia ďalšieho klinického prínosu v porovnaní so samotným etanerceptom. Vzhľadom na povahu nežiaducich účinkov pozorovaných pri kombinovanej terapii etanerceptom
a anakinrou sa podobné toxicity môžu vyskytnúť aj pri kombinácii anakinry a iného antagonistu TNF.
Preto sa neodporúča kombinácia adalimumabu a anakinry. (Pozri časť 4.5).
Súbežné podávanie adalimumabu a iných biologických DMARDs (napr. anakinra a abatacept) alebo iných antagonistov TNF sa neodporúča na základe možného zvýšeného rizika infekcií, vrátane vážnych infekcií a iných potenciálnych farmakologických interakcií. (Pozri časť 4.5).
Chirurgické zákroky
Je k dispozícii len limitované množstvo údajov o bezpečnosti pri chirurgických zákrokoch u pacientov
liečených adalimumabom. Ak je naplánovaný chirurgický zákrok, treba vziať do úvahy dlhý biologický polčas adalimumabu. Pacient, ktorý dostáva Idacio a vyžaduje chirurgický zákrok, sa musí
kvôli infekciám dôkladne monitorovať a prípadne sa majú vykonať vhodné opatrenia. U pacientov
dostávajúcich adalimumab a podstupujúcich artroplastiku je k dispozícii minimálne množstvo údajov
o bezpečnosti.
Obštrukcia tenkéhočreva
Zlyhanie odpovede pri liečbe Crohnovej choroby môže naznačovať výskyt fixovanej fibrotickej
striktúry, ktorá môže vyžadovať chirurgickú liečbu. Údaje, ktoré sú k dispozícii, naznačujú, že
adalimumab nezhoršuje alebo nespôsobuje striktúry.
Starší ľudia
Frekvencia výskytu závažných infekcií v skupine pacientov starších ako 65 rokov (3,7 %), liečených
adalimumabom, bola vyššia ako u pacientov mladších ako 65 rokov (1,5 %). Niektoré z nich sa
skončili fatálne. Pri liečbe starších pacientov je treba venovať osobitnú pozornosť riziku vzniku infekcií.
Pediatrická populácia
Pozri vyššie časť „Očkovanie“.
Pomocné látky so známymiúčinkami
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej 0,8 ml dávke, t. j. prakticky
neobsahuje sodík.
4.5 Liekové a iné interakcie
Adalimumab sa skúmal u pacientov s reumatoidnou artritídou, polyartikulárnou juvenilnou idiopatickou artritídou a psoriatickou artritídou, liečených adalimumabom v monoterapii
a v kombinácii s metotrexátom. Pri podávaní adalimumabu spolu s metotrexátom bola tvorba
protilátok nižšia v porovnaní s monoterapiou. Podávanie adalimumabu bez metotrexátu viedlo
k zvýšenej tvorbe protilátok, zvýšenému klírensu a zníženej účinnosti adalimumabu (pozri časť 5.1).
Kombinácia Idacia a anakinry sa neodporúča (pozri časť 4.4 „Súbežné podávanie biologických
DMARDs alebo antagonistov TNF“).
Kombinácia Idacia a abataceptu sa neodporúča (pozri časť 4.4 „Súbežné podávanie biologických
DMARDs alebo antagonistov TNF“).
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku
Ženy vo fertilnom veku majú zvážiť používanie primeranej antikoncepcie, aby sa predišlo gravidite,
a pokračovať v jej používaní aspoň päť mesiacov po poslednom podaní Idacia.
G
r
avidita
Veľké množstvo (približne 2100) prospektívne zozbieraných údajov z gravidít vystavených
adalimumabu, ktoré viedli k živému pôrodu so známymi výsledkami, vrátane viac ako 1500 pacientok vystavených počas prvého trimestra, nepoukazuje na zvýšenie miery malformácie u novorodencov.
Do prospektívneho kohortového registra bolo zaradených 257 žien s reumatoidnou artritídou (RA) alebo Crohnovou chorobou (CD) liečených adalimumabom aspoň počas prvého trimestra a 120 žien s RA alebo CD neliečených adalimumabom. Primárnym koncovým ukazovateľom bola prevalencia závažných vrodených chýb. Miera gravidít, ktoré sa skončili najmenej jedným živonarodeným dieťaťom so závažnou vrodenou chybou, bola 6/69 (8,7 %) u žien liečených adalimumabom s RA
a 5/74 (6,8 %) u neliečených žien s RA (neupravený OR 1,31, 95 % CI 0,38 – 4,52) 16/152 (10,5 %)
u žien liečených adalimumabom s CD a 3/32 (9,4 %) u neliečených žien s CD (neupravený OR 1,14,
95 % CI 0,31 – 4,16). Upravený OR (vzhľadom na východiskové rozdiely) bol 1,10 (95 % CI 0,45 –
2,73) u pacientov s RA a CD spolu. Medzi ženami liečenými a neliečenými adalimumabom neboli žiadne výrazné rozdiely v sekundárnych koncových ukazovateľoch zahŕňajúcich spontánne potraty,
menšie vrodené chyby, predčasné pôrody, veľkosť dieťaťa pri pôrode a vážne alebo oportúnne
infekcie a neboli hlásené žiadne mŕtvonarodené deti alebo malignity. Interpretácia údajov môže byť ovplyvnená metodologickými obmedzeniami štúdie vrátane malej veľkosti vzorky
a nerandomizovaného charakteru štúdie.
V štúdiách vývojovej toxicity, uskutočnených na opiciach, neboli zistené náznaky toxicity u matky, embryotoxicity alebo teratogenity. Predklinické údaje o účinku adalimumabu na postnatálnu toxicitu nie sú dostupné (pozri časť 5.3).
Adalimumab, podávaný v gravidite, môže vzhľadom na inhibíciu TNFa ovplyvniť normálne imunitné odpovede novorodenca. Adalimumab sa má používať počas tehotenstva, iba ak je to jednoznačne potrebné.
Adalimumab môže prechádzať placentou do séra detí, narodených ženám, ktoré boli počas gravidity liečené adalimumabom. Následkom toho môžu mať tieto deti zvýšené riziko vzniku infekcie. Podávanie živých vakcín (napr. BCG vakcína) dojčatám, ktoré boli in utero vystavené adalimumabu sa neodporúča počas 5 mesiacov po poslednej injekcii adalimumabu, podanej matke počas gravidity.
Dojčenie
Obmedzené informácie z publikovanej literatúry naznačujú, že adalimumab sa vylučuje do materského
mlieka vo veľmi nízkych koncentráciách, adalimumab prítomný v materskom mlieku je
v koncentráciách 0,1 % až 1 % zo sérovej hladiny matky.Perorálne podávané proteíny imunoglobulínu G prechádzajú proteolýzou v čreve a majú zlú biologickú dostupnosť. Nepredpokladajú sa žiadne účinky na dojčených novorodencov/dojčatá. Z toho vyplýva, že Idacio sa môže používať počas dojčenia.
Fertilita
Nie sú dostupné údaje o vplyve adalimumabu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Idacio môže mať mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní Idacia sa
môže vyskytnúť závrat a porucha zraku (pozri časť 4.8).
 4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profilu
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluAdalimumab sa skúmal u 9506 pacientov v kľúčových kontrolovaných a otvorených štúdiách počas
60 mesiacov alebo dlhšie. Tieto štúdie zahŕňali pacientov s krátkodobou a dlhodobou reumatoidnou
artritídou, juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou
a artritídou spojenou s entezitídou), ako aj s axiálnou spondylartritídou (ankylozujúcou spondylitídou
a axiálnou spondylartritídou bez rádiografického dôkazu AS), psoriatickou artritídou, Crohnovou chorobou, ulceróznou kolitídou, pacientov so psoriázou, s hidradenitissuppurativa a uveitídou. Kľúčové kontrolované štúdie zahŕňali 6089 pacientov dostávajúcich adalimumab a 3801 pacientov dostávajúcich placebo alebo účinný komparátor počas kontrolovanej fázy.
Podiel pacientov, ktorí prerušili liečbu v dôsledku vedľajších účinkov počas dvojito zaslepených, kontrolovaných častí kľúčových štúdií bol 5,9 % pacientov liečených adalimumabom a 5,4 % pacientov, ktorým sa podávala kontrola.
Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (napr. zápal nosohltana, infekcia horných dýchacích ciest a zápal prinosových dutín), reakcie v mieste vpichu injekcie (erytém, svrbenie, krvácanie, bolesť alebo opuch), bolesť hlavy a muskuloskeletálna bolesť.
U adalimumabu boli hlásené závažné nežiaduce reakcie. Antagonisty TNF, ako je adalimumab, pôsobia na imunitný systém a ich používanie môže ovplyvniť obranyschopnosť organizmu voči infekciám a nádorovým ochoreniam.
Pri použití adalimumabu boli tiež hlásené fatálne a život ohrozujúce infekcie (vrátane sepsy, oportúnnych infekcií a TBC), reaktivácia HBV a rôzne malignity (vrátane leukémie, lymfómu
a HSTCL).
Boli hlásené aj závažné hematologické, neurologické a autoimunitné reakcie. Patria k nim zriedkavé hlásenia pancytopénie, aplastickej anémie, centrálne a periférne prípady demyelinizácie a hlásenia lupusu, lupusu podobných stavov a Stevensovho-Johnsonovho syndrómu.
Pediatrická populáciaVo všeobecnosti boli nežiaduce účinky u pediatrických pacientov podobné vo frekvencii a type tým,
ktoré boli pozorované u dospelých pacientov.
Tabuľkový zoznamnežiaducichreakciíNasledujúci zoznam nežiaducich účinkov je založený na výsledkoch z klinických skúšaní
a postmarketingových skúsenostiach a je zoradený podľa triedy orgánových systémov a frekvencie
v tabuľke 6:veľmi časté(³ 1/10); časté(³ 1/100 až < 1/10); menej časté(³ 1/1000 až < 1/100); zriedkavé (³ 1/10 000 až< 1/1000) a neznáme (nedjú sa odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Uvedená je najvyššia frekvencia pozorovaná pri rôznych indikáciách. V stĺpci „trieda orgánových systémov“ je vyznačená hviezdička (*), ak sa ďalšie informácie vyskytujú aj na inom mieste
v častiach 4.3, 4.4 a 4.8.
Tabuľka 6Nežiaduce účinkyTrieda orgánových systémov Frekvencia Nežiaduci účinokInfekcie a nákazy* Veľmi časté Infekcie dýchacej sústavy (vrátane infekcií dolných a horných dýchacích ciest, pneumónie, sinusitídy, faryngitídy, nazofaryngitídy
a pneumónie spôsobenej vírusom herpesu)
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Časté
Menej časté
Systémové infekcie (vrátane sepsy, kandidózy
a chrípky),
črevné infekcie (vrátane vírusovej gastroenteritídy),
infekcie kože a mäkkých tkanív (vrátane paronychie, celulitídy, impetiga, nekrotizujúcej
fasciitídy a herpes zoster), infekcie ucha,
infekcie ústnej dutiny (vrátane herpes simplex, orálneho herpesu a infekcií zubov),
infekcie reprodukčného systému (vrátane
vulvovaginálnej mykotickej infekcie), infekcie močovej sústavy (vrátane pyelonefritídy),
hubové infekcie, infekcie kĺbov
Neurologické infekcie (vrátane vírusovej meningitídy),
oportúnne infekcie a tuberkulóza (vrátane kokcidioidomykózy, histoplazmózy
a systémovej infekcie Mycobacterium avium),
bakteriálne infekcie, infekcie oka, divertikulitída1
Benígne a malígne nádory,
vrátane nešpecifikovaných
novotvarov (cysty a polypy)*
Časté
Menej časté
Zriedkavé
Neznáme
Karcinóm kože okrem melanómu (vrátane
bazocelulárneho karcinómu
a skvamocelulárneho karcinómu), benígne novotvary
Lymfóm**,
solídne orgánové tumory (vrátane karcinómu prsníka, pľúc a štítnej žľazy),
melanóm**
Leukémia1
Hepatosplenický T-bunkový lymfóm1, karcinóm z Merkelových buniek (neuroendokrinný karcinóm kože)1
Poruchy krvi a lymfatického
systému*
Veľmi časté
Časté
Menej časté
Zriedkavé
Leukopénia (vrátane neutropénie
a agranulocytózy), anémia
Leukocytóza, trombocytopénia
Idiopatická trombocytopenická purpura
Pancytopénia

Poruchy imunitného systému* Časté Hypersenzitivita,
alergie (vrátane sezónnej alergie)
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Menej časté
Zriedkavé
Sarkoidóza1,
vaskulitída
Anafylaxia1
Poruchy metabolizmu a výživy Veľmi časté
Časté
Zvýšenie hladiny lipidov
Hypokaliémia, hyperurikémia,
abnormálne hladiny nátria v krvi,
hypokalciémia hyperglykémia, hypofosfatémia, dehydratácia
Psychické poruchy Časté Poruchy nálady (vrátane depresie),
úzkosť, nespavosť
Poruchy nervového systému* Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť hlavy
Parestézie (vrátane hypestézie), migréna,
kompresia nervového koreňa
Cerebrovaskulárna príhoda1, tremor,
neuropatia
Sclerosis multiplex,
demyelinizačné ochorenia (napr. optická neuritída, Guillain-Barrého syndróm)1
Poruchy oka Časté
Menej časté
Poruchy videnia,
zápal spojiviek, blefaritída,
opuch oka
Dvojité videnie
Poruchy ucha a labyrintu Časté
Menej časté
Závraty
Strata sluchu, Tinnitus
Poruchy srdca a srdcovej
činnosti*
Časté
Menej časté
Zriedkavé
Tachykardia
Infarkt myokardu1, arytmia,
kongestívne srdcové zlyhanie
Zastavenie srdca

Poruchy ciev Časté Hypertenzia,
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
návaly horúčavy, hematóm
Menej časté
Aneuryzma aorty,
vaskulárna arteriálna oklúzia, tromboflebitída
Poruchy dýchacej sústavy,
hrudníka a mediastína*
Časté
Menej časté
Zriedkavé
Astma,
dyspnoe,
kašeľ
Pľúcna embólia1,
intersticiálna pľúcna choroba, chronická obštrukčná choroba pľúc,
pneumonitída,
pleurálny výpotok1
Pľúcna fibróza1
Poruchy gastrointestinálneho
traktu
Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť brucha,
nauzea a vracanie
Gastrointestinálna hemorágia,
dyspepsia,
gastroezofageálna refluxná choroba, Sjögrenov syndróm
Pankreatitída, dysfágia, opuch tváre
Intestinálna perforácia1
Poruchy pečene a žlčových
ciest*
Veľmi časté
Menej časté
Zriedkavé
Neznáme
Zvýšenie hladín pečeňových enzýmov
Zápal žlčníka a žlčové kamene, steatóza pečene,
zvýšenie hladiny bilirubínu v krvi
Hepatitída
Reaktivácia hepatitídy B1
autoimunitná hepatitída1
Zlyhanie pečene1

Poruchy kože a podkožného
tkaniva
Veľmi časté
Časté
Exantém (vrátane exfoliatívneho exantému)
Zhoršenie alebo novovzplanutie psoriázy (vrátane palmoplantárnej pustulárnej psoriázy)1, žihľavka,
tvorba modrín (vrátane purpury), dermatitída (vrátane ekzému),
onychoklázia,
hyperhidróza, alopécia1,
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
svrbenie
Menej časté
Zriedkavé
Neznáme
Nočné potenie,
jazvy
Multiformný erytém1,
Stevensov-Johnsonov syndróm1,
angioedém1,
kutánna vaskulitída1
lichenoidná kožná reakcia1
Zhoršenie príznakov dermatomyozitídy1
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
Veľmi časté
Časté
Menej časté
Zriedkavé
Bolesť kostrových svalov
Svalové spazmy (vrátane zvýšenej hladiny kreatínfosfokinázy v krvi)
Rabdomyolýza,
systémový lupus erythematosus
Syndróm podobný lupusu1
Poruchy obličiek a močových
ciest
Časté
Menej časté
Poškodenie obličiek,
hematúria
Noktúria
Poruchy reprodukčného
systému a prsníkov
Menej časté Erektilná dysfunkcia
Celkové poruchy a reakcie
v mieste podania*
Veľmi časté
Časté
Menej časté
Reakcia v mieste vpichu (vrátane erytému
v mieste vpichu)
Bolesť na hrudníku,
opuch,
horúčka1
Zápal
Laboratórne a funkčné
vyšetrenia*
Časté Poruchy koagulácie a krvácania (vrátane
predĺženia aktivovaného parciálného tromboplastínového času),
pozitívny test na autoprotilátky (vrátane protilátok proti dvojvláknovej DNA),
zvýšená hladina laktátdehydrogenázy v krvi
Úrazy, otravy a komplikácie
liečebného postupu
Časté Zhoršené hojenie

* ďalšie informácie sa nachádzajú v častiach 4.3, 4.4 a 4.8
** vrátane otvorených rozšírených klinických skúšaní
1 vrátane údajov zo spontánneho hlásenia
H
i
dradenitis suppurativa
Bezpečnostný profil u pacientov s HS liečených adalimumabom jedenkrát za týždeň bol v súlade so
známym bezpečnostným profilom adalimumabu.
Uveitída
Bezpečnostný profil u pacientov s uveitídou liečených adalimumabom každý druhý týždeň bol v
súlade so známym bezpečnostným profilom adalimumabu.
Opis vybranýchnežiaducichreakcií
Reakcie v mieste podania injekcie
V kľúčových kontrolovaných štúdiach u dospelých a detí sa u 12,9 % pacientov liečených adalimumabom objavili reakcie v mieste podania injekcie (erytém a/alebo svrbenie, krvácanie, bolesť alebo opuch) v porovnaní so 7,2 % pacientov, ktorým sa podávalo placebo alebo účinná kontrola. Reakcie v mieste vpichu všeobecne nevyžadovali prerušenie podávania lieku.
Infekcie
V kľúčových kontrolovaných štúdiach u dospelých a detí sa u pacientov liečených adalimumabom vyskytla infekcia vo frekvencii 1,51 prípadu na pacienta za rok a u pacientov, ktorým sa podávalo placebo a účinná kontrola, vo frekvencii 1,46 prípadu na pacienta za rok. Infekcie predstavovali najmä zápal sliznice nosohltana, infekciu horných dýchacích ciest a sinusitídu. Po odznení infekcie väčšina pacientov pokračovala v liečbe adalimumabom.
Incidencia závažných infekcií bola 0,04 prípadov na pacienta za rok u pacientov liečených adalimumabom a 0,03 prípadu na pacienta za rok u pacientov, ktorým sa podávalo placebo alebo účinná kontrola.
V kontrolovaných a otvorených štúdiách s adalimumabom u dospelých a detí sa hlásili závažné infekcie (vrátane zriedkavo sa vyskytujúcich fatálnych infekcií), ktoré zahŕňali hlásenia o výskyte tuberkulózy (vrátane miliárnych a extrapulmonálnychlokácií) a invazívnych oportúnnych infekcií (napr. diseminovaná alebo extrapulmonárna histoplazmóza, blastomykóza, kokcidioidomykóza, pneumocystóza, kandidóza, aspergilóza a listerióza). Väčšina prípadov tuberkulózy sa vyskytla
v priebehu prvých ôsmich mesiacov od začiatku liečby a môže odrážať opätovné vzplanutie latentného
ochorenia.
Malignity a lymfoproliferatívne poruchy
V štúdii s adalimumabom v liečbe pacientov s juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou a artritídou spojenou s entezitídou)neboli u 249 pediatrických pacientov pri expozícii 655,6 pacientorokov pozorované žiadne malignity. Naviac sa nezaznamenali žiadne malignity u 192 pediatrických pacientov pri expozícii 498,1pacientorokov v štúdiách
s adalimumabom u pediatrických pacientov s Crohnovou chorobou.V klinickomskúšaní adalimumabu u pediatrických pacientov s chronickou ložiskovou psoriázou neboli pozorované u 77 pediatrických pacientov pri expozícii 80,0 pacientorokov žiadne malignity.V štúdii s adalimumabom v liečbe pediatrických pacientov s uveitídou neboli u 60 pediatrických pacientov pri expozícii
58,4 pacientorokov pozorované žiadne malignity.
Počas kontrolovaných častí kľúčových skúšaní adalimumabu trvajúcich minimálne 12 týždňov u dospelých pacientov so strednou až ťažkou aktívnou reumatoidnou artritídou, ankylozujúcou spondylitídou, axiálnou spondylartritídou bez rádiografického dôkazu AS, psoriatickou artritídou, psoriázou, hidradenitis suppurativa, Crohnovou chorobou, ulceróznou kolitídou a uveitídou sa malignity, iné ako lymfóm a nemelanómová rakovina kože, zistili s frekvenciou (95 % interval spoľahlivosti) 6,8(4,4;10,5) na 1000 pacientorokov medzi 5291 pacientmi liečenými
adalimumabomv porovnaní so 6,3 (3,4;11,8) na 1000 pacientorokov medzi 3444 kontrolnými pacientmi (stredná dĺžka trvania liečby adalimumabom bola 4,0 mesiacov a v kontrolnej skupine pacientov 3,8 mesiacov). Frekvencia (95 % interval spoľahlivosti) nemelanómového druhu rakoviny kože bola 8,8 (6,0; 13,0) na 1000 pacientorokov medzi pacientmi liečenými adalimumabom
a 3,2 (1,3;7,6) na 1000 pacientorokov medzi kontrolnými pacientmi. Z karcinómov kože sa skvamózne bunkové karcinómy vyskytli s frekvenciou (95 % interval spoľahlivosti) 2,7 (1,4; 5,4) na
1000 pacientorokov medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na 1000 pacientorokov
medzi kontrolnými pacientmi. Frekvencia (95 % interval spoľahlivosti) lymfómov bola 0,7 (0,2; 2,7)
na 1000 pacientorokov medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na
1000 pacientorokov medzi kontrolnými pacientmi.
Ak sa skombinujú kontrolované časti týchto skúšaní a prebiehajúce a ukončené otvorené rozšírené štúdie so strednou dobou trvania približne 3,3 roka, zahŕňajúce 6427 pacientov a viac ako 26 439 pacientorokov liečby, pozorovaná frekvencia malignít, iných ako lymfóm a nemelanómový druh rakoviny kože, je približne 8,5 na 1000 pacientorokov. Pozorovaná frekvencia nemelanómovej rakoviny kože je približne 9,6 na 1000 pacientorokov a pozorovaná frekvencia lymfómov je približne
1,3 na 1000 pacientorokov.
V postmarketingovej praxi od januára 2003 do decembra 2010, prevažne u pacientov s reumatoidnou artritídou, je hlásená frekvencia malignít približne 2,7 na 1000 pacientorokov liečby. Hlásené frekvencie nemelanómového druhu rakoviny kože a lymfómov sú približne 0,2 a 0,3 na
1000 pacientorokov liečby (pozri časť 4.4).
U pacientov liečených adalimumabom boli v postmarketingovej praxi hlásené zriedkavé prípady hepatosplenického T-lymfómu (pozri časť 4.4).
Autoprotilátky
U pacientov sa robilo vyšetrenie vzoriek séra na autoprotilátky v rôznych časových intervaloch
v štúdiách I - V s reumatoidnou artritídou. V týchto štúdiách sa u pacientov, ktorí mali negatívne východiskové titre antinukleových protilátok, zistili pozitívne titre v 24. týždni liečby u 11,9 %
pacientov, liečených adalimumabom, a u 8,1 % pacientov, ktorým sa podávalo placebo a aktívna
kontrola. Vo všetkých štúdiách s reumatoidnou artritídou a psoriatickou artritídou sa u dvoch z 3441 pacientov liečených adalimumabom vyvinuli klinické príznaky poukazujúce na novovzniknutý lupusu podobný syndróm. Po prerušení liečby sa stav pacientov zlepšil. U žiadneho pacienta sa nerozvinula lupózna glomerulonefritída alebo symptómy postihnutia centrálneho nervového systému.
Poruchy funkcie pečene a žlčových ciest
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s reumatoidnou
artritídou a psoriatickou artritídou s kontrolným obdobím v rozmedzí 4 až 104 týždňov prišlo
k zvýšeniu ALT ≥ 3 x horná hranica normálnej hodnoty (upper limit of normal – ULN) u 3,7 %
pacientov liečených adalimumabom a u 1,6 % pacientov, ktorým sa podávala kontrola.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 4 až 17 rokov, a u pacientov s artritídou spojenou s entezitídou, ktorí boli vo veku 6 až 17 rokov, prišlo k zvýšeniu hladiny ALT ≥ 3 x ULN u 6,1 % pacientov liečených adalimumabom a u 1,3 % pacientov, ktorým sa podávala kontrola. Väčšina prípadov zvýšenia hladiny ALT sa vyskytla pri súbežnom používaní metotrexátu. Žiadne zvýšenie hladiny ALT ≥ 3 x ULN sa nevyskytlo v skúšaní fázy 3s adalimumabom u pacientov
s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 2 až < 4 roky.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s Crohnovou chorobou a ulceróznoukolitídou s kontrolným obdobím v rozmedzí 4 až 52 týždňov prišlo k zvýšeniu
ALT ≥ 3 x ULN u 0,9 % pacientov liečených adalimumabom a u 0,9 % pacientov, ktorým sa podávala
kontrola.
V štúdii fázy3 s adalimumabom u pediatrických pacientov s Crohnovou chorobou, ktorá hodnotila účinnosť a bezpečnosť dvoch udržiavacích dávkovacích režimov po dobu až 52 týždňov liečby, ktoré boli upravené podľa telesnej hmotnosti a ktoré nasledovali po úvodnej liečbe, upravenej podľa telesnej hmotnosti, prišlo k zvýšeniu ALT ≥3 x ULN u 2,6 % (5/192) pacientov, z ktorých 4 dostávali súbežne imunosupresíva na začiatku liečby.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s ložiskovou psoriázous kontrolným obdobím v rozmedzí 12 až 14 týždňov prišlo k zvýšeniu ALT ≥ 3 x ULN u 1,8 % pacientov liečených adalimumabom a u 1,8 % pacientov, ktorým sa podávala kontrola.
V klinickom skúšaní fázy 3 s adalimumabom u pediatrických pacientov s ložiskovou psoriázou sa nevyskytli žiadne zvýšenia ALT ≥ 3 x ULN.
V kontrolovaných štúdiách s adalimumabom (počiatočné dávky 160 mg v týždni 0 a 80 mg
v 2. týždni, následne 40 mg jedenkrát za týždeň počínajúc 4. týždňom) u pacientov s hidradenitis suppurativa s trvaním kontrolného obdobia v rozmedzí 12 až 16 týždňov, nastalo zvýšenie
ALT ≥ 3 x ULN u 0,3 % pacientov liečených adalimumabom a u 0,6 % kontrolných pacientov.
V kontrolovaných klinických skúšaniach s adalimumabom (úvodné dávky 80 mg v týždni 0, potom 40 mg každé dva týždne od týždňa 1) u dospelých pacientov s uveitídou, ktoré trvali až 80 týždňov s mediánom expozície 166,5 dňa u pacientov liečených adalimumabom a 105,0 dňa u pacientov, ktorým sa podávala kontrola, nastalo zvýšenie ALT ≥ 3 x ULN u 2,4 % pacientov liečených adalimumabom a
2,4 % pacientov, ktorým sa podávala kontrola.
U všetkých indikácií v klinických štúdiách boli pacienti so zvýšenou ALT asymptomatickí a zvýšenia boli vo väčšine prípadov prechodné a upravili sa v priebehu liečby. Avšak aj po uvedení na trh boli
u pacientov, liečených adalimumabom, hlásené prípady zlyhania pečene, ako aj menej závažné
poruchy pečene, ktoré môžu predchádzať zlyhaniu pečene, ako je hepatitída, vrátane autoimunitnej hepatitídy.
Súbežná liečbasazatioprínom/6-merkaptopurínomV štúdiách s Crohnovou chorobou u dospelých bol vyšší výskyt malignít a nežiaducich udalostí
súvisiacich s vážnymi infekciami pri kombinácii adalimumabu a azatioprínu/6-merkaptopurínu
v porovnaní s adalimumabom samotným.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.
4.9 PredávkovanieV klinických štúdiách nebola pozorovaná žiadna toxicita, obmedzujúca dávku. Najvyššou hodnotenou dávkou bola opakovaná intravenózna dávka 10 mg/kg, čo je približne 15-násobok odporúčanej dávky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: imunosupresíva, inhibítory tumor nekrotizujúceho faktora alfa (TNF-α).
ATC kód: L04AB04
Idacio je biosimilárny liek. Podrobné informácie sú dostupné na webovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.
 Mechanizmus účinku
Mechanizmus účinkuAdalimumab sa špecificky viaže na TNF a neutralizuje biologickú funkciu TNF blokovaním jeho
interakcie s p55 a p75 receptormi TNF na povrchu bunky.
Adalimumab tiež moduluje biologické odpovede, ktoré sú navodené alebo regulované TNF, vrátane zmien hladín adhezívnych molekúl, ktoré zodpovedajú za migráciu leukocytov (ELAM-1, VCAM-1 a ICAM-1 pri IC50 0,1-0,2 nM).
Farmakodynamické účinkyU pacientov s reumatoidnou artritídou sa po liečbe adalimumabom pozoroval rýchly pokles hladín
reaktantov akútnej fázy zápalu (C-reaktívny proteín (CRP) a sedimentácia erytrocytov (FW))
a sérových cytokínov (IL-6) oproti východiskovému stavu. Po podaní adalimumabu sa znížili aj sérové koncentrácie matrixových metaloproteináz (MMP-1 a MMP-3), ktoré vyvolávajú remodeláciu tkaniva,
zodpovednú za deštrukciu chrupky. U pacientov liečených adalimumabom zvyčajne došlo k zlepšeniu
hematologických príznakov chronického zápalu.
Rýchly pokles hladín CRP sa pozoroval počas liečby adalimumabom aj u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, Crohnovou chorobou, ulceróznou kolitídou a hidradenitis suppurativa. U pacientov s Crohnovou chorobou sa pozorovalo zníženie počtu buniek, exprimujúcich zápalové markery v čreve, vrátane signifikantnej redukcie expresie TNFα. Endoskopické štúdie na intestinálnej mukóze preukázali dôkaz hojenia sliznice u pacientov liečených adalimumabom.
Klinická účinnosťabezpečnosťJuvenilná idiopatická artritída Poly arti kul árna j uvenil ná idi opat ick á art rit í da (pJI A) Bezpečnosť a účinnosť adalimumabu bola hodnotená v dvoch štúdiách (pJIA I a II) u detí s aktívnou
polyartikulárnou artritídou alebo s polyartikulárnym priebehom artritídy, ktoré mali rôzne typy vzplanutia JIA (najčastejšie polyartritída s negatívnym alebo pozitívnym reumatoidným faktorom alebo rozšírená oligoartritída).
pJIA I
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito
zaslepenej štúdii s paralelnými skupinami u 171 detí (vo veku 4 - 17 rokov) s polyartikulárnou JIA.
V otvorenej úvodnej fáze (OL LI) boli pacienti rozdelení do dvoch skupín, liečení MTX (metotrexát) alebo neliečení MTX. Pacienti, ktorí boli v skupine neliečených MTX neboli nikdy MTX liečení alebo bola liečba MTX u nich prerušená najmenej dva týždne pred podaním lieku v štúdii. Pacienti ostávali na stálych dávkach NSAIDs a/alebo prednizónu (≤ 0,2 mg/kg/deň alebo maximálne 10 mg/kg).
Vo fáze OL LI dostávali všetci pacienti adalimumab v dávke 24 mg/m2 až do maxima 40 mg každý druhý týždeň počas 16 týždňov. V tabuľke 7je rozdelenie pacientov podľa veku a minimálnej, strednej
a maximálnej dávky, ktorú dostávali vo fáze OL LI.
Tabuľka 7Rozdelenie pacientov podľa veku a dávky adalimumabu, ktorú dostávali vo fáze OL LIVeková skupina Počet pacientov na vstupe n (%) Minimálna, stredná a maximálna dávka
4 až 7 rokov 31 (18,1) 10, 20 a 25 mg
8 až 12 rokov 71 (41,5) 20, 25 a 40 mg
13 až 17 rokov 69 (40,4) 25, 40 a 40 mg
Pacienti, ktorí v 16. týždni vykázali odpoveď Pediatric ACR 30 boli vhodní na randomizáciu do dvojito zaslepenej (DB) fázy a dostávali každý druhý týždeň počas ďalších 32 týždňov alebo do vzplanutia ochorenia buď adalimumab v dávke 24 mg/m2 až do maxima 40 mg alebo placebo. Kritériá vzplanutia ochorenia boli definované ako zhoršenie ≥ 3 zo 6 hlavných kritérií Pediatric ACR o ≥ 30 % oproti vstupnej úrovni, ≥ 2 aktívnych kĺbov a zlepšenie nie viac ako 1 zo 6 kritérií o ≥ 30 %. Po
32 týždňoch alebo po vzplanutí ochorenia boli pacienti vhodní na zaradenie do predĺženej otvorenej fázy.
Tabuľka 8
Ped ACR 30 odpovede v JIA štúdii
Skupina MTX bez MTX
Fáza
OL LI 16. týždeň
Ped ACR 30
odpoveď (n/N)
94,1 % (80/85) 74,4 % (64/86)
Hodnotenie účinnosti
Dvojito zaslepená,
32 týždňov
Adalimumab/MTX (N = 38)
Placebo/MTX (N = 37)
Adalimumab
(N = 30)
placebo
(N = 28)
Vzplanutie ochorenia na konci
32. týždňaa (n/N)
36,8 % (14/38) 64,9 % (24/37)b
43,3 % (13/30) 71,4 % (20/28)c
Priemerný čas do
vzplanutia ochorenia
> 32 týždňov 20 týždňov > 32 týždňov 14 týždňov

a odpovede Ped ACR 30/50/70 boli v 48. týždni významne vyššie ako u pacientov liečených placebom
b p = 0,015
c p = 0,031
U pacientov, ktorí boli počas celej štúdie liečení adalimumabom a odpovedali v 16. týždni (n = 144),
pretrvávali odpovede Pediatric ACR 30/50/70/90 počas šiestich rokov fázy OLE. Všetkých
19 pacientov, z ktorých 11 bolo na začiatku štúdie vo veku 4 až 12 rokov a 8 vo veku 13 až 17 rokov, bolo liečených počas 6 rokov alebo dlhšie.
Celkové odpovede boli všeobecne lepšie a protilátky sa vyvinuli u menšieho počtu pacientov, ak boli liečení kombináciou adalimumabu a MTX v porovnaní s adalimumabom samotným. Berúc do úvahy tieto údaje, Idacio sa odporúča na používanie v kombinácii s MTX a na používanie ako monoterapia iba u pacientov, u ktorých je podávanie MTX nevhodné (pozri časť 4.2).
pJIA II
Bezpečnosť a účinnosť adalimumabu bola hodnotená v otvorenej multicentrickej štúdii u 32 detí (vo veku 2 - < 4 roky alebo vo veku 4 roky a viac s hmotnosťou < 15 kg) so stredne ťažkou až ťažkou aktívnou polyartikulárnou JIA. Pacienti dostávali 24 mg adalimumabu/m2 telesného povrchu (Body Surface Area, BSA) až maximálne 20 mg každý druhý týždeň v jednej dávke subkutánnou injekciou aspoň po dobu 24 týždňov. V priebehu štúdie väčšina subjektov používala súbežne MTX, menej bolo hlásené používanie kortikosteroidov alebo NSAIDs.
Z pozorovaných údajov vyplýva, že v 12. týždni a 24. týždni bola odpoveď PedACR 30 93,5 % resp.
90,0 %. Pomer subjektov s PedACR 50/70/90 v 12. týždni a v 24. týždni bol 90,3 %/61,3 %/38,7 %
resp. 83,3 %/73,3 %/36,7 %. Medzi tými, ktorí odpovedali (pediatrická ACR 30) v 24. týždni (n = 27
z 30 pacientov), sa pediatrická ACR odpoveď 30 zachovala po dobu až 60 týždňov vo fáze OLE
u pacientov, ktorí dostávali adalimumab po celé toto obdobie. Celkovo bolo 20 subjektov liečených po dobu 60 týždňov alebo dlhšie.
Art ri tí da spojená s entezi tí dou
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito
zaslepenej štúdii u 46 pediatrických pacientoch (vo veku 6 až 17 rokov) so stredne ťažkou artritídou
spojenou s entezitídou. Pacienti boli randomizovaní buď na podávanie adalimumabu v dávke
24 mg/m2 BSA až do maximálnej dávky 40 mg, alebo na podávanie placeba každý druhý týždeň po dobu 12 týždňov. Po dvojito zaslepenej fáze nasledovala otvorená (open-label – OL) fáza, počas ktorej pacienti dostávali 24 mg/m2 BSA adalimumabu až do maximálnej dávky 40 mg každý druhý týždeň
subkutánne po dobu ďalších až 192 týždňov. Primárnym koncovým ukazovateľom bola percentuálna zmena od východiskovej hodnoty do 12. týždňa v počte aktívnych kĺbov s artritídou (opuch nie pre
deformáciu alebo kĺby so stratou pohyblivosti plus bolesť a/alebo citlivosť), ktorá bolo dosiahnutá
s priemerným percentuálnym poklesom o - 62,6 % (medián percentuálnej zmeny - 88,9 %)
u pacientov v skupine liečenej adalimumabom v porovnaní s - 11,6 % (medián percentuálnej
zmeny - 50,0 %) u pacientov v skupine, ktorá dostávala placebo. Zlepšenie v počte aktívnych kĺbov s artritídou sa udržalo v priebehu otvorenej fázy až do 156.týždňa štúdie u 26 z 31 (84 %) pacientov liečených adalimumabom, ktorí zotrvali v štúdii. Aj keď to nie je štatisticky významné, u väčšiny pacientov sa prejavilo klinické zlepšenie sekundárnych koncových ukazovateľov, ako je počet miest entezitídy, počet bolestivých kĺbov (tender joint count -TJC), počet opuchnutých kĺbov (swollen joint count- SJC), pediatrická odpoveď ACR 50 a pediatrická odpoveď ACR 70.
Dospelí s reumatoidnou artritídou
Adalimumab bola hodnotený vo všetkých klinických štúdiách s reumatoidnou artritídou u viac ako
3000 pacientov. Účinnosť a bezpečnosť adalimumabu v liečbe reumatoidnej artritídy bola hodnotená
v piatich randomizovaných, dvojito zaslepených a dobre kontrolovaných štúdiách. Niektorí pacienti boli liečení až 120 mesiacov.
V RA štúdii I bolo hodnotených 271 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, vo veku ≥ 18 rokov, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom a liečba metotrexátom v dávkach od 12,5 do 25 mg (10 mg v prípade neznášanlivosti metotrexátu) každý týždeň pri konštantnej dávke 10 až 25 mg každý týždeň mala nedostatočnú účinnosť. Pacienti dostávali dávky 20, 40 alebo 80 mg adalimumabu alebo placebo každý druhý týždeň počas 24 týždňov.
V RA štúdii II sa hodnotilo 544 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom. Pacientom boli každý druhý týždeň po dobu 26 týždňov podávané subkutánne dávky 20 alebo 40 mg adalimumabu a placebo v týždňoch bez podania aktívnej liečby alebo bolo rovnakú dobu podávané každý týždeň placebo. Nebolo povolené podávanie žiadneho iného chorobu modifikujúceho antireumatického lieku.
V RA štúdii III sa hodnotilo 619 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, a ktorí mali nedostatočnú odpoveď na metotrexát
v dávkach od 12,5 do 25 mg alebo netolerovali dávku 10 mg metotrexátu každý týždeň. V tejto štúdii boli tri skupiny. Prvá skupina dostávala injekcie placeba raz týždenne počas 52 týždňov. Druhá
skupina dostávala 20 mg adalimumabu každý týždeň počas 52 týždňov. Tretia skupina dostávala
40 mg adalimumabu každý druhý týždeň a placebo v týždňoch bez podania aktívnej liečby. Po
uplynutí prvých 52 týždňov bolo 457 pacientov zaradených do otvorenej predĺženej fázy štúdie,
v ktorej sa podávalo 40 mg adalimumabu/MTX každý druhý týždeň až po dobu 10 rokov.
V RA štúdii IV sa primárne hodnotila bezpečnosť u 636 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac. Štúdie sa zúčastnili pacienti, ktorí ešte neboli liečení chorobu modifikujúcim antireumatickým liekom alebo pacienti
s predchádzajúcou reumatoidnou liečbou, v ktorej naďalej pokračovali, pod podmienkou, že liečba bola stabilná minimálne 28 dní. Tieto terapie zahrňujú metotrexát, leflunomid, hydroxylchlorochín,
sulfasalazín a/alebo soli zlata. Pacienti boli randomizovaní na 40 mg adalimumabu alebo placebo,
ktoré dostávali každý druhý týždeň počas 24 týždňov.
V RA štúdii V sa hodnotilo 799 dospelých pacientov so stredne ťažkou až ťažkou aktívnou včasnou
reumatoidnou artritídou doposiaľ neliečených metotrexátom (priemerné trvanie ochorenia menej ako
9 mesiacov). Táto štúdia hodnotila účinnosť 40 mg adalimumabu každý druhý týždeň/kombinovanú
terapiu s metotrexátom, adalimumabu 40 mg každý druhý týždeň v monoterapii a metotrexátu
v monoterapiina zníženie prejavov a príznakov a rýchlosti progresie poškodenia kĺbov u reumatoidnej artritídy počas 104 týždňov. Po dokončení prvých 104 týždňov bolo 497 pacientov zaradených do otvorenej predĺženej fázy štúdie, v ktorej sa podávalo 40 mg adalimumabu každý druhý týždeň po dobu až 10 rokov.
Primárnym koncovým ukazovateľom v RA štúdiách I, II a III a sekundárnym koncovým ukazovateľom v RA štúdii IV bolo percento pacientov, u ktorých sa dosiahla odpoveď ACR 20 v 24. alebo 26. týždni. Primárnym koncovým ukazovateľom v RA štúdii V bolo percento pacientov, ktorí dosiahli odpoveď ACR 50 v 52. týždni. RA štúdie III a V mali ďalší primárny koncový ukazovateľ po 52 týždňoch, a to spomalenie progresie ochorenia (hodnotené pomocou výsledkov röntgenu). RA štúdia III mala primárny koncový ukazovateľ aj zmenu v kvalite života.
ACR odpoveď
Percento pacientov, liečených adalimumabu, u ktorých sa dosiahla odpoveď ACR 20, 50 a 70, bolo
konzistentné v RA štúdiách I, II a III. Výsledky pre dávku 40 mg každý druhý týždeň sú zhrnuté
v tabuľke 9.
Tabuľka 9
ACR odpovede v placebom kontrolovaných štúdiách
(percento pacientov)
Odpoveď RA štúdia Ia** RA štúdia IIa** RA štúdia IIIa**
ACR 20
Placebo/
MTXc
n =60
Adalimumabb/
MTXc
n = 63
Placebo
n = 110
Adalimumabb
n = 113
Placebo/
MTXc
n = 200
Adalimumabb/
MTXc
n = 207

6 mesiacov 13,3 % 65,1 % 19,1 % 46,0 % 29,5 % 63,3 %
12 mesiacov NA NA NA NA 24,0 % 58,9 % ACR 50
6 mesiacov 6,7 % 52,4 % 8,2 % 22,1 % 9,5 % 39,1 %
12 mesiacov NA NA NA NA 9,5 % 41,5 % ACR 70
6 mesiacov 3,3 % 23,8 % 1,8 % 12,4 % 2,5 % 20,8 %
12 mesiacov NA NA NA NA 4,5 % 23,2 %
a RA štúdia I po 24 týždňoch, RA štúdia II po 26 týždňoch a RA štúdia III po 24 a 52 týždňoch
b 40 mg adalimumabu podávaného každý druhý týždeň
c MTX = metotrexát
**p < 0,01; adalimumab verzus placebo
V RA štúdiách I - IV sa po 24 alebo po 26 týždňoch v porovnaní s placebom zlepšili všetky jednotlivé
zložky kritérií odpovede ACR (počet bolestivých a opuchnutých kĺbov, hodnotenie aktivity ochorenia a bolesti lekárom a pacientom, skóre indexu postihnutia (HAQ) a hodnoty CRP (mg/dl)). V RA štúdii III tieto zlepšenia pretrvávali počas 52 týždňov.
V otvorenej predĺženej fáze RA štúdie III si väčšina pacientov s ACR odozvou udržala odozvu pri sledovaní až po dobu 10 rokov. 114 z 207 pacientov, ktorí boli randomizovaní na adalimumab 40 mg každý druhý týždeň pokračovalo s adalimumabom 40 mg každý druhý týždeň po dobu 5 rokov. Medzi týmito pacientmi malo 86 pacientov (75,4 %) odpoveď ACR20, 72 pacientov (63,2 %) odpoveď
ACR 50 a 41 pacientov (36 %) odpoveď ACR 70. 81 pacientov z 207 pokračovalo s adalimumabom
40 mg každý druhý týždeň po dobu 10 rokov. Medzi týmito pacientmi malo 64 pacientov (79,0 %)
odpoveď ACR 20, 56 pacientov (69,1 %) odpoveď ACR 50 a 43 pacientov (53,1 %) odpoveď ACR70.
V RA štúdii IV bola odpoveď ACR 20 u pacientov liečených adalimumabom spolu so štandardnou liečbou štatisticky signifikantne lepšia ako u pacientov, ktorým sa podávalo placebo spolu
so štandardnou liečbou (p < 0,001).
V RA štúdiách I - IV dosiahli pacienti liečení adalimumabom štatisticky významné odpovede ACR 20
a 50 v porovnaní s placebom a to už o jeden až dva týždne od začiatku liečby.
V RA štúdii V u pacientov s včasnou reumatoidnou artritídou, ktorí doposiaľ neboli liečení metotrexátom, viedla kombinovaná terapia adalimumabom a metotrexátom k rýchlejšej a významne väčšej odpovedi ACR ako monoterapia metotrexátom a monoterapia adalimumabom v 52. týždni
a odpoveď pretrvávala aj v 104. týždni (pozri tabuľku 10).
Tabuľka 10
ACR odpoveď v RA štúdii V
(percento pacientov)
O
dpoveď
MTX
n =
257Adalimumab n =
274Adalimumab/ MTXn
MTXn =
268Hodnot a paHodnota pbHodnota pc
ACR 20
Týždeň 52 62,6 % 54,4 % 72,8 % 0,013 <0,001 0,043
Týždeň 104 56,0 % 49,3 % 69,4 % 0,002 <0,001 0,140
ACR 50
Týždeň 52 45,9 % 41,2 % 61,6 % <0,001 <0,001 0,317
Týždeň 104 42,8 % 36,9 % 59,0 % <0,001 <0,001 0,162
ACR 70
Týždeň 52 27,2 % 25,9 % 45,5 % <0,001 <0,001 0,656
Týždeň 104 28,4 % 28,1 % 46,6 % <0,001 <0,001 0,864 a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
c hodnota p pochádza z párového porovnania monoterapie adalimumabom a monoterapie
metotrexátompomocou Mannovho-Whitneyho U testu
V predĺženej otvorenej RA štúdii V sa odpovede ACR udržali počas obdobia sledovania až 10 rokov.
Z 542 pacientov, ktorí boli randomizovaní na liečbu adalimumabu 40 mg každý druhý týždeň,
170 pacientov pokračovalo v liečbe adalimumabom 40 mg každý druhý týždeň po dobu 10 rokov. Spomedzi týchto pacientov malo 154 pacientov (90,6 %) odpoveď ACR 20, 127 pacientov (74,7 %) malo odpoveď ACR 50 a 102 pacientov (60,0 %) malo odpoveď ACR 70.
V 52. týždni dosiahlo 42,9 % pacientov liečených kombináciou adalimumab/metotrexát klinickú remisiu (DAS28 (CRP)< 2,6) v porovnaní s 20,6 % pacientov liečených metotrexátom v monoterapii a 23,4 % pacientov liečených adalimumabom v monoterapii. Kombinovaná terapia adalimumab/metotrexát bola klinicky a štatisticky lepšia ako monoterapia metotrexátom (p < 0,001)
a adalimumabom (p < 0,001) z hľadiska dosiahnutia stavu nízkej aktivity ochorenia u pacientov
so stredne ťažkou až ťažkou formou reumatoidnej artritídy diagnostikovanou v nedávnom období. Odpoveď v dvoch monoterapeutických ramenách štúdie bola podobná (p = 0,447).
Z 342 pacientov pôvodne randomizovaných na liečbu adalimumabom v monoterapii alebo na
kombinovanú liečbu adalimumab/metotrexát, ktorí boli zaradení do otvorenej predĺženej štúdie, 171 pacientov dokončilo 10 rokov liečby adalimumabom. Spomedzi týchto pacientov bola u 109 pacientov (63,7 %) hlásená remisia po 10 rokoch.
Rádiografi cká odpove ď
V RA štúdii III, kde priemerná dĺžka trvania reumatoidnej artritídy u pacientov liečených
adalimumabom bola približne 11 rokov, bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky a vyjadrené ako zmena modifikovaného celkového Sharpovho skóre (Total Sharp Score- TSS) a jeho komponentov, skóre erózie a skóre zúženia kĺbovej štrbiny. U pacientov liečených adalimumabom/metotrexátom sa zistila významne menšia rádiografická progresia v 6. a 12. mesiaci liečby ako u pacientov liečených metotrexátom v monoterapii (pozri tabuľku 11).
V otvorenom predĺžení RA štúdie III zníženie stupňa progresie štrukturálneho poškodenia
v podskupinách pacientov pretrvávalo 8 a 10 rokov. Po 8 rokoch bolo rádiograficky vyhodnotených
81 z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich
u 48 nedošlo k progresii štrukturálneho poškodenia, čo sa definovalo ako zmena modifikovaného TSS
(mTSS) z východiskovej hodnoty o 0,5 alebo menej. Po 10 rokoch bolo rádiograficky vyhodnotených
79 z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich u 40
nedošlo k progresii štrukturálneho poškodenia, definovaného ako zmena modifikovaného TSS (mTSS)
z východiskovej hodnoty o 0,5 alebo menej.
Tabuľka 11
Priemerné rádiografické zmeny po 12 mesiacoch v RA štúdii III

Placebo/MTXa
Adalimumab/MT X 40 mg každý druhý týždeň
Placebo/MTX-
Adalimumab/MT X (95 % interval spoľahlivostib)
Hodnota p
Celkové Sharpovo skóre 2,7 0,1 2,6 (1,4; 3,8) < 0,001c
Skóre erózie 1,6 0,0 1,6 (0,9; 2,2) < 0,001
Skóre JSNd 1,0 0,1 0,9 (0,3; 1,4) 0,002
a metotrexát
b 95 % intervaly spoľahlivosti pre rozdiely zmeny skóre medzi metotrexátom a adalimumabom.
c na základe analýzy poradia
d zúženie kĺbovej štrbiny (Joint Space Narrowing – JSN)
V RA štúdii V bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky a vyjadrené ako zmena
modifikovaného celkového Sharpovho skóre (pozri tabuľku 12).
Tabuľka 12
Priemerné rádiografické zmeny v týždni 52 v RA štúdii V
MTX
n = 257
(95 % interval
spoľahlivosti)
Adalimumab n = 274
(95 % interval
spoľahlivosti)
Adalimumab/
MTX
n = 268
(95 % interval
spoľahlivosti)
Hodnota pa
Hodnota pb
Hodnota pc
Celkové Sharpovo skóre
5,7 (4,2-7,3) 3,0 (1,7-4,3) 1,3 (0,5-2,1) < 0,001 0,0020 < 0,001

Skóre erózie 3,7 (2,7-4,7) 1,7 (1,0-2,4) 0,8 (0,4-1,2) < 0,001 0,0082 < 0,001
JSN skóre 2,0 (1,2-2,8) 1,3 (0,5-2,1) 0,5 (0-1,0) < 0,001 0,0037 0,151
a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
c hodnota p pochádza z párového porovnania monoterapie adalimumabom a monoterapie
metotrexátom pomocou Mannovho-Whitneyho U testu
Po 52 a 104 týždňoch terapie bolo percento pacientov bez progresie (zmena modifikovaného Sharpovho skóre oproti východiskovej hodnote £ 0,5) významne vyššie pri kombinovanej terapii adalimumab/metotrexát (63,8 %, resp. 61,2 %) v porovnaní s monoterapiou metotrexátom (37,4 %, resp. 33,5 %, p < 0,001) a monoterapiou adalimumabom (50,7 %, p < 0,002, resp. 44,5 %, p < 0,001).
V otvorenej predĺženej štúdii RA V bola priemerná zmena modifikovaného Sharpovho skóre oproti východiskovým hodnotám na konci 10. roka 10,8; 9,2 a 3,9 u pacientov pôvodne randomizovaných na liečbu metotrexátom v monoterapii, adalimumabom v monoterapii a na kombinovanú liečbu adalimumabom/metotrexátom, a to v uvedenom poradí. Zodpovedajúci percentuálny podiel pacientov bez progresie bol 31,3 %, 23,7 % a 36,7 % v uvedenom poradí.
Kval it a ži vot a a t el esné f unkc i e
Kvalita života súvisiaca so zdravím a telesné funkcie boli hodnotené v štyroch pôvodných
adekvátnych a dobre kontrolovaných štúdiách indexom obmedzenia pomocou Dotazníka na posudzovanie zdravotného stavu (Health Assessment Questionnaire - HAQ). Tento parameter bol
v RA štúdii III vopred určeným primárnym koncovým ukazovateľom v 52. týždni. U všetkých
dávok/schém podávania adalimumabu vo všetkých štyroch štúdiách sa preukázalo štatisticky významné zlepšenie indexu obmedzenia HAQ medzi východiskovými hodnotami a hodnotami
v 6. mesiaci v porovnaní s placebom. Rovnaké výsledky boli pozorované v RA štúdii III v 52. týždni.
Výsledky z dotazníka Krátka forma prieskumu zdravotného stavu (Short Form Health Survey - SF 36)
pre všetky dávky/schémy adalimumabu vo všetkých štyroch štúdiách podporujú tieto nálezy,
so štatisticky významným zlepšením skóre súhrnu telesnej zložky (physical component summary - PCS) a rovnako aj štatisticky významným zlepšením skóre súhrnu zložiek bolesti a vitality pre dávku
40 mg každý druhý týždeň. Vo všetkých troch štúdiách, v ktorých bola posudzovaná únavnosť (RA
štúdie I, III, IV), bolo pozorované štatisticky významné zníženie jej skóre, stanovené Funkčným hodnotením liečby chronickej choroby (Functional Assessment of Chronic Illness Therapy - FACIT).
Väčšina jedincov, ktorá dosiahla zlepšenie fyzických funkcií v RA štúdii III a ktorá pokračovala v liečbe v otvorenej fáze štúdie, si udržala zlepšenie až do týždňa 520 (120 mesiacov). Zlepšenie kvality života sa hodnotilo až do týždňa 156 (36 mesiacov) a pretrvávalo počas tejto doby.
V RA štúdii V zlepšenie indexu obmedzenia HAQ a skóre súhrnu telesných komponentov v SF 36 preukázalo väčšie zlepšenie (p < 0,001) pri kombinovanej liečbe adalimumab/metotrexát ako pri monoterapii metotrexátom a monoterapii adalimumabom v týždni 52 a zostalo väčšie až do týždňa
104. 250 pacientov, ktorí dokončili otvorenú rozšírenú štúdiu, si počas 10 rokov liečby uchovalo
zlepšenie telesných funkcií.
Ložisková psoriáza u pediatrických pacientov
Účinnosť adalimumabu bola hodnotená v randomizovanej, dvojito zaslepenej, kontrolovanej štúdii zahŕňajúcej 114 pediatrických pacientov vo veku od 4 rokov s ťažkou chronickou ložiskovou psoriázou (definovanou hodnotami skóre celkového hodnotenia lekárom (Physician’s Global Assessment - PGA) ≥ 4 alebo postihnutím > 20 % BSA alebo postihnutím > 10 % BSA s veľmi hrubými léziami alebo indexom plochy postihnutia a závažnosti psoriázy (Psoriasis Area and Severity Index - PASI) ≥ 20 alebo ≥ 10 s klinicky relevantným postihnutím tváre, pohlavných orgánov alebo rúk/nôh), ktorí boli nedostatočne kontrolovaní lokálnou liečbou a helioterapiou alebo fototerapiou.
Pacienti dostávali adalimumab 0,8 mg/kg každý druhý týždeň (maximálne 40 mg); 0,4 mg/kg každý druhý týždeň (maximálne 20 mg) alebo metotrexát 0,1 – 0,4 mg/kg jedenkrát týždenne (maximálne
25 mg). V týždni 16. malo viac pacientov randomizovaných do skupiny liečenej adalimumabom
0,8 mg/kg pozitívnu reakciu, pokiaľ ide o účinnosť, (napr. PASI 75) v porovnaní s pacientmi, ktorí
boli randomizovaní do skupiny liečenej 0,4 mg/kg každý druhý týždeň (every other week - eow) alebo
MTX.
T
abuľka 13: Výsledky účinnosti liečby ložiskovej psoriázy u detí v týždni 16

MTXa
N = 37
Adalimumab 0,8 mg/kg eow
N = 38
PASI 75b 12 (32,4 %) 22 (57,9 %) PGA: čisté/minimálne c 15 (40,5 %) 23 (60,5 %)
a MTX = metotrexát
b P = 0,027; adalimumab 0,8 mg/kg verzus MTX
c P = 0,083; adalimumab 0,8 mg/kg verzus MTX
Pacienti, ktorí dosiahli PASI 75 a PGA čisté alebo minimálne, boli vysadení z liečby po dobu najviac
36 týždňov a boli sledovaní z hľadiska straty kontroly nad ochorením (t. j. zhoršenie PGA aspoň
o 2 stupne). Pacienti boli potom znova liečení adalimumabom 0,8 mg/kg každý druhý týždeň (every
other week – eow) počas ďalších 16 týždňov a miera odpovede pozorovaná pri opakovanej liečbe bola podobná ako v predchádzajúcom dvojito zaslepenom období: PASI 75 odpoveď 78,9 % (15 z 19 subjektov) a PGA čisté alebo minimálne 52,6 % (10 z 19 subjektov).
V otvorenom období štúdie boli odpovede PASI 75 a PGA čisté alebo minimálne zachované až počas ďalších 52 týždňov bez nových bezpečnostných zistení.
Ložisková psoriáza u dospelých
Bezpečnosť a účinnosť adalimumabu bola študovaná v randomizovaných, dvojito zaslepených štúdiách u dospelých pacientov s chronickou ložiskovoupsoriázou (postihnutie³ 10 % BSA a PASI
³ 12 alebo ³ 10), ktorí boli kandidátmi na systémovú liečbu alebo fotoliečbu. 73 % pacientov
zahrnutých do štúdií I a II so psoriázou bolo predtým liečených systémovou liečbou alebo fotoliečbou. Bezpečnosť a účinnosť adalimumabu sa študovala aj u dospelých pacientov so stredne ťažkou až
ťažkou chronickou ložiskovou psoriázou so súčasnou psoriázou na rukách a/alebo chodidlách, ktorí
boli kandidátmi na systémovú liečbu, v randomizovanej dvojito zaslepenej štúdii (štúdia III
so psoriázou).
V štúdii I (REVEAL) so psoriázou bolo počas troch liečebných intervalov hodnotených 1212 pacientov. V intervale A dostali pacienti placebo alebo adalimumab v úvodnej dávke 80 mg a po uplynutí jedného týždňa od úvodnej dávky 40 mg každý druhý týždeň. Pacienti, ktorí dosiahli aspoň odpoveď PASI 75 (skóre zlepšenia PASI aspoň 75 % v porovnaní s počiatočným stavom), pokračovali po 16 týždňoch liečby v intervale B a v otvorenej fáze dostávali 40 mg adalimumabu každý druhý týždeň. Pacienti, ktorí si aj v týždni33 udržali odpoveď ³ PASI 75 a v intervale A boli randomizovaní na aktívnu liečbu, boli v intervale C znovu randomizovaní na podanie 40 mg adalimumabu každý druhý týždeň alebo placeba počas ďalších 19 týždňov. Vo všetkých liečebných skupinách bolo na začiatku liečby priemerné skóre PASI 18,9 a PGA sa pohybovalo od „stredne ťažkého“ (53 % hodnotených pacientov) po „ťažké“ (41 %) až „veľmi ťažké“ (6 %).
V štúdii II (CHAMPION) so psoriázou sa porovnávala účinnosť a bezpečnosť adalimumabu
v porovnaní s metotrexátom a placebom u 271 pacientov. Pacienti dostávali počas 16 týždňov placebo, úvodnú dávku MTX 7,5 mg, ktorá sa potom zvyšovala do 12. týždňa na maximálnu dávku 25 mg
alebo dostali úvodnú dávku 80 mg adalimumabu a potom 40 mg adalimumabu každý druhý týždeň (po
1. týždni od úvodnej dávky). K dispozícii nie sú údaje porovnávajúce adalimumab a MTX po liečbe trvajúcej viac ako 16 týždňov. Pacientom, ktorým sa podával MTX, a ktorí v týždni8 a/alebo 12mali odpoveď ³ PASI 50, sa nepodali ďalšie zvýšené dávky. Vo všetkých liečebných skupinách bolo na začiatku liečby priemerné skóre PASI 19,7 a skóre PGA sa pohybovalo od „mierneho“ (< 1 %) po
„stredne ťažké“ (48 %), „ťažké“ (46 %) až „veľmi ťažké“ (6 %).
Pacienti, ktorí sa zúčastnili klinických skúšaní fázy 2 aj fázy 3 zameraných na psoriázu, boli vhodní na zaradenie do otvoreného rozšíreného klinického skúšania s podávaním adalimumabu najmenej ďalších
108 týždňov.
V štúdiách I a II so psoriázou bol primárnym koncovým ukazovateľom pomer pacientov, ktorí
v porovnaní so stavom na začiatku liečby dosiahli v týždni 16 odpoveď PASI 75 (pozri tabuľky 14
a 15).
Tabuľka 14
Štúdia I so psoriázou (REVEAL) Účinnosť v týždni 16
 Placebo N = 398 n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 814
n (%)
Placebo N = 398 n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 814
n (%)
³ PASI 75a 26 (6,5) 578 (70,9)b PASI 100 3 (0,8) 163 (20,0)b PGA: čisté/minimálne 17 (4,3) 506 (62,2)b
a percento pacientov, ktorí dosiahli odpoveď PASI 75, bolo vypočítané ako priemerná hodnota
b p < 0,001; adalimumab verzus placebo
Tabuľka 15
Štúdia II so psoriázou (CHAMPION) Účinnosť v týždni 16
 Placebo N = 53 n (%)
MTX N = 110 n (%)
A
dalimumab
40 mg každý druhý týždeň
N = 108
n (%)
Placebo N = 53 n (%)
MTX N = 110 n (%)
A
dalimumab
40 mg každý druhý týždeň
N = 108
n (%)
³ PASI 75 10 (18,9) 39 (35,5) 86 (79,6) a, b
PASI 100 1 (1,9) 8 (7,3) 18 (16,7) c, d
P
GA
:
čisté/minimálne
6 (11,3) 33 (30,0) 79 (73,1) a, b
a p < 0,001 adalimumab verzus placebo
b p < 0,001 adalimumab verzus metotrexát
c p < 0,01 adalimumab verzus placebo
d p < 0,05 adalimumab verzus metotrexát
V štúdii I so psoriázou u pacientov, ktorí mali odpoveď PASI 75 a v týždni 33 boli znovu
randomizovaní na placebo, stratilo adekvátnu odpoveď 28 % v porovnaní s 5 %, ktorým sa ďalej podával adalimumab, p < 0,001 (skóre PASI po týždni 33 a v týždni 52 alebo pred ním vyústilo do odpovede < PASI 50 v porovnaní s počiatočným stavom s minimálne 6–bodovým zvýšením skóre PASI v porovnaní s týždňom 33). Z pacientov, ktorí po opätovnej randomizácii na placebo stratili schopnosť adekvátne odpovedať, a ktorí boli potom zaradení do otvorenej rozšírenej štúdie, 38 % (25/66) znova získalo odpoveď PASI 75 po 12 týždňoch liečby a 55 % (36/66) po 24 týždňoch liečby.
Celkovo 233 pacientov, ktorí dosiahli skóre PASI 75 v týždni 16 a 33, dostávalo kontinuálnu liečbu
adalimumabu v trvaní 52 týždňov v štúdii I so psoriázou a v liečbe adalimumabom pokračovali
v otvorenom rozšírenom skúšaní. Po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní 160
týždňov) dosiahlo skóre PASI 75 74,7 % týchto pacientov a skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke 59,0 % pacientov. V analýze sa všetci pacienti vylúčení zo skúšania kvôli nežiaducim udalostiam alebo nedostatočnej účinnosti a tí, ktorým sa zvýšila dávka, považovali za pacientov bez odpovede, po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní
160 týždňov) skóre PASI 75 dosiahlo 69,6 % pacientov a skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke 55,7 %.
V otvorenom rozšírenom skúšaní sa hodnotilo pri vysadení liečby a pri pokračovaní v liečbe celkovo
347 pacientov so stálou odpoveďou na liečbu. V období vysadenia liečby sa príznaky psoriázy časom vrátili, s mediánom času po relaps (pokles skóre PGA na „stredne ťažká psoriáza“ alebo horšie skóre) približne 5 mesiacov. Žiadny z týchto pacientov nezaznamenal zhoršenie po náhlom vysadení liečby. Celkovo 76,5 % (218/285) pacientov, ktorí sa zúčastnili pokračujúcej liečby, malo po 16 týždňoch pokračujúcej liečby skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke, bez ohľadu na to, či u nich počas vysadenia liečby došlo k relapsu (69,1 % [123/178] pacientov,
u ktorých došlo k relapsu, a 88,8 % [95/107] pacientov, u ktorých nedošlo k relapsu v období
s vysadenou liečbou). Bezpečnostný profil počas pokračujúcej liečby bol podobný ako pred vysadením.
Pri hodnotení indexu DLQI (Dermatology Life Quality Index) sa preukázali významné zlepšenia
v týždni16 v porovnaní so stavom na začiatku liečby a s placebom (štúdie I a II) a MTX (štúdia II). Zlepšenia vo fyzickej a mentálnej zložke súhrnných skór SF-36 v porovnaní s placebom v štúdii I boli
tiež významné.
V otvorenej rozšírenej štúdii u pacientov, ktorých dávka bola kvôli odpovedi PASI pod 50 % stupňovaná zo 40 mg každý druhý týždeň na 40 mg týždenne, dosiahlo v 12. týždni 26,4 % (92/349) a v 24. týždni 37,8 % (132/349) pacientov odpoveď PASI 75.
Štúdia III so psoriázou (REACH) porovnávala účinnosť a bezpečnosť adalimumabu v porovnaní
s placebom u 72 pacientov so stredne ťažkou až ťažkou chronickou ložiskovou psoriázou a psoriázou na rukách a/alebo chodidlách. Pacienti dostali úvodnú dávku 80 mg adalimumabu, po ktorej
nasledovala dávka 40 mg každý druhý týždeň (počínajúc prvým týždňom po úvodnej dávke) alebo placebo po dobu 16 týždňov. V týždni 16 dosiahol PGA "čisté" alebo "takmer čisté" pre ruky a/alebo
chodidlá štatisticky signifikantne vyšší podiel pacientov, ktorí dostávali adalimumab v porovnaní
s pacientmi, ktorí dostávali placebo (30,6 % verzus 4,3 %, respektíve [P = 0,014]).
Štúdia IV so psoriázou porovnávala účinnosť a bezpečnosť adalimumabu v porovnaní s placebom
u 217 dospelých pacientov so stredne ťažkou až ťažkou psoriázou nechtov. Pacientom bola podaná úvodná dávka 80 mg adalimumabu, po ktorej nasledovala 40 mg dávka každý druhý týždeň (počínajúc
prvým týždňom po úvodnej dávke) alebo placebo po dobu 26 týždňov, po ktorých nasledovala liečba
adalimumabomv otvorenej fáze štúdie v trvaní ďalších 26 týždňov. Hodnotenie závažnosti psoriázy nechtov zahŕňalo Modifikovaný index závažnosti psoriázy nechtov (Modified Nail Psoriasis Severity Index (mNAPSI)),Celkové hodnotenie psoriázy nechtov na rukách lekárom (Physician’s Global Assessment of Fingernail Psoriasis (PGA-F)) a Index závažnosti psoriázy nechtov (Nail Psoriasis Severity Index (NAPSI)) (pozri tabuľku 16). Adalimumab preukázala liečebný prínos u pacientov so psoriázou nechtov s rôznym rozsahom postihnutia kože (BSA ≥ 10 % (60 % pacientov) a BSA < 10 % a ≥ 5 % (40 % pacientov)).
Tabuľka 16
Účinnosť v štúdii IV so psoriázou v týždni 16, 26 a 52
Koncový ukazovateľ 16. týždeň
placebom kontrolovaná štúdia
26. týždeň placebom kontrolovaná štúdia
52. týždeň otvorená fáza liečby
Placebo
N = 108
Adalimumab
40 mg eow
N = 109
Placebo
N = 108
Adalimumab
40 mg eow
N = 109
Adalimumab
40 mg eow
N = 80
≥ mNAPSI 75 (%) 2,9 26,0a 3,4 46,6a 65,0
PGA-F čisté/minimálne
a ≥ 2 stupne zlepšenia (%) Percentuálna zmena
v celkovom indexe
NAPSI(%)
2,9 29,7a 6,9 48,9a 61,3
-7,8 -44,2 a -11,5 -56,2a -72,2

a p < 0,001, adalimumab
verzus placebo
Pacienti liečení adalimumabompreukázali v 26. týždni štatisticky významné zlepšenie DLQI (Dermatology Life Quality Index) v porovnaní s placebom.
Hidradenitis suppurativa u dospievajúcich
Neuskutočnili sa žiadne klinické skúšania s adalimumabom u dospievajúcich pacientov s HS. Účinnosť adalimumabu pri liečbe dospievajúcich pacientov s HS sa predpovedá na základe preukázanej účinnosti a vzťahu expozície a odpovede u dospelých pacientov s HS a pravdepodobnosti, že priebeh ochorenia, patofyziológia a účinky lieku sú do značnej miery podobné ako u dospelých pacientov s rovnakou úrovňou expozície. Bezpečnosť odporúčanej dávky adalimumabu
v dospievajúcej populácii s HS je založená na bezpečnostnom profile adalimumabu naprieč indikáciami u dospelých i pediatrických pacientov s podobnou alebo vyššou frekvenciou dávok (pozri časť 5.2).
Hidradenitis suppurativa u dospelých
Bezpečnosť a účinnosť adalimumabu boli hodnotené v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách a v otvorenej predĺženej štúdii u dospelých pacientov so stredne ťažkou až ťažkou hidradenitis suppurativa (HS), ktorí netolerovali, mali kontraindikáciu alebo nedostatočnú odpoveď na aspoň 3-mesačnú skúšobnú systémovú antibiotickú terapiu. Pacienti v HS-I a HS-II mali štádium ochorenia II alebo III podľa Hurleyho a mali aspoň 3 abscesy alebo zápalové uzlíky.
V štúdii HS-I (PIONEER I) bolo hodnotených 307 pacientov počas 2 liečebných fáz. Vo fáze A dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0; 80 mg v 2. týždni a 40 mg každý týždeň počínajúc 4. týždňom a končiac 11. týždňom. Súčasné používanie antibiotík v priebehu štúdie nebolo dovolené. Po 12 týždňoch liečby pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do 1 z 3 liečebných skupín (adalimumab
40 mgkaždý týždeň, adalimumab 40 mg každý druhý týždeň alebo placebo od 12. týždňa do
35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny s placebom, dostávali vo fáze B
adalimumab 40 mg každý týždeň.
V štúdii HS-II (PIONEER II) bolo hodnotených 326 pacientov počas 2 liečebných fáz. Vo fáze A
dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0 a 80 mg
v 2. týždni a 40 mg každý týždeňpočínajúc 4. týždňom a končiac 11. týždňom. 19,3 % pacientov
pokračovalo v priebehu štúdie v základnej perorálnej liečbe antibiotikami. Po 12 týždňoch liečby
pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do
1 z 3 liečebných skupín (adalimumab 40 mgkaždý týždeň, adalimumab 40 mg každý druhý týždeň alebo placebo od 12. týždňa do 35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny s placebom, dostávali vo fáze B placebo.
Pacienti, ktorí sa zúčastnili štúdií HS-I a HS-II, boli vhodní na zaradenie do otvorenej predĺženej štúdie, v ktorej bol adalimumab 40 mg podávaný každý týždeň. Priemerná expozícia v celej populácii s adalimumabom bola 762 dní.Počas všetkých 3 štúdií pacienti používali lokálny antiseptický prípravok na každodenné umývanie.
Kl i ni ck á odpoveď
Zníženie zápalových lézií a prevencia zhoršenia abscesov a vytekajúcich fistúl boli hodnotené
pomocou klinickej odpovede pri hidradenitis suppurativa (Hidradenitis Suppurativa Clinical Response
–HiSCR, najmenej 50 % zníženie celkového počtu abscesov a zápalových uzlíkov bez nárastu počtu abscesov a bez nárastu počtu vytekajúcich fistúl v porovnaní s východiskovým stavom). Zníženie bolesti kože súvisiacej s HS bolo hodnotené pomocou číselnej hodnotiacej stupnice u pacientov, ktorí vstúpili do štúdie s počiatočným východiskovým skóre 3 alebo viac na 11-bodovej stupnici.
V 12. týždni významne vyšší podiel pacientov liečených adalimumabom v porovnaní s pacientmi
liečenými placebom dosiahol HiSCR. V 12. týždni významne vyšší podiel pacientov v štúdii HS-II
dosiahol klinicky relevantné zníženie bolesti kože súvisiacej s HS (pozri tabuľku 17). U pacientov liečených adalimumabom sa významne znížilo riziko vzplanutia ochorenia v priebehu prvých 12 týždňov liečby.
Tabuľka 17: Výsledky hodnotenia účinnosti po 12 týždňoch, štúdie HS I a II
Štúdia HS I Štúdia HS II
Placebo
A
dalimumab
40 mg raz
t
ýždenne Placebo
A
dalimumab
40 mg raz
t
ýždenne
Klinická odpoveď pri hidradenitis suppurativa (HiSCR)a
N = 154
40 (26,0 %)
N = 153
64 (41,8 %) *
N = 163
45 (27,6 %)
N = 163
96 (58,9 %) ***
≥ 30 % zníženie bolesti kožeb N = 109
27 (24,8 %)
N = 122
34 (27,9 %)
N = 111
23 (20,7 %)
N = 105
48 (45,7 %) ***
*P< 0,05, ***P <0,001, adalimumab verzus placebo
a →U všetkých randomizovaných pacientov.
b →U pacientov s východiskovou hodnotou bolesti kože súvisiacej s HS ≥ 3, založené na číselnej hodnotiacej stupnici 0 – 10; 0 = žiadna bolesť kože, 10 = najhoršia bolesť kože, akú si dokážete predstaviť.
Liečba adalimumabom 40 mg každý týždeň významne znížila riziko zhoršenia abscesov
a vytekajúcich fistúl. V prvých 12 týždňoch štúdií HS-I a HS-II približne dvakrát vyšší podiel pacientov v skupine s placebom v porovnaní s tými, ktorí boli v skupine liečenej adalimumabom, zaznamenal zhoršenie abscesov (23,0 % verzus 11,4 %) a vytekajúcich fistúl (30,0 % verzus 13,9 %).
Výraznejšie zlepšenia v 12. týždni oproti východiskovému stavu v porovnaní s placebom bolo preukázané v kvalite života súvisiacej so zdravím kože, ktorá bola meraná Dermatologickým indexom kvality života (Dermatology Life Quality Index–DLQI; štúdie HS-I a HS-II), v celkovej spokojnosti pacienta s medikamentóznou liečbou, ktorá bola meraná Dotazníkom na zisťovanie spokojnosti
s liečbou – medikamentózna liečba (TSQM; štúdie HS-I a HS-II), a vo fyzickom zdraví, ktoré bolo merané pomocou skóre súhrnnej hodnoty fyzických komponentov SF-36 (štúdia HS-I).
Spomedzi pacientov, u ktorých bola v 12. týždni zaznamenaná aspoň čiastočná odpoveď na adalimumab 40 mg raz týždenne, bola hodnota HiSCR v 36. týždni vyššia u pacientov, ktorí pokračovali v liečbe adalimumabomraz týždenne, ako u pacientov, u ktorých bola frekvencia dávkovania zredukovaná na každý druhý týždeň alebo u ktorých bola liečba vysadená (pozri tabuľku
18).
Tabuľka 18: Podiel pacientova, ktorí dosiahli HiSCRb v 24. a 36. týždni po zmene liečby
adalimumabomraz týždennev 12. týždni
Placebo (liečba vysadená) N = 73
A
dalimumab
40 mg každý druhý týždeň
 N = 70
A
dalimumab
40 mg
raz týždenne
N = 70
N = 70
A
dalimumab
40 mg
raz týždenne
N = 70

24. týždeň 24 (32,9 %) 36 (51,4 %) 40 (57,1 %)
36. týždeň 22 (30,1 %) 28 (40,0 %) 39 (55,7 %) a→Pacienti, u ktorých bola po 12 týždňoch liečby zaznamenaná aspoň čiastočná odpoveď na adalimumab 40 mg raz týždenne.
b→Pacienti spĺňajúci kritériá protokolu týkajúce sa straty odpovede alebo
žiadneho zlepšenia boli požiadaní, aby ukončili účasť na štúdiách a boli počítaní medzi pacientov bez odpovede.
U pacientov, u ktorých bola zaznamenaná aspoň čiastočná odpoveď v 12. týždni a ktorí dostávali aj naďalej týždennú liečbu adalimumabu, bola hodnota HiSCR v 48. týždni 68,3 % a v 96. týždni
65,1 %. Pri dlhodobejšej týždennej liečbe adalimumabom 40 mg v trvaní 96 týždňov neboli
identifikované žiadne nové bezpečnostné zistenia.
U pacientov, ktorým bola liečba adalimumabom vysadená v 12. týždni v štúdiách HS-I a HS-II, sa hodnota HiSCR 12 týždňov po opätovnom zavedení adalimumabu 40 mg raz týždennevrátila na úrovne podobné tým, ktoré boli pozorované pred vysadením (56,0 %).
Crohnova choroba u pediatrických pacientov
Adalimumab sa hodnotil v multicentrickom, randomizovanom, dvojito zaslepenom klinickom skúšaní zameranom na hodnotenie účinnosti a bezpečnosti úvodnej a udržiavacej liečby dávkami závislými od telesnej hmotnosti (< 40 kg alebo ≥ 40 kg) u 192 pediatrických jedincov vo veku od 6 do 17 rokov (vrátane) s mierne ťažkou až ťažkou Crohnovou chorobou (CD), definovanou indexom aktivity Crohnovej choroby u detí (Pediatric Crohn’s Disease Activity Index- PCDAI) so skóre > 30. U týchto jedincov musela zlyhať konvenčná liečba CD (vrátane kortikosteroidov a/alebo imunomodulátorov). Jedinci mohli tiež predtým stratiť odpoveď na infliximab alebo ho netolerovať.
Všetci jedinci dostávali v otvorenej fáze úvodnú liečbu dávkou založenou na ich východiskovej
telesnej hmotnosti: jedinci ≥ 40 kg 160 mg v týždni 0 a 80 mg v týždni 2, prípadne jedinci< 40 kg
80 mg a 40 mg.
V týždni 4 boli jedinci randomizovaní 1:1 na základe ich telesnej hmotnosti v tom čase buď na dávkovací režim s nízkou dávkou alebo štandardnou udržiavacou dávkou, ako je uvedené v tabuľke
19.
Hm
o
t
nosť
pacienta
T
abuľka 19
 U
držiavací režim
N
í
z
ka dávka Štandardná dávka
U
držiavací režim
N
í
z
ka dávka Štandardná dávka
< 40 kg 10 mg každý druhý týždeň
≥ 40 kg 20 mg každý druhý týždeň
20 mg každý druhý týždeň
40 mg každý druhý týždeň
Výsl edky účinnost i
Primárny koncový ukazovateľ v štúdii bola klinická remisia v týždni 26, definovaná ako skóre PCDAI
≤ 10.
Klinická remisia a klinická odpoveď na liečbu (definovaná ako zníženie skóre PCDAI o najmenej
15 bodov v porovnaní s východiskovou hodnotou) sú uvedené v tabuľke 20. Percentá vysadenia kortikosteroidov alebo imunomodulátorov sú uvedené v tabuľke 21.
T
abuľka 20
P
ediatrická CD štúdia
K
l
i
nická remisia PCDAI a odpoveď
T
ýždeň 26
Štandardná dávka
40/20 mg každý
druhý týždeň
 N = 93
N
í
z
ka dávka
20/10 mg každý
H
odnota p
N = 93
N
í
z
ka dávka
20/10 mg každý
H
odnota p*
druhý týždeňN = 95
Klinická remisia 38,7 % 28,4 % 0,075
Klinická odpoveď 59,1 % 48,4 % 0,073
Týždeň 52Klinická remisia 33,3 % 23,2 % 0,100
Klinická odpoveď 41,9 % 28,4 % 0,038
* porovnanie hodnoty p štandardná dávka verzus nízka dávka
 Tabuľka 21Pediatrická CD štúdiaVysadenie kortikosteroidov alebo imunomodulátorov a remisia fistúl
Tabuľka 21Pediatrická CD štúdiaVysadenie kortikosteroidov alebo imunomodulátorov a remisia fistúl
Štandardná dávka
40/20 mg každý
druhý týždeň
N
í
z
ka dávka
20/10 mg každý druhý týždeň
H
odnota p
1
V
ysadenie kortikosteroidov N = 33 N = 38
Týždeň 26 84,8 % 65,8 % 0,066
Týždeň 52 69,7 % 60,5 % 0,420
Vysadenie imunomodulátorov2 N = 60 N = 57
Týždeň 52 30,0 % 29.8% 0,983
Remisia fistúl3 N = 15 N = 21
Týždeň 26 46,7 % 38,1 % 0,608
Týždeň 52 40,0 % 23,8 % 0,303
1 porovnanie hodnoty p štandardná dávka verzus nízka dávka
2 imunosupresívna liečba mohla byť zastavená len v týždni 26 alebo neskôr na základe uváženia skúšajúceho lekára o tom, či jedinec spĺňa kritéria klinickej odpovede
3 definované ako uzavretie všetkých fistúl, ktoré secernovali na začiatku liečby, prinajmenšom
pri 2 po sebe nasledujúcich návštevách po východiskovej návšteve
Štatisticky významné zvýšenia (zlepšenie) indexu telesnej hmotnosti a rýchlosti rastu
z východiskového stavu do týždňa 26 a 52 boli pozorované u oboch liečebných skupín.
Štatisticky a klinicky významnézlepšenia v porovnaní s východiskovým stavom boli pozorované
u oboch liečebných skupín aj pre parametre kvality života (vrátane IMPACT III).
Sto pediatrických pacientov (n = 100) zo štúdie s Crohnovou chorobou pokračovalo v otvorenej dlhodobej predĺženej štúdii. Po 5 rokoch liečby adalimumabom pretrvala klinická remisia u 74,0 % (37/50) z 50 pacientov, ktorí zotrvali v štúdiia u 92,0 % (46/50) pacientov pretrvala klinická odpoveďpodľa PCDAI.
Crohnova choroba u dospelých
Bezpečnosť a účinnosť adalimumabu sa hodnotila u viac ako 1500 pacientov s miernou až ťažkou aktívnou Crohnovou chorobou (index aktivity Crohnovej choroby: Crohn’s Disease Activity Index- CDAI ³ 220 a £ 450) v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách. Boli povolené súbežné stabilné dávky aminosalicylátov, kortikosteroidov a/alebo imunomodulátorov a 80 % pacientov pokračovalo v užívaní najmenej jedného z týchto liekov.
Indukcia klinickej remisie (definovaná ako CDAI < 150) sa hodnotila v dvoch štúdiách, CD štúdii I (CLASSIC I) a v CD štúdii II (GAIN). V CD štúdii I boli 299 pacienti bez predchádzajúcej liečby antagonistami TNF randomizovaní do jednej zo štyroch liečebných skupín; placebo v týždňoch 0 a 2,
160 mg adalimumabu v týždni 0 a 80 mg v týždni 2, 80 mg v týždni 0 a 40 mg v týždni 2, a 40 mg
v týždni 0 a 20 mg v týždni 2. V CD štúdii II bolo 325 pacientov, ktorí stratili schopnosť odpovedať alebo mali neznášanlivosť infliximabu, randomizovaných tak, že dostávali buď 160 mg adalimumabu v týždni 0 a 80 mg v týždni 2 alebo placebo v týždňoch 0 a 2. Primárne na liečbu neodpovedajúci pacienti boli zo štúdií vylúčení, a preto neboli ďalej hodnotení.
Pretrvávanie klinickej remisie sa hodnotilo v CD štúdii III (CHARM). V otvorenej fáze CD štúdie III
dostalo 854 pacientov 80 mg v týždni 0 a 40 mg v týždni 2. V týždni 4 boli pacienti v štúdii
s celkovým trvaním 56 týždňov randomizovaní do skupín so 40 mg každý druhý týždeň, 40 mg každý týždeň alebo placebo. Pacienti s klinickou odpoveďou na liečbu v týždni 4 (pokles v CDAI ≥ 70) boli
stratifikovaní a analyzovaní oddelene od tých, ktorí boli do týždňa 4 bez klinickej odpovede.
Znižovanie kortikosteroidu bolo povolené po týždni 8.
Indukcia remisie a percento odpovede v CD štúdii I a CD štúdii II sú uvedené v tabuľke 22.
T
abuľka 22
Indukcia klinickej remisie a odpovede
(
percento pacientov)
C
D štúdia I: Pacienti doteraz neliečení
i
n
fli
x
i
m
abom
C
D štúdia II: Pacienti
s predchádzajúcou liečbou
i
n
fli
x
i
m
abom
Týždeň 4
Placebo
N = 74
Adalimumab
80/40 mg
N = 75
Adalimumab
160/80 mg N
= 76
Placebo
N = 166
Adalimumab
160/80 mg
N =59
Klinická remisia 12 % 24 % 36 %* 7 % 21 %*
Klinická odpoveď
(CR-100)
24 % 37 % 49 %** 25 % 38 %**

Všetky hodnoty p sú párové porovnania adlimumabu verzus placebo
* p < 0,001
** p < 0,01
V oboch úvodných dávkovacích režimoch, 160/80 mg a 80/40 mg, sa do týždňa 8 pozorovali podobné
počty remisií a nežiaduce účinky boli častejšie pozorované v skupine so 160/80 mg.
V CD štúdii III malo 58 % (499/854) pacientov v týždni 4 klinickú odpoveď a boli hodnotení v primárnej analýze. Z tých s klinickou odpoveďou na liečbu v týždni 4 bolo 48 % predtým vystavených liečbe iným antagonistom TNF. Doba trvania remisie a počty pacientov s odpoveďou na liečbu sú uvedené v tabuľke 23. Výsledky klinickej remisie zostali pomerne nemenné bez ohľadu na predchádzajúcu expozíciu antagonistovi TNF.
Počet hospitalizácií a chirurgických zákrokov súvisiacich s ochorením bol v 56. týždni štatisticky
signifikantne znížený pri používaní adalimumabu v porovnaní s placebom.
T
abuľka 23
P
r
etrvávanie klinickej remisie a odpovede
(
percento pacientov)
 Placebo
40 mg
adalimumabu každý druhý týždeň
40 mg adalimumabu každý týždeň
Placebo
40 mg
adalimumabu každý druhý týždeň
40 mg adalimumabu každý týždeň
T
ýždeň 26 N=170 N=172 N=157
Klinická remisia 17 % 40 %* 47 %*
Klinická odpoveď (CR-100) 27 % 52 %* 52 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
3 % (2/66) 19 % (11/58)** 15 % (11/74)**
T
ýždeň 56 N=170 N=172 N=157
Klinická remisia 12 % 36 %* 41 %*
Klinická odpoveď (CR-100) 17 % 41 %* 48 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
5 % (3/66) 29 % (17/58)* 20 % (15/74)**
* p < 0,001 pre adalimumab verzus placebo, porovnania párových hodnôt
** p < 0,02 pre adalimumab verzusplacebo, porovnania párových hodnôt
a u tých, ktorí užívali kortikosteroidy na začiatku liečby
Z pacientov, ktorí boli v týždni 4 bez odpovede, do týždňa 12 odpovedalo 43 % pacientov liečených
adalimumabom v porovnaní s 30 % pacientov, ktorým sa podávalo placebo. Tieto výsledky naznačujú, že niektorí pacienti, ktorí neodpovedajú na liečbu do týždňa 4, majú prínos z pokračujúcej udržiavacej
liečby do týždňa 12. Liečba, pokračujúca po 12. týždni, neviedla k signifikantne vyššiemu počtu
odpovedí (pozri časť 4.2).
117 z 276 pacientov zo štúdie CD I a 272 zo 777 pacientov zo štúdií CD II a III bolo sledovaných počas otvorenej liečby adalimumabom minimálne 3 roky. 88 pacientov z CD I a 189 pacientov z CD II a III pokračovalo v liečbe až do klinickej remisie. Klinická odpoveď (CR-100) sa udržala
u 102 pacientov z CD I a 233 pacientov z CD II a III.
Kval it a ži vot a
V CD štúdii I a CD štúdii II sa v týždni 4 dosiahlo štatisticky signifikantné zlepšenie celkového skóre
v dotazníku pre zápalového ochorenia čreva (Inflammatory bowel disease questionnaire -IBDQ)
u pacientov randomizovaných do skupín adalimumab 80/40 mg a adalimumab 160/80 mg v porovnaní
s placebom a v týždňoch 26 a 56 sa pozorovalo v CD štúdii III vo všetkých skupinách liečených
adalimumabom v porovnaní so skupinou s placebom.
Uveitída u pediatrických pacientov
Bezpečnosť a účinnosť adalimumabu sa hodnotila v randomizovanej, dvojito zaslepenej, kontrolovanej štúdii s účasťou 90 pediatrických pacientov vo veku od 2 do < 18 rokov s aktívnou neinfekčnou anteriórnou uveitídou spojenou s JIA, ktorí nereagovali na najmenej 12-týždňovú liečbu metotrexátom. Pacienti dostávali buď placebo alebo 20 mg adalimumabu (ak < 30 kg), alebo 40 mg adalimumabu (ak ≥ 30 kg) každý druhý týždeň v kombinácii s východiskovou dávkou metotrexátu.
Primárnym koncovým ukazovateľom bol „čas do zlyhania liečby“. Kritériami zlyhania liečby boli zhoršenie alebo trvalé nezlepšenie očného zápalu, čiastočné zlepšenie s rozvojom trvalých očných komorbidít alebo zhoršenie očných komorbidít, nepovolené používanie súbežne podávaných liekov a prerušenie liečby na dlhší čas.
Kl i ni ck á odpoveď
Adalimumab významne oddialil čas do zlyhania liečby v porovnaní s placebom (pozri obrázok 1,
P < 0,0001 z logaritmického testu poradí).Medián času do zlyhania liečby bol 24,1 týždňa u pacientov liečených placebom, zatiaľ čo medián času do zlyhania liečby u pacientov liečených adalimumabom nebolo možné stanoviť, pretože zlyhanie liečby zaznamenalo menej ako polovica týchto pacientov. Adalimumab výrazne znížil riziko zlyhania liečby o 75 % v porovnaní s placebom, ako je to vidieť
z pomeru rizika (HR = 0,25 [95 % IS: 0,12; 0,49]).
Obrázok 1: Kaplanove-Meierove krivky znázorňujúce čas do zlyhania liečby v štúdii uveitídyu pediatrických pacientov
 ČAS (TÝŽDNE)
ČAS (TÝŽDNE) Liečba

Placebo Adalimumab
Poznámka: P = placebo (počet rizikových účastníkov); A = Adalimumab (počet rizikových účastníkov).
Uveitída u dospelých pacientovBezpečnosť a účinnosť adalimumabu sa hodnotili u dospelých pacientov s neinfekčnou intermediárnou a posteriórnou uveitídou a panuveitídou, s vylúčením pacientov s izolovanou anteriórnou uveitídou, v dvoch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách (UV I a II). Pacienti dostávali placebo alebo adalimumab v úvodnej dávke 80 mg, potom nasledovala dávka 40 mg každý druhý týždeň po uplynutí jedného týždňa od úvodnej dávky. Povolené bolo súčasné podávanie stabilných dávok jedného nebiologického imunosupresíva.
V štúdii UV I sa hodnotilo 217 pacientov s aktívnou uveitídou napriek liečbe kortikosteroidmi
(perorálny prednizón v dávke 10 až 60 mg/deň). Na začiatku štúdie dostávali všetci pacienti
2-týždňovú štandardizovanú dávku prednizónu 60 mg/deň, potom nasledoval harmonogram povinného znižovania dávky s úplným vysadením kortikosteroidov do 15. týždňa.
V štúdii UV II sa hodnotilo 226 pacientov s neaktívnou uveitídou vyžadujúcich chronickú liečbu kortikosteroidmi (perorálny prednizón v dávke 10 až 35 mg/deň) na začiatku liečby na kontrolu ich ochorenia. Pacienti následne absolvovali povinný harmonogram znižovania dávky s úplným vysadením kortikosteroidov do 19. týždňa.
Primárnym koncovým ukazovateľom v oboch štúdiách bol „čas do zlyhania liečby“. Zlyhanie liečby bolo definované ako viaczložkový výsledok založený na zápalových chorioretinálnych a/alebo zápalových retinálnych vaskulárnych léziách, hodnotení buniek prednej komory (anterior chamber- AC), hodnotení zákalu sklovca (vitreous haze- VH) a najlepšej korigovanej ostrosti videnia (best corrected visual acuity- BCVA).
Kl i ni ck á odpoveď
Výsledky oboch štúdií preukázali štatisticky významné zníženie rizika zlyhania liečby u pacientov
liečených adalimumabom oproti pacientom, ktorí dostávali placebo (pozri tabuľku 24). V oboch
štúdiách sa preukázal skorý a pretrvávajúci účinok adalimumabu na mieru zlyhania liečby v porovnaní
s placebom (pozri obrázok 2).
Tabuľka 24
Čas do zlyhania liečby v štúdiách UV I a UV II
A
nalýza
L
i
ečba
N Zlyhanie
N (%)
Medián času do
z
l
yhania
(m
e
siace)
H
R
a
IS 95 %
pre HR
a
H
odnota
P
b

 Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Primárna analýza (ITT)
Placebo 107 84 (78,5) 3,0 -- -- --
Adalimumab 110 60 (54,5) 5,6 0,50 0,36; 0,70 < 0,001 Čas do zlyhania liečby v 2. týždni alebo neskôr v štúdii UV IIPrimárna analýza (ITT)
Placebo 111 61 (55,0) 8,3 -- -- --
Adalimumab 115 45 (39,1) NOc 0,57 0,39; 0,84 0,004 Poznámka: Ako udalosť sa započítavalo zlyhanie liečby v 6. týždni alebo neskôr (štúdia UV I) alebo
v 2. týždni alebo neskôr (štúdia UV II). Prípady ukončenia liečby z iných dôvodov ako zlyhanie liečby
sa vyradili v čase ukončenia.
1. HR adalimumabu oproti placebu z regresného modelu relatívneho rizika s liečbou ako faktorom.
2. 2-stranná hodnota
p z logaritmického testu poradí.
3. NO = nemožno odhadnúť. Udalosť sa vyskytla u menej než polovice rizikových účastníkov.
O
brázok 2: Kaplanove-Meierove krivky znázorňujúce čas do zlyhania liečby v 6. týždni alebo
neskôr (štúdia UV I) alebo v 2. týždni alebo neskôr (štúdia UV II)

ČAS (MESIACE)

Štúdia UV I Liečba

Placebo

Adalimumab
ČAS (MESIACE)
Štúdia UV II Liečba

Placebo

Adalimumab
Poznámka: P# = placebo (počet udalostí/počet rizikových účastníkov); A# = Adalimumab (počet udalostí/počet rizikových účastníkov).
V štúdii UV I sa pozorovali štatisticky významné rozdiely v prospech adalimumabu v porovnaní s placebom pre každú zložku zlyhania liečby. V štúdii UV II sa pozorovali štatisticky významné rozdiely len v prípade ostrosti videnia, ale ostatné zložky boli číselne v prospech adalimumabu.
Zo 417 pacientov zahrnutých do nekontrolovaného dlhodobého predĺženia štúdií UV I a UV II bolo 46
pacientov považovaných za nevhodných (napr. vyvinuli sa u nich sekundárne komplikácie k
diabetickej retinopatii v dôsledku operácie sivého zákalu alebo vitrektómii) a boli vylúčení z primárnej analýzy účinnosti. Z 371 zostávajúcich pacientov 276 hodnotiteľných pacientov dosiahlo 78 týždňov otvorenej liečby adalimumabom. Z pozorovaných údajov vyplýva, že 222 (80,4 %) pacientov bolo
v pokojovej fáze (bez aktívnych zápalových lézií, stupeň hodnotenia buniek prednej komory ≤ 0,5 +, stupeň hodnotenia zákalu sklovca ≤ 0,5 +) so súčasnou dávkou steroidov ≤ 7,5 mg denne a 184
(66,7 %) sa nachádzalo v pokojovej fáze bez steroidov. Hodnota BCVA sa v týždni 78 buď zlepšila,
alebo udržala (zhoršenie o < 5 písmen) u 88,4 % očí. Spomedzi pacientov, ktorí prerušili účasť na štúdii pred týždňom 78, 11 % prerušilo v dôsledku nežiaducich účinkov a 5 % v dôsledku
nedostatočnej odpovede na liečbu adalimumabom.
Kval it a ži vot a
V oboch klinických štúdiách sa merali výsledky súvisiace s funkciou videnia hlásené pacientmi
s použitím dotazníka NEI VFQ-25. Výsledky adalimumabu boli číselne priaznivejšie pre väčšinu vedľajších skóre so štatisticky významnými priemernými rozdielmi pre celkové videnie, bolesť oka,
videnie na blízko, duševné zdravie a celkové skóre v štúdii UV I a pre celkové videnie a duševné
zdravie v štúdii UV II. Účinky súvisiace s videním neboli číselne priaznivejšie pre adalimumab
v prípade farebného videnia v štúdii UV I a farebného videnia, periférneho videnia a videnia na blízko
v štúdii UV II.
Imunogenicita
Počas liečby adalimumabom sa môžu tvoriť protilátky proti adalimumabu. Tvorba protilátok proti
adalimumabu je spojená so zvýšeným klírensom a zníženou účinnosťou adalimumabu. Nie je zrejmý vzťah medzi prítomnosťou protilátok proti adalimumabu a výskytom nežiaducich účinkov.
Pediatrická populácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s s referenčným
liekom obsahujúcim adalimumabv jednej alebo viacerých podskupinách pediatrickej populácie
s ulceróznou kolitídou, informácie o pediatrickom použití, pozri časť 4.2.
5.2 Farmakokinetické vlastnosti
Absorpcia a distribúcia
Po podávaní dávky 24 mg/m2 (až do maxima 40 mg) subkutánne každý druhý týždeň pacientom
s polyartikulárnou juvenilnou idiopatickou artritídou (JIA), ktorí mali 4 až 17 rokov, bola najnižšia priemerná sérová koncentrácia adalimumabu v rovnovážnom stave (hodnoty merané v týždňoch 20 až
48) 5,6 ± 5,6 μg/ml (102 % CV) pri adalimumabe bez súbežného metotrexátu a 10,9 ± 5,2 μg/ml
(47,7 % CV) so súbežným metotrexátom.
U pacientov s polyartikulárnou JIA, ktorí boli vo veku 2 až< 4 roky alebo 4 roky a viac a mali hmotnosť < 15 kg, ktorým bol podávaný adalimumab 24 mg/m2, boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 6,0 ± 6,1 µg/ml (101 % CV) pri adalimumabe bez súbežného metotrexátu a 7,9 ± 5,6 µg/ml (71,2 % CV) so súbežným metotrexátom.
Po podávaní dávky 24 mg/m² (až domaxima40 mg)
subkutánnekaždýdruhýtýždeňpacientoms artritídou spojenou s entezitídou, ktorí mali 6 až 17 rokov,
boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 8,8 ± 6,6 mg/mlpri adalimumabe bez súbežného metotrexátua 11,8 ± 4,3 mg/ml so súbežným metotrexátom (hodnoty meranév 24. týždni).
Po podávaní dávky 0,8 mg/kg (až do maxima 40 mg) subkutánne každý druhý týždeň pediatrickým pacientom s chronickou ložiskovou psoriázou bola priemerná najnižšia (± SD) sérová koncentrácia adalimumabu v rovnovážnom stave približne 7,4 ± 5,8 µg/ml (79 % CV).
Expozícia adalimumabu u dospievajúcich pacientov s HS sa predpovedala s použitím populačného farmakokinetického modelovania a simulácie na základe farmakokinetických parametrov zistených naprieč indikáciami u iných pediatrických pacientov (s pediatrickou psoriázou, juvenilnou idiopatickou artritídou, pediatrickou Crohnovou chorobou a artritídou spojenou
s entezitídou). Odporúčaná dávkovacia schéma u dospievajúcich s HS je 40 mg každý druhý týždeň. Pretože expozícia adalimumabu môže byť ovplyvnená telesnou hmotnosťou, u dospievajúcich
s vyššou telesnou hmotnosťou a nedostatočnou odpoveďou môže byť prospešné dávkovanie 40 mg
každý týždeň, ktoré je odporúčané pre dospelých.
V otvorenej liečbe detských pacientov so stredne ťažkou až ťažkou CD bola úvodná dávka
adalimumabu 160/80 alebo 80/40 mg v týždni 0 a 2, a to v závislosti od hranice telesnej
hmotnosti40 kg. V týždni 4 boli pacienti randomizovaní 1:1 do skupín s udržiavacou liečbou buď so štandardnou dávkou (40/20 mg každý druhý týždeň (every other week - eow)) alebo nízkou dávkou
(20/10 mg každý druhý týždeň (every other week - eow)) v závislosti od telesnej hmotnosti. Priemerné
najnižšie (± SD) sérové koncentrácie adalimumabu dosiahnuté v týždni 4 boli 15,7 ± 6,6 mg/ml u pacientov ≥ 40 kg (160/80 mg) a 10,6 ± 6,1 mg/ml u pacientov < 40 kg (80/40 mg).
U pacientov, ktorí ostali na randomizovanej liečbe, boli v týždni 52 priemerné najnižšie (± SD) koncentrácie adalimumabu 9,5 ± 5,6 mg/ml pre skupinu so štandardnou dávkou a 3,5 ± 2,2 mg/ml pre skupinu s nízkou dávkou. Priemerné najnižšie koncentrácie sa udržali u pacientov, ktorí pokračovali v liečbe adalimumabom každý druhý týždeň počas 52 týždňov. U pacientov, u ktorých sa dávka zvýšila z režimu každý druhý týždeň na raz týždenne boli v týždni 52 priemerné (± SD) sérové koncentrácie adalimumabu 15,3 ± 11,4 μg/ml (40/20 mg, raz týždenne) a 6,7 ± 3,5 μg/ml (20/10 mg, raz týždenne).
Expozícia adalimumabu u pediatrických pacientov s uveitídou sa predpovedala s použitím
populačného farmakokinetického modelovania a simulácie na základe farmakokinetických parametrov zistených naprieč indikáciami u iných pediatrických pacientov (s pediatrickou psoriázou, juvenilnou
idiopatickou artritídou, pediatrickou Crohnovou chorobou aartritídou spojenou s entezitídou). Nie sú
dostupné žiadne klinické údaje o expozícii týkajúce sa použitia úvodnej dávky u detí < 6 rokov.
Predpokladané expozície naznačujú, že za neprítomnosti metotrexátu môže viesť úvodná dávka
k počiatočnému zvýšeniu systémovej expozície.
Vzťahexpozícia–odpoveďu pediatrickejpopulácie
Na základe údajov z klinických štúdií u pacientov s JIA (pJIA a ERA) sa stanovil vzťah expozícia –
odpoveď medzi plazmatickými koncentráciami a odpoveďou PedACR 50. Zrejmá plazmatická koncentrácia adalimumabu, ktorá produkuje polovicu maximálnej pravdepodobnosti odpovede PedACR 50 (EC50), bola 3 μg/ml (95 % IS: 1 - 6 μg/ml).
Vzťahy expozícia – odpoveď medzi koncentráciou adalimumabu a účinnosťou u pediatrických pacientov s ťažkou chronickou ložiskovou psoriázou boli stanovené pre PASI 75 resp. PGA čisté alebo minimálne. Hodnoty PASI 75 aj PGA čisté alebo minimálne rástli so zvyšujúcimi sa koncentráciami adalimumabu s podobnou zrejmou EC50 približne 4,5 μg/ml (95 % IS 0,4 - 47,6 resp.
1,9 - 10,5).
Dospelí
Po subkutánnom podaní jednorazovej dávky 40 mg bola absorpcia a distribúcia adalimumabu pomalá.
Maximálne sérové koncentrácie sa dosiahli asi 5 dní po podaní. Priemerná absolútna biologická dostupnosť adalimumabu, na základe troch štúdií, bola 64 % po podaní jednorazovej subkutánnej
dávky 40 mg. Po jednorazových intravenóznych dávkach v rozpätí od 0,25 do 10 mg/kg boli
koncentrácie lieku úmerné dávke. Po dávkach 0,5 mg/kg (~ 40 mg) bol klírens v rozsahu
od 11 do 15 ml/hodinu, distribučný objem (Vss) v rozsahu od 5 do 6 litrov a priemerný polčas terminálnej fázy bol približne dva týždne. Koncentrácie adalimumabu v synoviálnej tekutine, stanovené u niekoľkých pacientov s ťažkou reumatoidnou artritídou, boli v rozsahu od 31 do 96 % sérových koncentrácií.
Po subkutánnom podávaní 40 mg adalimumabu každý druhý týždeň u dospelých pacientov
s reumatoidnou artritídou (RA) boli najnižšie priemerné rovnovážne koncentrácie približne 5 mg/ml (bez súčasnej liečby metotrexátom) a 8 až 9 mg/ml (pri súčasnej liečbe metotrexátom). Najnižšie sérové hladiny adalimumabu v rovnovážnom stave sa zvyšovali približne úmerne s dávkou
pri subkutánnom podávaní 20, 40 a 80 mg každý druhý týždeň aj každý týždeň.
U dospelých pacientov so psoriázou bola počas podávania adalimumabu 40 mg každý druhý týždeň
v monoterapii priemerná najnižšia rovnovážna koncentrácia 5 μg/ml.
U dospelých pacientov s hidradenitis suppurativa sa pri dávke 160 mg adalimumabu v týždni 0 nasledovanej dávkou 80 mg v 2. týždni dosiahla najnižšia hodnota sérových koncentrácií adalimumabu približne od 7 do 8 μg/ml v 2. a 4. týždni. Priemerné minimálne rovnovážne hladiny v týždňoch 12 až 36 boli približne 8 až 10 μg/ml pri dávke 40 mg adalimumabu každý týždeň.
U pacientov s Crohnovou chorobou, ktorým sa podávala úvodná dávka 80 mg adalimumabu v týždni
0, po ktorej nasledovala dávka 40 mg adalimumabu v týždni 2, sa dosiahli najnižšie sérové
koncentrácie adalimumabu približne 5,5 mg/ml počas obdobia indukcie. Úvodnou dávkou 160 mg adalimumabu v týždni 0, po ktorej nasledovala dávka 80 mg adalimumabu v týždni 2, sa dosiahli najnižšie sérové koncentrácie adalimumabu približne 12 mg/ml počas obdobia indukcie. Priemerne najnižšie hladiny v rovnovážnom stave s hodnotou približne 7 mg/ml sa pozorovali u pacientov s Crohnovou chorobou, ktorým sa podávala udržovacia dávka 40 mg adalimumabu každý druhý týždeň.
U dospelých pacientov s uveitídou, ktorým sa podávala úvodná dávka 80 mg adalimumabu v týždni 0, po ktorej nasledovala dávka 40 mg adalimumabu každý druhý týždeň od 1. týždňa, sa zistili priemerné koncentrácie v rovnovážnom stave približne 8 až 10 mg/ml.
Populačné farmakokinetické a farmakokinetické/farmakodynamické modelovanie a simulácia predpovedali porovnateľnú expozíciu a účinnosť adalimumabu u pacientov liečených 80 mg každý druhý týždeň v porovnaní so 40 mg každý týždeň (vrátane dospelých pacientov s RA, HS, UC, CD alebo Ps, dospievajúcich pacientov s HS a pediatrických pacientov ≥ 40 kg s CD).
Eliminácia
Populačná farmakokinetická analýza údajov od viac ako 1300 pacientov s RA odhalila tendenciu
k vyššiemu zdanlivému klírensu adalimumabu so zvyšujúcou sa telesnou hmotnosťou. Po úprave vzhľadom na hmotnostné rozdiely, pohlavie a vek sa preukázal minimálny vplyv na klírens
adalimumabu. Sérové hladiny voľného adalimumabu (neviazaného na protilátky proti adalimumabu,
anti-adalimumab antibodies- AAA) boli nižšie u pacientov s merateľným AAA.
Porucha funkcie pečene alebo obličiek
Adalimumab nebol študovaný u pacientov s poruchou funkcie pečene alebo obličiek.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje, na základe štúdií toxicity po jednorazovej dávke, toxicity po opakovanom
podávaní a genotoxicity, neodhalili žiadne osobitné riziko pre ľudí.
V štúdii embryofetálnej toxicity/perinatálneho vývoja, uskutočnenej u opíc rodu Cynomolgus, ktorým sa podávali dávky 0, 30 a 100 mg/kg (9 – 17 opíc/skupina), sa nezistil žiadny dôkaz poškodenia plodov, spôsobený adalimumabom. Ani štúdie karcinogenity ani štandardné hodnotenie fertility
a postnatálnej toxicity adalimumabu sa neuskutočnili pre nedostatok vhodných modelov pre protilátku
s obmedzenou skríženou reaktivitou na TNF hlodavcov a na rozvoj neutralizačných protilátok
u hlodavcov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Manitol
Chlorid sodný
Monohydrát kyseliny citrónovej
Trinátriumcitrát
Polysorbát 80
Hydroxid sodný (na úpravu pH)
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke. Injekčnú liekovku uchovávajte
vo vonkajšej škatuľke na ochranu pred svetlom.
Idacio 40 mg/0,8 ml injekčný roztok na pediatrické použitiesa môže uchovávať pri teplote do maximálne 25°C po dobu až 14 dní. Injekčná liekovka sa musí chrániť pred svetlom a zlikvidovať, ak sa nepoužije v priebehu tohto 14-dňového obdobia.
6.5 Druh obalu a obsah balenia
Idacio 40 mg/0,8 ml injekčnýroztoknapediatricképoužitie v injekčnejliekovkenajednorazovépoužitie
0,8 ml roztoku v injekčnej liekovke (sklo typu I) s gumovou zátkou (syntetická guma) a hliníkovým
krytom.
Každá škatuľka obsahuje 1 injekčnú liekovku, 1 sterilnú injekčnú striekačku, 1 sterilnú ihlu,1 adaptér na injekčnú liekovku a 2 alkoholom napustené tampóny.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Fresenius Kabi Deutschland GmbH Else-Kröner-Straße 1
61352 Bad Homburg v.d. Höhe
Nemecko
8. REGISTRAČNÉ ČÍSLO
EU/1/19/1356/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 2. apríl 2019
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Návod na použitie
Idacio
Jednorazová naplnená injekčná striekačka (adalimumab) na podkožnú injekciu
40mg
Poznámka: obrázky sú len na ilustračné účelyPred použitím Idacia v naplnenej injekčnej striekačke si pozorne prečítajte celý návod na použitie. Dôležité informácie Idacio v naplnenej injekčnej striekačke použite iba vtedy, ak vás zdravotnícky pracovník zaškolil
o tom, ako sa má naplnená injekčná striekačka správne použiť.
Idacio je liek v naplnenej injekčnej striekačke určený len na jednorazovej použitie.
Idacio v naplnenej injekčnej striekačke má priehľadný bezpečnostný chránič ihly, ktorý po podaní
injekcie prekryje ihlu.
Deti do 12 rokov si nesmú sami podávať injekciu, injekciu im musí podať zaškolený dospelý.
Idacio v naplnenej injekčnej striekačke a kontajner na ostrý injekčný odpad uchovávajte mimo dohľadu a dosahu detí.
Netraste. Naplnená injekčná striekačka a liek sa môžu trasením poškodiť.
Nepoužívajte Idacio v naplnenej injekčnej striekačke, ak je roztok zakalený alebo sfarbený alebo obsahuje častice či vločky. Roztok má byť číry a bezfarebný.
Nepokúšajte saaktivovať priehľadný bezpečnostný chránič ihly pred podaním injekcie.
Nedávajteprsty na miesto otvárania priehľadného bezpečnostného chrániča ihly.
Nepoužívajte Idacio v naplnenej injekčnej striekačke, ak bola zmrazený alebo ponechaný na priamo slnečnom svetle.
Nepoužívajte Idacio v naplnenej injekčnej striekačke, ak vám naplnená injekčná striekačka spadla alebo sa rozdrvila, pretože môže byť poškodená, aj keď nalomenie nemusí byť viditeľné.
Použite novú naplnenú injekčnú striekačku.
Informácie o uchovávaní Naplnenú injekčnú striekačku uchovávajte v originálnej vonkajšej škatuľke na ochranu pred
svetlom.
Naplnenú injekčnú striekačku uchovávajte v chladničke medzi 2 °C až 8 °C.
V prípade potreby, napríklad pri cestovaní, sa môže jednorazová naplnená injekčná striekačka uchovávať pri izbovej teplote až do 14 dní.
O
boznámte sa s Idaciom v naplnenej injekčnej liekovke
Pred použitím Priehľadný bezpečnostný chránič

ihly Piest
Predný náhľad Kryt ihly Valec striekačky naplnený roztokom (vnútri)
Zadný náhľad
Po použití


Priehľadný bezpečnostný chránič ihly Piest
Prekrytie ihly Pružina bezpečnostného chrániča ihly
Krok 1
Príprava na podanie injekcie
Každá škatuľka Idacia v naplnenej injekčnej striekačke obsahuje dve alebo šesť injekčných
striekačiek.
1.1 Pripravte si čistú rovnú plochu, ako napríklad stôl alebo iná pracovná plocha, na dôkladne osvetlenom mieste.
1.2 Taktiež budete potrebovať (obrázok A):
alkoholom napustený tampón (je súčasťou balenia)
vatový tampón alebo gázu a
kontajner na ostrý injekčný odpad.
Kontajner si otvorte, aby bol pripravený na použitie.
 Obrázok A1.3
Obrázok A1.3 Vyberte škatuľku z chladničky (obrázok B).
1.4 Na bočnej strane škatuľky skontrolujte dátum exspirácie (obrázok B).
Upozornenie: Nepoužívajte po uplynutí dátumu exspirácie.
EXP: MM/YYYYObrázok B1.5 Varovanie: Injekčnú stiekačku
nevyberajte uchopením za piest alebo za kryt ihly. Takéto zaobchádzanie by mohlo injekčnú striekačku poškodiť alebo aktivovať priehľadný bezpečnostný chránič ihly.
Vyberte injekčnú liekovku z originálnej škatuľky:
uchopte injekčnú striekačku dvoma prstami v strede priehľadného bezpečnostného chrániča
ihly.
injekčnú striekačku priamym ťahom nahor vyberte z balenia (obrázok C). Položte ju na čistý rovný povrch.
 O
brázok C
1.6
O
brázok C
1.6 Zvyšnú injekčnú striekačku(-ky) v originálnej škatuľke vložte späť do chladničky (obrázok D). Informácie o tom, ako uchovávať nepoužitú injekčnú striekačku(-ky) si pozrite v časti Informácie o uchovávaní.
 Obrázok D1.7
Obrázok D1.7 Nechajte injekčnú striekačku 30 minút pri izbovej teplote, aby sa liek zohrial.
Injekčné podanie studeného lieku môže bolieť (obrázok E).
 Obrázok EUpozornenie: Nezohrievajte
Obrázok EUpozornenie: Nezohrievajte injekčnú striekačku žiadnym iným spôsobom ako napríklad v mikrovlnej rúre, horúcej vode alebo na priamom slnečnom svetle.
Upozornenie: Neodstraňujte kryt z ihly kým nechávate liek, aby dosiahol izbovú teplotu.
Krok 2
Umytie rúk
2.1 Dôkladne si umyte ruky mydlom a vodou (obrázok F) a usušte si ich.
Upozornenie: Rukavice nenahradia potrebu umyť si ruky.
 Obrázok FKrok 3 Kontrola injekčnej striekačky3.1
Obrázok FKrok 3 Kontrola injekčnej striekačky3.1Skontrolujte injekčnú striekačku, aby ste sa uistili, že:
injekčná striekačka, priehľadný bezpečnostný chránič ihly a kryt ihly nie sú prasknuté alebo inak poškodené (obrázok G).
 Obrázok G
Obrázok G kryt ihly je bezpečne nasadený (obrázok H).
 Obrázok H
Obrázok H pružina bezpečnostného chrániča ihly nie je natiahnutá (obrázok I).
 Figure I
U
pozornenie: Nepoužívajte
Figure I
U
pozornenie: Nepoužívajte injekčnú striekačku, ktorá má viditeľné akékoľvek známky poškodenia.
Ak sú viditeľné známky poškodenia, vyhoďte injekčnú striekačku do kontajtera na ostrý injekčný odpad a kontaktujte svojho zdravotníckeho pracovníka alebo lekárnika.
3.2 Skontrolujte roztok, aby ste sa uistili, že:
roztok je číry, bezfarebný a bez prítomnosti častíc (obrázok J).
Upozornenie: Nepoužívajte injekčnú striekačku, ak roztok obsahuje častice alebo je zakalený alebo je sfarbený alebo obsahuje vločky.
 Obrázok J3.3
Obrázok J3.3 Skontrolujte etiketu, aby ste sa uistili, že:
názov na injekčnej striekačke je Idacio (obrázok K).
neuplynul dátum exspirácie uvedený na injekčnej striekačke
(Figure K).
EXP: MM/YYYY
Obrázok KUpozornenie: Nepoužívajte injekčnú striekačku, ak:
názov na injekčnej striekačke nie je Idacio.
dátum exspirácie uvedený na injekčnej striekačke už uplynul (obrázok K).
V takýchto prípadoch vyhoďte injekčnú striekačku do kontajtera na ostrý injekčný odpad a kontaktujte svojho zdravotníckeho pracovníka alebo lekárnika.
Krok 4 Výber miesta vpichu4.1Vyberte si miesto vpichu (obrázok L) na:
vrchnej časti stehien.
bruchu (injekciu podávajte aspoň 5 centimetrov od pupka).
 Obrázok L4.2
Obrázok L4.2 Pre každé podanie si zvoľte iné miesto (aspoň 2,5 centimetrov od predchádzajúceho miesta vpichu), aby ste tak znížili začervenanie, podráždenie kože alebo iné kožné problémy.
Upozornenie: Nepodávajte injekciu do miesta, ktoré je bolestivé (citlivé), zmodrané, začervenané, zatvrdnuté, zjazvené alebo, kde máte strie.
Upozornenie: Ak máte psoriázu,
nepodávajte injekciu do žiadnych postihnutých miest (lézií)
alebo začervenaných, zatvrdnutých, vyvýšených alebo šupinatých miest.
Krok 5 Očistenie miesta vpichu5.1 Potrite kožu v mieste vpichu tampónom napusteným alkoholom (obrázok M).
Upozornenie: Keď očistíte miesto vpichu,
nefúkajte na to miesto ani sa ho
nedotýkajte. Obrázok M
Obrázok M
Krok 6
Podanie injekcie
6.1 Odstráňte kryt z ihly.
Vždy držte injekčnú striekačku za priehľadný bezpečnostný chránič ihly.
Držte injekčnú striekačku smerom nahor a ťahom nahor stiahnite kryt z ihly (obrázok N).
 Obrázok N
Obrázok NNa konci ihly môžete vidieť kvapky roztoku.
Odhoďte kryt ihly.
Upozornenie: Nedotýkajte sa ihly.
6.2 Prichyťte kožu
Držte injekčnú striekačku rovnako ako pero.
Druhou rukou jemne prichyťte kožu (bez stláčania), aby ste nepodali injekciu do svalu (obrázok
O).
 Obrázok O6.3
Obrázok O6.3 Vpichnite ihlu
Rýchlym krátkym pohybom vpichnite ihlu do kože pod uhlom medzi 45° a 90° (obrázok P).
 O
brázok P
O
brázok P
Po vpichnutí ihly, uvoľnite prichytenú kožu.
6.4 Podanie injekcie
Palcom jemne zatlačte piest až úplne do konca (obrázok Q).
Obrázok Q Ešte raz úplne zatlačte piest, aby bola podaná úplná dávka (obrázok R).
Injekčnú striekačku držte pevne pod rovnakým uhlom a nehýbte ňou (obrázok R).
 Obrázok R
Obrázok RIhlu z kože po úplnom zatlačení piesta
nevyťahujte.
Pomaly uvoľnite svoj palec.
To umožní, aby sa ihla vsunula do priehľadného bezpečnostného chrániča ihly, ktorý ju celú
prekryje (obrázok S).
 O
brázok S
U
pozornenie:
O
brázok S
U
pozornenie: Obráťte sa na svojho zdravotníckeho pracovníka alebo na lekárnika, ak:
sa vám nepodarí podať plnú dávku alebo
sa po podaní nezaktivuje priehľadný bezpečnostný chránič ihly.
Upozornenie: V prípade, že by ste podali iba čiastočnú dávku, injekčnú striekačku opätovne už
nepoužívajte.
Nepokúšajte sa nasadiť kryt na ihlu, aby ste sa na ihle neporanili.
6.5 Jemne pritlačte na kožu vatový tampón alebo gázu, ak máte v mieste vpichu krv alebo roztok
(obrázok T).
 Obrázok TKrok 7 Likvidácia injekčnej striekačky7.1
Obrázok TKrok 7 Likvidácia injekčnej striekačky7.1 Ihneď po použití vyhoďte použitú injekčnú striekačku do kontajnera na ostrý injekčný odpad
(obrázok U).
 O
brázok U
U
pozornenie:
O
brázok U
U
pozornenie: Kontajner na ostrý injekčný odpad uchovávajte mimo dosahu detí.
Upozornenie: Nevyhadzujte injekčnú striekačku do svojho domáceho odpadu.
Ak nemáte kontajner na ostrý injekčný odpad, môžete použiť domáci kontajner, ktorý:
je vyrobený z vysoko odolného plastu,
je možné uzatvoriť presne padnúcim vrchnákom rezistentným voči prepichnutiu, ktorý zabráni
vypadnutiu ostrých ihiel z kontajnera,
stojí rovno a je stabilný počas používania,
nepresakuje a
je náležite označený, že obsahuje nebezpečný odpad.
7.2 Ak už je kontajner na ostrý injekčný odpad skoro naplnený, musíte ho zlikvidovať v súlade s národnými požiadavkymi na likvidáciu ostrého injekčného odpadu.
Nerecyklujte použitý kontajner na ostrý injekčný odpad.
Krok 8 Záznam podania injekcie8.1 Mali by ste si viesť písomný záznam s dátumami a miestami vpichov, čo vám pomôže zapamätať
si kedy a kde má byť podaná nasledujúca injekcia (obrázok V).
 O
brázok V
O
brázok V
Písomná informácia pre používateľa
Idacio40 mg injekčný roztok v naplnenom pere
adalimumab

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Váš lekár vám vydá aj informačnú kartičku pre pacienta, ktorá obsahuje dôležité informácie
o bezpečnosti, ktoré musíte mať na mysli pred začatím liečby Idaciom a počas liečby Idaciom. Majte túto informačnú kartičku pre pacienta vždy pri sebe počas vašej liečby (alebo liečby vášho dieťaťa) a 4 mesiace po podaní poslednej injekcie Idacia.
- Ak máte akékoľvek otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný iba vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj
vtedy, ak má rovnaké prejavy ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete1. Čo je Idacio a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Idacio
3. Ako používať Idacio
4. Možné vedľajšie účinky
5. Ako uchovávať Idacio
6. Obsah balenia a ďalšie informácie
7. Návod na použitie
1. Čo je Idacio a na čo sa používaIdacio obsahuje liečivo adalimumab, liek ktorý pôsobí na váš imunitný (obranný) systém.
Idacio je určený na liečbu zápalových ochorení opísaných nižšie:
reumatoidná artritída,
polyartikulárna juvenilná idiopatická artritída,
artritída spojená s entezitídou,
ankylozujúca spondylitída,
axiálna spondyloartritída bez rádiografického dôkazu ankylozujúcej spondylitídy
psoriatická artritída,
psoriáza,
hidradenitis suppurativa,
Crohnova choroba,
ulcerózna kolitída a
neinfekčná uveitída.
Aktívna zložka Idacia adalimumab je ľudská monoklonálna protilátka. Monoklonálne protilátky sú bielkoviny, ktoré sa viažu na špecifický cieľ v tele.
Cieľom adalimumabu je ďalšia bielkovina nazývaná tumor nekrotizujúci faktor (TNFα), ktorý je prítomný vo zvýšených hladinách pri zápalových ochoreniach uvedených vyššie. Tým, že saIdacio naviaže na TNFα, blokuje ich aktivitu a znižuje zápalový proces pri týchto ochoreniach.
Reumatoidná artritída
Reumatoidná artritída je zápalové ochorenie kĺbov.
Idacio sa používa na liečbu reumatoidnej artritídy u dospelých. Ak máte stredne ťažkú až ťažkú reumatoidnú artritídu najprv môžete dostávať iné lieky modifikujúce chorobu, ako je metotrexát. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, dostanete na liečbu vašej reumatoidnej artritídy Idacio.
Idacio je možné použiť aj na liečbu ťažkej, aktívnej a progresívnej reumatoidnej artritídy bez predchádzajúcej liečby metotrexátom.
Idacio môže spomaliť poškodenie kĺbovej chrupavky a kosti spôsobené ochorením a zlepšuje fyzické
funkcie.
Idacio sa zvyčajne používa s metotrexátom. Ak váš lekár rozhodne, že metotrexát nie je vhodný, može sa Idacio podávať samostatne.
Polyartikulárna juvenilná idiopatickáartritídaaartritídaspojenásentezitídou
Polyartikulárna juvenilná idiopatická artritída a artritída spojená s entezitídou sú zápalové ochorenia
kĺbov, ktoré sa zvyčajne objavia už v detstve.
Idacio sa používa na liečbu polyartikulárnej juvenilnej idiopatickej artritídy u detí a dospievajúcich vo
veku od 2 do 17 rokov a artritídy spojenej s entezitídouu detí a adolescentov vo veku od 6 do 17
rokov. Pacienti môžu najprv dostávať iné lieky modifikujúce chorobu, ako je metotrexát. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, pacienti môžu dostať Idacio na liečbu polyartikulárnej
juvenilnej idiopatickej artritídy alebo artritídy spojenej s entezitídou.
Ankylozujúcaspondylitídaaaxiálnaspondylartritídabezrádiografickéhodôkazuankylozujúcejspondylitídy
Ankylozujúca spondylitída a axiálna spondylartritída bez rádiografického dôkazu ankylozujúcej
spondylitídy sú zápalové ochorenia chrbtice.
Idacio sa používa na liečbu týchto stavov u dospelých. Ak máte ankylozujúcu spondylitídu alebo axiálnu spondylartritídu bez rádiografického dôkazu ankylozujúcej spondylitídy, budete najprv dostávať iné lieky. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, na zmiernenie prejavov a príznakov vášho ochorenia dostanete Idacio.
Psoriatická artritída
Psoriatická artritída je zápalové ochorenie kĺbov, ktoré je zvyčajne spojené s psoriázou.
Idacio sa používa na liečbu psoriatickej artritídy u dospelých. Idacio môže spomaliť poškodenie chrupavky a kosti kĺbov zapríčinené ochorením a zlepšuje fyzickú funkciu.
Ložisková psoriázaudospelýchadetí
Ložisková psoriáza je zápalové kožné ochorenie, ktoré spôsobuje červené, zlupujúce, zrohovatené
ložiská na koži pokryté striebristými šupinami. Ložisková psoriáza môže postihovať aj nechty, spôsobovať ich drobenie, zhrubnutie a oddelenie od nechtového lôžka, čo môže byť bolestivé.
Predpokladá sa, že psoriáza je spôsobená problémom s imunitným systémom organizmu, ktorý vedie k zvýšenej tvorbe kožných buniek.
Idacio sa používa na liečbu stredne ťažkej až ťažkej chronickej ložiskovej psoriázy u dospelých.
Idacio sa tiež používa na liečbu stredne ťažkej až ťažkej chronickej ložiskovej psoriázy u detí
a dospievajúcich vo veku od 4 do 17 rokov, u ktorých lokálna liečba a fotoliečba (liečba ultrafialovým svetlom) neúčinkovali veľmi dobre alebo nie sú u nich vhodné.
Hidradenitis suppurativa u dospelých adospevajúcich
Hidradenitis suppurativa (niekedy nazývané akné inversa) je dlhotrvajúce a často bolestivé zápalové
kožné ochorenie. Príznaky môžu zahŕňať bolestivé uzlíky (hrčky) a abscesy (vriedky), z ktorých môže vytekať hnis. Najčastejšie postihuje konkrétne oblasti kože, ako je oblasť podprsníkmi, podpazušie, vnútorná strana stehien, slabiny a zadok. V postihnutých oblastiach môže dôjsť aj k zjazveniu.
Idacio sa používa na liečbu hidradenitis suppurativa u detí a dospievajúcich vo veku od 12 rokov. Idacio môže znížiť počet uzlíkov a abscesov spôsobených týmto ochorením, ako aj bolesť, ktorá je
s týmto ochorením často spojená. Najprv môžete dostávať iné lieky. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, dostanete Idacio.
Crohnova choroba u dospelých adetí
Crohnova choroba je zápalové ochorenie čreva.
Idacio sa používa na liečbu Crohnovej choroby u dospelých a detí vo veku 6 až 17 rokov. Ak máte Cronovu chorobu, najprv môžete dostávať iné lieky. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, dostanete na zmiernenie prejavov a príznakov Crohnovej choroby Idacio.
Ulcerózna kolitída
Ulcerózna kolitída je zápalové ochorenie hrubého čreva.
Idacio sa používa na liečbu ulceróznej kolitídy u dospelých. Ak máte ulceróznu kolitídu, najprv dostanete iné lieky. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, dostanete na zmiernenie prejavov a príznakov vašej choroby Idacio.
Neinfekčná uveitída u dospelých adetí
Neinfekčná uveitída je zápalové ochorenie postihujúce niektoré časti oka. Tento zápal
vediek zhoršeniu videnia a/alebo prítomnosti zákalu oka (čierne bodky alebo jemné čiarky, ktoré sa pohybujú v zornom poli). Idacio pôsobí tak, že tento zápal znižuje.
Idacio sa používa na liečbu:
dospelých s neinfekčnou uveitídou so zápalom postihujúcim zadnú stranu oka
detí vo veku od 2 rokov s chronickou neinfekčnou uveitídou so zápalom postihujúcim prednú časť oka
2. Čo potrebujete vedieť predtým, ako použijete Idacio
Nepoužívajte Idacio:
ak ste alergický na adalimumab alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených
v časti 6).
ak máte ťažkú infekciu, vrátane tuberkulózy, sepsy (otrava krvi) alebo iné oportúnne infekcie
(zriedkavé infekcie spojené s oslabením imunitného systému). Je dôležité, aby ste informovali
svojho lekára, ak máte príznaky infekcie, napríklad horúčku, rany, pocit únavy, problémy
so zubami (pozri „Upozornenia a opatrenia“).
ak máte stredne ťažké alebo ťažké srdcové zlyhanie. Je dôležité informovať svojho lekára, ak ste mali alebo máte vážne problémy so srdcom (pozri „Upozornenia a opatrenia“).
Upozornenia a opatrenia
Obráťte sa na svojho lekára alebo lekárnika predtým, ako začnete používať Idacio. Alergickéreakcie
Ak sa u vás vyskytnú alergické reakcie s príznakmi ako je zvieranie na hrudníku, dýchavičnosť,
závrat, opuch alebo vyrážka, nepodávajte si ďalšiu injekciu Idacia a ihneď kontaktuje svojho lekára, pretože tieto reakcie môžu byť, v zriedkavých prípadoch, život ohrozujúce.
Infekcie
Ak máte nejakú infekciu, vrátane dlhotrvajúcej infekcie alebo infekcie v jednej časti tela
(napríklad vred na nohe), poraďte sa s lekárom predtým, ako začnete používať Idacio. Ak si nie ste istý, kontaktujte svojho lekára.
V priebehu liečby Idaciom môžete ľahšie dostať infekcie. Toto riziko sa môže zvýšiť, ak máte porušenú funkciu pľúc. Tieto infekcie môžu byť ťažké a môžu zahŕňať tuberkulózu, infekcie spôsobené vírusmi, hubami, parazitmi alebo baktériami alebo inými zriedkavýni infekčnými organizmami a sepsu (otravu krvi). V zriedkavých prípadoch môžu byť tieto infekcie život ohrozujúce. Je dôležité, aby ste informovali svojho lekára, ak sa u vás vyskytnú príznaky, ako je horúčka, rany, pocit únavy alebo problémy so zubami. Váš lekár vám môže odporučiť dočasné prerušenie liečby Idaciom.
Tuberkulóza (TBC)
Pretože sa u pacientov liečených adalimumabom vyskytli prípady tuberkulózy, vyšetrí vás lekár
pred začiatkom liečby Idaciom na prejavy a príznaky tuberkulózy. Vyšetrenie bude obsahovať dôkladné lekárske posúdenie vrátane anamnézy (chorobopisu) a príslušných skríningových
testov (napr. röntgen hrudníka a tuberkulínový test). Vykonanie týchto vyšetrení a ich výsledky sa zaznačia do vašej informačnej kartičky pre pacienta. Je veľmi dôležité, aby ste povedali svojmu lekárovi, ak ste v minulosti prekonali tuberkulózu alebo ste boli v blízkom kontakte s
niekým, kto mal tuberkulózu. Tuberkulóza sa môže vyvinúťv priebehu liečby, aj keď ste dostali preventívnu liečbu tuberkulózy. Ak sa u vás objavia počas liečby alebo po jej ukončení príznaky
tuberkulózy (pretrvávajúci kašeľ, úbytok hmotnosti, ochabnutosť, mierna horúčka) alebo inej
infekcie, ihneď to oznámte svojmu lekárovi.
Cestovné/opakované infekcie
Informujte svojho lekára, ak ste bývali alebo cestovali do oblastí s veľmi častým výskytom
plesňových infekcií ako sú histoplazmóza, kokcidioidomykóza alebo blastomykóza.
Informujte svojho lekárovi, ak sa u vás v minulosti vyskytli opakované infekcie alebo iné stavy, ktoré zvyšujú riziko infekcií.
Vírusová hepatitídatypuB(žltačka)
Informujte svojho lekára svojmu, ak ste nosičom vírusu hepatitídy B (HBV), ak máte aktívnu
HBV infekciu alebo ak si myslíte, že ste mohli dostať HBV. Váš lekár by vás mal vyšetriť na prítomnosť HBV. Adalimumab môže spôsobiť reaktiváciu HBV u ľudí, ktorí sú nosičmi tohto
vírusu. V niektorých zriedkavých prípadoch, najmä ak užívate iné lieky, ktoré potláčajú imunitný systém, môže byť reaktivácia HBV infekcie život ohrozujúca.
Vek nad 65 rokov
Ak ste starší ako 65 rokov, môžete byť počas liečby Idaciom náchylnejší na infekcie. Vy a váš
lekár by ste počas liečby Idaciom mali venovať osobitnú pozornosť príznakom infekcií. Je dôležité, aby ste informovali svojho lekára, ak u seba spozorujete príznaky infekcií, ako sú horúčka, rany, pocit únavy alebo problémy so zubami.
Chirurgický alebo stomatologickýzákrok
Ak sa máte podrobiť chirurgickému alebo stomatologickému zákroku, informujte svojho lekára,
že používate Idacio. Váš lekár vám môže odporučiť dočasné prerušenie liečby Idaciom.
Demyelinizačné ochorenie
Ak máte alebo ak sa u vás vyvinie demyelinizačné ochorenie (ochorenie postihujúce izolačnú
vrstvu okolo nervov,ako je skleróza multiplex), váš lekár rozhodne, či máte dostať alebo naďalej dostávať Idacio. Ak sa u vás vyskytnú príznaky ako zmena videnia, slabosť v rukách alebo nohách alebo znížená citlivosť alebo pálenie akejkoľvek časti tela, ihneď to povedzte svojmu
lekárovi.
Očkovanie
Určité vakcíny obsahujú živé ale oslabené formy choroboplodných baktérií alebo vírusov
a nemajú sa podávať počas liečby Idaciom v prípade, že vyvolajú infekcie. Overte si túto možnosť so svojím lekárom predtým, ako dostanete ktorúkoľvek vakcínu. Odporúča sa, aby sa,
pokiaľ sa dá, aktualizovali všetky imunizácie detí v súlade so súčasnými smernicami pre
imunizáciu ešte pred začatím liečby Idaciom. Ak ste boli počas tehotenstva liečená Idaciom, vaše dieťa môže mať zvýšené riziko vzniku takejto infekcie až približne do piateho mesiaca od poslednej dávky, ktorú ste dostali počas tehotenstva. Je dôležité, aby ste povedali lekárovi vášho dieťaťa a ďalším zdravotníckým pracovníkom, že ste počas tehotenstva používali Idacio, aby sa rozhodli, kedy má vaše dieťa dostať jednotlivé vakcíny.
Srdcové zlyhanie
Je dôležité , aby ste svojho lekára informovali, ak ste mali alebo máte vážne problémy so
srdcom. Ak máte mierne srdcové zlyhanie a ste liečený Idaciom, lekár musí starostlivo sledovať stav vášho srdcového zlyhania. Ak sa u vás vyvinú nové alebo sa zhoršia už existujúce príznaky
srdcového zlyhania (napr. dýchavičnosť alebo opuch nôh), musíte sa ihneď spojiť so svojím lekárom.
Horúčka, tvorbamodrín,krvácanie,bledosť
Telo niektorých pacientov môže stratiť schopnosť tvoriť dostatočný počet krvných buniek, ktoré
pomáhajú vášmu telu bojovať s infekciami alebo pomáhajú zastaviť krvácanie. Ak dostanete
horúčku, ktorá pretrváva alebo sa vám tvoria modriny alebo veľmi ľahko krvácate alebo ste veľmi bledý, informujte ihneď svojho lekára.Váš lekár môže rozhodnúť o ukončení liečby.
Rakovina
Pri používaní adalimumabu alebo iných TNF blokátorov sa u detských a dospelých pacientov
veľmi zriedkavo vyskytli prípady určitých typov rakoviny. Ľudia so závažnejšou reumatoidnou artritídou, ktorí majú chorobu počas dlhého obdobia, môžu mať vyššie ako priemerné riziko, že
dostanú lymfóm (rakovina, ktorá postihuje lymfatický systém) a leukémiu (rakovina, ktorá
lymfómu, leukémie alebo iných nádorov. U pacientov, používajúcich adalimumab, boli zaznamenané zriedkavé prípady špecifických a ťažkých typov lymfómu.Niektorí z týchto pacientov boli liečení aj liekmi azatioprinom alebo merkaptopurínom. Informujte svojho lekára v prípade, že užívate spolu s Idaciom azatioprin alebo merkaptopurín.
Okrem toho sa u pacientov používajúcich adalimumab zaznamenali prípady nemelanómovej rakoviny kože. Ak sa počas liečby alebo po liečbe objavia nové kožné lézie alebo ak existujúce lézie zmenia svoj vzhľad, informujte svojho lekára.
U pacientov so špecifickým typom pľúcnej choroby nazývanej chronická obštrukčná choroba pľúc (CHOCHP) sa pri liečbe iným TNFα blokátorom hlásili prípady rakoviny, inej ako lymfóm. Ak máte CHOCHP alebo ak veľa fajčíte, poraďte sa so svojím lekárom o tom, či je pre vás vhodná liečba TNFα blokátorom.
V zriedkavých prípadoch môže liečba Idaciom viesť k vzniku lupusu podobnému syndrómu.
Kontaktujte svojho lekára, ak sa vyskytnú príznaky, ako je pretrvávajúca nevysvetliteľná vyrážka, horúčka, bolesť kĺbov alebo únava.
Deti a dospievajúci
Očkovanie: ak je možné, vaše dieťa má mať aktualizované všetky očkovania pred použitím
Idacia.
Nepodávajte Idacio deťom do 2 rokov spolyartikulárnou juvenilnou idiopatickou artritídou.
Nepoužívajte 40 mg naplnenú injekčnú striekačku alebo 40 mg naplnené pero, ak sa odporúčajú dávky iné než 40 mg.
Iné lieky a Idacio
Ak užívate alebo ste v poslednom čase užívali, resp. budete užívať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi.
Idacio sa môže podávať spolu s metotrexátom alebo s určitými chorobu modifikujúcimi antireumatickými liekmi (sulfasalazín, hydroxychlorochín, leflunomid a injekčné lieky obsahujúce zlato), kortikosteroidmi alebo liekmi proti bolesti, vrátane nesteroidových protizápalových liekov (NSAIDs).
Idacio sa nemá používať s liekmi, ktoré ako liečivo obsahujú anakinru alebo abatacept pre zvýšené riziko ťažkej infekcie. Kombinácia adalimumabu ako aj iných TNF-antagonistov a anakinry alebo abataceptu sa neodporúča z dôvodu možného zvýšeného rizika infekcií, vrátane ťažkých infekcií
a iných farmakologických infekcií. Ak máte otázky, opýtajte sa svojho lekára.
Tehotenstvo a dojčenie
Ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom alebo lekárnikom predtým, ako začnete používať tento liek.
Odporúča sa, aby ste počas používania Idacia a aspoň 5 mesiacov po poslednej injekcie Idacia zabránili otehotneniu a musíte používať primeranú antikoncepciu.Ak otehotniete, máte kontaktovať svojho lekára.
Idacio sa má používať počas tehotenstva, iba ak je to potrebné.
Podľa štúdie zameranej na tehotenstvo sa nepreukázalo vyššie riziko vrodených chýb, keď matka dostávala adalimumab počas tehotenstva, v porovnaní s matkami s rovnakým ochorením, ktoré nedostávali adalimumab.
Idacio sa môže používať počas dojčenia.
Ak dostávate Idacio počas tehotenstva, vaše dieťa môže mať zvýšené riziko vzniku infekcie.Je dôležité informovať lekárov vášho dieťaťa a ďalších zdravotníckych pracovníkov, že ste počas tehotenstva používali Idacio ešte predtým, ako vaše dieťa dostane akúkoľvek vakcínu (pre ďalšie informácie pozri časť o očkovaní).
Vedenie vozidiel a obsluha strojov
Idacio môže mať malý vplyv na schopnosť viesť vozidlá, bicyklovať alebo obsluhovať stroje. Po podaní Idacia sa môže vyskytnúť pocit točenia hlavy a poruchy zraku.
Idacio obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej 0,8 ml dávke, t. j. prakticky neobsahuje sodík.
3. Ako používať Idacio
Vždy používajte tento liek presne tak, ako povedal váš lekár alebo lekárnik. Ak si nie ste niečím istý,
overte si to u svojho lekára alebo lekárnika.
Idacio sa podáva injekčne pod kožu (podkožné použitie). Pacienti vyžadujúci dávku menšiu ako
40 mg majú použiť 40 mg balenie Idacia v injekčnej liekovke.
Odporúčané dávky pre Idacio pre všetky schválené použitia sú uvedené v nasledujúcej tabuľke.
Reumatoidná artritída, psoriatická artritída, ankylozujúca spondylitída alebo axiálna spondylartritída bez rádiografického dôkazu ankylozujúcej spondylitídy
Vek alebo telesná hmotnosť Koľko a ako často používať? Poznámky
Dospelí 40 mg každý druhý týždeň Pri liečbe reumatoidnej artritídy Idaciom sa pokračuje
v podávaní metotrexátu. Ak váš lekár rozhodne, že metotrexát
nie je pre vás vhodný, môže sa podávať len samotný Idacio.
Ak máte reumatoidnú artritídu
a nedostávate spoločne
s Idaciom metotrexát, lekár môže rozhodnúť, že budete dostávať Idacio 40 mg každý týždeň alebo 80 mg každý druhý týždeň.
Polyartikulárna juvenilná idiopatická artritída
Vek alebo telesná hmotnosť Koľko a ako často používať? Poznámky
Deti, dospievajúci a dospelí vo veku od 2 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou od 10 kg
do menej ako 30 kg
40 mg každý druhý týždeň Neaplikovateľné
20 mg každý druhý týždeň Neaplikovateľné


 A
rtritída spojená s entezitídou
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
A
rtritída spojená s entezitídou
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Deti, dospievajúci a dospelí vo veku od 6 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
6 rokov s hmotnosťou od 15 kg
do menej ako 30 kg
40 mg každý druhý týždeň Neaplikovateľné
20 mg každý druhý týždeň Neaplikovateľné
L
ožisková psoriáza
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Dospelí Prvá dávka 80 mg (ako dve
40 mg injekcie v ten istý deň),
potom 40 mg podávaných
každý druhý týždeň po uplynutí jedného týždňa od prvej dávky.
Máte pokračovať v podávaní
Idacia tak dlho, ako vám to lekár povedal.
Ak máte neprimeranú odpoveď, váš lekár môže zvýšiť frekvenciu dávkovania na
40 mg každý týždeň alebo 80
mg každý druhý týždeň.
Deti a dospievajúci vo veku od
4 do 17 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
4 do 17 rokov s hmotnosťou od
15 kg do menej ako 30 kg
Prvá dávka 40 mg, potom
40 mg o jeden týždeň.
Potom nasleduje zvyčajná dávka 40 mg každý druhý týždeň.
Prvá dávka 20 mg, potom
20 mg o jeden týždeň.
Potom nasleduje zvyčajná dávka 20 mg každý druhý týždeň.
Neaplikovateľné
Neaplikovateľné
Hi
d
radenitis suppurativa
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Dospelí Prvá dávka 160 mg (ako štyri
40 mg injekcie v jeden deň
alebo dve 40 mg injekcie denne
počas dvoch po sebe nasledujúcich dní), o dva týždne nasleduje dávka 80 mg (ako dve 40 mg injekcie v ten istý deň). Po ďalších dvoch týždňoch sa pokračuje
s dávkou 40 mg jedenkrát za týždeňalebo 80 mg každý
druhý týždeň podľa podľa
predpisu lekára.
Odporúča sa každý deň umývať postihnuté miesta antiseptickým prípravkom.



Dospievajúci vo veku od 12 do
17 rokov s hmotnosťou 30 kg
alebo viac
Prvá dávka 80 mg (ako dve
40 mg injekcie v jeden deň),
potom 40 mg podávaných
každý druhý týždeň po uplynutí jedného týždňa od prvej dávky.
Ak máte neprimeranú odpoveď, váš lekár môže zvýšiť frekvenciu dávkovania na 40 mg každý týždeňalebo
80 mg každý druhý týždeň. Odporúča sa každý deň umývať postihnuté miesta antiseptickým prípravkom.
Deti, dospievajúci a dospelí vo
veku od 6 rokov s hmotnosťou
40 kg alebo viac
Deti a dospievajúci vo veku od
6 do 17 rokov s hmotnosťou
menej ako 40 kg
Prvá dávka 80 mg (ako dve
40 mg injekcie v ten istý deň),
potom 40 mg o nasledujúce
dva týždne.
Ak sa vyžaduje rýchlejšia odpoveď, váš lekár vám môže predpísať úvodnú dávku
160 mg (ako štyri 40 mg injekcie v jeden deň alebo ako
dve 40 mg injekcie denne
počas dvoch po sebe nasledujúcich dní) a 80 mg
(ako dve 40 mg injekcie
v jeden deň) o nasledujúce dva týždne.
Potom nasleduje zvyčajná dávka 40 mg každý druhý týždeň.
Prvá dávka je 40 mg, potom dávka 20 mg o nasledujúce dva týždne.
Ak je potrebná rýchlejšia odpoveď, váš lekár môže predpísať prvú dávku 80 mg (dve 40 mg injekcie
v jeden deň) a 40 mg
o nasledujúce dva týždne.
Potom nasleduje zvyčajná dávka 20 mg každý druhý týždeň.
Ak máte neprimeranú odpoveď, váš lekár môže zvýšiť frekvenciu dávkovania na 40 mg každý týždeňalebo
80 mg každý druhý týždeň.
Ak máte neprimeranú odpoveď, váš lekár môže zvýšiť frekvenciu dávkovania na 20 mg každý týždeň.
U
l
cerózna kolitída
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Dospelí Prvá dávka je 160 mg (ako štyri 40 mg injekcie v jeden deň alebo ako dve 40 mg injekcie denne počas dvoch po sebe nasledujúcich dní), ďalej
80 mg (ako dve 40 mg injekcie v jeden deň) o nasledujúce dva týždne.
Potom nasleduje zvyčajná dávka 40 mg každý druhý týždeň.
Ak máte neprimeranú odpoveď, váš lekár môže zvýšiť dávkovaniena 40 mg každý týždeňalebo 80 mg každý druhý týždeň.
N
einfekčná uveitída
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky



Dospelí Prvá dávka je 80 mg (ako dve
40 mg injekcie), ďalej 40 mg
každý druhý týždeň po
uplynutí jedného týždňa od
Kortikosteroidy alebo iné lieky, ktoré ovplyvňujú imunitný systém, sa môžu naďalej podávať počas liečby Idaciom.
prvej dávky. Máte pokračovať
v podávaní Idacia tak dlho, ako vám to lekár povedal.
Idacio je možné podávať aj
samostatne.
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou menej
ako 30 kg
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou
najmenej 30 kg
20 mg každý druhý týždeň Lekár môže predpísať úvodnú dávku 40 mg, ktorá sa podá jeden týždeň pred začiatkom zvyčajnej dávky.
Idacio sa odporúča na používanie v kombinácii s metotrexátom.
40 mg každý druhý týždeň Lekár môže predpísať úvodnú dávku 80 mg, ktorá sa podá jeden týždeň pred začiatkom zvyčajnej dávky.
Idacio sa odporúča na používanie v kombinácii s metotrexátom.
 Spôsob a cesta podávania
Spôsob a cesta podávania
Idacio sa podáva injekčne pod kožu (podkožnou injekciou).
Podrobný návod na podanie injekcie Idacia je uvedený v časti 7 „Návod na použitie“.
Ak použijete viac Idacia, ako máteAk ste si náhodne podali Idacio častejšie, ako ste mali, zavolajte svojmu lekárovi alebo lekárnikovi a povedzte mu, že ste použili viac lieku. Vždy si vezmite so sebou vonkajšiu škatuľku, aj keď je prázdna.
Ak zabudnete použiť IdacioAk si zabudnete dať injekciu, musíte si podať nasledujúcu dávku Idacia čo najskôr, ako si na to spomeniete. Nasledujúcu dávku si potom podajte v ten deň, ako je naplánovaná podľa pôvodnej dávkovacej schémy, ako keby ste nevynechali dávku.
Ak prestanete používať IdacioRozhodnutie prestať používať Idacio prekonzultujte so svojím lekárom. Ak prestanete s liečbou,
príznaky sa vám môžu vrátiť.
Ak máte ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Väčšina vedľajších účinkov je mierneho až stredného charakteru. Niektoré však môžu byť aj závažné a môžu vyžadovať liečbu. Vedľajšie účinky sa môžu vyskytnúť až do 4 mesiacov alebo aj viac po poslednej injekcii Idacia.
Okamžite vyhľadajte lekársku pomoc, ak sa u vás vyskytol niektorý z nasledujúcich príznakov alergickej reakcie alebo srdcového zlyhania:
silná vyrážka, žihľavka
opuchnutá tvár, ruky, nohy
problémy s dýchaním, prehĺtaním
dýchavičnosť pri fyzickej aktivite alebo v ľahu alebo opuch nôh
P
ovedzte lekárovi čo najskôr, ako je možné, ak sa u vás vyskytol niektorý z nasledujúcich príznakov:
prejavy a príznaky infekcie, ako je horúčka, pocit choroby, rany, problémy so zubami, pálenie pri močení, pocit slabosti alebo únavy alebo kašeľ
príznaky nervových problémov aho sú tŕpnutie, znížená citlivosť, dvojité videnie alebo slabosť
v rukách a nohách
prejavy rakoviny kože ako sú opuch alebo otvorená rana, ktorá sa nehojí
prejavy a príznaky naznačujúce krvné poruchy, ako sú pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť
Nasledovné vedľajšie účinky sa pozorovali s adalimumabom:
Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí)
reakcie v mieste podania injekcie (vrátane bolesti, opuchu, začervenania alebo svrbenia)
infekcie dýchacej sústavy (vrátane prechladnutia, nádchy, infekcie prinosových dutín, zápalu pľúc)
bolesť hlavy
bolesť brucha
nevoľnosť a vracanie
vyrážka
bolesť svalov
Časté (môžu postihovať menej ako1 z 10 ľudí)
ťažké infekcie (vrátane otravy krvi a chrípky)
črevné infekcie (vrátane gastroenteritídy)
kožné infekcie (vrátane celulitídy a pásového oparu)
infekcie ucha
infekcie ústnej dutiny (vrátane infekcie zubov a oparu na perách)
infekcie reprodukčného systému
infekcie močového ústrojenstva
mykotické infekcie
infekcie kĺbov
nezhubné nádory
rakovina kože
alergické reakcie (vrátane sezónnej alergie)
dehydratácia (odvodnenie organizmu)
výkyvy nálady (vrátane depresie)
úzkosť
poruchy spánku
poruchy zmyslového vnímania, ako sú tŕpnutie, pichanie alebo znížená citlivosť
migréna
príznaky stlačenia nervového koreňa (vrátane bolesti krížov a nôh)
poruchy zraku
zápal oka
zápal očného viečka a opuch oka
vertigo (pocit závratu alebo točenia)
pocit rýchleho tlkotu srdca
vysoký krvný tlak
návaly horúčavy
krvné podliatiny(nahromadenie krvi mimo krvných ciev)
kašeľ
astma
dýchavičnosť
krvácanie do tráviaceho traktu
porucha trávenia (zlé trávenie, plynatosť, pálenie záhy)
refluxná choroba (ochorenie spojené so spätným tokom kyslého žalúdkového obsahu)
Sjögrenov syndróm (vrátane suchých očí a úst)
svrbenie
svrbivá vyrážka
tvorba modrín
zápal kože (napr. ekzém)
lámanie nechtov na rukách a nohách
zvýšené potenie
vypadávanie vlasov
vznik alebo zhoršenie psoriázy
svalové kŕče
krv v moči
ťažkosti s obličkami
bolesť na hrudníku
edém (nahromadenie tekutiny v tele, ktoré spôsobuje opuch postihnutého tkaniva)
horúčka
zníženie počtu krvných doštičiek, ktoré zvyšuje riziko krvácania alebo tvorby modrín
zhoršené hojenie
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí)
zriedkavé infekcie (zahŕňajúce tuberkulózu a ďalšie infekcie), ktoré sa vyskytujú v prípade zníženej odolnosti proti chorobám
neurologické infekcie (vrátane vírusovej meningitídy)
infekcie oka
bakteriálne infekcie
diverkulitída (zápal a infekcia hrubého čreva)
rakovina vrátane rakovina lymfatického systému (lymfóm) a melanóm (druh kožného nádoru)
imunitné poruchy, ktoré môžu postihovať pľúca, kožu a lymfatické uzliny (najčastejšie sa prejavujú ako stav nazývajúci sa sarkoidóza)
vaskulitída (zápal krvných ciev)
tremor (trasenie)
neuropatia(porucha nervov)
mozgová príhoda
dvojité videnie
strata sluchu, hučanie v ušiach
pocit nepravidelného tlkotu srdca, ako je preskakovanie tepu
srdcové ťažkosti, ktoré môžu spôsobiť dýchavičnosť alebo opuchy členkov
infarkt myokardu
vydutina v stene hlavnej tepny, zápal a krvné zrazeniny v žilách, blokáda krvných ciev
ochorenia pľúc, spôsobujúce dýchavičnosť (vrátane zápalu)
pľúcna embólia (upchatie tepny v pľúcach)
pleurálny výpotok (abnormálne nahromadenie tekutiny v pleurálnej dutine)
zápal pankreasu, spôsobujúci ťažkú bolesť brucha a chrbta;
ťažkosti s prehĺtaním
edém tváre (opuch tváre)
zápal žlčníka, žlčníkové kamene
stukovatenie pečene (nahromadenie tuku v bunkách pečene)
nočné potenie
jazvy
abnormálne narušenie svalov
systémový lupus erythematosus (porucha imunity vrátane zápalu kože, srdca, pľúc, kĺbov a ďalších orgánových systémov)
prerušovaný spánok
impotencia
zápaly
Zriedkavé (môžu postihovať až 1 z 1000 ľudí)
leukémia (nádorové ochorenie postihujúce krv a kostnú dreň)
ťažká alergická reakcia so šokom
skleróza multiplex
nervové poruchy (ako sú zápal očného nervu a Guillainov-Barrého syndróm, stav ktorý môže spôsobiť svalovú slabosť, abnormálne pocity, brnenie v rukách a hornej časti tela)
zastavenie činnosti srdca
pľúcna fibróza (zjazvenie pľúc)
perforácia čreva(prederavenie čreva)
hepatitída (zápal pečene)
reaktivácia infekcie hepatitídy typu B
autoimunitná hepatitída (zápal pečene, spôsobený vlastným imunitným systémom tela)
kožná vaskulitída (zápal krvných ciev v koži)
Stevensov-Johnsonov syndróm (život ohrozujúca reakcia s príznakmi chrípky a vyrážok s pľuzgiermi)
edém tváre (opuch tváre) súvisiaci s alergickými reakciami
multiformný erytém (zápalová kožná vyrážka)
lupusu podobný syndróm
angioedém (lokalizovaný opuch kože)
lichenoidná kožná reakcia (svrbivá červenofialová kožná vyrážka)
Neznáme (frekvenciu nie je možné odhadnúť z dostupných údajov)
hepatosplenický T-lymfóm (zriedkavá krvná rakovina, ktorá je často smrteľná)
karcinóm z Merkelových buniek (typ rakoviny kože)
zlyhanie pečene
zhoršenie stavu nazývaného dermatomyozitída (prejavuje sa ako kožná vyrážka sprevádzaná
svalovou slabosťou)
Niektoré vedľajšie účinky pozorované s adalimumabom sa neprejavujú žiadnymi príznakmi a dajú sa odhaliť len za pomoci krvných testov. Tieto vedľajšie účinky zahŕňajú:
Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí)
znížené hodnoty bielych krviniek
znížené hodnoty červených krviniek
zvýšené hodnoty tukov v krvi
zvýšené hodnoty pečeňových enzýmov
Časté (môžu postihovať menej ako1 z 10 ľudí)
zvýšené hodnoty bielych krviniek
znížené hodnoty krvných doštičiek
zvýšené hodnoty kyseliny močovej v krvi
abnormálne hladiny sodíka v krvi
znížené hodnoty vápnika v krvi
znížené hodnoty fosfátov v krvi
zvýšené hladiny cukru v krvi
zvýšené hladiny laktátdehydrogenázy v krvi
prítomnosť autoprotilátok v krvi
nízka hladina draslíka v krvi
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí)
zvýšené hodnoty bilirubínu (krvný test pečene)
Zriedkavé (môžu postihovať až1 z 1000 ľudí)
znížené hodnoty bielych krviniek, červených krviniek a krvných doštičiek
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie
účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v Prílohe V. Hlásením
vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať IdacioTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na etikete/škatuľke po skratke EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke. Naplnené pero uchovávajte vo vonkajšej škatuľke na ochranu pred svetlom. Alternatívne uchovávanie:
V prípade potreby (napr. ak cestujete) môžete jednorazové naplnené pero Idacia uchovávaťpri izbovej teplote (do 25°C) po dobu maximálne 14dní -určite ju chráňte pred svetlom.
Akonáhle naplnené pero vyberiete z chladničky a ponecháte pri izbovej teplote,
musíte ho použiť do14 dní alebo zlikvidovať, a to aj vtedy, ak ste ho dali naspäť do chladničky.
Zaznamenajte si dátum, keď ste pero prvýkrát vybrali z chladničky, a dátum, po ktorom sa má zlikvidovať.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Idacio obsahuje- Liečivo je adalimumab.Každé naplnené pero obsahuje 40 mg v 0,8 ml roztoku.
- Ďalšie zložky súdihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, manitol, chlorid sodný, monohydrát kyseliny citrónovej, trinátriumcitrát, polysorbát
80, hydroxid sodný a voda na injekcie.
Ako Idacio vyzerá a obsah baleniaIdacio 40 mg injekčný roztok (injekcia) v naplnenom peresa dodáva ako 0,8 ml sterilný, číry, bezfarebný roztok 40 mg adalimumabu.
Idacio v naplnenom pero obsahuje naplnenú injekčnú striekačku s Idaciom. Každé balenie obsahuje 2
alebo 6 naplnených pier a 2 alebo 6 alkoholom napustených tampónov.
Idacio je dostupný ako injekčná liekovka, naplnená injekčná striekačka a ako naplnené pero.
D
ržiteľ rozhodnutia o registrácii
Fresenius Kabi Deutschland GmbH Else-Kröner-Straße 1
61352 Bad Homburg v.d.Höhe
Nemecko
VýrobcaFresenius Kabi Austria GmbH
Hafnerstraße 36
8055 Graz
Rakúsko
Merck Serono S.p.A. Via delle Magnolie 15
I-70026 Modugno (Bari) Taliansko
Táto písomná informácia bola naposledy aktualizovaná vĎalšie zdroje informáciíPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
7. Návod na použitiePred podaním injekcie Idacia si prečítajte návod na použitie a uistite sa, že mu rozumiete a postupujte podľa tohto návodu. Poskytovateľ zdravotníckej starostlivosti vám má ukázať ako pripraviť a správne podať Idaciov naplnenom pere, predtým ako ho použijete po prvý krát. Obráťte sa na svojho poskytovateľa zdravotníckej starostlivosti, ak máte akékoľvek otázky.
Návod na použitie
Jednorazové naplnené pero
(adalimumab) na
podkožnú injekciu
40mg
Poznámka: obrázky sú len na ilustračné účelyPred použitím Idacia v naplnenom pere si pozorne prečítajte celý návod na použitie. Dôležité informácie Idacio v naplnenom pere použite iba vtedy, ak vás zdravotnícky pracovník zaškolil o tom, ako sa má naplnené pero správne použiť.
Idacio v naplnenom pere sa dodáva ako jednorazové naplnené pero na podanie plnej dávky
adalimumabu.
Vždy podávajte injekciu takým spôsobom, ako vás zdravotnícky pracovník naučil.
Deti do 12 rokov si nemôžu sami podať injekciu, injekciu im musí podať zaškolený dospelý.
Uchovávajte Idacio v naplnenom pere mimo dosahu detí.
Nedávajte prsty na otváranie bezpečnostného chrániča.
Nepoužívajte Idacio v naplnenom pere, ak bol zmrazený alebo bol ponechaný na priamom slnečnom svetle.
Obráťte sa na svojho zdravotníckeho pracovníka, ak máte akékoľvek otázky alebo obavy.
Informácie o uchovávaní Uchovávajte naplnené pero v originálnej škatuľke na ochranu pred svetlom.
Uchovávajte naplnené pero v chladničke pri teplote medzi 2 °C až 8 °C.
V prípade potreby, napríklad pri cestovaní, sa môže jednorazové naplnené pero uchovávať pri izbovej teplote až do 14 dní.
O
boznámte sa s Idaciom v naplnenom pere
P
r
ed použitím Priehľadný plášť injekčnej striekačky
Miesto na etiketu

(Idacio, dávka, dátum exspirácie)
Tlačidlo
podania
Kryt ihly Piest injekčnej striekačky Telo vstrekovača
P
o použití

Kryt ihly

Ihla
Vysunutý bezpečnostný
chránič
Finálna pozícia piestu injekčnej striekačky
Krok 1
Príprava na podanie injekcie
Každá škatuľka Idacia v naplnenom pere obsahuje dve alebo šesť naplnených pier.
1.1 Pripravte si čistý plochý povrch, ako napríklad stôl alebo iná pracovná plocha, na dôkladne
osvetlenom mieste.
1.2 Taktiež budete potrebovať (obrázok A):
alkoholom napustený tampón (je súčasťou balenia)
vatový tampón alebo gázu a
kontajner na ostrý injekčný odpad.
 O
brázok A
1.3
O
brázok A
1.3 Vyberte škatuľku z chladničky (obrázok B).
 Obrázok B1.4
Obrázok B1.4 Skontrolujte dátum exspirácie na bočnej strane škatuľky (obrázok C).
EXP: MM/YYYY
Obrázok CUpozornenie: Nepoužívajte po uplynutí dátumu exspirácie.
1.5 Vyberte naplnené pero z originálnej škatuľky:
uchopte ho dvoma prstami v mieste etikety
ťahom nahor vyberte naplnené pero zo škatuľky (obrázok D).
 Obrázok D
Obrázok DPoložte ho na čistý plochý povrch.
1.6 Zostávajúce naplnené pero(-á) vložte späť v originálnej škatuľke do chladničky (obrázok E).
 O
brázok E
O
brázok E
Informácie o tom, ako uchovávať nepoužité naplnené pero(-á) si pozrite v časti Informácie o uchovávaní.
1.7 Nechajte naplnené pero 30 minút pri izbovej teplote, aby sa liek zohrial (obrázok F).
 Obrázok F
Obrázok FInjekčné podanie studeného lieku môže bolieť.
Upozornenie: Nezohrievajte naplenené pero žiadnym iným spôsobom, ako napríklad v mikrovlnej rúre, horúcej vode alebo na priamom slnečnom svetle.
Upozornenie: Neodstraňujte kryt z ihly až pokiaľ nie ste pripravený na podanie injekcie.
Krok 2 Umytie rúk2.1 Umyte si ruky mydlom a vodou (obrázok G) a dôkladne si ich osušte.
Upozornenie: Rukavice nenahradia potrebu umyť si ruky.
Obrázok G  Krok 3 Kontrola naplneného pera3.1
Krok 3 Kontrola naplneného pera3.1 Skontrolujte priehľadný plášť injekčnej striekačky, aby ste sa uistili, že:
roztok je číry, bezfarebný a neobsahuje častice (obrázok).

sklenená injekčná striekačka nie je prasknutá alebo rozbitá (obrázok H).
Priesvitný plášť injekčnej striekačky
Obrázok HUpozornenie: Nepoužívajte naplnené pero, ak roztok obsahuje častice alebo je zakalený alebo sfarbený alebo obsahuje vločky alebo vykazuje akékoľvek známky poškodenia.
V takýchto prípadoch ho vyhoďte do kontajnera na ostrý injekčný odpad a kontaktujte svojho zdravotníckeho pracovníka alebo lekárnika.
3.2 Skontrolujte etiketu, aby ste sa uistili, že:
názov na naplnenom pere je Idacio (obrázok I).
dátum exspirácie uvedený na naplnenom pere ešte neuplynul (obrázok I).
EXP: MM/YYYY
Obrázok IUpozornenie: Nepoužívajte naplnené pero, ak názov na etikete nie je Idacio a/alebo dátum exspirácie na etikete už uplynul.
V takýchto prípadoch vyhoďte naplnené pero do kontajnera na ostrý injekčný odpad a kontaktujte svojho zdravotníckeho pracovníka alebo lekárnika.
Krok 4 Výber miesta vpichu4.1 Vyberte si miesto vpichu (obrázok J) na:
vrchnej časti stehien.
bruchu (injekciu podávajte aspoň 5 centimetrov od pupka).
Obrázok J4.2 Pre každé podanie si zvoľte iné miesto (aspoň 2,5 centimetrov od predchádzajúceho miesta
vpichu), aby ste tak znížili začervenanie, podráždenie kože alebo iné kožné problémy.
Upozornenie: Nepodávajte injekciu do miesta, ktoré je bolestivé (citlivé), zmodrané, začervenané, zatvrdnuté, zjazvené alebo, kde máte strie.
Upozornenie: Ak máte psoriázu,
nepodávajte injekciu do žiadnych postihnutých miest (lézií)
alebo začervenaných, zatvrdnutých, vyvýšených alebo šupinatých miest.
Krok 5 Očistenie miesta vpichu5.1 Potrite kožu v mieste vpichu tampónom napusteným alkoholom (obrázok K).
Upozornenie: Keď očistíte miesto vpichu,
nefúkajte na to miesto ani sa ho
nedotýkajte.
 Obrázok KKrok 6 Podanie injekcie6.1
Obrázok KKrok 6 Podanie injekcie6.1 Odstráňte kryt z ihly
Držte naplnené pero smerom nahor a ťahom nahor stiahnite kryt z ihly (obrázok L).
 O
brázok L
O
brázok L
Na konci ihly môžete vidieť kvapky roztoku.
Odhoďte kryt ihly.
Upozornenie: Neotáčajte krytom.
Upozornenie: Opätovne
nenasadzujte kryt na naplnené pero.
6.2 Poloha naplneného pera
Držte naplnenené pero tak, aby ste videli priehľadný plášť injekčnej časť striekačky.
Položte svoj palec nad (tak by sa nedotýkal) žlté tlačidlo podania injekcie (obrázok M).
 Obrázok M
Obrázok M Položte naplnené pero na kožu pod 90° uhlom (obrázok N).
 Obrázok N
Obrázok N
Pred injekciou
Zatlačte a podržte naplnené pero pevne na koži až pokiaľ nie je bezpečnostný chránič úplne zatlačený.
Takto sa odomkne tlačidlo podania injekcie (obrázok O).
O
brázok O
Pred injekciou
6.3 Podanie injekcie
Zatlačte tlačidlo podania injekcie (obrázok P).
Budete počuť hlasné kliknutie, čo znamená začiatok podávania injekcie.
Naďalej pokračujte v pevnom
DRŽANÍ naplneného pera.
SLEDUJTE piest injekčnej striekačky, aby ste sa uistili, že piest sa zatlačil úplne nadol
(obrázok P).

O
brázok P
Po injekcii
U
pozornenie: Neodťahujte naplnené pero od kože, pokiaľ sa piest nezatlačí úplne nadol a pokiaľ
sa nepodá celý roztok.
Keď je piest zatlačený úplne nadol a zastavil sa, podržte ho ešte 5 sekúnd.
Odtiahnite naplnené pero od kože (obrázok Q).
Bezpečnostný chránič sa zasunie nadol a uzamkne sa v danej polohe, aby ste boli chránení pred kontaktom s ihlou (obrázok Q).
 O
brázok Q
U
pozornenie:
O
brázok Q
U
pozornenie: Obráťte sa na svojho zdravotníckeho pracovníka alebo na lekárnika, ak máte akýkoľvek problém.
6.4 Jemne pritlačte na kožu vatový tampón alebo gázu, ak máte v mieste vpichu krv alebo roztok
(obrázok R).
 Obrázok RKrok 7 Likvidácia naplneného pera7.1
Obrázok RKrok 7 Likvidácia naplneného pera7.1 Použité naplnené pero ihneď po použití vyhoďte do kontajnera na ostrý injekčný odpad (obrázok
S).
 O
brázok S
U
pozornenie:
O
brázok S
U
pozornenie: Uchovávajte kontajner na ostrý injekčný odpad mimo dosahu detí.
Upozornenie: Nevyhadzujte naplnené pero do svojho domáceho odpadu.
Ak nemáte kontajner na ostrý injekčný odpad, môžete použiť domáci kontajner, ktorý:
je vyrobený z vysoko odolného plastu,
je možné uzatvoriť presne padnúcim vrchnákom rezistentným voči prepichnutiu, ktorý zabráni vypadnutiu ostrých ihliel z kontajnera,
stojí rovno a je stabilný počas používania,
nepresakuje a
je náležite označený, že obsahuje nebezpečný odpad.
7.2 Ak už je kontajner na ostrý injekčný odpad skoro naplnený, musíte ho zlikvidovať v súlade s národnými požiadavkymi na likvidáciu ostrého injekčného odpadu.
Nerecyklujte použitý kontajner na ostrý injekčný odpad.
Krok 8 Záznam podania injekcie8.1 Mali by ste si viesť písomný záznam s dátumami a miestami vpichov, čo vám pomôže zapamätať
si kedy a kde má byť podaná nasledujúca injekcia (obrázok T).
 O
brázok T
O
brázok T
Písomná informácia pre používateľa
Idacio40 mg/0,8 ml injekčný roztok na pediatrické použitie
adalimumab

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa začne používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Váš lekár vám vydá aj informačnú kartičku pre pacienta, ktorá obsahuje dôležité informácie
o bezpečnosti, ktoré musíte mať na mysli pred tým, ako vaše dieťa začne používať Idacio
a počas liečby Idaciom. Majte túto informačnú kartičku pre pacienta vždy pri sebe vy alebo vaše dieťa počas liečby (alebo liečby vášho dieťaťa) a 4 mesiace po podaní poslednej injekcie
Idacia.
- Ak máte akékoľvek otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný iba vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete1. Čo je Idacio a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa použije Idacio
3. Ako používať Idacio
4. Možné vedľajšie účinky
5. Ako uchovávať Idacio
6. Obsah balenia a ďalšie informácie
7. Návod na použitie
1. Čo je Idacio a na čo sa používaIdacio obsahuje liečivo adalimumab, liek ktorý pôsobí na váš imunitný (obranný) systém. Idacio je určený na liečbu zápalových ochorení opísaných nižšie:
polyartikulárna juvenilná idiopatická artritída
artritída spojená s entezitídou
ložisková psoriáza u pediatrických pacientov
hidradenitis suppurativa u dospievajúcich pacientov
Crohnova choroba u pediatrických pacientov
uveitída u pediatrických pacientov
Aktívna zložka Idacia adalimumab je ľudská monoklonálna protilátka. Monoklonálne protilátky sú bielkoviny, ktoré sa viažu na špecifický cieľ v tele.
Cieľom adalimumabu je ďalšia bielkovina nazývaná tumor nekrotizujúci faktor (TNFα), ktorý je prítomný vo zvýšených hladinách pri zápalových ochoreniach uvedených vyššie. Tým, že saIdacio naviaže na TNFα,blokuje ich aktivitu a znižuje zápalový proces pri týchto ochoreniach.
Polyartikulárnajuvenilnáidiopatickáartritídaaartritídaspojenásentezitídou
Polyartikulárna juvenilná idiopatická artritída aartritída spojená s entezitídou sú zápalové ochorenia kĺbov, ktoré sa zvyčajne objavujú už v detstve.
Idacio sa používa na liečbu polyartikulárnej juvenilnej idiopatickej artritídy a artritídy spojenej
s entezitídou. Vaše dieťa môže najprv dostávať iné lieky modifikujúce chorobu, ako je metotrexát. Ak tieto lieky nevyvolajú dostatočnú odpoveď, vaše dieťa dostane Idacio naliečbu polyartikulárnej
juvenilnej idiopatickej artritídy alebo artritídy spojenej s entezitídou.
Ložisková psoriázaupediatrickýchpacientov
Ložisková psoriáza je kožné ochorenie, ktoré spôsobuje červené, zlupujúce, zrohovatené ložiská na
koži pokryté striebristými šupinami. Ložisková psoriáza môže postihnúť aj nechty, čo spôsobí, že sa
drobia, zhrubnú a oddeľujú od nechtového lôžka, čo môže byť bolestivé. Predpokladá sa, že psoriáza je spôsobená problémom s imunitným systémom organizmu, ktorý vedie k zvýšenej tvorbe kožných
buniek.
Idacio sa používa na liečbu ťažkej ložiskovej psoriázy u detí a dospievajúcich vo veku od 4 do 17 rokov, u ktorých lokálna liečba a fotoliečba (liečba ultrafialovým svetlom) neúčinkovali veľmi dobre, alebo nie sú u nich vhodné.
Hidradenitis suppurativa u dospievajúcich pacientov
Hidradenitis suppurativa (niekedy označovaná ako akné inversa) je dlhotrvajúce a často bolestivé
zápalové kožné ochorenie. Príznaky môžu zahŕňať bolestivé uzlíky (hrčky) a abscesy (vriedky), z ktorých môže vytekať hnis. Najčastejšie postihuje konkrétne oblasti kože, ako je oblasť pod prsníkmi, podpazušie, vnútorná strana stehien, slabiny a zadok. V postihnutých oblastiach môže dôjsť aj k zjazveniu.
Idacio sa používa na liečbu hidradenitis suppurativa u dospievajúcich vo veku od 12 rokov. Idacio môže znížiť počet uzlíkov a abscesov spôsobených týmto ochorením, ako aj bolesť, ktorá je s týmto ochorením často spojená. Najprv môžete dostávať iné lieky. Ak u vás tieto lieky nevyvolajú dostatočnú odpoveď, dostanete Idacio.
Crohnova chorobaupediatrickýchpacientov
Crohnova choroba je zápalové ochorenie čreva.
Idacio sa používa na liečbu Crohnovej choroby u detí vo veku 6 až 17 rokov. Vaše dieťa môže najprv dostávať iné lieky. Ak tieto lieky nevyvolajú dostatočnú odpoveď, vaše dieťa dostane Idacio na zmiernenie prejavov a príznakov ochorenia.
Uveitída u pediatrickýchpacientov
Neinfekčná uveitída je zápalové ochorenie postihujúce niektoré časti oka.Tento zápal vediek zhoršeniu
videnia a/alebo prítomnosti zákalu oka (čierne bodky alebo jemné čiarky, ktoré sa pohybujú v zornom
poli). Idacio pôsobí tak, že tento zápal znižuje.
Idacio sa používa na liečbudetí vo veku od 2 rokov s chronickou neinfekčnou uveitídou so zápalom postihujúcim prednú časť oka.
2. Čo potrebujete vedieť predtým, ako vaše dieťa použijeIdacio
N
epoužívajte Idacio:
ak je vaše dieťa alergické na adalimumab alebo na ktorúkoľvek z ďalších zložiek tohto lieku
(uvedených v časti 6).
ak má vaše dieťa ťažkú infekciu, vrátane tuberkulózy, sepsy (otrava krvi) alebo iné oportúnne infekcie (zriedkavé infekcie spojené s oslabením imunitného systému). Je dôležité, aby ste informovali lekára, ak má vaše dieťa príznaky infekcie, napríklad horúčku, rany, pocit únavy, problémy so zubami (pozri „Upozornenia a opatrenia“).
ak má vaše dieťa stredne ťažké alebo ťažké srdcové zlyhanie. Je dôležité informovať lekára, ak vaše dieťa malo alebo má vážne problémy so srdcom (pozri „Upozornenia a opatrenia“).
Upozornenia a opatrenia
Obráťte sa na lekára vášho dieťaťa alebo lekárnika predtým, ako začne používať Idacio. Alergickéreakcie
Ak sa u vášho dieťaťa vyskytnú alergické reakcie s príznakmi ako je zvieranie na hrudníku,
dýchavičnosť, závrat, opuch alebo vyrážka, nepodávajte mu ďalšiu injekciu Idacia a ihneď
kontaktuje lekára, pretože tieto reakcie môžu byť, v zriedkavých prípadoch, život ohrozujúce.
Infekcie
Ak má vaše dieťa nejakú infekciu, vrátane dlhotrvajúcej infekcie alebo lokalizovanej infekcie
(napríklad vred na nohe), poraďte sa s lekárom predtým, ako začne používať Idacio. Ak si nie
ste istý, kontaktujte lekára.
V priebehu liečby Idaciom môže vaše dieťa ľahšie dostať infekcie. Toto riziko sa môže zvýšiť, ak má vaše dieťa zníženú funkciu pľúc. Tieto infekcie môžu byť ťažké a môžu zahŕňať tuberkulózu, infekcie spôsobené vírusmi, hubami, parazitmi alebo baktériami alebo inými zriedkavýni infekčnými organizmami a sepsu (otravu krvi). V zriedkavých prípadoch môžu byť tieto infekcie život ohrozujúce. Je dôležité, aby ste informovali lekára, ak sa u vášho dieťaťa vyskytnú príznaky, ako je horúčka, rany, pocit únavy alebo problémy so zubami. Lekár vášho dieťaťa môže odporučiť dočasné prerušenie liečby Idaciom.
Tuberkulóza (TBC)
Pretože sa u pacientov liečených adalimumabom vyskytli prípady tuberkulózy, lekár vaše dieťa
vyšetrí pred začiatkom liečby Idaciom na prejavy a príznaky tuberkulózy. Vyšetrenie bude obsahovať dôkladné lekárske posúdenie vrátane anamnézy (chorobopisu) vášho dieťaťa a príslušných skríningových testov (napr. röntgen hrudníka a tuberkulínový test). Vykonanie a
výsledky týchto vyšetrení sa zaznačia do informačnej kartičky pre pacientavášho dieťaťa. Je
veľmi dôležité, aby ste povedali lekárovi, ak vaše dieťa v minulosti prekonalo tuberkulózu alebo
bolo v blízkom kontakte s niekým, kto mal tuberkulózu. Tuberkulóza sa môže vyvinúťv priebehu liečby, aj keď vaše dieťa dostalo preventívnu liečbu tuberkulózy. Ak sa u vášho dieťaťa objavia počas liečby alebo po jej ukončení príznaky tuberkulózy (pretrvávajúci kašeľ,
úbytok hmotnosti, ochabnutosť, mierna horúčka) alebo inej infekcie, ihneď to oznámte lekárovi.
Cestovné/opakované infekcie
Informujte lekára, ak vaše dieťa bývalo alebo cestovalo do oblastí s veľmi častým výskytom
plesňových infekcií ako sú histoplazmóza, kokcidioidomykóza alebo blastomykóza.
Informujte lekára, ak sa u vášho dieťaťa v minulosti vyskytli opakované infekcie alebo iné stavy, ktoré zvyšujú riziko infekcií.
Vírusová hepatitídatypuB(žltačka)
Informujte lekára, ak je vaše dieťa nosičom vírusu hepatitídy B (HBV), ak má aktívnu HBV
infekciu alebo ak si myslíte, že mohlo dostať HBV. Lekár vášho dieťaťa má vaše dieťa vyšetriť na prítomnosť HBV. Adalimumab môže spôsobiť reaktiváciu HBV u ľudí, ktorí sú nosičmi
tohto vírusu. V niektorých zriedkavých prípadoch, najmä ak vaše dieťa užíva iné lieky, ktoré
potláčajú imunitný systém, môže byť reaktivácia HBV infekcie život ohrozujúca.
Príznaky infekcií
Je dôležité, aby ste povedali lekárovi, ak má vaše dieťa príznaky infekcií, ako sú horúčka, rany,
pocit únavy alebo problémy so zubami.
Chirurgický alebo stomatologickýzákrok
Ak sa má vaše dieťa podrobiť chirurgickému alebo stomatologickému zákroku, informujte
lekára, že používa Idacio. Lekár vášho dieťaťa môže odporučiť dočasné prerušenie liečby
Idaciom.
Demyelinizačné ochorenie
Ak vaše dieťa má alebo ak sa u neho vyvinie demyelinizačné ochorenie (ochorenie postihujúce
izolačnú vrstvu okolo nervov,ako je skleróza multiplex), lekár rozhodne, či má dostať alebo naďalej dostávať Idacio. Ak sa u vášho dieťaťa vyskytnú príznaky ako zmena videnia, slabosť v rukách alebo nohách alebo znížená citlivosť alebo pálenie akejkoľvek časti tela, ihneď to
povedzte lekárovi.
Očkovanie
Určité vakcíny obsahujú živé ale oslabené formy choroboplodných baktérií alebo vírusov
a nemajú sa podávať počas liečby Idaciom v prípade, že vyvolajú infekcie. Overte si túto možnosť s lekárom predtým, ako vaše dieťadostane ktorúkoľvek vakcínu. Odporúča sa, aby sa,
pokiaľ sa dá, aktualizovali všetky imunizácie detí v súlade so súčasnými smernicami pre
imunizáciu ešte pred začatím liečby Idaciom. Ak ste bola počas tehotenstva liečená Idaciom, vaše dieťa môže mať zvýšené riziko vzniku takejto infekcie až približne do piateho mesiaca od poslednej dávky, ktorú ste dostali počas tehotenstva. Je dôležité, aby ste povedali lekárovi vášho dieťaťa a ďalším zdravotníckým pracovníkom, že ste počas tehotenstva používali Idacio, aby sa rozhodli, kedy má vaše dieťa dostať jednotlivé vakcíny.
Srdcové zlyhanie
Je dôležité , aby ste lekára informovali, ak vaše dieťa malo alebo má vážne problémy so
srdcom. Ak má vaše dieťa mierne srdcové zlyhanie a je liečené Idaciom, musí lekár starostlivo
sledovať stav jeho srdcového zlyhania. Ak sa u vášho dieťaťa vyvinú nové alebo sa zhoršia už existujúce príznaky srdcového zlyhania (napr. dýchavičnosť alebo opuch nôh), musíte sa ihneď
spojiť s lekárom. Lekár vášho dieťaťa rozhodne, či môže vaše dieťa dostávať Idacio.
Horúčka, tvorbamodrín,krvácanie,bledosť
Telo niektorých pacientov môže stratiť schopnosť tvoriť dostatočný počet krvných buniek, ktoré
bojujú s infekciami alebo pomáhajú zastaviť krvácanie. Ak vaše dieťa dostane horúčku, ktorá pretrváva, tvoria sa mu sa modriny alebo veľmi ľahko krváca alebo je veľmi bledé, informujte
ihneď lekára. Lekár vášho dieťaťa môže rozhodnúť o ukončení liečby.
R
akovina
Pri používaní adalimumabu alebo iných TNF blokátorov sa u detských a dospelých pacientov
veľmi zriedkavo vyskytli prípady určitých typov rakoviny. Ľudia so závažnejšou reumatoidnou artritídou, ktorí majú chorobu počas dlhého obdobia, môžu mať vyššie ako priemerné riziko, že
dostanú lymfóm (rakovina, ktorá postihuje lymfatický systém) a leukémiu (rakovina, ktorá
postihuje krv a kostnú dreň). Ak vaše dieťa používa Idacio, môže sa u neho zvýšiť riziko výskytu lymfómu, leukémie alebo iných nádorov. U pacientov, používajúcich adalimumab, boli zaznamenané zriedkavé prípady špecifických a ťažkých typov lymfómu.Niektorí z týchto pacientov boli liečení aj liekmi azatioprinom alebo merkaptopurínom.Informujte lekára v prípade, že vaše dieťa používa spolu s Idaciom azatioprin alebo merkaptopurín.
Okrem toho sa u pacientov používajúcich adalimumab zaznamenali prípady nemelanómovej rakoviny kože. Ak sa počas liečby alebo po liečbe objavia nové kožné lézie alebo ak existujúce lézie zmenia svoj vzhľad, informujte lekára.
U pacientov so špecifickým typom pľúcnej choroby nazývanej chronická obštrukčná choroba pľúc (CHOCHP) sa pri liečbe iným TNFα blokátorom hlásili prípady rakoviny, inej ako lymfóm. Ak má vaše dieťa CHOCHP alebo ak veľa fajčí, poraďte sa s lekárom o tom, či je pre neho vhodná liečba TNFα blokátorom.
V zriedkavých prípadoch môže liečba Idaciom viesť k vzniku lupusu podobnému syndrómu.
Kontaktujte lekára, ak sa vyskytnú príznaky, ako je pretrvávajúca nevysvetliteľná vyrážka, horúčka, bolesť kĺbov alebo únava.
Iné lieky a Idacio
Ak vaše dieťa užíva alebo v poslednom čase užívalo, resp. bude užívať ďalšie lieky, povedzte to lekárovi svojho dieťaťa alebo lekárnikovi.
Idacio sa môže podávať spolu s metotrexátom alebo s určitými chorobu modifikujúcimi antireumatickými liekmi (sulfasalazín, hydroxychlorochín, leflunomid a injekčné lieky obsahujúce zlato), kortikosteroidmi alebo liekmi proti bolesti, vrátane nesteroidových protizápalových liekov (NSAIDs).
Vaše dieťa nemá používať Idacio s liekmi, ktoré ako liečivo obsahujú anakinru alebo abatacept pre zvýšené riziko ťažkej infekcie. Kombinácia adalimumabu ako aj iných TNF-antagonistov a anakinry alebo abataceptu sa neodporúča z dôvodu možného zvýšeného rizika infekcií, vrátane ťažkých infekcií a iných farmakologických infekcií. Ak máte otázky, opýtajte sa lekára.
Tehotenstvo a dojčenie
Ak si myslíte, že vaša dcéra môže byť tehotná alebo, ak plánuje otehotnieť, poraďte sa s vaším lekárom alebo lekárnikom predtým, ako použijú tento liek.
Odporúča sa, aby vaša dcéra počas používania Idacia a aspoň 5 mesiacov po poslednej injekcii Idacia zabránila otehotneniu a musí používať primeranú antikoncepciu.Ak vaša dcéra otehotnie, kontaktujte vášho detského lekára.
Idacio sa má používať počas tehotenstva, iba ak je to potrebné.
Podľa štúdie zameranej na tehotenstvo sa nepreukázalo vyššie riziko vrodených chýb, keď matka dostávala adalimumab počas tehotenstva, v porovnaní s matkami s rovnakým ochorením, ktoré nedostávali adalimumab.
Idacio sa môže používať počas dojčenia.
Ak vaša dcéra dostávala Idacio počas tehotenstva, jej dieťa môže mať zvýšené riziko vzniku infekcie. Je dôležité informovať lekára jej dieťaťa a ďalších zdravotníckych pracovníkov, že vaša dcéra počas tehotenstva používala Idacio ešte predtým, ako dieťa dostane akúkoľvek vakcínu (pre ďalšie informácie pozri časť o očkovaní).
Vedenie vozidiel a obsluha strojov
Idacio môže mať malý vplyv na schopnosť viesť vozidlá, bicyklovať alebo obsluhovať stroje. Po podaní Idacia sa môže vyskytnúť pocit točenia hlavy a poruchy zraku.
Idacio obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej 0,8 ml dávke, t. j. prakticky neobsahuje sodík.
3. Ako používať Idacio
Vždy používajte tento liek presne podľa pokynov lekára vášho dieťaťa alebo lekárnika. Ak si nie ste istý ktoroukoľvek inštrukciou alebo ak máte nejaké otázky, overte si to u lekára vášho dieťaťa alebo lekárnika. Lekár môže predpísať inú silu Idacia, ak vaše dieťa potrebuje inú dávku.
Idacio sa podáva injekčne pod kožu (podkožné použitie). 40 mg v naplnenej injekčnej striekačke alebo
40 mg v naplnenom pere sú tiež dostupné na použitie.
Odporúčané dávky pre Idacio pre všetky schválené použitia sú uvedené v nasledujúcej tabuľke.
Polyartikulárna juvenilnáidiopatická artritída
Vek alebo telesná hmotnosť Koľko a ako často používať? Poznámky
Deti, dospievajúci a dospelí vo veku od 2 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou od 10 kg
do menej ako 30 kg
40 mg každý druhý týždeň Neaplikovateľné

20 mg každý druhý týždeň Neaplikovateľné
A
rtritída spojená s entezitídou
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Deti, dospievajúci a dospelí vo veku od 6 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
6 rokov s hmotnosťou od 15 kg
do menej ako 30 kg
40 mg každý druhý týždeň Neaplikovateľné

20 mg každý druhý týždeň Neaplikovateľné
L
ožisková psoriáza u pediatrických pacientov
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Deti a dospievajúci vo veku od
4 do 17 rokov s hmotnosťou
30 kg alebo viac
Deti a dospievajúci vo veku od
4 do 17 rokov s hmotnosťou od
15 kg do menej ako 30 kg
Prvá dávka 40 mg, potom
40 mg o jeden týždeň.
Potom nasleduje zvyčajná dávka 40 mg každý druhý týždeň.
Prvá dávka 20 mg, potom
20 mg o jeden týždeň.
Potom nasleduje zvyčajná dávka 20 mg každý druhý týždeň.
Neaplikovateľné
Neaplikovateľné
Hi
d
radenitis suppurativa
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky
Dospievajúci vo veku od 12 do
17 rokov s hmotnosťou 30 kg
alebo viac
Prvá dávka 80 mg (ako dve
40 mg injekcie v jeden deň),
potom 40 mg podávaných
každý druhý týždeň po uplynutí jedného týždňa od prvej dávky.
Ak je odpoveď neprimeraná, lekár vášho dieťaťa môže zvýšiť frekvenciu dávkovania na 40 mg každý týždeňalebo
80 mg každý druhý týždeň. Odporúča sa každý deň umývať
postihnuté miesta
antiseptickým prípravkom.
C
rohnova choroba u pediatrických pacientov
V
ek alebo telesná hmotnosť Koľko a ako často používať?
P
oznámky



Deti, dospievajúci a dospelí vo veku od 6 rokov s hmotnosťou
40 kg alebo viac
Deti a dospievajúci vo veku od
6 do 17 rokov s hmotnosťou
menej ako 40 kg
Prvá dávka 80 mg (ako dve
40 mg injekcie v ten istý deň),
potom 40 mg o nasledujúce
dva týždne.
Ak sa vyžaduje rýchlejšia odpoveď, lekár vášho dieťaťa môže predpísať úvodnú dávku
160 mg (ako štyri 40 mg injekcie v jeden deň alebo ako
dve 40 mg injekcie denne
počas dvoch po sebe nasledujúcich dní) a 80 mg
(dve 40 mg injekcie v jeden
deň) o nasledujúce dva týždne.
Potom nasleduje zvyčajná dávka 40 mg každý druhý týždeň.
Prvá dávka je 40 mg, potom dávka 20 mg o nasledujúce dva týždne.
Ak je potrebná rýchlejšia odpoveď, lekár vášho dieťaťa môže predpísať prvú dávku
80 mg (dve 40 mg injekcie v jeden deň) a 40 mg
o nasledujúce dva týždne.
Ak je odpoveď neprimeraná, lekár vášho dieťaťa môže zvýšiť frekvenciu dávkovania na 40 mg každý týždeňalebo
80 mg každý druhý týždeň.
Ak je odpoveď neprimeraná, lekár vášho dieťaťa môže zvýšiť frekvenciu dávkovania na 20 mg každý týždeň.
Potom nasleduje zvyčajná dávka 20 mg každý druhý týždeň.
Uveitída u pediatrických pacientov
Vek alebo telesná hmotnosť Koľko a ako často používať? Poznámky
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou menej
ako 30 kg
Deti a dospievajúci vo veku od
2 rokov s hmotnosťou
najmenej 30 kg
20 mg každý druhý týždeň Lekár vášho dieťaťa môže predpísať úvodnú dávku 40
mg, ktorá sa podá jeden týždeň pred začiatkom zvyčajnej
dávky.
Idacio sa odporúča na používanie v kombinácii s
metotrexátom.
40 mg každý druhý týždeň Lekár vášho dieťaťa môže predpísať úvodnú dávku
80 mg, ktorá sa podá jeden
týždeň pred začiatkom zvyčajnej dávky. Idacio sa odporúča na
používanie v kombinácii s metotrexátom.

 Spôsob a cesta podávania
Spôsob a cesta podávania
Idacio sa podáva injekčne pod kožu (podkožnou injekciou).
Podrobný návod na podanie injekcie Idacia je uvedený v časti 7 „Návod na použitie“.
Ak použijete viac Idacia, ako máteAk ste náhodne podali väčšie množstvo Idacia alebo ak ste podali Idacio častejšie, ako povedal váš lekár, zavolajte vášmu lekárovi a povedzte mu, že vaše dieťa dostalo viac lieku. Vždy si vezmite so sebou vonkajšiu škatuľku alebo injekčnú liekovku lieku, aj keď je prázdna.
Ak použijete menej Idacia, ako máteAk ste náhodne podali menšie množstvo Idacia alebo ak ste podali Idacio menej často, ako vám povedal lekár vášho dieťaťa alebo lekárnik, zavolajte lekárovi vášho dieťaťa alebo lekárnikovi a povedzte mu, že vaše dieťa dostalo menej lieku. Vždy vezmite so sebou vonkajšiu škatuľku alebo injekčnú liekovku lieku, aj keď je prázdna.
Ak zabudnete použiť IdacioAk zabudnete vášmu dieťaťu podať injekciu, musíte mu podať nasledujúcu dávku Idacia čo najskôr, ako si na to spomeniete. Nasledujúcu dávku potom vášmu dieťaťu podajte v ten deň, ako je naplánovaná podľa pôvodnej dávkovacej schémy, ako keby ste nevynechali dávku.
Ak vaše dieťa prestane používať IdacioRozhodnutie prestať používať Idacio prekonzultujte s lekárom vášho dieťaťa. Po ukončení liečby sa môžu vášmu dieťatu príznaky vrátiť.
Ak máte ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Väčšina vedľajších účinkov je mierneho až stredného charakteru. Niektoré však môžu byť aj závažné a môžu vyžadovať liečbu. Vedľajšie účinky sa môžu vyskytnúť až do 4 mesiacov alebo aj dlhšie po poslednej injekcii Idacia.
Okamžite vyhľadajte lekársku pomoc, ak sa u vášho dieťaťa vyskytol niektorý z nasledujúcich príznakov alergickej reakcie alebo srdcového zlyhania:
silná vyrážka, žihľavka
opuchnutá tvár, ruky, nohy
problémy s dýchaním, prehĺtaním
dýchavičnosť pri fyzickej aktivite alebo v ľahu alebo opuch nôh
Povedzte lekárovi čo najskôr, ako je možné, ak sa u vášho dieťaťa vyskytol niektorý z nasledujúcich príznakov:
prejavy a príznaky infekcie, ako je horúčka, pocit choroby, rany, problémy so zubami, pálenie pri močení, pocit slabosti alebo únavy alebo kašeľ
príznaky nervových problémov aho sú tŕpnutie, znížená citlivosť, dvojité videnie alebo slabosť
v rukách a nohách
prejavy rakoviny kože ako sú opuch alebo otvorená rana, ktorá sa nehojí
prejavy a príznaky naznačujúce krvné poruchy, ako sú pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť
Nasledovné vedľajšie účinky sa pozorovali s adalimumabom:
Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí)
reakcie v mieste podania injekcie (vrátane bolesti, opuchu, začervenania alebo svrbenia)
infekcie dýchacej sústavy (vrátane prechladnutia, nádchy, infekcie prinosových dutín, zápalu pľúc)
bolesť hlavy
bolesť brucha
nevoľnosť a vracanie
vyrážka
bolesť svalov
Časté (môžu postihovať menej ako1 z 10 ľudí)
ťažké infekcie (vrátane otravy krvi a chrípky)
črevné infekcie (vrátane gastroenteritídy)
kožné infekcie (vrátane celulitídy a pásového oparu)
infekcie ucha
infekcie ústnej dutiny (vrátane infekcie zubov a oparu na perách)
infekcie reprodukčného systému
infekcie močového ústrojenstva
mykotické infekcie
infekcie kĺbov
nezhubné nádory
rakovina kože
alergické reakcie (vrátane sezónnej alergie)
dehydratácia (odvodnenie organizmu)
výkyvy nálady (vrátane depresie)
úzkosť
poruchy spánku
poruchy zmyslového vnímania, ako sú tŕpnutie, pichanie alebo znížená citlivosť
migréna
príznaky stlačenia nervového koreňa (vrátane bolesti krížov a nôh)
poruchy zraku
zápal oka
zápal očného viečka a opuch oka
vertigo (pocit závratu alebo točenia)
pocit rýchleho tlkotu srdca
vysoký krvný tlak
návaly horúčavy
krvné podliatiny(nahromadenie krvi mimo krvných ciev)
kašeľ
astma
dýchavičnosť
krvácanie do tráviaceho traktu
porucha trávenia (zlé trávenie, plynatosť, pálenie záhy)
refluxná choroba (ochorenie spojené so spätným tokom kyslého žalúdkového obsahu)
Sjögrenov syndróm (vrátane suchých očí a úst)
svrbenie
svrbivá vyrážka
tvorba modrín
zápal kože (napr. ekzém)
lámanie nechtov na rukách a nohách
zvýšené potenie
vypadávanie vlasov
vznik alebo zhoršenie psoriázy
svalové kŕče
krv v moči
ťažkosti s obličkami
bolesť na hrudníku
edém (nahromadenie tekutiny v tele, ktoré spôsobuje opuch postihnutého tkaniva)
horúčka
zníženie počtu krvných doštičiek, ktoré zvyšuje riziko krvácania alebo tvorby modrín
zhoršené hojenie
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí)
zriedkavé infekcie (zahŕňajúce tuberkulózu a ďalšie infekcie), ktoré sa vyskytujú v prípade zníženej odolnosti proti chorobám
neurologické infekcie (vrátane vírusovej meningitídy)
infekcie oka
bakteriálne infekcie
diverkulitída (zápal a infekcia hrubého čreva)
rakovina vrátane rakovina lymfatického systému (lymfóm) a melanóm (druh kožného nádoru)
imunitné poruchy, ktoré môžu postihovať pľúca, kožu a lymfatické uzliny (najčastejšie sa prejavujú ako stav nazývajúci sa sarkoidóza)
vaskulitída (zápal krvných ciev)
tremor (trasenie)
neuropatia(porucha nervov)
mozgová príhoda
dvojité videnie
strata sluchu, hučanie v ušiach
pocit nepravidelného tlkotu srdca, ako je preskakovanie tepu
srdcové ťažkosti, ktoré môžu spôsobiť dýchavičnosť alebo opuchy členkov
infarkt myokardu
vydutina v stene hlavnej tepny, zápal a krvné zrazeniny v žilách, blokáda krvných ciev
ochorenia pľúc, spôsobujúce dýchavičnosť (vrátane zápalu)
pľúcna embólia (upchatie tepny v pľúcach)
pleurálny výpotok (abnormálne nahromadenie tekutiny v pleurálnej dutine)
zápal pankreasu, spôsobujúci ťažkú bolesť brucha a chrbta;
ťažkosti s prehĺtaním
edém tváre (opuch tváre)
zápal žlčníka, žlčníkové kamene
stukovatenie pečene (nahromadenie tuku v bunkách pečene)
nočné potenie
jazvy
abnormálne narušenie svalov
systémový lupus erythematosus (porucha imunity vrátane zápalu kože, srdca, pľúc, kĺbov a ďalších orgánových systémov)
prerušovaný spánok
impotencia
zápaly
Zriedkavé (môžu postihovať až 1 z 1000 ľudí)
leukémia (nádorové ochorenie postihujúce krv a kostnú dreň)
ťažká alergická reakcia so šokom
skleróza multiplex
nervové poruchy (ako sú zápal očného nervu a Guillainov-Barrého syndróm, stav ktorý môže spôsobiť svalovú slabosť, abnormálne pocity, brnenie v rukách a hornej časti tela)
zastavenie činnosti srdca
pľúcna fibróza (zjazvenie pľúc)
perforácia čreva(prederavenie čreva)
hepatitída (zápal pečene)
reaktivácia infekcie hepatitídy typu B
autoimunitná hepatitída (zápal pečene, spôsobený vlastným imunitným systémom tela)
kožná vaskulitída (zápal krvných ciev v koži)
Stevensov-Johnsonov syndróm (život ohrozujúca reakcia s príznakmi chrípky a vyrážok s pľuzgiermi)
edém tváre (opuch tváre) súvisiaci s alergickými reakciami
multiformný erytém (zápalová kožná vyrážka)
lupusu podobný syndróm
angioedém (lokalizovaný opuch kože)
lichenoidná kožná reakcia (svrbivá červenofialová kožná vyrážka)
Neznáme (frekvenciu nie je možné odhadnúť z dostupných údajov)
hepatosplenický T-lymfóm (zriedkavá krvná rakovina, ktorá je často smrteľná)
karcinóm z Merkelových buniek (typ rakoviny kože)
zlyhanie pečene
zhoršenie stavu nazývaného dermatomyozitída (prejavuje sa ako kožná vyrážka sprevádzaná
svalovou slabosťou)
Niektoré vedľajšie účinky pozorované s adalimumabom sa neprejavujú žiadnymi príznakmi a dajú sa odhaliť len za pomoci krvných testov. Tieto vedľajšie účinky zahŕňajú:
Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí)
znížené hodnoty bielych krviniek
znížené hodnoty červených krviniek
zvýšené hodnoty tukov v krvi
zvýšené hodnoty pečeňových enzýmov
Časté (môžu postihovať menej ako1 z 10 ľudí)
zvýšené hodnoty bielych krviniek
znížené hodnoty krvných doštičiek
zvýšené hodnoty kyseliny močovej v krvi
abnormálne hladiny sodíka v krvi
znížené hodnoty vápnika v krvi
znížené hodnoty fosfátov v krvi
zvýšené hladiny cukru v krvi
zvýšené hladiny laktátdehydrogenázy v krvi
prítomnosť autoprotilátok v krvi
nízka hladina draslíka v krvi
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí)
zvýšené hodnoty bilirubínu (krvný test pečene)
Zriedkavé (môžu postihovať až1 z 1000 ľudí)
znížené hodnoty bielych krviniek, červených krviniek a krvných doštičiek
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať IdacioTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na etikete/škatuľke po skratke EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Injekčnú liekovku uchovávajte vo vonkajšej škatuľke na ochranu pred svetlom. Alternatívne uchovávanie:
V prípade potreby (napr. ak cestujete) môžete Idacio uchovávaťpri izbovej teplote(do 25°C) po dobu
maximálne 14 dní - určite ju chráňte pred svetlom.
Akonáhle injekčnú liekovku vyberiete z chladničky a ponecháte pri izbovej teplote,
musíte ju použiťdo 14 dní alebo zlikvidovať, a to aj vtedy, ak ste ju dali naspäť do chladničky.
Zaznamenajte si dátum, keď ste injekčnú liekovku prvýkrát vybrali z chladničky, a dátum, po ktorom sa má zlikvidovať.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Idacio obsahuje- Liečivo je adalimumab. Každá injekčná liekovka obsahuje 40 mg adalimumabu v 0,8 ml roztoku.
- Ďalšie zložky sú dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, manitol, chlorid sodný, monohydrát kyseliny citrónovej, trinátriumcitrát, polysorbát
80, hydroxid sodný a voda na injekcie.
Ako Idacio vyzerá a obsah baleniaIdacio 40 mg/0,8 ml injekčný roztok (injekcia) na pediatrické použitie sa dodáva ako 0,8 ml sterilný,
číry, bezfarebný roztok 40 mg adalimumabu.
Idacio 40 mg/0,8 ml injekčný roztok (injekcia) na pediatrické použitie sa dodáva v injekčnej liekovke. Každé balenie obsahuje 1 injekčnú liekovku (0,8 ml sterilný roztok), 1 sterilnú injekčnú striekačku, 1 sterilnú ihlu, 1 adaptér na injekčnú liekovku a 2 alkoholom napustené tampóny.
Idacio je dostupný ako injekčná liekovka, naplnená injekčná striekačka a ako naplnené pero.
Držiteľ rozhodnutia o registráciiFresenius Kabi Deutschland GmbH Else-Kröner-Straße 1
61352 Bad Homburg v.d.Höhe
Nemecko
VýrobcaFresenius Kabi Austria GmbH
Hafnerstraße 36
8055 Graz
Rakúsko
Merck Serono S.p.A. Via delle Magnolie 15
I-70026 Modugno (Bari)
Taliansko
Táto písomná informácia bola naposledy aktualizovaná vĎalšie zdroje informáciíPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
7. Návod na použitiePred podaním injekcie Idacia si prečítajte návod na použitie a uistite sa, že mu rozumiete a postupujte podľa tohto návodu. Poskytovateľ zdravotníckej starostlivosti vám má ukázať ako pripraviť a správne podať Idacio pomocou sady s injekčnou liekovkou, predtým ako ju použijete po prvý krát. Obráťte sa na svojho poskytovateľa zdravotníckej starostlivosti, ak máte akékoľvek otázky.
Návod na použitie
s injekčnou liekovkou
J
ednorazové komponenty a liek (adalimumab) v injekčnej liekovke na podkožné podanie
4
0 mg/0,8 ml
Po
známka:
o
b
rázky sú len na ilustračné účely.
P
r
ed použitím Idacia sady s injekčnou liekovkou si pozorne prečítajte celý návod na použitie. Dôležité informácie
Idacio sadu s injekčnou liekovkou použite iba vtedy, ak vás zdravotnícky personál zaškolil, ako sa má sada správne použiť.
Idacio sada s injekčnou liekovkou je iba na jednorazové použitie.
Deti si sami nesmú podávať injekciu, injekciu im musí podať zaškolený dospelý.
Uchovávajte všetky komponenty Idacio sady s injekčnou liekovkou a kontajner na ostrý injekčný
odpad mimo dohľadu a dosahu detí.
Netraste injekčnou striekačkou alebo injekčnou liekovkou.
Trasením sa môžu poškodiť.
Obráťte sa na svojho zdravotníckeho pracovníka alebo na lekárnika, ak máte otázky alebo potrebujete poradiť.
Informácie o uchovávaní Uchovávajte Idacio sadu s injekčnou liekovkou vo vonkajšej škatuľke na ochranu pred svetlom.
Uchovávajte Idacio sadu s injekčnou liekovkou v chladničke medzi 2 °C to 8 °C.
V prípade potreby, napríklad pri cestovaní, sa môže Idacio sada s injekčnou liekovkou uchovávať pri
izbovej teplote až do 14 dní.
Krok 1
Z
hromaždenie komponentov a kontrola poškodení
1.1 Vyberte Idacio sadu s injekčnou liekovkou z chladničky.
 1.2
1.2 Nechajte sadu pri izbovej teplote aspoň 30 minutút, aby sa liek zohrial. Injekčné podanie studeného lieku môže bolieť.
 Upozornenie: Nezohrievajte
Upozornenie: Nezohrievajte sadu žiadnym iným spôsobom, ako napríklad v mikrovlnej rúre, horúcej vode alebo na priamom slnečnom svetle.
1.3 Otvorte sadu a vyberte všetky komponenty a položte ich na čistý, suchý, plochý povrch.
Skontrolujte komponenty, aby ste sa uistili, že balenia a obsah nie sú poškodené.

Injekčná
liekovka
Adaptér na injekčnú liekovku

Alkoholom napustené tampóny

Ihla

Injekčná striekačka
Upozornenie: Nepoužívajte, ak sú poškodené.
1.4 Taktiež budete potrebovať nasledujúce položky, ktoré nie sú súčasťou balenia:
čistý vatový tampón alebo gázu a
kontajner na ostrý injekčný odpad (pozri časť 7.2).
Otvorte kontajner, aby ste ho mali pripravený na použitie.
 1.5
1.5 Skontrolujte si svoje záznamy s dátumami a miestami vpichov, aby ste určili miesto nasledujúceho
podania.
Krok 2
Príprava injekčnej
liekovky
2.1 Umyte si ruky mydlom a vodou a dobre si ich osušte.
 Upozornenie:
Upozornenie: Rukavice nenahradia potrebu umyť si ruky.
2.2 Skontrolujte etiketu na injekčnej liekovke Idacia a dátum exspirácie.
EXP : MM/YYYYUpozornenie: Nepoužívajte injekčnú liekovku, ak:
názov na injekčnej liekovke nie je Idacio.
dátum exspirácie na injekčnej liekovke už uplynul.
2.3 Skontrolujte roztok, aby ste sa uistili, že:
Roztok je číry, bezfarebný a bez častíc.
 U
pozornenie: Nepoužívajte
U
pozornenie: Nepoužívajte injekčnú liekovku, ake je roztok zakalený, sfarbený alebo obsahuje
častice alebo vločky.
2.4 Opatrne odstráňte žlté viečko z injekčnej liekovky.
 2.5
2.5 Potrite celý povrch injekčnej liekovky tampónom napusteným alkoholom a tampón vyhoďte.
 Upozornenie:
Upozornenie: Povrchu injekčnej liekovky sa po očistení
nedotýkajte.
2.6 Stiahnite papier z balenia adaptéra na injekčnú liekovku, avšak adaptér na injekčnú liekovku z balenia nevyberajte.
 U
pozornenie: Nedotýkajte
U
pozornenie: Nedotýkajte sa adaptéra injekčnej liekovky.
2.7 Zatiaľ čo je adaptér na injekčnú liekovku stále v svojom balení, nasaďte ho na povrch injekčnej
liekovky tak, aby zapadol.
 2.8
2.8 Držte injekčnú liekovku a odstráňte balenie adaptéra. Aby adaptér ostal na povrchu injekčnej liekovky, držte balenie za vonkajšie okraje.
Krok 3
Príprava injekčnej striekačky

Piest
Hrot Valec Injekčná striekačky
3.1 Otvorte balenie injekčnej striekačky a uchopte injekčnú striekačku za valec.
 Upozornenie: Nedotýkajt
Upozornenie: Nedotýkajte sa hrotu injekčnej striekačky.
3.2 Držte adaptér na injekčnú liekovku, vsuňte hrot injekčnej striekačky do adaptéra a zakrúťte, aby sa
napojili.

3.3 Otočte injekčnú liekovku obrátene, aby bola v zvislej polohe so stále napojenou injekčnou striekačkou.
3.4 Držte injekčnú liekovku a injekčnú striekačku v zvislej polohe a pomaly natiahnite predpísanú dávku.
 Upozornenie:
Upozornenie: Ak sa piest úplne vysunie, vyhoďte injekčnú striekačku.
Nepokúšajte sa opätovne vsunúť piest a použite novú sadu.
3.5 Pomaly úplne zatlačte piest, aby ste liek vrátili späť do injekčnej liekovky. Takto sa odstránia akékoľvek vzduchové miesta alebo bublinky.
Opätovne pomaly natiahnite piest, aby ste natiahli predpísanú dávku a potom zastavte.
Ak stále vidíte vzduchové miesta alebo bublinky v hornej časti injekčnej striekačky, opakujte tento krok až pokiaľ neodstránite všetky vzduchové miesta alebo bublinky.
Netraste injekčnou striekačkou.
Upozornenie: Nepoužívajte injekčnú striekačku, ak sa v nej nachádza veľké množstvo vzduchu.
3.6 Obráťte injekčnú liekovku a injekčnú striekačku, pevne držte adaptér na injekčnú liekovku a
odkrúťte injekčnú striekačku z adaptéra injekčnej liekovky.
 3.7
3.7 Položte injekčnú striekačku na čistý rovný povrch.
Upozornenie: Nedotýkajte sa hrotu injekčnej striekačky.
Upozornenie: Nevyhadzujte injekčnú liekovku.
Krok 4 Príprava ihlyOchranný obal

Poduška pre prst
Žltý
konektor
injekčnej striekačky
Kryt Ihla
4.1 Otvorte balenie ihly tak, aby ste odkryli žltý konektor injekčnej striekačky.
 U
pozornenie: Nevyberajte
U
pozornenie: Nevyberajte ihlu z balenia.
Upozornenie: Nedotýkajte sa žltého konektora.
4.2 Vsuňte hrot injekčnej striekačky do žltého konektora injekčnej striekačky a zatočte, aby sa spojili.
 4.3
4.3 Odstráňte balenie ihly.
Upozornenie: Neodstraňujte priehľadný kryt ihly.
4.4 Stiahnite ružový ochraný obal ihly smerom k injekčnej striekačke.
 Upozornenie:
Upozornenie: Úplne
neoddeľujte ružový ochranný obal ihly od žltého konektora.
4.5 Položte injekčnú striekačku na čistý rovný povrch.
Krok 5
Príprava injekcie
5.1 Vyberte si miesto vpichu na:
vrchnej časti stehien
alebo
spodnej časti brucha (injekciu podávajte aspoň 5 centimetrov od pupka).
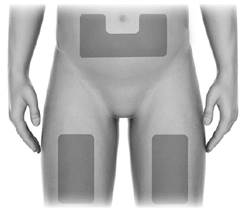
Pre každé podanie si vyberte iné miesto (aspoň 2,5 centimetrov od predchádzajúceho miesta
vpichu),aby ste tak znížili začervenanie, podráždenie pokožky alebo iné kožné problémy.
Upozornenie: Nepodávajte injekciu do miesta, ktoré je bolestivé (citlivé), zmodrané, začervenané, zatvrdnuté, zjazvené alebo, kde máte strie.
5.2 Očistite miesto vpichu tampónom napusteným alkoholom a tampón vyhoďte.
 Upozornenie:
Upozornenie: Keď očistíte miesto vpichu,
nefúkajte na to miesto ani sa ho
nedotýkajte.
5.3 Ťahom nahor odstráňte priehľadný kryt z ihly a vyhoďte ho.
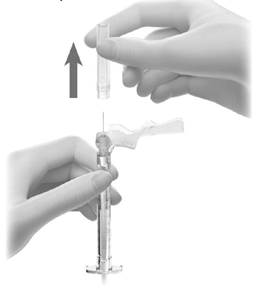 U
pozornenie: Nepokúšajte sa
U
pozornenie: Nepokúšajte sa opätovne nasadiť kryt na ihlu.
5.4 Držte injekčnú striekačku tak, ako pero a tak, aby ružový ochranný obal ihly smeroval nahor.
 Krok 6 Podanie injekcie6.1
Krok 6 Podanie injekcie6.1 Druhou rukou jemne uchopte očistené miesto tak, aby ste vytvorili vyvýšené miesto a pridržte ho.

U
pozornenie: Nedotýkajte sa miesta, kde plánujete podať injekciu.
6.2 Rýchlym krátkym pohybom zaveďte ihlu do kože pod 45° uhlom.
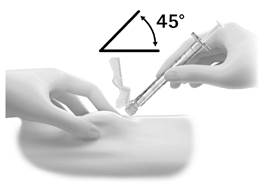 Poznámka:
Poznámka: Praxou si nájdete uhol (medzi 45° a 90°), ktorý bude pre vás a pre dieťa najpohodlnejší.
6.3 Jemne tlačte biely piest úplne nadol, až kým nie je injekčná striekačka prázdna.
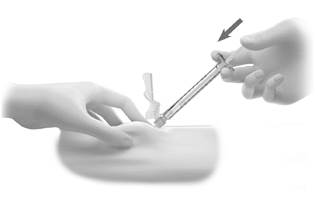 6.4
6.4 Vytiahnite ihlu z kože, avšak starostlivo dbajte na to, aby ste ju vyťahovali pod rovnakým uhlom, pod ktorým ste ju podali.
Potom uvoľnite stačenie kože.
6.5 Položte palec alebo ukazovák na podušku pre prst a zatlačte bezpečnostný kryt cez ihlu až kým nebudete počuť alebo cíťiť, že došlo k uzatvoreniu.
 6.6
6.6 Teraz je ihla zakrytá a zabezpečená. Teraz sa môže odhodiť do kontajnera na ostrý injekčný odpad.
Upozornenie: Obráťte sa na svojho zdravotníckeho pracovníka, ak sa vám nepodarilo podať úplnú dávku.
6.7 Jemne pritlačte na kožu vatový tampón alebo gázu a podržte 10 sekúnd, ak máte v mieste vpichu
krv alebo roztok.
 Upozornenie:
Upozornenie: Miesto vpichu
netrite.
Krok 7
Z
á
z
nam injekcie a
likvidácia kompotentov
7.1 Teraz, keď ste podali injekciu, poznačte si údaje ohľadom:
miesta vpichu
dátumu
akýkoľvek problem, ktorý ste mali
číslo šarže (uvedené na etikete injekčnej liekovky).
 7.2
7.2 Vyhoďte použitú injekčnú striekačku so zabezpečenou ihlou a injekčnú liekovku s napojeným
adaptérom injekčnej liekovky do kontajnera na ostrý injekčný odpad.
 Upozornenie:
Upozornenie: Uchovávajtekontajner na ostrý injekčný odpad mimo dosahu detí.
Upozornenie: Neponechávajte si žiaden nepoužitý liek.
Upozornenie: Nevyhadzujte injekčnú striekačku alebo injekčnú liekovku do svojho domového
odpadu.
Ak nemáte kontajner na ostrý injekčný odpad, môžete použiť domáci kontajner, ktorý:
je vyrobený z vysoko odolného plastu,
je možné uzatvoriť presne padnúcim vrchnákom rezistentným voči prepichnutiu, ktorý zabráni vypadnutiu ostrých ihliel z kontajnera,
stojí rovno a je stabilný počas používania,
nepresakuje a
je náležite označený, že obsahuje nebezpečný odpad.
7.3 Ak už je kontajner na ostrý injekčný odpad skoro naplnený, musíte ho zlikvidovať v súlade s národnými požiadavkami na likvidáciu ostrého injekčného odpadu.
Upozornenie: Nerecyklujte použitý kontajner na ostrý injekčný odpad.