
vádzal pocit slabosti s následným zvýšením telesnej teploty a bolesťou hlavy.
Zoznam nežiaducich reakcií v tabuľkeV tabuľke 1 je zoznam nežiaducich reakcií na liek zo štúdií fázy III (liečba hyperkalciémie indukovanej nádorom: 311 pacientov liečených 2 mg alebo 4 mg kyseliny ibandrónovej; prevencia skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými metastázami:
152 pacientov liečených kyselinou ibandrónovou 6 mg), a z postmarketingovej praxe.
Nežiaduce reakcie sú vymenované podľa tried orgánových systémov MedDRA a kategórií frekvencie. Kategórie frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (frekvencia sa nedá odhadnúť z dostupných údajov). V rámci každej skupiny frekvencie sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 1 Nežiaduce reakcie hlásené po intravenóznom podaní kyseliny ibandrónovejTriedy orgánových
systémov
| Veľmi
časté
| Časté
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
| Neznáme
|
Infekcie a nákazy
|
| Infekcie
| Cystitída,
vaginitída, orálna kandidóza s
|
|
|
|
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov
|
|
| Benígne novotvary
kože
|
|
|
|
Triedy orgánových systémov
|
Veľmi
časté
|
Časté
|
Menej časté
|
Z
r
iedkavé
|
Veľmi zriedkavé
|
Neznáme
|
Poruchy krvi
a lymfatického systému
|
|
|
Anémia, krvná
dyskrázia
|
|
|
|
Poruchy imunitného systému
|
|
|
|
|
Hypersenz itivita†, brochospa zmus† angioedém
†, anafylakti cká reakcia/šo k†**
|
exacerbácia
astmy
|
Poruchy endokrinného systému
|
|
Paratyro
idná porucha
|
|
|
|
|
Poruchy metabolizmu a výživy
|
|
Hypokal
ciémia*
*
|
Hypofosfatémia
|
|
|
|
Psychické poruchy
|
|
|
Poruchy spánku, úzkosť, nervová
labilita
|
|
|
|
Poruchy nervového systému
|
|
Bolesť
hlavy, závrat, dysgeúz ia (poruch a chuti)
|
Cerebrovaskulárna
porucha, lézia nervových koreňov, amnézia, migréna, neuralgia, hypertónia, hyperestézia, cirkumorálna parestézia,
parosmia
|
|
|
|
Poruchy oka
|
|
Katarakt
a
|
|
Zápal
oka†**
|
|
|
Poruchy ucha a labyrintu
|
|
|
Strata sluchu
|
|
|
|
Poruchy srdca a srdcovej činnosti
|
|
Blok cievneh
o
vetvenia
|
Ischémia myokardu,
kardiovaskulárna
porucha, palpitácie
|
|
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Faryngit
ída
|
Pľúcny edém,
stridor
|
|
|
|
Triedy orgánových systémov
|
Veľmi
časté
|
Časté
|
Menej časté
|
Z
r
iedkavé
|
Veľmi zriedkavé
|
Neznáme
|
Poruchy gastrointestinálne ho traktu
|
|
Hnačka,
dyspepsi a, vracanie
, bolesť
v gastroi ntestinál nej oblasti, poruchy zubov
|
Gastroenteritída,
dysfágia, gastritída, ulcerácie v ústach, cheilitída
|
|
|
|
Poruchy pečene a žlčových ciest
|
|
|
Cholelitiáza
|
|
|
|
Poruchy kože a podkožného tkaniva
|
|
Porucha
kože, ekchym óza
|
Vyrážka, alopécia
|
|
|
|
Poruchy kostrovej a svalovej sústavy a spojivového
tkaniva
|
|
Osteoart
ritída, myalgia, artralgia
, porucha kĺbov, bolesť kostí
|
|
Atypické
subtrochan terické
a diafyzárn e zlomeniny stehennej kosti†
|
Osteone-
króza
čeľuste†
**
|
|
Poruchy obličiek a močových ciest
|
|
|
Retencia moču, cysty na obličkách
|
|
|
|
Poruchy reprodukčného systému
a prsníkov
|
|
|
Bolesť v panve
|
|
|
|
Celkové poruchy
a reakcie v mieste podania
|
|
Pyrexia,
ochoreni e podobné chrípke, periférn
y edém, asténia, smäd
|
Hypotermia
|
|
|
|
Laboratórne a funkčné
vyšetrenia
|
|
Zvýšená hladina
Gama-
GT, zvýšená hladina kreatiní nu
|
Zvýšená hladina alkalickej fosfatázy
v krvi, úbytok
hmotnosti
|
|
|
|
Úrazy, otravy a komplikácie
liečebného postupu
|
|
|
Poranenia, bolesť
v mieste podania injekcie
|
|
|
|
**Pozri ďalšie informácie nižšie
†Zistené z postmarketingovej praxe.
Popis vybraných nežiaducich reakcií
Hypokalciémia
Znížené vylučovanie vápnika obličkami môže sprevádzať pokles hladín fosfátov v sére, ktorý si nevyžaduje žiadne terapeutické opatrenia. Hladina vápnika v sére môže klesnúť na hypokalciemické hodnoty.
Ochorenie podobné chrípke
Vyskytol sa syndróm podobný chrípke prejavujúci sa horúčkou, zimnicou, bolesťou kostí a/alebo svalov. Vo väčšine prípadov nebola potrebná žiadna špecifická liečba a príznaky ustúpili v priebehu niekoľkých hodín/dní.
Osteonekróza čeľuste
U pacientov liečených bisfosfonátmi bola hlásená osteonekróza čeľuste. Väčšina týchto prípadov bola u pacientov s nádorovým ochorením, ale hlásenia boli aj u pacientov liečených na osteoporózu. Osteonekróza čeľuste je väčšinou spojená s extrakciou zubov a/alebo lokálnou infekciou (vrátane
osteomyelitídy). Diagnóza nádorového ochorenia, chemoterapia, rádioterapia, kortikosteroidy a slabá
orálna hygiena sa tiež považujú za rizikové faktory (pozri časť 4.4).
Zápal oka
Zápaly oka ako uveitída, episkleritída a skleritída boli hlásené pri liečbe bifosfonátmi, vrátane
kyseliny ibandrónovej. V niekoľkých prípadoch tieto zápaly neustúpili, pokiaľ nebola prerušená liečba bisfosfonátmi.
Anafylaktická reakcia/šok
Prípady anafylaktickej reakcie/šoku, vrátane fatálnych prípadov, boli hlásené u pacientov liečených intravenózne podávanou kyselinou ibandrónovou.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Dosiaľ neexistujú žiadne skúsenosti s akútnou intoxikáciou infúznym koncentrátom kyseliny ibandrónovej. Keďže v predklinických štúdiách s vysokými dávkami lieku sa zistilo, že cieľovými orgánmi toxicity lieku sú pečeň a obličky, funkcie týchto orgánov sa majú sledovať. Klinicky významná hypokalciémia sa má korigovať intravenóznym podaním glukonátu vápenatého.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Lieky na liečbu ochorenia kostí, bisfosfonát, ATC kód: M05BA06
Kyselina ibandrónová patrí do skupiny bisfosfonátov, t.j. látok, ktoré špecificky pôsobia na kosť. Ich selektívny účinok na kostné tkanivo je založený na vysokej afinite bisfosfonátov ku kostnému minerálu. Bisfosfonáty pôsobia prostredníctvom inhibície aktivity osteoklastov, hoci presný mechanizmus ich účinku nie je stále objasnený.
Kyselina ibandrónová zabraňuje
in vivo experimentálne indukovanému odbúravaniu kostného tkaniva v dôsledku straty funkcie gonád, vplyvu retinoidov, nádorov alebo nádorových extraktov. Inhibícia endogénnej resorpcie kosti sa taktiež potvrdila v kinetických štúdiách 45Ca a na základe uvoľnenia rádioaktívne označeného tetracyklínu, ktorý bol predtým naviazaný v skelete.
Pri dávkach, ktoré boli považované za výrazne vyššie ako sú farmakologicky účinné dávky, kyselina ibandrónová nemala žiadny vplyv na mineralizáciu kostí.
Resorpcia kosti, ktorá je zapríčinená malígnym ochorením, je charakterizovaná nadmernou resorpciou kosti, ktorá nie je v rovnováhe s primeranou tvorbou kosti. Kyselina ibandrónová selektívne inhibuje aktivitu osteoklastov, čím sa redukuje resorpcia kosti, a tým sa znižuje aj výskyt skeletálnych komplikácií pri malígnom ochorení.
Klinické štúdie zamerané na liečbu hyperkalciémie vyvolanej nádorovým procesomKlinické štúdie zamerané na hyperkalciémiu pri malígnom ochorení dokázali, že inhibičný účinok kyseliny ibandrónovej na osteolýzu vyvolanú nádorom a najmä na hyperkalciémiu vyvolanú nádorom je charakterizovaný poklesom hladiny vápnika v sére a nižším vylučovaním vápnika do moču.
V dávkovom rozmedzí, ktoré je odporučené na liečbu, sa v klinických štúdiách získali nasledujúce údaje o odpovedi na liečbu spolu s intervalmi spoľahlivosti u pacientov s východiskovými hodnotami vápnika v sére korigovanými na albumín 3,0 mmol/l po primeranej rehydratácii.
6 mg
4 mg
vysoká
90% interval spoľahlivosti
dávka kyseliny ibandrónovej
vysoká
90% interval odpoveď
|
|
poveď
eeččbubu nínízzkkaa
90%90% iinn
|
|
od na li

terval spoľahlivosti
Dávka
kyseliny ibandrónovej
|
% pacientov
s odpoveďou
|
90 % interval
spoľahlivosti
|
2 mg
|
54
|
44-63
|
4 mg
|
76
|
62-86
|
6 mg
|
78
|
64-88
|
U týchto pacientov sa pri uvedenom dávkovaní pohyboval priemerný čas do dosiahnutia normokalciémie medzi 4 a 7 dňami. Priemerný čas do vzniku recidívy (opätovné zvýšenie hodnoty vápnika v sére korigovaného vzhľadom na albumín nad 3 mmol/l) bol 18 – 26 dní.
Klinické štúdie zamerané na prevenciu skeletálnych udalostí u pacientov s rakovinou prsníka akostnými metastázamiKlinické štúdie zamerané na pacientov s rakovinou prsníka a kostnými metastázami ukázali inhibičný vplyv na osteolýzu kosti v závislosti od dávkovania, vyjadrený markermi kostnej resorpcie a vplyv na skeletálne udalosti v závislosti od dávkovania.
Prevencia skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými metastázami, liečených kyselinou ibandrónovou 6 mg podávanou intravenózne, bola stanovená v III. fáze kontrolovanej štúdie s placebom v trvaní 96 týždňov. Pacientky s rakovinou prsníka a rádiologicky potvrdenými kostnými metastázami dostávali placebo (158 pacientok) alebo 6 mg kyseliny ibandrónovej (154 pacientok). Výsledky tejto štúdie sú zhrnuté nižšie.
Primárne konečné výsledky účinnostiPrimárnym konečným výsledkom štúdie bola miera obdobia skeletálnej morbidity (SMPR). Bol to kombinovaný konečný výsledok, ktorý zahŕňal nasledujúce skeletálne udalosti (SREs) ako jednotlivé
zložky:
- rádioterapia kostí pri liečbe fraktúr/hroziacich fraktúr
- chirurgické zásahy do kostí pri liečbe fraktúr
- vertebrálne fraktúry
- nevertebrálne fraktúry.
Analýza SMPR bola upravená vzhľadom na čas a uvažovalo sa potenciálne o jednej alebo viacerých udalostiach počas 12-týždňového obdobia. Početné udalosti sa preto za účelom analýzy započítali len raz. Údaje z tejto štúdie dokázali významný úžitok intravenóznej kyseliny ibandrónovej 6 mg oproti placebu pri redukcii skeletálnych udalostí meraných mierou SMPR upravenou vzhľadom na čas
(p = 0,004). Kyselina ibandrónová 6 mg významne znížila počet skeletálnych udalostí a v porovnaní s placebom sa riziko vzniku skeletálnych udalostí znížilo o 40 % (relatívne riziko 0,6; p = 0,003). Výsledky týkajúce sa účinnosti sú zhrnuté v tabuľke 2.
Tabuľka 2 Výsledky účinnosti (u pacientov s rakovinou prsníka s kostnými metastázami)
| Všetky skeletálne udalosti (SREs)
|
| Placebo
n = 158
| Kyselina ibandrónová
6 mg
n = 154
| p-hodnota
|
SMPR (na pacienta za rok)
| 1,48
| 1,19
| p = 0,004
|
Počet udalostí
(na pacienta)
|
3,64
|
2,65
|
p = 0,025
|
Relatívne riziko SRE
| -
| 0,60
| p = 0,003
|
Sekundárne konečné výsledky účinnostiPri intravenóznej kyseline ibandrónovej 6 mg sa dokázalo štatisticky významné zlepšenie bolesti kostí v porovnaní s placebom. Bolesti boli v porovnaní s východiskovým bodom menšie počas celej štúdie,
čo bolo sprevádzané významne zredukovaným používaním analgetík. Zníženie kvality života bolo
významne menšie u pacientov liečených kyselinou ibandrónovou v porovnaní s placebom. Súhrn týchto sekundárnych výsledkov účinnosti je uvedený v tabuľke 3.
Tabuľka 3 Sekundárne výsledky účinnosti (u pacientov s rakovinou prsníka s kostnými metastázami)
|
Placebo n = 158
|
Kyselina ibandrónová
6 mg
n = 154
|
p-hodnota
|
Bolesť kostí*
|
0,21
|
- 0,28
|
p < 0,001
|
Používanie analgetík*
|
0,90
|
0,51
|
p = 0,083
|
Kvalita života*
|
- 45,4
|
- 10,3
|
p = 0,004
|
* Priemerná zmena oproti východiskovému bodu po posledné vyhodnotenie.
U pacientov liečených kyselinou ibandrónovou sa pozoroval značný pokles urinárnych markerov resorpcie kosti (pyridinolín a deoxypyridinolín), ktorý bol štatisticky významný v porovnaní
s placebom.
V štúdii u 130 pacientov s rakovinou prsníka s metastázami sa porovnala bezpečnosť kyseliny ibandrónovej podávanej formou infúzie trvajúcej viac ako 1 hodinu alebo 15 minút. Nepozoroval sa žiaden rozdiel v indikátoroch funkcie obličiek. Celkový profil nežiaducich udalostí kyseliny ibandrónovej po 15-minútovej infúzii sa zhodoval so známym bezpečnostným profilom po dlhších časoch podávania infúzie a neidentifikovali sa žiadne nové bezpečnostné problémy súvisiace s použitím 15-minútového času podávania infúzie.
15-minútový čas podávania infúzie sa neskúmal u pacientov s rakovinou s klírensom kreatinínu
< 50 ml/min.
Pediatrická populácia (pozri časť 4.2 a časť 5.2)Bezpečnosť a účinnosť kyseliny ibandrónovej u detí a dospievajúcich mladších ako 18 rokov neboli stanovené. Nie sú dostupné žiadne údaje.
5.2 Farmakokinetické vlastnostiFarmakokinetické parametre sú po 2 hodinách infúzie 2, 4 a 6 mg kyseliny ibandrónovej úmerné dávke.
DistribúciaKyselina ibandrónová sa po počiatočnej systémovej expozícii rýchlo viaže na kosť alebo sa vylúči do moču. U ľudí je evidentný terminálny objem distribúcie najmenej 90 l a množstvo dávky, ktoré sa
dostane do kosti, sa odhaduje na 40 až 50 % cirkulujúcej dávky. Väzba proteínu v ľudskej plazme je pri terapeutických koncentráciách približne 87 %, a preto je nepravdepodobná interakcia s inými liekmi zapríčinená vytlačením.
BiotransformáciaNeexistuje žiaden dôkaz, že kyselina ibandrónová je u zvierat alebo ľudí metabolizovaná.
ElimináciaRozsah pozorovaného evidentného polčasu je široký a závisí od dávky a citlivosti testu, avšak evidentný terminálny polčas sa vo všeobecnosti pohybuje v rozsahu 10 až 60 hodín. Hladiny v plazme
však klesajú rýchlo, dosahujúc 10 % vrcholných hodnôt do 3 a 8 hodín po intravenóznom alebo
perorálnom podaní. Keď bola kyselina ibandrónová podávaná intravenózne raz za 4 týždne počas
48 týždňov pacientom s kostnými metastázami, nepozorovala sa žiadna systémová akumulácia.
Celkový klírens kyseliny ibandrónovej je nízky s priemernými hodnotami v rozsahu 84 až 160 ml/min. Renálny klírens (asi 60 ml/min u zdravých žien po menopauze) je 50 – 60 % z celkového klírensu a
súvisí s klírensom kreatinínu. Rozdiel medzi evidentným celkovým a renálnym klírensom je zrejme v dôsledku absorpcie kosťou.
Zdá sa, že sekrečná dráha eliminácie nezahŕňa známe kyslé alebo zásadité transportné systémy podieľajúce sa na vylučovaní iných liečiv. Okrem toho kyselina ibandrónová neinhibuje hlavné izoenzýmy pečeňového cytochrómového systému P450 u ľudí a neindukuje pečeňový cytochrómový systém P450 u potkanov.
Farmakokinetika u osobitných skupín pacientov
Pohlavie
Biologická dostupnosť a farmakokinetika kyseliny ibandrónovej je u mužov a žien podobná.
Rasa
Pokiaľ ide o užívanie kyseliny ibandrónovej, neexistuje žiaden dôkaz klinicky významných interetnických rozdielov medzi aziatmi a belochmi. Je dostupných len veľmi málo údajov o pacientoch s africkým pôvodom.
Pacienti s poruchou funkcie obličiek
Expozícia kyseline ibandrónovej u pacientov s rôznymi stupňami poruchy funkcie obličiek súvisí
s klírensom kreatinínu (CLcr). U jedincov s ťažkou poruchy funkcie obličiek (priemerný odhadovaný CLcr = 21,2 ml/min), sa k dávke prispôsobená priemerná AUC0-24h zvýšila o 110 % v porovnaní so zdravými dobrovoľníkmi. V klinickej štúdii zameranej na farmakológiu, WP18551, sa
po intravenóznom podaní jednorazovej dávky 6 mg (formou 15-minútovej infúzie) priemerná hodnota AUC0-24 zvýšila o 14 % u jedincov s miernym (priemerný odhadovaný CLcr = 68,1 ml/min) a o 86 % u jedincov so stredne ťažkou (priemerný odhadovaný CLcr = 41,2 ml/min) poruchou funkcie obličiek v porovnaní so zdravými dobrovoľníkmi (priemerný odhadovaný CLcr = 120 ml/min). Priemerná
hodnota Cmax sa nezvýšila u pacientov s miernou poruchou funkcie obličiek a zvýšila sa o 12 %
u pacientov so stredne ťažkou poruchou funkcie obličiek. U pacientov s miernou poruchou funkcie
obličiek (CLcr ≥ 50 a < 80 ml/min) nie je nutná úprava dávkovania. U pacientov s rakovinou prsníka a kostnými metastázami so stredne závažnou poruchou funkcie obličiek (CLcr ≥ 30 a < 50 ml/min) alebo závažnou poruchou funkcie obličiek (CLcr < 30 ml/min), ktorí sú liečení z dôvodu prevencie skeletálnych udalostí, sa odporúča dávku upraviť (pozri časť 4.2).
Pacienti s poruchou funkcie pečene (pozri časť 4.2)
Nie sú známe žiadne farmakokinetické údaje o kyseline ibandrónovej u pacientov s poruchou funkcie pečene. Pečeň nehrá žiadnu významnú úlohu pri klírense kyseliny ibandrónovej, pretože nie je metabolizovaná, ale je uvoľnená renálnou exkréciou a absorbovaná kosťami. Preto u pacientov
s poruchou funkcie pečene nie je potrebné upraviť dávkovanie. Keďže väzba proteínu kyseliny ibandrónovej pri terapeutických koncentráciách je približne 87 %, je nepravdepodobné, že by hypoproteinémia u pacientov s ťažkou poruchou funkcie pečene viedla ku klinicky významnému zvýšeniu koncentrácie vo voľnej plazme.
Starší ľudia (pozri časť 4.2)
Na základe viacnásobnej analýzy sa nezistilo, že by vek bol nezávislým faktorom akéhokoľvek zo študovaných farmakokinetických parametrov. Jediný faktor, ktorý sa má brať do úvahy je ten, že
s vekom sa znižuje funkcia obličiek (pozri časť porucha funkcie obličiek).
Pediatrická populácia (pozri časť 4.2 a časť 5.1)
Neexistujú žiadne údaje o užívaní kyseliny ibandrónovej pacientami u pacientou mladších ako
18 rokov.
5.3 Predklinické údaje o bezpečnosti
Účinky v predklinických štúdiách sa pozorovali iba po dávkach považovaných za dostatočne vyššie
než je maximálna dávka u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie. Tak ako v prípade iných bisfosfonátov, oblička bola hlavným cieľovým orgánom systémovej toxicity.
M
u
tagenita/Karcinogenita:
Nepozoroval sa žiadny náznak karcinogénneho potenciálu. Testy na genotoxicitu nedokázali žiadny náznak účinku na genetickú aktivitu kyseliny ibandrónovej.
Reprodukčná toxicita:
U potkanov a králikov, ktorým bola kyselina ibandrónová podávaná intravenózne, sa nezistil žiadny náznak priamej toxicity na plod alebo teratogénne účinky. V reprodukčných štúdiách u potkanov perorálne podávanie pri dávkach 1 mg/kg/deň a vyšších viedlo k nárastu preimplantačných potratov. V
reprodukčných štúdiách u potkanov intravenózne podávaná kyselina ibandrónová znížila počet spermií
pri dávkach 0,3 a 1 mg/kg/deň a znížil fertilitu u samcov pri dávke 1 mg/kg/deň a u žien pri dávke na
1,2 mg/kg/deň. Nežiaduce účinky kyseliny ibandrónovej na základe štúdií reprodukčnej toxicity u potkanov boli také, aké sa očakávali u tejto triedy liekov (bisfosfonáty). Tieto zahŕňajú znížený počet implantačných miest, narušenie prirodzeného pôrodu (ťažký pôrod), nárast viscerálnych odchýliek (syndróm renálnej panvičky a močovodu) a anomálií zubov u F1 potomstva potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný
Trihydrát octanu sodného Ľadová kyselina octová Voda na injekciu
6.2 Inkompatibility
Kvôli prevencii vzniku potenciálnych inkompatibilít sa infúzny koncentrát kyseliny ibandrónovej má riediť len s izotonickým roztokom chloridu sodného alebo 5% roztokom glukózy.
Infúzny koncentrát kyseliny ibandrónovej sa nemá miešať s roztokmi, ktoré obsahujú vápnik.
6.3 Čas použiteľnosti
2 roky
Po nariedení:
Chemická a fyzikálna stabilita pri použití po nariedení v 0,9% roztoku chloridu sodného alebo 5%
roztoku glukózy bola preukázaná na 36 hodín pri 25 °C a 2 °C až 8 °C.
Z mikrobiologického hľadiska sa má tento infúzny roztok použiť okamžite. Ak sa liek nepoužije okamžite, jeho užívateľ je zodpovedný za podmienky a dĺžku uchovávania pred použitím, ktorá by za normálnych okolností nemala presiahnuť 24 hodín pri 2 °C až 8 °C, ak nariedenie neprebehlo za kontrolovaných a platných aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky uchovávania nariedeného lieku nájdete v časti 6.3.
6.5 Druh obalu a obsah balenia
6 ml sklenená injekčná liekovka (typ I) s fluorotec/gumovou zátkou a hliníkovým uzáverom s levanduľovým flip off viečkom. Dodáva sa v baleniach, ktoré obsahujú 1 injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne. Uvoľnenie liečiv do prostredia má byť znížené na minimum.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited
Sage House
319, Pinner Road North Harrow Middlesex HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/12/798/001
9. DÁTUM PRVEJ REGISTRÁCIEDátum prvej registrácie
:19 november 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/
1. NÁZOV LIEKUIbandronic Acid Accord 6 mg infúzny koncentrát
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEJedna injekčná liekovka s obsahom 6 ml infúzneho koncentrátu obsahuje 6 mg kyseliny ibandrónovej
(ako sodný monohydrát).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInfúzny koncentrát. Bezfarebný, číry roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieKyselina ibandrónová je indikovaná u dospelých na
- Prevenciu skeletálnych udalostí (patologické fraktúry, kostné komplikácie vyžadujúce rádioterapiu alebo chirurgický zásah) u pacientov s rakovinou prsníka a kostnými metastázami
- Liečbu hyperkalciémie vyvolanej nádorovým procesom s metastázami alebo bez metastáz
4.2 Dávkovanie a spôsob podávaniaLiečbu kyselinou ibandrónovou majú zahájiť lekári, ktorí majú skúsenosti s liečbou nádorov. Dávkovanie
Prevencia skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými metastázamiOdporúčaná dávka pri prevencii skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými
metastázami je 6 mg lieku, ktorý sa podáva formou intravenóznej injekcie každé 3 až 4 týždne. Podávanie lieku pomocou infúzie má trvať aspoň 15 minút.
Kratší (t.j. 15 min) čas podávania infúzie sa má použiť len u pacientov s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek. Nie sú dostupné údaje charakterizujúce použitie kratšieho času podávania infúzie u pacientov, u ktorých je hodnota klírensu kreatinínu nižšia ako 50 ml/min. Predpisujúci lekári majú vziať do úvahy časť
Pacienti s poruchou funkcie obličiek (pozri časť 4.2) kvôli odporúčaniam o dávkovaní a podávaní.
Liečba hyperkalciémie vyvolanej nádorovým procesomPred liečbou kyselinou ibandrónovou má byť každý pacient primerane rehydratovaný roztokom chloridu sodného s koncentráciou 9 mg/ml (0,9 %). Pri liečbe sa má zvážiť stupeň hyperkalciémie ako aj druh nádorového ochorenia. Vo všeobecnosti platí, že pacienti s osteolytickými kostnými metastázami si vyžadujú nižšie dávky ako pacienti s humorálnym typom hyperkalciémie. U väčšiny
pacientov s ťažkou hyperkalciémiou (s hodnotami vápnika v sére korigovaného vzhľadom na
albumín* 3 mmol/l alebo 12 mg/dl) sa vystačí s jednorazovou dávkou 4 mg. U pacientov so stredne ťažkou hyperkalciémiou (s hodnotami vápnika v sére korigovaného vzhľadom na albumín < 3 mmol/l alebo < 12 mg/dl) je účinná dávka 2 mg. Najvyššia dávka, ktorá sa použila
v klinických štúdiách, bola 6 mg, avšak táto dávka nevedie k ďalšiemu zvyšovaniu účinnosti.
*Poznámka: koncentrácia vápnika v sére korigovaná vzhľadom na albumín sa vypočíta nasledujúcim spôsobom:
Hodnota vápnika v sére korigovaného vzhľadom
na albumín (mmol/l)
| =
| vápnik v sére (mmol/l) –
[0,02 x albumín(g/l)] + 0,8
|
Alebo
|
Hodnota vápnika v sére korigovaného vzhľadom
na albumín (mg/dl)
| =
| vápnik v sére (mg/dl) + 0,8 x [4 – albumín
(g/dl)]
|
Pri premene hodnoty vápnika v sére korigovaného vzhľadom na albumín z mmol/l
na mg/dl sa táto hodnota násobí 4.
|
Vo väčšine prípadov je možné znížiť zvýšenú hladinu vápnika v sére v priebehu 7 dní. Priemerný čas
do vzniku recidívy (opätovné zvýšenie hodnoty vápnika v sére korigovaného vzhľadom na albumín nad 3 mmol/l) po dávkach 2 mg a 4 mg bol 18 až 19 dní. Pri dávke 6 mg bol priemerný čas do vzniku recidívy 26 dní.
Obmedzený počet pacientov (50 pacientov) dostal druhú infúziu kvôli hyperkalciémii. V prípade recidivujúcej hyperkalciémie alebo nedostatočnej účinnosti je možné zvážiť opakovanú liečbu.
Infúzny koncentrát kyseliny ibandrónovej sa má podávať vo forme intravenóznej infúzie počas 2
hodín.
Osobitné skupinyPacienti s poruchou funkcie pečeneÚprava dávky nie je potrebná (pozri časť 5.2).
Pacienti s poruchou funkcie obličiekU pacientov s miernou poruchou funkcie obličiek (CLcr ≥ 50 a < 80 ml/min) nie je nutná úprava dávky. U pacientov s rakovinou prsníka a kostnými metastázami so stredne závažnou poruchou funkcie obličiek (CLcr ≥ 30 a < 50 ml/min) alebo závažnou poruchou funkcie obličiek (CLcr <

30 ml/min), ktorí sú liečení z dôvodu prevencie skeletálnych udalostí, sa majú dodržiavať nasledujúce odporúčania (pozri časť 5.2):
Klírens kreatinínu

(ml/min)
Dávkovanie/Čas podávania 2
infúzie1 Objem infúzie
≥ 50 CLcr < 80 6 mg/15 minút 100 ml
≥ 30 CLcr < 50 4 mg/1 hodina 500 ml
< 30 2 mg/1 hodina 500 ml

1 Podávanie každé 3 až 4 týždne
2 0,9 % roztok chloridu sodného alebo 5 % roztok glukózy
15-minútový čas podávania infúzie sa neskúmal u pacientov s rakovinou s CLcr < 50 ml/min.
Starší ľudia (> 65 rokov)Úprava dávkovania nie je potrebná (pozri časť 5.2).
Pediatrická populácia Bezpečnosť a účinnosť kyseliny ibandrónovej u detí a dospievajúcich mladších ako 18 rokov nebola stanovená. Nie sú dostupné žiadne údaje (pozri časť 5.1 a časť 5.2).
Spôsob podaniaNa intravenózne podanie.
Obsah injekčnej liekovky sa má použiť nasledovne:
- Prevencia skeletálnych udalostí – pridáva sa k 100 ml izotonického roztoku chloridu sodného alebo 100 ml 5 % roztoku glukózy a infúzia sa podáva minimálne 15 minút. Pozri tiež vyššie uvedenú časť týkajúcu sa dávky pre pacientov s poruchou funkcie obličiek.
- Liečba hyperkalciémie vyvolanej nádorom – pridáva sa k 500 ml izotonického roztoku chloridu sodného alebo 500 ml 5 % roztoku glukózy a infúzia sa podáva minimálne 2 hodiny.
Len na jednorazové použitie. Použiť sa má len číry roztok, ktorý neobsahuje žiadne čiastočky. Infúzny koncentrát kyseliny ibandrónovej sa má podávať formou intravenóznej infúzie.
Treba dávať pozor, aby sa infúzny koncentrát kyseliny ibandrónovej nepodal intraarteriálne alebo paravenóznevenózne, pretože to môže viesť k poškodeniu tkaniva.
4.3 Kontraindikácie- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Hypokalciémia
4.4 Osobitné upozornenia a opatrenia pri používaníPacienti s poruchou kostí a minerálneho metabolizmuPred začiatkom liečby kyselinou ibandrónovou v prípade kostných metastáz sa má účinne liečiť
hypokalciémia a iné poruchy metabolizmu kostí a minerálnych látok.
U všetkých pacientov je dôležitý adekvátny príjem vápnika a vitamínu D. Ak je príjem vápnika a/alebo vitamínu D zo stravy nedostatočný, pacienti majú tieto látky prijímať dodatočne.
Anafylaktická reakcia/šokPrípady anafylaktickej reakcie/šoku, vrátane fatálnych prípadov, boli hlásené u pacientov liečených intravenózne podávanou kyselinou ibandrónovou.
Pri podávaní intravenóznej injekcie kyseliny ibandrónovej má byť k dispozícii zodpovedajúca lekárska pomoc a výsledky monitorovania. Ak sa vyskytne anafylaktická reakcia alebo iné závažné reakcie z precitlivenosti / alergické reakcie, podávanie injekcie treba okamžite prerušiť a zahájiť vhodnú liečbu.
Osteonekróza čeľusteOsteonekróza čeľuste, vo všeobecnosti spojená s extrakciou zubov a/alebo lokálnou infekciou (vrátane
osteomyelitídy) bola hlásená u pacientov . U pacientov s nádorovým ochorením, ktorí v pôvodnom liečebnom režime dostávali intravenózne podávané bisfosfonáty. Mnohí títo pacienti dostávali tiež chemoterapiu a kortikosteroidy. Osteonekróza čeľuste bola tiež hlásená u pacientov s osteoporózou, ktorí dostávali perorálne bisfosfonáty.
Pred začiatkom liečby s bisfosfonátmi sa má zvážiť u pacientov s rizikovými faktormi (napr. nádorové ochorenie, chemoterapia, rádioterapia, kortikosteroidy, slabá orálna hygiena) zubné vyšetrenie
s primeranými preventívnymi stomatologickými zásahmi.
Počas liečby sa podľa možností majú títo pacienti vyhýbať invazívnym stomatologickým procedúram. U pacientov, ktorým sa počas liečby bisfosfonátmi vyvinula osteonekróza čeľuste, môže stomatochirurgický zásah exacerbovať ťažkosti. Pre pacientov vyžadujúcich stomatologické procedúry nie sú dostupné údaje, či prerušenie liečby bisfosfonátmi redukuje riziko osteonekrózy čeľuste.
Klinický posudok ošetrujúceho lekára sa má riadiť podľa individuálneho zhodnotenia prínosu/rizika pre pacienta.
Atypické zlomeniny stehennej kostiPri liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti, predovšetkým u pacientov, ktorí sa dlhodobo liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo žiadnej traume a
u niektorých pacientov sa niekoľko týždňov až mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne alebo slabine, pri zobrazovacom vyšetrení často spojená s charakteristikami únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov liečených bisfosfonátmi, ktorí utrpeli zlomeninu stehennej kosti, vyšetriť aj kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej kosti sa má na základe individuálneho zhodnotenia prínosu a rizika pre pacienta zvážiť prerušenie liečby bisfosfonátmi.
Počas liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť v stehne, bedre alebo slabine a každého pacienta s takýmito príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej kosti.
Pacienti s poruchou funkcie obličiekNa základe klinických štúdií sa nedokázal vplyv dlhodobej liečby kyselinou ibandrónovou na zhoršenie funkcie obličiek. Napriek tomu na základe klinických skúseností s jednotlivými pacientami sa u pacientov liečených kyselinou ibandrónovou odporúča sledovať funkciu obličiek, hodnoty hladín vápnika v sére, fosfátov a horčíka (pozri časť 4.2).
Pacienti s poruchou funkcie pečenePre pacientov s ťažkou hepatálnou insuficienciou neexistujú žiadne osobitné odporučenia pre dávku vzhľadom na chýbajúce klinické údaje (pozri časť 4.2).
Pacienti s poruchou srdcaU pacientov s rizikom srdcového zlyhania sa má predísť nadmernej hydratácii.
Pacienti so známou precitlivenosťou na iné bisfosfonátyU pacientov so známou precitlivenosťou na iné bisfosfonáty je potrebná opatrnosť.
Pomocné látky so známym účinkomTento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej liekovke, t.j. v podstate je bez sodíka.
4.5 Liekové a iné interakcieMetabolické interakcie sa nepovažujú za pravdepodobné, pretože kyselina ibandrónová neinhibuje u ľudí dôležité pečeňové izoenzýmy P450 a ukázalo sa, že neindukuje systém cytochrómu P450 v pečeni potkanov (pozri časť 5.2). Kyselina ibandrónová sa vylučuje len renálnou exkréciou a nepodlieha žiadnej biotransformácii.
Opatrnosť je potrebná, keď sa bisfosfonáty podávajú v kombinácii s aminoglykozidmi, pretože obe látky môžu dlhodobejšie znížiť hodnoty vápnika v sére. Pozornosť sa má taktiež venovať možnej simultánnej hypomagneziémii.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostatočné údaje o použití kyseliny ibandrónovej u gravidných žien. Štúdie
na potkanoch preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Preto sa kyselina ibandrónová nemá používať počas gravidity.
LaktáciaNie je známe, či sa kyselina ibandrónová vylučuje do ľudského mlieka. Štúdie na dojčiacich potkanoch dokázali prítomnosť nízkych hladín kyseliny ibandrónovej v mlieku po intravenóznom podaní. Kyselina ibandrónová sa nemá používať počas dojčenia.
FertilitaNie sú k dispozícii údaje o účinkoch kyseliny ibandrónovej u ľudí. V reprodukčných štúdiách u potkanov perorálne podávaná kyselina ibandrónová znížila fertilitu. V štúdiách u potkanov intravenózne podávaná kyselina ibandrónová znížila fertilitu pri vysokých denných dávkach (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNa základe farmakodynamického a farmakokinetického profilu a hlásených nežiaducich reakcií sa predpokladá, že kyselina ibandrónová nemá žiadny alebo len zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluNajzávažnejšie hlásené nežiaduce účinky sú anafylaktická reakcia/šok, atypické zlomeniny stehennej kosti, osteonekróza čeľuste a zápal oka (pozri odsek "Popis vybraných nežiaducich reakcií" a časť
4.4).
Liečba hyperkalciémie indukovanej nádorom je najčastejšie sprevádzaná zvýšením telesnej teploty. Menej často sa zaznamenalo zníženie sérového vápnika pod dolnú hranicu normy (hypokalciémia).
Poznámka: Údaje pre dávku 2 mg a 4 mg kyseliny ibandrónovej boli uvedené spoločne
Vo väčšine prípadov nie je potrebná žiadna špecifická liečba a príznaky ustúpia v priebehu niekoľkých hodín alebo dní.
Pri prevencii skeletálnych udalostí u pacientov s karcinómom prsníka a kostnými metastázami liečbu najčastejšie sprevádzal pocit slabosti s následným zvýšením telesnej teploty a bolesťou hlavy.
Zoznam nežiaducich reakcií v tabuľkeV tabuľke 1 je zoznam nežiaducich reakcií na liek zo štúdií fázy III (liečba hyperkalciémie indukovanej nádorom: 311 pacientov liečených 2 mg alebo 4 mg kyseliny ibandrónovej; prevencia skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými metastázami: 152 pacientov liečených kyselinou ibandrónovou 6 mg), a z postmarketingovej praxe.
Nežiaduce reakcie sú vymenované podľa tried orgánových systémov MedDRA a kategórií frekvencie. Kategórie frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (frekvencia sa nedá odhadnúť z dostupných údajov). V rámci každej skupiny frekvencie sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 1 Nežiaduce reakcie hlásené po intravenóznom podaní kyseliny ibandrónovejTriedy orgánových systémov
| Veľ mi časté
| Časté
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
| Neznáme
|
Infekcie a nákazy
|
| Infekcie
| Cystitída,
vaginitída,
orálna kandidóza s
|
|
|
|
Benígne
|
|
| Benígne
|
|
|
|
Triedy orgánových systémov
| Veľ mi časté
| Časté
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
| Neznáme
|
a malígne nádory, vrátane nešpecifikovaný ch novotvarov
|
|
| novotvary kože
|
|
|
|
Poruchy krvi
a lymfatického systému
|
|
| Anémia, krvná dyskrázia
|
|
|
|
Poruchy imunitného systému
|
|
|
|
| Hypersenzit
ivita†, brochospaz mus† angioedém†
, anafylaktick á
reakcia/šok
†**
| exacerbácia
astmy
|
Poruchy endokrinného systému
|
| Paratyroi
dná porucha
|
|
|
|
|
Poruchy metabolizmu
a výživy
|
| Hypokal ciémia**
| Hypofosfatémia
|
|
|
|
Psychické poruchy
|
|
| Poruchy spánku, úzkosť, nervová
labilita
|
|
|
|
Poruchy nervového systému
|
| Bolesť
hlavy, závrat, dysgeúzi a (porucha chuti)
| Cerebrovaskulár
na porucha, lézia nervových koreňov, amnézia, migréna, neuralgia, hypertónia, hyperestézia, cirkumorálna parestézia, parosmia
|
|
|
|
Poruchy oka
|
| Katarakt
a
|
| Zápal
oka†**
|
|
|
Poruchy ucha a labyrintu
|
|
| Strata sluchu
|
|
|
|
Poruchy srdca a srdcovej činnosti
|
| Blok
cievneho vetvenia
| Ischémia
myokardu, kardiovaskulárna porucha, palpitácie
|
|
|
|
Poruchy dýchacej
sústavy, hrudníka a mediastína
|
| Faryngití da
| Pľúcny edém, stridor
|
|
|
|
Triedy orgánových systémov
|
Veľ mi časté
|
Časté
|
Menej časté
|
Z
r
iedkavé
|
Veľmi zriedkavé
|
Neznáme
|
Poruchy gastrointestináln eho traktu
|
|
Hnačka,
dyspepsi a, vracanie, bolesť
v gastroi ntestinál nej oblasti, poruchy zubov
|
Gastroenteritída,
dysfágia, gastritída, ulcerácie
v ústach, cheilitída
|
|
|
|
Poruchy pečene a žlčových ciest
|
|
|
Cholelitiáza
|
|
|
|
Poruchy kože a podkožného tkaniva
|
|
Porucha
kože, ekchymó za
|
Vyrážka,
alopécia
|
|
|
|
Poruchy kostrovej a svalovej
sústavy
a spojivového tkaniva
|
|
Osteoartr
itída, myalgia, artralgia, porucha kĺbov, bolesť kostí
|
|
Atypické
subtrochant erické
a diafyzárne zlomeniny stehennej kosti†
|
Osteone-
króza
čeľuste† **
|
|
Poruchy obličiek
a močových ciest
|
|
|
Retencia moču, cysty na
obličkách
|
|
|
|
Poruchy reprodukčného systému
a prsníkov
|
|
|
Bolesť v panve
|
|
|
|
Celkové poruchy a reakcie
v mieste podania
|
|
Pyrexia,
ochoreni e podobné chrípke*
*, periférny edém, asténia, smäd
|
Hypotermia
|
|
|
|
Laboratórne a funkčné
vyšetrenia
|
|
Zvýšená hladina
Gama- GT, zvýšená hladina
kreatinín
u
|
Zvýšená hladina alkalickej
fosfatázy v krvi, úbytok hmotnosti
|
|
|
|
Úrazy, otravy a komplikácie liečebného
|
|
|
Poranenia,
bolesť v mieste podania injekcie
|
|
|
|

Triedy orgánových systémov
|
Veľ mi časté
|
Časté
|
Menej časté
|
Z
r
iedkavé
|
Veľmi zriedkavé
|
Neznáme
|
postupu
|
|
|
|
|
|
|
**Pozri ďalšie informácie nižšie
†Zistené z postmarketingovej praxe.
Popis vybraných nežiaducich reakciíHypokalciémiaZnížené vylučovanie vápnika obličkami môže sprevádzať pokles hladín fosfátov v sére, ktorý si nevyžaduje žiadne terapeutické opatrenia. Hladina vápnika v sére môže klesnúť na hypokalciemické hodnoty.
Ochorenie podobné chrípkeVyskytol sa syndróm podobný chrípke prejavujúci sa horúčkou, zimnicou, bolesťou kostí a/alebo svalov. Vo väčšine prípadov nebola potrebná žiadna špecifická liečba a príznaky ustúpili v priebehu niekoľkých hodín/dní.
Osteonekróza čeľusteU pacientov liečených bisfosfonátmi bola hlásená osteonekróza čeľuste. Väčšina týchto prípadov bola u pacientov s nádorovým ochorením, ale hlásenia boli aj u pacientov liečených na osteoporózu. Osteonekróza čeľuste je väčšinou spojená s extrakciou zubov a/alebo lokálnou infekciou (vrátane osteomyelitídy). Diagnóza nádorového ochorenia, chemoterapia, rádioterapia, kortikosteroidy a slabá
orálna hygiena sa tiež považujú za rizikové faktory (pozri časť 4.4).
Zápal okaZápaly oka ako uveitída, episkleritída a skleritída boli hlásené pri liečbe bifosfonátmi, vrátane
kyseliny ibandrónovej. V niekoľkých prípadoch tieto zápaly neustúpili, pokiaľ nebola prerušená liečba bisfosfonátmi.
Anafylaktická reakcia/šokPrípady anafylaktickej reakcie/šoku, vrátane fatálnych prípadov, boli hlásené u pacientov liečených intravenózne podávanou kyselinou ibandrónovou.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovanieDosiaľ neexistujú žiadne skúsenosti s akútnou intoxikáciou infúznym koncentrátom kyseliny ibandrónovej. Keďže v predklinických štúdiách s vysokými dávkami lieku sa zistilo, že cieľovými orgánmi toxicity lieku sú pečeň a obličky, funkcie týchto orgánov sa majú sledovať. Klinicky významná hypokalciémia sa má korigovať intravenóznym podaním glukonátu vápenatého.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Lieky na liečbu ochorenia kostí, bisfosfonát, ATC kód: M05BA06
Kyselina ibandrónová patrí do skupiny bisfosfonátov, t.j. látok, ktoré špecificky pôsobia na kosť. Ich selektívny účinok na kostné tkanivo je založený na vysokej afinite bisfosfonátov ku kostnému minerálu. Bisfosfonáty pôsobia prostredníctvom inhibície aktivity osteoklastov, hoci presný mechanizmus ich účinku nie je stále objasnený.
Kyselina ibandrónová zabraňuje
in vivo experimentálne indukovanému odbúravaniu kostného tkaniva v dôsledku straty funkcie gonád, vplyvu retinoidov, nádorov alebo nádorových extraktov. Inhibícia endogénnej resorpcie kosti sa taktiež potvrdila v kinetických štúdiách 45Ca a na základe uvoľnenia rádioaktívne označeného tetracyklínu, ktorý bol predtým naviazaný v skelete.
Pri dávkach, ktoré boli považované za výrazne vyššie ako sú farmakologicky účinné dávky, kyselina ibandrónová nemala žiadny vplyv na mineralizáciu kostí.
Resorpcia kosti, ktorá je zapríčinená malígnym ochorením, je charakterizovaná nadmernou resorpciou kosti, ktorá nie je v rovnováhe s primeranou tvorbou kosti. Kyselina ibandrónová selektívne inhibuje aktivitu osteoklastov, čím sa redukuje resorpcia kosti, a tým sa znižuje aj výskyt skeletálnych komplikácií pri malígnom ochorení.
Klinické štúdie zamerané na liečbu hyperkalciémie vyvolanej nádorovým procesomKlinické štúdie zamerané na hyperkalciémiu pri malígnom ochorení dokázali, že inhibičný účinok kyseliny ibandrónovej na osteolýzu vyvolanú nádorom a najmä na hyperkalciémiu vyvolanú nádorom je charakterizovaný poklesom hladiny vápnika v sére a nižším vylučovaním vápnika do moču.
V dávkovom rozmedzí, ktoré je odporučené na liečbu, sa v klinických štúdiách získali nasledujúce údaje o odpovedi na liečbu spolu s intervalmi spoľahlivosti u pacientov s východiskovými hodnotami vápnika v sére korigovanými na albumín 3,0 mmol/l po primeranej rehydratácii.
6 mg
4 mg
vysoká
90% interval spoľahlivosti
dávka kyseliny ibandrónovej
vysoká
90% interval odpoveď
|
|
poveď
eeččbubu nínízzkkaa
90%90% iinn
|
|
od na li
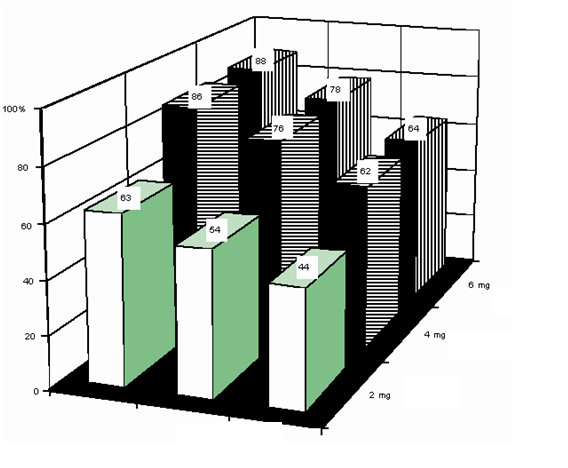
terval spoľahlivosti
Dávka
kyseliny ibandrónovej
|
% pacientov
s odpoveďou
|
90 % interval
spoľahlivosti
|
2 mg
|
54
|
44-63
|
4 mg
|
76
|
62-86
|

6 mg 78 64-88
U týchto pacientov sa pri uvedenom dávkovaní pohyboval priemerný čas do dosiahnutia
normokalciémie medzi 4 a 7 dňami. Priemerný čas do vzniku recidívy (opätovné zvýšenie hodnoty vápnika v sére korigovaného vzhľadom na albumín nad 3 mmol/l) bol 18 – 26 dní.
Klinické štúdie zamerané na prevenciu skeletálnych udalostí u pacientov s rakovinou prsníka akostnými metastázamiKlinické štúdie zamerané na pacientov s rakovinou prsníka a kostnými metastázami ukázali inhibičný vplyv na osteolýzu kosti v závislosti od dávkovania, vyjadrený markermi kostnej resorpcie a vplyv na skeletálne udalosti v závislosti od dávkovania.
Prevencia skeletálnych udalostí u pacientov s rakovinou prsníka a kostnými metastázami, liečených kyselinou ibandrónovou 6 mg podávanou intravenózne, bola stanovená v III. fáze kontrolovanej štúdie s placebom v trvaní 96 týždňov. Pacientky s rakovinou prsníka a rádiologicky potvrdenými kostnými metastázami dostávali placebo (158 pacientok) alebo 6 mg kyseliny ibandrónovej (154 pacientok). Výsledky tejto štúdie sú zhrnuté nižšie.
Primárne konečné výsledky účinnostiPrimárnym konečným výsledkom štúdie bola miera obdobia skeletálnej morbidity (SMPR). Bol to kombinovaný konečný výsledok, ktorý zahŕňal nasledujúce skeletálne udalosti (SREs) ako jednotlivé zložky:
- rádioterapia kostí pri liečbe fraktúr/hroziacich fraktúr
- chirurgické zásahy do kostí pri liečbe fraktúr
- vertebrálne fraktúry
- nevertebrálne fraktúry.
Analýza SMPR bola upravená vzhľadom na čas a uvažovalo sa potenciálne o jednej alebo viacerých udalostiach počas 12-týždňového obdobia. Početné udalosti sa preto za účelom analýzy započítali len raz. Údaje z tejto štúdie dokázali významný úžitok intravenóznej kyseliny ibandrónovej 6 mg oproti placebu pri redukcii skeletálnych udalostí meraných mierou SMPR upravenou vzhľadom na čas
(p = 0,004). Kyselina ibandrónová 6 mg významne znížila počet skeletálnych udalostí a v porovnaní s placebom sa riziko vzniku skeletálnych udalostí znížilo o 40 % (relatívne riziko 0,6; p = 0,003). Výsledky týkajúce sa účinnosti sú zhrnuté v tabuľke 2.
Tabuľka 2 Výsledky účinnosti (u pacientov s rakovinou prsníka s kostnými metastázami)
| Všetky skeletálne udalosti (SREs)
|
| Placebo
n = 158
| Kyselina ibandrónová
6 mg
n = 154
| p-hodnota
|
SMPR (na pacienta za rok)
| 1,48
| 1,19
| p = 0,004
|
Počet udalostí
(na pacienta)
|
3,64
|
2,65
|
p = 0,025
|
Relatívne riziko SRE
| -
| 0,60
| p = 0,003
|
Sekundárne konečné výsledky účinnostiPri intravenóznej kyseline ibandrónovej 6 mg sa dokázalo štatisticky významné zlepšenie bolesti kostí v porovnaní s placebom. Bolesti boli v porovnaní s východiskovým bodom menšie počas celej štúdie, čo bolo sprevádzané významne zredukovaným používaním analgetík. Zníženie kvality života bolo
významne menšie u pacientov liečených kyselinou ibandrónovou v porovnaní s placebom. Súhrn týchto sekundárnych výsledkov účinnosti je uvedený v tabuľke 3.
Tabuľka 3 Sekundárne výsledky účinnosti (u pacientov s rakovinou prsníka s kostnými metastázami)
| Placebo
n = 158
| Kyselina ibandrónová
6 mg
n = 154
| p-hodnota
|
Bolesť kostí*
| 0,21
| - 0,28
| p < 0,001
|
Používanie analgetík*
| 0,90
| 0,51
| p = 0,083
|
Kvalita života*
| - 45,4
| - 10,3
| p = 0,004
|
* Priemerná zmena oproti východiskovému bodu po posledné vyhodnotenie.
U pacientov liečených kyselinou ibandrónovou sa pozoroval značný pokles urinárnych markerov resorpcie kosti (pyridinolín a deoxypyridinolín), ktorý bol štatisticky významný v porovnaní
s placebom.
V štúdii u 130 pacientov s rakovinou prsníka s metastázami sa porovnala bezpečnosť kyseliny ibandrónovej podávanej formou infúzie trvajúcej viac ako 1 hodinu alebo 15 minút. Nepozoroval sa žiaden rozdiel v indikátoroch funkcie obličiek. Celkový profil nežiaducich udalostí kyseliny ibandrónovej po 15-minútovej infúzii sa zhodoval so známym bezpečnostným profilom po dlhších časoch podávania infúzie a neidentifikovali sa žiadne nové bezpečnostné problémy súvisiace s použitím 15-minútového času podávania infúzie.
15-minútový čas podávania infúzie sa neskúmal u pacientov s rakovinou s klírensom kreatinínu
< 50 ml/min.
Pediatrická populácia (pozri časť 4.2 a časť 5.2)Bezpečnosť a účinnosť kyseliny ibandrónovej u detí a dospievajúcich mladších ako 18 rokov nebola stanovená. Nie sú dostupné žiadne údaje.
5.2 Farmakokinetické vlastnostiFarmakokinetické parametre sú po 2 hodinách infúzie 2, 4 a 6 mg kyseliny ibandrónovej úmerné dávke.
DistribúciaKyselina ibandrónová sa po počiatočnej systémovej expozícii rýchlo viaže na kosť alebo sa vylúči do moču. U ľudí je evidentný terminálny objem distribúcie najmenej 90 l a množstvo dávky, ktoré sa dostane do kosti, sa odhaduje na 40 až 50 % cirkulujúcej dávky. Väzba proteínu v ľudskej plazme je pri terapeutických koncentráciách približne 87 %, a preto je nepravdepodobná interakcia s inými
liekmi zapríčinená vytlačením.
BiotransformáciaNeexistuje žiaden dôkaz, že kyselina ibandrónová je u zvierat alebo ľudí metabolizovaná.
ElimináciaRozsah pozorovaného evidentného polčasu je široký a závisí od dávky a citlivosti testu, avšak evidentný terminálny polčas sa vo všeobecnosti pohybuje v rozsahu 10 až 60 hodín. Hladiny v plazme však klesajú rýchlo, dosahujúc 10 % vrcholných hodnôt do 3 a 8 hodín po intravenóznom alebo perorálnom podaní. Keď bola kyselina ibandrónová podávaná intravenózne raz za 4 týždne počas
48 týždňov pacientom s kostnými metastázami, nepozorovala sa žiadna systémová akumulácia.
Celkový klírens kyseliny ibandrónovej je nízky s priemernými hodnotami v rozsahu 84 až 160 ml/min. Renálny klírens (asi 60 ml/min u zdravých žien po menopauze) je 50 – 60 % z celkového klírensu a súvisí s klírensom kreatinínu. Rozdiel medzi evidentným celkovým a renálnym klírensom je zrejme v dôsledku absorpcie kosťou.
Zdá sa, že sekrečná dráha eliminácie nezahŕňa známe kyslé alebo zásadité transportné systémy podieľajúce sa na vylučovaní iných liečiv. Okrem toho kyselina ibandrónová neinhibuje hlavné izoenzýmy pečeňového cytochrómového systému P450 u ľudí a neindukuje pečeňový cytochrómový systém P450 u potkanov.
Farmakokinetika u osobitných skupín pacientov
Pohlavie
Biologická dostupnosť a farmakokinetika kyseliny ibandrónovej je u mužov a žien podobná.
Rasa
Pokiaľ ide o užívanie kyseliny ibandrónovej, neexistuje žiaden dôkaz klinicky významných interetnických rozdielov medzi aziatmi a belochmi. Je dostupných len veľmi málo údajov o pacientoch s africkým pôvodom.
Pacienti s poruchou funkcie obličiek
Expozícia kyseline ibandrónovej u pacientov s rôznymi stupňami poruchy funkcie obličiek súvisí
s klírensom kreatinínu (CLcr). U jedincov s ťažkou poruchou funkcie obličiek (priemerný odhadovaný CLcr = 21,2 ml/min), sa k dávke prispôsobená priemerná AUC0-24h zvýšila o 110 % v porovnaní so zdravými dobrovoľníkmi. V klinickej štúdii zameranej na farmakológiu, WP18551, sa
po intravenóznom podaní jednorazovej dávky 6 mg (formou 15-minútovej infúzie) priemerná hodnota
AUC0-24 zvýšila o 14 % u jedincov s miernou (priemerný odhadovaný CLcr = 68,1 ml/min) a o 86 %
u jedincov so stredne ťažkou (priemerný odhadovaný CLcr = 41,2 ml/min) poruchou funkcie obličiek
v porovnaní so zdravými dobrovoľníkmi (priemerný odhadovaný CLcr = 120 ml/min). Priemerná hodnota Cmax sa nezvýšila u pacientov s miernou poruchou funkcie obličiek a zvýšila sa o 12 %
u pacientov so stredne ťažkou poruchou funkcie obličiek. U pacientov s miernou poruchou funkcie
obličiek (CLcr ≥ 50 a < 80 ml/min) nie je nutná úprava dávkovania. U pacientov s rakovinou prsníka a kostnými metastázami so stredne závažnou poruchou funkcie obličiek (CLcr ≥ 30 a < 50 ml/min) alebo závažnou poruchou funkcie obličiek (CLcr < 30 ml/min), ktorí sú liečení z dôvodu prevencie skeletálnych udalostí, sa odporúča dávku upraviť (pozri časť 4.2).
Pacienti s poruchou funkcie pečene (pozri časť 4.2)
Nie sú známe žiadne farmakokinetické údaje o kyseline ibandrónovej u pacientov s poruchou funkcie pečene. Pečeň nehrá žiadnu významnú úlohu pri klírense kyseliny ibandrónovej, pretože nie je metabolizovaná, ale je uvoľnená renálnou exkréciou a absorbovaná kosťami. Preto u pacientov
s poruchou funkcie pečene nie je potrebné upraviť dávkovanie. Keďže väzba proteínu kyseliny ibandrónovej pri terapeutických koncentráciách je približne 87 %, je nepravdepodobné, že by hypoproteinémia u pacientov s ťažkým poruchou funkcie pečene viedla ku klinicky významnému zvýšeniu koncentrácie vo voľnej plazme.
Starší ľudia (pozri časť 4.2)
Na základe viacnásobnej analýzy sa nezistilo, že by vek bol nezávislým faktorom akéhokoľvek zo študovaných farmakokinetických parametrov. Jediný faktor, ktorý sa má brať do úvahy je ten, že
s vekom sa znižuje funkcia obličiek (pozri časť porucha funkcie obličiek).
Pediatrická populácia (pozri časť 4.2 a časť 5.1)
Neexistujú žiadne údaje o užívaní kyseliny ibandrónovej pacientami mladšími ako 18 rokov.
5.3 Predklinické údaje o bezpečnosti
Účinky v predklinických štúdiách sa pozorovali iba po dávkach považovaných za dostatočne vyššie
než je maximálna dávka u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie. Tak ako v prípade iných bisfosfonátov, oblička bola hlavným cieľovým orgánom systémovej toxicity.
Mutagenita/Karcinogenita:
Nepozoroval sa žiadny náznak karcinogénneho potenciálu. Testy na genotoxicitu nedokázali žiadny náznak účinku na genetickú aktivitu kyseliny ibandrónovej.
Reprodukčná toxicita:
U potkanov a králikov, ktorým bola kyselina ibandrónová podávaná intravenózne, sa nezistil žiadny náznak priamej toxicity na plod alebo teratogénne účinky. V reprodukčných štúdiách u potkanov perorálne podávanie pri dávkach 1 mg/kg/deň a vyšších viedlo k nárastu preimplantačných potratov. V
reprodukčných štúdiách u potkanov intravenózne podávaná kyselina ibandrónová znížila počet spermií
pri dávkach 0,3 a 1 mg/kg/deň a znížil fertilitu u samcov pri dávke 1 mg/kg/deň a u žien pri dávke na
1,2 mg/kg/deň. Nežiaduce účinky kyseliny ibandrónovej na základe štúdií reprodukčnej toxicity u potkanov boli také, aké sa očakávali u tejto triedy liekov (bisfosfonáty). Tieto zahŕňajú znížený počet implantačných miest, narušenie prirodzeného pôrodu (ťažký pôrod), nárast viscerálnych odchýliek (syndróm renálnej panvičky a močovodu) a anomálií zubov u F1 potomstva potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný
Trihydrát octanu sodného Ľadová kyselina octová Voda na injekciu
6.2 Inkompatibility
Kvôli prevencii vzniku potenciálnych inkompatibilít sa infúzny koncentrát kyseliny ibandrónovej má riediť len s izotonickým roztokom chloridu sodného alebo 5% roztokom glukózy.
Infúzny koncentrát kyseliny ibandrónovej sa nemá miešať s roztokmi, ktoré obsahujú vápnik.
6.3 Čas použiteľnosti
2 roky
Po nariedení:
Chemická a fyzikálna stabilita pri použití po nariedení v 0,9% roztoku chloridu sodného alebo 5%
roztoku glukózy bola preukázaná na 36 hodín pri 25 °C a 2 °C až 8 °C.
Z mikrobiologického hľadiska sa má tento infúzny roztok použiť okamžite. Ak sa liek nepoužije okamžite, jeho užívateľ je zodpovedný za podmienky a dĺžku uchovávania pred použitím, ktorá by za normálnych okolností nemala presiahnuť 24 hodín pri 2 °C až 8 °C, ak nariedenie neprebehlo za kontrolovaných a platných aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky uchovávania nariedeného lieku nájdete v časti 6.3.
6.5 Druh obalu a obsah balenia
6 ml sklenená injekčná liekovka (typ I) s fluorotec/gumovou zátkou a hliníkovým uzáverom s levanduľovým flip off viečkom. Dodáva sa v baleniach, ktoré obsahujú 1, 5 alebo 10 injekčných liekoviek.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne. Uvoľnenie liečiv do prostredia má byť znížené na minimum.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited
Sage House
319, Pinner Road North Harrow Middlesex HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/12/798/002
EU/1/12/798/003
EU/1/12/798/004
9. DÁTUM PRVEJ REGISTRÁCIEDátum prvej registrácie
: 19 november 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/
1. NÁZOV LIEKU
Ibandronic Acid Accord 3 mg injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna naplnená injekčná striekačka s 3 ml roztoku obsahuje 3 mg kyseliny ibandrónovej (ako sodný monohydrát).
Koncentrácia kyseliny ibandrónovej v injekčnom roztoku je 1 mg/ml. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok (injekcia)
Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie'
Liečba osteoporózy u žien po menopauze so zvýšeným rizikom fraktúr (pozri časť 5.1). Preukázalo sa zníženie rizika vertebrálnych fraktúr, účinnosť u fraktúr femorálneho krčku nebola stanovená.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčaná dávka kyseliny ibandrónovej je 3 mg, podávaná vo forme intravenóznej injekcie počas
15-30 sekúnd každé tri mesiace.
Pacienti musia užívať vápnik a vitamín D vo forme výživových doplnkov (pozri časť 4.4 a časť 4.5). Optimálna dĺžka liečby osteoporózy bisfosfonátmi sa nestanovila. Potreba pokračovať v liečbe sa má u
jednotlivých pacientov pravidelne prehodnocovať na základe prínosu a možných rizík kyseliny
ibandrónovej, najmä po 5 alebo viacerých rokoch používania.
Ak sa dávka vynechá, injekcia sa má podať čo najskôr ako je možné. Potom sa injekcie majú naplánovať každé tri mesiace od dátumu poslednej injekcie.
Osobitné skupiny pacientov
Pacienti s poškodením funkcie obličiek
Použitie injekcie kyseliny ibandrónovej sa neodporúča pacientom, ktorí majú sérový kreatinín vyšší ako 200 µmol/l (2,3 mg/dl) alebo ktorí majú klírens kreatinínu (odmeraný alebo predpokladaný) nižší ako 30 ml/min, kvôli obmedzeným klinickým údajom dostupným zo štúdií u takýchto pacientov (pozri časť 4.4 a časť 5.2).
U pacientov s miernym alebo stredne závažným poškodením funkcie obličiek, u ktorých je sérový kreatinín rovný alebo nižší ako 200 µmol/l (2,3 mg/dl) alebo u ktorých je klírens kreatinínu (odmeraný alebo predpokladaný) rovný alebo vyšší ako 30 ml/min, nie je potrebné upraviť dávku.
Pacienti s poškodením funkcie pečene
Nie je potrebné upraviť dávku (pozri časť 5.2).
Starší pacienti (>65 rokov)
Nie je potrebné upraviť dávku (pozri časť 5.2).
Pediatrická populácia
Kyselina ibandrónová sa nepoužíva u detí do 18 rokov, a kyselina ibandrónová nebola študovaná v tejto populácii (pozri časť 5.1 a časť 5.2).
Spôsob podania
Na intravenózne použitie počas 15 - 30 sekúnd, každé tri mesiace.
Je potrebné prísne dodržiavať intravenózny spôsob podania (pozri časť 4.4).
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1
- Hypokalciémia
4.4 Osobitné upozornenia a opatrenia pri používaní
Nesprávne podanie
Musí sa dávať pozor, aby sa injekcia kyseliny ibandrónovej nepodala intraarteriálne alebo paravenózne, pretože to môže viesť k poškodeniu tkaniva.
Hypokalciémia
Kyselina ibandrónová, tak ako ostatné bisfosfonáty podávané intravenózne, môže spôsobiť prechodný pokles hodnôt vápnika v sére.
Pred liečbou injekciou kyseliny ibandrónovej sa musí upraviť prítomná hypokalciémia. Skôr ako sa začne liečba injekciou kyseliny ibandrónovej, majú sa účinne liečiť aj ďalšie poruchy kostí a metabolizmu minerálov.
Všetci pacienti musia mať primerane doplnený vápnik a vitamín D.
Anafylaktická reakcia/šok
Prípady anafylaktickej reakcie/šoku, vrátane fatálnych prípadov, boli hlásené u pacientov liečených intravenózne podávanou kyselinou ibandrónovou.
Pri podávaní intravenóznej injekcie kyseliny ibandrónovej má byť k dispozícii zodpovedajúca lekárska pomoc a výsledky monitorovania. Ak sa vyskytne anafylaktická reakcia alebo iné závažné reakcie z precitlivenosti / alergické reakcie, podávanie injekcie treba okamžite prerušiť a zahájiť vhodnú liečbu.
Poškodenie funkcie obličiek
Pacienti so sprievodnými ochoreniami alebo ktorí súbežne užívajú iné lieky, ktoré môžu mať
nežiaduce účinky na obličky, sa majú počas liečby pravidelne kontrolovať v súlade s klinickou praxou.
Vzhľadom na obmedzené klinické skúsenosti sa injekcia kyseliny ibandrónovej neodporúča pacientom so sérovým kreatinínom vyšším ako 200 µmol/l (2,3 mg/dl) alebo s klírensom kreatinínu nižším ako
30 ml/min. (pozri časť 4.2 a časť 5.2).
Pacienti s poruchou srdca
U pacientov s rizikom srdcového zlyhávania treba zabrániť prevodneniu.
Osteonekróza čeľuste
U pacientov s nádorovým ochorením, ktorí v liečbe dostávali najmä intravenózne podávané bisfosfonáty, sa zaznamenala osteonekróza čeľuste väčšinou v súvislosti s extrakciou zubu a/alebo
lokálnou infekciou (vrátane osteomyelitídy). Mnoho z týchto pacientov dostávalo tiež chemoterapiu
a kortikosteroidy. Osteonekróza čeľuste sa zaznamenala aj u pacientov s osteoporózou, ktorí dostávali perorálne bisfosfonáty.
Pred začiatkom liečby s bisfosfonátmi sa má u pacientov s rizikovými faktormi (napr. nádorové ochorenie, chemoterapia, rádioterapia, kortikosteroidy, slabá ústna hygiena), zvážiť zubné vyšetrenie a primeraný preventívny stomatologický výkon.
Ak je to možné, liečení pacienti sa majú vyhýbať invazívnym stomatologickým procedúram. U pacientov, u ktorých sa počas liečby bisfosfonátmi vyvinula osteonekróza čeľuste, môže stomatochirurgický zásah stav zhoršiť. Pre pacientov, ktorí vyžadujú stomatologické procedúry, nie sú dostupné údaje, či prerušenie liečby bisfosfonátmi redukuje riziko osteonekrózy čeľuste. Klinické rozhodnutie ošetrujúceho lekára, ako postupovať, má zohľadniť individuálne zhodnotenie prínosu/rizika pre pacienta.
Atypické zlomeniny stehennej kosti
Pri liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne zlomeniny stehennej kosti, predovšetkým u pacientov, ktorí sa dlhodobo liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo žiadnej traume a
u niektorých pacientov sa niekoľko týždňov až mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne alebo slabine, pri zobrazovacom vyšetrení často spojená s charakteristikami únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov liečených bisfosfonátmi, ktorí utrpeli zlomeninu stehennej kosti, vyšetriť aj kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej kosti sa má na základe individuálneho zhodnotenia prínosu a rizika pre pacienta zvážiť prerušenie liečby bisfosfonátmi.
Počas liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť v stehne, bedre alebo slabine a každého pacienta s takýmito príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej kosti.
Injekcia kyseliny ibandrónovej je v podstate bez sodíka.
4.5 Liekové a iné interakcie
Metabolické interakcie sa nepovažujú za pravdepodobné, pretože kyselina ibandrónová neinhibuje hlavné izoenzýmy pečeňového cytochrómového systému P450 u ľudí a ukázalo sa, že neindukuje pečeňový cytochrómový systém P450 u potkanov (pozri časť 5.2).
Kyselina ibandrónová sa vylučuje len renálnou exkréciou a nepodlieha žiadnej biotransformácii.
4.6 Fertilita, gravidita a laktácia
Gravidita
Kyselina ibandrónová je určená len na použitie u žien po menopauze a nesmú ju používať ženy v reprodukčnom veku.
Nie sú dostupné žiadne adekvátne údaje o používaní kyseliny ibandrónovej u gravidných žien. Štúdie vykonané na potkanoch dokázali určitú reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe.
Kyselina ibandrónová sa nemá používať počas gravidity. Laktácia
Nie je známe, či sa kyselina ibandrónová vylučuje do materského mlieka u ľudí. Štúdie vykonané u dojčiacich potkanov dokázali prítomnosť nízkych hladín kyseliny ibandrónovej v mlieku po intravenóznom podaní. Kyselina ibandrónová sa nemá používať počas laktácie.
FertilitaNie sú k dispozícii údaje o účinkoch kyseliny ibandrónovej u ľudí. V reprodukčných štúdiách u potkanov perorálne podávaná kyselina ibandrónová znížila fertilitu. V štúdiách u potkanov intravenózne podávaná kyselina ibandrónová znížila fertilitu pri vysokých denných dávkach (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNa základe farmakodynamického a farmakokinetického profilu a hlásených nežiaducich reakcií sa predpokladá, že kyselina ibandrónová nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluNajzávažnejšie hlásené nežiaduce reakcie sú anafylaktická reakcia / šok, atypické zlomeniny stehennej kosti, osteonekróza čeľuste, gastrointestinálne podráždenie, zápal oka (pozri odsek "Popis vybraných nežiaducich reakcií" a časť 4.4).
Najčastejšie hlásené nežiaduce reakcie boli artralgia a príznaky podobné chrípke. Tieto príznaky typické pri podaní prvej dávky, zvyčajne majú krátke trvanie, miernu alebo strednú intenzitu
a zvyčajne ustúpia počas pokračovania v liečbe bez nutnosti ich liečby (pozri odsek „Ochorenie podobné chrípke“).
Zoznam nežiaducich reakcií v tabuľkeV tabuľke 1 je uvedený celý zoznam známych nežiaducich reakcií. Bezpečnosť perorálnej liečby
2,5 mg kyseliny ibandrónovej denne bola vyhodnotená u 1 251 pacientov liečených v 4 placebom kontrolovaných klinických štúdiách, z ktorých veľká väčšina pacientov sa zúčastnila pivotnej trojročnej štúdie zameranej na zlomeniny (MF 4411).
V pivotnej dvojročnej štúdii u žien po menopauze s osteoporózou (BM 16550) bola dokázaná podobná celková bezpečnosť intravenóznej injekcie kyseliny ibandrónovej 3 mg každé 3 mesiace a perorálnej kyseliny ibandróvovej 2,5 mg denne. Celkový podiel pacientov, u ktorých sa objavila nežiaduca reakcia, bol pre kyselinu ibandrónovú 3 mg injekciu každé tri mesiace 26,0 % po jednom roku
a 28,6 % po dvoch rokoch. Väčšina prípadov nežiaducich reakcií neviedla k ukončeniu liečby.
Nežiaduce reakcie sú vymenované podľa tried orgánových systémov MedDRA a kategórií frekvencie. Kategórie frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci každej skupiny frekvencie sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie vyskytujúce sa u žien po menopauze, ktoré dostali intravenóznu injekciu kyseliny ibandrónovej 3 mg každé 3 mesiace alebo užívali kyselinu ibandrónovú 2,5 mg denne vo fáze III štúdií BM16549 a MF4411 a zo skúseností po uvedení lieku na trh.
|
Trieda orgánových systémov
| Časté
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
|
Poruchy imunitného
systému
|
| exacerbácia
astmy
| reakcia z
precitlivenosti
| anafylaktická
reakcia/šok*†
|
Poruchy nervového
systému
|
bolesť hlavy
|
|
|
|
Poruchy oka
|
|
|
zápal oka*†
|
|
Poruchy ciev
|
|
flebitída/tromb
oflebitída
|
|
|
Poruchy
gastrointestinálneho traktu *
|
gastritída,
dyspepsia, hnačka, abdominálna bolesť, nauzea, plynatosť
|
|
|
|
Poruchy kože
a podkožného tkaniva
|
vyrážka
|
|
angioedém, edém tváre, urtikária
|
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
artralgia, myalgia, muskuloskeletálna
bolesť, bolesť
chrbta
|
bolesť kostí
|
atypické subtrochanterické
a diafyzárne zlomeniny stehennej kosti†
|
osteonekróza
čeľuste*†
|
Celkové poruchy a
reakcie v mieste podania
|
ochorenie podobné
chrípke*, únava
|
reakcie v
mieste podania injekcie,
asténia
|
|
|
*Pozri ďalšie informácie nižšie
†Uvedené zo skúseností po uvedení lieku na trh.
Popis vybraných nežiaducich reakciíOchorenie podobné chrípkeOchorenie podobné chrípke zahŕňa udalosti hlásené ako reakcia alebo príznaky akútnej fázy, zahŕňajúce myalgiu, artralgiu, horúčku, triašku, únavu, nauzeu, strata chuti do jedla a bolesť kostí.
Osteonekróza čeľusteU pacientov liečených bisfosfonátmi sa zaznamenala osteonekróza čeľuste. Väčšina týchto prípadov sa vyskytla u pacientov s nádorovým ochorením, ale hlásili sa aj prípady u pacientov liečených
pre osteoporózu. Osteonekróza čeľuste je väčšinou spojená s extrakciou zubu a/alebo lokálnou
infekciou (vrátane osteomyelitídy). Diagnóza nádorového ochorenia, chemoterapia, rádioterapia, kortikosteroidy a slabá ústna hygiena sa tiež považujú za rizikové faktory (pozri časť 4.4).
Zápal okaZápaly oka ako uveitída, episkleritída a skleritída boli hlásené pri liečbe bifosfonátmi, vrátane
kyseliny ibandrónovej. V niekoľkých prípadoch tieto zápaly neustúpili, pokiaľ nebola prerušená liečba bisfosfonátmi.
Anafylaktická reakcia/šokPrípady anafylaktickej reakcie/šoku, vrátane fatálnych prípadov, boli hlásené u pacientov liečených intravenózne podávanou kyselinou ibandrónovou.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.
4.9 PredávkovanieNie sú dostupné žiadne špecifické informácie o liečbe pri predávkovaní injekčne podávanou kyselinou ibandrónovou.
Na základe poznatkov tejto skupiny zlúčenín intravenózne predávkovanie môže mať za následok hypokalciémiu, hypofosfatémiu a hypomagneziémiu. Klinicky významné poklesy sérových hladín vápnika, fosforu a horčíka sa majú upraviť intravenóznym podaním glukonátu vápenatého, draslíka alebo fosforečnanu sodného a síranu horečnatého.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Lieky na liečbu ochorenia kostí, bisfosfonáty, ATC kód: M05B A06
Mechanizmus účinku
Kyselina ibandrónová je vysoko účinný bisfosfonát patriaci k skupine bisfosfonátov obsahujúcich dusík, ktoré pôsobia selektívne na kostné tkanivo a špecificky inhibujú aktivitu osteoklastov bez priameho vplyvu na tvorbu kostí. Neinterferuje so zhlukovaním osteoklastov. Kyselina ibandrónová vedie k progresívnym čistým prírastkom kostnej hmoty a k zníženiu výskytu zlomenín v dôsledku redukcie zvýšeného kostného obratu u žien po menopauze smerom k úrovni pred menopauzou.
Farmakodynamické účinky
Farmakodynamickým účinkom kyseliny ibandrónovej je inhibícia kostnej rezorbcie. Kyselina ibandrónová in vivo bráni experimentálne indukovanej deštrukcii kostí, spôsobenej prerušením funkcie gonád, vplyvom retinoidov, nádorov alebo nádorových extraktov. U mladých (rýchlo rastúcich) potkanov je tiež inhibovaná endogénna kostná rezorbcia, čo vedie k nárastu normálnej kostnej hmoty
v porovnaní so zvieratami, ktoré nepodstúpili liečbu.
Živočíšne modely potvrdzujú, že kyselina ibandrónová je vysoko účinný inhibítor aktivity osteoklastov. U rastúcich potkanov nebol žiadny náznak poruchy mineralizácie kostí, ani pri dávkach vyšších ako 5 000-násobok dávky potrebnej na liečbu osteoporózy.
Každodenné aj intermitentné (s predĺženými intervalmi bez dávky) dlhodobé podávanie lieku u potkanov, psov a opíc bolo spojené s tvorbou novej kosti normálnej kvality, pričom sa udržala alebo zvýšila mechanická pevnosť kosti dokonca aj pri dávkach v toxickom rozsahu. U ľudí bola účinnosť každodenného aj intermitentného podávania (s 9 až 10-týždňovými intervalmi bez dávky) kyseliny ibandrónovej potvrdená v klinickej štúdii (MF 4411), v ktorej sa preukázala účinnosť kyseliny ibandrónovej proti fraktúram.
Na zvieracích modeloch kyselina ibandrónová spôsobila biochemické zmeny, ktoré poukazujú na inhibíciu kostnej rezorbcie v závislosti od dávky, vrátane supresie biochemických markerov degradácie kostného kolagénu (napríklad deoxypyridinolínu a priečne viazaných N-telopeptidov kolagénneho typu I (NTX)) v moči.
Každodenné aj intermitentné (s 9 až 10-týždňovými intervalmi bez dávky na štvrťrok) perorálne dávky ako aj intravenózne dávky kyseliny ibandrónovej u žien po menopauze spôsobili biochemické zmeny poukazujúce na inhibíciu kostnej rezorbcie v závislosti od dávky.
Intravenózna injekcia kyseliny ibandrónovej znížila hladiny sérového C-telopeptidu alfa reťazca kolagénu I. typu (CTX) v priebehu 3 - 7 dní od začiatku liečby a znížila hladiny osteokalcínu
v priebehu 3 mesiacov.
Po skončení liečby dochádza k návratu k patologickým ukazovateľom zvýšenej kostnej rezorbcie, ktoré sa vyskytovali pred liečbou v súvislosti s postmenopauzálnou osteoporózou.
Histologické vyšetrenie kostných biopsií po dvoch a troch rokoch liečby žien po menopauze
s dávkami perorálnej kyseliny ibandrónovej 2,5 mg denne a intermitentnými intravenóznymi dávkami až do 1 mg každé tri mesiace, dokázalo normálnu kvalitu kostí, bez náznaku poruchy mineralizácie
kostí. Očakávané zníženie kostného obratu, kosti normálnej kvality a neprítomnosť poruchy minerálov sa pozorovali aj po dvoch rokoch liečby injekciou kyseliny ibandrónovej 3 mg.
Klinická účinnosťNezávislé rizikové faktory, napríklad nízka BMD, vek, prítomnosť prekonaných fraktúr, fraktúry v rodinnej anamnéze, značný úbytok kostnej hmoty a nízky index telesnej hmotnosti sa majú brať do úvahy, aby sa zistilo, či má žena zvýšené riziko osteoporotických fraktúr.
Kyselina ibandrónová 3 mg injekcia každé 3 mesiaceHustota kostných minerálov (BMD)V dvojročnej, randomizovanej, dvojito zaslepenej, multicentrickej štúdii (BM 16550) so zameraním na dôkaz rovnocennej účinnosti u žien (1386 žien vo veku 55-80 rokov) s osteoporózou (východiskové T- skóre BMD driekovej chrbtice nižšie ako -2,5SD) po menopauze sa dokázalo, že kyselina ibandrónová
3 mg intravenózna injekcia, podávaná každé 3 mesiace, je najmenej rovnako účinná ako perorálna kyselina ibandrónová 2,5 mg denne. Bolo to dokázané v primárnej analýze jednoročných výsledkov, aj v konfirmačnej analýze dvojročných konečných výsledkov (tabuľka 2).
Primárna analýza údajov zo štúdie BM 16550 po jednom roku a potvrdzujúca analýza po 2 rokoch nepreukázali nižšiu účinnosť dávkovacej schémy s 3 mg injekciou každé 3 mesiace v porovnaní s dávkovacou schémou s 2,5 mg dennou perorálnou dávkou, pokiaľ ide o priemerné zvýšenia BMD driekovej chrbtice, bedrovej oblasti, femorálneho krčka a trochantera (tabuľka 2).
Tabuľka 2: Priemerná relatívna zmena od východiskovej hodnoty BMD driekovej chrbtice, bedrovej oblasti, femorálneho krčka a trochantera po jednoročnej liečbe (primárna analýza) a dvojročnej liečbe (populácia podľa protokolu) v štúdii BM 16550.
| Jednoročné údaje zo štúdie
BM 16550
| Dvojročné údaje zo štúdie
BM 16550
|
Priemerné relatívne zmeny
od východiskovej hodnoty
% [95 % CI]
| kyselina
ibandrónová
2,5 mg denne
(N=377)
| kyselina
ibandrónová
3 mg injekcia každé 3 mesiace (N=365)
| kyselina
ibandrónová
2,5 mg denne
(N=334)
| kyselina
ibandrónová
3 mg injekcia každé
3 mesiace
(N=334)
|
BMD driekovej chrbtice
L2-L4
| 3,8 [3,4, 4,2]
| 4,8 [4,5, 5,2]
| 4,8 [4,3, 5,4]
| 6,3 [5,7, 6,8]
|
BMD bedrovej oblasti
| 1,8 [1,5, 2,1]
| 2,4 [2,0, 2,7]
| 2,2 [1,8, 2,6]
| 3,1 [2,6, 3,6]
|
BMD femorálneho krčka
| 1,6 [1,2, 2,0]
| 2,3 [1,9, 2,7]
| 2,2 [1,8, 2,7]
| 2,8 [2,3, 3,3]
|
BMD trochantera
| 3,0 [2,6, 3,4]
| 3,8 [3,2, 4,4]
| 3,5 [3,0, 4,0]
| 4,9 [4,1, 5,7]
|
V prospektívne plánovanej analýze sa okrem toho dokázalo, že kyselina ibandrónová 3 mg injekcia
každé 3 mesiace je účinnejšia ako perorálna kyselina ibandrónová 2,5 mg denne vo zvýšení BMD
driekovej chrbtice po jednom roku, p<0,001 a po dvoch rokoch, p<0,001.
Stanovením BMD driekovej oblasti po 1 roku liečby, BMD sa zvýšila alebo udržala (t.j. pacienti reagovali na liečbu) u 92,1 % pacientov, ktorí dostali 3 mg injekciu každé tri mesiace v porovnaní s
84,9 % pacientov, ktorí užívali perorálne 2,5 mg denne (p=0,002). Po 2 rokoch liečby sa BMD driekovej chrbtice zvýšila alebo udržala u 92,8 % pacientov, ktorí dostali 3 mg injekcie a u 84,7 % pacientov, ktorí užívali perorálne 2,5 mg denne (p=0,001).
Pokiaľ ide o BMD bedrovej oblasti po jednom roku, na liečbu reagovalo 82,3 % pacientov, ktorí dostali 3 mg injekciu každé tri mesiace v porovnaní so 75,1 % pacientov, ktorí užívali perorálne
2,5 mg denne (p=0,02). Po 2 rokoch liečby sa BMD bedrovej oblasti zvýšila alebo udržala u 85,6 % pacientov, ktorí dostali 3 mg injekcie a u 77,0 % pacientov, ktorí užívali perorálne 2,5 mg denne (p=0,004).
Podiel pacientov, u ktorých sa po jednom roku BMD driekovej chrbtice aj bedrovej oblasti zvýšila alebo udržala, bol 76,2 % v skupine s 3 mg injekciou každé 3 mesiace a 67,2 % v skupine s 2,5 mg dennou perorálnou dávkou (p=0,007). Po dvoch rokoch toto kritérium splnilo 80,1 % pacientov v skupine s 3 mg injekciou každé 3 mesiace a 68,8 % pacientov v skupine s 2,5 mg dennou perorálnou dávkou (p=0,001).
Biochemické markery kostného obratuKlinicky významné zníženia sérových hladín CTX sa pozorovali vo všetkých hodnotených časových
obdobiach. Po 12 mesiacoch bola stredná hodnota relatívnych zmien od východiskovej hodnoty –
58,6 % pre schému s 3 mg intravenóznou injekciou každé 3 mesiace a –62,6 % pre schému s 2,5 mg dennou perorálnou dávkou. Okrem toho sa zistilo, že na liečbu reagovalo (t.j. zníženie o ≥ 50 % od východiskovej hodnoty) 64,8 % pacientov, ktorí dostali 3 mg injekciu každé 3 mesiace v porovnaní so
64,9 % pacientov, ktorí užívali perorálne 2,5 mg denne. Zníženie sérových hladín CTX sa udržalo počas 2 rokov, pričom v oboch skupinách na liečbu reagovala viac ako polovica pacientov.
Na základe výsledkov štúdie BM 16550 sa očakáva, že kyselina ibandrónová 3 mg intravenózna injekcia, podávaná každé 3 mesiace, je prinajmenšom rovnako účinná v prevencii zlomenín ako schéma s 2,5 mg dennou perorálnou dávkou kyseliny ibandrónovej.
Kyselina ibandrónová 2,5 mg tablety raz denneV úvodnej trojročnej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii zameranej
na zlomeniny (MF 4411) sa dokázal štatisticky významný, s liečbou súvisiaci pokles výskytu nových rádiografických morfometrických a klinických vertebrálnych fraktúr (tabuľka 3). V tejto štúdii bola vyhodnocovaná kyselina ibandrónová pri denných perorálnych dávkach 2,5 mg a intermitentných perorálnych dávkach 20 mg, ktoré sa použili ako výskumný režim. Kyselina ibandrónová sa užívala
60 minút pred prvým jedlom alebo nápojom dňa (obdobie nalačno po podaní dávky). Štúdia skúmala ženy vo veku 55 až 80 rokov, ktoré boli najmenej 5 rokov po menopauze a u ktorých bola BMD
v driekovej chrbtici s SD od -2 do 5-krát nižšej ako priemerná hodnota pred menopauzou (T-skóre) najmenej v jednom stavci [L1-L4] a ktoré mali jednu až štyri bežné fraktúry stavcov. Všetky pacientky dostávali denne 500 mg vápnika a 400 IU vitamínu D. Účinnosť bola vyhodnotená u 2928 pacientok. Pri dennom podávaní kyseliny ibandróvej 2,5 mg sa prejavilo štatisticky významné zníženie výskytu nových vertebrálnych fraktúr v dôsledku liečby. Tento režim počas troch rokov trvania štúdie znížil výskyt nových rádiografických vertebrálnych fraktúr o 62 % (p = 0,0001). Zníženie relatívneho rizika
o 61 % sa pozorovalo po 2 rokoch (p = 0,0006). Po 1 roku liečby sa nedosiahol žiadny štatisticky
významný rozdiel (p = 0,056). Účinok na fraktúry sa udržiaval počas trvania štúdie. V priebehu času sa nepozoroval žiaden náznak nižšieho účinku.
Tiež sa významne znížil výskyt klinických vertebrálnych fraktúr o 49 % po 3 rokoch (p = 0,011). Silný vplyv na vertebrálne fraktúry tiež odrážala štatisticky významná redukcia straty telesnej výšky v porovnaní s placebom (p < 0,0001).
Tabuľka 3: Výsledky trojročnej štúdie MF 4411 (%, 95 % IS) zameranej na fraktúry
| Placebo
(N = 974)
| kyselina ibandrónová 2,5 mg
denne
(N = 977)
|
Zníženie relatívneho rizika výskytu nových morfometrických
vertebrálnych fraktúr
|
| 62 % (40,9, 75,1)
|
Výskyt nových morfometrických
vertebrálnych fraktúr
| 9,56 % (7,5, 11,7)
| 4,68 % (3,2, 6,2)
|
Zníženie relatívneho rizika klinickej
vertebrálnej fraktúry
|
| 49 %
(14,03, 69,49)
|
|
Placebo
(N = 974)
|
kyselina ibandrónová 2,5 mg
denne
(N = 977)
|
Výskyt klinickej vertebrálnej
fraktúry
|
5,33 %
(3,73, 6,92)
|
2,75 %
(1,61, 3,89)
|
BMD – priemerná zmena vzhľadom
na východiskový stav driekovej chrbtice v 3. roku
|
1,26 % (0,8, 1,7)
|
6,54 % (6,1, 7,0)
|
BMD – priemerná zmena vzhľadom
na východiskový stav bedrovej oblasti v 3. roku
|
-0,69 %
(-1,0, -0,4)
|
3,36 %
(3,0, 3,7)
|
Účinok liečby kyselinou ibandrónovou sa ďalej stanovil na základe analýzy podskupiny pacientok,
ktoré mali vo východiskovom bode T-skóre BMD driekovej chrbtice nižšie ako –2,5 (tabuľka 4). Zníženie rizika vertebrálnych fraktúr bolo s tým v úplnej zhode a pozorovalo sa v celkovej populácii.
Tabuľka 4: Výsledky trojročnej štúdie MF 4411 (%, 95 % IS) zameranej na fraktúry u pacientok, ktoré mali vo východiskovom bode T-skóre BMD driekovej chrbtice nižšie ako –2,5
| Placebo
(N = 587)
| kyselina ibandrónová 2,5 mg
denne
(N = 575)
|
Zníženie relatívneho rizika výskytu
nových morfometrických vertebrálnych fraktúr
|
| 59 % (34,5, 74,3)
|
Výskyt nových morfometrických
vertebrálnych fraktúr
| 12,54 % (9,53, 15,55)
| 5,36 % (3,31, 7,41)
|
Zníženie relatívneho rizika klinickej
vertebrálnej fraktúry
|
| 50 % (9,49, 71,91)
|
Výskyt klinickej vertebrálnej
fraktúry
| 6,97 % (4,67, 9,27)
| 3,57 % (1,89, 5,24)
|
BMD – priemerná zmena vzhľadom
na východiskový stav driekovej chrbtice v 3. roku
| 1,13 % (0,6, 1,7)
| 7,01 % (6,5, 7,6)
|
BMD – priemerná zmena vzhľadom na východiskový stav bedrovej
oblasti v 3. roku
| -0,70 % (-1,1, -0,2)
| 3,59 % (3,1, 4,1)
|
V celej populácii pacientov v štúdii MF4411 sa nezaznamenalo zníženie výskytu nevertebrálnych
fraktúr, avšak pri dennom podávaní kyseliny ibandrónovej sa dokázala účinnosť u vysoko rizikovej podskupiny (s hodnotami T-skóre BMD stehnového krčku < -3,0), kde sa zaznamenalo zníženie rizika nevertebrálnych fraktúr o 69%
Denná perorálna liečba v dávke 2,5 mg kyseliny ibandrónovej mala za následok progresívny nárast
BMD na vertebrálnych i nevertebrálnych miestach kostry.
Nárast BMD driekovej chrbtice počas troch rokov v porovnaní s placebom bol 5,3 % a 6,5 %
v porovnaní s východiskovým stavom. Nárast v bedrovej oblasti, v mieste krčku stehennej kosti
v porovnaní s východiskovým bodom bol 2,8 %, v celej bedrovej oblasti 3,4 % a 5,5 % v trochanteri.
Biochemické markery kostného metabolizmu (napríklad CTX v moči a sérový osteokalcín) dokázali očakávanú supresiu až po hladiny pred menopauzou a maximálna supresia sa dosiahla v období
3 až 6 mesiacov používania 2,5 mg kyseliny ibandrónovej denne.
Klinicky významná 50 %-ná redukcia biochemických markerov kostnej rezorbcie sa pozorovala skoro, už jeden mesiac po začiatku liečby kyselinou ibandrónovou 2,5 mg.
Pediatická populácia (pozri časť 4.2 a časť 5.2)
Kyselina ibandrónová nebola skúmaná v pediatrickej populácii, preto nie sú k dispozícii žiadne údaje účinnosti a bezpečnosti pre túto skupinu pacientov.
5.2 Farmakokinetické vlastnosti
Primárne farmakologické účinky kyseliny ibandrónovej na kosť nesúvisia priamo s aktuálnymi koncentráciami v plazme, ako dokázali rôzne štúdie u zvierat aj u ľudí.
Plazmatické koncentrácie kyseliny ibandrónovej sa po intravenóznom podaní 0,5 mg až 6 mg zvyšujú úmerne dávke.
Absorpcia
Neaplikovateľné
Distribúcia
Kyselina ibandrónová sa po počiatočnej systémovej expozícii rýchlo viaže na kosť alebo sa vylúči do moču. U ľudí je zrejmý terminálny distribučný objem najmenej 90 l a množstvo dávky, ktoré sa dostane do kosti, sa odhaduje na 40 až 50 % cirkulujúcej dávky. Väzba na proteíny v ľudskej plazme je približne 85 až 87 % (stanovená in vitro pri terapeutických koncentráciách kyseliny ibandrónovej), a preto existuje len malý potenciál interakcie s inými liekmi v dôsledku vytesnenia.
Biotransformácia
Neexistuje žiadny dôkaz, že kyselina ibandrónová je u zvierat alebo u ľudí metabolizovaná.
Eliminácia
Kyselina ibandrónová sa eliminuje z obehu prostredníctvom kostnej absorpcie (odhaduje sa, že je to
40 až 50 % absorpcie u žien po menopauze) a zvyšok je eliminovaný v nezmenenom stave obličkami.
Rozsah pozorovaných zrejmých polčasov je široký, zdanlivý terminálny polčas sa vo všeobecnosti pohybuje v rozsahu 10 – 72 hodín. Keďže vypočítané hodnoty sú z veľkej časti závislé od dĺžky štúdie, použitej dávky a citlivosti testu, skutočný terminálny polčas je pravdepodobne podstatne dlhší, rovnako ako u ostatných bisfosfonátov. Včasné plazmatické hladiny rýchlo klesajú dosahujúc 10 % maximálnych hodnôt po 3 a 8 hodinách po intravenóznom alebo perorálnom podaní.
Celkový klírens kyseliny ibandrónovej je nízky s priemernými hodnotami v rozsahu 84 až 160 ml/min. Renálny klírens (približne 60 ml/min u zdravých žien po menopauze) činí 50 – 60 % celkového klírensu a súvisí s klírensom kreatinínu. Rozdiel medzi zdanlivým celkovým a renálnym klírensom sa odráža vychytávanie liečiva kosťou.
Zdá sa, že sekrečná dráha j eliminácie nezahŕňa známe kyslé alebo zásadité transportné systémy podieľajúce sa na vylučovaní iných liečiv. Okrem toho kyselina ibandrónová neinhibuje hlavné izoenzýmy pečeňového cytochrómového systému P450 u ľudí a neindukuje pečeňový cytochrómový systém P450 u potkanov.
Farmakokinetika v osobitných klinických situáciách
Pohlavie
Farmakokinetika kyseliny ibandrónovej je u mužov a žien podobná.
Rasa
Pokiaľ ide o vylučovanie kyseliny ibandrónovej, neexistuje žiadny dôkaz klinicky významných etnických rozdielov medzi Aziatmi a belochmi. Je dostupných málo údajov o pacientoch afrického
pôvodu.
Pacienti s poškodením funkcie obličiek
Renálny klírens kyseliny ibandrónovej u pacientov s rôznymi stupňami poškodenie funkcie obličiek je lineárne úmerný klírensu kreatinínu (CLcr).
U pacientov s miernou alebo stredne ťažkou renálnou insuficienciou (CLcr rovný alebo väčší ako
30/min) nie je potrebné upraviť dávku.
Pacienti s ťažkým poškodením funkcie obličiek (CLcr menší ako 30 ml/min), ktorí denne dostávali perorálnu dávku 10 mg kyseliny ibandrónovej počas 21 dní, mali 2 až 3-krát vyššie plazmatické koncentrácie ako pacienti s normálnou renálnou funkciou a celkový klírens kyseliny ibandrónovej u nich bol 44 ml/min. Po intravenóznom podaní 0,5 mg kyseliny ibandrónovej pacientom s ťažkým stupňom renálnej insuficiencie poklesol celkový klírens o 67 %, renálny klírens o 77 % a nerenálny klírens o 50 %. Avšak nepozorovalo sa žiadne zníženie znášanlivosti spojené so zvýšením expozície. Vzhľadom na obmedzené klinické skúsenosti sa kyselina ibandrónová neodporúča pacientom s ťažkou renálnou insuficienciou (pozri časť 4.2 a časť 4.4). Farmakokinetika kyseliny ibandrónovej u
pacientov s renálnym ochorením v konečnej fáze bola stanovená len u malého počtu pacientov kontrolovaných hemodialýzou, a z tohto dôvodu farmakokinetika kyseliny ibandrónovej u pacientov, ktorí nepodstupujú hemodialýzu, nie je známa. Vzhľadom k tomu, že k dispozícii sú len obmedzené údaje, kyselina ibandrónová sa nemá používať u všetkých pacientov s renálnym ochorením
v terminálnej fáze.
Pacienti s poškodením funkcie pečene (pozri časť 4.2)
Nie sú známe žiadne farmakokinetické údaje o kyseline ibandrónovej u pacientov s hepatálnou insuficienciou. Pečeň nehrá žiadnu významnú úlohu pri klírense kyseliny ibandrónovej, ktorá nie je metabolizovaná, ale je uvoľnená renálnou exkréciou a absorbovaná kosťami. Preto u pacientov
s hepatálnou insuficienciou nie je potrebné upraviť dávku.
Starší pacienti (pozri časť 4.2)
Na základe viacnásobnej analýzy sa nezistilo, že by akýkoľvek zo študovaných farmakokinetických paramentrov bol závislý od veku. Keďže funkcia obličiek sa vekom zhoršuje, je to jediný faktor, ktorý treba brať do úvahy (pozri časť Poškodenie funkcie obličiek).
Pediatrická populácia (pozri časť 4.2 a časť 5.1)
Neexistujú žiadne údaje o užívaní kyseliny ibandrónovej pacientmi tejto vekovej skupiny.
5.3 Predklinické údaje o bezpečnosti
Toxické účinky, t. j. príznaky renálneho poškodenia, sa pozorovali u psov len pri expozíciách dostatočne prevyšujúcich maximálne expozície u ľudí, čo naznačuje malý význam pre klinické použitie.
Mutagenita/Karcinogenita
Nepozoroval sa žiadny náznak karcinogénneho potenciálu. Testy na genotoxicitu nedokázali genetickú aktivitu kyseliny ibandrónovej.
Reprodukčná toxicita
Špecifické štúdie zamerané na dávkovací režim s podaním každé 3 mesiace sa neuskutočnili.
V štúdiách zameraných na denné intravenózne podávanie kyseliny ibandrónovej sa u potkanov a králikov nedokázal priamy toxický alebo teratogénny vplyv na plod. Nárast telesnej hmotnosti bol znížený u potomstva F1 u potkanov. V reprodukčných štúdiách u potkanov perorálne podávanie pri dávkach 1 mg/kg/deň a vyšších viedlo k nárastu preimplantačných potratov. V reprodukčných štúdiách u potkanov intravenózne podávaná kyselina ibandrónová znížila počet spermií pri dávkach
0,3 a 1 mg/kg/deň a znížila fertilitu u samcov pri dávke 1 mg/kg/deň a u žien pri dávke na
1,2 mg/kg/deň. Ďalšie nežiaduce reakcie na kyselinu ibandrónovú v štúdiách reprodukčnej toxicity u potkanov sa nelíšili od nežiaducich reakcií, ktoré sa zvyčajne pozorujú u bisfosfonátov. Zahŕňajú znížený počet implantačných miest, narušenie prirodzeného pôrodu (dystokia) a nárast viscerálnych odchýlok (renal pelvis ureter syndrome).
6
. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný
kyselina octová, ľadová
Nátriumacetát
Voda na injekciu
6.2 Inkompatibility
Injekčný roztok kyseliny ibandrónovej sa nesmie miešať s roztokmi obsahujúcimi vápnik alebo s inými intravenózne podávanými liekmi.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Naplnené injekčné striekačky vyrobené z bezfarebného skla, opatrené šedou pryžovou plunžerovou zátkou a krytom hrotu, obsahujú 3 ml injekčného roztoku.
Balenie obsahuje 1 naplnenú injekčnú striekačku a 1 injekčnú ihlu alebo 4 naplnené injekčné striekačky a 4 injekčné ihly.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Ak sa má liek podať do existujúceho intravenózneho prístupu, infúzny roztok sa má obmedziť buď na izotonický fyziologický roztok alebo na 50 mg/ml (5 %) roztok glukózy. Platí to aj pre roztoky používané na prepláchnutie krídielkového adaptéra a iných pomôcok.
Nepoužitý injekčný roztok, injekčná striekačka a injekčná ihla majú byť zlikvidované v súlade s národnými požiadavkami. Uvoľnenie liečiv do prostredia má byť znížené na minimum.
Pri použití a likvidácii injekčných striekačiek a ďalších injekčných ihiel sa majú dôsledne dodržať
nasledujúce body:
· Injekčné ihly a injekčné striekačky sa nemajú znovu použiť.
· Všetky injekčné ihly a injekčné striekačky po použití dajte do nádoby na ostré predmety
(odpadková nádoba odolná proti prerezaniu).
· Nádobu uchovávajte mimo dosahu detí.
· Nádobu na ostré predmety nedávajte do bežného odpadu.
· Naplnenú nádobu zlikvidujte v súlade s národnými požiadavkami alebo pokynov svojho lekára.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Accord Healthcare Limited
Sage House
319, Pinner Road North Harrow Middlesex HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/12/798/005
EU/1/12/798/006
9. DÁTUM PRVEJ REGISTRÁCIEDátum prvej registrácie
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.