
dostupný v dvoch silách. Perá KwikPen s Humalogom 100 jednotiek/ml a
s Humalogom 200 jednotiek/ml dávkujú v každej injekcii 1 - 60 jednotiek v kroku po 1 jednotke. Pero Junior KwikPen s Humalogom 100 jednotiek/ml dávkuje v každej injekcii 0,5 - 30 jednotiek
v kroku po 0,5 jednotkách. Počet inzulínových jednotiek sa zobrazí v dávkovacom okienku pera, bez ohľadu na silu a nie je potrebné upravovať dávku, keď pacienta prestavujete na novú silu alebo na pero s iným dávkovacím krokom.
Osobitné populácie
Porucha funkcie obličiek
Potreba inzulínu sa môže znížiť v prípade výskytu poruchy funkcie obličiek.
Porucha funkcie pečene
Potreba inzulínu sa môže znížiť u pacientov s poruchou funkcie pečene z dôvodu zníženej kapacity u glukoneogenézy a zhoršeného odbúravania inzulínu; avšak u pacientov s chronickou poruchou funkcie pečene môže zvýšenie inzulínovej rezistencie viesť k zvýšeniu potreby inzulínu.
Pediatrická populácia
Humalog sa môže používať u dospievajúcich a detí (pozri časť 5.1).
Spôsob podávania
Humalogové lieky sa majú podávať subkutánnou injekciou, môžu sa podávať, hoci sa to neodporúča,
aj intramuskulárnou injekciou.
Pero Junior KwikPen je vhodné na podávanie len subkutánnej injekcie. Humalog 100 jednotiek/ml je dostupný aj v injekčných liekovkach, ak by bolo potrebné podať intravenóznu injekciu alebo ho použiť v infúznej pumpe.
Miestom subkutánneho podania má byť horná časť ramena, stehno, sedací sval alebo brucho. Miesta vpichu sa majú meniť rotačným spôsobom tak, aby sa rovnaké miesto nepoužilo viackrát ako približne jedenkrát za mesiac.
Pri aplikácii subkutánnej injekcie Humalogu je potrebné dôkladne sa uistiť o tom, že nedošlo
k aplikácii do cievy. Po aplikácii injekcie sa miesto vpichu nemá masírovať. Pacient musí byť riadne poučený o správnej (injekčnej) aplikačnej technike.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Hypoglykémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Prechodpacientanainýtypaleboznačkuinzulínu
Prechod pacienta na iný typ alebo značku inzulínu sa má uskutočniť pod prísnym lekárskym dohľadom. Zmeny koncentrácie, značky (výrobcu), typu (regular, NPH, lente a i.), druhu (zvierací, ľudský, analóg ľudského inzulínu) a/alebo spôsobu výroby (rekombinantná DNA oproti inzulínu zvieracieho pôvodu) môžu mať za následok potrebu zmeny dávkovania. Každý pacient, ktorý užíva popri rýchlo pôsobiacom aj bazálny inzulín, musí optimalizovať dávkovanie oboch inzulínov
k dosiahnutiu kontroly glykémie po celý deň, najmä kontroly glykémie v noci/nalačno.
Hypoglykémia a hyperglykémia
Dlhotrvajúci diabetes, intenzifikovaná inzulínová terapia, diabetická neuropatia alebo užívanie liekov ako sú beta-blokátory môžu zmeniť alebo zmierniť skoré varovné príznaky hypoglykémie.
Malý počet pacientov, ktorí mali hypoglykemické reakcie po prechode z inzulínu zvieracieho pôvodu na ľudský inzulín uvádzal, že skoré varovné príznaky hypoglykémie boli menej výrazné alebo odlišné od tých, ktoré zažili pri používaní predchádzajúceho inzulínu. Nekontrolované hypoglykemické alebo hyperglykemické reakcie môžu spôsobiť stratu vedomia, kómu alebo smrť.
Použitie neadekvátnych dávok alebo prerušenie liečby, najmä u inzulín-dependentných diabetikov,
môže viesť k hyperglykémii a diabetickej ketoacidóze, ktoré sú potenciálne letálne.
Potreba inzulínu a úprava dávky
Potreba inzulínu sa môže zvýšiť počas choroby alebo pri emocionálnom rozrušení.
Úprava dávky môže byť tiež potrebná, ak pacienti vykonávajú zvýšenú fyzickú aktivitu alebo menia svoje obvyklé stravovanie. Cvičenie ihneď po jedle môže zvýšiť riziko hypoglykémie. Dôsledkom farmakodynamiky rýchlo pôsobiaceho analógu inzulínu je, že výskyt hypoglykémie, pri porovnaní
s rozpustným ľudským inzulínom, sa po injekcii môže objaviť skôr.
Kombinácia Humalogu a pioglitazónu:
V prípadoch, keď sa použil pioglitazón v kombinácii s inzulínom, boli zaznamenané prípady srdcového zlyhania, najmä u pacientov s rizikovými faktormi pre vznik srdcového zlyhania. Tieto
fakty je potrebné mať na zreteli v prípade, že sa zvažuje liečba kombináciou pioglitazónu a Humalogu. Ak pacient používa danú kombináciu, je u neho potrebné sledovať prejavy a symptómy srdcového zlyhania, priberania na hmotnosti a edému. Ak sa zistí akékoľvek zhoršenie srdcových symptómov,
pioglitazón sa musí prestať podávať.
Návod na použitie a zaobchádzanie
Aby sa zabránilo možnému prenosu choroby, každé pero smie používať len jeden pacient, a to aj
vtedy, ak by si vymenil ihlu.
Vyhnutie sa chybám v dávkovaní
Pacientov treba poučiť, aby si vždy pred každou injekciou skontrolovali inzulínový štítok, aby sa predišlo neúmyselnej zámene medzi dvomi rôznymi silami Humalogu KwikPen alebo inými inzulínovými liekmi.
Pacienti si majú vizuálne overiť množstvo navolených jednotiek v dávkovacom okienku pera. Preto je potrebné, aby pacienti, ktorí si sami podávajú injekciu, boli schopní prečítať hodnoty v dávkovacom okienku pera. Nevidiaci pacienti, alebo tí so slabým zrakom majú byť poučení, aby im pri dávkovaní vždy pomohla ďalšia osoba s dobrým znakom a vyškolená na používanie inzulínovej pomôcky.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v každej dávke, t. j. je v podstate „bez sodíka“.
4.5 Liekové a iné interakcie
Potreba inzulínu sa môže zvýšiť liekmi s hyperglykemickým účinkom, ako je perorálna antikoncepcia, kortikosteroidy alebo hormonálna substitučná terapia pri liečbe porúch štítnej žľazy, danazol, beta2-mimetiká (napríklad ritodrín, salbutamol, terbutalín).
Potreba inzulínu sa môže znížiť pri podávaní liekov s hypoglykemickým účinkom, ako sú perorálne antidiabetiká, salicyláty (napríklad kyselina acetylsalicylová), sulfónamidy, niektoré antidepresíva (inhibítory monoaminooxidázy, selektívne inhibítory spätného vychytávania sérotonínu), niektoré inhibítory angiotenzín konvertujúceho enzýmu (kaptopril, enalapril), blokátory receptorov angiotenzínu II, beta-blokátory, oktreotid alebo alkohol.
Používanie iných liekov podávaných súbežne s Humalogom 100 jednotiek/ml Junior KwikPen sa musí
konzultovať s lekárom (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Údaje o veľkom počte gravidných žien užívajúcich inzulín lispro nenaznačujú žiadne nežiaduce
účinky na graviditu alebo na zdravie plodu/novorodenca.
Udržanie dobrej kontroly glykémie počas gravidity je základnou požiadavkou liečby diabetu
u pacientky liečenej inzulínom pri inzulín-dependentnom alebo gestačnom diabete. Potreba inzulínu sa obvykle znižuje počas prvého trimestra a zvyšuje počas druhého a tretieho trimestra. Pacientky
s diabetom majú byť poučené o tom, aby informovali svojho lekára v prípade gravidity alebo ak
graviditu zvažujú. Starostlivé monitorovanie glykémie, rovnako ako aj celkového zdravotného stavu, je základnou požiadavkou u gravidných pacientok s diabetom.
Dojčenie
Dojčiace diabetičky môžu potrebovať úpravu dávky inzulínu, stravovania alebo oboje.
Fertilita
V štúdiách so zvieratami inzulín lispro nevyvolal poruchy plodnosti (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Schopnosť pacienta koncentrovať sa a reagovať môže byť v dôsledku hypoglykémie porušená. Môže to byť riskantné v situáciách špeciálne vyžadujúcich vyššie uvedené schopnosti (napr. vedenie auta alebo obsluha strojov).
Pacient má byť poučený o nutnosti zabrániť hypoglykémii počas vedenia vozidla, čo je obzvlášť dôležité u tých osôb, ktoré majú zníženú alebo chýbajúcu vnímavosť varovných príznakov hypoglykémie alebo sa u nich vyskytujú časté hypoglykemické epizódy. Za týchto okolností sa má vhodnosť vedenia vozidiel starostlivo zvážiť.
4.8 Nežiaduce účinky
Zhrnutie profilu bezpečnosti
Najčastejším nežiaducim účinkom inzulínovej terapie, ktorý sa môže vyskytnúť u pacienta s diabetom,
je hypoglykémia. Závažná hypoglykémia môže viesť k strate vedomia a v extrémnych prípadoch až k smrti. Konkrétna frekvencia výskytu hypoglykémie nie je uvedená, pretože hypoglykémia je výsledkom pôsobenia nielen dávky inzulínu, ale aj iných faktorov, napr. úrovne stravovania pacienta a fyzickej aktivity.
Tabuľka so zoznamomnežiaducichreakcií
Nasledujúce súvisiace nežiaduce reakcie z klinických skúšaní sú uvedené nižšie ako MedDRA
preferovaný termín podľa triedy orgánových systémov a v poradí klesajúceho výskytu (veľmi časté:
≥1/10; časté: ≥1/100 až <1/10; menej časté: ≥1/1 000 až <1/100; zriedkavé: ≥1/10 000 až <1/1 000;
veľmi zriedkavé: <1/10 000).
V rámci každej skupiny frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
T
rieda orgánových systémov podľa databázy MedDRA
P
oruchy imunitného systému
veľmi časté
 časté
m
enej
časté
z
riedkavé
veľmi
z
riedkavé
časté
m
enej
časté
z
riedkavé
veľmi
z
riedkavé
lokálna alergia X
systémová alergia X
Poruchy kože a podkožného tkanivalipodystrofia X
Opis vybraných nežiaducich reakciíLokálna alergiaLokálna alergia u pacientov je častá. V mieste vpichu inzulínovej injekcie sa môže objaviť začervenanie, opuch a svrbenie. Tento stav obvykle ustúpi počas niekoľkých dní alebo týždňov.
V niektorých prípadoch môže byť tento stav zapríčinený inými faktormi ako inzulínom, napríklad
iritáciou kože dezinfekčným prostriedkom alebo nesprávnou injekčnou technikou.
Systémová alergiaSystémová alergia, zriedkavá, ale potenciálne závažnejšia, je generalizovanou alergiou na inzulín. Môže spôsobiť vyrážky po celom tele, dýchavičnosť, pískanie, pokles krvného tlaku, zrýchlený pulz alebo potenie. Ťažké stavy generalizovanej alergie môžu ohrozovať život.
LipodystrofiaLipodystrofia v mieste vpichu injekcie je menej častá.
EdémPri inzulínovej liečbe boli hlásené prípady edému, najmä vtedy, keď v dôsledku intenzívnejšej inzulínoterapie došlo k zlepšeniu predchádzajúcej zlej metabolickej kompenzácie.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieInzulíny nemajú žiadnu konkrétnu definíciu predávkovania, pretože sérová hladina krvného cukru je výsledkom komplexných interakcií medzi hladinou inzulínu, dostupnosťou glukózy a ostatnými metabolickými procesmi. Hypoglykémia sa môže objaviť ako dôsledok nadbytku inzulínu v pomere k príjmu potravy a výdaju energie.
Hypoglykémia môže byť spojená s apatiou, zmätenosťou, palpitáciami, bolesťou hlavy, potením
a vracaním.
Epizódy miernej hypoglykémie reagujú na perorálne podanie glukózy alebo iného cukru, prípadne produktu obsahujúceho sacharidy.
Úpravu stredne závažnej hypoglykémie možno dosiahnuť intramuskulárnou alebo subkutánnou aplikáciou glukagónu a následným perorálnym podaním uhľohydrátov, pokiaľ sa pacient dostatočne zotaví. Pacientom, ktorí nereagujú na glukagón, sa musí podať infúzia glukózy intravenózne.
Ak je pacient v kóme, glukagón sa má aplikovať intramuskulárne alebo subkutánne. Ak však glukagón
nie je k dispozícii alebo pacient na jeho podanie nereaguje, musí sa podať roztok glukózy intravenózne. Hneď ako sa pacient preberie z bezvedomia, musí sa najesť.
Po zjavnej úprave klinického stavu môže byť potrebný trvalý príjem sacharidov a sledovanie pacienta, pretože hypoglykémia sa môže opakovať.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antidiabetiká, inzulíny a analógy na injekciu, rýchlo pôsobiace, ATC kód: A10AB04
Primárnou aktivitou inzulínu lispro je regulácia glukózového metabolizmu.
Okrem toho majú inzulíny ďalšie anabolické a antikatabolické účinky na mnoho rôznych tkanív.
V svalovom tkanive tieto účinky zahŕňajú zvýšenie syntézy glykogénu, mastných kyselín, glycerolu
a proteínov a vychytávanie aminokyselín, zároveň zníženie glykogenolýzy, glukoneogenézy,
ketogenézy, lipolýzy, proteínového katabolizmu a tvorby aminokyselín.
Inzulín lispro má rýchly nástup účinku (približne 15 minút), čo umožňuje jeho podanie krátko pred jedlom alebo po jedle (interval od 0 do 15 minút), v porovnaní s bežným rýchlo pôsobiacim inzulínom (aplikácia 30 až 45 minút pred jedlom). V porovnaní s regular inzulínom je nástup účinku
inzulínu lispro rýchly a trvanie aktivity kratšie (2 až 5 hodín).
Klinické skúšania u pacientov s diabetom 1. a 2. typu preukázali nižší výskyt postprandiálnej hyperglykémie u inzulínu lispro v porovnaní s rozpustným ľudským inzulínom.
Tak ako u všetkých inzulínových liekov, môže byť časový priebeh účinku inzulínu lispro odlišný
u rôznych jedincov alebo odlišný v rôznych časových intervaloch u rovnakého jedinca v závislosti od dávky, miesta podania injekcie, krvného zásobenia, teploty a fyzickej aktivity. Typický priebeh
aktivity v čase po subkutánnej injekcii ilustruje nasledujúci graf.

hypoglykemická aktivita
Insulin lispro
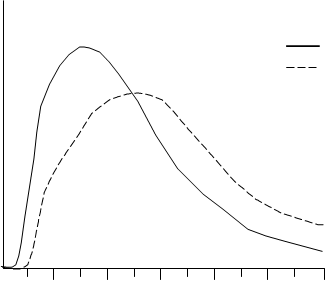
Humulin R
0 1 2 3 4 5 6

čas (hodiny)
Graf zobrazuje relatívne množstvo glukózy v závislosti od času potrebné na udržanie celkovej
plazmatickej glukózovej koncentrácie testovaného jedinca blízko k hladinám glukózy nalačno a je
indikátorom účinku týchto inzulínov na glukózový metabolizmus v závislosti od času.
Uskutočnili sa klinické skúšania u detí (61 pacientov vo veku 2 až 11 rokov) a u detí a mladistvých (481 pacientov vo veku 9 až 19 rokov) porovnávajúce inzulín lispro a ľudský rozpustný inzulín. Farmakodynamický profil inzulínu lispro u detí je podobný ako farmakodynamický profil pozorovaný u dospelých.
Pri používaní v subkutánnych infúznych pumpách preukázala liečba inzulínom lispro nižšie hladiny glykovaného hemoglobínu v porovnaní s rozpustným inzulínom. V dvojito zaslepenej skríženej štúdii
došlo ku zníženiu hladiny glykovaného hemoglobínu po 12 týždňoch o 0,37 percentuálnych bodov u inzulínu lispro v porovnaní s 0,03 percentuálnymi bodmi u rozpustného inzulínu (p = 0,004).
Štúdie ukázali, že pridanie inzulínu lispro významne znižuje hladinu HbA1C v porovnaní so samotnou sulfonylureou u pacientov s diabetom 2. typu na maximálnych dávkach derivátov sulfonylurey. Zníženie hladiny HbA1C možno očakávať takisto pri kombinácii s inými inzulínovými liekmi, napr.
s rozpustným alebo izofán inzulínom.
Klinické skúšania u pacientov s diabetom 1. a 2. typu preukázali nižší počet nočných hypoglykémií s inzulínom lispro v porovnaní s rozpustným ľudským inzulínom. V niektorých štúdiách bol nižší počet nočných hypoglykémií spojený so zvýšeným počtom denných hypoglykémií.
Glukodynamická odpoveď na inzulín lispro nie je ovplyvnená poškodením funkcie obličiek ani pečene. V širokom spektre renálnych funkcií sa zachovali glukodynamické rozdiely medzi inzulínom lispro a rozpustným ľudským inzulínom merané v priebehu glukózovej svorky.
Ukázalo sa, že inzulín lispro je molárne ekvipotentný s ľudským inzulínom, ale jeho účinok nastupuje
rýchlejšie a má kratšiu dobu trvania.
5.2 Farmakokinetické vlastnosti
Farmakokinetika inzulínu lispro zodpovedá látke, ktorá sa rýchlo absorbuje a dosahuje najvyššie plazmatické hladiny v čase od 30 do 70 minút po podaní subkutánnej injekcie. Pri zvažovaní klinickej relevancie tejto kinetiky je vhodnejšie vyšetriť krivky utilizácie glukózy (ako bolo uvedené v 5.1).
Inzulín lispro si zachováva rýchlejšiu absorpciu vtedy, keď ho porovnáme s rozpustným ľudským inzulínom u pacientov s poruchou funkcie obličiek. U pacientov s diabetom 2. typu v širokom spektre renálnych funkcií sa farmakokinetické rozdiely medzi inzulínom lispro a rozpustným ľudským inzulínom obvykle zachovávali a ukázalo sa, že sú nezávislé od renálnych funkcií. Inzulín lispro sa
u pacientov s poruchou funkcie pečene absorbuje a eliminuje rýchlejšie ako rozpustný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Pri testoch uskutočnených in vitro, zahŕňajúcich väzbu na inzulínové receptory a účinky na
rastúce bunky, sa inzulín lispro správal spôsobom, ktorý veľmi pripomínal ľudský inzulín. Štúdie tiež
preukázali, že disociácia väzby inzulínu lispro na inzulínový receptor je totožná s ľudským inzulínom.
Akútne, jeden mesiac a dvanásť mesiacov trvajúce toxikologické štúdie nepreukázali žiadne
významné nálezy toxicity.
V štúdiách na zvieratách inzulín lispro nespôsoboval poškodenie plodnosti, nevyvolal prejavy embryotoxicity ani teratogenicity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol glycerol
heptahydrát hydrogénfosforečnanu sodného
oxid zinočnatý
voda na injekciu
na úpravu pH sa môže použiť kyselina chlorovodíková a hydroxid sodný
6.2 Inkompatibility
Tento liek sa nemá miešať s inzulínmi iných výrobcov ani s inými liekmi.
6.3 Čas použiteľnosti
N
epoužité naplnené perá
3 roky.
Po prvom použití
28 dní.
6.4 Špeciálne upozornenia na uchovávanie
Nepoužité naplnené perá
Uchovávajte v chladničke (2°C - 8°C). Neuchovávajte v mrazničke. Nevystavujte nadmernému teplu alebo priamemu slnečnému svetlu.
Po prvom použití
Uchovávajte pri teplote do 30 °C. Neuchovávajte v chladničke. Naplnené pero sa nemá uchovávať
s nasadenou ihlou.
6.5 Druh obalu a obsah balenia
Sklenené náplne typu I, zabezpečené halobutylovým diskovým uzáverom zaistené alumíniovým tesnením a brómbutylovým piestovými hlavami. Na ošetrenie piestu náplne sa môže použiť dimetikón alebo silikónová emulzia. Náplne s objemom 3 ml sú uzatvorené v jednorazovom pere, ktoré sa volá
„Junior KwikPen“. Ihly nie sú súčasťou balenia.
1 naplnené pero s obsahom 3 ml
5 naplnených pier s obsahom 3 ml
multibalenie obsahujúce 10 (2 balenia po 5) naplnených 3 ml pier
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Návod na používanie a zaobchádzanie
Aby sa zabránilo možnému prenosu choroby, každé pero smie používať len jeden pacient, a to aj
vtedy, ak si vymení ihlu.
Roztok Humalogu má byť číry a bezfarebný. Nepoužívajte Humalog, ak sa javí zakalený, zahustený alebo ľahko zafarbený alebo ak sú v ňom viditeľné pevné častice.
Zaobchádzanie s naplneným perom
Pred použitím pera Junior KwikPen je potrebné si starostlivo prečítať návod na použitie, ktorý je súčasťou písomnej informácie. Pero Junior KwikPen sa má používať podľa odporúčaní uvedených v návode na použitie.
Nepoužívajte Junior KwikPen, ak akákoľvek jeho časť vyzerá ako zlomená, alebo poškodená.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko.
8. REGISTRAČNÉ ČÍSLA
EU/1/96/007/043
EU/1/96/007/044
EU/1/96/007/045
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 30. apríl 1996
Dátum posledného predĺženia registrácie: 30. apríl 2006
10. DÁTUM REVÍZIE TEXTU