arktu myokardu s eleváciou ST-segmentu STEMI je odporúčaná dávka enoxaparínu sodného jedna bolusová dávka 3000 IU (30 mg) podaná intravenózne (i.v.) plus dávka 100 IU/kg (1 mg/kg) podaná subkutánne (s.c.). Následne sa podáva dávka 100 IU/kg (1 mg/kg) s.c. každých 12 hodín (s obmedzením na maximálne 10 000 IU (100 mg) na každú z prvých dvoch dávok podaných s.c.). Súbežne sa má podávať vhodná antiagregačná liečba, ako je perorálne podávanie kyseliny acetylsalicylovej (75 mg až 325 mg jedenkrát denne), ak nie je kontraindikovaná. Odporúča sa, aby liečba enoxaparínom sodným trvala 8 dní alebo dovtedy, kým pacient neprejde do ambulantnej liečby, podľa toho, čo nastane skôr. Ak sa enoxaparín sodný podáva s trombolytikom (fibrín špecifickým alebo fibrín nešpecifickým), musí sa enoxaparín sodný podať v časovom rozmedzí 15 minút pred a 30 minút po začiatku fibrinolytickej liečby.
• Dávkovanie u pacientov vo veku ≥ 75 rokov je uvedené v časti „Starší ľudia”.
• U pacientov liečených perkutánnou koronárnou intervenciou (PCI) nie je potrebná žiadna dodatočná dávka, ak bol enoxaparín sodný naposledy podaný subkutánne pred menej ako ôsmimi hodinami pred insufláciou balónu. Ak bol enoxaparín sodný naposledy podaný subkutánne pred viac ako ôsmimi hodinami pred insufláciou balónu, musí sa podať dávka 30 IU/kg (0,3 mg/kg) enoxaparínu sodného ako i.v. bolusová dávka.
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu sodného nebola u pediatrickej populácie stanovená.
Starší ľudiaPre všetky indikácie okrem STEMI u starších pacientov nie je potrebné zníženie dávky, s výnimkou prípadov s poruchou funkcie obličiek (pozri nižšie „Porucha funkcie obličiek” a časť 4.4).
Na liečbu akútneho STEMI u starších pacientov vo veku 75 a viac rokov sa počiatočná intravenózna bolusová dávka nesmie použiť. Začnite dávkovanie subkutánnou dávkou 75 IU/kg (0,75 mg/kg) každých 12 hodín (s obmedzením na maximum 7 500 IU (75 mg) len pre každú z prvých dvoch dávok podaných subkutánne, potom pre zostávajúce ďalšie dávky je odporúčané dávkovanie 75 IU/kg
(0,75 mg/kg) subkutánne). Dávkovanie u starších pacientov s poruchou funkcie obličiek je uvedené nižšie v časti „Porucha funkcie obličiek” a v časti 4.4.
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene sú k dispozícii len obmedzené údaje (pozri časti 5.1 a 5.2) a treba u nich postupovať s opatrnosťou (pozri časť 4.4).
Porucha funkcie obličiek (pozri časti 4.4 a 5.2)• Závažná porucha funkcie obličiek
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii, okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Tabuľka s dávkovaním pre pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu 15- 30 ml/min):
Indikácia
| Dávkovací režim
|
Prevencia venóznej tromboembolickej choroby
| 2 000 IU (20 mg) s.c. jedenkrát denne
|
Liečba DVT a PE
| 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát denne
|
Liečba nestabilnej angíny a NSTEMI
| 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát denne
|
Liečba akútneho STEMI (pacienti vo veku do 75 rokov)
Liečba akútneho STEMI (pacienti vo veku nad 75 rokov)
| 1 × 3 000 IU (30 mg) i.v. bolus plus 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Bez i.v. úvodného bolusu, 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
|
Úprava odporúčaného dávkovania sa nevzťahuje na indikáciu týkajúcu sa hemodialýzy.
• Stredne ťažká a ľahká porucha funkcie obličiek
Aj keď pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a ľahkou (klírens kreatinínu 50-80 ml/min) poruchou funkcie obličiek nie je nutné dávkovanie upravovať, odporúča sa dôsledné klinické sledovanie.
Spôsob podávaniaGhemaxan sa nemá podávať intramuskulárne.
Na profylaxiu venóznej tromboembolickej choroby po chirurgickom zákroku, na liečbu DVT a PE, na liečbu nestabilnej angíny a NSTEMI sa enoxaparín sodný má podávať s.c. injekciou.
• Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, po ktorej ihneď nasleduje s.c. injekcia.
• Na prevenciu tvorby trombov v mimotelovom obehu počas hemodialýzy sa podáva do arteriálnej linky dialyzačného obvodu.
Naplnená jednorazová injekčná striekačka je pripravená na okamžité použitie.
• s.c. injekčná technika:
Injekcia enoxaparínu sodného sa má podávať pacientovi prednostne v ležiacej polohe hlbokou s.c. injekciou.
Ak používate naplnenú injekčnú striekačku, pred podaním injekcie z nej neodstrekujte vzduchovú bublinu, aby sa zabránilo stratám lieku. Ak je potrebné upraviť množstvo lieku, ktoré sa má podať, podľa telesnej hmotnosti pacienta, použite na dosiahnutie požadovaného množstva kalibrovanú injekčnú striekačku a prebytočné množstvo zlikvidujte pred podaním injekcie. Uvedomte si, že v niektorých prípadoch nie je možné dosiahnuť presnú dávku kvôli kalibrácii (dielikom) na injekčnej striekačke, vtedy treba objem zaokrúhliť na najbližšiu hodnotu (najbližší dielik).
Injekcia sa má striedavo podávať do ľavej a pravej anterolaterálnej alebo posterolaterálnej časti brušnej steny. Celá dĺžka ihly sa zavedie kolmo do kožného záhybu vytvoreného medzi palcom a ukazovákom.
Kožný záhyb sa nemá uvoľniť dovtedy, kým injekcia nie je podaná celá. Po podaní injekcie miesto podania nemasírujte.
Všimnite si, že pri naplnených injekčných striekačkách s chráničom ihly sa bezpečnostný systém aktivuje na konci injekcie (pozri pokyny v časti 6.6).
Ak si bude pacient podávať subkutánnu injekciu sám, pacienta treba upozorniť, aby si veľmi pozorne prečítal pokyny v písomnej informácii pre používateľa, ktorá je súčasťou balenia lieku.
· i.v. (bolus) injekcia (len pre indikáciu akútny STEMI):
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, za ktorou ihneď nasleduje s.c. injekcia. Pri i.v. injekcii sa môže použiť buď viacdávková injekčná liekovka, alebo
naplnená injekčná striekačka. Enoxaparín sodný sa má podať do i.v. linky. Nemá sa miešať ani podávať spolu s inými liekmi. Na zabránenie možnosti zmiešania enoxaparínu sodného s inými liekmi sa musí vybraný intravenózny prístup pred a aj po intravenóznej aplikácii enoxaparínu sodného premyť dostatočným množstvom fyziologického roztoku alebo roztoku dextrózy na vyčistenie prístupu pre liek. Enoxaparín sodný sa môže bezpečne podať spolu s fyziologickým roztokom (0,9 %) alebo s 5 %- ným vodným roztokom dextrózy.
o Úvodný bolus 3 000 IU (30 mg)
Pomocou kalibrovanej naplnenej injekčnej striekačky odstreknite nadbytočný objem tak, aby injekčná striekačka obsahovala len 3000 IU (30 mg) enoxaparínu sodného. Dávka 3000 IU (30 mg) sa potom podáva priamo do miesta podania injekcie v intravenóznej linke.
o Dodatočný bolus pri PCI v prípade, že sa posledné s.c. podanie uskutočnilo pred viac ako 8 hodinami pred insufláciou balónu
Pre pacientov liečených PCI sa má podať dodatočný i.v. bolus 30 IU/kg (0,3 mg/kg), a to vtedy, keď bol enoxaparín sodný naposledy podaný subkutánne pred viac ako 8 hodinami pred insufláciou balónu.
Na zabezpečenie presného odmerania malého objemu injekcie sa odporúča nariediť liek na 300 IU/ml (3 mg/ml). Na dosiahnutie koncentrácie roztoku 300 IU/ml (3 mg/ml) s použitím naplnených injekčných striekačiek obsahujúcich 6000 IU (60 mg) enoxaparínu sodného sa odporúča použiť infúzny vak s objemom 50 ml (napr. použiť fyziologický roztok (0,9 %) alebo 5 %-ný vodný roztok dextrózy) nasledujúcim spôsobom:
Injekčnou striekačkou odoberte z infúzneho vaku 30 ml roztoku a tento odobraný roztok zlikvidujte. Celý obsah naplnenej injekčnej striekačky obsahujúcej 6000 IU (60 mg) enoxaparínu sodného vstreknite do vaku k zostávajúcim 20 ml roztoku. Obsah vaku jemne premiešajte. Naberte požadovaný objem nariedeného roztoku do injekčnej striekačky určenej na podanie roztoku do intravenóznej linky.
Po ukončení riedenia sa dá vypočítať objem, ktorý je potrebný na injekčné podanie pomocou tohto vzorca: [objem nariedeného roztoku (ml) = hmotnosť pacienta (kg) × 0,1] alebo podľa nižšie uvedenej tabuľky. Riedenie sa odporúča robiť bezprostredne pred použitím.
Objem roztoku, ktorý má byť po riedení podaný do i.v. linky v koncentrácii 300 IU (3 mg)/ml.
hmotnosť
| požadovaná dávka
30 IU/kg (0,3 mg/kg)
| objem, ktorý má byť podaný po riedení na
výslednú koncentráciu 300 IU (3 mg)/ml
|
[kg]
| IU
| [mg]
| [ml]
|
45
| 1350
| 13,5
| 4,5
|
50
| 1500
| 15
| 5
|
55
| 1650
| 16,5
| 5,5
|
60
| 1800
| 18
| 6
|
65
| 1950
| 19,5
| 6,5
|
70
| 2100
| 21
| 7
|
75
| 2250
| 22,5
| 7,5
|
80
| 2400
| 24
| 8
|
85
| 2550
| 25.5
| 8.5
|
90
| 2700
| 27
| 9
|
95
| 2850
| 28,5
| 9,5
|
100
| 3000
| 30
| 10
|
105
| 3150
| 31,5
| 10,5
|
110
| 3300
| 33
| 11
|
115
| 3450
| 34.5
| 11.5
|
120
| 3600
| 36
| 12
|
125
| 3750
| 37,5
| 12,5
|
130
| 3900
| 39
| 13
|
135
| 4050
| 40,5
| 13,5
|
140
| 4200
| 42
| 14
|
145
| 4350
| 43,5
| 14,5
|
150
| 4500
| 45
| 15
|
• Injekcia do arteriálnej linky:
Podáva sa do arteriálnej linky dialyzačného obvodu na prevenciu tvorby trombov v mimotelovom obehu počas hemodialýzy.
Prechod medzi enoxaparínom sodným a perorálnymi antikoagulanciami• Prechod medzi enoxaparínom sodným a antagonistami vitamínu K (VKA)
Je nutné zintenzívniť klinické monitorovanie a laboratórne testy [protrombínový čas vyjadrený ako Medzinárodný normalizovaný pomer (International Normalised Ratio, INR) s cieľom sledovať účinok VKA.
Keďže je tu časový interval, kým VKA dosiahne svoj maximálny účinok, liečba enoxaparínom sodným musí pokračovať v konštantnej dávke tak dlho, ako je to nutné na udržanie INR v požadovanom terapeutickom rozsahu v danej indikácii v dvoch po sebe nasledujúcich testoch. U pacientov liečených VKA je potrebné liečbu VKA ukončiť a prvú dávku enoxaparínu sodného podať vtedy, keď INR poklesne pod terapeutický rozsah.
• Prechod medzi enoxaparínom sodným a priamymi perorálnymi antikoagulanciami (DOAC)
U pacientov, ktorí dostávajú v súčasnosti enoxaparín sodný, je potrebné ukončiť túto liečbu a začať s užívaním DOAC od 0 do 2 hodín pred časom určeným pôvodne na podanie ďalšej dávky enoxaparínu sodného, dávkovanie DOAC sa má použiť tak, ako je uvedené v jeho SPC.
U pacientov, ktorí užívajú v súčasnosti DOAC, sa má prvá dávka enoxaparínu sodného podať v čase, kedy sa pôvodne mala užiť ďalšia dávka DOAC.
Podanie pri spinálnej/epidurálnej anestézii alebo lumbálnej punkciiAk sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, odporúča sa dôsledné neurologické monitorovanie kvôli riziku neuraxiálnych hematómov (pozri časť 4.4).
-
Pri dávkach používaných na prevenciuMedzi poslednou injekciou enoxaparínu sodného pri profylaktických dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 12 hodín.
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 12 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu 15-30 ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 24 hodín. Začatie liečby enoxaparínom sodným v dávke 2 000 IU (20 mg) 2 hodiny pred operáciou nie je kompatibilné s neuraxiálnou anestéziou.
-
Pri dávkach používaných na liečbuMedzi poslednou injekciou enoxaparínu sodného pri liečebných dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 24 hodín (pozri aj časť 4.3).
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 24 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu 15-30 ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 48 hodín. Pacienti dostávajúci dávky dvakrát denne (t.j. 75 IU/kg (0,75 mg/kg) dvakrát denne alebo 100 IU/kg (1 mg/kg) dvakrát denne) majú vynechať druhú dávku enoxaparínu sodného kvôli umožneniu dostatočného časového posunu pre zavedenie alebo odstránenie katétra.
Hladina anti-Xa je v týchto časových bodoch stále ešte detekovateľná a toto posunutie negarantuje, že sa zabráni vytvoreniu neuraxiálneho hematómu.
Rovnako treba zvážiť posunutie času podania enoxaparínu sodného najmenej o 4 hodiny po spinálnej/epidurálnej punkcii alebo po odstránení katétra. Tento časový posun musí vychádať z vyhodnotenia pomeru prínosu a rizika, berúc do úvahy aj riziko trombózy aj riziko krvácania v kontexte liečby a rizikových faktorov konkrétneho pacienta.
4.3 Kontraindikácie
Enoxaparín sodný je kontraindikovaný u pacientov:
• s precitlivenosťou na enoxaparín sodný, heparín alebo jeho deriváty vrátane iných nízkomolekulových heparínov (LMWH) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
• s anamnézou heparínom indukovanej trombocytopénie (HIT) sprostredkovanej imunitou za posledných 100 dní alebo s prítomnosťou cirkulujúcich protilátok (pozri aj časť 4.4);
• s aktívnym klinicky signifikantným krvácaním a stavmi s vysokým rizikom krvácania, vrátane nedávnej mozgovej príhody s krvácaním, s gastrointestinálnym vredom, s prítomnosťou malígnej neoplazmy s vysokým rizikom krvácania, nedávnou operáciou mozgu, chrbtice alebo oka, so známymi alebo suspektnými varixami ezofágu, s arteriovenóznymi malformáciami, s vaskulárnou aneuryzmou alebo s veľkými intraspinálnymi alebo intracerebrálnymi vaskulárnymi abnormalitami;
• pri spinálnej alebo epidurálnej anestézii alebo lokálno-regionálnej anestézii, ak sa enoxaparín sodný použil v predchádzajúcich 24 hodinách (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
•
VšeobecnéEnoxaparín sodný nemožno zamieňať (jednotku za jednotku) s inými nízkomolekulovými heparínmi (LMWHs). Tieto lieky sa líšia svojím výrobným postupom, molekulovou hmotnosťou, špecifickou anti-Xa a anti-II aktivitou, jednotkami, dávkovaním a klinickou účinnosťou a bezpečnosťou.
Následkom toho majú rozdielnu farmakokinetiku a biologickú aktivitu (napr. antitrombínovú aktivitu a interakciu s krvnými doštičkami). Preto treba venovať osobitnú pozornosť špecifickým pokynom na používanie pre každý z týchto liekov a dodržiavať ich.
•
Anamnéza HIT (>100 dní)Používanie enoxaparínu sodného u pacientov s anamnézou imunitne sprostredkovanej HIT za posledných 100 dní alebo pri prítomnosti cirkulujúcich protilátok je kontraindikované (pozri časť 4.3). Cirkulujúce protilátky môžu pretrvávať niekoľko rokov.
U pacientov s anamnézou (>100 dní) heparínom indukovanej trombocytopénie bez prítomnosti cirkulujúcich protilátok sa má enoxaparín sodný používať s mimoriadnou opatrnosťou. V takomto prípade možno urobiť rozhodnutie o použití enoxaparínu sodného len po starostlivom vyhodnotení pomeru prínosu a rizika a po zvážení možnosti neheparínovej alternatívnej liečby (napr. danaparoid sodný alebo lepirudín).
•
Monitorovanie počtu krvných doštičiekPri nízkomolekulových heparínoch existuje aj riziko vzniku heparínom indukovanej trombocytopénie sprostredkovanej protilátkami. Ak sa vyskytne trombocytopénia, zvyčajne sa objaví medzi 5. až 21. dňom od začiatku liečby enoxaparínom sodným.
Riziko HIT je vyššie u pacientov po operácii a najmä po operácii srdca a u onkologických pacientov. Preto sa odporúča zmerať počet krvných doštičiek na začiatku liečby enoxaparínom sodným a potom merať pravidelne počas liečby.
Ak existujú klinické príznaky pripomínajúce HIT (nová epizóda arteriálneho a/alebo venózneho tromboembolizmu, bolestivé kožné lézie v mieste injekcie, alergické alebo anafylaktoidné reakcie na liečbu), je potrebné zmerať počet krvných doštičiek. Pacienti musia byť upovedomení, že takéto príznaky sa môžu objaviť, a ak sa to stane, musia informovať svojho lekára.
V praxi, ak sa potvrdí signifikantný pokles počtu krvných doštičiek (30 až 50 % z východiskovej hodnoty), liečba enoxaparínom sodným sa musí okamžite ukončiť a pacient musí prejsť na inú alternatívnu neheparínovú antikoagulačnú liečbu.
•
KrvácanieRovnako ako pri iných antikoagulanciách, môže sa vyskytnúť v ktoromkoľvek mieste krvácanie. Ak sa vyskytne, je nutné vyšetriť pôvod krvácania a začať vhodnú liečbu.
Rovnako ako pri inej antikoagulačnej liečbe, enoxaparín sodný sa má použiť s opatrnosťou v stavoch so zvýšeným potenciálom pre krvácanie, ako je napríklad:
• porucha hemostázy,
• peptický vred v anamnéze,
• nedávno prekonaná ischemická mozgová príhoda,
• ťažká arteriálna hypertenzia,
• nedávna diabetická retinopatia,
• neurologický alebo oftalmologický chirurgický výkon,
• súbežné podávanie liekov ovplyvňujúcich hemostázu (pozri časť 4.5).
•
Laboratórne vyšetreniaEnoxaparín sodný podávaný v dávkach za účelom profylaxie venóznej tromboembólie významne neovplyvňuje čas krvácania a celkové koagulačné testy, nemá vplyv na agregáciu krvných doštičiek alebo na väzbu fibrinogénu na krvné doštičky.
Pri vyšších dávkach enoxaparínu sa môže zvýšiť aktivovaný parciálny tromboplastínový čas (aPTT) a aktivovaný čas koagulácie (ACT). Predĺženia aPTT a ACT a zvýšený antitrombotický účinok enoxaparínu sodného nie sú v lineárnom vzťahu, a preto tieto hodnoty nie sú pre sledovanie účinku enoxaparínu sodného vhodné ani spoľahlivé.
•
Spinálna/epidurálna anestézia alebo lumbálna punkciaSpinálna/epidurálna anestézia alebo lumbálna punkcia sa nesmie robiť v priebehu 24 hodín od podania enoxaparínu sodného v terapeutických dávkach (pozri tiež časť 4.3).
Pri súbežnom použití enoxaparínu sodného a spinálnej/epidurálnej anestézie alebo spinálnej punkcii boli hlásené prípady neuraxiálnych hematómov, ktoré mali za následok dlhodobú alebo trvalú paralýzu. Pri dávkovacom režime 4000 IU (40 mg) jedenkrát denne alebo nižšom sú tieto prípady zriedkavé. Riziko je vyššie pri vyšších dávkovacích režimoch enoxaparínu sodného, pri použití pooperačných epidurálnych katétrov, pri súbežnom užívaní ďalších liekov ovplyvňujúcich hemostázu, ako sú nesteroidové protizápalové lieky (NSAID), pri traumatickej alebo opakovanej epidurálnej alebo spinálnej punkcii alebo u pacientov s operáciou chrbtice v anamnéze alebo deformáciou chrbtice v anamnéze.
Pri súbežnom použití enoxaparínu sodného a epidurálnej alebo spinálnej anestézie/analgézie alebo spinálnej punkcii je potrebné na zníženie rizika vzniku krvácania vziať do úvahy farmakokinetický profil enoxaparínu sodného (pozri časť 5.2). Zavedenie a odstraňovanie epidurálneho katétra alebo lumbálnu punkciu je najlepšie robiť vtedy, keď je antikoagulačný účinok enoxaparínu sodného nízky; avšak presný čas, kedy sa dosiahne dostatočne nízky antikoagulačný účinok u konkrétneho pacienta, nie je známy. U pacientov s klírensom kreatinínu 15 -30 ml/minúta je potrebné zvažovať aj ďalšie okolnosti, pretože eliminácia enoxaparínu sodného trvá dlhšie (pozri časť 4.2).
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, je potrebné často monitorovať akékoľvek prejavy a príznaky neurologického poškodenia, ako je bolesť pozdĺž chrbtice, zmyslové a motorické ťažkosti (necitlivosť alebo slabosť dolných končatín), poruchy činnosti hrubého čreva a/alebo močového mechúra. Pacienta je potrebné poučiť, že má ihneď informovať lekára, ak spozoruje niektorý z vyššie uvedených prejavov alebo príznakov. Pri podozrení na prejavy alebo príznaky spinálneho hematómu je potrebná urgentná diagnostika a okamžitá liečba, vrátane zváženia dekompresie miechy, aj keď táto liečba nemusí zabrániť alebo zvrátiť neurologické následky.
•
Nekróza kože/kožná vaskulitídaPri LMWH bola hlásená nekróza kože a kožná vaskulitída, v takých prípadoch treba okamžite liečbu ukončiť.
•
Perkutánne koronárne revaskularizačné výkonyAby sa minimalizovalo riziko krvácania pri cievnych inštrumentálnych výkonoch uskutočňovaných počas liečby nestabilnej anginy pectoris, NSTEMI a akútneho STEMI, dôsledne dodržiavajte intervaly odporúčané medzi dávkami enoxaparínu sodného. Je to dôležité preto, aby sa dosiahla homeostáza v mieste punkcie po PCI. V prípade, že sa použije uzatváracia pomôcka, puzdro cievneho vodiča možno odstrániť okamžite. Ak sa použije metóda manuálnej kompresie, puzdro cievneho vodiča sa má odstrániť po 6 hodinách po poslednej i.v./s.c. injekcii enoxaparínu sodného. Ak má liečba enoxaparínom sodným pokračovať, ďalšia plánovaná dávka enoxaparínu sa má podať najskôr 6-8 hodín po odstránení puzdra. Má sa sledovať, či sa v mieste výkonu nevyskytnú prejavy krvácania alebo hematóm.
•
Akútna infekčná endokarditídaU pacientov s akútnou infekčnou endokarditídou sa používanie heparínu obvykle neodporúča kvôli riziku krvácania do mozgu. Ak sa jeho použitie považuje za absolútne nevyhnutné, rozhodnutie treba urobiť len po starostlivom individuálnom posúdení pomeru prínosu a rizika.
•
Umelá mechanická srdcová chlopňaPoužívanie enoxaparínu sodného u pacientov s umelou mechanickou srdcovou chlopňou za účelom tromboprofylaxie nebolo dostatočne preskúmané. U pacientov s umelou mechanickou srdcovou chlopňou, ktorým bol podávaný enoxaparín sodný za účelom tromboprofylaxie, sa zaznamenali ojedinelé prípady trombózy umelej srdcovej chlopne. Priťažujúce okolnosti, vrátane základných ochorení a nedostatočných klinických údajov, obmedzujú zhodnotenie týchto prípadov. Niektoré z týchto prípadov boli gravidné ženy, u ktorých trombóza spôsobila smrť matky a plodu.
•
Gravidné ženy s umelou mechanickou srdcovou chlopňouPoužívanie enoxaparínu sodného u gravidných žien s umelou mechanickou srdcovou chlopňou za účelom tromboprofylaxie nebolo dostatočne preskúmané. V klinickej štúdii s gravidnými ženami s umelou mechanickou srdcovou chlopňou, kde sa podával enoxaparín sodný v dávke 100 IU/kg (1 mg/kg) dvakrát denne za účelom zníženia rizika tromboembólie, došlo u 2 z 8 žien k tvorbe krvných zrazenín, ktoré zablokovali chlopňu a spôsobili smrť matky a plodu. Po uvedení lieku na trh sa u gravidných žien s umelou mechanickou srdcovou chlopňou, ktorým sa podával profylakticky enoxaparín sodný, zaznamenali ojedinelé prípady chlopňovej trombózy. Gravidné ženy s umelou mechanickou srdcovou chlopňou môžu byť vystavené vyššiemu riziku tromboembólie.
•
Starší ľudiaPri podávaní profylaktických dávok enoxaparínu starším pacientom sa nepozorovala zvýšená tendencia ku krvácaniu. Starší pacienti (hlavne 80-roční a starší) môžu byť pri podávaní terapeutických dávok enoxaparínu vystavení vyššiemu riziku komplikácií s krvácaním. Odporúča sa preto starostlivé klinické sledovanie a u pacientov starších ako 75 rokov liečených na STEMI možno zvážiť zníženie dávky (pozri časti 4.2 a 5.2).
•
Porucha funkcie obličiekPacienti s poruchou funkcie obličiek sú vystavení vyššiemu účinku enoxaparínu sodného, čím sa zvyšuje riziko krvácania. U týchto pacientov sa odporúča starostlivé klinické monitorovanie a možno zvážiť aj biologické monitorovanie meraním anti-Xa aktivity(pozri časti 4.2 a 5.2).
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu 15-30 ml/min ) sú vystavení výrazne vyššiemu účinku enoxaparínu sodného, preto sa odporúča úprava terapeutických a profylaktických dávkovacích režimov (pozri časť 4.2).
Pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a ľahkou (klírens kreatinínu 50- 80 ml/min) poruchou funkcie obličiek nie je nutné upraviť dávku.
•
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene je potrebná opatrnosť pri používaní enoxaparínu sodného kvôli zvýšenému potenciálu krvácania. Úprava dávky na základe monitorovania hladiny anti-Xa nie je spoľahlivá u pacientov s cirhózou pečene a neodporúča sa (pozri časť 5.2).
•
Nízka hmotnosťPacienti s nízkou hmotnosťou (ženy < 45 kg, muži < 57 kg) sú pri profylaktickom dávkovaní enoxaparínu sodného (neupraveného podľa hmotnosti pacienta) vystavení vyššiemu účinku lieku, čo môže viesť k vyššiemu riziku krvácania. Preto sa odporúča starostlivé klinické sledovanie takýchto pacientov (pozri časť 5.2).
•
Obézni pacientiObézni pacienti majú vyššie riziko tromboembolizmu. Bezpečnosť a účinnosť profylaktických dávok u obéznych pacientov (BMI >30 kg/m
2) neboli úplne stanovené a neexistuje konsenzus, pokiaľ ide o úpravu dávok. U týchto pacientov je potrebné starostlivo sledovať prejavy a príznaky tromboembolizmu.
•
HyperkaliémiaHeparíny môžu potláčať sekréciu aldosterónu v nadobličkách, čo spôsobuje hyperkaliémiu (pozri časť 4.8), najmä u pacientov s diabetom mellitus, chronickým zlyhaním obličiek, prítomnou metabolickou acidózou a u pacientov užívajúcich lieky, o ktorých je známe, že zvyšujú hladinu draslíka (pozri časť 4.5). Je potrebné pravidelne monitorovať plazmatické hladiny draslíka, najmä u rizikových pacientov.
•
Sledovateľnosť Nízkomolekulové heparíny (LMWHs) sú biologické lieky. Zdravotníckym pracovníkom sa odporúča zaznamenať názov a číslo šarže podaného lieku do zdravotného záznamu pacienta s cieľom zlepšiť sledovateľnosť LMWHs.
·
Obsah sodíkaTento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. je v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Súbežné používanie sa neodporúča:•
Lieky ovplyvňujúce hemostázu (pozri časť 4.4)Pred začiatkom terapie enoxaparínom sodným sa odporúča prerušiť liečbu niektorými liekmi ovplyvňujúcimi hemostázu, pokiaľ nie sú striktne indikované. Ak je kombinované používanie indikované, je potrebné pri používaní enoxaparínu sodného starostlivé príslušné klinické a laboratórne monitorovanie.
K takýmto liekom patria:
- systémové salicyláty, kyselina acetylsalicylová v protizápalových dávkach a nesteroidové antiflogistiká (NSAID) vrátane ketorolaku,
- iné trombolytiká (napr. altepláza, retepláza, streptokináza, tenektepláza, urokináza) a antikoagulanciá (pozri časť 4.2).
Súbežné používanie sa odporúča s opatrnosťou:Tieto lieky je možné podávať súbežne s enoxaparínom sodným s opatrnosťou:
•
Iné lieky ovplyvňujúce hemostázu, ako sú:- inhibítory zhlukovania krvných doštičiek vrátane kyseliny acetylsalicylovej používanej ako antiagregačný liek (v dávke na kardioprotekciu), klopidogrel, tiklopidín a antagonisty glykoproteínu IIb/IIIa indikované pri akútnom koronárnom syndróme, kvôli riziku krvácania,
- dextran 40,
- systémové glukokortikoidy.
•
Lieky zvyšujúce hladinu draslíka:Lieky zvyšujúce sérovú hladinu draslíka sa môžu podávať súbežne s enoxaparínom sodným pri starostlivom klinickom a laboratórnom monitorovaní (pozri časti 4.4 a 4.8).
4.6 Fertilita, gravidita a laktácia
GraviditaU ľudí nie sú žiadne dôkazy o prechode enoxaparínu placentárnou bariérou v druhom a treťom trimestri gravidity. O prvom trimestri nie sú k dispozícii žiadne informácie.
Štúdie na zvieratách nepreukázali žiadne známky fetálnej toxicity alebo teratogenity (pozri časť 5.3). Údaje získané na zvieratách preukázali, že prechod enoxaparínu cez placentu je minimálny.
Enoxaparín sodný sa má používať počas gravidity, len ak lekár potvrdí jednoznačnú potrebu jeho použitia.
Ženy, ktoré dostávajú enoxaparín sodný počas gravidity, treba starostlivo monitorovať, pokiaľ ide o prejavy krvácania alebo výraznej antikoagulácie, a upozorniť ich na riziko krvácania. Podľa celkových údajov u gravidných žien neexistuje dôkaz zvýšeného rizika krvácania, trombocytopénie alebo osteoporózy v porovnaní s rizikom pozorovaným u žien, ktoré nie sú gravidné, okrem rizika, ktoré sa pozorovalo u gravidných žien s umelou srdcovou chlopňou (pozri časť 4.4).
Ak sa plánuje epidurálna anestézia, odporúča sa predtým ukončiť liečbu enoxaparínom sodným (pozri časť 4.4).
DojčenieNie je známe, či sa nezmenený enoxaparín vylučuje do ľudského mlieka. U laktujúcich potkanov je prechod enoxaparínu alebo jeho metabolitov do mlieka veľmi nízky. Perorálna absorpcia enoxaparínu sodného je nepravdepodobná. Ghemaxan sa môže používať počas dojčenia.
FertilitaNie sú žiadne klinické údaje súvisiace s enoxaparínom sodným týkajúce sa fertility. Štúdie na zvieratách nepreukázali žiadny vplyv na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enoxaparín sodný nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profiluEnoxaparín sodný sa vyhodnocoval u viac ako 15 000 pacientov, ktorí dostávali enoxaparín sodný v klinických skúšaniach vykonaných s referenčným liekom. Z toho 1776 pacientov s rizikom tromboembolických komplikácií dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy po ortopedickej alebo abdominálnej operácii, 1169 pacientov s akútnym interným ochorením s ťažkým obmedzením mobility dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy, 559 pacientov s pľúcnou embóliou alebo bez nej dostávalo enoxaparín na liečbu hlbokej žilovej trombózy, 1578 pacientov na liečbu nestabilnej angíny a non-Q-infarktu myokardu a 10 176 pacientov na liečbu akútneho STEMI.
Režim podávania enoxaparínu sodného v klinickom skúšaní sa menil v závislosti od indikácie. Pri prevencii hlbokej žilovej trombózy po operácii alebo u pacientov s akútnym interným ochorením s ťažkým obmedzením mobility bola dávka enoxaparínu sodného 4 000 IU (40 mg) subkutánne jedenkrát denne. Pri liečbe hlbokej žilovej trombózy (DVT) s pľúcnou embóliou (PE) alebo bez nej dostávali pacienti dávku buď 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín alebo dávku 150 IU/kg (1,5 mg/kg) subkutánne jedenkrát denne. V klinických štúdiách na liečbu nestabilnej angíny a non-Q-infarktu myokardu boli dávky 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín a v klinickej štúdii na liečbu akútneho STEMI sa podával enoxaparín sodný v dávke 3 000 IU (30 mg) intravenózne ako bolus a potom nasledovala dávka 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín.
V klinických štúdiách boli najčastejšími hlásenými reakciami krvácanie, trombocytopénia a trombocytóza (pozri časť 4.4 a „Opis vybraných nežiaducich reakcií“ nižšie).
Zoznam nežiaducich reakcií v tabuľkovom formáteĎalšie nežiaduce reakcie, ktoré sa pozorovali v klinických štúdiách a ktoré boli hlásené po uvedení lieku na trh (* znamená reakcie zo skúseností po uvedení lieku na trh) sú podrobnejšie uvedené nižšie. Frekvencie výskytu sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V rámci každej triedy orgánového systému sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Poruchy krvi a lymfatického systému• časté: krvácanie, hemoragická anémia*, trombocytopénia, trombocytóza
• zriedkavé: eozinofília*
• zriedkavé: prípady imunoalergickej trombocytopénie s trombózou, u niektorých bola trombóza komplikovaná orgánovým infarktom alebo ischémiou končatiny (pozri časť 4.4).
Poruchy imunitného systému• časté: alergická reakcia
• zriedkavé: anafylaktické/anafylaktoidné reakcie vrátane šoku*
Poruchy nervového systému• časté: bolesť hlavy*
Poruchy ciev• zriedkavé: spinálny hematóm* (alebo neuraxiálny hematóm). Tieto reakcie majú za následok rôzne stupne neurologického poškodenia vrátane dlhodobej alebo permanentnej paralýzy (pozri časť 4.4)
Poruchy pečene a žlčových ciest• veľmi časté: zvýšenie pečeňových enzýmov (najmä transamináz > 3-násobok hornej hranice normálu)
• menej časté: hepatocelulárne poškodenie pečene*,
• zriedkavé: cholestatické poškodenie pečene*
Poruchy kože a podkožného tkaniva• časté: urtikária, pruritus, erytém
• menej časté: bulózna dermatitída
• zriedkavé: alopécia*
• zriedkavé: kožná vaskulitída*, kožná nekróza* obvykle sa vyskytuje v mieste vpichu injekcie (predchádza jej zvyčajne purpura alebo erytematózne plaky, infiltrované a bolestivé). Uzlíky v mieste vpichu injekcie * (zapálené uzlíky, ktoré neboli cystickým obalom enoxaparínu). Vymiznú v priebehu niekoľkých dní a nie je potrebné kvôli tomu ukončiť liečbu.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva• zriedkavé: osteoporóza* po dlhodobej liečbe (viac ako 3 mesiace).
Celkové poruchy a reakcie v mieste podania• časté: hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, iné reakcie v mieste vpichu injekcie (ako je opuch, krvácanie, hypersenzitivita, zápal, zhrubnutie, bolesť alebo reakcia)
• menej časté: lokálne podráždenie, kožná nekróza v mieste vpichu injekcie
Laboratórne a funkčné vyšetrenia• zriedkavé: hyperkaliémia*(pozri časti 4.4 a 4.5)
Opis vybraných nežiaducich reakciíKrvácaniePatrilo sem veľké krvácanie, zaznamenalo sa u viac ako 4,2 % pacientov (chirurgickí pacienti). Niektoré z týchto prípadov boli fatálne. U chirurgických pacientov sa za veľké krvácanie považovalo (1) to, ktoré spôsobilo závažnú klinickú udalosť, alebo (2) to, pri ktorom bol pokles hemoglobínu ≥ 2 g/dl alebo ktoré si vyžiadalo transfúziu 2 alebo viac jednotiek krvných prípravkov. Retroperitoneálne a intrakraniálne krvácanie za vždy považovalo za veľké.
Podobne ako pri podávaní iných antikoagulancií, sa môže v prítomnosti pridružených rizikových faktorov, ako sú organické poškodenia s tendenciou ku krvácaniu, invazívne zákroky alebo súbežné používanie liekov ovplyvňujúcich hemostázu, vyskytnúť krvácanie (pozri časti 4.4 a 4.5).
Trieda orgánového systému
| Prevencia
u chirurgických pacientov
| Prevencia u interných pacientov
| Liečba pacientov s DVT s PE alebo bez nej
| Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
| Liečba pacientov s akútnym STEMI
|
Poruchy krvi a lymfatického systému
| veľmi časté:
krvácanie*
zriedkavé: retroperitoneálne krvácanie
| časté:
krvácanie*
| veľmi časté:
krvácanie*
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
| časté:
krvácanie*
zriedkavé: retroperitoneálne krvácanie
| časté:
krvácanie*
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
|
*: napríklad: hematóm, ekchymóza iná ako v mieste vpichu injekcie, hematóm v rane, hematúria, epistaxa a gastrointestinálne krvácanie.
Trombocytopénia a trombocytózaTrieda orgánového systému
| Prevencia
u chirurgických pacientov
| Prevencia u interných pacientov
| Liečba pacientov s DVT s PE alebo bez nej
| Liečba pacientov s nestabilnou angínou a non-Q infarktom
myokardu
| Liečba pacientov s akútnym STEMI
|
Poruchy krvi a lymfatického systému
| veľmi časté:
trombocytóza*
časté:
trombocyto-pénia
| menej časté:
trombocyto-pénia
| veľmi časté:
trombocytóza*
časté:
trombocytopénia
| menej časté:
trombocytopénia
| časté: trombocytóza*trombocytopéniaveľmi zriedkavé: imuno-alergická trombocytopénia
|
*: zvýšenie počtu krvných doštičiek > 400 g/l
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie
Prejavy a príznakyNáhodné predávkovanie enoxaparínom sodným po intravenóznom, mimotelovom alebo subkutánnom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok, nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín sodný podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na 100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu sodného nemusí byť podanie protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antitrombotiká, heparíny, ATC kód: B01AB05
Farmakodynamické účinkyEnoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne 4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V
in vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu sodného.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosť a bezpečnosťPrevencia venóznej tromboembolickej choroby spojená s operáciou• Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu, 179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali subkutánne 4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo (n=89) na 3 týždne. Výskyt DVT počas predĺženej profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie.
Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
| enoxaparín sodný 4 000 IU (40 mg)
jedenkrát denne s.c. n (%)
|
placebo jedenkrát denne s.c.
n (%)
|
Všetci pacienti liečení predĺženou profylaxiou
| 90 (100)
| 89 (100)
|
celkovo VTE
| 6 (6,6)
| 18 (20,2)
|
• celkovo DVT (%)
| 6 (6,6)*
| 18 (20,2)
|
• proximálna DVT (%)
| 5 (5,6)#
| 7 (8,8)
|
*p-hodnota oproti placebu =0,008
#p-hodnota oproti placebu =0,537
|
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochorenia podstupujúcich operáciu s náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, bolo randomizovaných po prepustení buď na enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45 [34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %]; p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
• Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 25. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas 4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa očakáva obmedzenie mobilityV dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný 2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤ 3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronickou respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou, ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥ 75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg) jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
| enoxaparín sodný 2 000 IU (20 mg)
jedenkrát denne s.c. n (%)
| enoxaparín sodný 4 000 IU (40 mg)
jedenkrát denne s.c. n (%)
| placebo n (%)
|
všetci liečení interní pacienti počas akútneho ochorenia
| 287 (100)
| 291(100)
| 288 (100)
|
celkovo VTE (%)
| 43 (15,0)
| 16 (5,5)*
| 43 (14,9)
|
• celkovo DVT (%)
| 43 (15,0)
| 16 (5,5)
| 40 (13,9)
|
• proximálna DVT (%)
| 13 (4,5)
| 5 (1,7)
| 14 (4,9)
|
VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
*p-hodnota oproti placebu = 0,0002
|
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom. Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 % a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nejV multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide'
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
| enoxaparín sodný 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
| enoxaparín sodný 100 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
| heparín
i.v. liečba upravovaná podľa
aPTT
n (%)
|
všetci liečení pacienti s DVT, pacienti s PE alebo bez nej
| 298 (100)
| 312 (100)
| 290 (100)
|
celkovo VTE (%)
| 13 (4,4)*
| 9 (2,9)*
| 12 (4,1)
|
• iba DVT (%)
| 11 (3,7)
| 7 (2,2)
| 8 (2,8)
|
• proximálna DVT (%)
| 9 (3,0)
| 6 (1,9)
| 7 (2,4)
|
• PE (%)
| 2 (0,7)
| 2 (0,6)
| 4 (1,4)
|
VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovo pre VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
|
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie STV rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej fáze nestabilnej anginy pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď
s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne významné rozdiely, aj keď krvácanie v mieste podania s.c. injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentuV rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke
100 IU/kg (1,0 mg/kg) a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu 48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní. Stratégia dávkovania enoxaparínu sodného bola prispôsobená pre pacientov so závažne zhoršenou funkciou obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sodného sa podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom sodným musela byť vykonaná PCI s enoxaparínom sodným (žiadna zmena), pričom bol použitý režim stanovený v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu sodného, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom významne znížil výskyt primárneho koncového ukazovateľa - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom sodným v porovnaní s 12,0 percentami v skupine s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p< 0,001).
Prínos liečby enoxaparínom sodným, zjavný vo viacerých ukazovateľoch účinnosti, sa objavil už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Prínos enoxaparínu sodného v primárnom koncovom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu, typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa významný prínos liečby enoxaparínom sodným v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení farmakologicky (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného koncového ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemorágie na 30.deň (merané ako čistý klinický prínos) bol významne nižší (p<0,0001) v skupine s enoxaparínom sodným (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol významne vyšší (p<0,0001) v skupine s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt
gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu sodného na primárny koncový ukazovateľ pozorovaný počas prvých 30 dní sa zachoval počas 12 mesiacov sledovania.
Porucha funkcie pečenePodľa literárnych údajov sa používanie enoxaparínu sodného v dávke 4 000 IU (40 mg) u pacientov s cirhózou (Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou funkcie pečene je potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov s cirhózou (Child-Pugh trieda A,B,C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky neuskutočnili.
Ghemaxan je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Štátneho ústavu pre kontrolu liečiv.
5.2 Farmakokinetické vlastnosti
Všeobecná charakteristikaFarmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom intravenóznom podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa vykonalo validovanými amidolytickými metódami.
AbsorpciaAbsolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity je približne 100 %.
Môžu sa použiť rôzne dávky, liekové formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej injekcii a dosahuje približne 0,2, 0,4, 1,0 a 1,3 ani-Xa IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU, 100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti-Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave.
Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2. deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní dávky 100 IU/kg (1 mg/kg) dvakrát denne sa ustálený stav dosiahne od 3. po 4. deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu aktivity anti-Xa 1,2 IU/ml a minimálnu hodnotu aktivity anti-Xa 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu sodného po podaní dávok vyšších ako sú odporúčané dávky je lineárna. Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c. podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg (1 mg/kg) dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg (1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
DistribúciaDistribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
BiotransformáciaEnoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
ElimináciaEnoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného.
Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Osobitné skupiny pacientovStarší ľudiaNa základe výsledkov populačnej farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši.
Avšak je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečeneV štúdii, ktorá sa vykonala u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený so vzostupom závažnosti poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiekMedzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU (40 mg) raz denne je expozícia anti-Xa aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU (40 mg) raz denne, významne zvýšená, priemerne o 65 % (pozri časti 4.2 a 4.4).
HemodialýzaPo jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50 alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosťPo opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI 30-48 kg/m
2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (40 mg) (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetické interakciePri súbežnom podaní enoxaparínu sodného a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu sodného okrem antikoagulačného účinku nedokázali.
Nasledujúce
in vitro testy nepreukázali mutagénne účinky enoxaparínu sodného: Amesov test, progresívny mutačný test na bunkách myšacích lymfómov, humánny lymfocytový test chromozomálnych aberácií
in-vitro a
in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov so s.c. dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako 20 mg/kg/deň nemal enoxaparín sodný vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látokvoda na injekcie
6.2 Inkompatibility
Subkutánna injekciaNemiešajte s inými liekmi.
Intravenózna injekcia (bolus) (len pre indikáciu akútny STEMI):Enoxaparín sodný sa môže bezpečne podávať s fyziologickým roztokom (0,9 %) alebo 5 %-ným vodným roztokom dextrózy (pozri časť 4.2).
6.3 Čas použiteľnosti
36 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v mrazničke.
Tento liek je určený iba na jednorazové použitie. Nepoužitý liek zlikvidujte.
6.5 Druh obalu a obsah balenia
Injekčný roztok v 0,5 ml alebo 1 ml naplnenej injekčnej striekačke zo skla typu I so vsadenou ihlou a chráničom ihly (syntetická polyizoprénová guma), ktorá je uzatvorená elastomérovou piestovou zátkou (chlórbutylovou gumou) a piestovou tyčinkou. Injekčný roztok je dostupný v dvoch rôznych baleniach:
1. Injekčná striekačka s chráničom ihly, ktorý kryje ihlu po podaní injekcieGhemaxan 2 000 IU (20 mg)/0,2 ml injekčný roztok naplnený v
injekčných striekačkách:
balenia po 2, 6 alebo 10 naplnených injekčných striekačkách a multibalenia obsahujúce 12 (2 balenia po 6), 20 (2 balenia po 10), 24 (4 balenia po 6), 30 (3 balenia po 10), 50 (5 balení po 10) a 90 (9 balení po 10) naplnených injekčných striekačiek
Ghemaxan 4 000 IU (40 mg)/0,4 ml
injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 naplnených injekčných striekačkách a multibalenia obsahujúce 12 (2 balenia po 6), 20 (2 balenia po 10), 24 (4 balenia po 6), 30 (3 balenia po 10), 50 (5 balení po 10) a 90 (9 balení po 10) naplnených injekčných striekačiek
Ghemaxan 6 000 IU (60 mg)/0,6 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 kalibrovaných naplnených injekčných striekačkách a multibalenia obsahujúce 12 (2 balenia po 6), 20 (2 balenia po 10), 24 (4 balenia po 6), 30 (3 balenia po 10), 50 (5 balení po 10) a 90 (9 balení po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 8 000 IU (80 mg)/0,8 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 kalibrovaných naplnených injekčných striekačkách a multibalenia obsahujúce 12 (2 balenia po 6), 20 (2 balenia po 10), 24 (4 balenia po 6), 30 (3 balenia po 10), 50 (5 balení po 10) a 90 (9 balení po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 10 000 IU (100 mg)/1 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 kalibrovaných naplnených injekčných striekačkách a multibalenia obsahujúce 12 (2 balenia po 6), 20 (2 balenia po 10), 24 (4 balenia po 6), 30 (3 balenia po 10), 50 (5 balení po 10) a 90 (9 balení po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 12 000 IU (120 mg)/0,8 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 kalibrovaných naplnených injekčných striekačkách a multibalenia obsahujúce 30 (3 balenia po 10) a 50 (5 balení po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 15 000 IU (150 mg)/1 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2, 6 alebo 10 kalibrovaných naplnených injekčných striekačkách a multibalenia obsahujúce 30 (3 balenia po 10) a 50 (5 balení po 10) kalibrovaných naplnených injekčných striekačiek
2. Injekčná striekačka bez chrániča ihly, ktorý kryje ihlu po podaní injekcieGhemaxan 2 000 IU (20 mg)/0,2 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2 a 10 naplnených injekčných striekačkách
Ghemaxan 4 000 IU (40 mg)/0,4 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2 a 10 naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) naplnených injekčných striekačiek
Ghemaxan 6 000 IU (60 mg)/0,6 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2 a 10 kalibrovaných naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 8 000 IU (80 mg)/0,8 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2 a 10 kalibrovaných naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 10 000 IU (100 mg)/1 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 2 a 10 kalibrovaných naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 12 000 IU (120 mg)/0,8 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 10 kalibrovaných naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) kalibrovaných naplnených injekčných striekačiek
Ghemaxan 15 000 IU (150 mg)/1 ml injekčný roztok naplnený v injekčných striekačkách:
balenia po 10 kalibrovaných naplnených injekčných striekačkách a multibalenie obsahujúce 30 (3 balenia po 10) kalibrovaných naplnených injekčných striekačiek
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Naplnená injekčná striekačka je pripravená na okamžité použitie (pozri časť 4.2).
Na intravenóznu injekciu môže byť liek zriedený vo fyziologickom roztoku (0,9 %) alebo v 5 % vodnom roztoku dextrózy.
Pre použitím roztok vizuálne skontrolujte. Nesmie sa použiť, ak sa akýmkoľvek spôsobom zmení jeho vzhľad.
Ghemaxan naplnené injekčné striekačky sú určené iba na podanie jednej dávky; zlikvidujte všetok nepoužitý liek.
Naplnené injekčné striekačky sa dodávajú s chráničom ihly alebo bez neho, ktorý kryje ihlu po podaní injekcie. Pokyny na použitie sú uvedené v písomnej informácii pre používateľa.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
POKYNY NA POUŽITIE: NAPLNENÁ INJEKČNÁ STRIEKAČKAAko si sám podať injekciu GhemaxanuAk si dokážete sám podať Ghemaxan, váš lekár alebo zdravotná sestra vám ukáže, ako to urobiť. Nepokúšajte sa sám si podať injekciu, ak ste neboli zaškolený, ako to urobiť. Ak si nie ste istý, čo máte robiť, ihneď sa opýtajte svojho lekára alebo zdravotnej sestry.
Predtým, ako si sám podáte injekciu Ghemaxanu· Skontrolujte dátum exspirácie na lieku. Nepoužite ho, ak je už po tomto dátume.
· Skontrolujte injekčnú striekačku, či nie je poškodená, a či liek v nej je číry roztok. Ak nie, použite inú injekčnú striekačku.
· Nepoužívajte tento liek, ak spozorujete akékoľvek zmeny vzhľadu lieku.
· Uistite sa, že viete, koľko lieku si máte injekčne podať.
· Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmeny farby kože, opuch, mokvanie alebo či ešte stále nie je bolestivé. Ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
· Rozhodnite sa, kam budete injekciu lieku podávať. Pri každom podávaní lieku zmeňte miesto z pravej na ľavú stranu brucha. Ghemaxan sa má injekčne podať tesne pod kožu vášho brucha, ale nie príliš blízko pupku či nejakej jazvy (minimálne 5 cm od nich).
Naplnená injekčná striekačka je určená iba na jednorazové použitie a je dostupná v nasledujúcich baleniach:
- s chráničom ihly, ktorý kryje ihlu po podaní injekcie
- bez chrániča ihly, ktorý kryje ihlu po podaní injekcie
Pokyny ako si sám podať injekciu Ghemaxanu:Máte ležať a Ghemaxan si podať hlbokou subkutánnou injekciou. Podávanie sa má striedať medzi ľavou a pravou anterolaterálnou stranou a ľavou a pravou posterolaterálnou abdominálnou stenou. Do kožného záhybu vytvoreného medzi palcom a ukazovákom sa má zaviesť celá dĺžka ihly; kožný záhyb sa má držať po celú dobu injekcie. Po podaní injekcie miesto nemasírujte, aby sa minimalizovala tvorba modrín.
Ghemaxan naplnené injekčné striekačky a kalibrované naplnené injekčné striekačky sú určené iba na jednorazové použitie. Injekčné striekačky môžu byť vybavené chráničom ihly, ktorý kryje ihlu po podaní injekcie; pokyny na použitie injekčných striekačiek s týmto systémom sú uvedené nižšie.
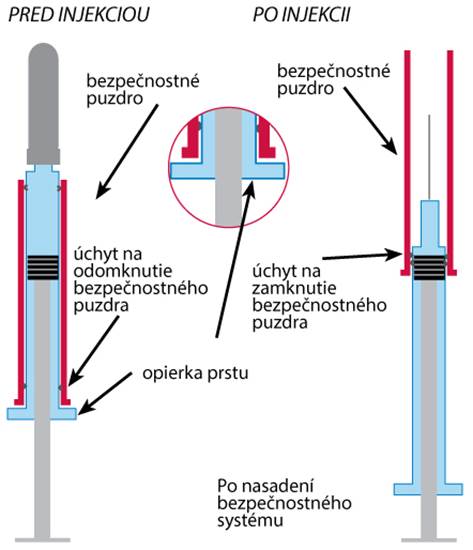
Bezpečnostné puzdro má úchyt na odomknutie a uzamknutie systému.
Naplnenú injekčnú striekačku vyberte z blistrového obalu odlúpnutím v mieste šípky, ako je uvedené na blistri. Nevyberajte ju ťahaním za piest, keďže to môže spôsobiť poškodenie injekčnej striekačky.
POKYNY NA POUŽITE: BEZPEČNOSTNÉ ZARIADENIETento blister obsahuje naplnenú injekčnú striekačku Ghemaxanus bezpečnostným chráničom ihly, ktorý kryje ihlu po podaní injekcie
|
|
|
|
Nasadenie bezpečnostného systému na injekčnú striekačku Ghemaxanu po podaní injekcie
V jednej ruke držte pevne valec injekčnej striekačky. V druhej ruke držte spodnú časť, „krídla“, injekčnej striekačky a ťahajte, až kým nebudete počuť zvuk kliknutia. Teraz je použitá ihla úplne chránená.
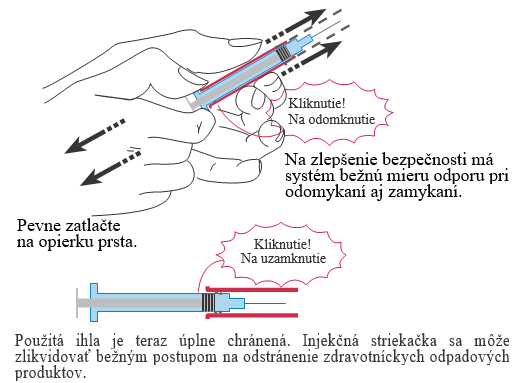
|
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Chemi S.p.A.
Via dei Lavoratori, 54
20092 Cinisello Balsamo (MI)
Taliansko
8. REGISTRAČNÉ ČÍSLA
Ghemaxan 2 000 IU (20 mg)/0,2 ml injekčný roztok naplnený v injekčnej striekačke: 16/0170/20-S
Ghemaxan 4 000 IU (40 mg)/0,4 ml injekčný roztok naplnený v injekčnej striekačke: 16/0171/20-S
Ghemaxan 6 000 IU (60 mg)/0,6 ml injekčný roztok naplnený v injekčnej striekačke: 16/0172/20-S
Ghemaxan 8 000 IU (80 mg)/0,8 ml injekčný roztok naplnený v injekčnej striekačke: 16/0173/20-S
Ghemaxan 10 000 IU (100 mg)/1 ml injekčný roztok naplnený v injekčnej striekačke: 16/0174/20-S
Ghemaxan 12 000 IU (120 mg)/0,8 ml injekčný roztok naplnený v injekčnej striekačke: 16/0175/20-S
Ghemaxan 15 000 IU (150 mg)/1 ml injekčný roztok naplnený v injekčnej striekačke: 16/0176/20-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
07/2020