
pre matku sa musí prijať rozhodnutie o tom, či sa má prerušiť dojčenie alebo liečba liekom Galafold.
Fertilita
Účinky lieku Galafold na fertilitu u ľudí sa neskúmali. Prechodná, ale úplne reverzibilná neplodnosť u potkaních samcov súvisela s liečbou migalastátom vo všetkých hodnotených dávkach. Úplná reverzibilita sa pozorovala po štyroch týždňoch od vysadenia dávok. Podobné zistenia sa zaznamenali predklinicky po liečbe inými iminocukrami (pozri časť 5.3). Liek Galafold neovplyvnil fertilitu
u potkaních samíc.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Galafold nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Najčastejšou nežiaducou reakciou bola bolesť hlavy, ktorá sa vyskytla približne u 10 % pacientov užívajúcich liek Galafold.
Tabuľkovýzoznamnežiaducichreakcií
Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až <1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (nemožno ich odhadnúť z dostupných údajov). V rámci každej skupiny frekvencie sú nežiaduce reakcie uvedené
v každej triede orgánových systémov v poradí klesajúcej frekvencie.
Tabuľka 1: Nežiaduce reakcie na liek Galafold hlásené v klinických skúšaniach
T
rieda orgánových systémov
V
eľmi časté Časté
Psychické poruchy depresia parestézia
Poruchy nervového systému bolesť hlavy
závraty
hypoestézia
Poruchy ucha a labyrintu vertigo
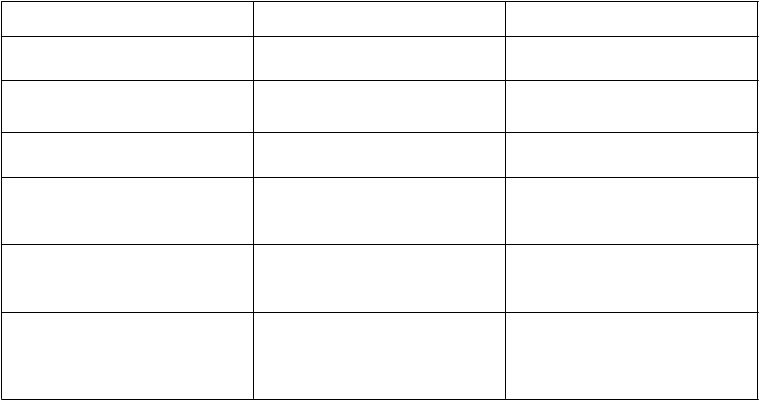
Poruchy srdca a srdcovej
činnosti
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
palpitácie
dyspnoe epistaxa
hnačka
nauzea
bolesť brucha
zápcha
sucho v ústach
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
nutkanie na stolicu dyspepsia
vyrážka pruritus
svalové kŕče myalgia tortikolis
Poruchy obličiek a močových
ciest
proteinúria
Celkové poruchy a reakcie
v mieste podania
únava
Laboratórne a funkčné
vyšetrenia
zvýšená hladina
kreatínfosfokinázy v krvi
zvýšená telesná hmotnosť
 H
l
ásenie podozrení na nežiaduce reakcie
H
l
ásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
prílohe V.4.9 PredávkovanieV prípade predávkovania sa odporúča všeobecná zdravotná starostlivosť. Najčastejšie nežiaduce reakcie hlásené pri užívaní lieku Galafold v dávkach do 1 250 mg a 2 000 mg boli bolesť hlavy, závraty, v uvedenom poradí.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: {zatiaľ nepridelená}, ATC kód: {zatiaľ nepridelený}
Fabryho choroba je progresívna porucha lyzozomálnej akumulácie viazaná na chromozóm X, ktorá postihuje mužov aj ženy. Mutácie v géne
GLA zapríčinené Fabryho chorobou vedú k nedostatku lyzozomálneho enzýmu α-galaktozidázy A (α-Gal A), ktorý je potrebný pre metabolizmus glykosfingolipidového substrátu (napr. GL-3, lyzo-Gb3 ). Znížená aktivita α-Gal A je preto spojená s progresívnou akumuláciou substrátu v citlivých orgánoch a tkanivách, čo vedie k morbidite
a mortalite spojenej s Fabryho chorobou.
Mechanizmus účinkuUrčité mutácie
GLA môžu viesť k vytváraniu abnormálne zvinutých a nestabilných mutantných foriem
α-Gal A. Migalastát je farmakologický šaperón, ktorý je vytvorený tak, že sa selektívne a reverzibilne viaže s vysokou afinitou na aktívne miesta určitých mutantných foriem α-Gal A, ktorých genotypy sa nazývajú senzibilné mutácie. Naviazanie migalastátu stabilizuje tieto mutantné formy α-Gal A
v endoplazmatickom retikule a uľahčuje ich náležitú migráciu do lyzozómov, v ktorých disociácia migalastátu obnovuje aktivitu α-Gal A, čo vedie ku katabolizmu GL-3 a súvisiacich substrátov.
Mutácie
GLA senzibilné a nesenzibilné voči liečbe liekom Galafold sú uvedené ďalej v tabuľke 2
a v tabuľke 3. Mutácie
GLA sú k dispozícii aj poskytovateľom zdravotnej starostlivosti na
adrese
www.galafoldamenabilitytable.com:Tabuľka 2: Tabuľka senzibility lieku Galafold (migalastát)Zmena nukleotidov Zmena nukleotidov Zmena sekvencie proteínovc.8 T>C c.T8C L3P c.37 G>A c.G37A A13T c.37 G>C c.G37C A13P c.43 G>A c.G43A A15T c.44 C>G c.C44G A15G c.58 G>C c.G58C A20P c.59 C>A c.C59A A20D c.70 T>C c.T70C W24R c.70 T>G c.T70G W24G c.72 G>C c.G72C W24C c.95 T>C c.T95C L32P c.97 G>T c.G97T D33Y c.98 A>G c.A98G D33G c.101 A>G c.A101G N34S c.102 T>G c.T102G N34K c.103 G>C c.G103C G35R c.107 T>C c.T107C L36S c.107 T>G c.T107G L36W c.108 G>C c.G108C L36F c.109 G>A c.G109A A37T c.110 C>T c.C110T A37V c.122 C>T c.C122T T41I c.124 A>C c.A124C M42L c.124 A>G c.A124G M42V c.125 T>A c.T125A M42K c.125 T>C c.T125C M42T c.125 T>G c.T125G M42R c.137 A>C c.A137C H46P c.142 G>C c.G142C E48Q c.152 T>A c.T152A M51K c.153 G>A c.G153A M51I c.157 A>G c.A157G N53D
c.[157 A>C; 158 A>T] c. A157C/A158T N53L
c.160 C>T c.C160T L54F c.161 T>C c.T161C L54P c.164 A>T c.A164T D55V
c.[164 A>T; 170 A>T] c.A164T/A170T D55V/Q57L
c.167 G>T c.G167T C56F c.167 G>A c.G167A C56Y c.170 A>T c.A170T Q57L c.175 G>A c.G175A E59K c.178 C>A c.C178A P60T c.178 C>T c.C178T P60S c.179 C>T c.C179T P60L c.196 G>A c.G196A E66K c.197 A>G c.A197G E66G c.214 A>G c.A214G M72V
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.216 G>A c.G216A M72I c.218 C>T c.C218T A73V c.227 T>C c.T227C M76T c.247 G>A c.G247A D83N c.253 G>A c.G253A G85S c.254 G>A c.G254A G85D
c.[253 G>A; 254 G>T; 255 T>G] c. G253A/G254T/T255G G85M
c.265 C>T c.C265T L89F c.272 T>C c.T272C I91T c.288 G>A c.G288A M96I c.289 G>C c.G289C A97P c.290 C>T c.C290T A97V c.305 C>T c.C305T S102L c.311G>T c.G311T G104V c.322 G>A c.G322A A108T c.326 A>G c.A326G D109G c.334 C>G c.C334G R112G c.335 G>A c.G335A R112H c.337 T>C c.T337C F113L c.352 C>T c.C352T R118C c.361 G>A c.G361A A121T c.368 A>G c.A368G Y123C c. 374 A>T c.A374T H125L c.376 A>G c.A376G S126G c.383 G>A c.G383A G128E c.404 C>T c.C404T A135V c.408 T>A c.T408A D136E c.416 A>G c.A416G N139S c.419 A>C c.A419C K140T c.427 G>A c.G427A A143T c.431 G>A c.G431A G144D c.431 G>T c.G431T G144V c.436 C>T c.C436T P146S c.455 A>G c.A455G Y152C c.466 G>A c.G466A A156T c.467 C>T c.C467T A156V c.484 T>G c.T484G W162G c.493 G>C c.G493C D165H c.494 A>G c.A494G D165G
c.[496 C>G; 497 T>G] c. C496G/T497G L166G c.496 C>G c.C496G L166V c.506 T>C c.T506C F169S c.520 T>C c.T520C C174R c.520 T>G c.T520G C174G c.525 C>G c.C525G D175E c.548 G>C c.G548C G183A c.548 G>A c.G548A G183D c.550 T>A c.T550A Y184N c.551A>G c.A551G Y184C c.553 A>G c.A553G K185E
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.559 A>G c.A559G M187V c.560 T>C c.T560C M187T c.561 G>T c.G561T M187I
c.559_564 dup c.559_564dup p. M187_S188 dup c.572 T>A c.T572A L191Q
c.581 C>T c.C581T T194I c.584 G>T c.G584T G195V c.593 T>C c.T593C I198T c.595 G>A c.G595A V199M c.596 T>G c.T596G V199G c.599 A>G c.A599G Y200C c.602 C>T c.C602T S201F c.602 C>A c.C602A S201Y c.608 A>T c.A608T E203V c.609 G>C c.G609C E203D c.613 C>A c.C613A P205T c.613 C>T c.C613T P205S c.614 C>T c.C614T P205L c.619 T>C c.T619C Y207H c.620 A>C c.A620C Y207S c.628 C>T c.C628T P210S c.629 C>T c.C629T P210L c.638 A>T c.A638T K213M c.640 C>T c.C640T P214S c.641 C>T c.641T P214L c.643 A>G c.A643G N215D c.644 A>G c.A644G N215S
c.[644 A>G; 937 G>T] c. A644G/G937T N215S/D313Y c.646 T>G c.T646G Y216D c.647 A>G c.A647G Y216C c.656 T>A c.T656A I219N c.656 T>C c.T656C I219T c.659 G>A c.G659A R220Q c.659 G>C c.G659C R220P c.671 A>G c.A671G N224S c.673 C>G c.C673G H225D c.683 A>G c.A683G N228S c.687 T>A c.T687A F229L c.695 T>C c.T695C I232T c.713 G>A c.G713A S238N c.716 T>C c.T716C I239T c.724 A>T c.A724T I242F c.725 T>A c.T725A I242N c.729 G>C c.G729C L243F c.728 T>G c.T728G L243W c.730 G>A c.G730A D244N c.730 G>C c.G730C D244H c.735 T>G c.T735G W245G c.740 C>G c.C740G S247C c.747 C>G c.C747G N249K
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.749 A>C c.A749C Q250P c.758 T>C c.T758C I253T c.758 T>G c.T758G I253S
c.760-762del GTT c.760_762delGTT p.V254del c.769 G>C c.G769C A257P c.770 C>G c.C770G A257G c.772 G>C c.G772C G258R c.773 G>T c.G773T G258V c.776 C>G c.C776G P259R c.776 C>T c.C776T P259L c.779 G>A c.G779A G260E c.779 G>C c.G779C G260A c.788 A>G c.A788G N263S c.790 G>T c.G790T D264Y c.794 C>T c.C794T P265L c.800 T>C c.T800C M267T c.805 G>A c.G805A V269M c.806 T>C c.T806C V269A c.809 T>C c.T809C I270T c.811 G>A c.G811A G271S
c.[811 G>A; 937 G>T] c. G811A/G937T G271S/D313Y
c.812 G>A c. G812A G271D c.827 G>A c.G827A S276N c.829 T>G c.T829G W277G c.831 G>T c.G831T W277C c.835 C>G c.C835G Q279E c.838 C>A c.C838A Q280K c.840 A>T c.A840T Q280H c.844 A>G c.A844G T282A c.845 C>T c.C845T T282I c.850 A>G c.A850G M284V c.851 T>C c.T851C M284T c.862 G>C c.G862C A288P c.866 T>G c.T866G I289S c.868 A>C c.A868C M290L c.870 G>A c.G870A M290I c.871 G>A c.G871A A291T c.877 C>A c.C877A P293T c.881 T>C c.T881C L294S c.884 T>G c.T884G F295C c.886 A>G c.A886G M296V c.886 A>T c.A886T M296L c.887 T>C c.T887C M296T c.888 G>A c.G888A M296I c.893 A>G c.A893G N298S c.897 C>G c.C897G D299E c.898 C>T c.C898T L300F c.899 T>C c.T899C L300P c.901 C>G c.C901G R301G c.902 G>C c.G902C R301P
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.902 G>A c.G902A R301Q c.902 G>T c.G902T R301L c.908 T>A c.T908A I303N c.911 G>A c.G911A S304N c.911 G>C c.G911C S304T c.919 G>A c.G919A A307T c.924 A>T c.A924T K308N c.925 G>C c.G925C A309P c.928 C>T c.C928T L310F c.931 C>G c.C931G L311V c.935 A>G c.A935G Q312R c.936 G>T c.G936T Q312H c.937 G>T c.G937T D313Y c.938 A>G c.A938G D313G c.946 G>A c.G946A V316I c.947 T>G c.T947G V316G c.950 T>C c.T950C I317T c.955 A>T c.A955T I319F c.956 T>C c.T956C I319T c.959 A>T c.A959T N320I c.962 A>G c.A962G Q321R c.962 A>T c.A962T Q321L c.963 G>C c.G963C Q321H c.964 G>C c.G964C D322N c.966 C>A c.C966A D322E c.973 G>A c.G973A G325S c.973 G>C c.G973C G325R c.979 C>G c.C979G Q327E c.983 G>C c.G983C G328A c.1001 G>A c.G1001A G334E c.1012 G>A c.G1012A E338K c.1016 T>A c.T1016A V339E c.1028 C>T c.C1028T P343L c.1033 T>C c.T1033C S345P c.1046 G>C c.G1046C W349S c.1055 C>T c.C1055T A352V c.1061 T>A c.T1061A I354K c.1066 C>G c.C1066G R356G c.1066 C>T c.C1066T R356W c.1067G>A c.G1067A R356Q c.1067G>C c.G1067C R356P c.1073 A>C c.A1073C E358A c.1073 A>G c.A1073G E358G c.1074 G>T c.G1074T E358D c.1076 T>C c.T1076C I359T c.1078 G>A c.G1078A G360S c.1078 G>T c.G1078T G360C c.1079 G>A c.G1079A G360D c.1082 G>A c.G1082A G361E c.1082 G>C c.G1082C G361A
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov

c.1084 C>A c.C1084A P362T c.1085 C>T c.C1085T P362L c.1087 C>T c.C1087T R363C c.1088 G>A c.G1088A R363H c.1102 G>A c.G1102A A368T c.1117 G>A c.G1117A G373S c.1153 A>G c.A1153G T385A c.1172 A>C c.A1172C K391T c.1184 G>A c.G1184A G395E c.1184 G>C c.G1184C G395A c.1192 G>A c.G1192A E398K
c.1202 Ins GACTTC c.1202Ins GACTTC p. T400_S401dup c.1208 T>C c.T1208C L403S c.1225 C>G c.C1225G P409A c.1225 C>T c.C1225T P409S c.1225 C>A c.C1225A P409T c.1228 A>G c.A1228G T410A c.1229 C>T c.C1229T T410I c.1232 G>A c.G1232A G411D c.1235 C>A c.C1235A T412N c.1253 A>G c.A1253G E418G c.1261 A>G c.A1261G M421V
Keď je na rovnakom chromozóme (u mužov aj žien) prítomná dvojitá mutácia, pacient je senzibilný,
ak je dvojitá mutácia prítomná v jednom údaji v tabuľke 2 (napr. D55V/Q57L). Keď je dvojitá mutácia prítomná na rôznych chromozómoch (len u žien), pacient je senzibilný, ak je prítomná jedna z ktorýchkoľvek mutácií uvedených v tabuľke 2.
Mutácie, ktoré nie sú senzibilné voči liečbe liekom Galafold, sú uvedené ďalej v tabuľke 3:
Tabuľka 3: Mutácie nesenzibilné voči lieku Galafold (migalastát)Zmena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.1 A>C c.A1C M1L c.1 A>G c.A1G M1V c.2 T>G c.T2G M1R c.2 T>C c.T2C M1T c.2 T>A c.T2A M1K c.3 G>A c.G3A M1I c.19 G>T c.G19T E7X c.41 T>C c.T41C L14P c.43 G>C c.G43C A15P c.47 T>A c.T47A L16H c.47 T>C c.T47C L16P c.53 T>C c.T53C F18S c.56 T>A c.T56A L19Q c.56 T>C c.T56C L19P
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.59 C>T c.C59T A20V c.61C>T c.C61T L21F c.62 T>C c.T62C L21P c.62 T>G c.T62G L21R c.71 G>A c.G71A W24X c.92 C>T c.C92T A31V c.118 C>G c.C118G P40A c.118 C>T c.C118T P40S c.119 C>A c.C119A P40H c.119 C>G c.C119G P40R c.119 C>T c.C119T P40L c.127 G>C c.G127C G43R c.127 G>A c.G127A G43S c.128 G>A c.G128A G43D c.128 G>T c.G128T G43V c.131 G>A c.G131A W44X c.132 G>T c.G132T W44C c.134 T>C c.T134C L45P c.134 T>G c.T134G L45R
c.134_138delTGCACinsGCT
CG
c.134_138delTGCACinsGCT
CG L45R/H46S
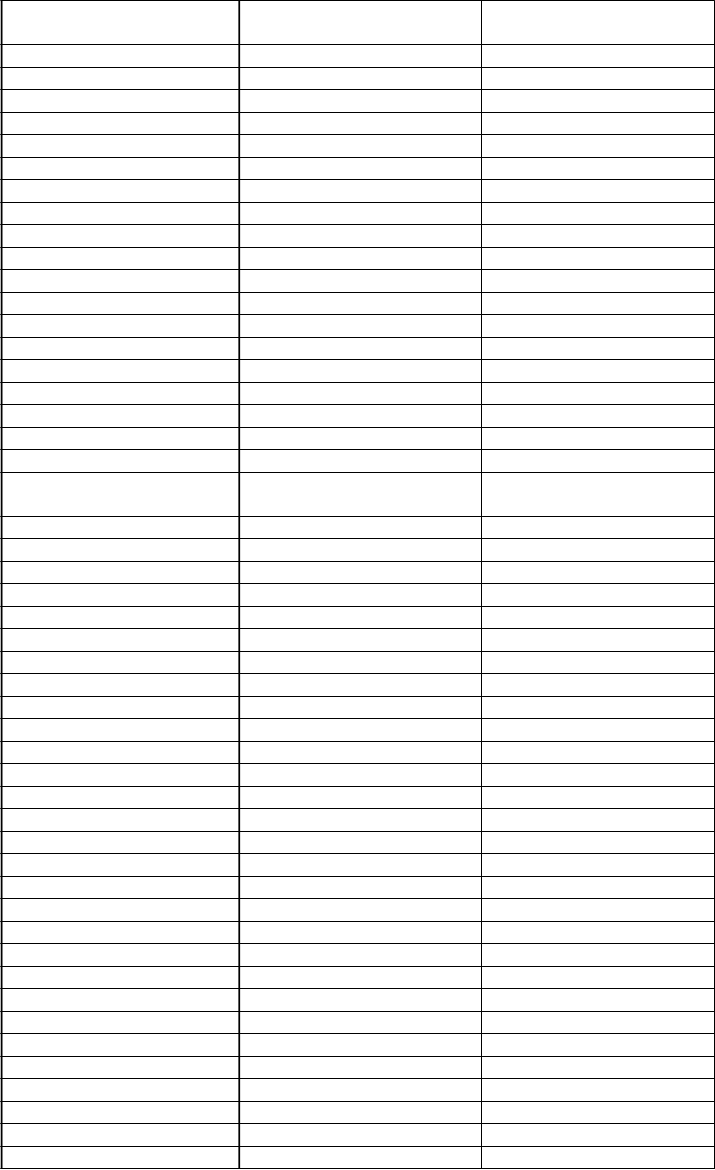
c.136 C>T c.C136T H46Y c.137 A>T c.A137T H46L c.137 A>G c.A137G H46R c.139 T>G c.T139G W47G
c.140 G>A alebo 141 G>A c.G140A alebo G141A W47X
c.140 G>T c.G140T W47L c.141G>C c.G141C W47C c.139T>C c.T139C W47R c.142 G>A c.G142A E48K c.144 G>T c.G144T E48D c.145 C>T c.C145T R49C c.145 C>A c.C145A R49S c.146 G>T c.G146T R49G c.146 G>C c.G146C R49P c.146 G>T c.G146T R49L c.149 T>G c.T149G F50C c.154 T>G c.T154G C52G c.154 T>C c.T154C C52R c.155 G>C c.G155C C52S c.155 G>A c.G155A C52Y c.156 C>A c.C156A C52X c.156 C>G c.C156G C52W c.166 T>G c.T166G C56G c.167 G>C c.G167C C56S c.168 C>A c.C168A C56X c.187 T>C c.T187C C63R c.188 G>A c.G188A C63Y c.188 G>C c.G188C C63S
c.194 G>C (údajné miesto c.G194C (údajné miesto NEZNÁME (S65T )
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
spojenia) spojenia)
c.194 G>T (údajné miesto spojenia)
c.G194T (údajné miesto
spojenia) NEZNÁME (S65I )
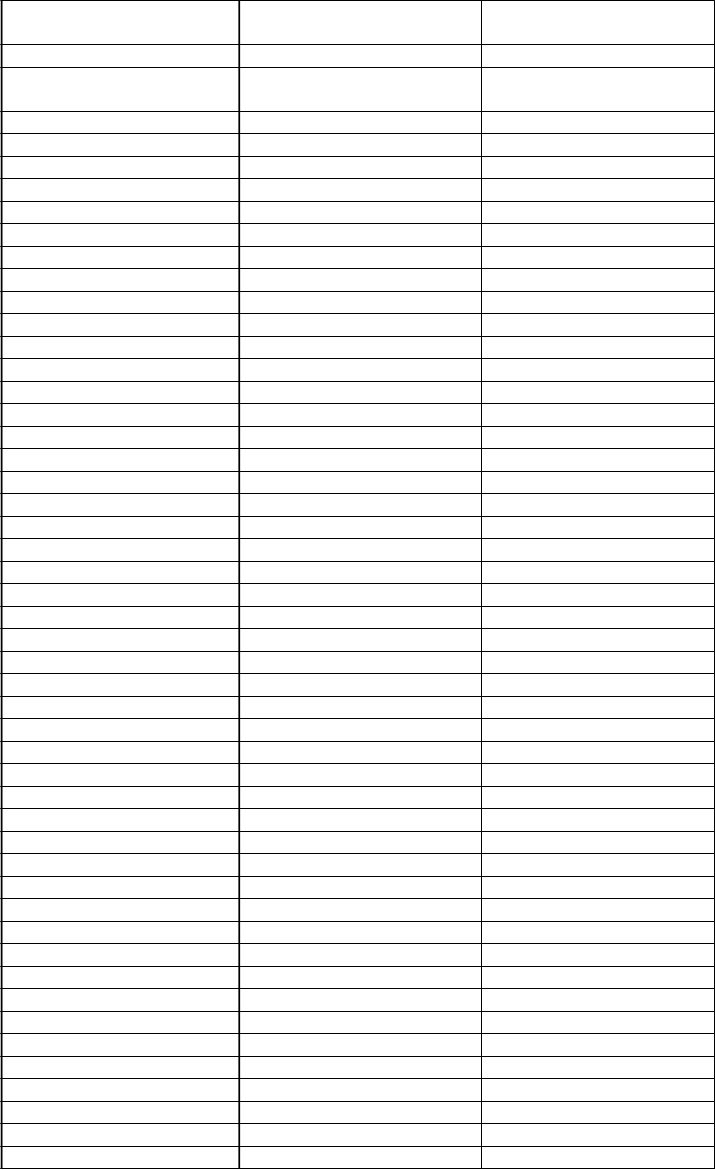
c.196 G>C c.G196C E66Q c.202 C>T c.C202T L68F c.215 T>G c.T215G M72R c.218 C>A c.C218A A73E c.227 T>G c.T227G M76R c.233 C>G c.C233G S78X c.235 G>T c.G235T E79X c.241 T>C c.T241C W81R c.242 G>A c.G242A W81X c.242 G>C c.G242C W81S c.243 G>T c.G243T W81C c.244 A>T c.A244T K82X c.256 T>G c.T256G Y86D c.256 T>C c.T256C Y86H c.257 A>G c.A257G Y86C c.258 T>G c.T258G Y86X c.262 T>G c.T262G Y88D c.266 T>C c.T266C L89P c.266 T>G c.T266G L89R c.268 T>C c.T268C C90R c.269 G>A c.G269A C90Y c.270 C>A c.C270A C90X c.274 G>C c.G274C D92H c.274 G>A c.G274A D92N c.274 G>T c.G274T D92Y c.275 A>G c.A275G D92G c.275 A>T c.A275T D92V c.277 G>A c.G277A D93N c.277 G>T c.G277T D93Y c.278 A>G c.A278G D93G c.278 A>T c.A278T D93V c.279 C>G c.C279G D93E c.280T>G c.T280G C94G c.281 G>C c.G281C C94S c.281 G>A c.G281A C94Y c.284 G>A c.G284A W95X c.284 G>T c.G284T W95L c.284 G>C c.G284C W95S c.295 C>T c.C295T Q99X c.299 G>A c.G299A R100K c.299 G>C c.G299C R100T c.305 C>G c.C305G S102X c.307 G>C c.G307C E103Q c.307 G>T c.G307T E103X c.317 T>G c.T317G L106R c.319 C>T c.C319T Q107X c.320 A>T c.A320T Q107L
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.334 C>T c.C334T R112C c.334 C>A c.C334A R112S c.338 T>C c.T338C F113S c.350 T>G c.T350G I117S c.355 C>T c.C355T Q119X c.358 C>G c.C358G L120V
c.[358 C>T; 359 T>C] c.C358T/T359C L120S c.359 T>C c.T359C L120P c.361 G>C c.G361C A121P c.371 T>A c.T371A V124D c.374 A>C c.A374C H125P c.379 A>T c.A379T K127X c.386 T>C c.T386C L129P c.389 A>G c.A389G K130R c.392 T>C c.T392C L131P c.394 G>A c.G394A G132R c.395 G>A c.G395A G132E c.395 G>C c.G395C G132A c.398T>A c.T398A I133N c.400 T>C c.T400C Y134H c.400 T>G c.T400G Y134D c.401 A>C c.A401C Y134S c.402 T>G c.T402G Y134X c.406 G>C c.G406C D136H c.406 G>T c.G406T D136Y c.412 G>A c.G412A G138R c.413 G>A c.G413A G138E c.416 A>C c.A416C N139T c.422 C>A c.C422A T141N c.422 C>T c.C422T T141I c.424 T>C c.T424C C142R c.425 G>A c.G425A C142Y c.426 C>A c.C426A C142X c.426 C>G c.C426G C142W c.427 G>C c.G427C A143P c.439 G>A c.G439A G147R c.440 G>A c.G440A G147E c.443 G>A c.G443A S148N c.444 T>G c.T444G S148R c.453 C>G c.C453G Y151X c.456 C>A c.C456A Y152X c.463 G>C c.G463C D155H c.467 C>A c.C467A A156D c.469 C>T c.C469T Q157X c.484 T>C c.T484C W162R c.485 G>A c.G485A W162X c.485 G>T c.G485T W162L c.486 G>C c.G486C W162C c.488 G>T c.G488T G163V c.491 T>G c.T491G V164G
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.493 G>T c.G493T D165Y c.494 A>T c.A494T D165V c.500 T>A c.T500A L167Q c.500 T>C c.T500C L167P c.503 A>G c.A503G K168R c.504 A>C c.A504C K168N c.508 G>A c.G508A D170N c.508 G>C c.G508C D170H c.509 A>G c.A509G D170G c.509 A>T c.A509T D170V c.511 G>C c.G511C G171R c.511 G>T c.G511T G171C c.512 G>A c.G512A G171D c.514 T>G c.T514G C172G c.514 T>C c.T514C C172R c.515 G>C c.G515C C172S c.515 G>T c.G515T C172F c.515 G>A c.G515A C172Y c.516 T>G c.T516G C172W c.519 C>A c.C519A Y173X c.530 T>A c.T530A L177X
c.547 G>A (údajné miesto
spojenia)
c.G547A (údajné miesto
spojenia) NEZNÁME (G183S)

c.548 G>T c.G548T G183V c.557 A>C c.A557C H186P c.560 T>G c.T560G M187R c.572 T>C c.T572C L191P c.605 G>A c.G605A C202Y c.604 T>C c.T604C C202R c.606 T>G c.T606G C202W c.607 G>A c.G607A E203K
c.611 G>A alebo 612G>A c.G611A alebo G612A W204X
c.612 G>T c.G612T W204C c.614 C>G c.C614G P205R c.617 T>C c.T617C L206P c.620 A>G c.A620G Y207C c.634 C>T c.C634T Q212X c.658 C>T c.C658T R220X c.661 C>T c.C661T Q221X c.666 C>A c.C666A Y222X c.667 T>G c.T667G C223G c.667 T>C c.T667C C223R c.668 G>A c.G668A C223Y c.670 A>G c.A670G N224D c.674 A>G c.A674G H225R c.676 T>C c.T676C W226R c.677 G>A c.G677A W226X c.678 G>T c.G678T W226C c.679 C>T c.C679T R227X c.680 G>A c.G680A R227Q
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.680 G>C c.G680C R227P c.688 G>A c.G688A A230T c.691 G>A c.G691A D231N c.692 A>G c.A692G D231G c.692 A>T c.A692T D231V c.700 G>T c.G700T D234Y c.702 T>G c.T702G D234E c.704 C>A c.C704A S235Y c.704 C>G c.C704G S235C c.704 C>T c.C704T S235F c.706 T>C c.T706C W236R c.707 G>A c.G707A W236X c.707 G>T c.G707T W236L c.708 G>C c.G708C W236C c.712 A>C c.A712C S238R c.718 A>T c.A718T K240X
c.734 G>A alebo 735G>A c.G734A alebo G735A W245X c.739 T>C c.T739C S247P c.748 C>T c.C748T Q250X c.751 G>T c.G751T E251X c.755 G>C c.G755C R252T c.770 C>A c.C770A A257D c.782 G>A c.G782A G261D c.782 G>T c.G782T G261V c.785 G>A c.G785A W262X c.785 G>T c.G785T W262L c.786 G>C c.G786C W262C c.791 A>C c.A791C D264A c.791 A>T c.A791T D264V c.793 C>T c.C793T P265S c.794 C>G c.C794G P265R c.796 G>C c.G796C D266H c.796 G>T c.G796T D266Y c.796 G>A c.G796A D266N c.797 A>C c.A797C D266A c.797 A>T c.A797T D266V c.798 T>A c.T798A D266E c.800 T>G c.T800G M267R
c.801 G>A (údajné miesto spojenia)
c. G801A (údajné miesto
spojenia) NEZNÁME (M267I)

c.803 T>C c.T803C L268S c.806 T>A c.T806A V269E c.[806T>G,937G>T] c.T806G/G937T V269G/D313Y c.811 G>T c.G811T G271C
c.812 G>T c.G812T G271V c.815 A>G c.A815G N272S c.816 C>A c.C816A N272K c.819 T>G c.T819G F273L c.820 G>A c.G820A G274S c.821 G>T c.G821T G274V
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.823 C>T c.C823T L275F c.826 A>G c.A826G S276G c.830 G>A c.G830A W277X c.835 C>A c.C835A Q279K c.836 A>G c.A836G Q279R c.837 G>C c.G837C Q279H c.845 C>A c.C845A T282N c.847 C>T c.C847T Q283X c.848 A>C c.A848C Q283P c.848A>G c.A848G Q283R c.853 G>C c.G853C A285P c.854 C>A c.C854A A285D c.859 T>G c.T859G W287G
c.860 G>A alebo 861G>A c.G860A alebo G861A W287X
c.861 G>C c.G861C W287C c.863 C>A c.C863A A288D c.865 A>T c.A865T I289F c.874 G>A c.G874A A292T c.874 G>C c.G874C A292P c.875 C>T c.C875T A292V c.877 C>G c.C877G P293A c.877 C>T c.C877T P293S c.878 C>A c. C878A P293H c.878 C>T c. C878T P293L c.881 T>G c.T881G L294X c.890 C>G c. C890G S297C c.890 C>T c.C890T S297F c.892 A>C c.A892C N298H c.894 T>G c.T894G N298K c.896 A>G c.A896G D299G c.899 T>A c.T899A L300H c.901 C>T c.C901T R301X c.916 C>T c.C916T Q306X c.929 T>G c.T929G L310R c.931 C>T c.C931T L311F c.932 T>C c.T932C L311P c.932 T>G c.T932G L311R c.947 T>A c.T947A V316E c.950 T>A c.T950A I317N c.950 T>G c.T950G I317S c.958 A>T c.A958T N320Y c.960 T>G c.T960G N320K c.961 C>G c.C961G Q321E c.961 C>T c.C961T Q321X c.974 G>A c.G974A G325D c.979 C>A c.C979A Q327K c.982 G>A c.G982A G328R c.982 G>T c.G982T G328W c.983 G>A c.G983A G328E c.983 G>T c.G983T G328V
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.988 C>T c.C988T Q330X c.997 C>T c.C997T Q333X c.998 A>G c.A998G Q333R c.1012 G>T c.G1012T E338X c.1016 T>G c.T1016G V339G c.1018 T>C c.T1018C W340R c.1020 G>A c.G1020A W340X c.1021 G>A c.G1021A E341K c.1023 A >C c.A1023C E341D c.1024C>G c.C1024G R342G c.1024 C>T c.C1024T R342X c.1025 G>A c.G1025A R342Q c.1025 G>C c.G1025C R342P c.1025 G>T c.G1025T R342L c.1031 T>C c.T1031C L344P c.1034 C>G c.C1034G S345X c.1042 G>C c.G1042C A348P c.1045 T>C c.T1045C W349R c.1046 G>A c.G1046A W349X c.1048 G>C c.G1048C A350P c.1054 G>C c.G1054C A352P c.1055 C>A c.C1055A A352D c.1065 C>A c.C1065A N355K c.1069 C>T c.C1069T Q357X c.1072 G>A c.G1072A E358K c.1081 G>A c.G1081A G361R c.1088 G>C c.G1088C R363P c.1095 T>A c.T1095A Y365X c.1115 T>A c.T1115A L372Q c.1115 T>C c.T1115C L372P c.1115 T>G c.T1115G L372R c.1117 G>C c.G1117C G373R c.1118 G>A c.G1118A G373D
c.1124_1129del c.1124_1129del G375_V376del
c.1129_1140dup c.1129_1140dup A377_P380dup c.1130 C>A c.C1130A A377D c.1132 T>C c.T1132C C378R c.1133 G>A c.G1133A C378Y c.1144T>C c.T1144C C382R c.1145 G>A c.G1145A C382Y c.1146 C>G c.C1146G C382W c.1151 T>A c.T1151A I384N c.1153 A>C c.A1153C T385P c.1156 C>T c.C1156T Q386X c.1157 A>C c.A1157C Q386P c.1165 C>G c.C1165G P389A c.1166 C>G c.C1166G P389R c.1166 C>T c.C1166T P389L
c.1181_1183dup c.1181_1183dup L394_G395InsV
c.1187 T>A c.T1187A F396Y
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.1192 G>T c.G1192T E398X c.1196 G>A alebo 1197 G>A c.G1196A alebo G1197A W399X c.1202 C>G c.C1202G S401X
c.1215 T>A c.T1215A S405R
c.1217 A>G c.A1217G H406R c.1219 A>G c.A1219G I407V c.1220 T>A c.T1220A I407K c.1220 T>G c.T1220G I407R
c.1226_1231del c.1226_1231del p.409_410delinsR c.1228 A>C c.A1228C T410P c.1229 C>A c.C1229A T410K c.1241 T>C c.T1241C L414S c.1243 C>T c.C1243T L415F c.1244 T>C c.T1244C L415P c.1246 C>T c.C1246T Q416X c.1247A>C c.A1247C Q416P
c.1247_1248CT>AA c.C1247A/T1248A L417K c.1250 T>G c.T1250G L417R g.941_5845del c.1-179_369+577del p.?(Exon1_2del)
g.?_?del c.?_? NEZNÁME (del Exon1_2?)
c.18delA c.18delA p.P6fs 114 c.26delA c.26delA p.H9Lfs 111 c.32delG c.32delG p.G11Afs 109 c.33delC c.33delC p.G11fs 109 c.34_42del c.34_42del p.C12_L14del c.34_57del c.34_57del p.C12_L19del c.35_47del c.35_47del p.C12Ffs 104
c.147_148 Ins CCC c.147_148 Ins CCC p.49Ins P
c.58_83del c.58_83del p.A20_G28delfs 2 c.58_72del c.58_72del p.A20_W24del c.85dupG c.85dupG p.A29Gfs 1 c.123delC c.123delC p.T41fs 79
c.123_126dupCATG c.123_126dupCATG p.G43Hfs 13 c.124_125del c.124_125del p.M42Gfs 12 c.125_137del c.125_137del p.M42Tfs 74 c.154delT c.154delT p.C52Afs 68
c.162delT c.162delT p.L54fs 66 c.181_182dupA c.181_182dupA p.D61Efs 5 c.184delT c.184delT p.S62Pfs 58 g.2594_10904dup c.195-2500_999+197dup NEZNÁME
c.194+2049_369+773del2620
g.3422_6041delinsCG
insCG NEZNÁME
g.?_?del c.195-?_547+?del NEZNÁME (del Exon2_3?) g.?_?dup c.?_?dup NEZNÁME (Exon2_4dup?) NEZNÁME (E66_Y123del;
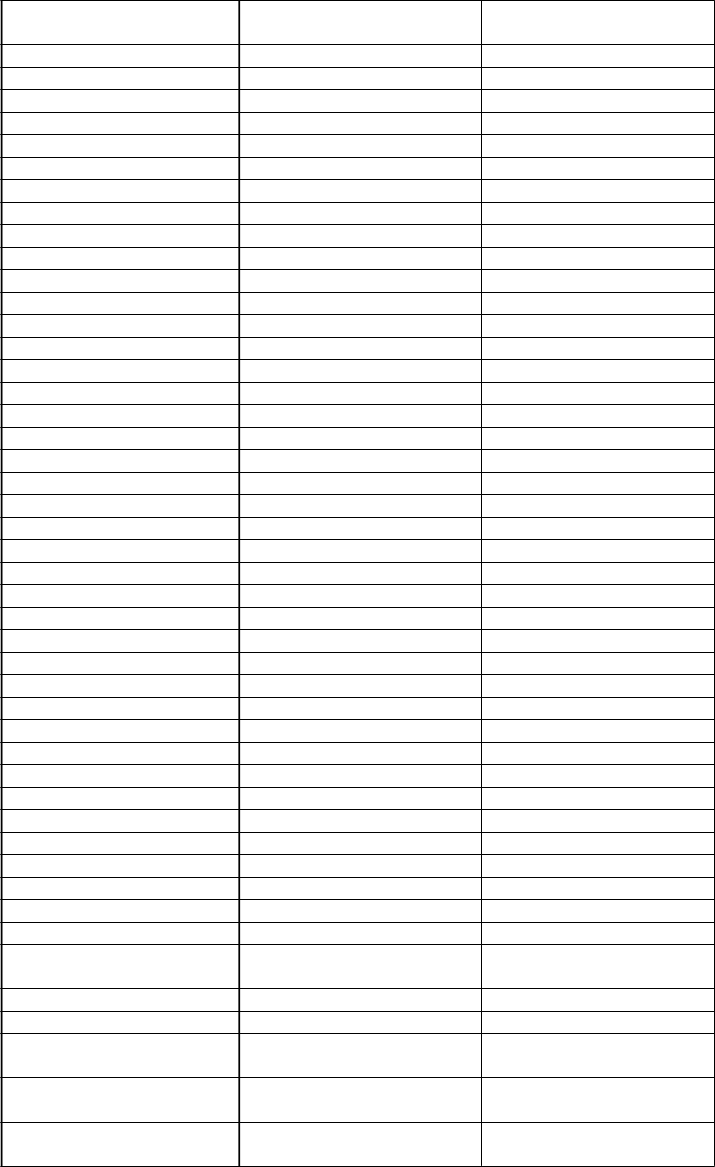
g.2934_6378del c.194+1561_370-891del
g.3396_6012del c.194+2023_370-1257del g.3260_6410del c.194+1887_370-859del
del Exon2?)
NEZNÁME (E66_Y123del;
del Exon2?) NEZNÁME (E66_Y123del; del Exon2?)
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
NEZNÁME (E66_Y123del;
g.2979_6442del c.194+1606_369+1174del
del Exon2)
c.256delT c.256delT p.Y88Mfs 42
g.5106_5919delins231 c.207_369+651del814ins231 NEZNÁME (del Exon2?)
c.259_276Del c.259_276 Del p.87_92del c.267_268dupCT c.267_268dupCT p.C90Sfs 31 c.270delC c.270delC p.C90X c.281_286delinsT c.281_286delinsT p.C94Ffs 26
c.297_298del c.297_298del p.Q99fs 22 c.305delC c.305delC p.S102X c.317_327del c.317_327del p.S102fs 16
c.323_324insCAGA c.323_324insCAGA p.D109Rfs 14
c.336 Del18 c.336 Del18 p.113del6aa c.358 Del6 c.358 Del6 p.120del2aa/L120H c.363delT c.363delT p.A121fs 8
g.5271_9366del4096insT
c.369+3_639+954del3129ins
T
NEZNÁME (del Exon3
a 4?)
g.7086_7487del c.370-183_547+41del NEZNÁME (del Exon3?)
g.6736_11545del c.370-533_c.1290+277del NEZNÁME (del Exon3_7?) NEZNÁME (del Exon3
g.6009_9741del c.369+741_640-390del
g.6547_9783del c.369+1279_640-348del g.>5.5 kb del až 3UTR c.?_?del
a 4?)
NEZNÁME (del Exon3
a 4?) NEZNÁME (del Exon3_3’UTR?)
c.[374 A>T;383 G>A] c.A374T/G383A H125L/G128E c.402delT c.402delT p.Y134X c.409delG c.409delG p.V137Lfs 27 c.413dupG c.413dupG p.G138fs 2 c.421delA c.421delA p.T141Pfs 23 c.426dupC c.426dupC p.A143Rfs 13 c.452delA c.452delA p.Y151Sfs 13 c.457_459del c.457_459del p.153delD
c.477delT c.477delT p.F159Lfs 5
c.486_498del c.486_498del p.W162Cfs 1 c.516 InsGAC c.516 InsGAC p. 152 Ins D c.520delT c.520delT p.C174Vfs 17
c.[604 T>C;644 A>G] c.T604C/A644G p. C202R/N215S
c.568delG c.568delG p.A190Pfs 1 c.590delG c.590delG p.S197Tfs 42 c.606delT c.606delT p.C202Wfs 37 c.613_621del c.613_621del p.205_207del c.614delC c.614delC p.P205Lfs 34
c.618_619del c.618_619del p.L206fs 24
c.621dupT c.621dupT p.M208Yfs 24
g.?_?del c.?_?del NEZNÁME (del Exon5_7?)
g.[10237_11932del;
11933_12083inv;
12084_12097del]
g.[10237_11932del;
11933_12083inv;
12084_12097del]
NEZNÁME

c.646dupT c.646dupT p.Y216Lfs 15
 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.646delT c.646delT p.Y216Ifs 23 c.650_663dup14 c.650_663dup14 p.Q221fs 23 c.672_673ins37 c.672_673ins37 p.H225Tfs 18 c.674_732del c.674_732del p.H225Lfs 5 c.678delG c.678delG p.A230Lfs 9
c.715_717 del c.715_717 del p.del I239
c.716dupT c.716dupT p.I239fs 10 c.718_719del c.718_719del p.K240Efs 8 c.719dupA c.719dupA p.K240fs 9
c.722delG c.722delG p.S241Ifs 27
c.723dupT c.723dupT p.S238fs 8 c.732delC c.732delC p.D244fs 24 c.741ins9 c.741ins9 p.247ins3 c.744delT c.744delT p.F248Lfs 20
c.744_745del c.744_745del p.F248Lfs 6 c.746_747del c.746_747del p.N249Tfs 5 c.759delT c.759delT p.I253Mfs 15 c.760dupG c.760dupG p.V254Gfs 1 c.761_762del c.761_762del p.V254Gfs 9
c.774_775del c.774_775del p.G258fx 5
c.777delA c.777delA p.P259fs 9 c.782dupG c.782dupG p.G261fs 3 c.807delG c.807delG p.V269fs 12 c.833dupA c.833dupA p.N278Kfs 20 c.833delA c.833delA p.N278Ifs 3 c.842_844del c.842_844del p.V281AdelT282 c.881delT c.881delT p.L294Yfs 22
c.892_893insT c.892_893insT p.N298I 1
c.893_894insG c.893_894insG p.N298Kfs 1 c.902dupG c.902dupG p.R301fs 13 c.909_918del c.909_918del p.I303Mfx 10 c.914delC c.914delC p.P305Lfs 11
c.931delC c.931delC p.L311Ffs 5
c.941_961del c.941_961del p.D315_Q321del c.946delG c.946delG p.V316X
c.950_954dupTTGCC c.950_954dupTTGCC p.A318fs 31
c.974dupG c.974dupG p.G325fs 7 c.986delA c.986delA p.Y329Sfs 18 c.988delC c.988delC p.Q330Sfs 17
c.946_966del c.946_966del p.V316_D322del
c.994delA c.994delA p.R332Dfs 15 c.996_999del c.996_999del p.R332fs 14 c.997dupC c.997dupC p.Q333Pfs 5 c.1011_1029del c.1011_1029del p.F337fs 4
c.1017_1020delins24 c.1017_1020delins24 p.V339fs 7
c.1017_1027del c.1017_1027del p.V339fs 5 c.1021delG c.1021delG p.E341Nfs 6 c.1025delG c.1025delG p.R342Hfs 5
c.1030_1031insT c.1030_1031insT p.L344fs 30
c.1033_1034del c.1033_1034del p.S345Rfs 28
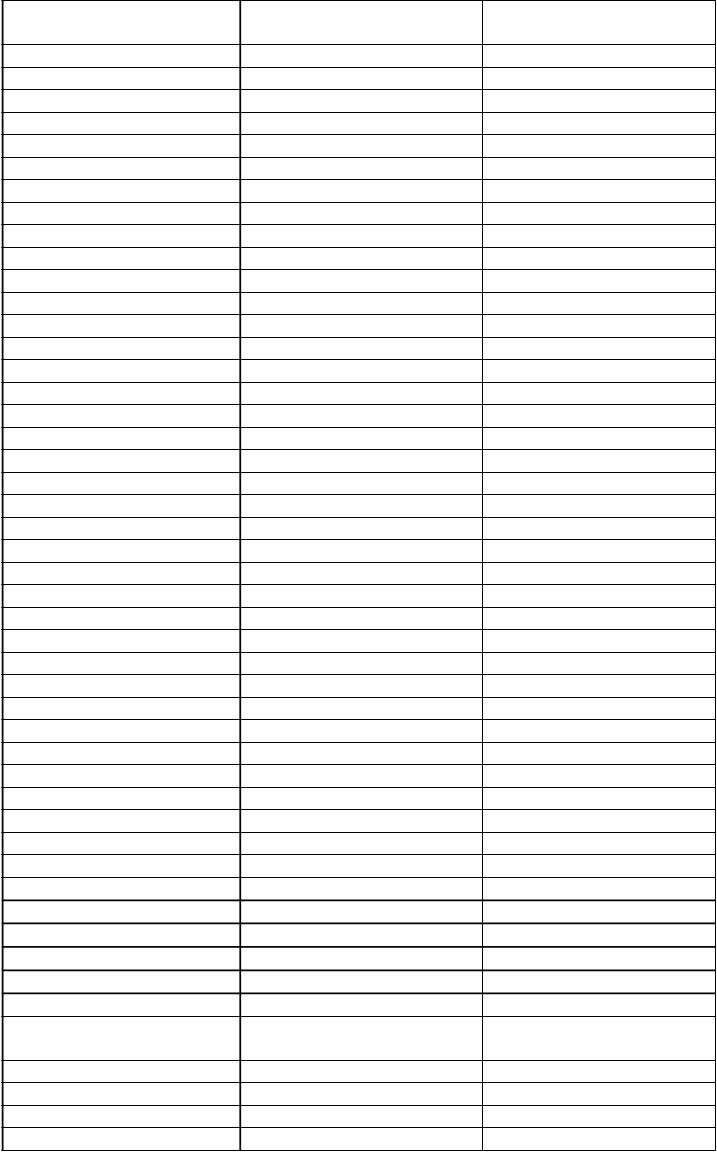 Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
c.1037delG c.1037delG p.G346Afs 1 c.1040dupT c.1040dupT p.L347Ffs 27 c.1041dupA c.1041dupA p.L347fs 27 c.1042dupG c.1042dupG p.A348Gfs 26
c.1043_1044insG c.1043_1044insG p.A348fs 26
c.1049delC c.1049delC p.A350Vfs 1
c.1151_1152delinsAT c.1151_1152delinsAT p.I384N c.1055_1057dup c.1055_1057dup p.353InsT c.1057_1058del c.1057_1058del p.M353Dfs 20 c.1072_1074del c.1072_1074del p.358delE c.1074_1075del c.1074_1075del p.E358Dfs 15
c.1077delT c.1077delT p.I359Mfs 31
c.1081_1100del c.1081_1100del p.G360fs 7
c.1086_1098del c.1086_1098del p.P362fs 24
c.1088delG c.1088delG p.R363Pfs 27 c.1091_1092del c.1091_1092del p.S364Lfs 9 c.1093dupT c.1093dupT p.Y365Lfs 9
c.1095delT c.1095delT p.Y365X'
c.1096_1100del c.1096_1100del p.Y365fs 7 c.1102delGinsTTATAC c.1102delGinsTTATAC p.A368delinsFYfs 23 c.1122_1125del c.1122_1125del p.K374fs 15
c.1123_1175del c.1123_1175del p.G375_R392del
c.1139delC c.1139delC p.380Lfs 10 c.1145_1149del c.1145_1149del p.C382Yfs 14 c.1146_1148del c.1146_1148del p.383delF c.1156_1157del c.1156_1157del p.Q386Afs 10
c.1167dupT c.1167dupT p.P389fs 9 c.1168 Ins T c.1168 Ins T p. V390fs 9 c.1176_1179del c.1176_1179del p.R392Sfs 1 c.1177_1178del c.1177_1178del p.K393Afs 4 c.1187dupT c.1187dupT p.F396fs 2
c.1187delT c.1187delT p.F396Sfs 7
c.1188delC c.1188delC p.F396fs 7 c.1201dupT c.1201dupT p.S401Ffs 49 c.1208delT c.1208delT p.L403X c.1208ins21 c.1208ins21 NEZNÁME
c.1209_1211del c.1209_1211del p.404delR
c.1223delA c.1223delA p.N408Ifs 9 c.1235_1236del c.1235_1236del p.T412Sfs 37 c.1277_1278del c.1277_1278del p.K426Rfs 23 c.1284_1287del c.1284_1287del p.L428Ffs 23
c.359 T>C; c.361 G>A c.T359C/G361A L120P/A121T
c.644 A>G; c.811 G>A c.A644G; c.G811A N215S/G271S
c.[644 A>G; 811 G>A; 937
G>T] c.A644G/G811A/G937T N215S/G271S/D313Y
c.790 G>T; c.805 G>A c.G790T/G805A D264Y/V269M
c.963_964 GG>CC c.G963C/G964C Q321H/D322N c.1288 T>C c. T1288C X430Q IVS1+2 T>C c.194+2 T>C NEZNÁME
Z
m
ena nukleotidov Zmena nukleotidov Zmena sekvencie proteínov
IVS1-1 G>A c.195-1 G>A NEZNÁME IVS1-1 G>T c.195-1 G>T NEZNÁME IVS1-2 A>G c.195-2 A>G NEZNÁME
IVS1-2 A>G;IVS1-49 T>C c.[195-2 A>G;195-49 T>C] NEZNÁME
IVS2+1 G>A c.369+1 G>A NEZNÁME IVS2+2 T>G c.369+2 T>G NEZNÁME IVS2-2 A>G c.370-2A>G NEZNÁME IVS3+1 G>A c.547+1 G>A NEZNÁME IVS3+1 G>C c.547+1 G>C NEZNÁME IVS3-2 A>G c.548-2 A>G NEZNÁME IVS3-1 G>A c.548-1 G>A NEZNÁME IVS3-1 G>C c.548-1 G>C NEZNÁME IVS3-1 G>T c.548-1 G>T NEZNÁME IVS4-1 G>T c.639-1 G>T NEZNÁME IVS4+1 G>A c.639+1 G>A NEZNÁME IVS4+1 G>C c.639+1 G>C NEZNÁME IVS4+4 A>T c.639+4 A>T NEZNÁME IVS4+861 C>T c.639+861 C>T NEZNÁME IVS4+919 G>A c.639+919G>A NEZNÁME IVS4-11 T>A c.640-11 T>A NEZNÁME IVS4-3 C>G c.640-3 C>G NEZNÁME IVS4-2 A>T c.640-2 A>T NEZNÁME IVS4-1 G>A c.640-1 G>A NEZNÁME IVS5+2 T>C c.801+2 T>C NEZNÁME IVS5+3 A>G c.801+3 A>G NEZNÁME IVS5+4 A>G c.801+4 A>G NEZNÁME IVS5-2 A>G c.802-2 A>G NEZNÁME IVS6+1 G>T c.999+1 G>T NEZNÁME IVS6+2 T>C c.999+2 T>C NEZNÁME IVS6-2 A>G c.1000-2 A>G NEZNÁME IVS6-2 A>T c.1000-2 A>T NEZNÁME IVS6-1 G>A c.1000-1 G>A NEZNÁME IVS6-1 G>C c.1000-1 G>C NEZNÁME
NEZNÁME v stĺpci „zmena sekvencie proteínov“ znamená, že zmeny v sekvencii proteínov zapríčinené mutáciami nemôžu byť ľahko odvodené zo zmien nukleotidov a musia sa určiť experimentálne. V týchto prípadoch otázniky v sprievodných zátvorkách znamenajú, že zmeny, ktoré sú tu uvedené, neboli experimentálne potvrdené a nemusia byť správne.
Neboli testované všetky mutácie.
Farmakodynamické účinkyLiečba liekom Galafold vo farmakodynamických skúšaniach fázy 2 zvyčajne viedla u väčšiny
pacientov k zvýšeniu endogénnej aktivity α-Gal A v bielych krvinkách a tiež v koži a obličkách.
U pacientov so senzibilnými mutáciami sa zvyčajne znížila hladina GL-3 v moči a v intersticiálnej
oblasti kapilár obličiek.
K
l
i
n
i
cká účinnosť abezpečnosť
Klinická účinnosť a bezpečnosť lieku Galafold boli hodnotené v dvoch hlavných skúšaniach fázy 3
a v otvorenom predĺženom (OLE) skúšaní. Všetci pacienti dostávali odporúčané 123 mg dávky lieku
Galafold každý druhý deň.
Prvé skúšanie fázy 3 (ATTRACT) bolo 18-mesačné randomizované otvorené skúšanie s aktívnym porovnávacím liekom, v ktorom sa hodnotila účinnosť a bezpečnosť lieku Galafold v porovnaní
s enzýmovou substitučnou liečbou (ERT) (agalzidáza beta, agalzidáza alfa) u 52 mužov a žien
s Fabryho chorobou, ktorí dostávali ERT pred vstupom do skúšania a ktorí mali senzibilné mutácie
(skúšanie u pacientov, ktorí mali skúsenosti s ERT).
Druhé skúšanie fázy 3 (FACETS) bolo šesťmesačné randomizované dvojito zaslepené skúšanie kontrolované placebom (až do šiesteho mesiaca) s 18-mesačným otvoreným obdobím na vyhodnotenie účinnosti a bezpečnosti lieku Galafold u 50 mužov a žien s Fabryho chorobou, ktorí nedostávali ERT alebo dostávali ERT v minulosti a prestali ju užívať najmenej na šesť mesiacov a ktorí mali senzibilné mutácie (skúšanie s pacientmi, ktorí nedostávali ERT).
Funkcia obličiek
V skúšaní u pacientov, ktorí mali skúsenosti s ERT, funkcia obličiek ostala stabilná až do 18 mesiacov liečby liekom Galafold. Priemerná anualizovaná miera zmeny eGFRCKD-EPI bola –0,40 ml/min/1,73 m2 (95 % IS: –2,272; 1,478) v skupine užívajúcej liek Galafold v porovnaní s –1,03 ml/min/1,73 m2 (95 % IS: –3,636; 1,575) v skupine, ktorá dostávala ERT.
V skúšaní u pacientov, ktorí nedostávali ERT, a v otvorenom predĺženom skúšaní ostala funkcia obličiek stabilná počas troch rokov liečby liekom Galafold. Po priemerne 36 mesiacoch liečby bola priemerná anualizovaná miera zmeny eGFRCKD-EPI –0,81 ml/min/1,73 m2 (95 % IS: –2,00; 0,37). Počas počiatočného šesťmesačného obdobia kontrolovaného placebom sa nepozorovali klinicky významné rozdiely.
Index hmotnosti ľavej komory (LVMi)
V skúšaní u pacientov, ktorí mali skúsenosti s ERT, sa po 18 mesiacoch liečby liekom Galafold pozorovalo štatisticky významné zníženie LVMi (p < 0,05). Zmena LVMi (g/m2) od začiatku do 18. mesiaca u pacientov s hypertrofiou ľavej komory (ženy s LVMi na začiatku > 95 g/m2 a muži s LVMi na začiatku > 115 g/m2) bola –8,4 (95 % IS: –15,7; 2,6; n = 13) pre migalastát a 4,5 (95 % IS: -10,7;
18,4; n = 5) pre ERT.
V skúšaní u pacientov, ktorí nedostávali ERT, liečba liekom Galafold viedla k štatisticky významnému zníženiu LVMi (p < 0,05); priemerná zmena LVMi od začiatku do 18. – 24. mesiaca bola –7,7 (95 % IS: –15,4; –0,01; n = 27). Po sledovaní v OLE bola priemerná zmena LVMi od začiatku do 30. – 36. mesiaca –17,0 (95 % IS: –26,2; –7,9; n = 15). Priemerná zmena LVMi od začiatku do 18. – 24.
mesiaca u pacientov s hypertrofiou ľavej komory na začiatku (ženy s LVMi na začiatku > 95 g/m2
alebo muži s LVMi na začiatku > 115 g/m2) bola –18,6 (95 % IS: –38,2; 1,0; n = 8). Po sledovaní
v OLE bola priemerná zmena LVMi od začiatku do 30. – 36. mesiaca u pacientov s hypertrofiou ľavej komory na začiatku -30,0 (95 % IS: –57,9; –2,2; n = 4). Počas počiatočného šesťmesačného obdobia kontrolovaného placebom sa nepozorovali klinicky významné rozdiely LVMi.
Substrát ochorenia
V skúšaní u pacientov, ktorí mali skúsenosti s ERT, plazmatická hladina lyzo-Gb3 ostala nízka
a stabilná až 18 mesiacov u pacientov so senzibilnými mutáciami, ktorí prešli z ERT na liek Galafold
a u pacientov, ktorí naďalej dostávali ERT.
V skúšaní u pacientov, ktorí nedostávali ERT, liek Galafold preukázal štatisticky významné zníženia plazmatických koncentrácií lyzo-Gb3 a inklúzií GL-3 v intersticiálnej oblasti kapilár obličiek
u pacientov so senzibilnými mutáciami. Pacienti randomizovaní na liečbu liekom Galafold v 1. štádiu
preukázali štatisticky výraznejšie významné zníženie (±SEM) priemerného ukladania GL-3
v intersticiálnej oblasti kapilár (–0,25 ± 0,10; –39 %) v šiestom mesiaci v porovnaní s placebom
(+0,07 ± 0,13; +14 %) (p = 0,008). Pacienti randomizovaní na liečbu placebom v 1. štádiu, ktorí prešli na liek Galafold v šiestom mesiaci (2. štádium) tiež preukázali štatisticky významné zníženia inklúzií GL-3 v intersticiálnej oblasti kapilár v 12. mesiaci (–0,33 ± 0,15; –58 %) (p = 0,014). Počas 12 mesiacov liečby liekom Galafold sa pozorovali kvalitatívne zníženia hladiny GL-3 vo viacerých typoch renálnych buniek: v podocytoch, mezangiálnych bunkách a v glomerulárnych endoteliálnych bunkách.
Zložené klinické výsledky
V skúšaní u pacientov, ktorí mali skúsenosti s ERT, sa uskutočnila analýza zloženého klinického výsledku, ktorý sa skladal z renálnych, srdcových a cerebrovaskulárnych udalostí alebo úmrtia, pričom frekvencia udalostí pozorovaných v skupine liečenej liekom Galafold bola 29 % a 44 % v skupine, ktorá dostávala ERT.
Výsledok udávaný pacientmi – stupnica hodnotenia gastrointestinálnych symptómov
V skúšaní u pacientov, ktorí nedostávali ERT, analýzy stupnice hodnotenia gastrointestinálnych symptómov preukázali, že liečba liekom Galafold sa spájala so štatisticky významnými (p < 0,05) zlepšeniami od začiatku do šiesteho mesiaca v porovnaní s placebom, pokiaľ ide o hnačku a reflux u pacientov, ktorí mali na začiatku symptómy. Počas otvorenej predĺženej fázy sa pozorovali
štatisticky významné (p < 0,05) zlepšenia oproti začiatku, pokiaľ ide o hnačku a trávenie a pozoroval
sa trend zlepšenia, pokiaľ ide o zápchu.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Galafold
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe Fabryho choroby
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absolútna biologická dostupnosť (AUC) jednorazovej perorálnej 150 mg dávky migalastátiumchloridu
alebo jednorazovej dvojhodinovej 150 mg intravenóznej infúzie dosahovala približne 75 %. Po jednej perorálnej 150 mg dávke roztoku migalastátiumchloridu bola maximálna plazmatická koncentrácia dosiahnutá približne za tri hodiny. Plazmatická expozícia migalastátu (AUC0-∞ ) a Cmax vykazovali zvýšenia úmerné dávke pri perorálnych dávkach migalastátu od 50 mg do 1 250 mg.
Migalastátiumchlorid podávaný s jedlom s vysokým obsahom tuku alebo 1 hodinu pred jedlom
s vysokým obsahom tuku alebo ľahkým jedlom, alebo 1 hodinu po ľahkom jedle spôsobil významné zníženie priemernej celkovej expozície migalastátu (AUC0-∞ ) o 37 – 42 % a zníženie priemernej maximálnej expozície migalastátu (Cmax ) o 15 – 40 % v porovnaní s užívaním lieku nalačno. Pozri časť 4.2.
Distribúcia
U zdravých dobrovoľníkov bol distribučný objem (Vz /F) migalastátu po stúpajúcich jednotlivých
perorálnych dávkach (25 – 675 mg migalastát HCl) v rozsahu od 77 do 133 l, čo naznačuje, že sa
dobre distribuuje do tkanív a vo väčšej miere ako celková telesná voda (42 litrov). Väzba na plazmatické proteíny po podaní [14C]-migalastátiumchloridu v rozsahu koncentrácií 1 – 100 µM bola nezistiteľná.
Biotransformácia
Na základe in vivo údajov je migalastát substrátom pre UGT, čo je menej významná eliminačná dráha.
Migalastát nie je substrátom pre P-glykoproteín (P-gP) in vitro a považuje sa za nepravdepodobné, že
migalastát by podliehal liekovým interakciám s enzýmami cytochrómu P450. Pri farmakokinetickom skúšaní u zdravých dobrovoľníkov (mužov) so 150 mg [14C]-migalastát HCl sa zistilo, že 99 % rádioaktívne označenej dávky zistenej v plazme pozostávalo z nezmeneného migalastátu (77 %)
a z troch dehydrogenovaných metabolitov konjugovaných s O-glukuronidom, M1 až M3 (13 %). Približne 9 % celkovej rádioaktivity nebolo možné určiť.
Eliminácia
Pri farmakokinetickom skúšaní u zdravých dobrovoľníkov – mužov so 150 mg [14C]- migalastátiumchloridu sa zistilo, že približne 77 % rádioaktívne označenej dávky sa nachádzalo
v moči. 55 % dávky sa vylúčilo ako nezmenený migalastát, 4 % ako metabolity M1 až M3 a 5 %
tvorili nezistené zložky, celkovo 64 %. Zvyšných 5 % predstavuje metabolity v koncentrácii pod
hranicou kvantifikovateľnej koncentrácie. Približne 20 % celkovej rádioaktívne označenej dávky sa vylúčilo stolicou, pričom jedinou meranou zložkou bol nezmenený migalastát.
Po stúpajúcich jednotlivých perorálnych dávkach (25 – 675 mg migalastátiumchlorid) sa nezistili žiadne trendy, pokiaľ ide o klírens CL/F). Pri dávke 150 mg bol CL/F približne 11 – 14 l/hod. Po podaní rovnakých dávok bol priemerný polčas eliminácie (t1/2 ) v rozsahu približne od troch do piatich hodín.
Špeciálne populácie
Pacienti s poškodenímfunkcieobličiek
Liek Galafold sa neskúmal u pacientov s Fabryho chorobou, ktorí majú odhadnutú hodnotu GFR nižšiu ako 30 ml/min/1,73 m2. V štúdii skúmajúcej podávanie jednej dávky lieku Galafold u jedincov bez Fabryho choroby s rôznymi stupňami renálnej nedostatočnosti sa expozícia zvýšila 4,3-násobne
u jedincov so závažným poškodením funkcie obličiek (GFR < 30 ml/min/1,73 m2).
Pacienti s poruchoufunkciepečene
U jedincov s poruchou funkcie pečene sa neuskutočnili nijaké štúdie. Na základe metabolickej
a exkrečnej dráhy sa nepredpokladá, že znížená funkcia pečene môže ovplyvniť farmakokinetiku
migalastátu.
Starší pacienti (> 65 rokov)
Klinické štúdie lieku Galafold zahŕňali malý počet pacientov vo veku 65 a starších. Vplyv veku sa hodnotil vo farmakokinetickej analýze populácií na základe plazmatického klírensu migalastátu
v skúmanej populácii pacientov, ktorí nedostávali ERT. Rozdiel v klírense medzi pacientmi s Fabryho
chorobou vo veku 65 rokov a starších a pacientmi mladšími ako 65 rokov bol 20 %, čo sa
nepovažovalo za klinicky významné.
Pohlavie
Farmakokinetické charakteristiky migalastátu sa výrazne neodlišovali medzi ženami a mužmi
u zdravých dobrovoľníkov alebo u pacientov s Fabryho chorobou.
5.3 Predklinické údaje o bezpečnosti
Z neklinických údajov získaných na základe štúdií skúmajúcich jednu dávku a opakované podávanie nevyplynulo nijaké osobitné riziko pre ľudí s výnimkou prechodnej, ale úplne reverzibilnej neplodnosti u potkaních samcov spájanej s liečbou migalastátom. Neplodnosť súvisiaca s liečbou migalastátom bola hlásená pri klinicky významných expozíciách. Úplná reverzibilita sa pozorovala po štyroch týždňoch od vysadenia dávok. Podobné predklinické zistenia sa zaznamenali po liečbe inými iminocukrami. V štúdii skúmajúcej embryofetálnu toxicitu u králikov sa pozorovali určité zistenia vrátane embryofetálnej smrti, zníženia priemernej hmotnosti plodu, oneskorenej osifikácie a mierne zvýšeného výskytu menších abnormalít skeletu iba v dávkach, ktoré boli toxické pre matku.
V 104-týždňovej štúdii karcinogenity u potkanov sa pozoroval zvýšený výskyt adenómov ostrovčekových buniek pankreasu u samcov v dávkovej hladine, ktorá bola 19-násobne vyššia ako expozícia (AUC) pri klinicky účinnej dávke. To je častý spontánny nádor u potkaních samcov kŕmených ad libitum. Vzhľadom na neprítomnosť podobných zistení u samíc, neprítomnosť zistení v batérii testov genotoxicity alebo v štúdii karcinogenity pri myšiach s Tg.rasH2 a neprítomnosť
preneoplastických zistení na pankrease pri hlodavcoch alebo opiciach sa toto pozorovanie u potkaních
samcov nepovažuje za súvisiace s liečbou a jeho význam pre ľudí nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
predželatínovaný škrob (kukuričný)
magnéziumstearát
Obal kapsuly želatína
oxid titaničitý (E171)
indigotín (E132)
Potlačováfarba
šelak
čierny oxid železitý
hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek si nevyžaduje nijaké zvláštne teplotné podmienky na uchovávanie. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PCTFE/PVC/Al blister.
Veľkosť balenia: 14 kapsúl.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Amicus Therapeutics UK Ltd
Phoenix House, Oxford Road, Tatling End, Gerrards Cross, Buckinghamshire SL9 7AP
Spojené kráľovstvo
Tel. +44 1753 888 567
Fax +44 1753 437 192
e-mail
info@amicusrx.co.uk8. REGISTRAČNÉ ČÍSLOEU/1/15/1082/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: DD. mesiac RRRR
10. DÁTUM REVÍZIE TEXTUDD. mesiac RRRR
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.