
u.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Samovražedné myšlienky
Samovražedné myšlienky a správanie sa zaznamenali u pacientov liečených antiepileptikami
v niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných klinických štúdií s antiepileptikami tiež preukázala mierne zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika pre perampanel.
Preto sa majú u pacientov sledovať prejavy samovražedných myšlienok a správania a má sa zvážiť vhodná liečba. Pacientom (a opatrovateľom pacientov) sa má odporučiť, aby vyhľadali lekársku pomoc, ak sa objavia prejavy samovražedných myšlienok alebo správania.
Poruchy nervovéhosystému
Perampanel môže spôsobiť závrat a ospalosť a preto môže ovplyvňovať schopnosť viesť vozidlá alebo
obsluhovať stroje (pozri časť 4.7).
Perorálne kontraceptíva
Pri dávkach Fycompy 12 mg/deň sa môže znížiť účinnosť hormonálnych kontraceptív obsahujúcich
progestagény; za týchto okolností sa odporúčajú ďalšie nehormonálne formy antikoncepcie pri použití
Fycompy (pozri časť 4.5).
Pády
Javí sa, že existuje zvýšené riziko pádov, hlavne u starších pacientov; základná príčina nie je jasná.
Agresivita
Agresívne a nepriateľské správanie sa zaznamenalo u pacientov liečených perampanelom. U pacientov
liečených perampanelom v klinických štúdiách boli agresivita, hnev a podráždenosť hlásené častejšie pri vyšších dávkach. Väčšina hlásených prípadov boli buď mierne alebo stredne závažné udalosti a pacienti sa zotavili buď spontánne alebo po úprave dávky. U niektorých pacientov (< 1 % v klinických štúdiách s perampanelom) sa však pozorovali myšlienky na ublíženie iným osobám, fyzické
napadnutie alebo vyhrážanie. Pacienti a ošetrovatelia musia byť poučení, aby okamžite upozornili zdravotníckeho pracovníka, ak spozorujú významné zmeny nálady alebo správania. Ak sa tieto príznaky objavia, dávkovanie perampanelu sa má znížiť a ak sú príznaky závažné, liek sa má okamžite vysadiť.
Potenciál zneužívania
U pacientov so zneužívaním látok v anamnéze sa má postupovať opatrne a u pacienta sa majú
sledovať príznaky zneužívania perampanelu.
Súbežné antiepileptikáindukujúceCYP3A
Miery odpovede po pridaní perampanelu vo fixných dávkach boli nižšie, keď pacienti dostávali
súbežne antiepileptiká indukujúce enzým CYP3A (karbamazepín, fenytoín, oxkarbazepín),
v porovnaní s mierami odpovede u pacienta, ktorý dostával súbežne antiepileptiká neindukujúce
enzýmy. Odpoveď pacienta sa má sledovať pri prechode zo súbežne podávaného neindukujúceho antiepileptika na antiepileptikum indukujúce enzým a naopak. V závislosti od individuálnej klinickej odpovede a znášanlivosti sa môže dávka súčasne zvýšiť alebo znížiť o 2 mg (pozri časť 4.2).
Iné súbežné(ne-antiepileptické)liekyindukujúcealeboinhibujúce cytochrómP450
U pacientov sa má starostlivo sledovať znášanlivosť a klinická odpoveď po pridaní alebo vysadení
induktorov alebo inhibítorov cytochrómu P450, pretože plazmatické hladiny perampanelu sa môžu znížiť alebo zvýšiť; dávku perampanelu bude možno potrebné podľa toho upraviť.
Fycompa obsahuje laktózu, preto pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Fycompa sa nepovažuje za silného induktora ani inhibítora enzýmov cytochrómu P450 alebo UGT (pozri časť 5.2).
Perorálne kontraceptíva
U zdravých žien užívajúcich 12 mg (nie však 4 ani 8 mg/deň) súbežne s kombinovaným perorálnym
kontraceptívom počas 21 dní sa preukázalo, že Fycompa znižuje expozíciu levonorgestrelu (priemerné hodnoty Cmax a AUC sa znížili o 40 %). Fycompa v dávke 12 mg neovplyvňovala AUC etinylestradiolu, zatiaľ čo Cmax sa znížilo o 18 %. Preto sa má u žien vyžadujúcich Fycompu v dávke
12 mg/deň vziať do úvahy možnosť zníženej účinnosti perorálnych kontraceptív obsahujúcich
progesterón a má sa používať dodatočná spoľahlivá metóda (vnútromaternicové teliesko - IUD,
prezervatív) (pozri časť 4.4).
Interakcie medziFycompoua inýmiantiepileptikami
V klinických štúdiách sa určovali potenciálne interakcie medzi Fycompou (až do 12 mg jedenkrát
denne) a inými antiepileptikami (AE) a hodnotili sa v populačnej FK analýze štyroch združených štúdií fázy 3 vrátane pacientov s parciálnymi záchvatmi a primárne generalizovanými tonicko- klonickými záchvatmi. Vplyv týchto interakcií na priemernú koncentráciu v rovnovážnom stave je zhrnutý v nasledujúcej tabuľke.
Súbežn
e podávané
AE
Vplyv AE na koncentráciu
Fycompy
Vply
v Fycompy na
k
o
ncentráciu AE

Karbamazepín 2,75-násobné zníženie < 10% zníženie Klobazam Žiadny vplyv < 10% zníženie Klonazepam Žiadny vplyv Žiadny vplyv Lamotrigín Žiadny vplyv < 10% zníženie Levetiracetam Žiadny vplyv Žiadny vplyv Oxkarbazepín 1,9-násobné zníženie 35% zvýšenie 1) Fenobarbital Žiadny vplyv Žiadny vplyv Fenytoín 1,7-násobné zníženie Žiadny vplyv Topiramát 19% zníženie Žiadny vplyv Kyselina valproová Žiadny vplyv < 10% zníženie Zonisamid Žiadny vplyv Žiadny vplyv
1) Aktívny metabolit monohydroxykarbazepín sa nehodnotil.
Preukázalo sa, že niektoré antiepileptiká, známe ako induktory enzýmov (karbamazepín, fenytoín, oxkarbazepín), zvyšujú klírens perampanelu a následne znižujú plazmatické koncentrácie perampanelu.
Karbamazepín, známy silný induktor enzýmov, znížil hladiny perampanelu o dve tretiny v štúdii uskutočnenej u zdravých osôb.
Podobný výsledok sa pozoroval v populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi perampanel v dávke až do 12 mg/deň a pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcimi perampanel v dávke až do 8 mg/deň v placebom kontrolovaných klinických štúdiách. Celkový klírens Fycompy sa zvýšil pri podávaní
s karbamazepínom (2,75-násobne), s fenytoínom (1,7-násobne) a s oxkarbazepínom (1,9-násobne), ktoré sú známymi induktormi enzýmov metabolizmu (pozri časť 5.2). Tento vplyv sa má vziať do úvahy a riešiť po pridaní alebo vysadení týchto antiepileptík z liečebného režimu pacienta.
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi Fycompu
v dávke až do 12 mg/deň v placebom kontrolovaných klinických štúdiách Fycompa neovplyvňovala klinicky významným spôsobom klírens klonazepamu, levetiracetamu, fenobarbitalu, fenytoínu, topiramátu, zonisamidu, karbamazepínu, klobazamu, lamotrigínu a kyseliny valproovej, pri najvyššej hodnotenej dávke perampanelu (12 mg/deň).
V populačnej farmakokinetickej analýze epilepsie sa zistilo, že perampanel znižuje klírens oxkarbazepínu o 26 %. Oxkarbazepín sa rýchlo metabolizuje cytozolovým reduktázovým enzýmom na aktívny metabolit, monohydroxykarbazepín. Vplyv perampanelu na koncentrácie monohydroxykarbazepínu nie je známy.
Perampanel sa dávkuje do klinického účinku bez ohľadu na iné AE.
V
p
lyv perampanelunasubstrátyCYP3A
U zdravých jedincov znížila Fycompa (v dávke 6 mg jedenkrát denne počas 20 dní) AUC midazolamu
o 13 %. Väčšie zníženie expozície midazolamu (alebo iných citlivých substrátov CYP3A) pri vyšších dávkach Fycompy nie je možné vylúčiť.
Vplyv induktorovcytochrómuP450nafarmakokinetikuperampanelu
Predpokladá sa, že silné induktory cytochrómu P450, ako je rifampicín a ľubovník, znižujú
koncentrácie perampanelu a v ich prítomnosti nebolo možné vylúčiť potenciál vyšších plazmatických koncentrácií reaktívnych metabolitov. Preukázalo sa, že felbamát znižuje koncentrácie niektorých liekov a môže tiež znížiť koncentrácie perampanelu.
Vplyv inhibítorovcytochrómuP450nafarmakokinetikuperampanelu
U zdravých jedincov zvýšil inhibítor CYP3A4 ketokonazol (400 mg jedenkrát denne počas 10 dní)
AUC perampanelu o 20 % a predĺžil polčas perampanelu o 15 % (67,8 h oproti 58,4 h). Pri kombinácii perampanelu s inhibítorom CYP3A4 s dlhším polčasom ako má ketokonazol alebo keď sa inhibítor podáva počas dlhšie trvajúcej liečby, nie je možné vylúčiť väčší vplyv.
Levodopa
U zdravých jedincov nemala Fycompa (v dávke 4 mg jedenkrát denne počas 19 dní) žiadny vplyv na
Cmax ani AUC levodopy.
Alkohol
Účinky perampanelu na činnosti vyžadujúce bdelosť a ostražitosť, ako je schopnosť viesť vozidlá, boli
aditívne alebo supraaditívne k účinkom samotného alkoholu, ako sa zistilo vo farmakodynamickej interakčnej štúdii u zdravých jedincov. Opakované dávkovanie perampanelu 12 mg/deň zvýšilo úroveň hnevu, zmätenosti a depresie, ako to bolo hodnotené pomocou 5-bodovej hodnotiacej škály Profilu náladového stavu (pozri časť 5.1). Tieto účinky sa môžu pozorovať aj pri používaní Fycompy v kombinácii s inými látkami s tlmivým účinkom na centrálny nervový systém (CNS).
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
V populačnej farmakokinetickej analýze dospievajúcich pacientov v klinických štúdiách fázy 3 neboli
žiadne výrazné rozdiely medzi touto populáciou a celkovou populáciou.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomvekua antikoncepciau mužova žien
Fycompu sa neodporúča užívať u žien vo fertilnom veku nepoužívajúcich antikoncepciu, pokiaľ to nie
je jednoznačne nevyhnutné.
Gravidita
Existuje iba obmedzené množstvo údajov (menej ako 300 ukončených gravidít) o použití perampanelu
u gravidných žien. Štúdie u zvierat nepreukázali žiadne teratogénne účinky u potkanov ani králikov,
avšak u potkanov bola pozorovaná embryotoxicita pri dávkach toxických pre matku (pozri časť 5.3). Fycompu sa neodporúča užívať počas gravidity.
Dojčenie
Štúdie u laktujúcich potkanov preukázali vylučovanie perampanelu a/alebo jeho metabolitov do
mlieka (podrobnosti pozri v časti 5.3). Nie je známe, či sa perampanel vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu Fycompou, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
V štúdiách fertility u potkanov sa u samíc pri podávaní vysokých dávok (30 mg/kg) pozoroval
predĺžený a nepravidelný estrálny cyklus; tieto zmeny však neovplyvňovali fertilitu a včasný embryonálny vývoj. Nezistili sa žiadne účinky na fertilitu mužov (pozri časť 5.3). Vplyv perampanelu na fertilitu ľudí sa nestanovil.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Fycompa má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Perampanel môže spôsobiť závraty a ospalosť a preto môže ovplyvňovať schopnosť viesť vozidlá
alebo obsluhovať stroje. Pacientom sa neodporúča viesť vozidlá, obsluhovať zložité stroje ani vykonávať iné potenciálne nebezpečné činnosti, kým nebude známe, či perampanel ovplyvňuje ich schopnosť vykonávať tieto úlohy (pozri časti 4.4 a 4.5).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Vo všetkých kontrolovaných a nekontrolovaných klinických štúdiách u pacientov s parciálnymi
záchvatmi užívalo 1 639 osôb perampanel, z ktorých 1 147 bolo liečených 6 mesiacov a 703 dlhšie ako 12 mesiacov.
V kontrolovanej a nekontrolovanej klinickej štúdii u pacientov s primárne generalizovanými tonicko- klonickými záchvatmi užívalo 114 osôb perampanel, z ktorých 68 bolo liečených 6 mesiacov
a 36 dlhšie ako 12 mesiacov.
Nežiaduce reakcie vedúce k vysadeniu: V kontrolovaných klinických štúdiách parciálnych záchvatov fázy 3 bola miera vysadenia v dôsledku nežiaducej reakcie 1,7 %, 4,2 % a 13,7 % u pacientov randomizovaných pre užívanie perampanelu v odporúčaných dávkach 4 mg, 8 mg a 12 mg/deň,
v uvedenom poradí, a 1,4 % u pacientov randomizovaných pre užívanie placeba. Nežiaduce reakcie, ktoré najčastejšie (≥ 1 % v celkovej perampanelovej skupine a častejšie ako pri placebe) viedli
k vysadeniu liečby, boli závrat a ospalosť.
V kontrolovanej klinickej štúdii primárne generalizovaných tonicko-klonických záchvatov fázy 3 bola miera vysadenia v dôsledku nežiaducej reakcie 4,9 % u pacientov randomizovaných pre užívanie perampanelu v dávke 8 mg, a 1,2 % u pacientov randomizovaných pre užívanie placeba. Nežiaduca reakcia, ktorá najčastejšie (≥ 2 % v celkovej perampanelovej skupine a častejšie ako pri placebe)
viedla k vysadeniu liečby, bola závrat.
Zoznam nežiaducich reakcií zoradených dotabuľky
V nižšie uvedenej tabuľke sú nežiaduce reakcie, ktoré boli identifikované na základe posúdenia
kompletnej bezpečnostnej databázy klinických štúdií s Fycompou, zoradené podľa triedy orgánových systémov a frekvencie. Na klasifikáciu nežiaducich reakcií bola použitá nasledujúca konvencia: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
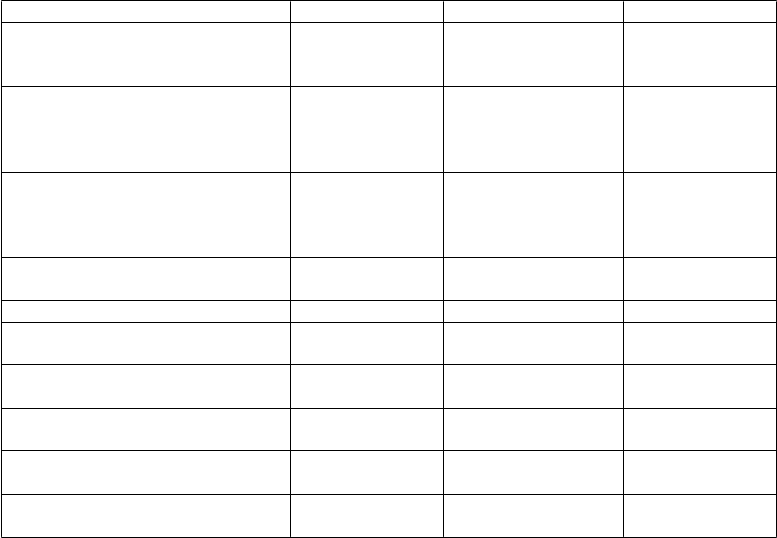
Trieda orgánových systémov Veľmi časté Časté Menej časté
Poruchy metabolizmu a výživy Znížená chuť do jedla
Zvýšená chuť do
jedla
Psychick
é poruchy Agresivita Hnev Úzkosť
Stav zmätenosti
Samovražedné myšlienky Samovražedný pokus
Poruchy nervového systému Závrat
Ospalosť
Ataxia
Dyzartria
Porucha rovnováhy
Podráždenosť
Poruch
y oka Diplopia
Rozmazané videnie
Poruchy ucha a labyrintu Vertigo
Poruch
y gastrointestinálneho traktu
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Celkové poruchy a reakcie v mieste podania
Nauzea
Bolesť chrbta
Porucha chôdze
Únava
Laboratórn
e a funkčné vyšetrenia Zvýšená telesná hmotnosť
Úrazy
, otravy a komplikácie liečebného postupu
Pád
 Pediatrick
á
populácia
Pediatrick
á
populácia
Na základe databázy klinických štúdií so 196 dospievajúcimi, ktorým sa podával perampanel v dvojito
zaslepených štúdiách parciálnych záchvatov a primárne generalizovaných tonicko-klonických
záchvatov, bol bezpečnostný profil u dospievajúcich podobný profilu u dospelých, okrem agresivity, ktorá sa pozorovala častejšie u dospievajúcich ako u dospelých.
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieS predávkovaním perampanelu u ľudí sú len obmedzené klinické skúsenosti. V správe o úmyselnom predávkovaní po užití dávky až 264 mg sa u pacienta vyskytovali príhody zmeneného duševného stavu, agitácia a agresívne správanie a zotavil sa bez následkov. K dispozícii nie je žiadne špecifické
antidotum k účinkom perampanelu. Indikovaná je všeobecná podporná starostlivosť o pacienta vrátane monitorovania vitálnych znakov a sledovania klinického stavu pacienta. Vzhľadom na jeho dlhý
polčas môžu účinky spôsobené perampanelom trvať dlhšie. Z dôvodu nízkeho renálneho klírensu
nebudú mať pravdepodobne význam špeciálne zásahy ako forsírovaná diuréza, dialýza alebo hemoperfúzia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.
1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiepileptiká, iné antiepileptiká, ATC kód: N03AX22
Mechanizmus účinku
Perampanel je prvý vo svojej triede, selektívny, nekompetitívny antagonista inotropného receptora α-
amino-3-hydroxy-5-metyl-4-izoxazolpropiónovej kyseliny (α-amino-3-hydroxy-5-methyl-4- isoxazolepropionic acid - AMPA) glutamátu na postsynaptických neurónoch. Glutamát je primárny excitačný neurotransmiter v centrálnom nervovom systéme a je zapletený do veľkého počtu neurologických porúch zapríčinených neuronálnou hyperexcitáciou. Aktivácia AMPA receptorov glutamátom je pravdepodobne zodpovedná za väčšinu rýchlo excitačnej synaptickej transmisie
v mozgu. V in vitro štúdiách perampanel nesúťažil s AMPA vo väzbe na AMPA receptor, perampanel bol však vytesnený z väzby nekompetitívnymi antagonistami AMPA receptora, čo svedčí o tom, že perampanel je nekompetitívny antagonista AMPA receptora. In vitro perampanel inhiboval zvýšenie intracelulárneho vápnika indukovaného AMPA (nie však indukovaného NMDA). In vivo perampanel významne predlžoval latenciu záchvatov v modeli záchvatu indukovaného AMPA.
Presný mechanizmus, ktorým perampanel vykazuje svoje antiepileptické účinky u ľudí, je potrebné ešte úplne objasniť.
Farmakodynamické účinky
Farmakokineticko-farmakodynamická analýza (účinnosti) sa uskutočnila na základe združených
údajov z 3 klinických skúšaní účinnosti pri parciálnych záchvatoch. Okrem toho sa uskutočnila farmakokineticko-farmakodynamická analýza (účinnosti) v jednej klinickej štúdii pri primárne generalizovaných tonicko-klonických záchvatoch. V obidvoch analýzach je expozícia perampanelu vo vzájomnom vzťahu so znížením frekvencie záchvatov.
Psychomotorická výkonnosť
Jednotlivé a opakované dávky 8 mg a 12 mg zhoršovali psychomotorickú výkonnosť u zdravých
dobrovoľníkov spôsobom závislým od dávky. Účinky perampanelu na zložité úlohy, ako je schopnosť viesť vozidlá, boli aditívne alebo supraaditívne k tlmivým účinkom alkoholu. Psychomotorická výkonnosť sa obnovila na pôvodnú úroveň v priebehu 2 týždňov od skončenia podávania
perampanelu.
Kognitívna funkcia
V štúdii hodnotiacej účinky perampanelu na bdelosť a pamäť použitím štandardnej série hodnotení sa
u zdravých dobrovoľníkov nezistili žiadne účinky perampanelu po jednorazových a opakovaných dávkach perampanelu až do 12 mg/deň.
Bdelosť a nálada
Úroveň bdelosti (ostražitosti) sa znížila spôsobom závislým od dávky u zdravých osôb, ktoré dostávali perampanel v dávke od 4 do 12 mg/deň. Nálada sa zhoršila len po podaní dávky 12 mg/deň; zmeny nálady boli malé a odzrkadľovali celkové zníženie bdelosti. Opakované dávkovanie perampanelu
12 mg/deň tiež zvýšilo účinky alkoholu na ostražitosť a bdelosť a zvýšilo úroveň hnevu, zmätenosti a depresie meranú pomocou 5-bodovej hodnotiacej škály profilu stavu nálady.
Elektrofyziológia srdca
Perampanel nepredlžoval QTc interval pri podávaní denných dávok až do 12 mg/deň a nevykazoval účinok závislý od dávky ani klinicky významný účinok na trvanie QRS.
Klinická účinnosťa bezpečnosť
Parciálne záchvaty
Účinnosť perampanelu pri parciálnych záchvatoch bola stanovená v troch 19-týždňových, randomizovaných, dvojito zaslepených, placebom kontrolovaných, multicentrických klinických štúdiách s prídavnou liečbou u dospelých a dospievajúcich pacientov. Jedinci mali parciálne záchvaty so sekundárnou generalizáciou alebo bez nej a neboli primerane kontrolovaní jedným až troma súbežne podávanými AE. Počas 6-týždňového východiskového obdobia bolo potrebné, aby jedinci mali viac ako päť záchvatov s obdobím bez záchvatov neprekračujúcim 25 dní. V týchto troch
klinických štúdiách mali jedinci priemerné trvanie epilepsie približne 21,06 rokov. V rozmedzí 85,3 % a 89,1 % pacientov užívalo dva až tri súbežne podávané AE so súčasnou vagálnou nervovou stimuláciou alebo bez nej.
Dve štúdie (štúdia 304 a 305) porovnávali dávky 8 a 12 mg perampanelu/deň s placebom a tretia štúdia (štúdia 306) porovnávala dávky 2, 4 a 8 mg perampanelu/deň s placebom. Vo všetkých troch klinických štúdiách po 6-týždňovej východiskovej fáze na stanovenie východiskovej frekvencie záchvatov pred randomizáciou boli osoby randomizované a titrované do randomizovanej dávky. Počas titračnej fázy vo všetkých troch klinických štúdiách sa liečba začala dávkou 2 mg/deň a bola
zvyšovaná v týždňových prírastkoch po 2 mg/deň až po cieľovú dávku. Osoby, u ktorých sa
vyskytovali netolerovateľné nežiaduce príhody, mohli zostať na rovnakej dávke alebo ich dávka bola znížená na poslednú tolerovanú dávku. Vo všetkých troch klinických štúdiách po titračnej fáze nasledovala udržiavacia fáza, ktorá trvala 13 týždňov, počas ktorej boli pacienti udržiavaní na stabilnej dávke perampanelu.
Združené 50 %-né miery odpovede boli pri placebe 19 %, pri 4 mg 29 %, pri 8 mg 35 % a pri 12 mg
35 %. Štatisticky významný vplyv na zníženie frekvencie záchvatov počas 28 dní (od východiskovej
po liečebnú fázu) v porovnaní s placebovou skupinou sa pozoroval pri liečbe perampanelom v dávke
4 mg/deň (štúdia 306), 8 mg/deň (štúdie 304, 305 a 306) a 12 mg/deň (štúdie 304 a 305). 50 %-ná miera odpovede v kombinácii s antiepileptikami indukujúcimi enzým bola v skupine so 4 mg 23,0 %, v skupine s 8 mg 31,5 % a v skupine s 12 mg 30,0 % a keď sa podával perampanel v kombinácii s antiepileptikami neindukujúcimi enzým 33,3 %, 46,5 % a 50,0 %, v uvedenom poradí. Tieto štúdie preukazujú, že podávanie perampanelu raz denne v dávkach 4 mg až 12 mg bolo významne účinnejšie ako placebo vo forme prídavnej liečby v tejto populácii.
Údaje z placebom kontrolovaných štúdií dokazujú, že zlepšenie kontroly záchvatov sa pozorovalo pri dávkovaní perampanelu 4 mg raz denne a tento účinok sa zvýšil pri zvýšení dávky na 8 mg/deň. Pri dávke 12 mg v porovnaní s dávkou 8 mg sa v celkovej populácii nepozoroval žiadny prínos v účinnosti. Prínos sa pozoroval pri dávke 12 mg u niektorých pacientov, ktorí tolerujú dávku 8 mg
a u ktorých je klinická odpoveď na túto dávku nedostatočná. Klinicky významné zníženie frekvencie záchvatov v porovnaní s placebom sa dosiahlo už po druhom týždni podávania, keď pacienti dosiahli dennú dávku 4 mg.
1,7 až 5,8 % pacientov na perampanele v klinických štúdiách nemalo záchvat počas 3-mesačného udržiavacieho obdobia v porovnaní s 0 % - 1,0 % pri placebe. Nie sú k dispozícii žiadne údaje týkajúce sa účinkov vysadenia súbežne podávaných antiepiletík na dosiahnutie monoterapie perampanelom.
Nezaslepené rozšírené štúdie
Deväťdesiatsedem percent pacientov, ktorí dokončili randomizované klinické štúdie u pacientov s parciálnymi záchvatmi, bolo zaradených do nezaslepenej rozšírenej štúdie (n = 1 186). Pacienti
z randomizovanej klinickej štúdie boli prevedení na perampanel v priebehu 16 týždňov, po ktorých nasledovalo dlhodobé udržiavacie obdobie (≥ 1 rok). Priemerná denná dávka bola 10,05 mg.
Primárne generalizované tonicko-klonické záchvaty
Perampanel ako prídavná liečba u pacientov vo veku 12 rokov a starších s idiopatickou generalizovanou epilepsiou s primárne generalizovanými tonicko-klonickými záchvatmi, bol zavedený
v multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii (štúdia 332). Vhodní pacienti na stabilnej dávke 1 až 3 antiepileptík, u ktorých sa vyskytli aspoň 3 primárne generalizované tonicko-klonické záchvaty počas 8 týždňov úvodného obdobia, boli randomizovaní buď pre užívanie perampanelu alebo pre užívanie placeba. Populácia zahŕňala 164 pacientov (perampanel N = 82, placebo N = 82). U pacientov sa po dobu štyroch týždňov titrovala dávka do cieľovej dávky 8 mg na deň alebo najvyššej tolerovanej dávky a ďalších 13 týždňov pokračovala liečba poslednou úrovňou dávky dosiahnutej na konci titrovacieho obdobia. Celková doba liečby bola
17 týždňov. Študovaný liek sa podával raz denne.
50 %-ná miera odpovede pri primárne generalizovaných tonicko-klonických záchvatoch bola počas udržiavacieho obdobia signifikantne vyššia v skupine s perampanelom (58,0 %) ako v skupine
s placebom (35,8 %), P=0,0059. 50 %-ná miera odpovede bola 22,2 % v kombinácii s antiepileptikami indukujúcimi enzým a 69,4 % pri podávaní perampanelu v kombinácii s antiepileptikami neindukujúcimi enzým. Počet osôb v skupine s perampanelom užívajúcich antiepileptiká indukujúce enzým bol malý (n = 9). Mediánová percentuálna zmena frekvencie pri primárne generalizovaných tonicko-klonických záchvatoch za 28 dní počas titrácie a udržiavacieho obdobia (kombinovaná) vzhľadom k prerandomizácii bola väčšia s perampanelom (-76,5 %) ako s placebom (-38,4 %), P<0,0001. V priebehu 3-mesačného udržiavacieho obdobia, 30,9 % (25/81) pacientov na perampanele v klinických štúdiách nemalo primárne generalizované tonicko-klonické záchvaty v porovnaní
s 12,3 % (10/81) na placebe.
Ostatné podtypy idiopatických generalizovaných záchvatov
Účinnosť a bezpečnosť perampanelu u pacientov s myoklonickými záchvatmi nebola stanovená.
Dostupné údaje sú nedostatočné na dosiahnutie akýchkoľvek záverov. Účinnosť perampanelu v liečbe záchvatov absencií nebola preukázaná.
V štúdii 332 u pacientov s PGTC záchvatmi, ktorí tiež mali súbežné myoklonické záchvaty, stav bez
záchvatov bol dosiahnutý u 16,7 % (4/24) na perampanele v porovnaní s 13,0 % (3/23) na placebe. U pacientov so sprievodnými záchvatmi absencií bol stav bez záchvatov dosiahnutý u 22,2 % (6/27) na perampanele v porovnaní s 12,1 % (4/33) na placebe. Stav bez všetkých záchvatov bol u 23,5 % (19/81) pacientov na perampanele v porovnaní so 4,9 % (4/81) pacientov na placebe.
Nezaslepená rozšírená fáza
Zo 140 osôb, ktorí dokončili štúdiu 332, 114 osôb (81,4 %) vstúpilo do rozšírenej fázy. Pacienti
z randomizovanej klinickej štúdie boli prevedení na perampanel počas 6 týždňov s následným dlhodobým udržiavacím obdobím (≥ 1 rok). V rozšírenej fáze malo 73,7 % osôb modálnu dennú dávku perampanelu väčšiu ako 4 až 8 mg/deň a 16,7 % malo modálnu dennú dávku väčšiu ako 8 až
12 mg/deň. Pokles vo frekvencii primárne generalizovaných tonicko-klonických záchvatov aspoň
o 50 % sa pozoroval u 65,9 % osôb po roku liečby počas rozšírenej fázy (v porovnaní s východiskovou frekvenciou záchvatov pred liečbou perampanelom). Tieto údaje boli zhodné s tými pre percentuálnu zmenu frekvencie záchvatov a preukázali, že 50 %-ná miera odpovede pri primárne generalizovaných tonicko-klonických záchvatoch bola všeobecne stabilná v čase od 26. týždňa do konca 2. roku.
Podobné výsledky sa pozorovali, keď boli v priebehu času zhodnotené všetky záchvaty a absencie vs. myoklonické záchvaty.
Konverzia na monoterapiu
Nie sú k dispozícii žiadne údaje týkajúce sa účinkov vysadenia súbežne podávaných antiepiletík na
dosiahnutie monoterapie perampanelom.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Fycompou
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri epilepsii odolnej voči liečbe (epileptické syndrómy závislé od lokalizácie a veku) (informácie o použití u dospievajúcich, pozri časť 4.2).
Tri pivotné, dvojito zaslepené, placebom kontrolované štúdie fázy 3 zahŕňali 143 dospievajúcich vo vekovom rozmedzí 12 až 18 rokov. Výsledky u týchto dospievajúcich boli podobné ako výsledky pozorované u dospelej populácie.
Štúdia 332 zahŕňala 22 dospievajúcich vo vekovom rozmedzí 12 až 18 rokov. Výsledky u týchto dospievajúcich boli podobné ako výsledky pozorované u dospelej populácie.
5.2 Farmakokinetické vlastnosti
Farmakokinetika perampanelu sa skúmala u zdravých dospelých jedincov (vo veku 18 až 79 rokov), u dospelých a dospievajúcich s parciálnymi záchvatmi a primárne generalizovanými tonicko- klonickými záchvatmi, u dospelých s Parkinsonovou chorobou, u dospelých s diabetickou neuropatiou, u dospelých so sklerózou multiplex a u osôb s poruchou funkcie pečene.
Absorpcia
Perampanel sa ľahko absorbuje po perorálnom podaní bez dôkazu o zjavnom metabolizme prvého
prechodu pečeňou. Spoločné podávanie tabliet perampanelu s jedlom s vysokým obsahom tuku nemá vplyv na maximálnu plazmatickú koncentráciu (Cmax) alebo na celkovú expozíciu perampanelu (AUC0-inf). Hodnota Tmax bola oneskorená približne o 1 hodinu v porovnaní s dávkovaním nalačno.
Distribúcia
Údaje z in vitro štúdií naznačujú, že približne 95 % perampanelu sa viaže na plazmatické proteíny.
In vitro štúdie preukázali, že perampanel nie je substrátom ani významným inhibítorom organických aniónových transportných polypeptidov (organic anion transporting polypeptides - OATP) 1B1 a 1B3, organických aniónových transportérov (organic anion transporters - OAT) 1, 2, 3 a 4, organických katiónových transportérov (organic cation transporters - OCT) 1, 2 a 3 a efluxných transportérov
P-glykoproteínu a proteínu rezistencie rakoviny prsníka (Breast Cancer Resistance Protein - BCRP).
Biotransformácia
Perampanel sa v značnej miere metabolizuje primárnou oxidáciou a postupnou glukuronidáciou.
Metabolizmus perampanelu je sprostredkovaný primárne CYP3A na základe výsledkov klinickej štúdie na zdravých dobrovolníkoch, ktorým bol podaný rádioaktívne označený perampanel a in vitro štúdií, v ktorých sa použili rekombinantné ľudské CYP a ľudské pečeňové mikrozómy.
Po podaní rádioaktívne označeného perampanelu sa v plazme pozorovali len stopové množstvá metabolitov perampanelu.
Eliminácia
Po podaní dávky rádioaktívne označeného perampanelu buď 8 zdravým dospelým alebo starším
jedincom sa približne 30 % vylúčenej rádioaktivity zistilo v moči a 70 % v stolici. V moči a v stolici vylúčená rádioaktivita pozostávala predovšetkým zo zmesi oxidatívnych a konjugovaných metabolitov. V populačnej farmakokinetickej analýze združených údajov z 19 štúdií fázy 1 bol priemerný t1/2 perampanelu 105 hodín. Pri podávaní v kombinácii so silným induktorom CYP3A4 karbamazepínom bol priemerný t1/2 perampanelu 25 hodín.
Linearita/nelinearita
U zdravých osôb sa plazmatické koncentrácie perampanelu zvýšili priamo úmerne s podávanými
dávkami v rozmedzí 2 až 12 mg. V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi perampanel až do 12 mg/deň a pacientov s primárne generalizovanými tonicko-
klonickými záchvatmi užívajúcimi perampanel až do 8 mg/deň v placebom kontrolovaných klinických štúdiách sa zistil lineárny vzťah medzi dávkou a plazmatickými koncentráciami perampanelu.
Osobitné skupinypacientov
Porucha funkcie pečene
Farmakokinetika perampanelu po jednorazovej dávke 1 mg bola hodnotená u 12 osôb s ľahkou a stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre A a B, v uvedenom poradí)
v porovnaní s 12 zdravými demograficky zodpovedajúcimi osobami. Priemerný zjavný klírens
neviazaného perampanelu u pacientov s ľahkou poruchou bol 188 ml/min oproti 338 ml/min
u zodpovedajúcich kontrol a u jedincov so stredne ťažkou poruchou bol 120 ml/min oproti 392 ml/min u zodpovedajúcich kontrol. Hodnota t1/2 bola dlhšia u osôb s ľahkou poruchou (306 h oproti 125 h)
a u osôb so stredne ťažkou poruchou (295 h oproti 139 h) v porovnaní so zodpovedajúcimi zdravými
jedincami.
Porucha funkcie obličiek
Farmakokinetika perampanelu sa oficiálne nehodnotila u pacientov s poruchou funkcie obličiek. Perampanel je eliminovaný takmer výlučne metabolizmom, po ktorom nasleduje rýchle vylučovanie metabolitov; v plazme sa pozorovali len stopové množstvá metabolitov perampanelu. V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi s klírensom kreatinínu v rozmedzí od 39 do 160 ml/min a užívajúcich perampanel v dávke až do 12 mg/deň v placebom kontrolovaných klinických štúdiách nebol klírens perampanelu ovplyvnený klírensom kreatinínu. V populačnej farmakokinetickej analýze pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcich perampanel v dávke až do 8 mg/deň v placebom kontrolovanej klinickej štúdii, nebol klírens perampanelu ovplyvnený hodnotou klírensu kreatinínu nameraného na začiatku štúdie (baseline).
Pohlavie
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcich perampanel v dávke až do 12 mg/deň a pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcich perampanel v dávke až do 8 mg/deň v placebom kontrolovaných klinických štúdiách bol klírens perampanelu u žien (0,54 l/h) o 18 % nižší ako u mužov (0,66 l/h).
Starší pacienti (vo veku 65 rokov a viac)
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi (vekové rozmedzie 12 až
74 rokov) a primárne generalizovanými tonicko-klonickými záchvatmi (vekové rozmedzie 12 až
58 rokov) a užívajúcich perampanel v dávke až do 8 alebo 12 mg/deň v placebom kontrolovaných klinických štúdiách sa nezistil žiadny významný vplyv veku na klírens perampanelu. Úprava dávkovania u starších pacientov nie je potrebná (pozri časť 4.2).
Pediatrická populácia
V populačnej farmakokinetickej analýze dospievajúcich pacientov v klinických štúdiách fázy 3 neboli žiadne významné rozdiely medzi touto populáciou a celkovou populáciou.
Liekové interakčnéštúdie
In vitro hodnotenie liekových interakcií
Inhibícia enzýmu metabolizujúceho liečivo
V ľudských pečeňových mikrozómoch mal perampanel (30 μmol/l) slabý inhibičný účinok na
CYP2C8 a UGT1A9 v skupine dôležitejších hepatálnych enzýmov CYP a UGT.
Indukcia enzýmu metabolizujúceho liečivo
Zistilo sa, že perampanel v porovnaní s pozitívnymi kontrolami (vrátane fenobarbitalu, rifampicínu) slabo indukuje CYP2B6 (30 µmol/l) a CYP3A4/5 (≥ 3 µmol/l) v skupine dôležitejších hepatálnych CYP a UGT enzýmov v kultivovaných ľudských hepatocytoch.
5.
3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie, boli tieto:
V štúdii fertility u potkanov sa pozoroval predĺžený a nepravidelný estrálny cyklus pri maximálnej tolerovanej dávke (30 mg/kg) u samíc; tieto zmeny však neovplyvňovali fertilitu a včasný embryonálny vývoj. Nezistili sa žiadne účinky na fertilitu samcov.
Vylučovanie do materského mlieka sa meralo u potkanov 10 dní po pôrode. Hladiny dosiahli maximum za jednu hodinu a boli 3,65-násobkom hladín v plazme.
V toxikologickej štúdii prenatálneho a postnatálneho vývoja u potkanov sa pozorovali abnormálny pôrod a dojčenie pri dávkach toxických pre matku a počet narodených mŕtvych plodov sa u potomkov zvýšil. Behaviorálny a reprodukčný vývoj potomstva nebol ovplyvnený, niektoré parametre fyzického vývoja však preukázali malé oneskorenie, ktoré je pravdepodobne sekundárne k CNS účinkom perampanelu vychádzajúcich z farmakológie. Prechod placentou bol relatívne nízky; 0,09 % alebo menej podanej dávky sa zistilo v plode.
Predklinické údaje preukázali, že perampanel nie je genotoxický a nemá karcinogénny potenciál. Podávanie maximálnych tolerovaných dávok u potkanov a opíc malo za následok CNS klinické prejavy vychádzajúce z farmakológie a zníženú terminálnu telesnú hmotnosť. Nezistili sa žiadne zmeny, ktoré možno pripísať priamo perampanelu v klinickej patológii alebo histopatológii.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Fycompa 2 mg,4 mgfilmomobalenétablety
Jadro
monohydrát laktózy
nízko substituovaná hydroxypropylcelulóza povidón K-29/32
magnéziumstearát (E470b)
Fycompa 6 mg,8 mg,10 mg,12 mgfilmomobalenétablety
Jadro
monohydrát laktózy
nízko substituovaná hydroxypropylcelulóza
povidón K-29/32 mikrokryštalická celulóza magnéziumstearát (E470b)
Fycompa 2 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec makrogol 8000
oxid titaničitý (E171) žltý oxid železitý (E172) červený oxid železitý (E172)
Fycompa 4 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec
makrogol 8000
oxid titaničitý (E171)
červený oxid železitý (E172)
Fycompa 6 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec makrogol 8000
oxid titaničitý (E171)
červený oxid železitý (E172)
Fycompa 8 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec makrogol 8000
oxid titaničitý (E171)
červený oxid železitý (E172)
čierny oxid železitý (E172)
Fycompa 10 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec makrogol 8000
oxid titaničitý (E171)
žltý oxid železitý (E172)
hlinitý lak indigotínu (E132)
Fycompa 12 mgfilmomobalenétablety
Filmotvornávrstva
hypromelóza 2910
mastenec makrogol 8000
oxid titaničitý (E171)
hlinitý lak indigotínu (E132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
5 rokov
6.
4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPVC/hliníkové pretlačovacie balenia
Fycompa2 mgfilmomobalenétabletyBalenie 7 tabliet pre dávkovanie len v prvom týždni, 28 a 98.
Fycompa4 mgfilmomobalenétablety4 mg - balenie 7, 28, 84 a 98
Fycompa6 mgfilmomobalenétablety6 mg - balenie 7, 28, 84 a 98
Fycompa8 mgfilmomobalenétablety8 mg - balenie 7, 28, 84 a 98
Fycompa10 mgfilmomobalenétablety10 mg - balenie 7, 28, 84 a 98
Fycompa12 mgfilmomobalenétablety12 mg - balenie 7, 28, 84 a 98
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEisai Europe Limited European Knowledge Centre Mosquito Way
Hatfield Hertfordshire AL10 9SN Veľká Británia
tel: +44 (0)208 600 1400
fax: +44 (0)208 600 1401
e-mail:
EUmedinfo@eisai.net8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/12/776/001-0023
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 23/07/2012
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUFycompa 0,5 mg/ml perorálna suspenzia
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každý ml perorálnej suspenzie obsahuje 0,5 mg perampanelu. Každá 340 ml fľaša obsahuje 170 mg perampanelu
Pomocnálátkasoznámymúčinkom:Každý ml perorálnej suspenzie obsahuje 175 mg sorbitolu (E420). Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAPerorálna suspenzia
Biela až takmer biela suspenzia
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieFycompa je indikovaná na prídavnú liečbu parciálnych záchvatov so sekundárne generalizovanými záchvatmi alebo bez nich dospelým a dospievajúcim pacientom vo veku 12 rokov a starším
s epilepsiou.
Fycompa je indikovaná na prídavnú liečbu primárne generalizovaných tonicko-klonických záchvatov dospelým a dospievajúcim pacientom od 12 rokov s idiopatickou generalizovanou epilepsiou (pozri časť 5.1).
4.2 Dávkovanie a spôsob podávaniaDávkovanieFycompa sa musí titrovať podľa individuálnej odpovede pacienta, aby sa optimalizovala rovnováha
medzi účinnosťou a znášanlivosťou.
Suspenzia perampanelu sa má užívať perorálne raz denne večer pred spaním.
Môže sa užívať s jedlom alebo bez jedla, ale prednostne vždy za rovnakých podmienok. Pri prechode z tabliet na suspenziu sa má postupovať opatrne (pozri časť 5.2).
Parciálne záchvatyPreukázalo sa, že perampanel v dávkach 4 mg/deň až 12 mg/deň je účinnou liečbou parciálnych záchvatov.
Liečba Fycompou sa má začať dávkou 2 mg/deň (4 ml/deň). Dávka sa môže zvýšiť na základe klinickej odpovede a znášanlivosti v prírastkoch o 2 mg (4 ml) (buď týždenne alebo každé 2 týždne, s ohľadom na polčas ako je popísané nižšie) po udržiavaciu dávku 4 mg/deň (8 ml/deň) až 8 mg/deň (16 ml/deň). V závislosti od individuálnej klinickej odpovede a znášanlivosti dávky 8 mg/deň
(16 ml/deň) sa dávka môže zvýšiť v prírastkoch o 2 mg/deň (4 ml/deň) po dávku 12 mg/deň
(24 ml/deň). U pacientov, ktorí súčasne užívajú lieky, ktoré neskracujú polčas perampanelu (pozri časť
4.5), sa dávka nemá titrovať častejšie ako v 2-týždňových intervaloch. U pacientov, ktorí súčasne užívajú lieky, ktoré skracujú polčas perampanelu (pozri časť 4.5), sa dávka nemá titrovať častejšie ako v 1-týždňových intervaloch.
Primárne generalizované tonicko-klonické záchvatyPreukázalo sa, že perampanel v dávkach až do 8 mg/deň je účinný pri liečbe primárne generalizovaných tonicko-klonických záchvatov.
Liečba Fycompou sa má začať dávkou 2 mg/deň (4 ml/deň). Dávka sa môže zvýšiť na základe klinickej odpovede a znášanlivosti v prírastkoch o 2 mg (4 ml) (buď týždenne alebo každé 2 týždne, s ohľadom na polčas ako je popísané nižšie) po udržiavaciu dávku až do 8 mg/deň (16 ml/deň).
V závislosti od individuálnej klinickej odpovede a znášanlivosti dávky 8 mg/deň (16 ml/deň) sa dávka môže zvýšiť až po dávku 12 mg/deň (24 ml/deň), čo môže byť účinné u niektorých pacientov (pozri časť 4.4). U pacientov, ktorí súčasne užívajú lieky, ktoré neskracujú polčas perampanelu (pozri časť
4.5), sa dávka nemá titrovať častejšie ako v 2-týždňových intervaloch. U pacientov, ktorí súčasne užívajú lieky, ktoré skracujú polčas perampanelu (pozri časť 4.5), sa dávka nemá titrovať častejšie ako v 1-týždňových intervaloch.
Ukončenie liečbyOdporúča sa ukončovať liečbu postupne, aby sa minimalizovalo potenciálne riziko rebound záchvatov.
Vzhľadom na jeho dlhý polčas a následný pomalý pokles plazmatických koncentrácií sa však môže perampanel vysadiť náhle, ak je to nevyhnutné.
Vynechanie dávokJedna vynechaná dávka: Keďže perampanel má dlhý polčas, pacient má počkať a užiť ďalšiu dávku podľa plánu.
Pri vynechaní viac ako 1 dávky počas nepretržitého obdobia menej ako 5 polčasov (3 týždne pre pacientov, ktorí neužívajú antiepileptiká (AE) indukujúce metabolizmus perampanelu, 1 týždeň pre pacientov užívajúcich AE indukujúce metabolizmus perampanelu (pozri časť 4.5)) je potrebné zvážiť opätovné začatie liečby na úrovni poslednej dávky.
Ak pacient prestal užívať perampanel počas nepretržitého obdobia viac ako 5 polčasov, odporúča sa dodržiavanie úvodnej odporúčanej dávky uvedenej vyššie.
Starší pacienti (vo veku 65 rokov a viac)Klinické štúdie s Fycompou pri epilepsii nezahŕňali dostatočný počet osôb vo veku 65 rokov a viac na
určenie, či odpovedali odlišne než mladšie osoby. Analýza bezpečnostných informácií u 905 starších osôb liečených perampanelom (v dvojito zaslepenej štúdii uskutočnenej pri neepileptických indikáciách) neodhalila žiadne rozdiely v bezpečnostnom profile súvisiace s vekom. V kombinácii
s chýbajúcim rozdielom v expozícii perampanelu súvisiacim s vekom výsledky naznačujú, že úprava dávky u starších osôb sa nevyžaduje. Perampanel sa má u starších pacientov používať s opatrnosťou, pričom treba vziať do úvahy potenciál liekových interakcií u polypragmatických pacientov (pozri časť 4.4).
Porucha funkcie obličiekU pacientov s ľahkou poruchou funkcie obličiek nie je potrebná úprava dávky. Použitie u pacientov so
stredne ťažkou alebo ťažkou poruchou funkcie obličiek alebo pacientov podstupujúcich hemodialýzu sa neodporúča.
Por
ucha funkcie pečene
U pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene sa má dávka zvyšovať podľa
klinickej odpovede a znášanlivosti. U pacientov s ľahkou alebo stredne ťažkou poruchou funkcie pečene sa môže dávkovanie začať dávkou 2 mg (4 ml). U pacientov sa má titrovať dávka pomocou
2 mg (4 ml) dávok nie rýchlejšie ako každé 2 týždne na základe znášanlivosti a účinnosti. Dávkovanie perampanelu u pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene nemá prekročiť 8 mg.
Použitie u pacientov s ťažkou poruchou funkcie pečene sa neodporúča.
Pediatrická populácia
Bezpečnosť a účinnosť perampanelu u detí vo veku do 12 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Fycompa je na perorálne použitie.
Príprava: Zatlačovací adaptér fľaše (press-in-bottle adapter- PIBA), ktorý je dodávaný v škatuli s liekom, sa má pred použitím pevne vložiť do hrdla fľaše a má zostať na mieste v priebehu používania fľaše. Perorálna striekačka sa má vložiť do PIBA a z prevrátenej fľaše sa má natiahnuť dávka. Viečko sa má nasadiť po každom použití. Viečko sedí presne, keď je PIBA na mieste.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Samovražedné myšlienky
Samovražedné myšlienky a správanie sa zaznamenali u pacientov liečených antiepileptikami
v niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných klinických štúdií s antiepileptikami tiež preukázala mierne zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika pre perampanel.
Preto sa majú u pacientov sledovať prejavy samovražedných myšlienok a správania a má sa zvážiť
vhodná liečba. Pacientom (a opatrovateľom pacientov) sa má odporučiť, aby vyhľadali lekársku pomoc, ak sa objavia prejavy samovražedných myšlienok alebo správania.
Poruchy nervovéhosystému
Perampanel môže spôsobiť závrat a ospalosť a preto môže ovplyvňovať schopnosť viesť vozidlá alebo
obsluhovať stroje (pozri časť 4.7).
Perorálne kontraceptíva
Pri dávkach Fycompy 12 mg/deň sa môže znížiť účinnosť hormonálnych kontraceptív obsahujúcich
progestagény; za týchto okolností sa odporúčajú ďalšie nehormonálne formy antikoncepcie pri použití
Fycompy (pozri časť 4.5).
Pády
Javí sa, že existuje zvýšené riziko pádov, hlavne u starších pacientov; základná príčina nie je jasná.
Ag
r
esivita
Agresívne a nepriateľské správanie sa zaznamenalo u pacientov liečených perampanelom. U pacientov
liečených perampanelom v klinických štúdiách boli agresivita, hnev a podráždenosť hlásené častejšie pri vyšších dávkach. Väčšina hlásených prípadov boli buď mierne alebo stredne závažné udalosti a pacienti sa zotavili buď spontánne alebo po úprave dávky. U niektorých pacientov (< 1 % v klinických štúdiách s perampanelom) sa však pozorovali myšlienky na ublíženie iným osobám, fyzické
napadnutie alebo vyhrážanie. Pacienti a ošetrovatelia musia byť poučení, aby okamžite upozornili zdravotníckeho pracovníka, ak spozorujú významné zmeny nálady alebo správania. Ak sa tieto príznaky objavia, dávkovanie perampanelu sa má znížiť a ak sú príznaky závažné, liek sa má okamžite vysadiť.
Potenciál zneužívania
U pacientov so zneužívaním látok v anamnéze sa má postupovať opatrne a u pacienta sa majú
sledovať príznaky zneužívania perampanelu.
Súbežné antiepileptikáindukujúceCYP3A
Miery odpovede po pridaní perampanelu vo fixných dávkach boli nižšie, keď pacienti dostávali
súbežne antiepileptiká indukujúce enzým CYP3A (karbamazepín, fenytoín, oxkarbazepín),
v porovnaní s mierami odpovede u pacienta, ktorý dostával súbežne antiepileptiká neindukujúce enzýmy. Odpoveď pacienta sa má sledovať pri prechode zo súbežne podávaného neindukujúceho antiepileptika na antiepileptikum indukujúce enzým a naopak. V závislosti od individuálnej klinickej odpovede a znášanlivosti sa môže dávka súčasne zvýšiť alebo znížiť o 2 mg (pozri časť 4.2).
Iné súbežné(ne-antiepileptické)liekyindukujúcealeboinhibujúcecytochrómP450
U pacientov sa má starostlivo sledovať znášanlivosť a klinická odpoveď po pridaní alebo vysadení
induktorov alebo inhibítorov cytochrómu P450, pretože plazmatické hladiny perampanelu sa môžu
znížiť alebo zvýšiť; dávku perampanelu bude možno potrebné podľa toho upraviť.
Sorbitol
Fycompa obsahuje sorbitol (E420), preto pacienti so zriedkavými dedičnými problémami intolerancie
fruktózy nesmú užívať tento liek.
Pri kombinovaní perorálnej suspenzie Fycompa s ďalšími antiepileptickými liekmi obsahujúcimi sorbitol sa má postupovať opatrne, pretože kombinovaný príjem viac ako 1 gramu sorbitolu môže ovplyvniť absorpciu niektorých liekov.
4.5 Liekové a iné interakcie
Fycompa sa nepovažuje za silného induktora ani inhibítora enzýmov cytochrómu P450 alebo UGT (pozri časť 5.2).
Perorálne kontraceptíva
U zdravých žien užívajúcich 12 mg (nie však 4 ani 8 mg/deň) súbežne s kombinovaným perorálnym
kontraceptívom počas 21 dní sa preukázalo, že Fycompa znižuje expozíciu levonorgestrelu (priemerné
hodnoty Cmax a AUC sa znížili o 40 %). Fycompa v dávke 12 mg neovplyvňovala AUC
etinylestradiolu, zatiaľ čo Cmax sa znížilo o 18 %. Preto sa má u žien vyžadujúcich Fycompu v dávke
12 mg/deň vziať do úvahy možnosť zníženej účinnosti perorálnych kontraceptív obsahujúcich
progesterón a má sa používať dodatočná spoľahlivá metóda (vnútromaternicové teliesko - IUD, prezervatív) (pozri časť 4.4).
Interakcie medziFycompoua inýmiantiepileptikami
V klinických štúdiách sa určovali potenciálne interakcie medzi Fycompou (až do 12 mg jedenkrát
denne) a inými antiepileptikami (AE) a hodnotili sa v populačnej FK analýze štyroch združených štúdií fázy 3 vrátane pacientov s parciálnymi záchvatmi a primárne generalizovanými tonicko- klonickými záchvatmi. Vplyv týchto interakcií na priemernú koncentráciu v rovnovážnom stave je zhrnutý v nasledujúcej tabuľke.
Súbežn
e podávané
AE
Vply
v AE na koncentráciu
Fycompy
Vply
v Fycompy na
k
o
ncentráciu AE

Karbamazepín 2,75-násobné zníženie < 10% zníženie Klobazam Žiadny vplyv < 10% zníženie Klonazepam Žiadny vplyv Žiadny vplyv Lamotrigín Žiadny vplyv < 10% zníženie Levetiracetam Žiadny vplyv Žiadny vplyv Oxkarbazepín 1,9-násobné zníženie 35% zvýšenie 1) Fenobarbital Žiadny vplyv Žiadny vplyv Fenytoín 1,7-násobné zníženie Žiadny vplyv Topiramát 19% zníženie Žiadny vplyv Kyselina valproová Žiadny vplyv < 10% zníženie Zonisamid Žiadny vplyv Žiadny vplyv
1) Aktívny metabolit monohydroxykarbazepín sa nehodnotil.
Preukázalo sa, že niektoré antiepileptiká, známe ako induktory enzýmov (karbamazepín, fenytoín, oxkarbazepín), zvyšujú klírens perampanelu a následne znižujú plazmatické koncentrácie perampanelu.
Karbamazepín, známy silný induktor enzýmov, znížil hladiny perampanelu o dve tretiny v štúdii uskutočnenej u zdravých osôb.
Podobný výsledok sa pozoroval v populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi perampanel v dávke až do 12 mg/deň a pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcimi perampanel v dávke až do 8 mg/deň v placebom kontrolovaných klinických štúdiách. Celkový klírens Fycompy sa zvýšil pri podávaní
s karbamazepínom (2,75-násobne), s fenytoínom (1,7-násobne) a s oxkarbazepínom (1,9-násobne), ktoré sú známymi induktormi enzýmov metabolizmu (pozri časť 5.2). Tento vplyv sa má vziať do úvahy a riešiť po pridaní alebo vysadení týchto antiepileptík z liečebného režimu pacienta.
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi Fycompu
v dávke až do 12 mg/deň v placebom kontrolovaných klinických štúdiách Fycompa neovplyvňovala klinicky významným spôsobom klírens klonazepamu, levetiracetamu, fenobarbitalu, fenytoínu, topiramátu, zonisamidu, karbamazepínu, klobazamu, lamotrigínu a kyseliny valproovej, pri najvyššej hodnotenej dávke perampanelu (12 mg/deň).
V populačnej farmakokinetickej analýze epilepsie sa zistilo, že perampanel znižuje klírens oxkarbazepínu o 26 %. Oxkarbazepín sa rýchlo metabolizuje cytozolovým reduktázovým enzýmom na aktívny metabolit, monohydroxykarbazepín. Vplyv perampanelu na koncentrácie monohydroxykarbazepínu nie je známy.
Perampanel sa dávkuje do klinického účinku bez ohľadu na iné AE.
V
p
lyv perampanelunasubstrátyCYP3A
U zdravých jedincov znížila Fycompa (v dávke 6 mg jedenkrát denne počas 20 dní) AUC midazolamu
o 13 %. Väčšie zníženie expozície midazolamu (alebo iných citlivých substrátov CYP3A) pri vyšších dávkach Fycompy nie je možné vylúčiť.
Vplyv induktorovcytochrómuP450nafarmakokinetikuperampanelu
Predpokladá sa, že silné induktory cytochrómu P450, ako je rifampicín a ľubovník, znižujú
koncentrácie perampanelu a v ich prítomnosti nebolo možné vylúčiť potenciál vyšších plazmatických koncentrácií reaktívnych metabolitov. Preukázalo sa, že felbamát znižuje koncentrácie niektorých liekov a môže tiež znížiť koncentrácie perampanelu.
Vplyv inhibítorovcytochrómuP450nafarmakokinetikuperampanelu
U zdravých jedincov zvýšil inhibítor CYP3A4 ketokonazol (400 mg jedenkrát denne počas 10 dní)
AUC perampanelu o 20 % a predĺžil polčas perampanelu o 15 % (67,8 h oproti 58,4 h). Pri kombinácii perampanelu s inhibítorom CYP3A4 s dlhším polčasom ako má ketokonazol alebo keď sa inhibítor podáva počas dlhšie trvajúcej liečby, nie je možné vylúčiť väčší vplyv.
Levodopa
U zdravých jedincov nemala Fycompa (v dávke 4 mg jedenkrát denne počas 19 dní) žiadny vplyv na
Cmax ani AUC levodopy.
Alkohol
Účinky perampanelu na činnosti vyžadujúce bdelosť a ostražitosť, ako je schopnosť viesť vozidlá, boli
aditívne alebo supraaditívne k účinkom samotného alkoholu, ako sa zistilo vo farmakodynamickej interakčnej štúdii u zdravých jedincov. Opakované dávkovanie perampanelu 12 mg/deň zvýšilo úroveň hnevu, zmätenosti a depresie, ako to bolo hodnotené pomocou 5-bodovej hodnotiacej škály Profilu náladového stavu (pozri časť 5.1). Tieto účinky sa môžu pozorovať aj pri používaní Fycompy v kombinácii s inými látkami s tlmivým účinkom na centrálny nervový systém (CNS).
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
V populačnej farmakokinetickej analýze dospievajúcich pacientov v klinických štúdiách fázy 3 neboli
žiadne výrazné rozdiely medzi touto populáciou a celkovou populáciou.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomvekua antikoncepciau mužova žien'
Fycompu sa neodporúča užívať u žien vo fertilnom veku nepoužívajúcich antikoncepciu, pokiaľ to nie
je jednoznačne nevyhnutné.
Gravidita
Existuje iba obmedzené množstvo údajov (menej ako 300 ukončených gravidít) o použití perampanelu
u gravidných žien. Štúdie u zvierat nepreukázali žiadne teratogénne účinky u potkanov ani králikov,
avšak u potkanov bola pozorovaná embryotoxicita pri dávkach toxických pre matku (pozri časť 5.3). Fycompu sa neodporúča užívať počas gravidity.
Dojčenie
Štúdie u laktujúcich potkanov preukázali vylučovanie perampanelu a/alebo jeho metabolitov do
mlieka (podrobnosti pozri v časti 5.3). Nie je známe, či sa perampanel vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu Fycompou, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
V štúdiách fertility u potkanov sa u samíc pri podávaní vysokých dávok (30 mg/kg) pozoroval
predĺžený a nepravidelný estrálny cyklus; tieto zmeny však neovplyvňovali fertilitu a včasný embryonálny vývoj. Nezistili sa žiadne účinky na fertilitu mužov (pozri časť 5.3). Vplyv perampanelu na fertilitu ľudí sa nestanovil.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Fycompa má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Perampanel môže spôsobiť závraty a ospalosť a preto môže ovplyvňovať schopnosť viesť vozidlá
alebo obsluhovať stroje. Pacientom sa neodporúča viesť vozidlá, obsluhovať zložité stroje ani vykonávať iné potenciálne nebezpečné činnosti, kým nebude známe, či perampanel ovplyvňuje ich schopnosť vykonávať tieto úlohy (pozri časti 4.4 a 4.5).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Vo všetkých kontrolovaných a nekontrolovaných klinických štúdiách u pacientov s parciálnymi
záchvatmi užívalo 1 639 osôb perampanel, z ktorých 1 147 bolo liečených 6 mesiacov a 703 dlhšie ako 12 mesiacov.
V kontrolovanej a nekontrolovanej klinickej štúdii u pacientov s primárne generalizovanými tonicko- klonickými záchvatmi užívalo 114 osôb perampanel, z ktorých 68 bolo liečených 6 mesiacov
a 36 dlhšie ako 12 mesiacov.
Nežiaduce reakcie vedúce k vysadeniu: V kontrolovaných klinických štúdiách parciálnych záchvatov fázy 3 bola miera vysadenia v dôsledku nežiaducej reakcie 1,7 %, 4,2 % a 13,7 % u pacientov randomizovaných pre užívanie perampanelu v odporúčaných dávkach 4 mg, 8 mg a 12 mg/deň,
v uvedenom poradí, a 1,4 % u pacientov randomizovaných pre užívanie placeba. Nežiaduce reakcie, ktoré najčastejšie (≥ 1 % v celkovej perampanelovej skupine a častejšie ako pri placebe) viedli
k vysadeniu liečby, boli závrat a ospalosť.
V kontrolovanej klinickej štúdii primárne generalizovaných tonicko-klonických záchvatov fázy 3 bola miera vysadenia v dôsledku nežiaducej reakcie 4,9 % u pacientov randomizovaných pre užívanie perampanelu v dávke 8 mg, a 1,2 % u pacientov randomizovaných pre užívanie placeba. Nežiaduca reakcia, ktorá najčastejšie (≥ 2 % v celkovej perampanelovej skupine a častejšie ako pri placebe)
viedla k vysadeniu liečby, bola závrat.
Zoznamnežiaducichreakciízoradenýchdotabuľky
V nižšie uvedenej tabuľke sú nežiaduce reakcie, ktoré boli identifikované na základe posúdenia
kompletnej bezpečnostnej databázy klinických štúdií s Fycompou, zoradené podľa triedy orgánových systémov a frekvencie. Na klasifikáciu nežiaducich reakcií bola použitá nasledujúca konvencia: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
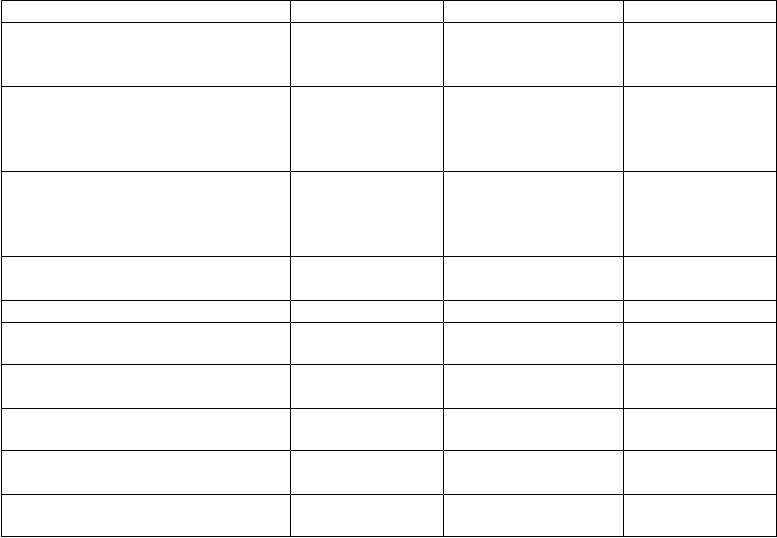
Tried
a orgánových systémov Veľmi časté Časté Menej časté
Poruch
y metabolizmu a výživy Znížená chuť do jedla
Zvýšená chuť do
jedla
Psychick
é poruchy Agresivita Hnev Úzkosť
Stav zmätenosti
Samovražedné myšlienky Samovražedný pokus
P
oruchy nervového systému Závrat
Ospalosť
Ataxia
Dyzartria
Porucha rovnováhy
Podráždenosť
Poruch
y oka Diplopia
Rozmazané videnie
Poruchy ucha a labyrintu Vertigo
Poruch
y gastrointestinálneho traktu
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Celkové poruchy a reakcie v mieste podania
Nauzea
Bolesť chrbta
Porucha chôdze
Únava
Laboratórne a funkčné vyšetrenia Zvýšená telesná hmotnosť
Úrazy
, otravy a komplikácie liečebného postupu
Pád
 Pediatrick
á
populácia
Pediatrick
á
populácia
Na základe databázy klinických štúdií so 196 dospievajúcimi, ktorým sa podával perampanel v dvojito
zaslepených štúdiách parciálnych záchvatov a primárne generalizovaných tonicko-klonických záchvatov, bol bezpečnostný profil u dospievajúcich podobný profilu u dospelých, okrem agresivity, ktorá sa pozorovala častejšie u dospievajúcich ako u dospelých.
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieS predávkovaním perampanelu u ľudí sú len obmedzené klinické skúsenosti. V správe o úmyselnom predávkovaní po užití dávky až 264 mg sa u pacienta vyskytovali príhody zmeneného duševného stavu, agitácia a agresívne správanie a zotavil sa bez následkov. K dispozícii nie je žiadne špecifické
antidotum k účinkom perampanelu. Indikovaná je všeobecná podporná starostlivosť o pacienta vrátane
monitorovania vitálnych znakov a sledovania klinického stavu pacienta. Vzhľadom na jeho dlhý polčas môžu účinky spôsobené perampanelom trvať dlhšie. Z dôvodu nízkeho renálneho klírensu nebudú mať pravdepodobne význam špeciálne zásahy ako forsírovaná diuréza, dialýza alebo hemoperfúzia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.
1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiepileptiká, iné antiepileptiká, ATC kód: N03AX22
Mechanizmus účinku
Perampanel je prvý vo svojej triede, selektívny, nekompetitívny antagonista inotropného receptora α-
amino-3-hydroxy-5-metyl-4-izoxazolpropiónovej kyseliny (α-amino-3-hydroxy-5-methyl-4- isoxazolepropionic acid - AMPA) glutamátu na postsynaptických neurónoch. Glutamát je primárny excitačný neurotransmiter v centrálnom nervovom systéme a je zapletený do veľkého počtu neurologických porúch zapríčinených neuronálnou hyperexcitáciou. Aktivácia AMPA receptorov glutamátom je pravdepodobne zodpovedná za väčšinu rýchlo excitačnej synaptickej transmisie
v mozgu. V in vitro štúdiách perampanel nesúťažil s AMPA vo väzbe na AMPA receptor, perampanel bol však vytesnený z väzby nekompetitívnymi antagonistami AMPA receptora, čo svedčí o tom, že perampanel je nekompetitívny antagonista AMPA receptora. In vitro perampanel inhiboval zvýšenie intracelulárneho vápnika indukovaného AMPA (nie však indukovaného NMDA). In vivo perampanel významne predlžoval latenciu záchvatov v modeli záchvatu indukovaného AMPA.
Presný mechanizmus, ktorým perampanel vykazuje svoje antiepileptické účinky u ľudí, je potrebné ešte úplne objasniť.
Farmakodynamické účinky
Farmakokineticko-farmakodynamická analýza (účinnosti) sa uskutočnila na základe združených
údajov z 3 klinických skúšaní účinnosti pri parciálnych záchvatoch. Okrem toho sa uskutočnila farmakokineticko-farmakodynamická analýza (účinnosti) v jednej klinickej štúdii pri primárne generalizovaných tonicko-klonických záchvatoch. V obidvoch analýzach je expozícia perampanelu vo vzájomnom vzťahu so znížením frekvencie záchvatov.
Psychomotorická výkonnosť
Jednotlivé a opakované dávky 8 mg a 12 mg zhoršovali psychomotorickú výkonnosť u zdravých
dobrovoľníkov spôsobom závislým od dávky. Účinky perampanelu na zložité úlohy, ako je schopnosť viesť vozidlá, boli aditívne alebo supraaditívne k tlmivým účinkom alkoholu. Psychomotorická výkonnosť sa obnovila na pôvodnú úroveň v priebehu 2 týždňov od skončenia podávania
perampanelu.
Kognitívna funkcia
V štúdii hodnotiacej účinky perampanelu na bdelosť a pamäť použitím štandardnej série hodnotení sa
u zdravých dobrovoľníkov nezistili žiadne účinky perampanelu po jednorazových a opakovaných dávkach perampanelu až do 12 mg/deň.
Bdelosť a nálada
Úroveň bdelosti (ostražitosti) sa znížila spôsobom závislým od dávky u zdravých osôb, ktoré dostávali perampanel v dávke od 4 do 12 mg/deň. Nálada sa zhoršila len po podaní dávky 12 mg/deň; zmeny nálady boli malé a odzrkadľovali celkové zníženie bdelosti. Opakované dávkovanie perampanelu
12 mg/deň tiež zvýšilo účinky alkoholu na ostražitosť a bdelosť a zvýšilo úroveň hnevu, zmätenosti a depresie meranú pomocou 5-bodovej hodnotiacej škály profilu stavu nálady.
Elektrofyziológia srdca
Perampanel nepredlžoval QTc interval pri podávaní denných dávok až do 12 mg/deň a nevykazoval účinok závislý od dávky ani klinicky významný účinok na trvanie QRS.
Klinická účinnosťa bezpečnosť
Parciálne záchvaty
Účinnosť perampanelu pri parciálnych záchvatoch bola stanovená v troch 19-týždňových, randomizovaných, dvojito zaslepených, placebom kontrolovaných, multicentrických klinických štúdiách s prídavnou liečbou u dospelých a dospievajúcich pacientov. Jedinci mali parciálne záchvaty so sekundárnou generalizáciou alebo bez nej a neboli primerane kontrolovaní jedným až troma súbežne podávanými AE. Počas 6-týždňového východiskového obdobia bolo potrebné, aby jedinci mali viac ako päť záchvatov s obdobím bez záchvatov neprekračujúcim 25 dní. V týchto troch
klinických štúdiách mali jedinci priemerné trvanie epilepsie približne 21,06 rokov. V rozmedzí 85,3 % a 89,1 % pacientov užívalo dva až tri súbežne podávané AE so súčasnou vagálnou nervovou stimuláciou alebo bez nej.
Dve štúdie (štúdia 304 a 305) porovnávali dávky 8 a 12 mg perampanelu/deň s placebom a tretia štúdia (štúdia 306) porovnávala dávky 2, 4 a 8 mg perampanelu/deň s placebom. Vo všetkých troch klinických štúdiách po 6-týždňovej východiskovej fáze na stanovenie východiskovej frekvencie záchvatov pred randomizáciou boli osoby randomizované a titrované do randomizovanej dávky. Počas titračnej fázy vo všetkých troch klinických štúdiách sa liečba začala dávkou 2 mg/deň a bola
zvyšovaná v týždňových prírastkoch po 2 mg/deň až po cieľovú dávku. Osoby, u ktorých sa
vyskytovali netolerovateľné nežiaduce príhody, mohli zostať na rovnakej dávke alebo ich dávka bola znížená na poslednú tolerovanú dávku. Vo všetkých troch klinických štúdiách po titračnej fáze nasledovala udržiavacia fáza, ktorá trvala 13 týždňov, počas ktorej boli pacienti udržiavaní na stabilnej dávke perampanelu.
Združené 50 %-né miery odpovede boli pri placebe 19 %, pri 4 mg 29 %, pri 8 mg 35 % a pri 12 mg
35 %. Štatisticky významný vplyv na zníženie frekvencie záchvatov počas 28 dní (od východiskovej
po liečebnú fázu) v porovnaní s placebovou skupinou sa pozoroval pri liečbe perampanelom v dávke
4 mg/deň (štúdia 306), 8 mg/deň (štúdie 304, 305 a 306) a 12 mg/deň (štúdie 304 a 305). 50 %-ná miera odpovede v kombinácii s antiepileptikami indukujúcimi enzým bola v skupine so 4 mg 23,0 %, v skupine s 8 mg 31,5 % a v skupine s 12 mg 30,0 % a keď sa podával perampanel v kombinácii s antiepileptikami neindukujúcimi enzým 33,3 %, 46,5 % a 50,0 %, v uvedenom poradí. Tieto štúdie preukazujú, že podávanie perampanelu raz denne v dávkach 4 mg až 12 mg bolo významne účinnejšie ako placebo vo forme prídavnej liečby v tejto populácii.
Údaje z placebom kontrolovaných štúdií dokazujú, že zlepšenie kontroly záchvatov sa pozorovalo pri dávkovaní perampanelu 4 mg raz denne a tento účinok sa zvýšil pri zvýšení dávky na 8 mg/deň. Pri dávke 12 mg v porovnaní s dávkou 8 mg sa v celkovej populácii nepozoroval žiadny prínos v účinnosti. Prínos sa pozoroval pri dávke 12 mg u niektorých pacientov, ktorí tolerujú dávku 8 mg
a u ktorých je klinická odpoveď na túto dávku nedostatočná. Klinicky významné zníženie frekvencie záchvatov v porovnaní s placebom sa dosiahlo už po druhom týždni podávania, keď pacienti dosiahli dennú dávku 4 mg.
1,7 až 5,8 % pacientov na perampanele v klinických štúdiách nemalo záchvat počas 3-mesačného udržiavacieho obdobia v porovnaní s 0 % - 1,0 % pri placebe. Nie sú k dispozícii žiadne údaje týkajúce sa účinkov vysadenia súbežne podávaných antiepiletík na dosiahnutie monoterapie perampanelom.
Nezaslepené rozšírené štúdie
Deväťdesiatsedem percent pacientov, ktorí dokončili randomizované klinické štúdie u pacientov s parciálnymi záchvatmi, bolo zaradených do nezaslepenej rozšírenej štúdie (n = 1 186). Pacienti
z randomizovanej klinickej štúdie boli prevedení na perampanel v priebehu 16 týždňov, po ktorých nasledovalo dlhodobé udržiavacie obdobie (≥ 1 rok). Priemerná denná dávka bola 10,05 mg.
Primárne generalizované tonicko-klonické záchvaty
Perampanel ako prídavná liečba u pacientov vo veku 12 rokov a starších s idiopatickou generalizovanou epilepsiou s primárne generalizovanými tonicko-klonickými záchvatmi bol zavedený
v multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii (štúdia 332). Vhodní pacienti na stabilnej dávke 1 až 3 antiepileptík, u ktorých sa vyskytli aspoň 3 primárne generalizované tonicko-klonické záchvaty počas 8 týždňov úvodného obdobia, boli randomizovaní buď pre užívanie perampanelu alebo pre užívanie placeba. Populácia zahŕňala 164 pacientov (perampanel N = 82, placebo N = 82). U pacientov sa po dobu štyroch týždňov titrovala dávka do cieľovej dávky 8 mg na deň alebo najvyššej tolerovanej dávky a ďalších 13 týždňov pokračovala liečba poslednou úrovňou dávky dosiahnutej na konci titrovacieho obdobia. Celková doba liečby bola
17 týždňov. Študovaný liek sa podával raz denne.
50 %-ná miera odpovede pri primárne generalizovaných tonicko-klonických záchvatoch bola počas udržiavacieho obdobia signifikantne vyššia v skupine s perampanelom (58,0 %) ako v skupine
s placebom (35,8 %), P=0,0059. 50 %-ná miera odpovede bola 22,2 % v kombinácii s antiepileptikami indukujúcimi enzým a 69,4 % pri podávaní perampanelu v kombinácii s antiepileptikami neindukujúcimi enzým. Počet osôb v skupine s perampanelom užívajúcich antiepileptiká indukujúce enzým bol malý (n = 9). Mediánová percentuálna zmena frekvencie pri primárne generalizovaných tonicko-klonických záchvatoch za 28 dní počas titrácie a udržiavacieho obdobia (kombinovaná) vzhľadom k prerandomizácii bola väčšia s perampanelom (-76,5 %) ako s placebom (-38,4 %), P<0,0001. V priebehu 3-mesačného udržiavacieho obdobia, 30,9 % (25/81) pacientov na perampanele v klinických štúdiách nemalo primárne generalizované tonicko-klonické záchvaty v porovnaní
s 12,3 % (10/81) na placebe.
Ostatné podtypy idiopatických generalizovaných záchvatov
Účinnosť a bezpečnosť perampanelu u pacientov s myoklonickými záchvatmi nebola stanovená.
Dostupné údaje sú nedostatočné na dosiahnutie akýchkoľvek záverov. Účinnosť perampanelu v liečbe záchvatov absencií nebola preukázaná.
V štúdii 332 u pacientov s PGTC záchvatmi, ktorí tiež mali súbežné myoklonické záchvaty, stav bez
záchvatov bol dosiahnutý u 16,7 % (4/24) na perampanele v porovnaní s 13,0 % (3/23) na placebe. U pacientov so sprievodnými záchvatmi absencií bol stav bez záchvatov dosiahnutý u 22,2 % (6/27) na perampanele v porovnaní s 12,1 % (4/33) na placebe. Stav bez všetkých záchvatov bol u 23,5 % (19/81) pacientov na perampanele v porovnaní so 4,9 % (4/81) pacientov na placebe.
Nezaslepená rozšírená fáza
Zo 140 osôb, ktorí dokončili štúdiu 332, 114 osôb (81,4 %) vstúpilo do rozšírenej fázy. Pacienti
z randomizovanej klinickej štúdie boli prevedení na perampanel počas 6 týždňov s následným dlhodobým udržiavacím obdobím (≥ 1 rok). V rozšírenej fáze malo 73,7 % osôb modálnu dennú dávku perampanelu väčšiu ako 4 až 8 mg/deň a 16,7 % malo modálnu dennú dávku väčšiu ako 8 až
12 mg/deň. Pokles vo frekvencii primárne generalizovaných tonicko-klonických záchvatov aspoň
o 50 % sa pozoroval u 65,9 % osôb po roku liečby počas rozšírenej fázy (v porovnaní s východiskovou frekvenciou záchvatov pred liečbou perampanelom). Tieto údaje boli zhodné s tými pre percentuálnu zmenu frekvencie záchvatov a preukázali, že 50 %-ná miera odpovede pri primárne generalizovaných tonicko-klonických záchvatoch bola všeobecne stabilná v čase od 26. týždňa do konca 2. roku.
Podobné výsledky sa pozorovali, keď boli v priebehu času zhodnotené všetky záchvaty a absencie vs. myoklonické záchvaty.
Konverzia na monoterapiu
Nie sú k dispozícii žiadne údaje týkajúce sa účinkov vysadenia súbežne podávaných antiepiletík na
dosiahnutie monoterapie perampanelom.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Fycompou
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri epilepsii odolnej voči liečbe (epileptické syndrómy závislé od lokalizácie a veku) (informácie o použití u dospievajúcich, pozri časť 4.2).
Tri pivotné dvojito zaslepené, placebom kontrolované štúdie fázy 3 zahŕňali 143 dospievajúcich vo vekovom rozmedzí 12 až 18 rokov. Výsledky u týchto dospievajúcich boli podobné ako výsledky pozorované u dospelej populácie.
Štúdia 332 zahŕňala 22 dospievajúcich vo vekovom rozmedzí 12 až 18 rokov. Výsledky u týchto dospievajúcich boli podobné ako výsledky pozorované u dospelej populácie.
5.2 Farmakokinetické vlastnosti
Farmakokinetika perampanelu sa skúmala u zdravých dospelých jedincov (vo veku 18 až 79 rokov), u dospelých a dospievajúcich s parciálnymi záchvatmi a primárne generalizovanými tonicko- klonickými záchvatmi, u dospelých s Parkinsonovou chorobou, u dospelých s diabetickou neuropatiou, u dospelých so sklerózou multiplex a u osôb s poruchou funkcie pečene.
Absorpcia
Perampanel sa ľahko absorbuje po perorálnom podaní bez dôkazu o zjavnom metabolizme prvého
prechodu pečeňou.
Perorálna suspenzia perampanelu je bioekvivantná na báze mg na mg s tabletami perampanelu nalačno. Keď bola podaná 12 mg dávka obidvoch liekových foriem s jedlom s vysokým obsahom tuku, perorálna suspenzia perampanelu dosiahla ekvivalentnú AUC0-inf, približne o 23 % nižšiu Cmax a v porovnaní s tabletami došlo k 2 hodinovému meškaniu v čase dosiahnutia maximálnej expozície (tmax). Avšak populačná farmakokinetická analýza ukázala, že pri napodobení podmienok expozície
v ustálenom stavu boli Cmax a AUC(0-24h) perorálnej suspenzie perampanelu bioekvivalentné tabletám za obidvoch podmienok, nalačno aj po jedle.
Pri podaní jednej 12 mg dávky perorálnej suspenzie perampanelu s jedlom s vysokým obsahom tuku boli Cmax a AUC0-inf približne o 22 %, respektívne o 13 % nižšie v porovnaní s podmienkami nalačno.
Distribúcia
Údaje z in vitro štúdií naznačujú, že približne 95 % perampanelu sa viaže na plazmatické proteíny.
In vitro štúdie preukázali, že perampanel nie je substrátom ani významným inhibítorom organických aniónových transportných polypeptidov (organic anion transporting polypeptides - OATP) 1B1 a 1B3, organických aniónových transportérov (organic anion transporters - OAT) 1, 2, 3 a 4, organických katiónových transportérov (organic cation transporters - OCT) 1, 2 a 3 a efluxných transportérov
P-glykoproteínu a proteínu rezistencie rakoviny prsníka (Breast Cancer Resistance Protein - BCRP).
Biotransformácia
Perampanel sa v značnej miere metabolizuje primárnou oxidáciou a postupnou glukuronidáciou.
Metabolizmus perampanelu je sprostredkovaný primárne CYP3A na základe výsledkov klinickej štúdie na zdravých dobrovolníkoch, ktorým bol podaný rádioaktívne označený perampanel a in vitro štúdií, v ktorých sa použili rekombinantné ľudské CYP a ľudské pečeňové mikrozómy.
Po podaní rádioaktívne označeného perampanelu sa v plazme pozorovali len stopové množstvá metabolitov perampanelu.
Eliminácia
Po podaní dávky rádioaktívne označeného perampanelu buď 8 zdravým dospelým alebo starším
jedincom sa približne 30 % vylúčenej rádioaktivity zistilo v moči a 70 % v stolici. V moči a v stolici vylúčená rádioaktivita pozostávala predovšetkým zo zmesi oxidatívnych a konjugovaných metabolitov. V populačnej farmakokinetickej analýze združených údajov z 19 štúdií fázy 1 bol
priemerný t1/2 perampanelu 105 hodín. Pri podávaní v kombinácii so silným induktorom CYP3A4
karbamazepínom bol priemerný t1/2 perampanelu 25 hodín.
Linearita/nelinearita
U zdravých osôb sa plazmatické koncentrácie perampanelu zvýšili priamo úmerne s podávanými
dávkami v rozmedzí 2 až 12 mg. V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcimi perampanel až do 12 mg/deň a pacientov s primárne generalizovanými tonicko- klonickými záchvatmi užívajúcimi perampanel až do 8 mg/deň v placebom kontrolovaných klinických štúdiách sa zistil lineárny vzťah medzi dávkou a plazmatickými koncentráciami perampanelu.
Osobitné skupinypacientov
Porucha funkcie pečene
Farmakokinetika perampanelu po jednorazovej dávke 1 mg bola hodnotená u 12 osôb s ľahkou a stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre A a B, v uvedenom poradí)
v porovnaní s 12 zdravými demograficky zodpovedajúcimi osobami. Priemerný zjavný klírens neviazaného perampanelu u pacientov s ľahkou poruchou bol 188 ml/min oproti 338 ml/min
u zodpovedajúcich kontrol a u jedincov so stredne ťažkou poruchou bol 120 ml/min oproti 392 ml/min
u zodpovedajúcich kontrol. Hodnota t1/2 bola dlhšia u osôb s ľahkou poruchou (306 h oproti 125 h)
a u osôb so stredne ťažkou poruchou (295 h oproti 139 h) v porovnaní so zodpovedajúcimi zdravými
jedincami.
Porucha funkcie obličiek
Farmakokinetika perampanelu sa oficiálne nehodnotila u pacientov s poruchou funkcie obličiek. Perampanel je eliminovaný takmer výlučne metabolizmom, po ktorom nasleduje rýchle vylučovanie metabolitov; v plazme sa pozorovali len stopové množstvá metabolitov perampanelu. V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi s klírensom kreatinínu v rozmedzí od 39 do 160 ml/min a užívajúcich perampanel v dávke až do 12 mg/deň v placebom kontrolovaných klinických štúdiách nebol klírens perampanelu ovplyvnený klírensom kreatinínu. V populačnej farmakokinetickej analýze pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcich perampanel v dávke až do 8 mg/deň v placebom kontrolovanej klinickej štúdii, nebol klírens perampanelu ovplyvnený hodnotou klírensu kreatinínu nameraného na začiatku štúdie (baseline).
Pohlavie
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi užívajúcich perampanel v dávke až do 12 mg/deň a pacientov s primárne generalizovanými tonicko-klonickými záchvatmi užívajúcich perampanel v dávke až do 8 mg/deň v placebom kontrolovaných klinických štúdiách bol klírens perampanelu u žien (0,54 l/h) o 18 % nižší ako u mužov (0,66 l/h).
Starší pacienti (vo veku 65 rokov a viac)
V populačnej farmakokinetickej analýze pacientov s parciálnymi záchvatmi (vekové rozmedzie 12 až
74 rokov) a primárne generalizovanými tonicko-klonickými záchvatmi (vekové rozmedzie 12 až
58 rokov) a užívajúcich perampanel v dávke až do 8 alebo 12 mg/deň v placebom kontrolovaných klinických štúdiách sa nezistil žiadny významný vplyv veku na klírens perampanelu. Úprava dávkovania u starších pacientov nie je potrebná (pozri časť 4.2).
Pediatrická populácia
V populačnej farmakokinetickej analýze dospievajúcich pacientov v klinických štúdiách fázy 3 neboli
žiadne významné rozdiely medzi touto populáciou a celkovou populáciou.
Liekové interakčnéštúdie
In vitro hodnotenie liekových interakcií
Inhibícia enzýmu metabolizujúceho liečivo
V ľudských pečeňových mikrozómoch mal perampanel (30 μmol/l) slabý inhibičný účinok na
CYP2C8 a UGT1A9 v skupine dôležitejších hepatálnych enzýmov CYP a UGT.
Indukcia enzýmu metabolizujúceho liečivo
Zistilo sa, že perampanel v porovnaní s pozitívnymi kontrolami (vrátane fenobarbitalu, rifampicínu) slabo indukuje CYP2B6 (30 µmol/l) a CYP3A4/5 (≥ 3 µmol/l) v skupine dôležitejších hepatálnych CYP a UGT enzýmov v kultivovaných ľudských hepatocytoch.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie, boli tieto:
V štúdii fertility u potkanov sa pozoroval predĺžený a nepravidelný estrálny cyklus pri maximálnej tolerovanej dávke (30 mg/kg) u samíc; tieto zmeny však neovplyvňovali fertilitu a včasný embryonálny vývoj. Nezistili sa žiadne účinky na fertilitu samcov.
Vylučovanie do materského mlieka sa meralo u potkanov 10 dní po pôrode. Hladiny dosiahli maximum za jednu hodinu a boli 3,65-násobkom hladín v plazme.
V toxikologickej štúdii prenatálneho a postnatálneho vývoja u potkanov sa pozorovali abnormálny pôrod a dojčenie pri dávkach toxických pre matku a počet narodených mŕtvych plodov sa u potomkov zvýšil. Behaviorálny a reprodukčný vývoj potomstva nebol ovplyvnený, niektoré parametre fyzického vývoja však preukázali malé oneskorenie, ktoré je pravdepodobne sekundárne k CNS účinkom perampanelu vychádzajúcich z farmakológie. Prechod placentou bol relatívne nízky; 0,09 % alebo menej podanej dávky sa zistilo v plode.
Predklinické údaje preukázali, že perampanel nie je genotoxický a nemá karcinogénny potenciál. Podávanie maximálnych tolerovaných dávok u potkanov a opíc malo za následok CNS klinické prejavy vychádzajúce z farmakológie a zníženú terminálnu telesnú hmotnosť. Nezistili sa žiadne zmeny, ktoré možno pripísať priamo perampanelu v klinickej patológii alebo histopatológii.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sorbitol (E420) tekutý (kryštalizujúci) mikrokryštalická celulóza (E460) sodná soľ karmelózy (E466) poloxamér 188
emulzia simetikonu 30% obsahuje čistenú vodu, silikónový olej, polysorbát 65, metylcelulózu, silika gél, stearát makrogolu, kyselinu askorbovú, kyselinu benzoovú a kyselinu sírovú
bezvodá kyselina citrónová (E330)
benzoan sodný (E211)
čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.
3 Čas použiteľnosti
2 roky
Po prvom otvorení: 90 dní
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPolyetylén tereftalátová (PET) fľaša s detským bezpečnostným uzáverom z polypropylénu: každá fľaša obsahuje 340 ml suspenzie vo vonkajšej papierovej škatuli.
Každá škatuľa obsahuje jednu fľašu, dve 20 ml perorálne striekačky so stupnicou a LDPE zatlačovací adaptér fľaše (PIBA). Perorálne striekačky sú odstupňované po 0,5 ml.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEisai Europe Limited European Knowledge Centre Mosquito Way
Hatfield Hertfordshire AL10 9SN Veľká Británia
tel: +44 (0)208 600 1400
fax: +44 (0)208 600 1401
e-mail:
EUmedinfo@eisai.net8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/12/776/024
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 23/07/2012
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.