pievajúcich vo veku od 12 do 17 rokov sú zhrnuté v častiach 4.8 a 5.1, ale nie sú odporúčania na dávkovanie.
Pacienti musia byť pravidelne kontrolovaní lekárom, či dávkovanie Fosteru Nexthalerzostáva optimálne a môže sa upraviť iba na jeho odporúčanie. Dávka sa má titrovať na najnižšiu dávku, pri ktorej sa zachová účinná kontrola príznakov astmy. Ak je kontrola symptómov udržiavaná pri najnižšej odporúčanej dávke, potom ďalší krok môže zahŕňať použitie samotného inhalačného kortikosteroidu.
Pacienti sa majú upozorniť na to, aby používali Foster Nexthalerkaždý deň, aj v prípade, že sú bez príznakov.
Chronická obštrukčná choroba pľúc (CHOCHP)
Odporúčané dávkovanie pre dospelých, 18 ročných a starších2 inhalácie dvakrát denne.
Osobitné skupiny pacientovNie je potrebná žiadna úprava dávkovania u starších pacientov. Nie sú k dizpozícii žiadne údaje o použití Fosteru Nexthaler u pacientov s poruchou funkcie pečene alebo obličiek (pozri časť 5.2).
Spôsob podávania Nexthaler je vdychom ovládaný inhalátor. U pacientov so stredne ťažkou až ťažkou astmou sa preukázalo, že sú schopní vytvoriť dostatočný nádych na uvoľnenie dávky z Nexthaleru (pozri časť 5.1). Uvoľnená dávka z Fosteru Nexthaler nie je závislá od intenzity nádychu, ktorú je schopná táto skupina pacientov dosiahnuť cez inhalátor.
Aby bola liečba úspešná, je nevyhnutné správne použitie Nexthaler inhalátora. Pacient sa má poučiť, aby si pozorne prečítal písomnú informáciu a postupoval podľa pokynov na použitie, ako sú uvedené v písomnej informácii. Pre potrebu predpisujúceho lekára sú tieto pokyny uvedené nižšie.
Počet dávok uvedených v okienku pod krytom sa nezníži uzavretím krytu, ak pacient neinhaloval.
Pacient musí byť poučený, aby otváral kryt inhalátora iba vtedy, ak je to potrebné. V prípade, že pacient otvoril inhalátor, ale neinhaloval a kryt uzavrel, dávka sa vráti späť do zásobníka prášku
v inhalátore; ďalšia dávka sa môže bezpečne inhalovať.
Po inhalácii si pacienti musia vypláchnuť ústa vodou alebo kloktať vodou alebo si vyčistiť zuby (pozri časť 4.4).
Návod na použitie inhalátora NexthalerFoster Nexthalerje dostupný v dvoch veľkostiach:
- inhalátor, ktorý poskytuje 120 dávok
- inhalátor, ktorý poskytuje 180 dávok.
A. Obsah baleniaPre informácie o obsahu balenia pozri časť 6.5.
Ak obsah balenia nie je taký, ako je uvedený v časti 6.5, vráťte inhalátor osobe, ktorá vám ho vydala, a požiadajte o nové balenie.B. Všeobecné upozornenia a opatrenia·
Nevyberajte inhalátor z fólie, ak ho nebudete okamžite používať.
· Používajte inhalátor tak, ako je to uvedené.
· Kryt udržujte uzavretý, až kým nebudete musieť použiť dávku z inhalátora.
· Ak inhalátor nepoužívate, udržujte ho na suchom a čistom mieste.
·
Nepokúšajte sa z akéhokoľvek dôvodu rozobrať inhalátor Nexthaler.
C. Hlavné časti inhalátora Nexthaler
Ak používate inhalátor ktorý poskytuje
120 dávok
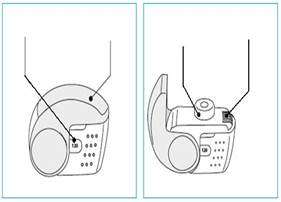
| Ak používate inhalátor ktorý poskytuje
180 dávok
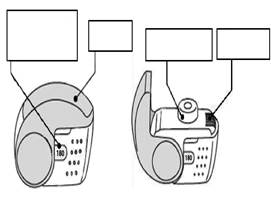
|
Na použitie dávky z vášho inhalátora Nexthaler sú potrebné tri jednoduché kroky: otvoriť, inhalovať, zatvoriť.
D. Pred použitím nového inhalátora Nexthaler
1.
Otvorte hliníkovú fóliu a vyberte inhalátor Nexthaler. o
Nepoužívajte inhalátor, ak je obal nezapečatený alebo poškodený – vráťte ho tam, kde ste ho dostali a vypýtajte si nový.
o Použite štítok na škatuľke na zapísanie dátumu otvorenia fólie.
2.
Skontrolujte inhalátor.o Ak sa vám inhalátor zdá byť zlomený alebo poškodený, vráťte ho tam, kde ste ho dostali a vypýtajte si nový.
3.
Skontrolujte počítadlo dávok. Ak je váš inhalátor úplne nový, počítadlo má ukazovať “120” alebo “180”.o
Nepoužívajte nový inhalátor,ak číslo na počítadle je menšie ako ,,120“ alebo ,,180“ ak to tak nie je, vráťte ho tam, kde ste ho dostali a vypýtajte si nový.
120
Ak používate inhalátor ktorý poskytuje
120 dávok
| 180
Ak používate inhalátor ktorý poskytuje
180 dávok
|
E. Ako používať inhalátor Nexthaler
· Ak si nie ste istý, či užívate vašu dávku správne, kontaktujte svojho lekárnika alebo lekára.
· Ak si nie ste istý, že počítadlo dávok sa po vdýchnutí znížil o jednu, počkajte do ďalšej plánovanej dávky a vezmite si to ako normálne. Neužívajte ďalšiu dávku.
E.1 Otvorte
1. Držte inhalátor pevne vo zvislej polohe. 2. Skontrolujte počet zostávajúcich dávok: ľubovoľné číslo medzi "1" a "120" alebo "180" ukazuje, že v inhalátore sa ešte nachádza dostatok dávok.o Ak sa v okne počítača dávok zobrazí "0", nezostali žiadne dávky - zlikvidujte inhalátor a získajtenový.
3. Úplne otvorte kryt. 120
Ak používate inhalátor ktorý poskytuje
120 dávok
A. 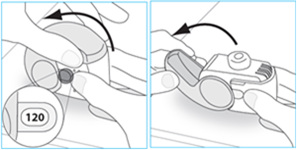
| 180
Ak používate inhalátor ktorý poskytuje
180 dávok
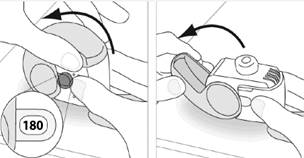
|
4. Pred inhaláciou hlboko vydýchnite toľko, ako je vám pohodlné.o
Nevydychujte do inhalátora.
E.2 Inhalujte
Kedykoľvek ak je to možné, keď inhalujete, stojte alebo seďte vo vzpriamenej polohe.
1. Zdvihnite inhalátor, položte ho do úst a pevne zovrite pery okolo náustku.o
Nezakrývajte rukou vzdušný ventil pri držaní inhalátora.
o
Nevdychujte cez vzdušný ventil.
2. Spravte mocný a hlboký nádych cez ústa.o Môžete pocítiť chuť, keď použijete dávku.
o Môžete počuť alebo pocítiť cvaknutie, keď použijete dávku.
o
Nevdychujte cez nos.
o
Nevyberajte inhalátorz pier počas inhalácie.
 3. Odtiahnite inhalátor od pier.4. Zadržte dych na 5 až 10 sekúnd alebo tak dlho, ako je vám príjemné.5. Pomaly vydýchnite.
3. Odtiahnite inhalátor od pier.4. Zadržte dych na 5 až 10 sekúnd alebo tak dlho, ako je vám príjemné.5. Pomaly vydýchnite.o
Nevydychujte cez inhalátor.
E.3 Zatvorte
1. Presuňte inhalátor späť do zvislej polohy a úplne zatvorte kryt.2. Skontrolujte, či sa počítadlo dávok znížilo o jednu hodnotu. 120
Ak používate inhalátor ktorý poskytuje
120 dávok
B. 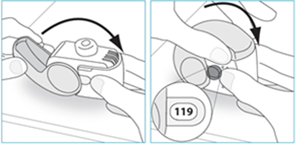
| 180
Ak používate inhalátor ktorý poskytuje
180 dávok

|
3. Ak potrebujete použiť ešte jednu dávku, zopakujte kroky E.1 až E.3.F. Čistenie
· Zvyčajne nie je nutné inhalátor čistiť.
· Ak je to nutné, môžete čistiť inhalátor po použití suchou handričkou alebo obrúskom.
o
Nečistite váš inhalátor vodou alebo inými tekutinami. Udržujte ho suchý.
G. Uchovávanie a likvidácia
Informácie o podmienkach uchovávania a pokynoch na likvidáciu nájdete v častiach 6.4 a 6.6.
4.3 Kontraindikácie Precitlivenosť na beklometazóndipropionát, dihydrát formoteroliumfumarát alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPri ukončení liečby sa odporúča dávkovanie znižovať postupne, liečba sa nesmie náhle ukončiť.
Liečba astmy sa má riadiť postupnými krokmi na základe klinickej odpovede pacienta a funkčného
vyšetrenia pľúc.
Ak sa pacient nazdáva, že je liečba neúčinná, musí vyhľadať lekára. Zvýšené použitie záchranných bronchodilatancií a zhoršenie kontroly astmy si vyžaduje prehodnotenie liečby.
Náhle a progresívne zhoršenie kontroly astmy potenciálne ohrozuje život a pacient sa musí okamžite podrobiť lekárskemu vyšetreniu. Má sa zvážiť potreba zvýšiť dávky kortikosteroidov, buď inhalačnú alebo perorálnu liečbu, alebo ak je podozrenie na infekciu, pridať do liečby antibiotiká.
U pacientov sa nemá začať liečba Fosterom Nexthaler počas exacerbácie alebo signifikantného či akútneho zhoršenia astmy.
Počas liečby Fosterom Nexthaler sa môžu vyskytnúť závažné, s astmou spojené nežiaduce účinky a exacerbácie. Pacientov treba upozorniť, aby pokračovali v liečbe, ale vyhľadali lekársku pomoc v prípade, že symptómy astmy neustúpia alebo sa pri liečbe Fosterom Nexthaler zhoršia.
Rovnako ako pri iných inhalačných terapiách sa môže vyskytnúť paradoxný bronchospazmus, prejavujúci sa zvýraznením pískania, kašľom a skrátením dychu okamžite po podaní dávky. Liečba s rýchlo pôsobiacim inhalačným bronchodilatansom sa má začať okamžite.
Liečba s Fosterom Nexthaler sa má okamžite prerušiť, stav pacienta prehodnotiť a podľa potreby sa má začať alternatívna liečba.
Foster Nexthaler nie je určený na liečbu akútnej astmy.
Pacienti sa musia poučiť, aby na zvládnutie akútnych astmatických záchvatov mali vždy k dispozícii
ich krátkodobo pôsobiaci bronchodilatans buď Foster Nexthaler (pre pacientov užívajúcich Foster Nexthaler ako udržiavacia a úľavová liečba) alebo samostatný rýchlo pôsobiaci bronchodilatátor (pre pacientov používajúcich len Foster Nexthaler ako udržiavaciu terapiu).
Pacientom treba pripomenúť, aby denne používali Foster Nexthaler tak, ako im to predpísal lekár, aj keď sú bez príznakov.
Inhalácie Fosteru Nexthaler na úľavu sa majú používať ako reakcia na príznaky astmy, ale nie sú určené na pravidelné profylaktické použitie, napr. pred cvičením. Na takéto použitie sa má zvážiť samostatný rýchlo pôsobiaci bronchodilatátor.
Len čo sú príznaky astmy pod kontrolou, možno zvážiť postupné znižovanie dávky Fosteru Nexthaler. Po znížení dávky lieku je dôležité pacientov pravidelne sledovať. Pacienti majú používať najnižšiu účinnú dávku Fosteru Nexthaler (pozri časť 4.2).
Pneumónia u pacientov s CHOCHP U pacientov s CHOCHP liečených inhalačnými kortikosteroidmi sa pozorovalo zvýšenie výskytu pneumónií vrátane pneumónií vyžadujúcich hospitalizáciu. Existuje niekoľko dôkazov o zvýšenom riziku pneumónií so zvyšujúcou sa dávkou steroidu, ale nepreukázalo sa to presvedčivo naprieč všetkými štúdiami.
Neexistuje žiadny presvedčivý klinický dôkaz o rozdieloch vo veľkosti rizika pneumónií v rámci skupiny inhalačných kortikosteroidov.
U pacientov s CHOCHP musia lekári zostať ostražití kvôli možnému vzniku pneumónie, pretože klinické prejavy takýchto infekcií sa prekrývajú s príznakmi exacerbácií CHOCHP.
Rizikové faktory vzniku pneumónie u pacientov s CHOCHP zahŕňajú súčasné fajčenie, starší vek, nízky index telesnej hmotnosti (BMI) a ťažkú CHOCHP.
Systémové účinky sa môžu vyskytnúť pri aplikácii akéhokoľvek inhalačného kortikosteroidu hlavne vtedy, ak sa podáva dlhodobo vo vysokých dávkach. Výskyt týchto systémových účinkov je menej pravdepodobný pri inhalačných kortikosteroidoch ako pri perorálnych. Možné systémové účinky zahŕňajú: Cushingov syndróm, Cushingove príznaky, zníženú funkciu nadobličiek, spomalenie rastu u detí a dospievajúcich, zníženie kostnej denzity, katarakta, glaukóm a veľmi zriedkavo duševné poruchy alebo poruchy správania, ktoré zahŕňajú psychomotorickú hyperaktivitu, poruchy spánku, úzkosť, depresie alebo agresivitu (predovšetkým u detí).
Preto je dôležité, aby sa dávka inhalačného kortikosteroidu znížila na najnižšiu dávku, pri ktorej je zachovaná účinná kontrola astmy.
Dlhodobá liečba pacientov vysokými dávkami inhalačných kortikosteroidov môže viesť k nadobličkovej supresii a akútnej nadobličkovej kríze. Zvýšené riziko sa týka detí a dospievajúcich vo veku menej ako 16 rokov, ktorí používajú dávky beklometazóndipropionátu vyššie ako sú odporúčané. Medzi situácie, ktoré môžu viesť k spusteniu akútnej nadobličkovej krízy, patrí úraz, chirurgický zákrok, infekcie alebo náhle zníženie dávky. Prítomné príznaky sú zvyčajne nejasné a môžu zahŕňať anorexiu, abdominálnu bolesť, stratu hmotnosti, únavu, bolesť hlavy, nauzeu, vracanie, hypotenziu, poruchy vedomia, hypoglykémiu a závraty. Počas obdobia stresu alebo elektívneho chirurgického zákroku sa má zvážiť používanie systémových kortikosteroidov.
U pacientov prechádzajúcich z perorálnej liečby kortikosteroidmi na inhalačnú liečbu môže počas určitého obdobia pretrvávať riziko poruchy funkcie kôry nadobličiek. Pacienti, ktorí v minulosti absolvovali liečbu s mimoriadne vysokými dávkami kortikosteroidov alebo užívali vysoké dávky inhalačných kortikosteroidov dlhodobo, môžu byť tiež ohrození. Túto možnosť reziduálneho poškodenia funkcie je potrebné mať vždy na pamäti v akútnych a vybraných situáciách vyvolavajúcich stres, pri ktorých bude potrebné zvážiť liečbu vhodnými kortikosteroidmi. Pred zahájením elektívnych zákrokov môže rozsah poškodenia obličiek určiť špecialista.
Foster Nexthaler sa má podávať s opatrnosťou u pacientov s aktívnou alebo inaktívnou pľúcnou tuberkulózou, plesňovými a vírusovými infekciami dýchacích ciest.
Foster Nexthaler sa má podávať s opatrnosťou u pacientov (môže zahŕňať sledovanie pacientov) so srdcovou arytmiou, najmä s atrioventrikulárnou blokádou tretieho stupňa a tachyarytmiou, idiopatickou subvalvulárnou aortálnou stenózou, hypertrofickou obštrukčnou kardiomyopatiou, ischemickou chorobou srdca, závažným zlyhávaním srdca, závažnou arteriálnou hypertenziou a aneuryzmou.
Zvýšená opatrnosť je potrebná aj u pacientov liečených so známym alebo suspektným predĺžením QTc-intervalu, či už kongenitálnym alebo liekmi vyvolaným (QTc > 0,44 sekúnd). Predĺženie QTc-intervalu môže vyvolať aj samotný formoterol.
Foster Nexthaler sa má tiež používať s opatrnosťou u pacientov s tyreotoxikózou, diabetes mellitus, feochromocytómom a neliečenou hypokaliémiou.
Potenciálne závažná hypokaliémia môže nastať v dôsledku liečby b
2- agonistami. Zvláštna pozornosť sa odporúča v prípade ťažkej astmy, keďže tento účinok môže byť potenciovaný hypoxiou. Hypokaliémia môže byť tiež potenciovaná súbežnou liečbou s inými liečivami, ktoré môžu vyvolať hypokaliémiu, ako sú xantínové deriváty, steroidy a diuretiká (pozri časť 4.5). Opatrnosť sa tiež odporúča pri nestálej astme, kedy môže byť potrebné použiť väčšie množstvo „záchranných“ bronchodilatancií. V takýchto situáciách sa odporúča sledovať sérové hladiny draslíka.
Inhalácia formoterolu môže spôsobiť zvýšenie hladiny glukózy v krvi. Pacientom s diabetom sa musí starostlivo sledovať glykémia.
V prípade plánovanej anestézie halogénovými anestetikami sa musí zabezpečiť, aby sa Foster Nexthaler nepodával najmenej 12 hodín pred začiatkom anestézie, v dôsledku rizika srdcovej arytmie.
Pacienti musia byť upozornení, že po inhalácii predpísanej dávky si majú vypláchnuť ústa vodou, vykloktať vodou alebo vyčistiť zuby na zníženie rizika orofaryngeálnej kandidózy a dysfónie.
Pomocná látka laktóza obsahuje malé množstvo mliečnych proteínov, ktoré môžu spôsobiť alergické reakcie.
Liek obsahuje laktózu. Laktóza obsahuje malé množstvá mliečnych bielkovín, ktoré môžu spôsobiť alergické reakcie. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkového deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nemajú tento liek užívať.
Poruchy videnia
Poruchy videnia môžu byť hlásené pri systémovom a lokálnom použití kortikosteroidov. Ak sa u pacienta objavia symptómy, ako rozmazané videnie alebo iné poruchy videnia, pacient má byť odporučený k oftalmológovi na posúdenie možných príčin, medzi ktoré možu patriť sivý zákal, glaukóm alebo zriedkavé ochorenia, ako napríklad centrálne serózna chorioretinopatia (CSCR), ktoré boli hlásené po použití systémových a lokálnych kortikosteroidov.
4.5 Liekové a iné interakcieFarmakokinetické interakcie Beklometazóndipropionát sa veľmi rýchlo metabolizuje prostredníctvom systému esteráz bez účasti systému P450 cytochrómu.
Beklometazón je menej závislý od metabolizmu CYP3A, ako niektoré iné kortikosteroidy a
vo všeobecnosti interakcie sú nepravdepodobné; hoci nie je možné vylúčiť možnosť systémových účinkov pri súbežnom použití silných inhibítorov CYP3A (napr. ritonavir, kobicistát), a preto pri užívaní týchto liekov sa odporúča pozornosť a vhodné sledovanie pacienta.
Farmakodynamické interakciePacienti s astmou sa majú vyhnúť β- blokátorom (vrátane očných kvapiek). Ak sa β- blokátory podávajú zo závažných dôvodov, účinok formoterolu sa zníži alebo vymizne.
Na druhej strane, súbežné podávanie iných β- adrenergných liečiv môže mať potenciálne aditívne účinky, preto pri súbežnom podávaní formoterolu a teofylínu alebo iných β- adrenergných liečiv sa vyžaduje opatrnosť.
Súbežná liečba s chinidínom, dizopyramidom, prokaínamidom, fenotiazínom, niektorými antihistaminikami (napr. terfenadín), inhibítormi monoaminooxidázy a tricyklickými antidepresívami môže predĺžiť QTc interval a zvýšiť riziko ventrikulárnej arytmie.
L-dopa, L-tyroxín, oxytocín a alkohol môžu narušiť srdcovú toleranciu k β
2-sympatomimetikám.
Súbežná liečba s inhibítormi monoaminooxidázy, vrátane liečiv s podobnými vlastnosťami ako je furazolidón a prokarbazín, môže vyvolať hypertenznú reakciu.
Zvýšené riziko arytmie sa môže vyskytnúť u pacientov súbežne podstupujúcich anestéziu halogénovými uhľovodíkmi.
Súbežná liečba so xantínovými derivátmi, steroidmi alebo diuretikami môže potenciovať možný hypokaliemický účinok b
2-agonistov (pozri časť 4.4). U pacientov liečených digitálisovými glykozidmi môže hypokaliémia zvýšiť náchylnosť k arytmii.
4.6 Fertilita, gravidita a laktáciaFertilita Nie sú k dispozícii údaje u ľudí. V štúdiách na potkanoch podávanie vysokých dávok beklometazóndipropionátu v kombinácii bolo spojené so zníženou plodnosťou u samíc a embryotoxicitou (pozri časť 5.3).
GraviditaNie sú k dispozícii žiadne relevantné klinické údaje o použití Fosteru Nexthaler u gravidných žien. Štúdie na zvieratách používajúce kombináciu beklometazóndipropionátu a dihydrát formoteroliumfumarátu preukázali reprodukčnú toxicitu až po vysokej systémovej expozícii (pozri časť 5.3).
Je známe, že vysoké dávky kortikosteroidov podávané gravidným zvieratám spôsobujú abnormality fetálneho vývoja, vrátane rázštepu podnebia a vnútromaternicovej rastovej retardácie.
Pre tokolytický účinok β
2-sympatomimetík, je potrebné venovať špeciálnu pozornosť celému obdobiu gravidity až po samotný pôrod.
Formoterol sa neodporúča používať počas gravidity a zvlášť na konci gravidity alebo počas pôrodu, pokiaľ je k dispozícii iná (viac bezpečná) alternatívna liečba.
Foster Nexthaler sa môže používať počas gravidity iba v prípade, ak očakávaný prínos prevýši potenciálne riziko.
Dojčenie Nie sú známe žiadne relevantné klinické údaje o použití Fosteru Nexthaler u žien počas dojčenia. Hoci z pokusov na zvieratách nie sú dostupné žiadne údaje, je pochopiteľné, že sa predpokladá vylučovanie beklometazóndipropionátu ( podobne ako iných kortikosteroidov) do materského mlieka. Hoci nie je známe, či formoterol prechádza do ľudského materského mlieka, jeho prítomnosť sa však zistila v mlieku dojčiacich zvierat. Podávanie Fosteru Nexthaler dojčiacim ženám sa má zvážiť iba v prípade, ak očakávaný prínos preváži potenciálne riziko.
Rozhodnutie, či prerušiť dojčenie alebo prerušiť/ukončiť liečbu Fosterom Nexthaler, sa má zvážiť po vyhodnotení prínosu dojčenia pre dieťa a prínosu liečby pre matku.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeFoster Nexthaler nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNajčastejším nežiaducim účinkom je tremor. V 12-týždňovom klinickom skúšaní s Fosterom Nexthaler sa tremor vyskytoval iba pri najvyššom dávkovacom režime (2 inhalácie 2x denne) , prejavoval sa najčastejšie na začiatku liečby a jeho intenzita bola mierna. Žiaden pacient nebol vylúčený zo skúšania z dôvodu výskytu tremoru.
Skúsenosti z klinických skúšaní u astmatických pacientovBezpečnosť Fosteru Nexthaler bola hodnotená v aktívnych a placebo kontrolovaných klinických skúšaniach u 719 pacientov s astmou rôznej závažnosti vo veku od 12 rokov a starších, ktorí používali tento liek. Nežiaduce účinky uvedené v tabuľke sa vyskytli u astmatických pacientov vo veku 12 rokov a starších počas dvoch pilotných klinických skúšaní, kde sa podával Foster Nexthaler v odporúčaných dávkach po dobu 8-12 týždňov.
V klinických skúšaniach s Fosterom Nexthaler neboli pozorované žiadne psychické poruchy, len sú zahrnuté v tabuľke ako možný účinok (class- effect) inhalačných kortikosteroidov.
Nežiaduce účinky, ktoré sú spojené s beklometazóndipropionátom a dihydrát formoteroliumfumarátom ako fixnej kombinácie Fosteru Nexthaler sú uvedené nižšie a sú zoradené podľa tried orgánových systémov. Frekvencia výskytu je definovaná nasledovne: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000 až <1/100), zriedkavé (≥1/10 000 až <1/1000) a veľmi zriedkavé (≤1/10 000), neznáme (z dostupných údajov).
Trieda orgánových systémov
| Nežiaduce účinky
| Frekvencia
|
Infekcie a nákazy
| nasofaryngitída
orálna kandidóza
pneumónia (u pacientov s CHOCHP)
| menej časté
časté
|
Poruchy metabolizmu a výživy
| hypertriglyceridémia
| menej časté
|
Psychické poruchy
| psychomotorická hyperaktivita, poruchy spánku, úzkosť, depresia, agresivita, zmeny v správaní (predovšetkým u detí)
| neznáme
|
Poruchy oka
| Poruchy videnia (pozri tiež časť 4.4)
| neznáme
|
Poruchy nervového systému
| tremor
| časté
|
bolesť hlavy
| menej časté
|
Poruchy srdca a srdcovej činnosti
| tachykardia, sínusová bradykardia, angína pektoris, ischémia myokardu
| menej časté
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| podráždenie hrdla, exacerbácia astmy, dyspnoe, orofaryngeálna bolesť, dysfónia, kašeľ
| menej časté
|
Poruchy gastrointestinálneho traktu
| nauzea
| menej časté
|
Celkové ochorenia a reakcie v mieste podania
| únava, podráždenosť
| menej časté
|
Laboratórne a funkčné vyšetrenia
| predĺženie QT intervalu na elektrokardiograme, zníženie voľného kortizolu v moči, zníženie kortizolu v krvi, zvýšenie hladiny draslíka, zvýšenie hladiny cukru v krvi, zmeny na EKG typu pomalého nárastu vlny R.
| menej časté
|
Medzi pozorované nežiaduce reakcie, ktoré sú typicky spojené s formoterolom patria: tremor, bolesť hlavy, tachykardia, sínusová bradykardia, angína pektoris, ischémia myokardu, predĺženie QTc intervalu.
Medzi pozorované nežiaduce reakcie, ktoré sú typicky spojené s beklometazóndipropionátom sú: nasofaryngitída, orálna kandidóza, dysfónia, podráždenie hrdla, podráždenosť, zníženie voľného kortizolu v moči, zníženie kortizolu v krvi, zvýšenie hladiny cukru v krvi.
Nežiaduce reakcie typu plesňových infekcií v ústach a pneumónia sú typicky spojené s inhalačným podávaním beklometazóndipropionátu a neboli pozorované v klinickej praxi s Fosterom Nexthaler.
Počas liečby inhalačnými kortikosteroidmi boli občas hlásené poruchy chuti.
V časti 4.4 pozri opatrenia ako minimalizovať výskyt orálnej plesňovej infekcie, orálnej kandidózy a dysfónie.
Systémové účinky inhalačných kortikosteroidov (napr. beklometazóndipropionátu) sa môžu vyskytnúť predovšetkým pri vysokých dávkach podávaných dlhodobo.
Tie môžu zahŕňať Cushingov syndróm, Cushingove príznaky, zníženú funkciu nadobličiek, zníženie kostnej denzity, spomalenie rastu u detí a dospievajúcich, kataraktu a glaukóm (pozri tiež časť 4.4).
V klinickej praxi pri terapeutických dávkach Fosteru Nexthaler neboli pozorované ďalšie nežiaduce reakcie, ale sú typicky spojené s inhalačným podávaním β
2-agonistov ako je formoterol: palpitácie, atriálna fibrilácia, ventrikulárne extrasystoly, tachyarytmia, eventuálne závažná hypokaliémia a zvýšenie/zníženie krvného tlaku. Insomnia, závrat, nepokoj a úzkosť boli príležitostne hlásené počas inhalačnej liečby s formoterolom. Formoterol môže vyvolať svalové kŕče, myalgiu.
Reakcie z precitlivenosti zahŕňajú vyrážku, urtikáriu, pruritus, erytém a tiež sa môže vyskytnúť opuch očí, tváre, pier a hrdla.
Tak ako pri inej inhalačnej liečbe, môže sa vyskytnúť paradoxný bronchospazmus, prejavujúci
sa zvýraznením pískania, kašľom a skrátením dychu okamžite po podaní dávky.
Pediatrická populáciaNie sú k dispozícii informácie o bezpečnosti Fosteru Nexthaler u detí do 11 rokov, a iba obmedzené informácie u dospievajúcich od 12 - 17 rokov. V 12 týždňov trvajúcej randomizovanej klinickej štúdii u dospelých a dospievajúcich, 162 dospievajúcich vo veku 12 - 17 rokov so stredne ťažkou až ťažkou astmou dostávalo Foster Nexthaler alebo zodpovedajúcu inhaláciu roztoku v tlakovom obale, 1 alebo 2 inhalácie 2x denne; frekvencia, typ a závažnosť nežiaducich účinkov sa nelíšili u dospievajúcich v porovnaní s dospelými.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieNajvyššia odporúčaná jednorazová dávka Fosteru Nexthaler je podanie dvoch inhalácií.
U astmatických pacientov boli sledované podania kumulovanej dávky 4 inhalácií Fosteru Nexthaler (celkový obsah beklometazóndipropionátu 400 mikrogramov, formoterolu 24 mikrogramov podaných v jednej dávke). Kumulovaná liečba nepreukázala abnormálne, klinicky relevantné účinky na životne dôležité funkcie a nepozorovali sa závažné nežiaduce účinky (pozri tiež časť 4.8.)
U astmatických pacientov sa sledovalo podanie kumulovanej dávky inhalačného roztoku v tlakovom obale v množstve 12 uvoľnených dávok (celkový obsah beklometazóndipropionátu 1200 mikrogramov, formoterolu 72 mikrogramov). Kumulovaná liečba nespôsobila abnormálne, klinicky relevantné účinky na životne dôležité funkcie a nepozorovali sa ani závažné nežiaduce účinky.
Nadmerné dávky formoterolu môžu viesť k reakciám typickým pre b
2-adrenergných agonistov ako sú nauzea, vracanie, bolesť hlavy, tremor, somnolencia, palpitácie, tachykardia, ventrikulárna arytmia, predĺženie QTc intervalu, metabolická acidóza, hypokaliémia, hyperglykémia.
V prípade predávkovania formoterolom sa indikuje podporná a symptomatická liečba. Závažné prípady sa musia hospitalizovať. Keďže použitie b
2-adrenergných blokátorov môže vyvolať bronchospazmus, použitie kardioselektívnych b
2-adrenergných blokátorov sa má zvážiť a to iba v mimoriadnych prípadoch. Majú sa sledovať sérové hladiny draslíka.
Akútna inhalácia dávok beklometazóndipropionátu presahujúcich odporúčané dávkovanie môže viesť k dočasnej nadobličkovej supresii. Stav si nevyžaduje zvláštne opatrenia, funkcia nadobličiek sa o pár dní obnoví do pôvodného stavu, ako potvrdili merania plazmatického kortizolu. U týchto pacientov sa má v liečbe pokračovať pri dávke postačujúcej na zvládnutie kontroly astmy.
Chronické predávkovanie inhalačným beklometazóndipropionátom: riziko nadobličkovej supresie (pozri časť 4.4). Môže byť nevyhnutné stanovenie nadobličkovej rezervy. V liečbe sa má pokračovať pri dávke postačujúcej na zvládnutie kontroly astmy.
Jednotlivé dávky, podávané až do maximálne povolenej dávky 800 mikrogramov beklometazóndipropionátu, 48 mikrogramov formoterolu, podávané prostredníctvom Fosteru Nexthaler, sú všeobecne bezpečné a dobre tolerované.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Adrenergiká, inhalačné, formoterol a iné liečivá na obštrukčné
ochorenia dýchacích ciest.
ATC kód: R03AK08
Spôsob účinku a farmakodynamické účinkyFoster Nexthaler obsahuje beklometazóndipropionát a formoterol v práškovej inhalačnej forme, ktorá po uvoľnení z inhalátora vytvára aerosól s obsahom extra jemných („extrafine“) častíc so strednou hodnotou aerodynamického priemeru častíc (MMAD) 1,4 -1,5 mikrometrov a súbežným aditívnym pôsobením obidvoch zložiek.
Aerosólové častice Fosteru Nexthaler sú v priemere oveľa menšie ako častice podávané v ,,non-extrafine“ zložení.
Štúdia sledujúca depozíciu rádiofarmakom označeného lieku v pľúcach u dospelých pacientov s astmou preukázala jeho homogénnu distribúciu a depozíciu v pľúcach a v dýchacích cestách (približne 42 % nominálnej dávky). Tieto charakteristiky umožňujú použitie nižšej dávky kortikosteroidov s vystupňovanými lokálnymi farmakodynamickými účinkami, ktoré sa ukázali ako rovnocenné k inhalačnému roztoku v tlakovom obale (pozri klinické skúsenosti).
Aktívne zložky Fosteru Nexthaler majú odlišný spôsob účinku. Podobne ako pri iných kombináciách inhalačných kortikosteroidov a b
2-agonistov, je aj v tomto prípade viditeľný aditívny účinok v zmysle redukcie exacerbácií astmy.
Beklometazóndipropionát Beklometazóndipropionát podávaný inhaláciou v odporúčaných dávkach má glukokortikoidný protizápalový účinok v pľúcach, ktorého výsledkom je redukcia symptómov a exacerbácií astmy a nižší výskyt nežiaducich účinkov v porovnaní so systémovo podávanými kortikosteroidmi.
Formoterol Formoterol je selektívny b
2-adrenergný agonista, ktorý vyvoláva uvoľnenie hladkých svalov v prieduškách u pacientov s reverzibilnou obštrukciou dýchacích ciest. Bronchodilatačný účinok nastupuje rýchlo, počas 1-3 minút po inhalácii a jeho trvanie je 12 hodín po jednorazovej dávke. '
Klinické skúsenostiPôsobenie oboch zložiek Fosteru Nexthaler bolo hodnotené v troch samostatných štúdiách, ktoré porovnávali ich účinnosť s účinnosťou inhalácie 100 mikrogramov/6 mikrogramov inhalačného roztoku v tlakovom obale u pacientov so stredne ťažkou a ťažkou pretrvávajúcou astmou. Celkovo sa očakáva, že účinnosť týchto dvoch inhalačných systémov bude pri dávkovaní 1 – 2 vdychy dvakrát denne rovnocenná.
V prvej štúdii bolo primárnym cieľom hodnotenie účinnosti zložky inhalačných kortikosteroidov meranej na základe bronchodilatácie ( bazálnej FEV
1 – meranej pred použitím dávky). Klinicky významné zlepšenie bazálnej FEV
1 bolo zaznamenané u 696 pacientov so stredne ťažkou až ťažkou symptomatickou astmou na konci trojmesačnej liečby v porovnaní s východiskovými hodnotami, pri podaní 1 alebo 2 inhalácií dvakrát denne oboch liekových foriem. Priemerný nárast bol minimálne 250 ml. Pri rovnakom dávkovaní nebol pozorovaný klinicky významný rozdiel v bazálnej FEV
1 medzi Fosterom Nexthaler inhalačným práškom a inhalačným roztokom v tlakovom obale pri oboch dávkovaniach.
Signifikantný rozdiel bol pozorovaný pri rannom PEF v závislosti na dávke. Štatistická významnosť
v hodnote bazálnej FEV
1 v závislosti na dávke nebola dosiahnutá. Kontrola astmy vyjadrená
pomocou skóre ranných a večerných symptómov a percenta dní bez príznakov, sa výrazne zlepšila pri
porovnaní nálezu na začiatku a na konci liečebnej periódy, najmä pri užívaní vyšších dávok u oboch
liekových foriem.
V druhej štúdii bolo primárnym cieľom hodnotenie účinnosti zložky dlhodobo pôsobiaceho a b
2-agonistu vo Fosteri Nexthaler.V tejto štúdii bola opakovane meraná spirometria a to na začiatku a v priebehu 12 hodín po podaní jednej dávky, s primárnym hodnotením FEV
1 (FEV
1 AUC – najmenej 80 % trvania účinku formoterolu). V porovnaní s placebom, jedna inhalácia a štyri inhalácie Fosteru Nexthaler signifikantne zlepšili FEV
1 AUC
0-12. Účinnosť oboch dávok Fosteru Nexthaler inhalačný prášok bola porovnateľná s korešpondujúcimi dávkami inhalačného roztoku v tlakovom obale. Štatisticky významná na dávke závislá odpoveď bola zaznamenaná pri použití oboch liekových foriem medzi nižšou a vyššou dávkou.
V tretej štúdii po 4 týždňoch liečby beklometazóndipropionátom/formoterolom vo fixnej kombinácii vo forme inhalačného roztoku v tlakovom obale 1inhalácia 2x denne, bolo randomizovaných 755 pacientov s astmou na 8 týždňov liečby s fixnou kombináciou liečiv vo forme inhalačného roztoku v tlakovom obale, s Fosterom Nexthaler inhalačný prášok alebo s beklometazóndipropionátom 100 mikrogramov v inhalačnom prášku, 1 inhalácia 2x denne.
Primárnym cieľom bolo hodnotenie zmeny ranného maximálneho expiračného prietoku vzduchu (PEF) porovnaním východiskovej hodnoty s hodnotami meranými počas celého trvania liečby.
Po ôsmich týždňoch terapie sa nepreukázal žiadny rozdiel v primárnom cieli medzi dvoma inhalátormi s fixnou kombináciou liečiv, ale obidva boli signifikantne účinnejšie ako monoterapia beklometazóndipropionátom. Neboli zistené žiadne rozdiely medzi inhalátormi s fixnou kombináciou liečiv pri hodnotení symptómov astmy dotazníkom kontroly astmy (asthma control score) a počtom dní bez záchrannej liečby.
Otvorená štúdia s placebom sa vykonala na overenie predpokladu, že pacienti sú schopní generovať cez Nexthaler inhalátor dostatočný inspiračný prietok, ktorý nie je ovplyvnený vekom pacienta, ochorením a závažnosťou ochorenia, a preto aktivácia a uvoľnenie liečiva z inhalátora je dostupné u všetkých pacientov. Primárnym cieľom bolo množstvo pacientov vyjadrených v percentách v každom veku a v skupine ochorenia, ktorí boli schopní aktivovať inhalátor. Tejto štúdie sa zúčastnilo 89 pacientov, vo veku 5 – 84 rokov, so stredne ťažkou a ťažkou astmou (predpokladané FEV
1 > 60 % a £ 60%) a stredne ťažkou až ťažkou CHOCHP. Všetci pacienti, bez ohľadu na vek, ochorenie a závažnosť ochorenia, boli schopní vytvoriť dostatočný inspiračný prietok pre aktiváciu Nexthaler inhalátora.
V ďalšej otvorenej štúdii s placebom, na základe posúdenia inspiračného profilu prostredníctvom Fosteru Nexthaler bolo preukázané, že pacienti s ľahkou až ťažkou CHOCHP, bez ohľadu na ich obmedzenia pľúcnych funkcií, boli schopní efektívne aktivovať a používať inhalátor.
Pediatrická populáciaEurópska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s Fosterom Nexthaler v pediatrickej podskupine populácie u detí s astmou vo veku 5-11 rokov a dospievajúcich s astmou vo veku 12-17 rokov.
V súčasnosti nie sú klinické skúsenosti s liečbou s Fosterom Nexthaler u detí vo veku 5 - 11 rokov a len obmedzené množstvo údajov u dospievajúcich vo veku 12 - 17 rokov.
V trojmesačnej randomizovanej klinickej štúdii so 162 adolescentmi vo veku 12 až 17 rokov, pacienti
so stredne ťažkou až ťažkou astmou dostávali Foster Nexthaler alebo zodpovedajúcu inhaláciu inhalačného roztoku v tlakovom obale, 1 alebo 2 inhalácie 2x denne.
Zmena bazálnej FEV
1 na konci liečby bola väčšia u dospievajúcich ako u dospelých (pozri tiež časti 4.2 a 4.8 informácie o pediatrickom použití ).
5.2 Farmakokinetické vlastnostiBeklometazóndipropionát Beklometazóndipropionát je pro-liečivo so slabou afinitou ku glukokortikoidnému receptoru, ktoré sa hydrolyzuje pomocu enzýmov esteráz na účinný metabolit beklometazón-17-monopropionát, ktorý má silnejší lokálny protizápalový účinok v porovnaní s pro-liečivom beklometazóndipropionátom.
Absorpcia, distribúcia a biotransformácia
Inhalovaný beklometazóndipropionát sa rýcho absorbuje pľúcami. Pred absorpciou podlieha rozsiahlej premene na účinný metabolit beklometazón-17-monopropionát prostredníctvom enzýmov esteráz, ktoré sa nachádzajú vo väčšine tkanív. Systémová dostupnosť účinného metabolitu pochádza z absorpcie pľúcami a z gastrointestinálnej absorpcie po prehltnutí časti dávky. Biodostupnosť prehltnutého beklometazóndipropionátu je zanedbateľná, i keď presystémová premena beklometazóndipropionátu na beklometazón-17-monopropionát má za následok, že časť absorbovanej dávky je dostupná vo forme účinného metabolitu.
Systémová expozícia narastá približne lineárne so zvyšujúcou sa inhalovanou dávkou.
Absolútna biodostupnosť po inhalácii inhalačného roztoku v tlakovom obale je približne 2 % a 62 % nominálnej dávky pre beklometazóndipropionát a beklometazón-17-monopropionát.
Po intravenóznom podaní je beklometazóndipropionát a jeho účinný metabolit charakterizovaný vysokým plazmatickým klírensom (150 a 120 l/h), s ustálením stavu s malým distribučným objemom pre beklometazóndipropionát (20 l) a s väčšou distribúciou v tkanivách pre jeho účinný metabolit
(424 l). Metabolická dispozícia beklometazóndipropionátu (82 %) je výsledkom hlavne jeho účinného metabolitu beklometazón-17-monopropionátu.
Väzba na plazmatické proteíny je stredne vysoká (87 %).
ElimináciaVylučovanie stolicou je hlavnou cestou eliminácie beklometazóndipropionátu, najmä vo forme polárnych metabolitov. Vylučovanie beklometazóndipropionátu a jeho účinných metabolitov obličkami je zanedbateľné. Polčas terminálnej eliminácie je u beklometazóndipropionátu 0,5h a 2,7h u beklometazón-17-monopropionátu.
Osobitné skupiny pacientov
Farmakokinetika beklometazóndipropionátu u pacientov s
poruchou funkcie obličiek alebo pečene sa nezisťovala, keďže beklometazóndipropionát sa rýchlo metabolizuje pomocou esteráz enzýmov prítomných v črevných tekutinách, sére, pľúcach a v pečeni, činnosťou ktorých sa tvorí viac polárnych metabolitov ako sú beklometazón-21-monopropionát, beklometazón-17-mnonopropionát a beklometazón, a preto sa neočakáva zmena farmakokinetiky a bezpečnostného profilu beklometazóndipropionátu u pacientov s poruchou funkcie pečene.
Keďže prítomnosť beklometazóndipropionátu alebo jeho metabolitov sa v moči nezistila, nepredpokladá sa zvýšenie systémovej expozície u pacientov s poruchou funkcie obličiek.
FormoterolAbsorpcia a distribúcia
Po inhalácii sa formoterol absorbuje z pľúc a gastrointestinálneho traktu.
Časť inhalovanej dávky, ktorá sa po podaní odmeranej dávky inhalátorom (MDI) prehltne, môže byť v rozmedzí 60 % až 90 %. Najmenej 65 % množstva, ktoré sa prehltne, sa absorbuje z gastrointestinálneho traktu. Maximálnu plazmatickú koncentráciu dosahuje nezmenené liečivo do 0,5 – 1 hodiny po perorálnom podaní. Väzba formoterolu na plazmatické bielkoviny je 61-64 %, z toho 34 % sa viaže na albumín. V rozsahu koncentrácií, ktoré sa dosiahli pri terapeutických dávkach, nenastáva úplná saturácia väzbových miest. Polčas eliminácie po perorálnom podaní sa stanovil na 2-3 hodiny. Absorpcia formoterolu po inhalácii 12-96 mikrogramov formoteroliumfumarátu je lineárna.
BiotransformáciaFormoterol je z väčšej časti metabolizovaný a to hlavne cestou priamej konjugácie na fenolovej hydroxylej skupine. Konjugát s kyselinou glukorónovou je inaktívny. Druhou cestou je
O-demetylácia, ktorá nasleduje po konjugácii na 2-hydroxylovú skupinu fenolu. Izoenzýmy CYP2D6, CYP2C19 a CYP2C9 cytochrómu P450 sa zapájajú do O-demetylácie formoterolu. Pečeň je primárnym miestom metabolizmu. Formoterol neinhibuje enzýmy CYP450 pri terapeutických relevantných koncentráciách.
Eliminácia
Kumulatívne vylučovanie formoterolu močom po jednorazovej inhalácii suchého prášku lineárne rastie v rozmedzí dávok 12-96 mikrogramov. V priemere 8 % dávky sa vylúčilo ako nezmenený a
25 % ako celkový formoterol. Stredná hodnota koncového eliminačného polčasu sa stanovila na 10 hodín, pri ktorej sa vychádzalo z meraní plazmatických koncentrácií po inhalácii jednorazovej dávky 120 mikrogramov u 12 zdravých dobrovoľníkov. (R,R)- enantioméry predstavujú 40 % vylúčenej látky v nezmenenej forme močom a (S,S)- enantioméry 60 %. Relatívny podiel oboch enantiomeróv zostáva konštantný v rozmedzí sledovaných dávok a po opakovanom podaní dávok sa nezistila žiadna relatívna kumulácia jedného enantioméru voči druhému.
Po perorálnom podaní u zdravých dobrovoľníkov (40 až 80 mikrogramov), 6 % až 10 % z dávky sa vylúčilo močom v nezmenenej forme, až do 8 % dávky sa vylúčilo vo forme glukoronidu.
Celkovo 67 % z perorálnej dávky formoterolu sa vylúči močom (predovšetkým vo forme metabolitov) a zvyšok stolicou. Renálny klírens formoterolu sa stanovil na 150 ml/min.
Špeciálne skupiny pacientov
Porucha funkcie pečene/obličiek: farmakokinetika formoterolu sa u pacientov s poruchou funkcie pečene alebo obličiek nesledovala.
Klinické skúsenostiV klinickej štúdii porovnávali systémovú expozíciu beklometazóndipropionátu a formoterolu vo fixnej kombinácii s jednotlivými zložkami.
Nie sú žiadne dôkazy o farmakokinetických a farmakodynamických (systémových) interakciách medzi beklometazóndipropionátom a formoterolom.
Farmakokinetika Fosteru Nexthaler inhalačný prášok sa porovnávala so zodpovedajúcou dávkou inhalačného roztoku v tlakovom obale.
Analýzy steroidných zložiek sa zamerali na beklometazón-17-monopropionát, hlavný aktívny metabolit beklometazóndipropionátu.
Systémová absorpcia a metabolizmus beklometazóndipropionátu boli rýchle a C
max dosiahli do 5 minút po dávke pre obe liekové formy, pričom vyššia bola u Fosteru Nexthaler inhalačný prášok
(+ 68 %). AUC
t bola asi 3-krát vyššia u Fosteru Nexthaler inhalačný prášok v porovnaní s inhalačným roztokom.
C
max beklometazón-17-monopropionátu, hlavného aktívneho metabolitu, predstavuje približne 82 %
z celkového množstva v krvi a dosiahla sa v priemere po 15 minútach u Fosteru Nexthaler inhalačný prášok a 30 minútach u inhalačného roztoku v tlakovej nádobe.
Plazmatické koncentrácie beklometazón-17-monopropionátu boli nižšie (C
max - 49 % a AUC
t -29 % ) po inhalácii inhalačného prášku ako po inhalácii inhalačného roztoku v tlakovej nádobe.
Po inhalácii Fosteru Nexthaler maximálne koncentrácie (C
max) formoterolu sa dosiahli do 5 minút a boli vyššie (+ 47 %) pre inhalačný prášok, zatiaľ čo celková expozícia (AUC
t) bola porovnateľná pre obidve liečby.
V jednej štúdii sa sledovalo relatívne dodanie do pľúc s použitím blokovania absorpcie lieku z gastrointestinálneho traktu aktívnym uhlím a použitím schváleného „spaceru“ AeroChamberPlus k inhalácii pre referenčný liek (inhalačný roztok v tlakovom obale).
Za týchto podmienok mali Nexthaler a inhalačný roztok v tlakovom obale ekvivalentné AUC
t pre obidve liečivá beklometazón-17-monopropionát a formoterol (pomer inhalačný prášok/inhalačný roztok v tlakovom obale roztoku a 90 % intervalu spoľahlivosti bolo v rozsahu 80-125 %); avšak C
max beklometazón-17-monopropionátu bola nižšia (-38 %) po inhalácii z Nexthaleru.
5.3 Predklinické údaje o bezpečnostiNeklinické údaje pre jednotlivé zložky Fosteru Nexthaler získané v konvenčných farmakologických štúdiách bezpečnosti a toxicity po opakovanom podávaní, neodhalili žiadne osobitné riziko pre ľudí. Profil toxicity kombinácie odráža profil jednotlivých zložiek bez zvýšenia toxicity alebo neočakávaných nálezov.
Reprodukčné štúdie na potkanoch preukázali účinky závislé na veľkosti dávky. Prítomnosť vysokých dávok beklometazóndipropionátu bola spojená so zníženou fertilitou u samíc, znížením počtu plodov a embryofetálnou toxicitou. Je známe, že vysoké dávky kortikosteroidov spôsobujú abnormality vo vývine plodu vrátane rázštepu podnebia a vnútromaternicového spomaleniu rastu. Je pravdepodobné, že tieto účinky pozorované pri kombinácii beklometazóndipropionát/formoterolu spôsobil beklometazóndipropionát. Tieto účinky sa zaznamenali iba pri veľkej systémovej expozícii účinného metabolitu beklometazón-17-monopropionátu (200-krát vyššou ako očakávané plazmatické hladiny u pacientov). Navyše, v štúdiách na zvieratách sa pozorovalo dlhšie trvanie gravidity alebo pôrodu, čo je zapríčinené známym tokolytickým účinkom b
2-sympatomimetík. Tieto účinky sa zaznamenali, keď plazmatické hladiny formoterolu matiek boli nižšie ako sa očakávali u pacientov liečených Fosterom Nexthaler.
Štúdie genotoxicity uskutočnené s kombináciou beklometazóndipropionát/formoterolu nenaznačujú žiadny mutagénny potenciál. Neuskutočnili sa žiadne štúdie na karcinogenicitu s uvedenou kombináciou. Jednako údaje o jednotlivých zložkách, získané na zvieratách nenaznačujú žiadne potenciálne riziko karcinogenicity u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokmonohydrát laktózy (ktorý obsahuje malé množstvo mliečnych bielkovín),
magnéziumstearát.
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky
Po prvom otvorení hliníkovej fólie liek spotrebujte do 6 mesiacov.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Inhalátor vyberte z hliníkovej fólie iba bezprostredne pred prvým použitím.
Pred prvým otvorením hliníkovej fólie:
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie.
Po prvom otvorení hliníkovej fólie:
Uchovávajte pri teplote do 25 °C.
6.5 Druh obalu a obsah balenia Každá škatuľka obsahuje 1, 2 alebo 3 inhalátory Nexthaler, ktorý každý obsahuje 1,50 g alebo 2,22 g inhalačného prášku na dodanie 120 alebo 180 inhalácií.
Každý inhalátor je uložený v zatavenej hliníkovej fólii vyrobenej z PET/AL/PE (polyetyléntereftalát/alumínium/polyetylén) alebo PA/Al/PE (polyamid/alumínium/polyetylén).
Na trh nemusia byť uvedené všetky veľkosti balenia.
Foster Nexthaler je viacdávkový inhalátor. Inhalátor sa skladá z pevného plastového obalu s okienkom, v ktorom sa zobrazuje počet zostávajúcich dávok a neoddeliteľného krytu. Po otvorení krytu, ktorý ovplyvňuje mechanizmus počítania dávok, sa odhalí náustok, prostredníctvom ktorého sa liek inhaluje. Inhalátor a náustok sú vyrobené z akrylonitril-butadién-styrénu a kryt je vyrobený z polypropylénu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIChiesi Pharmaceuticals GmbH, Gonzagagasse 16/16, Viedeň, Rakúsko
8. REGISTRAČNÉ ČÍSLO14/0506/12-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28.11.2012
Dátum predĺženia registrácie: 18.10.2018
10. DÁTUM REVÍZIE TEXTUApríl 2019