etí mladších ako 3 roky neboli stanovené.
Spôsob podávaniaImunizácia sa má uskutočniť intramuskulárnou injekciou.
Opatrenia pred zaobchádzaním alebo podaním liekuPokyny na prípravu očkovacej látky pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na ktorúkoľvek zložku, ktorá môže byť prítomná v stopových množstvách, napríklad na vajcia (ovalbumín, kuracie bielkoviny), formaldehyd, gentamicíniumsulfát a deoxycholát sodný.
Imunizácia sa má odložiť u pacientov s horúčkovitým ochorením alebo akútnou infekciou.
4.4 Osobitné upozornenia a opatrenia pri používaní
V súlade so správnou klinickou praxou sa má pred očkovaním podrobne odobrať anamnéza (najmä s ohľadom na predchádzajúce očkovanie a na možný výskyt nežiaducich udalostí) a urobiť klinické vyšetrenie očkovaného.
Tak ako pri všetkých injekčne podávaných očkovacích látkach, musí byť pre prípad anafylaktickej reakcie vyskytujúcej sa po podaní očkovacej látky vždy okamžite k dispozícii zodpovedajúca liečba a lekársky dohľad.
Tvorba protilátok u pacientov s endogénnou alebo iatrogénnou imunosupresiou nemusí byť dostatočná.
Fluarix Tetra nie je účinný proti všetkým možným kmeňom vírusu chrípky. Fluarix Tetra je určený na poskytnutie ochrany pred tými kmeňmi vírusu, z ktorých je očkovacia látka pripravená a pred blízko príbuznými kmeňmi.
Tak ako pri každej očkovacej látke, ochranná imunitná odpoveď sa nemusí vyvolať u všetkých očkovaných.
Fluarix Tetra sa nesmie za žiadnych okolností podať intravaskulárne.
Tak ako iné očkovacie látky podávané intramuskulárne, Fluarix Tetra sa musí podávať opatrne osobám s trombocytopéniou alebo akoukoľvek poruchou zrážanlivosti krvi, pretože po intramuskulárnom podaní môže u týchto osôb nastať krvácanie.
Synkopa (strata vedomia) sa môže vyskytnúť po, alebo dokonca pred akýmkoľvek očkovaním zvlášť u dospievajúcich ako psychogénna odpoveď na vpich ihlou. Môže to byť sprevádzané viacerými neurologickými prejavmi ako je prechodná vizuálna porucha, parestézia a tonicko‑klonické pohyby končatín počas zotavovania. Je dôležité, aby sa zaviedli postupy na predchádzanie zranenia zo straty vedomia.
Interferencia so sérologickým testovaním
Pozri časť 4.5.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie. Ak sa má Fluarix Tetra podať v rovnakom čase ako iná injekčne podávaná očkovacia látka, očkovacie látky sa musia vždy podať do rôznych miest vpichu.
Po očkovaní proti chrípke boli pozorované falošne pozitívne výsledky v sérologických testoch využívajúcich metódu ELISA na detekciu protilátok proti HIV1, hepatitíde C a hlavne HTLV1. Tieto falošne pozitívne výsledky v testoch ELISA vyvracia technika Western Blot. Prechodne falošne pozitívne reakcie môžu byť dôsledkom IgM odpovede vyvolanej očkovacou látkou.
4.6 Fertilita, gravidita a laktácia
GraviditaInaktivované očkovacie látky proti chrípke možno použiť vo všetkých štádiách tehotenstva. V porovnaní s prvým trimestrom sú od druhého a tretieho trimestra dostupné väčšie súbory údajov týkajúcich sa bezpečnosti; avšak údaje získané z celosvetového použitia inaktivovaných očkovacích látok proti chrípke nenaznačujú, že by očkovanie mohlo mať nežiaduce účinky na plod a matku.
LaktáciaFluarix Tetra sa môže použiť počas laktácie.
FertilitaK dispozícii nie sú žiadne údaje týkajúce sa fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Fluarix Tetra nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Klinické skúšaniaSúhrn bezpečnostného profiluV dvoch klinických štúdiách bol zdravým dospelým vo veku 18 a viac rokov a zdravým deťom vo veku 3 až 17 rokov podaný Fluarix Tetra (viac ako 3 000 dospelých a 900 detí) alebo trivalentná očkovacia látka proti chrípke od spoločnosti GlaxoSmithKline, Fluarix (viac ako 1 000 dospelých a 900 detí).
U osôb, ktorým bol podaný Fluarix Tetra alebo Fluarix, sa pozoroval podobný výskyt cielene sledovaných nežiaducich udalostí.
Vo všetkých vekových skupinách bola najčastejšie hlásenou lokálnou nežiaducou reakciou po očkovaní bolesť v mieste vpichu (36,4 % až 40,9 %).
U dospelých vo veku 18 a viac rokov boli najčastejšie hlásenými celkovými nežiaducimi reakciami po očkovaní únava (11,1 %), bolesť hlavy (9,2 %) a myalgia (11,8 %).
U osôb vo veku 6 až 17 rokov boli najčastejšie hlásenými celkovými nežiaducimi reakciami po očkovaní únava (12,6 %), myalgia (10,9 %) a bolesť hlavy (8,0 %).
U osôb vo veku 3 až 5 rokov boli najčastejšie hlásenými celkovými nežiaducimi reakciami po očkovaní ospalosť (9,8 %) a podráždenosť (11,3 %).
Zoznam nežiaducich reakciíNežiaduce reakcie hlásené pri Fluarixe Tetra sú uvedené podľa výskytu na dávku podľa nasledujúcich kategórií frekvencie:
Veľmi časté ≥ 1/10
Časté ≥ 1/100 až < 1/10
Menej časté ≥ 1/1 000 až < 1/100
Zriedkavé ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé < 1/10 000
Poruchy metabolizmu a výživyČasté: nechutenstvo
1Psychické poruchyVeľmi časté: podráždenosť
1Poruchy nervového systémuČasté: ospalosť
1, bolesť hlavy
Menej časté: závraty
2Poruchy gastrointestinálneho traktuČasté: gastrointestinálne príznaky (vrátane nauzey, vracania, hnačky a/alebo bolesti brucha)
Poruchy kože a podkožného tkanivaMenej časté: vyrážka
3Poruchy kostrovej a svalovej sústavy a spojivového tkanivaVeľmi časté: myalgia
Časté: artralgia
Celkové poruchy a reakcie v mieste podaniaVeľmi časté: bolesť v mieste vpichu, únava
Časté: začervenanie v mieste vpichu
4, opuch v mieste vpichu
4, triaška, horúčka
Menej časté: hematóm v mieste vpichu
2, pruritus v mieste vpichu
1hlásené ako cielene sledovaný príznak u osôb mladších ako 6 rokov
2hlásené u dospelých osôb
3hlásené u osôb vo veku 3 roky až 17 rokov
4veľmi časté u osôb vo veku 3 roky až 17 rokov
V predchádzajúcich štúdiách s Fluarixom boli navyše hlásené nasledujúce nežiaduce reakcie:
Poruchy kože a podkožného tkanivaČasté: potenie
Celkové poruchy a reakcie v mieste podaniaČasté: indurácia v mieste vpichu
Údaje získané v období po uvedení lieku na trhK dispozícii nie sú udaje o expozícii Fluarixu Tetra v období po jeho uvedení na trh. Nakoľko sú však vo Fluarixe Tetra zahrnuté všetky tri kmene vírusu chrípky, ktoré sú obsiahnuté vo Fluarixe, u pacientov, ktorým bude Fluarix Tetra podaný po schválení sa môžu vyskytnúť nasledujúce nežiaduce udalosti, ktoré sa pozorovali v rámci sledovania po uvedení Fluarixu na trh.
Poruchy krvi a lymfatického systémuZriedkavé: prechodná lymfadenopatia
Poruchy imunitného systémuZriedkavé: alergické reakcie (vrátane anafylaktických reakcií)
Poruchy nervového systémuZriedkavé: neuritída, akútna diseminovaná encefalomyelitída, Guillainov‑Barrého syndróm*
*Po očkovaní Fluarixom boli obdržané spontánne hlásenia Guillainovho‑Barrého syndrómu; avšak príčinná súvislosť medzi očkovaním a Guillainovým‑Barrého syndrómom nebola stanovená.
Poruchy kože a podkožného tkanivaZriedkavé: urtikária, pruritus, erytém, angioedém
Celkové poruchy a reakcie v mieste podaniaZriedkavé: ochorenie podobné chrípke, malátnosť
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 Predávkovanie
Je nepravdepodobné, že by predávkovanie spôsobilo nejaký nežiaduci účinok.
5. Farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Očkovacia látka proti chrípke, ATC kód: J07BB02
Mechanizmus účinkuFluarix Tetra poskytuje aktívnu imunizáciu proti kmeňom vírusu chrípky (proti dvom podtypom vírusu A a dvom typom vírusu B) obsiahnutým v očkovacej látke.
Fluarix Tetra indukuje tvorbu humorálnych protilátok proti hemaglutinínom. Tieto protilátky neutralizujú vírusy chrípky.
Špecifické hladiny titra hemaglutináciu‑inhibujúcich (HI) protilátok po očkovaní inaktivovanými očkovacími látkami proti chrípke nekorelujú s ochranou pred chrípkovým ochorením, ale titre HI protilátok sa používajú na hodnotenie účinnosti očkovacej látky. V niektorých štúdiách s provokačnými dávkami podanými ľuďom boli titre HI protilátok ≥ 1:40 spájané s ochranou pred chrípkovým ochorením až u 50 % osôb.
Farmakodynamické účinkyImunogenita Fluarixu Tetra v porovnaní s FluarixomKlinické štúdie vykonané s dospelými (D‑QIV‑001 a D‑QIV‑008) a s deťmi vo veku 3 roky až 17 rokov (D‑QIV‑003) hodnotili noninferioritu Fluarixu Tetra v porovnaní s Fluarixom v zmysle geometrického priemeru titru protilátok (GMT) na 21. deň (u dospelých) a na 28. deň (u detí) a mieru sérokonverzie stanovenú pomocou testu inhibície hemaglutinácie (HI) (4‑násobný vzostup v recipročnom titri alebo zmena z nedetegovateľného [< 10] na recipročný titer ≥ 40).
Vo všetkých štúdiách bola imunitná odpoveď na tri spoločné kmene vyvolaná Fluarixom Tetra noninferiórna Fluarixu. Fluarix Tetra vyvolal lepšiu imunitnú odpoveď na dodatočný kmeň vírusu B zahrnutý vo Fluarixe Tetra v porovnaní s Fluarixom.
Dospelí vo veku 18 a viac rokovV klinickej štúdii D‑QIV‑008 bola približne 1 800 dospelým vo veku 18 a viac rokov podaná jednorazová dávka Fluarixu Tetra a približne 600 osobám bola podaná jednorazová dávka Fluarixu.
Tabuľka 1: GMT a miery sérokonverzie po očkovaníDospelí vo veku 18 a viac rokov
| Fluarix Tetra
N = 1 809
| Fluarix™1
N = 608
|
| GMT (95 % interval spoľahlivosti)
|
A/H1N1
| 201,1 (188,1;215,1)
| 218,4 (194,2;245,6)
|
A/H3N2
| 314,7 (296,8;333,6)
| 298,2 (268,4;331,3)
|
B (Victoria)2
| 404,6 (386,6;423,4)
| 393,8 (362,7;427,6)
|
B (Yamagata)3
| 601,8 (573,3;631,6)
| 386,6 (351,5;425,3)
|
| Miera sérokonverzie (95 % interval spoľahlivosti)
|
A/H1N1
| 77,5% (75,5;79,4)
| 77,2% (73,6;80,5)
|
A/H3N2
| 71,5% (69,3;73,5)
| 65,8% (61,9;69,6)
|
B (Victoria)
| 58,1% (55,8;60,4)
| 55,4% (51,3;59,4)
|
B (Yamagata)
| 61,7% (59,5;64,0)
| 45,6% (41,6;49,7)
|
1obsahujúci A/H1N1, A/H3N2 a B (línia Victoria)
2kmeň odporúčaný SZO počas sezóny 2010‑2011
3dodatočný kmeň vírusu B obsiahnutý vo Fluarixe Tetra odporúčaný v sezóne 2008‑2009
Pri Fluarixe Tetra bola miera sérokonverzie po očkovaní (recipročný titer ≥ 40 na 21. deň) 91,3 % proti A/H1N1, 96,8 % proti A/H3N2, 98,8 % proti B (Victoria) a 91,8 % proti B (Yamagata).
V klinickej štúdii D‑QIV‑001 (zloženie očkovacej látky zo sezóny 2007‑2008) bola pri Fluarixe Tetra miera séroprotekcie 92,3 % proti A/H1N1, 97,1 % proti A/H3N2, 97,1 % proti B (Victoria) a 98,1 % proti B (Yamagata).
Deti vo veku 3 ‑ 17 rokovV klinickej štúdii (D‑QIV‑003) bola približne 900 deťom vo veku 3 ‑ 17 rokov podaná jedna alebo dve dávky Fluarixu Tetra alebo Fluarixu.
Tabuľka 2: GMT a miery sérokonverzie po očkovaníDeti vo veku 3 roky až 17 rokov
| Fluarix Tetra
N = 791
| Fluarix1
N = 818
|
| GMT (95 % interval spoľahlivosti)
|
A/H1N1
| 386,2 (357,3;417,4)
| 433,2 (401,0;468,0)
|
A/H3N2
| 228,8 (215,0;243,4)
| 227,3 (213,3;242,3)
|
B (Victoria)2
| 244,2 (227,5;262,1)
| 245,6 (229,2;263,2)
|
B (Yamagata)3
| 569,6 (533,6;608,1)
| 224,7 (207,9;242,9)
|
| Miera sérokonverzie (95 % interval spoľahlivosti)
|
A/H1N1
| 91,4% (89,2;93,3)
| 89,9% (87,6;91,8)
|
A/H3N2
| 72,3% (69,0;75,4)
| 70,7% (67,4;73,8)
|
B (Victoria)
| 70,0% (66,7;73,2)
| 68,5% (65,2;71,6)
|
B (Yamagata)
| 72,5% (69,3;75,6)
| 37,0% (33,7;40,5)
|
1obsahujúci A/H1N1, A/H3N2 a B (línia Victoria)
2kmeň odporúčaný SZO počas sezóny 2010‑2011
3dodatočný kmeň vírusu B obsiahnutý vo Fluarixe Tetra odporúčaný v sezóne 2008‑2009
Pri Fluarixe Tetra bola miera séroprotekcie po očkovaní 96,6 % proti A/H1N1, 98,0 % proti A/H3N2, 97,3 % proti B (Victoria) a 99,2 % proti B (Yamagata).
Účinnosť u dospelých vo veku 18 ‑ 64 rokovKlinická štúdia vykonaná s viac ako 7 600 osobami v Českej republike a vo Fínsku hodnotila účinnosť Fluarixu v prevencii kultivačne potvrdených prípadov chrípky typu A a/alebo typu B pri kmeňoch vírusu antigénovo zhodných s kmeňmi v očkovacej látke.
Osoby boli sledované kvôli ochoreniu podobnému chrípke, ktoré malo byť potvrdené kultiváciou (výsledky si pozrite v nasledujúcej tabuľke). Ochorenie podobné chrípke bolo definované ako aspoň jeden celkový príznak (horúčka ≥ 37,8 °C a/alebo myalgia) a aspoň jeden respiračný príznak (kašeľ a/alebo bolesť v hrdle).
Tabuľka 3: Výskyt atakov chrípky a účinnosť očkovacej látky proti ochoreniu súvisiacemu s preukázanou infekciou vírusom chrípky A alebo B u dospelých vo veku 18 až 64 rokov (Celková očkovaná skupina)'
| Výskyt atakov chrípky (n/N)1
| Účinnosť očkovacej látky (95 % IS2)
|
| N
| n
| %
| %
| LL3
| UL
|
Antigénovo zhodný, kultivačne potvrdený vírus chrípky4
|
Fluarix™
| 5 103
| 49
| 1,0
| 66,9
| 51,9
| 77,4
|
Placebo
| 2 549
| 74
| 2,9
| -
| -
| -
|
Všetky kultivačne potvrdené prípady chrípky (zhodný, nezhodný a neurčený typ vírusu)5
|
Fluarix™
| 5 103
| 63
| 1,2
| 61,6
| 46,0
| 72,8
|
Placebo
| 2 549
| 82
| 3,2
| -
| -
| -
|
1n/N: počet prípadov/celkový počet osôb
2IS: interval spoľahlivosti
3LL: dolná hranica
4Pri Fluarixe ani pri placebe sa nezistili žiadne kultivačne potvrdené prípady chrípky spôsobenej kmeňmi A/New Caledonia/20/1999 (H1N1) alebo B/Malaysia/2506/2004 zhodujúcimi sa s kmeňmi v očkovacej látke
5Z 22 dodatočných prípadov išlo v 18 prípadoch o nezhodný vírus a v 4 prípadoch nebol typ vírusu určený; v 15 z 22 prípadoch išlo o A (H3N2) (11 prípadov pri Fluarixe a 4 prípady pri placebe).
V tejto štúdii bola hodnotená aj imunogenita.
Tabuľka 4: GMT a miery sérokonverzie po očkovaníDospelí vo veku 18 rokov až 64 rokov
| Fluarix1
N = 291
|
| GMT (95 % interval spoľahlivosti)
|
A/H1N1
| 541,0 (451,0;649,0)
|
A/H3N2
| 133,2 (114,6;154,7)
|
B (Victoria)
| 242,8 (210,7;279,7)
|
| Miera sérokonverzie (95 % interval spoľahlivosti)
|
A/H1N1
| 76,3% (71,0;81,1)
|
A/H3N2
| 73,9% (68,4;78,8)
|
B (Victoria)
| 85,2% (80,6;89,1)
|
1obsahujúci A/H1N1, A/H3N2 a B (línia Victoria)
Miera séroprotekcie po očkovaní bola 97,6 % proti A/H1N1, 86,9 % proti A/H3N2 a 96,2 % proti B (Victoria).
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Fluarixom Tetra v jednej alebo vo viacerých podskupinách pediatrickej populácie pri prevencii chrípkového ochorenia spôsobeného dvoma podtypmi vírusu chrípky A a dvoma typmi vírusu chrípky B obsiahnutými v očkovacej látke (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdii akútnej toxicity, lokálnej tolerancie, toxicity po opakovanom podávaní a reprodukčnej/vývojovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný, dodekahydrát hydrogénfosforečnanu sodného, dihydrogénfosforečnan draselný, chlorid draselný, hexahydrát chloridu horečnatého, tokoferolhydrogénsukcinát alfa, polysorbát 80, oktoxinol 10 a voda na injekciu.
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
1 rok
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
0,5 ml suspenzia v naplnenej injekčnej striekačke (sklo typu I) s gumovou zátkou (šedý butylkaučuk) s pevne pripojenou ihlou, s oddelenými ihlami alebo bez ihly, v nasledujúcich veľkostiach balenia:
- s pevne pripojenou ihlou: veľkosti balenia 1 alebo 10,
- s 1 oddelenou ihlou: veľkosti balenia 1 alebo 10,
- s 2 oddelenými ihlami: veľkosti balenia 1,
- bez ihly: veľkosti balenia 1 alebo 10.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím pretrepte. Pred podaním očkovaciu látku vizuálne skontrolujte.
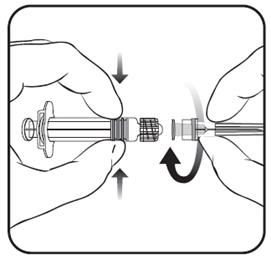
Pokyny na podanie očkovacej látky obsiahnutej v naplnenej injekčnej striekačke bez pevne pripojenej ihlyPripojte ihlu k injekčnej striekačke tak, ako je znázornené nižšie.
 Ihla
Ihla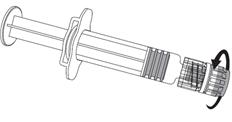 Injekčná striekačka
Injekčná striekačka
1. Držte
valec injekčnej striekačky v jednej ruke (dbajte na to, aby ste nedržali piest injekčnej striekačky) a odskrutkujte uzáver injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
2. Pripojte ihlu k injekčnej striekačke tak, že budete ihlu nasadenú na injekčnú striekačku otáčať v smere hodinových ručičiek, pokým neucítite, že sa uzamkla (pozri obrázok).
3. Odstráňte ochranný kryt ihly, ktorý pri tom môže klásť malý odpor.
4. Podajte očkovaciu látku.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
GlaxoSmithKline Biologicals S.A.
Rue de l’Institut 89
1300 Rixensart
Belgicko
8. REGISTRAČNÉ ČÍSLO
59/0114/14-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 26.marec 2014
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTU
August 2015