potrebu liečby perorálnymi kortikosteroidmi. Taktiež spomaľuje zhoršovanie zdravotného stavu.
4.2 Dávkovanie a spôsob podávaniaFlixotide Diskus je určený len na perorálnu inhaláciu.
Pacientom je potrebné vysvetliť, že liečba inhalačným flutikazónpropionátom má profylaktický charakter a je ju potrebné užívať pravidelne, a to aj v asymptomatickom období.
Astma
Nástup terapeutického účinku je 4 až 7 dní, aj keď u pacientov bez predošlej liečby inhalačnými steroidmi môže byť účinok liečby čiastočne pozorovaný už do 24 hodín.
Ak pacienti zistia, že po liečbe krátkodobo pôsobiacimi bronchodilatanciami nedochádza k bežnej úľave, alebo že potrebujú viac inhalácií ako zvyčajne, musia sa poradiť s lekárom.
Dospelí a deti staršie ako 16 rokov:100 až 1000 μg dvakrát denne.
Pacientom sa má podať počiatočná dávka inhalačného flutikazónpropionátu, ktorá zodpovedá závažnosti ich ochorenia:
Ľahká astma - 100 až 250 μg dvakrát denne.
Stredne ťažká astma - 250 až 500 μg dvakrát denne.
Ťažká astma - 500 až 1000 μg dvakrát denne.
Dávka sa môže následne upravovať až do dosiahnutia kontroly alebo znížiť na minimálnu účinnú dávku, v závislosti od individuálnej odpovede na liečbu.
Počiatočná dávka flutikazónpropionátu sa alternatívne môže stanoviť ako polovica celkovej dennej dávky beklometazón dipropionátu alebo iného ekvivalentu, podávaného prostredníctvom inhalátora s dávkovačom (MDI).
Deti vo veku 4 a viac rokov:50 až 200 μg dvakrát denne.
U mnohých detí sa dobrá kontrola astmy dosiahne pomocou dávkovacieho režimu 50 μg až 100 μg dvakrát denne. U pacientov s nedostatočnou kontrolou astmy je možné dosiahnuť lepší efekt zvýšením dávky až na 200 μg dvakrát denne.
Deťom sa má podať počiatočná dávka inhalačného flutikazónpropionátu, ktorá zodpovedá závažnosti ich ochorenia.
Dávka sa môže následne upravovať až do dosiahnutia kontroly alebo znížiť na minimálnu účinnú dávku, v závislosti od individuálnej odpovede pacienta na liečbu.
Deti vo veku od 1 do 4 rokov:Táto inhalačná pomôcka sa neodporúča používať u detí vo veku od 1 do 4 rokov. V tejto vekovej skupine, prosím, použite Flixotide inhaler a dávkovacie odporúčania, ktoré sa naň vzťahujú.
Chronická obštrukčná choroba pľúc (CHOCHP)Dospelí:500 μg dvakrát denne.
Pacientom treba vysvetliť, že na dosiahnutie optimálneho účinku sa Flixotide Diskus musí používať každý deň. Účinok sa zvyčajne prejaví v priebehu 3 až 6 mesiacov. Ak však po uplynutí 3 až 6 mesiacov nenastane žiadne zlepšenie, pacient má podstúpiť lekárske vyšetrenie.
Osobitné skupiny pacientovU starších pacientov alebo u pacientov s poruchou funkcie pečene alebo obličiek nie je potrebná úprava dávky.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníLiečba astmy sa má riadiť metódou postupných krokov a odpoveď pacienta je potrebné monitorovať klinicky a vyšetrovaním funkcie pľúc.
Zvýšené používanie krátkodobo pôsobiacich inhalačných β
2-agonistov na zmiernenie príznakov astmy svedčí o zhoršení kontroly astmy. V takomto prípade sa má prehodnotiť terapeutický plán pacienta.
Náhle a pokračujúce zhoršovanie kontroly astmy je potenciálne život ohrozujúce a je potrebné zvážiť zvýšenie dávky kortikosteroidov. U rizikových pacientov môže byť vhodné každodenné sledovanie maximálneho výdychového prietoku.
Flixotide Diskus sa nemá používať na liečbu akútnych záchvatov astmy, ale na bežnú dlhodobú liečbu. Na zmiernenie akútnych príznakov astmy potrebujú pacienti rýchlo a krátkodobo pôsobiace inhalačné bronchodilatanciá.
Nedostatočná odpoveď na liečbu, alebo ťažké exacerbácie astmy sa majú liečiť zvýšením dávky inhalačného flutikazónpropionátu a v prípade potreby podaním systémových steroidov a/alebo antibiotík v prípade infekcie.
Systémové účinky sa môžu objaviť pri akýchkoľvek inhalačných kortikosteroidoch, hlavne pri dlhodobom užívaní vysokých dávok. Výskyt týchto účinkov je oveľa menej pravdepodobný ako pri perorálnych kortikosteroidoch (pozri časť 4.9 ). Možné systémové účinky zahŕňajú Cushingov syndróm, Cushingoidné prejavy, útlm funkcie nadobličiek, spomalenie rastu u detí a dospievajúcich, zníženie kostnej denzity, kataraktu a glaukóm a zriedkavejšie aj rôzne účinky na psychiku alebo správanie zahŕňajúce psychomotorickú hyperaktivitu, poruchy spánku, úzkosť, depresiu alebo agresivitu (hlavne u detí). Preto je dôležité, aby bola dávka inhalačného kortikosteroidu stanovená na najnižšej dávke, pri ktorej je ešte zachovaná účinná kontrola astmy (pozri časť 4.8).
Odporúča sa pravidelné monitorovanie výšky u detí dlhodobo užívajúcich inhalačné kortikosteroidy.
Niektorí jedinci môžu byť na účinky inhalačných kortikosteroidov vnímavejší než ostatná populácia.
Pre možnosť narušenia funkcie nadobličiek majú byť pacienti prechádzajúci z liečby perorálnymi steroidmi na liečbu inhalačným flutikazónpropionátom liečení so zvláštnou opatrnosťou a funkcia kôry nadobličiek má byť pravidelne sledovaná.
Po nasadení inhalačného flutikazónpropionátu má byť vysadenie systémovej liečby postupné a pacientom sa má odporučiť, aby so sebou nosili kartu upozorňujúcu na to, že v čase stresu môžu potrebovať prídavnú liečbu steroidmi.
Nahradenie liečby systémovými steroidmi inhalačnou liečbou môže tiež demaskovať alergie, ako sú alergická rinitída alebo ekzém, predtým potlačené systémovým liekom. Tieto alergie je potrebné symptomaticky liečiť antihistaminikami a/alebo lokálnymi liekmi vrátane lokálnych steroidov.
Liečba s Flixotide Diskus sa nesmie ukončiť náhle.
Veľmi zriedkavo boli hlásené prípady zvýšených hladín glukózy v krvi (pozri časť 4.8 Nežiaduce účinky), na tento poznatok je potrebné myslieť pri predpisovaní tohto lieku pacientom s diabetom mellitus v anamnéze.
Tak ako u všetkých inhalačných kortikosteroidov, zvláštnu opatrnosť je potrebné venovať pacientom s aktívnou alebo inaktívnou tuberkulózou pľúc.
Počas postmarketingového používania boli hlásené klinicky významné liekové interakcie u pacientov užívajúcich flutikazónpropionát a ritonavir, ktoré mali za následok systémové účinky kortikosteroidov vrátane Cushingovho syndrómu a útlmu funkcie nadobličiek. Z tohto dôvodu je potrebné sa vyhnúť súčasnému použitiu flutikazónpropionátu a ritonaviru, pokiaľ možný prínos pre pacienta neprevyšuje riziko systémových vedľajších účinkov kortikosteroidov (pozri časť 4.5 Liekové a iné interakcie).
V prípade kritických situácií, vrátane chirurgického zákroku a situácií, ktoré pravdepodobne spôsobia stres, je vždy potrebné myslieť na možnosť narušenej reakcie nadobličiek a je potrebné zvážiť vhodnú liečbu kortikosteroidmi (pozri časť 4.9 Predávkovanie).
Pri liečbe flutikazónpropionátom v odporúčaných dávkach zostáva adrenálna funkcia a adrenálna rezerva zvyčajne v normálnom rozsahu. Prínosom liečby inhalačným flutikazónpropionátom je minimalizácia potreby perorálnych steroidov. V prechodnom období zmeny liečby z perorálnej na inhalačnú však ešte môže pretrvávať riziko nežiaducich účinkov vyvolaných predchádzajúcou alebo intermitentnou liečbou perorálnymi steroidmi. Pred elektívnymi zákrokmi môže byť preto potrebné konzultovať rozsah adrenálnej dysfunkcie so špecialistom.
V štúdiách u pacientov s CHOCHP užívajúcich 500 mikrogramov flutikazónpropionátu bol hlásený zvýšený výskyt pneumónie (pozri časť 4.8 Nežiaduce účinky). U pacientov s CHOCHP musia lekári zostať ostražití kvôli možnému vzniku pneumónie, pretože klinické prejavy pneumónie a exacerbácie sa často prekrývajú.
4.5 Liekové a iné interakcie Za normálnych okolností je po inhalačnom podávaní plazmatická koncentrácia flutikazónpropionátu nízka vďaka rozsiahlemu metabolizmu pri prvom prechode pečeňou a vysokému systémovému klírensu sprostredkovanému cytochrómom P450 3A4 v čreve a pečeni. Z toho dôvodu nie sú klinicky významné liekové interakcie sprostredkované flutikazónpropionátom pravdepodobné.
V štúdii so zdravými dobrovoľníkmi zameranej na liekové interakcie sa dokázalo, že ritonavir (veľmi silný inhibítor cytochrómu P450 3A4) môže značne zvýšiť plazmatické koncentrácie flutikazónpropionátu, čo má za následok výrazne znížené koncentrácie kortizolu v sére. Počas postmarketingového použitia boli hlásené klinicky významné liekové interakcie u pacientov užívajúcich intranazálny alebo inhalačný flutikazónpropionát a ritonavir, ktoré mali za následok systémové účinky kortikosteroidov vrátane Cushingovho syndrómu a útlmu funkcie nadobličiek. Z tohto dôvodu sa má vyhnúť súčasnému použitiu flutikazónpropionátu a ritonaviru, pokiaľ možný prínos pre pacienta neprevyšuje riziko systémových vedľajších účinkov kortikosteroidov.
V štúdiách sa dokázalo, že ďalšie inhibítory cytochrómu P450 3A4 spôsobujú zanedbateľné (erytromycín) a mierne (ketokonazol) zvýšenia systémovej expozície flutikazónpropionátu bez výrazného zníženia koncentrácií kortizolu v sére. Napriek tomu sa odporúča opatrnosť pri súčasnom podávaní silných inhibítorov cytochrómu P450 3A4 (napr. ketokonazolu), pretože existuje možnosť zvýšenej systémovej expozície flutikazónpropionátu.
4.6 Fertilita, gravidita a laktácia
GraviditaBezpečnosť používania flutikazónpropionátu v gravidite u žien nie je dostatočne dokázaná. Reprodukčné štúdie na zvieratách ukázali len účinky typické pre glukokortikosteroidy pri systémových expozíciách prevyšujúcich systémové expozície pozorované pri inhalačnom podávaní odporúčanej terapeutickej dávky. Testy na genetickú toxicitu neukázali žiadny mutagénny potenciál.
O aplikácii flutikazónpropionátu rovnako ako o aplikácii iných liekov počas gravidity sa však má uvažovať len vtedy, ak je očakávaný prínos pre matku väčší ako akékoľvek možné riziko pre plod.
LaktáciaVylučovanie flutikazónpropionátu do ľudského materského mlieka nebolo skúmané. Po subkutánnom podaní laboratórnym potkanom v laktácii bolo možné dokázať flutikazónpropionát v materskom mlieku potkanov. Po inhalačnom podaní odporúčaných dávok flutikazónpropionátu sú však plazmatické hladiny u pacientov pravdepodobne nízke.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeVplyv flutikazónpropionátu na schopnosť viesť vozidlá a obsluhovať stroje nie je pravdepodobný.
4.8 Nežiaduce účinkyNežiaduce účinky sú nižšie uvedené podľa tried orgánových systémov a frekvencie. Frekvencie sú definované ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000 až <1/100), zriedkavé (≥1/10 000 až <1/1000) a veľmi zriedkavé (<1/10 000), zahŕňajúce ojedinelé hlásenia a neznáme (z dostupných údajov).Veľmi časté, časté a menej časté nežiaduce účinky boli zvyčajne určené z údajov z klinických štúdií. Zriedkavé a veľmi zriedkavé nežiaduce účinky boli zvyčajne určené zo spontánnych hlásení.
Infekcie a nákazyVeľmi časté: kandidóza ústnej dutiny a hrdla.
U niektorých pacientov sa môže objaviť kandidóza (soor) ústnej dutiny a hrdla. Takýmto pacientom môže pomôcť výplach úst vodou po použití inhalátora Diskus. Symptomatická kandidóza môže byť liečená lokálnymi antimykotickými liekmi aj pri pokračovaní liečby s liekom Flixotide Diskus.
Časté: pneumónia (u pacientov s CHOCHP).
Poruchy imunitného systémuBoli hlásené reakcie z precitlivenosti s nasledujúcimi prejavmi:
Menej časté: kožné reakcie z precitlivenosti.
Veľmi zriedkavé: angioedém (hlavne edém tváre a orofaryngeálny edém), respiračné symptómy
(dyspnoe a/alebo bronchospazmus) a anafylaktické reakcie.
Poruchy endokrinného systémuMožné systémové účinky zahŕňajú (pozri časť 4.4):
Veľmi zriedkavé: Cushingov syndróm, Cushingoidné prejavy, útlm funkcie nadobličiek, spomalenie rastu, zníženie denzity kostných minerálov, katarakta a glaukóm.
Poruchy metabolizmu a výživyVeľmi zriedkavé: hyperglykémia.
Psychické poruchy Veľmi zriedkavé: úzkosť, poruchy spánku a zmeny správania, zahŕňajúce hyperaktivitu a podráždenosť (hlavne u detí).
Neznáme: depresia a agresivita (hlavne u detí).
Ochorenia dýchacej sústavy, hrudníka a mediastínaČasté: zachrípnutie.
U niektorých pacientov môže inhalačný flutikazónpropionát spôsobiť zachrípnutie. V takomto prípade môže pomôcť výplach úst vodou ihneď po inhalácii.
Veľmi zriedkavé: paradoxný bronchospazmus.
Tak ako pri inej inhalačnej liečbe, môže dôjsť k paradoxnému bronchospazmu s okamžitým zhoršením piskotu po podaní dávky. Tento stav je nutné okamžite liečiť podaním rýchlo pôsobiaceho inhalačného bronchodilatancia. Používanie lieku Flixotide Diskus sa musí ihneď prerušiť, pacient vyšetriť a v prípade potreby začať alternatívnu liečbu.
Poruchy kože a podkožného tkanivaČasté: krvné podliatiny.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V*.
4.9 PredávkovanieSymptómy a príznakyAkútna inhalácia flutikazónpropionátu v dávkach vyšších ako sú odporúčané môže viesť k dočasnému potlačeniu osi hypotalamus-hypofýza-nadobličky. Zvyčajne nie je potrebný okamžitý zásah, pretože normálna adrenálna funkcia sa v priebehu niekoľkých dní spontánne obnoví.
Ak sa vyššie ako odporúčané dávky podávajú dlhší čas, môže dôjsť k významnému útlmu funkcie nadobličiek. Veľmi zriedkavo boli hlásené prípady akútnej adrenálnej krízy, ktorá sa vyskytla u detí vystavených vyšším ako odporúčaným dávkam (typicky 1000 µg denne a viac) počas dlhého obdobia (niekoľko mesiacov alebo rokov); pozorované prejavy zahŕňali hypoglykémiu spojenú so zníženým vedomím a/alebo kŕčmi. Situácie, ktoré by potenciálne mohli spustiť akútnu adrenálnu krízu zahŕňajú úraz, chirurgický zákrok, infekciu alebo akékoľvek rýchle zníženie dávok.
LiečbaPacienti, ktorí užívajú vyššie ako odporúčané dávky si vyžadujú starostlivú liečbu a dávka sa musí znižovať postupne.
5. Farmakologické vlastnosti5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina:Antiastmatikum
ATC kód:R03BA05
Flutikazónpropionát podávaný inhalačne v odporúčaných dávkach má silný glukokortikoidový protizápalový účinok v pľúcach, výsledkom ktorého je zmiernenie príznakov a exacerbácií astmy. Významne zmierňuje príznaky CHOCHP a zlepšuje funkciu pľúc bez ohľadu na pacientov vek, pohlavie, funkciu pľúc na začiatku liečby, fajčenie alebo prítomnosť atopie. To môže viesť k významnému zlepšeniu kvality života.
Klinické štúdie zamerané na CHOCHPTORCH bola 3-ročná štúdia hodnotiaca účinok liečby s Diskusom so salmeterolom/flutikazónom propionátom (FP) 50/500 µg dvakrát denne, Diskusom so salmeterolom 50 µg dvakrát denne, Diskusom s FP 500 µg dvakrát denne alebo placebom na úmrtnosť z akejkoľvek príčiny (celkovú úmrtnosť) u pacientov s CHOCHP. Pacientom s CHOCHP, ktorí mali pri zaradení do štúdie (pred podaním bronchodilatancia) FEV
1 < 60 % náležitých hodnôt, pridelili náhodným výberom dvojito zaslepenú liečbu. Počas štúdie bola u pacientov povolená obvyklá liečba CHOCHP s výnimkou iných inhalačných kortikosteroidov, dlhodobo pôsobiacich bronchodilatancií a dlhodobo užívaných systémových kortikosteroidov. Stav prežívania po 3 rokoch bol zisťovaný u všetkých pacientov bez ohľadu na prerušenie užívania skúšaného lieku. Primárnym cieľovým ukazovateľom bolo zníženie úmrtnosti z akejkoľvek príčiny po 3 rokoch pre salmeterol/FP oproti placebu.
| Placebo
n = 1 524
| Salmeterol 50
n = 1 521
| FP 500
n = 1 534
| Salmeterol/FP 50/500
n = 1 533
|
Úmrtnosť z akejkoľvek príčiny po 3 rokoch
|
Počet úmrtí (%)
| 231
(15,2 %)
| 205
(13,5 %)
| 246
(16,0 %)
| 193
(12,6 %)
|
Pomer rizika oproti placebu
(IS)
p-hodnota
| N/A
| 0,879
(0,73, 1,06)
0,180
| 1,060
(0,89, 1,27)
0,525
| 0,825
(0,68, 1,00 )
0,0521
|
Pomer rizika pre salmeterol/FP 50/500 oproti jeho zložkám (IS)
p-hodnota
| N/A
|
0,932
(0,77, 1,13)
0,481
|
0,774
(0,64, 0,93)
0,007
| N/A
|
1.Nevýznamná p-hodnota po úprave vzhľadom k 2 priebežným analýzam porovnávajúcim primárnu účinnosť z log-rank analýzy stratifikovanej podľa stavu fajčenia resp. nefajčenia.
|
U jedincov liečených liekom salmeterol/FP bol počas 3 rokov trend k zlepšenému prežívaniu v porovnaní s placebom, avšak v tomto parametri sa nedosiahla hladina štatistickej významnosti p ≤ 0,05.
Percento pacientov, ktorí zomreli počas 3 rokov kvôli príčinám spojeným s CHOCHP, bolo 6,0 % u placeba, 6,1 % u salmeterolu, 6,9 % u FP a 4,7 % u salmeterolu/FP.
Priemerný počet stredne ťažkých až ťažkých exacerbácií ročne bol významne znížený pri liečbe so salmeterolom/FP v porovnaní s liečbou salmeterolom, FP a placebom (v skupine so salmeterolom/FP bola priemerná hodnota výskytu 0,85 oproti 0,97 v skupine so salmeterolom, 0,93 v skupine s FP a 1,13 v skupine s placebom). Toto zodpovedá zníženiu výskytu stredne ťažkých až ťažkých exacerbácií o 25 % (95 % IS: 19 % až 31 %; p < 0,001) v porovnaní s placebom, o 12 % v porovnaní so salmeterolom (95 % IS: 5 % až 19 %, p = 0,002) a o 9 % v porovnaní s FP (95 % IS: 1 % až 16 %, p = 0,024). Salmeterol a FP významne znížili výskyt exacerbácií v porovnaní s placebom, salmeterol o 15 % (95 % IS: 7 % až 22 %; p < 0,001) a FP o 18 % (95 % IS: 11 % až 24 %; p < 0,001). '
Kvalitu života spojenú so zdravotným stavom, meranú pomocou dotazníka SGRQ (St George’s Respiratory Questionnaire /dotazník hodnotiaci kvalitu života pri respiračných ochoreniach/), zlepšili všetky aktívne lieky v porovnaní s placebom. Priemerné zlepšenie počas troch rokov so salmeterolom/FP v porovnaní s placebom bolo -3,1 jednotiek (95 % IS: -4,1 až -2,1; p < 0,001), v porovnaní so salmeterolom bolo -2,2 jednotiek (p < 0,001) a v porovnaní s FP bolo ‑1,2 jednotiek (p = 0,017). Zníženie o 4 jednotky sa považuje za klinicky významné.
Odhadovaná pravdepodobnosť vzniku pneumónie, hlásenej ako nežiaduca udalosť, počas 3 rokov bola 12,3 % u placeba, 13,3 % u salmeterolu, 18,3 % u FP a 19,6 % u salmeterolu/FP (pomer rizík u salmeterolu/FP oproti placebu: 1,64, 95 % IS: 1,33 až 2,01, p < 0,001). Nedošlo k zvýšeniu výskytu úmrtí spojených s pneumóniou; počet úmrtí počas liečby, ktoré sa posudzovali ako primárne spôsobené pneumóniou, bol 7 u placeba, 9 u salmeterolu, 13 u FP a 8 u salmeterolu/FP. Nebol žiadny významný rozdiel v pravdepodobnosti vzniku zlomeniny kosti (5,1 % u placeba, 5,1 % u salmeterolu, 5,4 % u FP a 6,3 % u salmeterolu/FP; pomer rizík u salmeterolu/FP oproti placebu: 1,22, 95 % IS: 0,87 až 1,72, p = 0,248).
5.2 Farmakokinetické vlastnostiAbsorpciaAbsolútna biologická dostupnosť flutikazónpropionátu z každej z dostupných inhalačných pomôcok bola odhadnutá na základe porovnaní inhalačných a intravenóznych farmakokinetických údajov uskutočnených v rámci štúdií a medzi štúdiami . U zdravých dospelých jedincov bola absolútna biologická dostupnosť odhadnutá pre flutikazónpropionát z pomôcky Diskus (7,8 %), flutikazónpropionát z pomôcky Diskhaler (9,0 %) a flutikazónpropionát z pomôcky Inhaler (10,9 %). U pacientov s astmou alebo CHOCHP bol pozorovaný nižší stupeň systémovej expozície inhalačným flutikazónpropionátom. Systémová absorpcia flutikazónpropionátu prebieha hlavne prostredníctvom pľúc a na začiatku je rýchla, potom sa spomaľuje. Zbytok inhalovanej dávky môže byť prehltnutý, ale na systémovej expozícii sa podieľa minimálne v dôsledku nízkej rozpustnosti vo vode a presystémového metabolizmu, výsledkom čoho je menej ako 1 %-ná perorálna dostupnosť. So zvyšujúcou sa inhalovanou dávkou sa lineárne zvyšuje systémová expozícia.
DistribúciaFlutikazónpropionát má veľký distribučný objem v rovnovážnom stave (približne 318 l). Väzba na plazmatické bielkoviny je stredne vysoká (91 %).
MetabolizmusFlutikazónpropionát je zo systémovej cirkulácie odstránený veľmi rýchlo, hlavne metabolizmom na inaktívny metabolit, kyselinu karboxylovú, prostredníctvom enzýmu CYP3A4 cytochrómu P450. Opatrnosť je potrebná pri súčasnom podávaní známych inhibítorov CYP3A4, pretože môžu zvýšiť systémovú expozíciu flutikazónpropionátu.
ElimináciaVylučovanie flutikazónpropionátu je charakterizované vysokým plazmatickým klírensom (1150 ml/min) a terminálnym polčasom približne 8 hodín. Renálny klírens flutikazónpropionátu je zanedbateľný (< 0,2 %) a vo forme metabolitu sa vylúči menej ako 5 %.
5.3 Predklinické údaje o bezpečnostiToxikologické skúšky ukázali iba tie skupinové účinky, ktoré sú typické pre silné kortikosteroidy, a to iba v dávkach presahujúcich dávky odporúčané na terapeutické použitie. V štúdiách toxicity po opakovanom podávaní, reprodukčnej toxicity a teratogenity neboli pozorované žiadne nové účinky. Flutikazónpropionát nemá žiadnu
in vitro ani
in vivo mutagénnu aktivitu a nemá žiadny karcinogénny potenciál u hlodavcov. U zvierat nie je dráždivý ani nevyvoláva precitlivenosť.
6. Farmaceutické informácie6.1. Zoznam pomocných látokLactosum monohydricum (ktorá obsahuje mliečny proteín).
6.2 InkompatibilityNeboli hlásené.
6.3 Čas použiteľnosti
18 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v suchu pri teplote do 30 °C.
Diskus je uzatvorený vo fóliovom prebale, ktorý treba otvoriť až vtedy, keď sa má Diskus použiť prvýkrát. Po otvorení sa má fóliový prebal znehodnotiť.
6.5 Druh obalu a obsah baleniaPrášková zmes flutikazónpropionátu a laktózy je naplnená v blistroch na tvarovanom základnom fóliovom prúžku, blistre sú prikryté oddeliteľnou laminátovou fóliou.
Fóliový prúžok je uzavretý v inhalačnej pomôcke Diskus. Diskus je zabalený vo fóliovom prebale.
Písomná informácia pre používateľov, papierová škatuľka.
Veľkosť balenia:
60 dávok x 50 µg
60 dávok x 100 µg
60 dávok x 250 µg
60 dávok x 500 µg
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na použitie Flixotide Diskus
O inhalačnej pomôcke Diskus
Diskus je uzatvorený vo fóliovom prebale. Prebal poskytuje ochranu pred vlhkosťou a treba ho otvoriť až vtedy, keď budete pripravený použiť Diskus prvýkrát. Po otvorení sa má fóliový prebal znehodnotiť.
ZATVORENÝ
Keď vyberiete Diskus zo škatuľky a odstránite fóliový prebal, bude v polohe zatvorený.
OTVORENÝ
Nový Diskus obsahuje 60 dávok lieku. Počítadlo dávok ukazuje, koľko dávok ešte zostáva.
Tento Diskus obsahuje 60 jednotlivo chránených dávok lieku vo forme prášku.
Každá dávka je presne odmeraná a hygienicky chránená. Diskus si nevyžaduje žiadnu údržbu ani opätovné plnenie.
Na hornej strane Diskusu je počítadlo dávok, ktoré ukazuje, koľko dávok ešte zostáva. Číslice
5 až 0 sú vyznačené ČERVENOU farbou, ktorá upozorňuje, že už zostáva len niekoľko dávok.
Použitie Diskusu je jednoduché. Keď potrebujete dávku, postupujte podľa piatich jednoduchých znázornených krokov.
1. Otvoriť.
2. Posunúť.
3. Inhalovať.
4. Zatvoriť.
5. Vypláchnuť ústa.
Ako funguje Diskus.
Posunutím páčky Diskusu sa otvorí malý otvor v náustku a tým sa pripraví jedna blistrová dávka na vdýchnutie. Pri zavretí Diskusu sa páčka automaticky vráti do svojej pôvodnej polohy a je pripravená ďalšia dávka. Vonkajší kryt chráni Diskus, keď sa nepoužíva.
1. Otvoriť – Ako používať Diskus
Aby ste otvorili Diskus, v jednej ruke držte vonkajší kryt a palec druhej ruky vložte do jazdca. Palcom zatlačte jazdec smerom od Vás tak ďaleko, ako to pôjde.

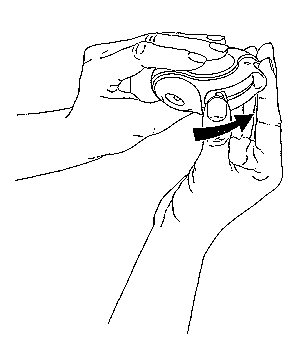
2. Posunúť
Držte Diskus tak, aby bol náustok otočený smerom k Vám. Posuňte páčku smerom od seba tak ďaleko ako to pôjde, až pokiaľ nebudete počuť „kliknutie“. Diskus je vtedy pripravený na použitie. Po každom zatlačení páčky je pripravená ďalšia dávka k vdýchnutiu. Je to vidieť na počítadle dávok. S páčkou sa nehrajte, pretože sa tým uvoľní dávka, ktorá sa vyplytvá bez úžitku.
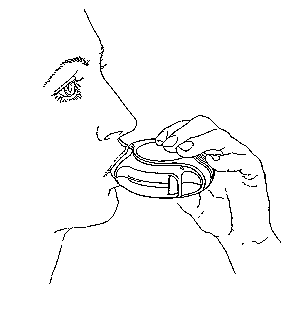
3. Inhalovať
Prečítajte si túto časť pozorne skôr, ako začnete inhalovať dávku.
- Držte Diskus mimo Vašich úst. Vydýchnite čo najviac ako je to možné bez námahy. Nikdy nevydychujte do Diskusu.
- Priložte si náustok k perám. Vdychujte plynule a hlboko cez Diskus, nie cez nos.
- Vyberte si Diskus z úst.
- Zadržte dych asi na 10 sekúnd alebo na tak dlho, ako je to možné bez námahy.
- Pomaly vydýchnite.
4. Zatvoriť
Diskus zatvoríte tak, že palec vložíte do jazdca a jazdec posuniete späť smerom k Vám čo najviac ako to pôjde. Po zavretí Diskusu budete počuť „kliknutie“. Páčka sa automaticky vráti do pôvodnej polohy a je znovu nastavená. Váš Diskus bude pripravený na ďalšie použitie.

5. Vypláchnuť ústa
Potom si vypláchnite ústa vodou a vodu vypľujte.
Ak máte užiť dve dávky, musíte Diskus zavrieť a opakovať kroky 1 až 4.
Upozornenie
Uchovávajte Diskus v suchu.
Pokiaľ sa Diskus nepoužíva, ponechajte ho zatvorený.
Nikdy nevydychujte do Diskusu.
Páčku posúvajte len ak idete práve inhalovať liek. Dávka sa uvoľní posunutím páčky.
Nepresahujte určenú dávku. Uchovávajte mimo dosahu detí.
7. Držiteľ rozhodnutia o registráciiGlaxoSmithKline Slovakia s.r.o., Bratislava, Slovenská republika
8. Registračné číslo14/0196/98-S
9. Dátum prvej registrácie/ predĺženia registrácieDátum prvej registrácie: 21. apríla 1998
Dátum posledného predĺženia registrácie: 30. mája 2007/bez časového obmedzenia
10. Dátum revízie textuJúl 2013