
alšie informácie o bezpečnosti infliximabu
u starších pacientov pozri v častiach 4.4 a 4.8.
Poškodená funkcia obličiek a/alebo pečene
Infliximab sa neskúmal v týchto skupinách pacientov. Odporúčanú dávku nie je možné stanoviť
(pozri časť 5.2).
P
ediatrická populácia
C
r
ohnova choroba (6 až 17 rokov)
5 mg/kg podaných intravenóznou infúziou nasledovaných ďalšími infúziami v dávke 5 mg/kg, a to
2 a 6 týždňov po prvej infúzii a potom každých 8 týždňov. Dostupné údaje nepodporujú ďalšiu liečbu infliximabom u detí a dospievajúcich, ktorí neodpovedali počas prvých 10 týždňov liečby
(pozri časť 5.1).
U niektorých pacientov môže byť na udržanie klinického prínosu potrebný kratší interval medzi dávkami, kým u iných môže postačovať dlhší interval medzi dávkami. Pacienti s intervalom medzi dávkami skráteným na menej ako 8 týždňov môžu mať zvýšené riziko výskytu nežiaducich reakcií. Pokračovanie liečby so skráteným intervalom sa má starostlivo zvážiť u tých pacientov, u ktorých sa po zmene intervalu podávania dávky neobjavuje žiadny dôkaz ďalšieho terapeutického prínosu.
Bezpečnosť a účinnosť infliximabu sa neskúmali u detí s Crohnovou chorobou mladších ako
6 rokov. V súčasnosti dostupné farmakokinetické údaje sú opísané v časti 5.2, ale neumožňujú uviesť odporúčania na dávkovanie u detí mladších ako 6 rokov.
Ulcerózna kolitída (6 až 17 rokov)
5 mg/kg podaných intravenóznou infúziou nasledovaných ďalšími infúziami v dávke 5 mg/kg, a to
2 a 6 týždňov po prvej infúzii a potom každých 8 týždňov. Dostupné údaje nepodporujú ďalšiu liečbu infliximabom u detských a dospievajúcich pacientov, ktorí neodpovedali počas prvých
8 týždňov liečby (pozri časť 5.1).
Bezpečnosť a účinnosť infliximabu sa neskúmali u detí s ulceróznou kolitídou mladších ako
6 rokov. V súčasnosti dostupné farmakokinetické údaje sú opísané v časti 5.2, ale neumožňujú uviesť odporúčania na dávkovanie u detí mladších ako 6 rokov.
Psoriáza
Bezpečnosť a účinnosť infliximabu u detí a dospievajúcich mladších ako 18 rokov v indikácii psoriáza neboli stanovené. V súčasnosti dostupné údaje sú opísané v časti 5.2, ale neumožňujú
uviesť odporúčania na dávkovanie.
Juvenilná idiopatická artritída, psoriatická artritída a ankylozujúca spondylitída
Bezpečnosť a účinnosť infliximabu u detí a dospievajúcich mladších ako 18 rokov v indikáciách juvenilná idiopatická artritída, psoriatická artritída a ankylozujúca spondylitída neboli stanovené.
V súčasnosti dostupné údaje sú opísané v časti 5.2, ale neumožňujú uviesť odporúčania na
dávkovanie.
Juvenilná reumatoidná artritída
Bezpečnosť a účinnosť infliximabu u detí a dospievajúcich mladších ako 18 rokov v indikácii juvenilná reumatoidná artritída neboli stanovené. V súčasnosti dostupné údaje sú opísané v častiach
4.8 a 5.2, ale neumožňujú uviesť odporúčania na dávkovanie.
Poškodená funkcia obličiek a/alebo pečene
Infliximab sa neskúmal v týchto skupinách pacientov. Odporúčanú dávku nie je možné stanoviť
(pozri časť 5.2).
Spôsob podávania
Flixabi sa má podávať intravenózne po dobu 2 hodín. Všetci pacienti, ktorým sa podal Flixabi, musia byť najmenej 1 – 2 hodiny po infúzii pozorovaní pre akútne reakcie súvisiace s infúziou. K dispozícii musí byť vybavenie na urgentné výkony, ako je adrenalín, antihistaminiká,
kortikosteroidy a prístroj na umelú ventiláciu. Aby sa znížilo riziko reakcií súvisiacich s infúziou,
zvlášť ak sa reakcie súvisiace s infúziou objavili v minulosti, môžu byť pacienti predliečení napr. antihistaminikom, hydrokortizónom a/alebo paracetamolom a rýchlosť infúzie možno spomaliť (pozri časť 4.4).
Skrátenie doby infúzie pri indikáciách u dospelých
U starostlivo vybraných dospelých pacientov, ktorí tolerovali najmenej 3 úvodné 2-hodinové infúzie Flixabi (indukčná fáza) a ktorí dostávajú udržiavaciu liečbu, možno zvážiť podávanie ďalších infúzií počas doby nie kratšej ako 1 hodina. Ak sa vyskytne reakcia na infúziu v spojení so skrátením doby infúzie, možno pre ďalšie infúzie zvážiť nižšiu rýchlosť, ak má liečba pokračovať. Skrátenie doby infúzií s dávkami > 6 mg/kg sa neskúmalo (pozri časť 4.8).
Pokyny na prípravu a podanie, pozri časť 6.6.
4.3 Kontraindikácie
Pacienti s precitlivenosťou na infliximab v anamnéze (pozri časť 4.8), na iné myšie proteíny alebo
na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Pacienti s tuberkulózou alebo inými ťažkými infekciami, ako sú sepsa, abscesy a oportúnne infekcie
(pozri časť 4.4).
Pacienti so stredne ťažkým alebo ťažkým zlyhávaním srdca (NYHA trieda III/IV) (pozri časti 4.4
a 4.8).
4.4 Osobitné upozornenia a opatrenia pri používaní
V záujme zlepšenia sledovateľnosti biologických liekov sa má v zdravotnej dokumentácii pacienta
zrozumiteľne zaznamenať (alebo uviesť) názov a číslo šarže podaného lieku.
Reakcie na infúziu a precitlivenosť
Podanie infliximabu bolo spojené s akútnymi reakciami súvisiacimi s infúziou, vrátane anafylaktického šoku a s oneskorenými reakciami z precitlivenosti (pozri časť 4.8).
Akútne reakcie na infúziu, vrátane anafylaktických reakcií, sa môžu rozvinúť v priebehu infúzie (do niekoľkých sekúnd) alebo počas niekoľkých hodín po jej podaní. Ak sa objavia akútne reakcie na infúziu, infúzia sa musí okamžite prerušiť. K dispozícii musí byť vybavenie na urgentné výkony,
ako je adrenalín, antihistaminiká, kortikosteroidy a prístroj na arteficiálnu ventiláciu. Aby sa
predišlo ľahkým a prechodným účinkom, pacienti môžu byť predliečení, napr. antihistaminikom,
hydrokortizónom a/alebo paracetamolom.
Proti infliximabu sa môžu vytvoriť protilátky. Tieto boli spojené so zvýšenou frekvenciou reakcií
na infúziu. Malá časť reakcií na infúziu boli závažné alergické reakcie. Pozorovalo sa spojenie medzi tvorbou protilátok proti infliximabu a skrátené trvanie odpovede. Súčasné podávanie imunomodulátorov bolo spojené s nižšou incidenciou protilátok proti infliximabu a znížením frekvencie reakcií na infúziu. Účinok súčasnej imunomodulačnej liečby bol intenzívnejší
u pacientov liečených epizodicky, ako u pacientov, ktorí dostávali udržiavaciu liečbu. U pacientov,
ktorí prerušia imunosupresívnu liečbu pred alebo počas liečby infliximabom, je väčšie riziko, že sa u nich takéto protilátky vytvoria. Protilátky proti infliximabu sa nie vždy dajú dokázať vo vzorkách séra. Ak sa objavia závažné reakcie, musí sa podať symptomatická liečba a ďalšie infúzie Flixabi sa nesmú podať (pozri časť 4.8).
V klinických štúdiách boli hlásené oneskorené reakcie z precitlivenosti. Údaje, ktoré sú k dispozícii, naznačujú, že riziko oneskorenej precitlivenosti narastá s predlžujúcim sa obdobím bez infliximabu. Pacienti majú byť upozornení na potrebu okamžite vyhľadať lekársku pomoc pri výskyte
akejkoľvek oneskorenej nežiaducej udalosti (pozri časť 4.8). Ak sú pacienti opakovane liečení po dlhšom čase, musí sa u nich starostlivo sledovať výskyt prejavov a príznakov oneskorenej
precitlivenosti.
Infekcie
Pacienti musia byť pred liečbou, počas liečby a po liečbe Flixabi dôkladne sledovaní, či sa u nich
neobjavujú infekcie, vrátane tuberkulózy. Pretože eliminácia infliximabu môže trvať až šesť
mesiacov, sledovanie pacientov má pokračovať počas celej tejto doby. Ak sa u pacienta rozvinie
závažná infekcia alebo sepsa, ďalšia liečba Flixabi sa nesmie podať.
Zvýšená opatrnosť je potrebná, keď sa použitie Flixabi zvažuje u pacientov s chronickou infekciou alebo s opakovanými infekciami v anamnéze, vrátane súbežnej imunosupresívnej liečby. Pacientov treba poučiť a je potrebné sa vyhýbať potenciálnym rizikovým faktorom pre infekcie.
Tumor nekrotizujúci faktor alfa (TNFα) sprostredkúva zápal a moduluje bunkové imunitné odpovede. Experimentálne údaje ukazujú, že TNFα je nevyhnutný pri odstraňovaní vnútrobunkových infekcií. Klinické skúsenosti ukazujú, že u niektorých pacientov liečených infliximabom, je obrana hostiteľa proti infekcii oslabená.
Je potrebné poznamenať, že supresia TNFα môže maskovať príznaky infekcie, ako je horúčka. Veľmi dôležité je včasné rozpoznanie atypických klinických príznakov závažných infekcií
a typických klinických príznakov zriedkavých alebo nezvyčajných infekcií, aby sa minimalizovalo
oneskorenie stanovenia diagnózy a liečby.
Pacienti používajúci blokátory TNF sú na závažné infekcie náchylnejší.
U pacientov liečených infliximabom sa pozorovali tuberkulóza, bakteriálne infekcie, vrátane sepsy, a pneumónie, invazívne mykotické, vírusové a iné oportúnne infekcie. Niektoré z týchto infekcií boli fatálne; najčastejšie hlásené oportúnne infekcie s hodnotou mortality > 5 % zahŕňajú pneumocystózu, kandidózu, listeriózu a aspergilózu.
Pacienti, u ktorých sa vyvinula nová infekcia počas liečby Flixabi, majú byť starostlivo sledovaní
a majú podstúpiť kompletné diagnostické vyšetrenie. Podávanie Flixabi sa má prerušiť, ak sa
u pacienta vyvinie nová závažná infekcia alebo sepsa, a má sa začať vhodná antimikrobiálna alebo antimykotická liečba, pokým nie je infekcia pod kontrolou.
Tuberkulóza
U pacientov dostávajúcich infliximab sa hlásili prípady aktívnej tuberkulózy. Treba poukázať na to, že vo väčšine týchto hlásení bola tuberkulóza extrapulmonálna, prebiehajúca buď ako lokálne alebo
ako diseminované ochorenie.
Predtým, ako sa začne s liečbou Flixabi, musia byť všetci pacienti vyhodnotení tak na aktívnu, ako aj na neaktívnu („latentnú“) tuberkulózu. Toto vyhodnotenie má zahŕňať detailnú anamnézu
s osobnou anamnézou tuberkulózy alebo možného predchádzajúceho kontaktu s tuberkulózou a
predchádzajúcu a/alebo súčasnú imunosupresívnu liečbu. U všetkých pacientov sa majú urobiť vhodné skríningové testy, t. j. tuberkulínový kožný test a RTG hrudníka (možno aplikovať miestne odporúčania).
Odporúča sa, aby sa vykonanie týchto testov zaznamenalo do Karty s upozornením pre pacienta.
Upozorňujeme predpisujúcich na riziko falošne negatívnych výsledkov tuberkulínových kožných testov, zvlášť u pacientov ťažko chorých alebo imunokompromitovaných.
Ak sa diagnostikuje aktívna tuberkulóza, liečba Flixabi sa nesmie začať (pozri časť 4.3).
Ak je podozrenie na latentnú tuberkulózu, treba to konzultovať s lekárom s odbornosťou v liečbe tuberkulózy. Vo všetkých situáciách popísaných nižšie sa má veľmi starostlivo zvážiť pomer prínosu a rizika liečby Flixabi.
Ak sa diagnostikuje neaktívna („latentná“) tuberkulóza, musí sa, predtým ako sa iniciuje liečba
Flixabi, začať s antituberkulóznou liečbou latentnej tuberkulózy, a táto liečba má byť v zhode s miestnymi odporúčaniami.
U pacientov, ktorí majú niekoľko rizikových faktorov alebo významné rizikové faktory pre vznik tuberkulózy a majú negatívny test na latentnú tuberkulózu, sa musí predtým, ako sa iniciuje liečba Flixabi, zvážiť antituberkulózna liečba.
Použitie antituberkulóznej liečby sa má tiež zvážiť predtým, ako sa iniciuje liečba Flixabi
u pacientov s latentnou alebo aktívnou tuberkulózou v anamnéze, u ktorých nemožno potvrdiť postačujúci priebeh liečby.
Niektoré prípady aktívnej tuberkulózy sa hlásili u pacientov liečených Flixabi počas liečby latentnej
tuberkulózy alebo po nej.
Všetci pacienti majú byť informovaní o tom, že musia vyhľadať lekársku pomoc, ak sa u nich počas liečby alebo po liečbe Flixabi objavia prejavy/príznaky, ktoré pripomínajú tuberkulózu (napr. pretrvávajúci kašeľ, chradnutie/úbytok telesnej hmotnosti, zvýšená teplota).
Invazívne mykotické infekcie
U pacientov liečených Flixabi je potrebné myslieť na invazívne mykotické infekcie, ako je aspergilóza, kandidóza, pneumocystóza, histoplazmóza, kokcidioidomykóza alebo blastomykóza, ak sa u nich vyvinie závažné systémové ochorenie. Pri vyšetrovaní týchto pacientov sa má v ranom štádiu konzultovať s odborníkom v diagnostike a liečbe invazívnych mykotických infekcií. Invazívne mykotické infekcie sa môžu prejaviť skôr ako diseminované než lokalizované ochorenie a testovanie na antigény a protilátky môže byť u niektorých pacientov s aktívnou infekciou negatívne. Kým prebieha vypracovanie diagnózy, má sa zvážiť vhodná empirická antimykotická liečba s prihliadnutím na riziko závažnej mykotickej infekcie a riziká antimykotickej liečby.
U pacientov, ktorí žili alebo cestovali do oblastí, kde sú invazívne mykotické infekcie ako histoplazmóza, kokcidioidomykóza alebo blastomykóza endemické, sa majú starostlivo zvážiť prínosy a riziká pred začatím liečby Flixabi.
Fistulizujúca Crohnova choroba
U pacientov s fistulizujúcou Crohnovou chorobou s akútnymi hnisavými fistulami sa nesmie
začínať s liečbou Flixabi dovtedy, kým sa nevylúči zdroj možnej infekcie, zvlášť absces (pozri časť
4.3).
Reaktivácia hepatitídy B (HBV)
U pacientov liečených TNF-antagonistom vrátane infliximabu, ktorí sú chronickými nositeľmi tohto
vírusu, sa objavila reaktivácia hepatitídy B. Niektoré prípady mali fatálne následky.
Pred začatím liečby Flixabi majú byť pacienti testovaní na infekciu HBV. Pacientom s pozitívnym testom na infekciu HBV sa odporúča konzultácia s lekárom s odbornosťou na liečbu hepatitídy B. Nositeľov HBV, ktorí vyžadujú liečbu Flixabi, je potrebné starostlivo sledovať, či sa u nich nevyvíjajú prejavy a príznaky aktívnej HBV infekcie, a to počas celej liečby a niekoľko mesiacov po jej skončení. Nie sú dostupné dostatočné informácie o liečbe pacientov, ktorí sú nositeľmi HBV a dostávajú antivírusovú liečbu v kombinácii s TNF-antagonistom, aby sa zabránilo reaktivácii HBV. U pacientov, u ktorých došlo k reaktivácii HBV, je potrebné liečbu Flixabi prerušiť a má sa začať s účinnou antivírusovou liečbou s príslušnou podpornou liečbou.
Hepatobiliárne udalosti
Počas skúseností s infliximabom po jeho uvedení na trh sa pozorovali prípady žltačky a neinfekčnej hepatitídy, niektoré s črtami autoimunitnej hepatitídy. Vyskytli sa ojedinelé prípady zlyhania pečene, ktoré viedli k transplantácii pečene alebo k úmrtiu. U pacientov s príznakmi alebo prejavmi poruchy funkcie pečene musí byť vyhodnotená prítomnosť dôkazov poškodenia pečene. Ak sa objaví žltačka a/alebo zvýšenia ALT ≥ 5-násobku hornej hranice normálu, podávanie Flixabi sa má ukončiť a abnormalita sa má dôkladne vyšetriť.
SúčasnépodávanieinhibítoraTNF-alfa a anakinry
V klinických štúdiách so súčasným používaním anakinry a ďalšej TNFα-blokujúcej látky, etanerceptu, sa pozorovali závažné infekcie a neutropénia so žiadnym ďalším klinickým prínosom v porovnaní s použitím etanerceptu samotného. Vzhľadom k povahe nežiaducich udalostí, pozorovaných pri kombinovanej liečbe s etanerceptom a anakinrou, kombinácia s anakinrou
a inými TNFα-blokujúcimi látkami môže mať podobné toxické účinky. Preto sa kombinácia Flixabi a anakinry neodporúča.
Súčasné
podávanie
i
nhibítora
T
N
F-alfa a abataceptu
Klinické štúdie so súčasným podávaním TNF-antagonistov a abataceptu sa spájali so zvýšeným rizikom infekcií vrátane závažných infekcií v porovnaní so samotnými TNF-antagonistami, bez zvýšeného klinického prospechu. Kombinácia Flixabi a abataceptu sa neodporúča.
Súčasnépodávaniesinýmibiologickýmiliečivami
Existujú nedostatočné informácie týkajúce sa súčasného používania Flixabi s inými biologickými
liečivami používanými na liečbu rovnakých ochorení ako infliximab. Súčasné používanie
infliximabu s týmito biologickými liečivami sa neodporúča vzhľadom na možnosť zvýšeného rizika
vzniku infekcie a iných potenciálnych farmakologických interakcií.
Zámena jednotlivých biologických DMARDs
Pri prechode z jedného biologického liečiva na iné sa má postupovať s opatrnosťou a pacienti majú
byť naďalej monitorovaní, pretože prekrývanie biologického účinku môže ďalej zvyšovať riziko
vzniku nežiaducich udalostí vrátane infekcie.
Živévakcíny/infekčnélátkynaterapeutickéúčely
U pacientov, ktorí dostávajú anti-TNF liečbu sú dostupné obmedzené údaje týkajúce sa odpovede
na vakcináciu živými vakcínami alebo sekundárneho prenosu infekcie živými vakcínami. Použitie živých vakcín môže viesť k vzniku klinických infekcií vrátane diseminovaných infekcií. Súbežné podávanie živých vakcín s Flixabi sa neodporúča.
U dojčiat vystavených infliximabu in utero sa po podaní BCG vakcíny po narodení hlásilo úmrtie v dôsledku diseminovanej infekcie Bacillus Calmette-Guérin (BCG). S podaním živých vakcín dojčatám vystaveným infliximabu in utero sa odporúča počkať minimálne 6 mesiacov po narodení (pozri časť 4.6).
Iné použitia infekčných látok na terapeutické účely, ako sú napr. atenuované baktérie (napr. BCG na instiláciu do močového mechúra na liečbu nádorového ochorenia) môžu viesť ku vzniku klinických infekcií vrátane diseminovaných infekcií. Odporúča sa, aby sa infekčné látky na terapeutické účely nepodávali súbežne s Flixabi.
Autoimunitné procesy
Anti-TNF liečbou vyvolaný relatívny deficit TNFα môže viesť k iniciácii autoimunitného procesu. Ak sa u pacienta po liečbe Flixabi vyvinú príznaky pripomínajúce lupusu podobný syndróm a ak
má pacient pozitívne protilátky proti dvojvláknovej DNA, ďalšia liečba Flixabi sa nesmie podať
(pozri časť 4.8).
Neurologické udalosti
Použitie blokátorov TNF vrátane infliximabu sa spájalo s prípadmi nového výskytu alebo
exacerbácie klinických príznakov a/alebo rádiografického dôkazu demyelinizačných porúch centrálneho nervového systému, vrátane roztrúsenej sklerózy a periférnych demyelinizačných porúch, vrátane Guillainov-Barrého syndrómu. U pacientov s už existujúcimi alebo nedávno diagnostikovanými demyelinizačnými poruchami sa majú pred začatím liečby Flixabi starostlivo zvážiť prínosy a riziká anti-TNF liečby. Ak sa tieto poruchy vyvinú, má sa zvážiť vysadenie liečby Flixabi.
Malignity a lymfoproliferatívne poruchy
V kontrolovaných častiach klinických štúdií s TNF-blokujúcimi látkami sa medzi pacientmi, ktorí dostávali TNF-blokátor, pozorovalo viac prípadov malignít, vrátane lymfómov, ako u pacientov
v kontrolnej skupine. Počas klinických štúdií s infliximabom vo všetkých schválených indikáciách bola incidencia lymfómov u pacientov liečených infliximabom vyššia, ako sa očakáva v bežnej
populácii; výskyt lymfómov bol však zriedkavý. V súbore po uvedení lieku na trh sa hlásili prípady leukémie u pacientov liečených antagonistami TNF. U pacientov s reumatoidnou artritídou
s dlhotrvajúcim, vysoko aktívnym zápalovým ochorením je zvýšený dôvod rizika vzniku lymfómov a leukémie, čo komplikuje odhad rizika.
V prieskumnej klinickej štúdii hodnotiacej používanie infliximabu u pacientov so stredne ťažkou až ťažkou chronickou obštrukčnou chorobou pľúc (CHOCHP) bolo u pacientov liečených infliximabom v porovnaní s pacientmi v kontrolnej skupine hlásených viac malignít. Všetci pacienti mali v anamnéze intenzívne fajčenie. Pri zvažovaní liečby u pacientov so zvýšeným rizikom vývoja malignity z dôvodu silného fajčenia je potrebná zvýšená opatrnosť.
Podľa dnešných vedomostí nemožno u pacientov liečených TNF-blokátorom vylúčiť riziko vzniku lymfómov alebo iných malignít (pozri časť 4.8). Keď sa zvažuje liečba TNF-blokujúcou látkou
u pacientov s malignitou v anamnéze alebo pokračovanie liečby u pacientov, u ktorých sa vyvinula
malignita, je potrebná zvýšená opatrnosť.
Opatrnosť je potrebná aj u pacientov so psoriázou a extenzívnou imunosupresívnou liečbou alebo predĺženou PUVA liečbou v anamnéze.
Malignity, niektoré fatálne, sa hlásili u detí, dospievajúcich a mladých dospelých (do veku
22 rokov) liečených látkami blokujúcimi TNF (začatie liečby vo veku ≤ 18 rokov) vrátane infliximabu v skupine po uvedení lieku na trh. Približne polovica týchto prípadov boli lymfómy. Ďalšie prípady predstavovali rôzne druhy iných malignít a zahŕňali zriedkavé malignity zvyčajne súvisiace s imunosupresiou. Riziko rozvoja malignít u pacientov liečených blokátormi TNF nemožno vylúčiť.
Po uvedení na trh sa hlásili prípady hepatosplenického T-bunkového lymfómu (hepatosplenic T-cell lymphoma, HSTCL) u pacientov liečených látkami blokujúcimi TNF vrátane infliximabu. Tento zriedkavý typ T-bunkového lymfómu má veľmi agresívny priebeh ochorenia a je zvyčajne
smrteľný. Takmer všetci pacienti sa liečili AZA alebo 6-MP súbežne s blokátorom TNF alebo
bezprostredne pred ním. Prevažná väčšina prípadov s infliximabom sa vyskytla u pacientov
s Crohnovou chorobou alebo ulceróznou kolitídou a väčšina sa hlásila u dospievajúcich a mladých dospelých mužov. Potenciálne riziko kombinácie AZA alebo 6-MP s Flixabi sa má starostlivo
zvážiť. Riziko rozvoja hepatosplenického T-bunkového lymfómu u pacientov liečených Flixabi
nemožno vylúčiť (pozri časť 4.8).
U pacientov liečených blokátormi TNF vrátane infliximabu sa hlásil výskyt melanómu a karcinómu z Merkelových buniek (pozri časť 4.8). Odporúča sa vykonávať pravidelné vyšetrenie kože, najmä
u pacientov s rizikovými faktormi pre vznik nádorového ochorenia kože.
V retrospektívnej populačnej kohortnej štúdii s údajmi zo Švédskych národných zdravotných registrov sa zistila zvýšená incidencia rakoviny krčka maternice u žien s reumatoidnou artritídou liečených infliximabom v porovnaní s pacientkami, ktoré sa predtým neliečili biologickými liekmi, alebo s bežnou populáciou vrátane tých vo veku nad 60 rokov. U žien liečených infliximabom vrátane tých vo veku nad 60 rokov sa má pokračovať v pravidelných vyšetreniach.
Všetci pacienti s ulceróznou kolitídou a so zvýšeným rizikom dysplázie alebo karcinómu hrubého čreva (napríklad pacienti s dlhoročnou ulceróznou kolitídou alebo primárnou sklerotizujúcou cholangitídou) alebo s dyspláziou alebo karcinómom hrubého čreva v anamnéze musia byť
v pravidelných intervaloch vyšetrovaní, či u nich nie je prítomná dysplázia a to pred začatím liečby
a v priebehu choroby. Toto vyšetrenie má zahŕňať kolonoskopiu a biopsie v súlade s miestnymi odporúčaniami. Podľa súčasných vedomostí nie je známe, či liečba infliximabom ovplyvňuje riziko vývoja dysplázie alebo karcinómu hrubého čreva (pozri časť 4.8).
Pretože možnosť zvýšeného rizika vývoja nádorového ochorenia u pacientov
s novodiagnostikovanou dyspláziou liečených infliximabom nebola preukázaná, má sa starostlivo zhodnotiť riziko a prínosy liečby pre individuálneho pacienta, pričom treba zvážiť ukončenie liečby.
Z
l
y
hávanie srdca
Flixabi sa má použiť s opatrnosťou u pacientov s miernym zlyhávaním srdca (NYHA trieda I/II). Pacienti, u ktorých sa rozvinú nové alebo zhoršené príznaky zlyhávania srdca, majú byť dôkladne sledovaní a podávanie Flixabi nesmie pokračovať (pozri časti 4.3 a 4.8).
Hematologické reakcie
U pacientov, ktorí dostávali TNF-blokátory, vrátane infliximabu, sa hlásili pancytopénia, leukopénia, neutropénia a trombocytopénia. Všetci pacienti majú byť upozornení na potrebu
okamžite vyhľadať lekársku pomoc, ak sa u nich rozvinú prejavy a príznaky naznačujúce dyskrázie
krvi (napr. pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť). Ukončenie liečby Flixabi sa
má zvážiť u pacientov s potvrdenými signifikantnými hematologickými abnormalitami.
Iné
Skúsenosti ohľadom bezpečnosti liečby infliximabom u pacientov, ktorí podstúpili chirurgické zákroky vrátane artroplastiky, sú obmedzené. Ak sa plánuje chirurgický zákrok, má sa zvážiť dlhý polčas infliximabu. Pacient, ktorý počas liečby Flixabi potrebuje chirurgický zákrok, má byť pozorne sledovaný kvôli infekciám a majú sa vykonať náležité opatrenia.
Neodpovedanie na liečbu pri Crohnovej chorobe môže poukazovať na prítomnosť fixných fibrotických striktúr, ktoré si môžu vyžadovať chirurgickú liečbu. Neexistuje dôkaz, ktorý by naznačoval, že infliximab zhoršuje alebo spôsobuje fibrotické striktúry.
Osobitné skupiny pacientov
Staršípacienti(≥ 65 rokov)
U pacientov vo veku 65 rokov a starších liečených infliximabom bol vyšší výskyt závažných infekcií ako u pacientov mladších ako 65 rokov. Niektoré z nich mali fatálny koniec. Pri liečbe starších pacientov je potrebná mimoriadna pozornosť v súvislosti s rizikom infekcie (pozri časť
4.8).
Pediatrická populácia
Infekcie
V klinických štúdiách boli infekcie hlásené vo väčšej miere u pediatrických pacientov v porovnaní s dospelými pacientmi (pozri časť 4.8).
Očkovania
Ak je to možné, odporúča sa, aby boli u pediatrických pacientov načas vykonané všetky očkovania
v súlade s platnými nariadeniami týkajúcimi sa očkovaní, a to ešte pred začatím liečby Flixabi.
Malignity a lymfoproliferatívne poruchy
Po uvedení lieku na trh sa u detí, dospievajúcich a mladších dospelých (do 22 rokov veku)
liečených blokátormi TNF (iniciačná liečba ≤ 18 rokov veku), vrátane infliximabu hlásili malignity, niektoré fatálne. Približne polovica prípadov boli lymfómy. Ostatné prípady predstavovali
množstvo rozdielnych malignít a zahŕňali zriedkavé malignity zvyčajne spojené s imunosupresiou.
Riziko rozvoja malignít u detí a dospievajúcich liečených blokátormi TNF nemožno vylúčiť.
Po uvedení lieku na trh sa u pacientov liečených blokátormi TNF vrátane infliximabu hlásili
prípady hepatosplenického T-bunkového lymfómu. Tento zriedkavý typ T-bunkového lymfómu má
veľmi agresívny priebeh a je zvyčajne smrteľný. Takmer všetci pacienti sa liečili AZA alebo 6-MP
súbežne s blokátorom TNF alebo bezprostredne pred ním. Prevažná väčšina prípadov s infliximabom sa objavila u pacientov s Crohnovou chorobou alebo ulceróznou kolitídou a väčšina bola hlásená u dospievajúcich alebo mladších dospelých mužov. Potenciálne riziko kombinácie AZA alebo 6-MP a Flixabi sa má starostlivo zvážiť. Riziko vzniku hepatosplenického T-bunkového lymfómu u pacientov liečených Flixabi nemožno vylúčiť (pozri časť 4.8).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Ukazuje sa, že u pacientov s reumatoidnou artritídou, psoriatickou artritídou a Crohnovou chorobou súčasné užívanie metotrexátu a iných imunomodulátorov redukuje tvorbu protilátok proti infliximabu a zvyšuje jeho plazmatické koncentrácie. Výsledky sú však neisté z dôvodu obmedzení metód používaných na analýzu infliximabu a protilátok proti nemu v sére.
Nezdá sa, že by kortikosteroidy ovplyvňovali farmakokinetiku infliximabu v klinicky významnej miere.
Kombinácia Flixabi s inými biologickými liečivami používanými na liečbu rovnakých ochorení ako
Flixabi, vrátane anakinry a abataceptu, sa neodporúča (pozri časť 4.4).
Odporúča sa, aby sa živé vakcíny nepodávali súbežne s Flixabi. Tiež sa odporúča nepodávať živé vakcíny dojčatám vystaveným infliximabu in utero počas minimálne 6 mesiacov po narodení (pozri časť 4.4).
Odporúča sa, aby sa infekčné látky na terapeutické účely nepodávali súbežne s Flixabi (pozri časť
4.4).
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Ženy vo fertilnom veku musia počas používania Flixabi používať primeranú antikoncepciu, aby zabránili počatiu a v jej používaní musia pokračovať najmenej 6 mesiacov po poslednom podaní
Flixabi.
Gravidita
Nie príliš veľký počet (približne 450) prospektívne zachytených gravidít vystavených infliximabu
so známymi výsledkami, vrátane obmedzeného počtu (približne 230) vystaveného v priebehu prvého trimestra, nenaznačuje neočakávané účinky na výsledok gravidity. Pretože infliximab inhibuje TNFα, ak sa podáva počas gravidity, mohol by ovplyvniť normálne imunitné odpovede novorodenca. V štúdii skúmajúcej vývojovú toxicitu na myšiach s použitím analógnej protilátky, ktorá selektívne inhibuje funkčnú aktivitu myšieho TNFα, nič nepoukazovalo na toxicitu pre matku, embryotoxicitu alebo teratogenitu (pozri časť 5.3).
Klinické skúsenosti, ktoré sú k dispozícii, sú príliš obmedzené na to, aby vylúčili riziko, a preto sa
podávanie Flixabi počas gravidity neodporúča.
Infliximab prechádza placentou a bol zistený v sére dojčiat až 6 mesiacov po narodení. Po vystavení infliximabu in utero môže byť u dojčiat zvýšené riziko infekcie vrátane závažnej diseminovanej infekcie, ktorá môže byť fatálna. Podávanie živých vakcín (napr. BCG vakcíny) dojčatám vystaveným infliximabu in utero sa neodporúča počas minimálne 6 mesiacov po narodení (pozri časti 4.4 a 4.5). Hlásili sa tiež prípady agranulocytózy (pozri časť 4.8).
Dojčenie
Nie je známe, či sa infliximab vylučuje do ľudského mlieka alebo či sa po užití systémovo absorbuje. Pretože ľudské imunoglobulíny sa vylučujú do mlieka, ženy nesmú dojčiť ešte najmenej
6 mesiacov po liečbe Flixabi.
Fertilita
Nie sú dostatočné predklinické údaje na vytvorenie záverov o účinkoch infliximabu na fertilitu
a celkovú reprodukčnú schopnosť (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Flixabi môže mať malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní Flixabi sa môže objaviť závrat (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšou nežiaducou liekovou reakciou (adverse drug reaction, ADR) hlásenou v klinických skúšaniach bola infekcia horných dýchacích ciest vyskytujúca sa u 25,3 % pacientov liečených infliximabom v porovnaní so 16,5 % pacientov v kontrolnej skupine. Najzávažnejšie ADR spojené s používaním blokátorov TNF, ktoré boli hlásené pri infliximabe, zahŕňajú reaktiváciu HBV, CHF, závažné infekcie (vrátane sepsy, oportúnnych infekcií a TBC), sérovú chorobu (oneskorené reakcie z precitlivenosti), hematologické reakcie, systémový lupus erythematosus/lupusu podobný
syndróm, demyelinizačné ochorenia, hepatobiliárne udalosti, lymfóm, HSTCL, leukémiu, karcinóm
z Merkelových buniek, melanóm, malignity v pediatrickej populácii, sarkoidózu/reakciu podobnú sarkoidu, intestinálny alebo perianálny absces (pri Crohnovej chorobe) a závažné reakcie na infúziu (pozri časť 4.4).
Tabuľkovýzoznamnežiaducichreakcií
Tabuľka 1 uvádza ADR podľa skúseností z klinických štúdií ako aj nežiaduce reakcie, niektoré s fatálnymi následkami, hlásenými po uvedení na trh. V rámci tried orgánových systémov sú nežiaduce reakcie vymenované pod hlavičkami frekvencií výskytu s použitím nasledovných kategórií: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Infekcie a nákazy
Tabuľka 1
Nežiaduce účinky v klinických štúdiách a po uvedení na trh
Veľmi časté: vírusová infekcia (napr. chrípka, herpesové infekcie)
Časté: bakteriálne infekcie (napr. sepsa, celulitída, absces)
Menej časté: tuberkulóza, mykotické infekcie (napr. kandidóza)
Zriedkavé: meningitída, oportúnne infekcie (ako sú invazívne mykotické infekcie [pneumocystóza, histoplazmóza, aspergilóza,
kokcidioidomykóza, kryptokokóza, blastomykóza], bakteriálne infekcie [atypické mykobakteriálne, listerióza, salmonelóza]
a vírusové infekcie [cytomegalovírus]), parazitické infekcie, reaktivácia hepatitídy B
Neznáme: prielomová infekcia spôsobená vakcínou (po vystavení
infliximabu in utero)*

Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy) Zriedkavé: lymfóm, non-Hodgkinov lymfóm, Hodgkinova choroba,
leukémia, melanóm, rakovina krčka maternice
Neznáme: hepatosplenický T-bunkový lymfóm (predovšetkým
u dospievajúcich a mladých dospelých s Crohnovou chorobou alebo ulceróznou kolitídou), karcinóm z Merkelových buniek
Poruchy krvi a lymfatického systému
Časté: neutropénia, leukopénia, anémia, lymfadenopatia
Menej časté: trombocytopénia, lymfopénia, lymfocytóza
Zriedkavé: Agranulocytóza (vrátane dojčiat vystavených infliximabu
in utero), trombotická trombocytopenická purpura, pancytopénia,
hemolytická anémia, idiopatická trombocytopenická purpura
Poruchy imunitného systému
Časté: symptóm respiračnej alergie
Menej časté: anafylaktická reakcia, lupusu podobný syndróm, sérová
Psychické poruchy
choroba alebo sérovej chorobe podobná reakcia
Zriedkavé: anafylaktický šok, vaskulitída, reakcia podobná sarkoidu
Časté: depresia, nespavosť
Menej časté: amnézia, agitácia, konfúzia, somnolencia, nervozita
Zriedkavé: apatia
Poruchy nervového systému
Veľmi časté: bolesť hlavy
Časté: vertigo, závrat, hypestézia, parestézia
Menej časté: záchvat, neuropatia
Zriedkavé: transverzná myelitída, demyelinizačné ochorenia centrálneho
nervového systému (ochorenie podobné roztrúsenej skleróze
a neuritída optického nervu), periférne demyelinizačné poruchy (ako sú Guillainov-Barrého syndróm, chronická zápalová demyelinizačná polyneuropatia a multifokálna motorická neuropatia)
Poruchy oka
Časté: konjunktivitída
Menej časté: keratitída, periorbitálny edém, hordeolum
Zriedkavé: endoftalmitída
Neznáme: prechodná strata videnia vyskytujúca sa počas infúzie alebo do
2 hodín po nej
Poruchy srdca a srdcovej činnosti
Časté: tachykardia, palpitácie
Menej časté: zlyhávanie srdca (nový nástup alebo zhoršenie), arytmia, synkopa, bradykardia
Zriedkavé: cyanóza, perikardiálny výpotok
Neznáme: ischémia myokardu/infarkt myokardu
Poruchy ciev
Časté: hypotenzia, hypertenzia, ekchymóza, návaly horúčavy, sčervenanie
Menej časté: periférna ischémia, tromboflebitída, hematóm
Zriedkavé: zlyhanie cirkulácie, petéchia, vazospazmus

Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté: infekcia horných dýchacích ciest, sinusitída
Časté: infekcia dolných dýchacích ciest (napr. bronchitída,
pneumónia), dýchavičnosť, epistaxa
Menej časté: edém pľúc, bronchospazmus, pleuritída, pleurálny výpotok
Zriedkavé: intersticiálne ochorenie pľúc (vrátane náhleho progresívneho ochorenia, fibrózy pľúc a pneumonitídy)
Poruchy gastrointestinálneho traktu
Veľmi časté: bolesť brucha, nauzea
Časté: gastrointestinálne krvácanie, hnačka, dyspepsia,
gastroezofágový reflux, zápcha
Menej časté: intestinálna perforácia, intestinálna stenóza, divertikulitída, pankreatitída, cheilitída
Poruchy pečene a žlčových ciest
Časté: abnormálna hepatálna funkcia, zvýšené transaminázy
Menej časté: hepatitída, hepatocelulárne poškodenie, cholecystitída
Zriedkavé: autoimunitná hepatitída, žltačka
Neznáme: zlyhanie pečene
Poruchy kože a podkožného tkaniva
Časté: nová alebo zhoršená psoriáza vrátane pustulárnej psoriázy
(najmä palmárna/plantárna), žihľavka, vyrážka, svrbenie, hyperhidróza, suchá koža, mykotická dermatitída, ekzém, alopécia
Menej časté: bulózna erupcia, onychomykóza, seborea, rozacea, kožný

papilóm, hyperkeratóza, abnormálna pigmentácia kože
Zriedkavé: toxická epidermálna nekrolýza, Stevensov-Johnsonov syndróm, multiformný erytém, furunkulóza
Neznáme: zhoršenie príznakov dermatomyozitídy
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté: artralgia, myalgia, bolesť chrbta
Poruchy obličiek a močových ciest
Časté: infekcia močových ciest
Menej časté: pyelonefritída
Poruchy reprodukčného systému a prsníkov
Menej časté: vaginitída
Celkové poruchy a reakcie v mieste podania
Veľmi časté: reakcia súvisiaca s infúziou, bolesť
Časté: bolesť na hrudníku, únava, horúčka, reakcia v mieste injekcie, triaška, edém
Menej časté: zhoršené hojenie rán
Zriedkavé: granulomatózna lézia
Laboratórne a funkčné vyšetrenia
Menej časté: pozitívne autoprotilátky
Zriedkavé: abnormálny faktor komplementu
* vrátane bovinnej tuberkulózy (diseminovaná BCG infekcia), pozri časť 4.4.
Popis vybraných nežiaducich reakciíReakcie súvisiace s infúziouReakcia súvisiaca s infúziou bola v klinických štúdiách definovaná ako akákoľvek nežiaduca udalosť, ktorá sa objaví počas infúzie alebo v priebehu 1 hodiny po infúzii. V klinických štúdiách fázy III sa reakcia súvisiaca s infúziou vyskytla u 18 % pacientov liečených infliximabom
v porovnaní s 5 % pacientov dostávajúcich placebo. Celkovo sa reakcia súvisiaca s infúziou vyskytla u väčšieho percenta pacientov dostávajúcich infliximab v monoterapii v porovnaní
s pacientmi dostávajúcimi infliximab súbežne s imunomodulátormi. Približne 3 % pacientov ukončili liečbu kvôli reakciám súvisiacim s infúziou a všetci pacienti sa uzdravili s použitím liekov alebo bez nich. Zo skupiny pacientov liečených infliximabom, ktorí mali reakciu na infúziu počas
obdobia od indukčnej fázy po 6. týždeň, sa u 27 % vyskytla reakcia na infúziu počas udržiavacej
fázy v 7. až 54. týždni. Zo skupiny pacientov, ktorí nemali reakciu na infúziu počas indukčnej fázy, sa u 9 % vyskytla reakcia na infúziu počas udržiavacej fázy.
V klinickej štúdii s pacientmi s reumatoidnou artritídou (ASPIRE) boli prvé 3 infúzie podávané v priebehu 2 hodín. U pacientov, u ktorých sa nevyskytli závažné reakcie na infúziu, mohla byť doba trvania ďalších infúzií skrátená na nie menej ako 40 minút. V tomto skúšaní dostalo šesťdesiatšesť percent pacientov (686 z 1 040) najmenej jednu skrátenú infúziu v trvaní 90 minút alebo menej a 44 % pacientov (454 z 1 040) najmenej jednu skrátenú infúziu v trvaní 60 minút alebo menej. U pacientov liečených infliximabom, ktorí dostali aspoň jednu skrátenú infúziu, sa reakcie súvisiace s infúziou objavili u 15 % a závažné reakcie na infúziu u 0,4 % pacientov.
V klinickej štúdii pacientov s Crohnovou chorobou (SONIC) sa vyskytli reakcie súvisiace
s infúziou u 16,6 % (27/163) pacientov dostávajúcich infliximab v monoterapii, 5 % (9/179)
pacientov dostávajúcich infliximab v kombinácii s AZA a 5,6 % (9/161) pacientov dostávajúcich
AZA v monoterapii. U pacienta s infliximabom v monoterapii sa vyskytla jedna závažná reakcia na infúziu (< 1 %).
S podaním infliximabu sa spájali, podľa skúseností po uvedení lieku na trh, prípady reakcií podobných anafylaktickým, vrátane laryngálneho/faryngálneho edému a ťažkého bronchospazmu, a záchvaty (pozri časť 4.4). Hlásili sa prípady prechodnej straty videnia vyskytujúce sa počas infúzie infliximabu alebo do 2 hodín po nej. Hlásili sa tiež prípady (niektoré fatálne) ischémie/infarktu myokardu a arytmie, niektoré v úzkej časovej spojitosti s infúziou infliximabu.
Reakcie na infúziu po opakovanom podaní infliximabu
Klinická štúdia s pacientmi so stredne ťažkou až ťažkou psoriázou bola navrhnutá tak, aby
zhodnotila účinnosť a bezpečnosť dlhodobej udržiavacej liečby oproti opakovanej liečbe
s indukčným režimom infliximabu (maximálne štyri infúzie v 0., 2., 6. a 14. týždni) po vzplanutí ochorenia. Pacienti neužívali žiadnu súbežnú imunosupresívnu liečbu. V skupine s opakovanou liečbou sa u 4 % (8/219) pacientov objavili závažné reakcie na infúziu oproti < 1 % (1/222)
v skupine s udržiavacou liečbou. Väčšina závažných reakcií na infúziu sa vyskytla v priebehu druhej infúzie v 2. týždni. Interval medzi poslednou udržiavacou dávkou a prvou opakovanou
indukčnou dávkou bol v rozmedzí 35 – 231 dní. Príznaky zahŕňali dyspnoe, urtikáriu, edém tváre a hypotenziu, no neobmedzovali sa len na ne. Vo všetkých prípadoch bola liečba infliximabom
prerušená a/alebo sa začala iná liečba s úplným ústupom prejavov a príznakov.
Oneskorenáprecitlivenosť
V klinických štúdiách boli oneskorené reakcie z precitlivenosti menej časté a vyskytovali sa po obdobiach bez infliximabu kratších ako 1 rok. V štúdiách so psoriázou sa reakcie oneskorenej precitlivenosti objavovali včasne v priebehu liečby. Prejavy a príznaky zahŕňali myalgiu a/alebo artralgiu s horúčkou a/alebo vyrážkou, pričom u niektorých pacientov sa vyskytlo svrbenie, opuch tváre, ruky alebo pery, dysfágia, urtikária, bolesť hrdla a bolesť hlavy.
Údaje o výskyte oneskorených reakcií z precitlivenosti po obdobiach bez infliximabu dlhších ako
1 rok sú nedostatočné, ale obmedzené údaje z klinických štúdií naznačujú zvýšené riziko
oneskorenej precitlivenosti s predlžujúcim sa obdobím bez infliximabu (pozri časť 4.4).
V 1-ročnej klinickej štúdii s opakovanými infúziami u pacientov s Crohnovou chorobou (štúdia
ACCENT I) bola incidencia reakcií podobných sérovej chorobe 2,4 %.
Imunogenita
Pacienti, u ktorých sa vytvorili protilátky proti infliximabu, mali vyššiu pravdepodobnosť (približne
2- až 3-násobnú), že sa u nich objavia reakcie súvisiace s infúziou. Zdá sa, že súčasné použitie
imunosupresívnych látok redukuje frekvenciu reakcií súvisiacich s infúziou.
V klinických štúdiách, v ktorých sa podávali jednorazové a viacnásobné dávky infliximabu v rozsahu od 1 do 20 mg/kg, sa protilátky proti infliximabu detegovali u 14 % pacientov
s akoukoľvek imunosupresívnou liečbou a u 24 % pacientov bez imunosupresívnej liečby.
U pacientov s reumatoidnou artritídou, ktorí dostávali odporúčanú opakovanú liečbu dávkovacími režimami s metotrexátom, si 8 % pacientov vytvorilo protilátky proti infliximabu. U pacientov so psoriatickou artritídou, ktorí dostávali 5 mg/kg infliximabu s a bez metotrexátu, sa protilátky
objavili celkovo u 15 % pacientov (protilátky sa objavili u 4 % pacientov, ktorí dostávali metotrexát a u 26 % pacientov bez metotrexátu na začiatku liečby). U pacientov s Crohnovou chorobou, ktorí
dostávali udržiavaciu liečbu, sa protilátky proti infliximabu vyskytli celkovo u 3,3 % pacientov dostávajúcich imunosupresíva a u 13,3 % pacientov, ktorí nedostávali imunosupresíva. Výskyt protilátok bol 2- až 3- násobne vyšší u pacientov liečených epizodicky. Kvôli metodologickým
obmedzeniam, negatívny test nevylučuje prítomnosť protilátok proti infliximabu. U niektorých pacientov, u ktorých sa vyvinuli vysoké titre protilátok proti infliximabu, boli viditeľné znaky
zníženej účinnosti. Približne 28 % pacientov so psoriázou, liečených infliximabom v udržiavacom režime a nedostávajúcich súbežne imunomodulátory, si vytvorilo protilátky proti infliximabu (pozri časť 4.4: „Reakcie na infúziu a precitlivenosť“).
Infekcie
U pacientov liečených infliximabom sa pozorovali tuberkulóza, bakteriálne infekcie, vrátane sepsy a pneumónie, invazívne mykotické, vírusové a iné oportúnne infekcie. Niektoré z týchto infekcií boli fatálne; najčastejšie hlásené oportúnne infekcie s hodnotou mortality > 5 % zahŕňali pneumocystózu, kandidózu, listeriózu a aspergilózu (pozri časť 4.4).
V klinických štúdiách sa na infekciu liečilo 36 % pacientov liečených infliximabom v porovnaní s 25 % pacientov dostávajúcich placebo.
V klinických štúdiách s reumatoidnou artritídou bola incidencia závažných infekcií vrátane pneumónie vyššia u pacientov liečených infliximabom plus metotrexátom v porovnaní s metotrexátom samotným, a to zvlášť v dávkach 6 mg/kg alebo vyšších (pozri časť 4.4).
Najčastejšou závažnou nežiaducou udalosťou v spontánnych hláseniach po uvedení lieku na trh sú infekcie. Niektoré z týchto prípadov mali fatálne následky. Takmer 50 % hlásených úmrtí bolo
v súvislosti s infekciou. Hlásili sa prípady tuberkulózy, niekedy fatálne, vrátane miliárnej tuberkulózy a tuberkulózy s extrapulmonálnou lokalizáciou (pozri časť 4.4).
Malignity a lymfoproliferatívne poruchy
V klinických štúdiách s infliximabom, v ktorých bolo liečených 5 780 pacientov, čo predstavovalo
5 494 pacientskych rokov, sa zistilo 5 prípadov lymfómov a 26 nelymfómových malignít, v porovnaní so žiadnymi lymfómami a 1 nelymfómovou malignitou u 1 600 pacientov
dostávajúcich placebo, reprezentujúcich 941 pacientskych rokov.
Počas dlhodobého následného sledovania v rámci klinických štúdií s infliximabom až počas
5 rokov, čo predstavovalo 6 234 pacientskych rokov (3 210 pacientov), sa hlásilo 5 prípadov lymfómov a 38 prípadov nelymfómových malignít.
Po uvedení na trh sa hlásili prípady malignít vrátane lymfómov (pozri časť 4.4).
V prieskumnej klinickej štúdii zahŕňajúcej pacientov so stredne ťažkou až ťažkou CHOCHP, ktorí buď fajčia v súčasnosti, alebo fajčili v minulosti, bolo 157 dospelých pacientov liečených infliximabom v dávkach podobných, ako sa používajú pri reumatoidnej artritíde a Crohnovej chorobe. U deviatich z týchto pacientov sa objavili malignity, vrátane jedného lymfómu. Medián trvania sledovania bol 0,8 roka (incidencia 5,7 % [95 % IS 2,65 % - 10,6 %]). V kontrolnej skupine
77 pacientov sa hlásila jedna malignita (medián trvania sledovania 0,8 roka; incidencia 1,3 % [95 % IS 0,03 % - 7,0 %]). Väčšina malignít sa vytvorila v pľúcach alebo na hlave a krku.
V retrospektívnej populačnej kohortnej štúdii sa zistila zvýšená incidencia rakoviny krčka maternice u žien s reumatoidnou artritídou liečených infliximabom v porovnaní s pacientkami, ktoré sa pred tým neliečili biologickými liekmi, alebo s bežnou populáciou vrátane tých vo veku nad 60 rokov (pozri časť 4.4).
Navyše po uvedení na trh sa hlásili prípady hepatosplenického T-bunkového lymfómu u pacientov liečených infliximabom, z ktorých sa prevažná väčšina prípadov vyskytovala pri Crohnovej chorobe a ulceróznej kolitíde a väčšina z pacientov boli dospievajúci alebo mladí dospelí muži (pozri časť
4.4).
Zlyhávanie srdca
V štúdii II. fázy zameranej na vyhodnotenie účinku infliximabu pri kongestívnom zlyhávaní srdca (congestive heart failure = CHF) sa pozorovala vyššia incidencia mortality spôsobenej zhoršením zlyhávania srdca u pacientov liečených infliximabom, zvlášť u tých, ktorí boli liečení dávkou vyššou ako 10 mg/kg (t. j. dvojnásobkom maximálnej schválenej dávky). V tejto štúdii bolo
150 pacientov s CHF triedy NYHA III - IV (ejekčná frakcia ľavej komory ≤ 35 %) liečených 3
infúziami infliximabu v dávke 5 mg/kg, 10 mg/kg alebo placebom po dobu 6 týždňov. V 38. týždni zomrelo 9 zo 101 pacientov liečených infliximabom (2 pri dávke 5 mg/kg a 7 pri dávke 10 mg/kg) oproti jednému úmrtiu medzi 49 pacientmi v skupine s placebom.
Po uvedení lieku na trh sa u pacientov používajúcich infliximab zaznamenali hlásenia zhoršenia srdcového zlyhávania, s identifikovateľnými precipitačnými faktormi a bez nich. Po uvedení lieku
na trh sa tiež hlásilo novo vzniknuté zlyhávanie srdca, vrátane zlyhávania srdca u pacientov bez známeho už existujúceho kardiovaskulárneho ochorenia. Niektorí pacienti mali menej ako
50 rokov.
Hepatobiliárne udalosti
V klinických štúdiách sa pozorovali mierne až stredne ťažké zvýšenia ALT a AST u pacientov, ktorí dostávali infliximab, bez progresie do ťažkého poškodenia pečene. Pozorovali sa zvýšené
hladiny ALT ≥ 5 x horná hranica normálu (HHN) (pozri tabuľku 2). Zvýšenia aminotransferáz sa
pozorovali (ALT častejšie ako AST) častejšie u pacientov, ktorí dostávali infliximab, ako
v kontrolnej skupine, keď sa infliximab podával v monoterapii, ako aj keď sa použil v kombinácii s inými imunosupresívnymi látkami. Väčšina abnormalít aminotransferáz bola prechodná, avšak u
malého počtu pacientov zvýšenie trvalo dlhšie. Vo všeobecnosti boli pacienti, u ktorých sa objavili
zvýšenia ALT a AST, asymptomatickí a tieto abnormality sa zmiernili alebo vymizli tak pri pokračovaní alebo po prerušení podávania infliximabu, ako aj po modifikácii súbežnej liečby. Počas sledovania po uvedení na trh sa u pacientov dostávajúcich infliximab hlásili prípady žltačky
a hepatitíd, niektoré s črtami autoimunitnej hepatitídy (pozri časť 4.4).
Tabuľka 2
Podiel pacientov v klinických štúdiách so zvýšenou aktivitou ALT
Medián doby
Indikácia Počet pacientov3
sledovania
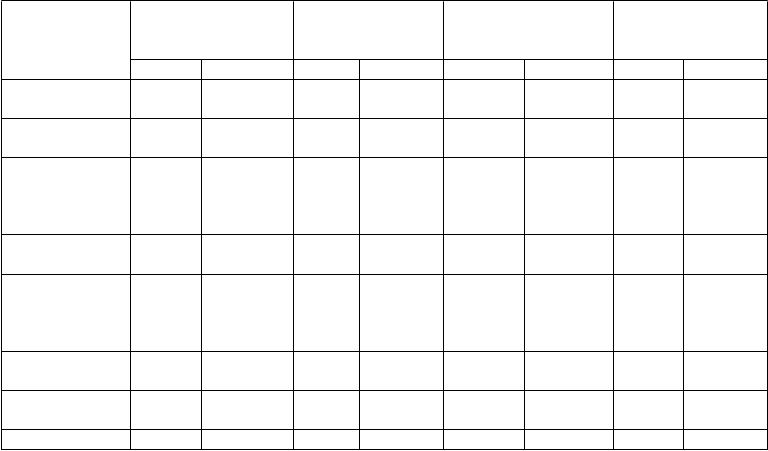
(týždne)4
≥ 3 x HHN ≥ 5 x HHN
Reumatoidná
placebo infliximab placebo infliximab placebo infliximab placebo infliximab
artritída1 375 1 087 58,1 58,3 3,2 % 3,9 % 0,8 % 0,9 %
Crohnova
choroba2 324 1 034 53,7 54,0 2,2 % 4,9 % 0,0 % 1,5 %
Crohnova choroba
v pediatrickej populácii
Ulcerózna
N/A 139 N/A 53,0 N/A 4,4 % N/A 1,5 %
kolitída 242 482 30,1 30,8 1,2 % 2,5 % 0,4 % 0,6 %
Ulcerózna
kolitída
v pediatrickej populácii
Ankylozujúca
N/A 60 N/A 49,4 N/A 6,7 % N/A 1,7 %
spondylitída 76 275 24,1 101,9 0,0 % 9,5 % 0,0 % 3,6 %
Psoriatická
artritída 98 191 18,1 39,1 0,0 % 6,8 % 0,0 % 2,1 %
Plaková psoriáza 281 1 175 16,1 50,1 0,4 % 7,7 % 0,0 % 3,4 %
1 Pacienti v skupine s placebom dostávali metotrexát, pokým pacienti liečení infliximabom dostávali oba lieky, infliximab
aj metotrexát.
2 Pacienti v skupine s placebom v 2 štúdiách Crohnovej choroby fázy III, ACCENT I a ACCENT II, dostali na začiatku štúdie úvodnú dávku 5 mg/kg infliximabu a počas udržiavacej fázy boli nastavení na placebo. Pacienti randomizovaní do skupiny s placebom v udržiavacej fáze s následným prechodom na infliximab sú v rámci analýzy ALT zaradení do skupiny liečenej infliximabom.
V skúšaní Crohnovej choroby fázy IIIb, SONIC, dostali pacienti v skupine s placebom AZA 2,5 mg/kg/deň ako aktívnu
kontrolu navyše k placebovým infúziám infliximabu.
3 Počet pacientov, u ktorých sa hodnotili hladiny ALT.
4 Medián doby sledovania liečených pacientov.
Antinukleárne protilátky (antinuclear antibodies = ANA)/Protilátky proti dvojvláknovej DNA(anti-double-stranded DNA = dsDNA)
V klinických štúdiách sa približne u polovice pacientov liečených infliximabom, ktorí mali pred
začatím liečby negatívne ANA, vyvinula pozitivita ANA počas štúdie, v porovnaní s približne pätinou pacientov dostávajúcich placebo. Protilátky anti-dsDNA sa novo detegovali u približne
17 % pacientov liečených infliximabom v porovnaní s 0 % pacientov dostávajúcich placebo. Pri
poslednom hodnotení 57 % pacientov liečených infliximabom zostalo anti-dsDNA pozitívnych. Hlásenia lupusu a lupusu podobných syndrómov však zostávajú menej časté (pozri časť 4.4).
Pediatrická populácia
Pacienti s juvenilnou reumatoidnou artritídou
Infliximab sa skúmal v klinickej štúdii u 120 pacientov (vek v rozmedzí 4 – 17 rokov) s aktívnou juvenilnou reumatoidnou artritídou napriek metotrexátu. Pacienti dostávali 3 mg/kg infliximabu
v 3-dávkovom indukčnom režime (týždne 0, 2, 6) alebo 6 mg/kg infliximabu v 3-dávkovom
indukčnom režime (týždne 14, 16, 20) s následnou udržiavacou liečbou každých 8 týždňov
v kombinácii s metotrexátom.
Reakcie na infúziu
Reakcie na infúziu sa objavili u 35 % pacientov s juvenilnou reumatoidnou artritídou, ktorí dostávali 3 mg/kg, oproti 17,5 % u pacientov, ktorí dostávali 6 mg/kg. V skupine s infliximabom
v dávke 3 mg/kg sa závažná reakcia na infúziu zaznamenala u 4 zo 60 pacientov a 3 pacienti hlásili
možnú anafylaktickú reakciu (z toho 2 boli medzi závažnými reakciami na infúziu). V skupine
s dávkou 6 mg/kg sa závažná reakcia na infúziu zaznamenala u 2 z 57 pacientov, jedna z toho bola
možná anafylaktická reakcia (pozri časť 4.4).
Imunogenita
Protilátky proti infliximabu sa vytvorili u 38 % pacientov liečených dávkou 3 mg/kg v porovnaní s 12 % pacientov s dávkou 6 mg/kg. Titre protilátok boli nápadne vyššie v skupine s dávkou
3 mg/kg oproti skupine so 6 mg/kg.
Infekcie
Infekcie sa objavili u 68 % (41/60) detí, ktoré dostávali 3 mg/kg počas 52 týždňov, u 65 % (37/57) detí, ktoré dostávali 6 mg/kg počas 38 týždňov, a u 47 % (28/60) detí, ktoré dostávali placebo po dobu 14 týždňov (pozri časť 4.4).
Pediatrickí pacienti s Crohnovou chorobou
V štúdii REACH (pozri časť 5.1) sa nasledujúce nežiaduce udalosti hlásili častejšie u pediatrických pacientov s Crohnovou chorobou ako u dospelých pacientov s Crohnovou chorobou: anémia
(10,7 %), krv v stolici (9,7 %), leukopénia (8,7 %), sčervenanie (8,7 %), vírusová infekcia (7,8 %), neutropénia (6,8 %), lámavosť kostí (6,8 %), bakteriálna infekcia (5,8 %) a alergická reakcia
v dýchacej sústave (5,8 %). Ďalšie špecifické oblasti sú rozvedené nižšie.
Reakcie súvisiace s infúziou
V štúdii REACH zaznamenalo 1 alebo viac reakcií na infúziu 17,5 % randomizovaných pacientov. Nezaznamenali sa závažné reakcie na infúziu a u 2 osôb sa v štúdii REACH objavili nezávažné anafylaktické reakcie.
Imunogenita
U 3 (2,9 %) pediatrických pacientov sa objavili protilátky proti infliximabu.
Infekcie
V štúdii REACH sa infekcie hlásili u 56,3 % randomizovaných osôb liečených infliximabom. Infekcie sa hlásili častejšie u osôb, ktoré dostávali infúzie každých 8 týždňov, ako u tých, ktoré
dostávali infúzie každých 12 týždňov (73,6 % oproti 38,0 %); závažné infekcie sa pritom hlásili u 3 osôb, ktoré dostávali v rámci udržiavacej liečby infúzie každých 8 týždňov, a u 4 osôb, ktoré
dostávali infúzie každých 12 týždňov. Najčastejšie hlásené infekcie boli infekcia horných dýchacích ciest a faryngitída a najčastejšie hlásená závažná infekcia bol absces. Hlásili sa tri prípady zápalu pľúc (1 závažný) a 2 prípady herpesu zoster (obidva nezávažné).
Pediatrickí pacienti s ulceróznou kolitídou
Celkovo boli nežiaduce reakcie hlásené v skúšaní ulceróznej kolitídy v pediatrickej populácii (C0168T72) a v štúdiách ulceróznej kolitídy u dospelých (ACT 1 a ACT 2) vo všeobecnosti zhodné. V štúdii C0168T72 boli najčastejšími nežiaducimi reakciami infekcia horných dýchacích ciest, faryngitída, bolesť brucha, horúčka a bolesť hlavy. Najčastejšou nežiaducou udalosťou bolo zhoršenie ulceróznej kolitídy, ktorej výskyt bol vyšší u pacientov s režimom dávkovania každých
12 týždňov oproti pacientom s režimom dávkovania každých 8 týždňov.
Reakcie súvisiace s infúziou
Celkovo 8 (13,3 %) zo 60 liečených pacientov zaznamenalo jednu alebo viac reakcií na infúziu, z toho 4 z 22 (18,2 %) v skupine s udržiavacou liečbou každých 8 týždňov a 3 z 23 (13,0 %)
v skupine s udržiavacou liečbou každých 12 týždňov. Nehlásili sa žiadne závažné reakcie na infúziu. Všetky reakcie na infúziu boli miernej až stredne závažnej intenzity.
Imunogenita
U 4 (7,7 %) pacientov sa počas 54. týždňa zistili protilátky proti infliximabu.
Infekcie
V štúdii C0168T72 sa hlásili infekcie u 31 (51,7 %) zo 60 liečených pacientov a 22 (36,7 %)
vyžadovalo perorálnu alebo parenterálnu antimikrobiálnu liečbu. V štúdii C0168T72 bol podiel pacientov s infekciami podobný ako v pediatrickej štúdii Crohnovej choroby (REACH), ale vyšší ako podiel pacientov v štúdiách ulceróznej kolitídy u dospelých (ACT 1 a ACT 2). Celkový výskyt infekcií v štúdii C0168T72 bol 13/22 (59 %) v skupine s udržiavacou liečbou každých 8 týždňov
a 14/23 (60,9 %) v skupine s udržiavacou liečbou každých 12 týždňov. Najčastejšie hlásenými
infekciami dýchacej sústavy boli infekcia horných dýchacích ciest (7/60 [12 %]) a faryngitída
(5/60 [8 %]). Závažné infekcie sa hlásili u 12 % (7/60) zo všetkých liečených pacientov.
V tejto štúdii bolo viac pacientov vo vekovej skupine 12 až 17 rokov (45/60 [75,0 %]) ako vo vekovej skupine 6 až 11 rokov (15/60 [25,0 %]). I keď je počet pacientov v každej podskupine veľmi malý na vyvodenie definitívnych záverov o vplyve veku na výskyt nežiaducich udalostí, v mladšej vekovej skupine bol vyšší podiel pacientov so závažnými nežiaducimi udalosťami
a prerušením liečby kvôli nežiaducim udalostiam ako v staršej vekovej skupine. Aj keď podiel pacientov s infekciami bol tiež vyšší v mladšej vekovej skupine, podiely pacientov so závažnými infekciami boli podobné v oboch vekových skupinách. Celkové podiely nežiaducich udalostí
a reakcií na infúziu boli pre vekové skupiny 6 až 11 ročných a 12 až 17 ročných podobné.
Skúsenosti po uvedení lieku na trh
Závažné nežiaduce udalosti hlásené spontánne po uvedení infliximabu na trh v pediatrickej
populácii zahŕňali malignity vrátane hepatosplenického T-bunkového lymfómu, prechodné
abnormality pečeňových enzýmov, lupusu podobný syndróm a pozitívne autoprotilátky (pozri časti
4.4 a 4.8).
Ďalšieinformácieoosobitných skupinách pacientov
Starší pacienti (≥ 65 rokov)
V klinických štúdiách reumatoidnej artritídy bol výskyt závažných infekcií u pacientov liečených
infliximabom a metotrexátom vyšší u pacientov vo veku 65 rokov a starších (11,3 %) ako
u pacientov mladších ako 65 rokov (4,6 %). U pacientov liečených samotným metotrexátom bol
výskyt závažných infekcií 5,2 % u pacientov vo veku 65 rokov a starších v porovnaní s 2,7 %
u pacientov mladších ako 65 rokov (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V
4.9 Predávkovanie
Nebol hlásený žiaden prípad predávkovania. Boli podané jednorazové dávky až do 20 mg/kg bez
toxických účinkov.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: imunosupresíva, inhibítory tumor nekrotizujúceho alfa faktora
(TNFα), ATC kód: L04AB02.
Flixabi je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.
Mechanizmus účinkuInfliximab je chimérická ľudsko-myšia monoklonálna protilátka, ktorá sa s vysokou afinitou viaže rovnako na rozpustnú, ako aj na transmembránovú formu TNFα, neviaže sa však na lymfotoxín α (TNFβ).
FarmakodynamickéúčinkyInfliximab inhibuje funkčnú aktivitu TNFα v mnohých typoch
in vitro biologických testov. Infliximab zabránil ochoreniu u transgénnych myší, u ktorých sa rozvíja polyartritída ako výsledok konštitučnej expresie ľudského TNFα, a ak sa im podal po vzniku ochorenia, umožnil hojenie erodovaných kĺbov.
In vivo infliximab rýchlo tvorí stabilné komplexy s ľudským TNFα, čo je proces paralelný so stratou biologickej aktivity TNFα.
V kĺboch pacientov s reumatoidnou artritídou sa našli zvýšené koncentrácie TNFα, ktoré korelovali so zvýšenou aktivitou ochorenia. Pri reumatoidnej artritíde liečba infliximabom redukovala infiltráciu zápalových buniek do zapálených oblastí kĺbu, ako aj expresiu molekúl sprostredkujúcich bunkovú adhéziu, chemoatrakciu a degradáciu tkaniva. Po liečbe infliximabom pacienti vykazovali, oproti stavu pred liečbou, znížené hladiny sérového interleukínu 6 (IL-6), C-reaktívneho proteínu (CRP) a zvýšenie hladín hemoglobínu u pacientov s reumatoidnou artritídou so zníženou hladinou hemoglobínu. Navyše lymfocyty periférnej krvi nevykazovali, oproti bunkám od neliečených pacientov, významný pokles ich počtu alebo zníženie proliferatívnych odpovedí na
in vitro mitogénnu stimuláciu. U pacientov so psoriázou viedla liečba infliximabom k zníženiu epidermálneho zápalu a normalizácii diferenciácie keratinocytov v psoriatických plakoch.
V prípade psoriatickej artritídy redukovala krátka liečba infliximabom počet T-buniek a krvných ciev v synovii a psoriatickej koži.
Histologické vyhodnotenie biopsií hrubého čreva, získaných pred liečbou a 4 týždne po podaní infliximabu, ukázali podstatnú redukciu detegovateľného TNFα. Liečba pacientov s Crohnovou chorobou infliximabom bola tiež spojená s podstatným znížením bežne zvýšeného sérového zápalového markera, CRP. U pacientov liečených infliximabom boli celkové počty periférnych bielych krviniek len málo ovplyvnené, i keď zmeny počtov lymfocytov, monocytov a neutrofilov vykazovali posuny smerom k normálnym hodnotám. Mononukleárne bunky periférnej krvi (peripheral blood mononuclear cells = PBMC) pacientov liečených infliximabom vykazovali
v porovnaní s neliečenými pacientmi nezmenšenú proliferatívnu odpoveď na podnety a po liečbe
infliximabom sa nepozorovali podstatné zmeny v produkcii cytokínov stimulovanými PBMC. Analýza mononukleárnych buniek z lamina propria, získaných biopsiou črevnej sliznice, ukázala, že liečba infliximabom zapríčinila redukciu počtu buniek schopných exprimovať TNFα a interferón γ. Ďalšie histologické štúdie priniesli dôkaz, že liečba infliximabom redukuje infiltráciu postihnutých oblastí čreva zápalovými bunkami a prítomnosť zápalových markerov na týchto miestach. U pacientov liečených infliximabom sa v endoskopických štúdiách črevnej sliznice potvrdili známky zahojenia sliznice.
KlinickáúčinnosťabezpečnosťReumatoidná artritída u dospelýchÚčinnosť infliximabu sa hodnotila v dvoch multicentrických, randomizovaných, dvojito zaslepených, pivotných klinických štúdiách: ATTRACT a ASPIRE. V oboch štúdiách bolo povolené súčasné užívanie stálych dávok kyseliny listovej, perorálnych kortikosteroidov
(≤ 10 mg/deň) a/alebo nesteroidových protizápalových liekov (NSAIDs).
Primárnymi koncovými ukazovateľmi boli redukcia prejavov a príznakov, hodnotené kritériami Amerického kolégia reumatológie (American College of Reumatology, ACR20 pre ATTRACT, medzné ACR-N pre ASPIRE), prevencia štrukturálneho poškodenia kĺbu a zlepšenie fyzickej funkcie. Redukcia prejavov a príznakov bola definovaná ako najmenej 20 % zlepšenie (ACR20) počtu tak citlivých, ako aj opuchnutých kĺbov, a zlepšenie v 3 z nasledujúcich 5 kritérií: (1) celkové
vyhodnotenie hodnotiacim, (2) celkové vyhodnotenie pacientom, (3) miera funkčnosti/zneschopnenia, (4) vizuálna analógová stupnica bolesti a (5) rýchlosť sedimentácie erytrocytov alebo C-reaktívny proteín. ACR-N používa rovnaké kritériá ako ACR20, počítané tak, že sa zoberie vždy najnižšie percentuálne zlepšenie v počte opuchnutých kĺbov, počte citlivých kĺbov a mediáne zostávajúcich zložiek ACR odpovede. Štrukturálne poškodenie kĺbov (erózie
a zúženie kĺbovej štrbiny) na rukách aj na chodidlách, bolo merané zmenou celkového skóre (0 -
440) podľa Sharpa modifikovaného van der Heijdeovou oproti stavu pred liečbou. Na meranie
priemernej zmeny skóre fyzických funkcií pacienta v čase oproti stavu pred liečbou sa používal
dotazník na posudzovanie zdravia (Health Assessment Questionnaire – HAQ; stupnica 0 - 3).
Štúdia ATTRACT hodnotila odpovede v placebom kontrolovanej štúdii po 30, 54 a 102 týždňoch u 428 pacientov s reumatoidnou artritídou aktívnou napriek liečbe metotrexátom. Približne 50 % pacientov bolo vo funkčnej triede III. Pacienti dostávali placebo, 3 mg/kg alebo 10 mg/kg infliximabu v týždni 0, 2 a 6 a potom každé 4 alebo každých 8 týždňov. Všetci pacienti boli na stálych dávkach metotrexátu (medián 15 mg/týždeň) po dobu 6 mesiacov pred zaradením do štúdie a zostali na stabilných dávkach počas celej štúdie.
Výsledky z 54. týždňa (ACR20, celkové skóre podľa Sharpa modifikované van der Heijdeovou
a HAQ) sú v tabuľke 3. Vyššie stupne klinickej odpovede (ACR50 a ACR70) sa pozorovali u všetkých skupín s infliximabom v 30. a 54. týždni oproti samotnému metotrexátu.
Redukcia stupňa progresie štrukturálneho poškodenia kĺbov (erózie a zúženie kĺbovej štrbiny) sa
pozorovala vo všetkých skupinách s infliximabom po 54 týždňoch (tabuľka 3).
Účinky pozorované v 54. týždni sa udržali počas 102 týždňov. Vzhľadom na počet vyradení z liečby, nie je možné definovať veľkosť rozdielu účinku medzi skupinami s infliximabom
a samotným metotrexátom.
Tabuľka 3
Účinky na ACR20, štrukturálne poškodenie kĺbu a fyzickú funkciu v 54. týždni, ATTRACT
Pacienti s ACR20 odpoveďou/ vyhodnotení pacienti (%)c
Kontrolaa
15/88 (17 %)
3 mg/kg každých
8 týždňov
36/86 (42 %)
3 mg/kg každé
4 týždne
41/86 (48 %)
infliximabb
10 mg/kg každých
8 týždňov
51/87 (59 %)
10 mg/kg každé
4 týždne
48/81 (59 %)
Infliximab celkovob
176/340 (52 %)
Celkové skóred (skóre
podľa Sharpa modifikované van der Heijdeovou)
Zmena oproti stavu pred
liečbou (priemer ± SDc) 7,0 ± 10,3 1,3 ± 6,0 1,6 ± 8,5 0,2 ± 3,6 -0,7 ± 3,8 0,6 ± 5,9
Mediánc
(Medzikvartilný rozsah) Pacienti bez poškodenia/ vyhodnotení pacienti (%)c
4,0 (0,5;9,7)
13/64 (20 %)
0,5
(-1,5;3,0)
34/71 (48 %)
0,1
(-2,5;3,0)
35/71 (49 %)
0,5
(-1,5;2,0)
37/77 (48 %)
-0,5
(-3,0;1,5)
44/66 (67 %)
0,0
(-1,8;2,0)
150/285 (53 %)
HAQ zmena oproti stavu
pred liečbou v časee
(vyhodnotené pacientmi)
87 86 85 87 81 339
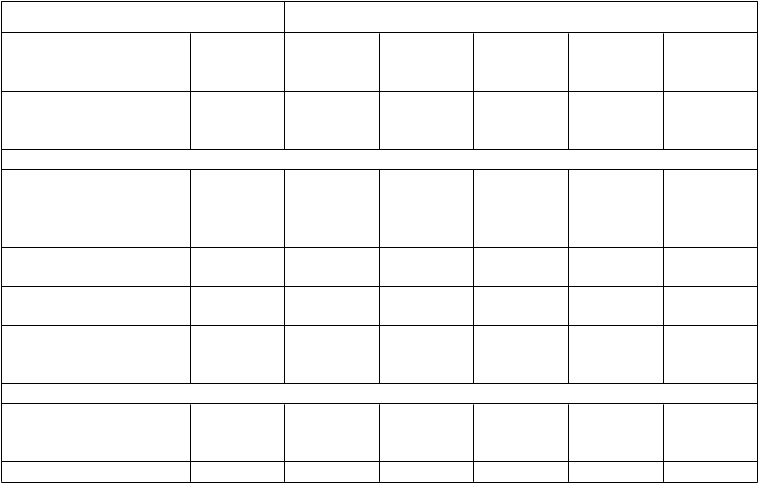
Priemer ± SDc 0,2 ± 0,3 0,4 ± 0,3 0,5 ± 0,4 0,5 ± 0,5 0,4 ± 0,4 0,4 ± 0,4
a Kontrola = všetci pacienti mali aktívnu reumatoidnú artritídu napriek stálym dávkam metotrexátu počas 6 mesiacov pred zaradením a zostali na stálych dávkach počas celej štúdie. Povolené bolo súčasné používanie perorálnych kortikosteroidov (≤ 10 mg/deň) a/alebo NSAID a bol suplementovaný folát.
b všetky podávané dávky infliximabu v kombinácii s metotrexátom a folátom, niektorí s kortikosteroidmi a/alebo NSAID.
c p < 0,001; pre každú skupinu s infliximabom oproti kontrole.
d väčšie hodnoty indikujú väčšie poškodenie kĺbu.
e HAQ - dotazník na posudzovanie zdravia; väčšie hodnoty indikujú menšie zneschopnenie.
Štúdia ASPIRE hodnotila odpovede po 54 týždňoch u 1 004 predtým metotrexátom neliečených pacientov s včasne (trvanie ochorenia ≤ 3 roky, medián 0,6 roka) aktívnou reumatoidnou artritídou (medián počtu opuchnutých kĺbov 19 a citlivých kĺbov 31). Všetci pacienti dostávali metotrexát (optimalizovaný na 20 mg/týždeň v 8. týždni) a buď placebo, 3 mg/kg, alebo 6 mg/kg infliximabu v týždni 0, 2 a 6 a potom každých 8 týždňov. Výsledky z 54. týždňa sú uvedené v tabuľke 4.
Po 54 týždňoch liečby, stanovené podľa podielu pacientov, ktorí dosiahli odpovede ACR20, 50
a 70, viedli obidve dávky infliximabu + metotrexátu k štatisticky významnému väčšiemu zlepšeniu
prejavov a príznakov, v porovnaní s metotrexátom samotným.
V štúdii ASPIRE sa u viac ako 90 % pacientov robili aspoň 2 hodnotiteľné RTG vyšetrenia. Po 30
a 54 týždňoch sa v skupinách s infliximabom + metotrexátom pozorovala redukcia stupňa progresie
štrukturálneho poškodenia, v porovnaní so samotným metotrexátom.
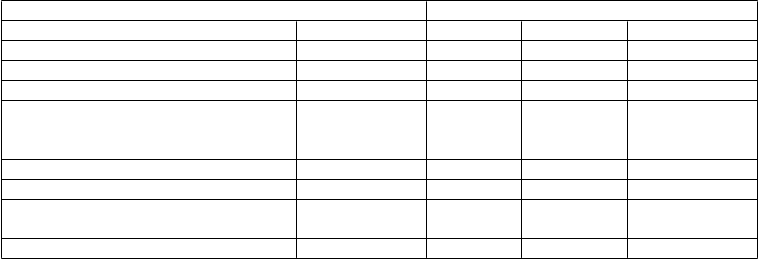
Tabuľka 4Účinky na ACR-N, štrukturálne poškodenie kĺbu a fyzickú funkciu v 54. týždniASPIREInfliximab + MTX
Placebo + MTX 3 mg/kg 6 mg/kg Kombinovane
Randomizovaní pacienti 282 359 363 722
Percento ACR zlepšenia
Priemer ± SDa 24,8 ± 59,7 37,3 ± 52,8 42,0 ± 47,3 39,6 ± 50,1
Zmena celkového skóre podľa Sharpa modifikované van der Heijdeovou oproti stavu pred liečboub
Priemer ± SDa 3,70 ± 9,61 0,42 ± 5,82 0,51 ± 5,55 0,46 ± 5,68
Medián 0,43 0,00 0,00 0,00
Priemerné zlepšenie HAQ oproti stavu
pred liečbou v čase od 30. do 54. týždňac
priemer ± SDd 0,68 ± 0,63 0,80 ± 0,65 0,88 ± 0,65 0,84 ± 0,65
a p < 0,001; pre každú skupinu liečenú infliximabom oproti kontrole.
b väčšie hodnoty ukazujú na väčšie poškodenie kĺbu.
c HAQ = dotazník na posudzovanie zdravia; väčšie hodnoty indikujú menšie zneschopnenie.
d p = 0,030 pre liečebnú skupinu 3 mg/kg a p < 0,001 pre liečebnú skupinu 6 mg/kg oproti placebu + MTX.
Údaje podporujúce titrovanie dávky pri reumatoidnej artritíde pochádzajú zo štúdií ATTRACT, ASPIRE a START. Štúdia START bola randomizovaná, multicentrická, dvojito zaslepená štúdia bezpečnosti s 3 paralelnými skupinami. V jednej zo skupín štúdie (skupina 2, n = 329) bolo
u pacientov, u ktorých sa nedosiahla adekvátna odpoveď, povolené titrovať dávku s postupným
zvyšovaním o 1,5 mg/kg od 3 mg/kg až do 9 mg/kg. Väčšina (67 %) týchto pacientov titráciu dávky nepotrebovala. Z ostatných pacientov, u ktorých bola titrácia dávky potrebná, dosiahlo klinickú
odpoveď 80 % pacientov a väčšina (64 %) si vyžadovala iba jedno zvýšenie o 1,5 mg/kg.
Crohnova choroba u dospelýchIndukčná liečba stredne ťažkej až ťažkej aktívnej Crohnovej chorobyÚčinnosť liečby jednorazovou dávkou infliximabu sa hodnotila u 108 pacientov s aktívnou
Crohnovou chorobou (Index aktivity Crohnovej choroby (Crohn’s Disease Activity
Index (CDAI) ≥ 220 ≤ 400) v randomizovanej, dvojito zaslepenej, placebom kontrolovanej a odpoveď na dávku zisťujúcej klinickej štúdii. Z týchto 108 pacientov bolo 27 liečených odporúčanou dávkou infliximabu 5 mg/kg. Všetci pacienti vykázali neadekvátnu odpoveď na predchádzajúce konvenčné liečby. V štúdii bolo povolené súčasné používanie stálych dávok konvenčných terapií a 92 % pacientov pokračovalo v používaní týchto terapií.
Primárnym koncovým ukazovateľom bol podiel pacientov s klinickou odpoveďou, ktorá bola definovaná ako zníženie CDAI o ≥ 70 bodov oproti stavu pred liečbou počas 4-týždňového hodnotenia, a to bez zvýšeného použitia liekov alebo vykonania chirurgického zákroku pre
Crohnovu chorobu. Pacienti, ktorí v 4. týždni odpovedali na liečbu, boli sledovaní do 12. týždňa. Sekundárne koncové ukazovatele zahŕňali podiel pacientov v klinickej remisii v 4. týždni
(CDAI < 150) a dlhodobú klinickú odpoveď.
V 4. týždni po podaní jednorazovej dávky dosiahlo klinickú odpoveď 22/27 (81 %) pacientov
liečených infliximabom dávkou 5 mg/kg oproti 4/25 (16 %) pacientov dostávajúcich placebo
(p < 0,001). Taktiež v 4. týždni dosiahlo klinickú remisiu (CDAI < 150) 13/27 (48 %) pacientov
liečených infliximabom oproti 1/25 (4 %) pacientov dostávajúcich placebo. Odpoveď na liečbu sa
pozorovala do 2 týždňov, maximálna odpoveď sa dosiahla v 4. týždni. Pri poslednom sledovaní v 12. týždni 13/27 (48 %) pacientov liečených infliximabom stále odpovedalo na liečbu.
Udržiavacia liečba stredne ťažkej až ťažkej aktívnej Crohnovej choroby u dospelých
Účinnosť opakovaných infúzií infliximabu sa skúmala v 1-ročnej klinickej štúdii (ACCENT I). Celkovo 573 pacientov so stredne závažnou až závažnou aktívnou Crohnovou chorobou
(CDAI ≥ 220 ≤ 400) dostalo jednorazovú infúziu s dávkou 5 mg/kg v týždni 0. 178 z 580
zaradených pacientov (30,7 %) bolo definovaných, že majú závažné ochorenie (CDAI skóre > 300 a
súbežne užívali kortikosteroid a/alebo imunosupresívum), čo zodpovedá populácii definovanej
v indikácii (pozri časť 4.1). V 2. týždni sa u všetkých pacientov hodnotila klinická odpoveď a boli randomizovaní do jednej z 3 liečebných skupín; skupina v udržiavacej fáze s placebom, skupina
s udržiavacou liečbou dávkou 5 mg/kg a skupina s udržiavacou liečbou dávkou 10 mg/kg. Všetky 3
skupiny dostali opakované infúzie v týždňoch 2 a 6 a potom každých 8 týždňov.
Z 573 randomizovaných pacientov dosiahlo klinickú odpoveď v 2. týždni 335 (58 %). Títo pacienti boli klasifikovaní ako reagujúci v 2. týždni a boli zaradení do primárnej analýzy (pozri tabuľku 5). Medzi pacientmi klasifikovanými ako nereagujúci v 2. týždni bolo 32 % (26/81) v skupine
v udržiavacej fáze s placebom a 42 % (68/163) v skupine s infliximabom, ktorí dosiahli klinickú
odpoveď v 6. týždni. Potom nebol žiaden rozdiel medzi skupinami v počte neskoro reagujúcich.
Súbežné primárne koncové ukazovatele boli pomerom medzi pacientmi s klinickou remisiou (CDAI < 150) v 30. týždni a časom straty reakcie počas 54. týždňa. Zníženie dávky kortikosteroidov bolo umožnené po 6. týždni.
Tabuľka 5
Účinky na reakciu a mieru remisie, údaje z ACCENT I (reagujúci v 2. týždni)
ACCENT I (reagujúci v 2. týždni)
% pacientov
Medián času straty reakcie počas
udržiavacia fáza s placebom
(n = 110)
udržiavacia liečba
infliximabom
5 mg/kg
(n = 113) (p hodnota)
38 týždňov
udržiavacia liečba infliximabom
10 mg/kg
(n = 112) (p hodnota)
> 54 týždňov
54. týždňa 19 týždňov
30. týždeň
(0,002)
(< 0,001)
Klinická odpoveďa 27,3 51,3 59,1
(< 0,001) (< 0,001)
Klinická remisia 20,9 38,9 45,5 (0,003) (< 0,001)
Remisia bez steroidov 10,7 (6/56) 31,0 (18/58) 36,8 (21/57) (0,008) (0,001)
54
. týždeň
Klinická odpoveďa 15,5 38,1
(< 0,001)
Klinická remisia 13,6 28,3 (0,007)
Pretrvávajúca remisia bez steroidovb 5,7 (3/53) 17,9 (10/56) (0,075)
47,7
(< 0,001)
38,4
(< 0,001)
28,6 (16/56) (0,002)
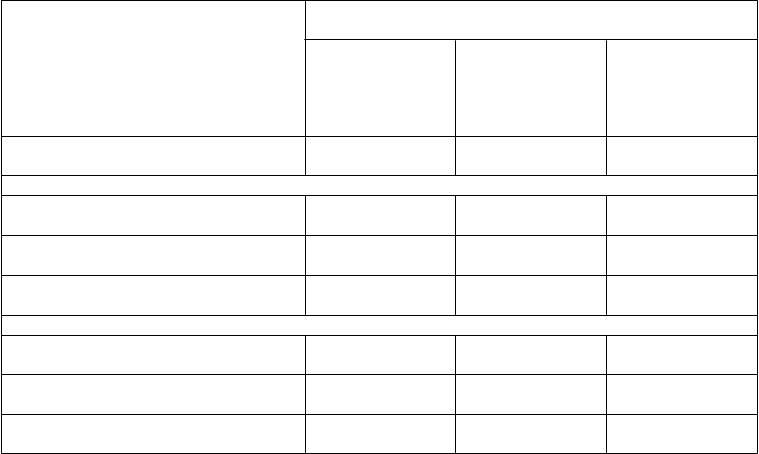
a Redukcia CDAI ≥ 25 % a ≥ 70 bodov.
b CDAI < 150 v 30. a 24. týždni a bez podávania kortikosteroidov 3 mesiace pred 54. týždňom v skupine pacientov, ktorí'
na začiatku dostávali kortikosteroidy.
Na začiatku 14. týždňa bolo pacientom, ktorí odpovedali na liečbu, no následne stratili ich klinický prospech umožnené prekročiť dávku infliximabu 5 mg/kg vyššie ako bola dávka, do ktorej boli pôvodne randomizovaní. Osemdesiatdeväť percent (50/56) pacientov, ktorí stratili klinickú odpoveď na udržiavaciu liečbu infliximabom 5 mg/kg po 14. týždni reagovali na liečbu 10 mg/kg infliximabu.
Stupne zlepšenia kvality života, zníženie hospitalizácií spojených s ochorením a používanie kortikosteroidov sa pozorovali v 30. a 54. týždni v skupinách s udržiavacou liečbou infliximabom v porovnaní so skupinou v udržiavacej fáze s placebom.
Infliximab s AZA alebo bez AZA sa hodnotil v randomizovanej, dvojito zaslepenej štúdii
s aktívnym komparátorom (SONIC) u 508 dospelých pacientov so stredne ťažkou až ťažkou
Crohnovou chorobou (CDAI ≥ 220 ≤ 450), ktorí sa pred tým neliečili biologickými liekmi
a imunosupresívami a mali medián trvania choroby 2,3 rokov. Na začiatku dostávalo 27,4 %
pacientov systémové kortikosteroidy, 14,2 % pacientov dostávalo budezonid a 54,3 % pacientov dostávalo 5-ASA liečivá. Pacienti boli randomizovaní do skupín s AZA v monoterapii, infliximabom v monoterapii alebo infliximabom a AZA v kombinovanej liečbe. Infliximab sa podával v dávke 5 mg/kg v týždňoch 0, 2, 6 a potom každých 8 týždňov. AZA sa podával v dávke
2,5 mg/kg denne.
Primárnym koncovým ukazovateľom štúdie bola klinická remisia bez kortikosteroidov v 26. týždni definovaná ako pacienti v klinickej remisii (CDAI < 150), ktorí počas najmenej 3 týždňov neužívali perorálne systémové kortikosteroidy (prednizón alebo ekvivalent) alebo budezonid
v dávke > 6 mg/deň. Výsledky pozri v tabuľke 6. Podiel pacientov s hojením sliznice v 26. týždni bol signifikantne vyšší v skupinách s infliximabom a AZA v kombinácii (43,9 %, p < 0,001)
a s infliximabom v monoterapii (30,1 %, p = 0,023) v porovnaní so skupinou AZA v monoterapii
(16,5 %).
Tabuľka 6
Percento pacientov, ktorí dosiahli klinickú remisiu bez kortikosteroidov v 26. týždni, SONIC
26
. týždeň
AZA
monoterapia
Infliximab monoterapia
Infliximab + AZA
kombinovaná liečba
Všetci randomizovaní pacienti 30,0 % (51/170) 44,4 % (75/169) (p = 0,006)*
* hodnoty p predstavujú jednotlivé liečebné skupiny s infliximabom oproti AZA v monoterapii.
56,8 % (96/169) (p < 0,001)*

Podobné trendy v dosahovaní klinickej remisie bez kortikosteroidov sa pozorovali v 50. týždni.
Okrem toho sa pri infliximabe pozorovala zlepšená kvalita života meraná pomocou IBDQ.
Indukčná liečba fistulizujúcej, aktívnej Crohnovej chorobyÚčinnosť liečby sa hodnotila v randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii
u 94 pacientov s fistulizujúcou Crohnovou chorobou, ktorí mali fistuly najmenej v trvaní 3 mesiace.
Tridsaťjeden z týchto pacientov bolo liečených 5 mg/kg infliximabu. Približne 93 % z týchto
pacientov predtým dostalo antibiotickú alebo imunosupresívnu liečbu.
Bolo povolené súčasné užívanie stálych dávok konvenčných terapií a 83 % pacientov pokračovalo
v užívaní najmenej jednej z týchto terapií. Pacienti dostali tri dávky buď placeba, alebo infliximabu v 0., 2. a 6. týždni. Pacienti boli sledovaní až 26 týždňov. Primárnym koncovým ukazovateľom bolo
zistiť podiel pacientov s klinickou odpoveďou, ktorá bola definovaná ako zníženie počtu fistúl
drénujúcich po jemnom stlačení o ≥ 50 % oproti ich počtu pred liečbou, prinajmenšom pri dvoch po
sebe nasledujúcich kontrolách (intervaly medzi kontrolami boli 4 týždne), pričom nesmelo dôjsť
k nárastu používania liekov alebo k chirurgickému zákroku pre Crohnovu chorobu.
Klinickú odpoveď dosiahlo šesťdesiatosem percent (21/31) pacientov liečených infliximabom dávkovacím režimom 5 mg/kg oproti 26 % (8/31) pacientov dostávajúcich placebo (p = 0,002). Medián času do nástupu odpovede bol v skupine liečenej infliximabom 2 týždne. Medián času pretrvávania odpovede bol 12 týždňov. Navyše u 55 % pacientov liečených infliximabom sa dosiahlo uzatvorenie všetkých fistúl v porovnaní s 13 % pacientov dostávajúcich placebo
(p = 0,001).
Udržiavacia liečba fistulizujúcej, aktívnej Crohnovej choroby
Účinnosť opakovaných infúzií infliximabu u pacientov s fistulizujúcou Crohnovou chorobou sa skúmala v 1-ročnej klinickej štúdii (ACCENT II). Celkovo 306 pacientov dostalo 3 dávky infliximabu 5 mg/kg v 0., 2. a 6. týždni. Pred začatím liečby malo 87 % pacientov perianálnu fistulu, 14 % pacientov abdominálnu fistulu, 9 % rektovaginálnu fistulu. Medián CDAI skóre bol
180. V 14. týždni sa hodnotila klinická odpoveď 282 pacientov a boli randomizovaní buď do
skupiny s placebom, alebo do skupiny s 5 mg/kg infliximabu každých 8 týždňov počas 46 týždňov.
U pacientov, ktorí 14. týždeň reagovali na liečbu (195/282), sa hodnotil primárny koncový ukazovateľ, čo bol čas od randomizácie po stratu odpovede (pozri tabuľku 7). Zníženie dávky kortikosteroidov bolo umožnené po 6. týždni.
Tabuľka 7
Účinky na rýchlosť reakcie, údaje z ACCENT II (reagujúci v 14. týždni)
ACCENT II (reagujúci v 14. týždni)
udržiavacia fáza s placebom
(n = 99)
udržiavacia liečba
infliximabom
(5 mg/kg) (n = 96)
p-hodnota
Medián času straty reakcie počas 54. týždňa 14 týždňov > 40 týždňov < 0,001
54. týždeňOdpoveď fistuly (%) a 23,5 46,2 0,001
Celková odpoveď fistuly (%) b 19,4 36,3 0,009
a ≥ 50 % zníženie počtu drenáží fistúl počas obdobia ≥ 4 týždňov od začiatku liečby.
b Bez prítomnosti akýchkoľvek drenáží fistúl.
Na začiatku 22. týždňa mohli pacienti, ktorí spočiatku odpovedali na liečbu a následne stratili odpoveď, prejsť na aktívne opakovanie liečby každých 8 týždňov s dávkou infliximabu o 5 mg/kg vyššou ako bola dávka, do ktorej boli pôvodne randomizovaní. Medzi pacientmi v skupine s infliximabom 5 mg/kg, ktorí prešli na inú dávku, pretože stratili odpoveď fistuly po 22. týždni, bolo
57 % (12/21) reagujúcich na opakovanú liečbu infliximabom 10 mg/kg každých 8 týždňov.
V podiele pacientov s pretrvávajúcim uzatváraním všetkých fistúl počas 54 týždňov, v príznakoch, ako sú proktalgia, abscesy a infekcie močového traktu, alebo v počte novo vytvorených fistúl počas liečby sa nezaznamenal významný rozdiel medzi placebom a infliximabom.
Udržiavacia liečba infliximabom každých 8 týždňov významne znížila hospitalizácie spojené
s ochorením a chirurgické zákroky v porovnaní s placebom. Ďalej sa pozorovalo znížené používanie
kortikosteroidov a zlepšenie kvality života.
Ulcerózna kolitída u dospelýchBezpečnosť a účinnosť infliximabu sa hodnotili v dvoch (ACT 1 a ACT 2) randomizovaných
dvojito zaslepených placebom kontrolovaných klinických štúdiách u dospelých pacientov so stredne
ťažkou až ťažkou aktívnou ulceróznou kolitídou (skóre 6 až 12 podľa Maya, subskóre podľa endoskopického vyšetrenia ≥ 2), ktorí adekvátne neodpovedali na konvenčné liečby [perorálne kortikosteroidy, aminosalicyláty a/alebo imunomodulátory (6-MP, AZA)]. Povolená bola súbežná liečba perorálnymi aminosalicylátmi, kortikosteroidmi a/alebo imunomodulátormi) v stabilných dávkach. Pacienti v oboch štúdiách boli randomizovaní buď do skupiny s placebom alebo na liečbu
5 mg/kg infliximabu alebo 10 mg/kg infliximabu a to v týždňoch 0, 2, 6, 14 a 22 a v ACT 1
v týždňoch 30, 38 a 46. Po 8. týždni bolo povolené znížiť dávku kortikosteroidov.
T
abuľka 8
V
plyvy na klinickú odpoveď, klinickú remisiu a hojenie sliznice v 8. a 30. týždni
K
ombinované údaje z ACT 1 & ACT 2
Placebo
Infliximab
5 mg/kg 10 mg/kg Kombinovaná
Randomizované osoby 244 242 242 484
Percento osôb s klinickou odpoveďou a pretrvávajúcou klinickou odpoveďou
Klinická odpoveď v 8. týždnia 33,2 % 66,9 % 65,3 % 66,1 % Klinická odpoveď v 30. týždnia 27,9 % 49,6 % 55,4 % 52,5 % Pretrvávajúca odpoveď
(klinická odpoveď v oboch, 8.
a 30. týždni)a
19,3 % 45,0 % 49,6 % 47,3 %
P
ercento osôb v klinickej remisii a pretrvávajúcej remisii
Klinická remisia v 8. týždnia 10,2 % 36,4 % 29,8 % 33,1 % Klinická remisia v 30. týždnia 13,1 % 29,8 % 36,4 % 33,1 % Pretrvávajúca remisia
(v remisii v oboch, 8.
a 30. týždni)a
5,3 % 19,0 % 24,4 % 21,7 %
 P
ercento osôb, u ktorých došlo k hojeniu sliznice
P
ercento osôb, u ktorých došlo k hojeniu sliznice
Hojenie sliznice v 8. týždnia 32,4 % 61,2 % 60,3 % 60,7 % Hojenie sliznice v 30. týždnia 27,5 % 48,3 % 52,9 % 50,6 % a p < 0,001, pre každú liečebnú skupinu s infliximabom oproti placebu.
Účinnosť infliximabu počas 54 týždňov sa hodnotila v štúdii ACT 1.
V 54. týždni dosiahlo klinickú odpoveď 44,9 % pacientov v kombinovanej liečebnej skupine
s infliximabom v porovnaní s 19,8 % v liečebnej skupine s placebom (p < 0,001). Klinická remisia a hojenie sliznice v 54. týždni sa objavili u vyššieho podielu pacientov v kombinovanej liečebnej
skupine s infliximabom ako v liečebnej skupine s placebom (34,6 % oproti 16,5 %; p < 0,001 a
46,1 % oproti 18,2 %; p < 0,001). Podiel pacientov s pretrvávajúcou odpoveďou a v pretrvávajúcej remisii v 54. týždni bol vyšší v skupine s kombinovanou liečbou s infliximabom ako v skupine
dostávajúcej placebo (37,9 % oproti 14,0 %; p < 0,001, respektíve 20,2 % oproti 6,6 %; p < 0,001).
U väčšej časti pacientov v skupine s kombinovanou liečbou s infliximabom bolo možné vysadiť podávanie kortikosteroidov počas pretrvávania klinickej remisie v porovnaní so skupinou dostávajúcou placebo tak v 30. týždni (22,3 % oproti 7,2 %, p < 0,001, zlúčené údaje ACT 1 & ACT 2), ako aj v 54. týždni (21,0 % oproti 8,9 %, p = 0,022, údaje ACT 1).
Analýza zlúčených údajov z ACT 1 a ACT 2 štúdií a ich predĺžení, analyzovaná od začiatku do
54. týždňa, ukázala zmiernenie ulceróznej kolitídy súvisiace s hospitalizáciami a chirurgickými
výkonmi pri liečbe infliximabom. Počet hospitalizácií súvisiacich s ulceróznou kolitídou bol signifikantne nižší v skupine liečenej 5 a 10 mg/kg infliximabu (priemerný počet hospitalizácií na
100 pacientskych rokov: 21 a 19 oproti 40 v skupine s placebom; p = 0,019, respektíve p = 0,007).
Počet chirurgických výkonov súvisiacich s ulceróznou kolitídou bol tiež nižší v skupine liečenej 5
a 10 mg/kg infliximabu než v skupine s placebom (priemerný počet chirurgických výkonov na 100
pacientskych rokov: 22 a 19 oproti 34; p = 0,145, respektíve p = 0,022).
Podiel osôb, ktoré absolvovali kolektómiu v akomkoľvek čase v priebehu 54 týždňov po prvej infúzii skúšanej látky, sa zhromaždil a zlúčil z ACT 1 a ACT 2 štúdií a ich predĺžení. Menej osôb absolvovalo kolektómiu v skupine s 5 mg/kg infliximabu (28/242 alebo 11,6 % [N.S.]) a v skupine s 10 mg/kg infliximabu (18/242 alebo 7,4 % [p = 0,011]) než v skupine s placebom (36/244;
14,8 %).
Znížená incidencia kolektómie sa tiež zistila v inej randomizovanej, dvojito zaslepenej štúdii (C0168Y06) s hospitalizovanými pacientmi (n = 45) so stredne ťažkou až ťažkou aktívnou ulceróznou kolitídou, ktorí nereagovali na intravenózne (i.v.) kortikosteroidy a ktorí preto mali vyššie riziko kolektómie. Signifikantne menej kolektómií sa vyskytlo počas 3 mesiacov štúdie
s infúziou u pacientov, ktorí dostali jednorazovú dávku 5 mg/kg infliximabu v porovnaní s pacientmi, ktorí dostali placebo (29,2 % oproti 66,7 %, p = 0,017).
V ACT 1 a ACT 2, infliximab zlepšoval kvalitu života, čo sa potvrdilo štatisticky významným zlepšením v pre ochorenie špecifickom meradle, IBDQ a zlepšením v prieskume pomocou generického 36-položkového krátkeho formuláru SF-36.
Ankylozujúca spondylitída u dospelých
Účinnosť a bezpečnosť infliximabu sa skúmali v dvoch multicentrických, dvojito zaslepených, placebom kontrolovaných štúdiách u pacientov s aktívnou ankylozujúcou spondylitídou (skóre
Bathovho indexu aktivity ankylozujúcej spondylitídy [BASDAI] ≥ 4 a bolesť chrbtice ≥ 4 v škále 1
- 10).
V prvej štúdii (P01522), ktorá mala 3 mesiace dvojito zaslepenú fázu, dostávalo 70 pacientov buď
5 mg/kg infliximabu alebo placebo, a to v týždňoch 0, 2 a 6 (v každej skupine bolo 35 pacientov). V 12. týždni boli pacienti, ktorí dostávali placebo, preradení na 5 mg/kg infliximabu
každých týždňov až do 54. týždňa. Po prvom roku štúdie 53 pacientov pokračovalo v nezaslepenom
predĺžení až do 102. týždňa.
V druhej klinickej štúdii (ASSERT) bolo randomizovaných 279 pacientov, ktorí dostávali buď placebo (Skupina 1, n = 78) alebo 5 mg/kg infliximabu (Skupina 2, n = 201) a to v týždňoch 0, 2 a 6 a každých 6 týždňov až do 24. týždňa. Potom všetky osoby pokračovali infliximabom každých
6 týždňov až do 96. týždňa. Skupina 1 dostávala 5 mg/kg infliximabu. V Skupine 2 sa začalo
infúziou v 36. týždni, pacienti, ktorí mali BASDAI ≥ 3 pri dvoch po sebe nasledujúcich návštevách, potom dostávali 7,5 mg/kg infliximabu každých 6 týždňov až do 96. týždňa.
V ASSERT sa pozorovalo zlepšenie prejavov a príznakov už v 2. týždni. V 24. týždni bol počet
osôb, ktoré dosiahli ASAS 20 v skupine s placebom 15/78 (19 %) a 123/201 (61 %) v skupine
s 5 mg/kg infliximabu (p < 0,001). Z 2. skupiny 95 osôb pokračovalo s 5 mg/kg každých 6 týždňov. Po 102 týždňoch bolo 80 osôb ešte stále liečených infliximabom, z ktorých 71 (89 %) dosiahlo ASAS 20.
V P01522 sa tiež pozorovalo zlepšenie prejavov a príznakov už v 2. týždni. V 12. týždni bol počet
osôb, ktoré dosiahli BASDAI 50 v skupine s placebom 3/35 (9 %) a 20/35 (57 %) v skupine
s 5 mg/kg (p < 0,01). 53 osôb pokračovalo s 5 mg/kg každých 6 týždňov. Po 102 týždňoch bolo
49 pacientov ešte stále liečených infliximabom, z ktorých 30 (61 %) dosiahlo BASDAI 50.
V obidvoch štúdiách sa tiež významne zlepšili fyzické funkcie a kvalita života, hodnotené pomocou
BASFI a fyzickou zložkou skóre SF36.
Psoriatická artritída u dospelých
Účinnosť a bezpečnosť sa hodnotili v dvoch multicentrických, dvojito zaslepených, placebom kontrolovaných štúdiách u pacientov s psoriatickou artritídou.
V prvej klinickej štúdii (IMPACT) sa účinnosť a bezpečnosť infliximabu skúmali u 104 pacientov s aktívnou polyartikulárnou psoriatickou artritídou. Počas 16-týždňovej dvojito zaslepenej fázy pacienti dostávali v týždni 0, 2, 6 a 14 buď 5 mg/kg infliximabu alebo placebo (52 pacientov
v každej skupine). Počínajúc 16. týždňom prešli pacienti, ktorí dostávali placebo, na infliximab
a následne dostávali všetci pacienti až do 46. týždňa 5 mg/kg infliximabu každých 8 týždňov. Po prvom roku štúdie pokračovalo 78 pacientov v otvorenom predĺžení do 98. týždňa.
V druhej klinickej štúdii (IMPACT 2) sa účinnosť a bezpečnosť infliximabu skúmali u 200 pacientov s aktívnou psoriatickou artritídou (≥ 5 opuchnutých kĺbov a ≥ 5 bolestivých kĺbov). Štyridsaťšesť percent pacientov pokračovalo v stabilnej dávke metotrexátu (≤ 25 mg/týždeň). Počas
24-týždňovej dvojito zaslepenej fázy dostávali pacienti buď infliximab v dávke 5 mg/kg, alebo placebo v 0., 2., 6., a 22. týždni (100 pacientov v každej skupine). V 16. týždni bolo 47 pacientov zo
skupiny s placebom, ktorí dosiahli < 10 %-né zlepšenie oboch, počtu opuchnutých aj bolestivých
kĺbov, oproti počiatočnému stavu preradených na indukčnú liečbu infliximabom (predčasný únik –
„early escape“). V 24. týždni všetci pacienti dostávajúci placebo prešli na indukčnú liečbu infliximabom. Všetci pacienti pokračovali v dávkovaní do 46. týždňa.
Kľúčové výsledky účinnosti zo štúdií IMPACT a IMPACT 2 sú uvedené v tabuľke 9:
Tabuľka 9
Účinok na ACR a PASI v IMPACT a IMPACT 2
IMPACT IMPACT 2*
Placebo
(16. týždeň)
Infliximab
(16. týždeň)
Infliximab
(98. týždeň)
Placebo
(24. týždeň)
Infliximab
(24. týždeň)
Infliximab
(54. týždeň)
Randomizovaní pacienti 52 52 N/Aa 100 100 100
ACR odpoveď (% pacientov)
počet 52 52 78 100 100 100
ACR 20 odpoveď* 5 (10 %) 34 (65 %) 48 (62 %) 16 (16 %) 54 (54 %) 53 (53 %) ACR 50 odpoveď* 0 (0 %) 24 (46 %) 35 (45 %) 4 (4 %) 41(41 %) 33 (33 %) ACR 70 odpoveď* 0 (0 %) 15 (29 %) 27 (35 %) 2 (2 %) 27 (27 %) 20 (20 %) PASI odpoveď (% pacientov)b
počet
PASI 75 odpoveď**
N/A
87 83 82
1 (1 %) 50 (60 %) 40 (48,8 %)

* ITT-analýza, v ktorej boli pacienti s chýbajúcimi údajmi započítaní ako neodpovedajúci.
a Údaje z 98. týždňa v štúdii IMPACT zahŕňali pacientov z kombinovanej skupiny, preradených z placeba a liečených
infliximabom, ktorí vstúpili do otvoreného predĺženia.
b pacienti s počiatočným PASI ≥ 2,5 v IMPACT a pacienti s počiatočným psoriatickým postihnutím kože BSA ≥ 3 %
v IMPACT 2.
** IMPACT nezahŕňal odpoveď PASI 75 pre nízky počet pacientov; p < 0,001 pre infliximab oproti placebu v 24. týždni v štúdii IMPACT 2.
V štúdiách IMPACT a IMPACT 2 sa klinická odpoveď pozorovala už v 2. týždni a udržala sa až do
98. týždňa v IMPACT a 54. týždňa v IMPACT 2. Účinnosť sa demonštrovala s alebo bez súbežného metotrexátu. U pacientov liečených infliximabom sa pozorovalo zníženie parametrov
charakteristík periférnej aktivity psoriatickej artritídy (ako je počet opuchnutých kĺbov, počet
bolestivých/na dotyk citlivých kĺbov, daktilitída a prítomnosť entezopatie).
V IMPACT2 sa hodnotili röntgenografické zmeny. Röntgenové snímky rúk a nôh sa zozbierali na začiatku liečby, v 24. a 54. týždni. Liečba infliximabom znížila pomer progresie periférneho poškodenia kĺbov v porovnaní s placebom v 24. týždni, primárny koncový ukazovateľ sa hodnotil ako zmena od začiatku liečby v celkovom modifikovanom vdH-S skóre (priemer ± SD skóre bolo
0,82 ± 2,62 v placebo skupine v porovnaní s –0,70 ± 2,53 v skupine s infliximabom; p < 0,001). V skupine s infliximabom sa priemerná zmena v celkovom modifikovanom vdH-S skóre udržala
pod 0 v časovom bode 54. týždňa.
Infliximabom liečení pacienti vykazovali významné zlepšenie telesných funkcií, hodnotených HAQ. Významné zlepšenie kvality života súvisiacej so zdravím v IMPACT 2 sa demonštrovalo vo fyzickej aj psychickej zložke sumárneho skóre SF-36.
Psoriáza u dospelýchÚčinnosť infliximabu sa hodnotila v dvoch multicentrických, randomizovaných, dvojito zaslepených štúdiách: SPIRIT a EXPRESS. Pacienti v oboch štúdiách mali plakovú psoriázu (plocha povrchu tela [Body Surface Area, BSA] ≥ 10 % a skóre indexu plochy postihnutia
a závažnosti psoriázy [Psoriasis Area and Severity Index, PASI] ≥ 12). Primárnym koncovým
ukazovateľom v oboch štúdiách bolo percento pacientov, ktorí v 10. týždni dosiahli ≥ 75 %
zlepšenie PASI oproti stavu pred začiatkom liečby.
Štúdia SPIRIT hodnotila účinnosť infliximabu v indukčnej liečbe u 249 pacientov s plakovou psoriázou, ktorí predtým dostávali PUVA alebo systémovú liečbu. Pacienti dostávali infúzie infliximabu v dávke 3 alebo 5 mg/kg alebo placeba v týždňoch 0, 2 a 6. Pacienti s PGA skóre ≥ 3 mohli v 26. týždni dostať ďalšiu infúziu s rovnakou liečbou.
V štúdii SPIRIT bol podiel pacientov, ktorí v 10. týždni dosiahli PASI 75, 71,7 % v skupine
s infliximabom v dávke 3 mg/kg; 87,9 % v skupine s infliximabom v dávke 5 mg/kg a 5,9 %
v skupine s placebom (p < 0,001). V 26. týždni, dvadsať týždňov po poslednej indukčnej dávke,
dosiahlo PASI 75 30 % pacientov v skupine s dávkou 5 mg/kg a 13,8 % pacientov v skupine s dávkou 3 mg/kg. V období medzi 6. a 26. týždňom sa príznaky psoriázy postupne vracali
s mediánom času do relapsu choroby > 20 týždňov. Nepozoroval sa rebound fenomén. Štúdia
EXPRESS hodnotila účinnosť infliximabu v indukčnej a udržiavacej liečbe u 378 pacientov s plakovou psoriázou. Pacienti dostávali infúzie infliximabu v dávke 5 mg/kg alebo placebo
v týždňoch 0, 2 a 6, po ktorých nasledovala udržiavacia liečba každých 8 týždňov až do 22. týždňa
v skupine s placebom a až do 46. týždňa v skupine s infliximabom. V 24. týždni prešla skupina s placebom na indukčnú liečbu infliximabom (5 mg/kg) s následnou udržiavacou liečbou infliximabom (5 mg/kg). Psoriáza nechtov sa hodnotila pomocou indexu závažnosti nechtovej psoriázy (Nail Psoriasis Severity Index, NAPSI). Predchádzajúcu liečbu PUVA, metotrexátom, cyklosporínom alebo acitretínom dostalo 71,4 % pacientov, i keď neboli bezpodmienečne voči tejto liečbe rezistentní. Kľúčové výsledky sú uvedené v tabuľke 10. U osôb liečených infliximabom bola významná odpoveď PASI 50 viditeľná pri prvej návšteve (týždeň 2) a odpoveď PASI 75 pri druhej návšteve (týždeň 6). Účinnosť bola v podskupine pacientov vystavených predchádzajúcim systémovým terapiám a v celkovej populácii štúdie podobná.
Tabuľka 10
Súhrn PASI odpovede, PGA odpovede a percento pacientov, u ktorých došlo k vyčisteniu
všetkých nechtov, v týždňoch 10, 24 a 50. EXPRESS
Placebo →
10
. týždeň
Infliximab 5 mg/kg
(v 24. týždni)
Infliximab
5 mg/kg

N 77 301
≥ 90 % zlepšenie 1 (1,3 %) 172 (57,1 %)a
≥ 75 % zlepšenie 2 (2,6 %) 242 (80,4 %)a
≥ 50 % zlepšenie 6 (7,8 %) 274 (91,0 %) PGA vymiznuté (0) alebo minimálne (1) 3 (3,9 %) 242 (82,9 %)ab PGA vymiznuté (0), minimálne (1) alebo mierne (2) 14 (18,2 %) 275 (94,2 %)ab
24. týždeňN 77 276
≥ 90 % zlepšenie 1 (1,3 %) 161 (58,3 %)a
≥ 75 % zlepšenie 3 (3,9 %) 227 (82,2 %)a
≥ 50 % zlepšenie 5 (6,5 %) 248 (89,9 %) PGA vymiznuté (0) alebo minimálne (1) 2 (2,6 %) 203 (73,6 %)a PGA vymiznuté (0), minimálne (1) alebo mierne (2) 15 (19,5 %) 246 (89,1 %)a
50. týždeňN 68 281
≥ 90 % zlepšenie 34 (50,0 %) 127 (45,2 %)
≥ 75 % zlepšenie 52 (76,5 %) 170 (60,5 %)
≥ 50 % zlepšenie 61 (89,7 %) 193 (68,7 %) PGA vymiznuté (0) alebo minimálne (1) 46 (67,6 %) 149 (53,0 %) PGA vymiznuté (0), minimálne (1) alebo mierne (2) 59 (86,8 %) 189 (67,3 %)
Vyčistené všetky nechtyc10. týždeň 1/65(1,5 %) 16/235 (6,8 %)
24. týždeň 3/65 (4,6 %) 58/223 (26,0 %)a
50. týždeň 27/64 (42,2 %) 92/226 (40,7 %)
a p < 0,001; pre každú liečebnú skupinu s infliximabom oproti kontrole.
b n = 292.
c Podkladom analýzy boli osoby, ktoré mali na začiatku liečby psoriázu nechtov (81,8 % osôb). Priemerné skóre NAPSI
na začiatku liečby bolo 4,6 v skupine s infliximabom a 4,3 v skupine s placebom.
Signifikantné zlepšenie oproti stavu na začiatku liečby sa ukázalo v DLQI (p < 0,001) a vo fyzickej a psychickej zložke skóre SF 36 (p < 0,001 pre obe porovnania).
Pediatrická populácia
C
r
ohnova choroba v pediatrickej populácii (6 až 17 rokov)
V štúdii REACH dostalo 112 pacientov (vo veku od 6 do 17 rokov, medián veku 13,0 rokov) so
stredne ťažkou až ťažkou aktívnou Crohnovou chorobou (medián pediatrickej CDAI 40)
a s neadekvátnou odpoveďou na konvenčnú terapiu infliximab 5 mg/kg v týždňoch 0, 2 a 6. Všetci pacienti boli nastavení na stabilnú dávku 6-MP, AZA alebo MTX (35 % dostávalo na začiatku aj
kortikosteroidy). Pacienti, ktorí na základe zhodnotenia skúšajúceho v 10. týždni dosiahli klinickú
odpoveď, boli randomizovaní na udržiavaciu liečbu infliximabom 5 mg/kg, a to buď každých
8 týždňov alebo každých 12 týždňov. Ak došlo počas udržiavacej liečby ku strate odpovede, bol povolený prechod na režim s vyššou dávkou (10 mg/kg) a/alebo kratším intervalom medzi dávkami (každých 8 týždňov). Tridsaťdva (32) hodnotiteľných pediatrických pacientov prešlo na nový režim (9 osôb zo skupiny s podávaním každých 8 týždňov a 23 osôb zo skupiny s podávaním každých
12 týždňov). U dvadsiatich štyroch z týchto pacientov (75,0 %) sa po prestupe znovu dosiahla
klinická odpoveď.
Podiel osôb s klinickou odpoveďou v 10. týždni bol 88,4 % (99/112). Podiel osôb v klinickej remisii v 10. týždni bol 58,9 % (66/112).
V 30. týždni bol podiel osôb v klinickej remisii vyšší v skupine s udržiavacou liečbou každých
8 týždňov (59,6 %, 31/52) ako v skupine s podávaním každých 12 týždňov (35,3 %, 18/51;
p = 0,013). V 54. týždni boli vyjadrenia odpovede na udržiavaciu liečbu nasledovné: 55,8 % (29/52)
v skupine s podávaním každých 8 týždňov a 23,5 % (12/51) pri podávaní každých 12 týždňov
(p < 0,001).
Údaje o fistulách sa odvodili zo skóre PCDAI. V kombinovaných skupinách udržiavacej liečby
každých 8 týždňov a každých 12 týždňov dosiahlo z 22 osôb s fistulami na začiatku liečby úplnú odpoveď, čo sa týka fistúl, 63,6 % (14/22) osôb v 10. týždni; 59,1 % (13/22) osôb v 30. týždni
a 68,2 % (15/22) osôb v 54. týždni.
Okrem toho sa pri porovnaní so stavom na začiatku pozorovalo štatisticky a klinicky významné zlepšenie kvality života a výšky, a tiež výrazné zníženie používania kortikosteroidov.
Ulcerózna kolitída v pediatrickej populácii (6 až 17 rokov)
Bezpečnosť a účinnosť infliximabu sa hodnotili v multicentrickej randomizovanej nezaslepenej klinickej štúdii s paralelnými skupinami (C0168T72) u 60 pediatrických pacientov vo veku 6 až
17 rokov (medián veku 14,5 roka) so stredne ťažkou až ťažkou aktívnou ulceróznou kolitídou (skóre 6 až 12 podľa Maya, subskóre podľa endoskopického vyšetrenia ≥ 2), u ktorých nedošlo k adekvátnej odpovedi na konvenčnú liečbu. Na začiatku dostávalo 53 % pacientov
imunomodulačnú liečbu (6-MP, AZA a/alebo MTX) a 62 % pacientov dostávalo kortikosteroidy.
Ukončenie podávania imunomodulátorov a zníženie dávky kortikosteroidov bolo povolené po
0. týždni.
Všetci pacienti dostali indukčný režim 5 mg/kg infliximabu v 0., 2. a 6. týždni. Pacienti, korí neodpovedali na infliximab v 8. týždni (n = 15), nedostali ďalšie lieky a vrátili sa späť do následného sledovania bezpečnosti. V 8. týždni bolo randomizovaných 45 pacientov a v rámci udržiavacej liečby dostávali 5 mg/kg každých 8 týždňov alebo každých 12 týždňov.
Podiel pacientov s klinickou odpoveďou v 8. týždni bol 73,3 % (44/60). Klinická odpoveď
v 8. týždni bola podobná u tých, ktorí dostali na začiatku súbežnú liečbu imunomodulátormi
a u pacientov bez imunomodulačnej liečby. Klinická remisia bola podľa skóre indexu aktivity
ulceróznej kolitídy v pediatrickej populácii (Paediatric Ulcerative Colitis Activity Index, PUCAI)
v 8. týždni 33,3 % (17/51).
V 54. týždni bol podiel osôb v klinickej remisii, hodnotenej podľa skóre PUCAI, 38 % (8/21)
v skupine s udržiavacou liečbou každých 8 týždňov a 18 % (4/22) v skupine s udržiavacou liečbou
každých 12 týždňov. U pacientov dostávajúcich kortikosteroidy na začiatku liečby bol v 54. týždni podiel pacientov v remisii a bez kortikosteroidov 38 % (5/13) v skupine s udržiavacou liečbou každých 8 týždňov a 0 % (0/13) v skupine s udržiavacou liečbou každých 12 týždňov.
V tejto štúdii bolo viac pacientov vo vekovej skupine 12 až 17 rokov (45/60) ako vo vekovej skupine 6 až 11 rokov (15/60). Aj keď je počet pacientov v každej podskupine veľmi malý na vyvodenie definitívnych záverov o vplyve veku, v mladšej vekovej skupine bolo viac pacientov so zvýšením dávky alebo s prerušením liečby z dôvodu nedostatočnej účinnosti.
Iné indikácie v pediatrickej populácii
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným
liekom obsahujúcim infliximab vo všetkých podskupinách pediatrickej populácie v liečbe
reumatoidnej artritídy, juvenilnej idiopatickej artritídy, psoriatickej artritídy, ankylozujúcej spondylitídy, psoriázy a Crohnovej choroby (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Jednorazové intravenózne infúzie infliximabu v dávkach 1, 3, 5, 10 alebo 20 mg/kg viedli
k dávkovo úmerným zvýšeniam maximálnej sérovej koncentrácie (Cmax) a plochy pod časovou krivkou koncentrácie (AUC). Distribučný objem v rovnovážnom stave (medián Vd 3,0 až 4,1 litrov) bol nezávislý od podanej dávky, čo ukazuje, že infliximab sa distribuuje prevažne v cievnom kompartmente. Nebola pozorovaná časová závislosť farmakokinetiky. Cesty eliminácie infliximabu neboli charakterizované. V moči nebol detegovaný nezmenený infliximab. Nepozorovali sa veľké rozdiely hodnôt klírensu alebo distribučného objemu súvisiace s vekom alebo hmotnosťou
pacientov s reumatoidnou artritídou. Farmakokinetika infliximabu sa neskúmala u starších pacientov. Nerobili sa štúdie s pacientmi s ochorením pečene alebo obličiek.
Pri jednorazových dávkach 3, 5 alebo 10 mg/kg boli mediány hodnôt Cmax 77, 118 a 277 mikrogramov/ml. Medián terminálneho polčasu bol pri týchto dávkach v rozsahu 8 až 9,5 dní. Po odporúčanej jednorazovej dávke 5 mg/kg pri Crohnovej chorobe a pri udržiavacej dávke 3 mg/kg každých 8 týždňov pri reumatoidnej artritíde mohol byť u väčšiny pacientov infliximab detegovaný v sére najmenej po dobu 8 týždňov.
Opakované podávanie infliximabu (5 mg/kg v 0., 2. a 6. týždni pacientom s fistulizujúcou Crohnovou chorobou, 3 alebo 10 mg/kg každé 4 alebo každých 8 týždňov pacientom s reumatoidnou artritídou) viedlo k ľahkej akumulácii infliximabu v sére po druhej dávke.
Nepozorovala sa žiadna ďalšia klinicky významná akumulácia. U väčšiny pacientov s fistulizujúcou
Crohnovou chorobou bol infliximab detegovaný v sére 12 týždňov (rozsah 4 – 28 týždňov) po
podaní režimu.
Pediatrická populácia
Farmakokinetická analýza populácie na základe údajov získaných od pacientov s ulceróznou kolitídou (N = 60), Crohnovou chorobou (N = 112), juvenilnou reumatoidnou artritídou (N = 117)
a Kawasakiho chorobou (N = 16) s celkovým vekovým rozmedzím od 2 mesiacov do 17 rokov
naznačila, že expozícia infliximabu bola nelineárne závislá od telesnej hmotnosti. Po podaní
5 mg/kg infliximabu každých 8 týždňov bol predpokladaný medián expozície infliximabu
v rovnovážnom stave (plocha pod časovou krivkou koncentrácie v rovnovážnom stave, AUCss)
u pediatrických pacientov vo veku 6 rokov až 17 rokov približne o 20 % nižší ako predpokladaný medián v rovnovážnom stave u dospelých. U pediatrických pacientov vo veku 2 roky až do menej
ako 6 rokov bol predpokladaný medián AUCss o približne 40 % nižší ako u dospelých, hoci počet
pacientov podporujúcich tento odhad je limitovaný.
5.3 Predklinické údaje o bezpečnosti
Infliximab nereaguje skrížene s TNFα iných živočíšnych druhov okrem ľudí a šimpanzov. Preto sú bežné predklinické údaje o bezpečnosti infliximabu obmedzené. Štúdia vývojovej toxicity vykonaná na myšiach za použitia analogickej protilátky, ktorá selektívne inhibuje funkčnú aktivitu myšieho TNFα, nepreukázala toxicitu pre matku, embryotoxicitu ani teratogenitu. V štúdii fertility a všeobecnej reprodukčnej funkcie bol počet gravidných myší po podaní tej istej analogickej protilátky znížený. Nevie sa, či to bolo spôsobené účinkom na samce a/alebo na samice.
V 6-mesačnej štúdii toxicity po opakovanom podaní na myšiach s použitím rovnakej analogickej protilátky proti myšiemu TNFα sa u niektorých liečených samcov pozorovali kryštalické usadeniny na puzdre šošovky. U pacientov neboli robené žiadne špecifické oftalmologické vyšetrenia, aby sa skúmala relevantnosť tohto nálezu pre ľudí.
Nevykonali sa dlhodobé štúdie, za účelom vyhodnotenia karcinogénneho potenciálu infliximabu.
Štúdie na myšiach s deficienciou TNFα nepreukázali zvýšenie tumorov, keď boli takéto myši
vystavené známym iniciátorom a/alebo promótorom tumorov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sacharóza polysorbát 80
monohydrát hydrogenfosforečnanu sodného heptahydrát dihydrogenfosforečnanu sodného
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
36 mesiacov.
Bola preukázaná chemická a fyzikálna stabilita počas používania rekonštituovaného roztoku 24 hodín pri 25 °C. Z mikrobiologického hľadiska sa má liek použiť čo najskôr, ale počas 3 hodín po rekonštitúcii a zriedení. Ak sa nepoužije okamžite, doba a podmienky uchovávania počas používania a pred vlastným použitím sú zodpovednosťou používateľa a táto doba nemá byť dlhšia ako 24 hodín pri 2 °C až 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Sklenená injekčná liekovka typu 1 s gumovou zátkou a hliníkovým uzáverom, chránená plastovým
viečkom, obsahujúca 100 mg infliximabu.
Flixabi je dostupný v baleniach obsahujúcich 1 injekčnú liekovku a v multibaleniach po 2, 3, 4 a 5 injekčných liekovkách (2, 3, 4, a 5 balíčkov po 1). Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
1. Vypočítajte dávku a potrebný počet injekčných liekoviek Flixabi. Každá injekčná liekovka Flixabi obsahuje 100 mg infliximabu. Vypočítajte celkový potrebný objem rekonštituovaného roztoku Flixabi.
2. Za aseptických podmienok rekonštituujte obsah každej injekčnej liekovky Flixabi s 10 ml vody na injekciu za použitia striekačky s ihlou kalibru 21 (0,8 mm) alebo menšou. Odstráňte vyklápací kryt z injekčnej liekovky a jej vrch utrite tampónom namočeným v 70 % alkohole. Vpichnite injekčnú ihlu do injekčnej liekovky cez stred gumenej zátky a prúd vody na injekciu
nasmerujte na sklenenú stenu injekčnej liekovky. Otáčaním injekčnej liekovky jemne rozvírte roztok, aby sa lyofilizovaný prášok rozpustil. Vyhnite sa dlhodobému alebo veľmi silnému miešaniu. Injekčnou liekovkou NETRASTE. Spenenie roztoku pri rekonštitúcii nie je nezvyčajné. Rekonštituovaný roztok nechajte 5 minút stáť. Skontrolujte, či je roztok bezfarebný až bledožltý a opaleskujúci. Pretože infliximab je bielkovina, môže sa v roztoku vytvoriť niekoľko málo jemných priesvitných častíc. Roztok nepoužite, ak sú v ňom nepriesvitné častice, má zmenenú farbu alebo sú v ňom iné cudzie častice.
3. Zrieďte celý objem dávky rekonštituovaného roztoku Flixabi 9 mg/ml (0,9 %) infúznym roztokom chloridu sodného na 250 ml. Rekonštituovaný roztok Flixabi nerieďte žiadnym iným riediacim roztokom. Toto sa môže uskutočniť tak, že z 250 ml sklenenej fľaše alebo infúzneho vaku 9 mg/ml (0,9 %) infúzneho roztoku chloridu sodného odoberiete rovnaký objem, ako je objem rekonštituovaného roztoku Flixabi. Potom pomaly pridajte celý objem rekonštituovaného roztoku Flixabi do 250 ml infúznej fľaše alebo vaku. Jemne premiešajte.
4. Infúzny roztok nepodávajte kratšie, než je odporúčaná doba infúzie (pozri časť 4.2). Použite len infúznu súpravu vybavenú prietokovým, sterilným, nepyrogénnym, bielkoviny málo viažucim filtrom (veľkosť pórov 1,2 mikrometrov alebo menej). Keďže infúzny roztok neobsahuje konzervačné látky, odporúča sa začať ho podávať čo najskôr a počas 3 hodín po rekonštitúcii a zriedení. Ak sa rekonštitúcia a riedenie vykonalo za aseptických podmienok, môže sa infúzny roztok Flixabi použiť počas 24 hodín, ak sa uchováva pri 2 °C – 8 °C. Akúkoľvek nepoužitú časť infúzneho roztoku neuchovávajte na ďalšie použitie.
5. Skúšky fyzikálnej a biochemickej kompatibility na vyhodnotenie súčasného podávania Flixabi
s inými látkami sa nevykonali. Neinfundujte Flixabi jednou intravenóznou linkou spolu s inými látkami.
6. Flixabi pred podaním vizuálne skontrolujte, či neobsahuje pevné čiastočky alebo či jeho farba nie je zmenená. Roztok nepoužite, ak ste si všimli nepriehľadné častice, zmenu farby alebo cudzie častice.
7. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Samsung Bioepis UK Limited
3000 Hillswood Drive
Chertsey
Surrey KT16 0RS
Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/16/1106/001
EU/1/16/1106/002
EU/1/16/1106/003
EU/1/16/1106/004
EU/1/16/1106/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:26/05/2016
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.