
ečerou v predchádzajúcom dni
• Dávka pred večerou sa má upraviť podľa hodnoty SMPG pred spaním v predchádzajúcom dni
T
a
b
u
ľ
k
a 1 Úprava dávky
SM
PG (pozri vyššie)
|
Ú
p
r
av
a dávky
|
mmol/l
|
mg/dl
|
Jednotka
|
< 4,0
|
< 71
|
-1
|
4,0 – 6,0
|
71 – 108
|
Žiadna úprava
|
> 6,0
|
> 108
|
+1
|
O
sobitné populácie
S
t
a
rší
p
a
c
i
e
n
t
i
(
≥
65
r
o
k
o
v
)
Bezpečnosť a účinnosť lieku Fiasp boli stanovené u starších pacientov vo veku 65 až 75 rokov. U starších pacientov sa odporúča dôsledné monitorovanie glukózy a dávka inzulínu sa má nastaviť na individuálnom základe (pozri časti 5.1 a 5.2). Terapeutické skúsenosti s pacientmi vo veku ≥ 75 rokov sú obmedzené.
PoruchafunkcieobličiekapečenePorucha funkcie obličiek alebo pečene môže u pacienta znižovať potrebu inzulínu. U pacientov s
poruchou funkcie obličiek alebo pečene sa musí dôsledne monitorovať glukóza a dávka inzulínu sa má nastaviť na individuálnom základe (pozri časť 5.2).
PediatrickápopuláciaFiasp môžu používať dospievajúci a deti vo veku od 1 roka (pozri časť 5.1). Nie sú žiadne klinické skúsenosti s použitím lieku Fiasp u detí mladších ako 2 roky.
Fiasp sa odporúča podávať pred jedlom (0-2 minúty) s flexibilitou podania 20 minút po začiatku jedla
v situáciach, keď existuje neistota ohľadom príjmu jedla.
Prechod z iných inzulínových liekovPočas prechodu z iných inzulínov podávaných v čase jedla a v prvých týždňoch po ňom sa odporúča dôsledné monitorovanie glukózy. Prechod z iného inzulínu podávaného v čase jedla môže byť urobený na báze jednotka-k-jednotke. Prechod pacienta z iného typu, značky alebo výrobcu inzulínu na Fiasp
sa musí uskutočniť pod prísnou kontrolou lekára a môže vyžadovať zmenu dávkovania.
Možno bude potrebné upraviť dávky a čas podávania súbežne používaných strednodobo pôsobiacich alebo dlhodobo pôsobiacich inzulínov alebo inej súbežnej liečby antidiabetikami.
Spôsob podávaniaSubkutánne použitieFiasp sa podáva subkutánne injekciou do brušnej steny alebo do nadlaktia (pozri časť 5.2). Miesta
podania injekcie sa majú v tej istej oblasti vždy striedať, aby sa znížilo riziko lipodystrofie a kožnej amyloidózy (pozri časti 4.4 a 4.8).
Fiasp100jednotiek/ml FlexTouchinjekčnýroztokvnaplnenomperePodávanie naplneným perom (FlexTouch)Naplnené pero (FlexTouch) je určené na použitie s ihlami NovoFine Plus, NovoFine alebo
NovoTwist. Toto naplnené pero dávkuje 1–80 jednotiek s možnosťou pridávania po 1 jednotke.
Pero FlexTouch je farebne označené a dodáva sa s písomnou informáciou pre používateľa, kde je podrobný návod na použitie, ktorý je potrebné dodržať.
Toto naplnené pero je vhodné len na subkutánne injekcie. Ak je nevyhnutné podanie pomocou injekčnej striekačky alebo intravenóznou injekciou, má sa použiť injekčná liekovka. Ak je nevyhnutné podanie infúznou pumpou, má sa použiť injekčná liekovka alebo náplň PumpCart.
Fiasp100jednotiek/ml PenFill injekčnýroztokvnáplniPodávanie opakovane použiteľným inzulínovým peromNáplň (Penfill) je určená na používanie s opakovane použiteľnými inzulínovými perami spoločnosti Novo Nordisk a ihlami NovoFine Plus, NovoFine alebo NovoTwist, je vhodná len na subkutánne injekcie z opakovane použiteľného pera.
Ak je nevyhnutné podanie pomocou injekčnej striekačky alebo intravenóznou injekciou, má sa použiť injekčná liekovka. Ak je nevyhnutné podanie infúznou pumpou, má sa použiť injekčná liekovka alebo náplň PumpCart.
Fiasp100jednotiek/ml injekčnýroztokvinjekčnejliekovke
Podávanie injekčnou striekačkou
Injekčná liekovka sa má používať s inzulínovými injekčnými striekačkami so zodpovedajúcou stupnicou jednotiek (U-100 alebo 100 U/ml).
Kontinuálna subkutánna inzulínová infúzia (CSII)
Fiasp sa môže používať na kontinuálnu podkožnú inzulínovú infúziu (CSII) v inzulínových pumpách vhodných na inzulínovú infúziu a pokryje požiadavku na bolusový inzulín (približne 50 %) aj bazálny inzulín. Môže sa podávať podľa pokynov výrobcu pumpy, najlepšie do brucha. Miesta infúzie sa majú striedať v rámci rovnakej oblasti, aby sa znížilo riziko lipodystrofie. Pri podávaní pumpou na inzulínovú infúziu sa nesmie riediť ani miešať so žiadnymi inými inzulínmi.
Pacienti používajúci CSII majú byť poučení o používaní pumpy a používať správny zásobník a hadičky k pumpe (pozri časť 6.6). Infúzna súprava (hadičky a kanyla) sa má meniť v súlade s pokynmi v informácii o produkte dodanými s infúznou súpravou.
Pacienti, ktorí si podávajú Fiasp ako CSII, musia byť zaškolení ohľadom podávania inzulínu injekčne a musia mať vždy k dispozícii alternatívnu inzulínovú liečbu pre prípad zlyhania pumpy.
Intravenózne použitie
Ak je to potrebné, môžu liek Fiasp podávať intravenózne zdravotnícki pracovníci.
Pri intravenóznom používaní sa má liek používať v infúznom systéme v koncentráciách
0,5 jednotky/ml až 1,0 jednotka/ml inzulínu aspartátu s použitím polypropylénových infúznych vakov. Fiasp je v infúznych roztokoch, ako roztok chloridu sodného 9 mg/ml (0,9 %) alebo 5 % roztok glukózy, stabilný pri izbovej teplote po dobu 24 hodín.
Počas inzulínovej infúzie je potrebné monitorovanie glukózy v krvi. Je potrebné dbať na to, aby sa zaistilo, že sa inzulín injektuje do infúzneho vaku a nie jednoducho do portu.
Fiasp100jednotiek/mlPumpCartinjekčnýroztokvnáplni
Podávanie pomocou kontinuálnej subkutánnej inzulínovej infúzie (CSII)
Náplň (PumpCart) je určená na používanie len s inzulínovými infúznymi pumpami, ako sú inzulínové pumpy Accu-Chek Insight a YpsoPump, ktoré sú určené na používanie s touto náplňou.
Fiasp pokryje požiadavku na bolusový inzulín (približne 50 %) ako aj požiadavku na bazálny inzulín. Môže sa podávať v súlade s pokynmi, ktoré poskytuje výrobca pumpy, prednostne do brucha. Miesta infúzie sa majú obmieňať v rámci rovnakej oblasti, aby sa znížilo riziko lipodystrofie.
Pacienti, ktorí používajú CSII majú byť poučení ako používať pumpu a majú používať správnu hadičku k pumpe (pozri časť 6.6). Infúzna súprava (hadička a kanyla) sa majú vymieňať podľa pokynov, ktoré sú v návode dodávanom s infúznou súpravou.
Pacienti, ktorí si podávajú Fiasp pomocou CSII musia byť vyškolení na podávanie inzulínu injekciou a musia mať dostupnú alternatívnu inzulínovú liečbu pre prípad zlyhania pumpy.
Náplň (PumpCart) je vhodná len na CSII v pumpách vhodných na infúziu inzulínu. Ak je nevyhnutné podanie pomocou injekčnej striekačky alebo intravenóznou injekciou, má sa použiť injekčná liekovka.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
F
i
a
s
p
1
0
0
j
e
dn
o
t
i
e
k
/
m
l PumpCart
i
n
j
e
k
č
ný
r
o
z
t
o
k
v
náplni
Ne
s
p
r
á
v
n
e používanie PumpCart
Náplň (PumpCart) je určená na používanie len s inzulínovými infúznymi pumpami, ako sú inzulínové pumpy Accu-Chek Insight a YpsoPump, ktoré sú určené na používanie s touto náplňou. Nesmie sa používať s inými pomôckami, ktoré nie sú určené na túto náplň, pretože to môže mať za následok nesprávne dávkovanie inzulínu a následnú hyperglykémiu alebo hypoglykémiu.
Hypoglykémia
Vynechanie jedla alebo neplánovaná namáhavá fyzická aktivita môžu viesť k hypoglykémii.
Hypoglykémia môže nastať vtedy, keď je dávka inzulínu príliš vysoká v porovnaní s potrebou inzulínu
(pozri časti 4.8 a 4.9).
Pacienti, u ktorých nastalo významné zlepšenie kontroly glykémie (napr. po intenzifikovanej inzulínovej liečbe), môžu pocítiť zmenu obvyklých varovných príznakov hypoglykémie a majú byť
o nich primerane poučení. Obvyklé varovné príznaky môžu u pacientov dlhodobo chorých na diabetes vymiznúť.
Načasovanie hypoglykémie väčšinou odzrkadľuje časový profil účinku podľa typu podávaného inzulínu. Hypoglykémia sa po injekcii/infúzii môže v porovnaní s inými inzulínmi podávanými v čase jedla objaviť skôr, z dôvodu skoršieho nástupu účinku lieku Fiasp (pozri časť 5.1).
Keďže sa Fiasp má podať bezprostredne pred začiatkom jedla ( najskôr 2 minúty pred začiatkom jedla) s možnosťou podania až do 20 minút od začiatku jedla, pri predpisovaní pacientom so súbežným ochorením alebo liečbou, kde sa dá očakávať oneskorené vstrebávanie jedla, sa musí vziať do úvahy čas do nástupu účinku.
Pediatrická populácia
Odporúča sa starostlivé sledovanie hladín glukózy v krvi, ak sa tento liek podáva po začiatku posledného jedla dňa, aby sa predišlo nočnej hypoglykémií.
Hyperglykémia
Neprimerané dávky alebo prerušenie liečby môžu viesť, najmä u pacientov, ktorí potrebujú inzulín,
k hyperglykémii a diabetickej ketoacidóze – stavom, ktoré sú potenciálne smrteľné.
Kontinuálna subkutánna inzulínová infúzia (CSII)
Poruchy pumpy alebo infúznej súpravy môžu viesť k rýchlemu nástupu hyperglykémie a ketózy. Je potrebné rýchlo identifikovať a korigovať príčinu hyperglykémie alebo ketózy. Môže byť potrebná preventívna liečba subkutánnou injekciou.
Poruchy kože a podkožného tkaniva
Pacienti musia byť poučení o tom, aby miesto podania injekcie neustále menili, čím sa zníži riziko
vzniku lipodystrofie a kožnej amyloidózy. Na miestach s týmito reakciami existuje potenciálne riziko oneskorenej absorpcie inzulínu a zhoršenej kontroly glykémie po podaní inzulínových injekcií.
V prípade náhlej zmeny miesta podania injekcie na nepostihnutú oblasť bol hlásený vznik hypoglykémie. Po zmene miesta podania injekcie z postihnutej oblasti na nepostihnutú oblasť sa odporúča monitorovanie hladiny glukózy v krvi a je možné zvážiť úpravu dávky antidiabetík.
Prechod z iných inzulínov
Prechod pacientov na iný typ alebo na inú značku inzulínu sa musí uskutočniť len za prísnej lekárskej
kontroly. Zmeny v sile, značke (výrobca), type, pôvode (zvierací, ľudský inzulín alebo analóg ľudského inzulínu) a/alebo v spôsobe jeho výroby (rekombinantná DNA oproti inzulínu zvieracieho
pôvodu) môžu mať za následok potrebu zmeny dávky. Pacienti prechádzajúci na Fiasp z iného typu inzulínu môžu vyžadovať úpravu dávky oproti dávke inzulínov, ktoré zvyčajne používali.
Súbežné ochorenie
Súbežné ochorenie, najmä infekcie a horúčkové stavy, obvykle zvyšujú potrebu inzulínu u pacienta.
Súbežné ochorenia obličiek, pečene alebo ochorenia ovplyvňujúce nadobličky, hypofýzu alebo štítnu žľazu môžu vyžadovať zmeny dávky inzulínu.
Kombinácia tiazolidíndiónov a inzulínov
Boli zaznamenané prípady kongestívneho zlyhávania srdca, keď sa užívali tiazolidíndióny
v kombinácii s inzulínom, zvlášť u pacientov s rizikovými faktormi pre rozvoj kongestívneho zlyhávania srdca. Na toto sa má pamätať, ak sa uvažuje o liečbe s kombináciou tiazolidíndiónov a inzulínov. Ak sa používa táto kombinácia, majú sa u pacientov sledovať prejavy a symptómy
kongestívneho zlyhávania srdca, zvýšenie telesnej hmotnosti a edémy. Užívanie tiazolidíndiónov má byť ukončené, ak sa objaví akékoľvek zhoršenie kardiálnych symptómov.
Začiatok podávania inzulínu a intenzifikácia kontroly glukózy
Intenzifikácia alebo rýchle zlepšenie kontroly glukózy boli spojené s prechodnou reverzibilnou
oftalmologickou refrakčnou poruchou, zhoršením diabetickej retinopatie, akútnou bolestivou periférnou neuropatiou a periférnym edémom. Avšak dlhodobá kontrola glykémie znižuje riziko
diabetickej retinopatie a neuropatie.
Protilátky proti inzulínu
Podávanie inzulínu môže spôsobiť tvorbu protilátok proti inzulínu. V zriedkavých prípadoch si
prítomnosť protilátok proti inzulínu môže vynútiť úpravu dávky inzulínu, aby sa korigovala tendencia
k hyperglykémii alebo hypoglykémii.
Zamedzenie náhodným zámenám/medikačným chybám
Pacient musí byť upozornený, aby vždy pred každým injekčným podaním skontroloval obal inzulínu, aby sa zamedzilo náhodnej zámene tohto lieku za iné inzulíny.
Pacienti si pred podávaním musia vizuálne skontrolovať jednotky dávky. Predpokladom toho, aby si pacienti mohli sami podávať dávku, je schopnosť prečítať údaje na stupnici dávky. Nevidiacich alebo slabozrakých pacientov je nutné informovať, že vždy musia požiadať o asistenciu inú osobu s dobrým zrakom, ktorá je vyškolená v podávaní inzulínu.
Cestovanie medzi časovými pásmami
Pred cestovaním medzi rôznymi časovými pásmami má pacient požiadaťo radu lekára.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na dávku, t.j. v podstate zanedbateľné
množstvo sodíka.
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
4.5 Liekové a iné interakcie
O viacerých liekoch je známe, že ovplyvňujú metabolizmus glukózy.
Látky, ktoré môžu znižovať potrebu inzulínu:
Perorálne antidiabetiká, inhibítory monoaminooxidázy (IMAO), betablokátory, inhibítory enzýmu konvertujúceho angiotenzín (ACE), salicyláty, anabolické steroidy, sulfónamidy a agonista receptora GLP-1.
Látky, ktoré môžu zvyšovať potrebu inzulínu:
Perorálne kontraceptíva, tiazidy, glukokortikoidy, tyroidálne hormóny, sympatomimetiká, rastový
hormón a danazol.
Betablokátory môžu maskovať príznaky hypoglykémie. Oktreotid/lanreotid môžu znižovať alebo zvyšovať potrebu inzulínu.
Alkohol môže zosilňovať alebo redukovať hypoglykemický účinok inzulínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Fiasp sa môže používať počas gravidity.
Údaje z dvoch randomizovaných kontrolovaných klinických štúdií s inzulínom aspartátom (322 + 27 gravidných žien) nepreukázali žiadne nežiaduce účinky inzulínu aspartátu na graviditu alebo na zdravie plodu/novorodenca v porovnaní s rozpustným ľudským inzulínom.
Intenzifikovaná kontrola glykémie a monitorovanie gravidných žien s diabetes mellitus (1. typ, 2. typ alebo gestačný diabetes) sa odporúča počas gravidity a pri plánovaní gravidity. Potreba inzulínu
v prvom trimestri obvykle poklesne a následne sa zvýši počas druhého a tretieho trimestra. Po pôrode sa potreba inzulínu rýchlo vracia na hodnoty pred graviditou.
Dojčenie
Nie sú žiadne obmedzenia na liečbu liekom Fiasp počas dojčenia. Liečba dojčiacich matiek inzulínom
nepreukazuje žiadne riziko pre dojča. Avšak môže byť potrebné dávku lieku upraviť.
Fertilita
Reprodukčné štúdie na zvieratách nepreukázali žiadne rozdiely medzi inzulínom aspartátom a
ľudským inzulínom, čo sa týka fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Schopnosť koncentrácie, ako aj reakčná schopnosť pacientov, môže byť znížená v dôsledku hypoglykémie. Táto skutočnosť vytvára riziko v situáciách, ktoré si vyžadujú mimoriadnu pozornosť (napr. pri vedení vozidiel alebo pri obsluhe strojov).
Pacienti musia byť poučení o opatreniach, ako zabrániť vzniku hypoglykémie pri vedení vozidiel. Zvlášť dôležité je to u pacientov, ktorí si nedostatočne uvedomujú, alebo si neuvedomujú varovné prejavy hypoglykémie, alebo ktorí mávajú časté hypoglykémie. V takýchto prípadoch sa má zvážiť vhodnosť vedenia vozidla.
4.8 Nežiaduce účinky
Prehľadbezpečnostnéhoprofilu
Najčastejšou nežiaducou reakciou hlásenou počas liečby je hypoglykémia (pozri časť „Opis vybraných nežiaducich reakcií“ nižšie).
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie uvedené nižšie (Tabuľka 2) na základe údajov z klinických skúšaní
zo 6 dokončených terapeutických potvrdzovacích klinických skúšaní u dospelých. Kategórie frekvencií sú definované podľa nasledujúcich konvencií: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé
(< 1/10 000) a neznáme (nemôžu byť stanovené z dostupných údajov).
Tabuľka 2 Nežiaduce reakcie z klinických skúšaníMedDRA trieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
| Neznáme
|
Poruchy imunitného systému
|
|
| Precitlivenosť
| Anafylaktické
reakcie
|
Poruchy metabolizmu a výživy
| Hypoglykémia
|
|
|
|
Poruchy kože a podkožného
tkaniva
|
| Alergické kožné
prejavy
| Lipodystrofia
| Kožná
amyloidóza†
|
Celkové poruchy a reakcie
v mieste podávania
|
| Reakcie
v mieste
podávania
injekcie/infúzie
|
|
|
† nežiaduce reakcie z postmarketingových zdrojov
Opis vybraných nežiaducich reakciíAlergické reakcieAlergické kožné prejavy hlásené u lieku Fiasp (1,8 % oproti 1,5 % u komparátora) zahŕňajú ekzém, vyrážku, svrbiacu vyrážku, žihľavku a dermatitídu.
U lieku Fiasp boli generalizované hypersenzitívne reakcie (prejavujúce sa generalizovanou kožnou vyrážkou a edémom tváre) hlásené menej často (0,2 % oproti 0,3 % u komparátora).
HypoglykémiaHypoglykémia môže nastať vtedy, keď je dávka inzulínu príliš vysoká v porovnaní s potrebou inzulínu. Závažná hypoglykémia môže viesť k bezvedomiu a/alebo kŕčom a môže spôsobiť prechodné alebo trvalé poškodenie funkcií mozgu alebo až smrť. Príznaky hypoglykémie sa zvyčajne objavujú
náhle. Môže medzi ne patriť studený pot, studená a bledá pokožka, vyčerpanosť, nervozita alebo triaška, úzkosť, nezvyčajná únava alebo slabosť, zmätenosť, problémy s koncentráciou, ospalosť, nadmerný hlad, zmeny videnia, bolesť hlavy, nauzea a búšenie srdca (pozri časti 4.4 a 5.1). Hypoglykémia sa môže objaviť skôr po podaní injekcie/infúzie lieku Fiasp v porovnaní s inými inzulínmi podávanými v čase jedla, vzhľadom na skorší nástup účinku.
Poruchy kože a podkožného tkanivaLipodystrofia (vrátane lipohypertrofie, lipoatrofie) a kožná amyloidóza sa môže vyskytnúť v mieste podávania injekcie, čím sa môže oneskoriť lokálna absorpcia inzulínu.V mieste podávania injekcie/infúzie bola u pacientov liečených liekom Fiasp (0,5 % oproti 0,2 % u komparátora) hlásená lipodystrofia. Pravidelné striedanie miesta podania injekcie v danej oblasti môže pomôcť pri zmiernení týchto reakcií alebo môže týmto reakciám zabrániť (pozri časť 4.4).
Reakcie v mieste podávania injekcie/infúzieReakcie v mieste podávania (zahŕňajúce vyrážku, začervenanie, zápal, bolesť a tvorbu modrín). boli
hlásené u pacientov liečených liekom Fiasp (1,3 % oproti 1,0 % u komparátora). Pacienti používajúci CSII (kontinuálna subkutánna infúzia inzulínu) (N=261): Reakcie v mieste podávania infúzie (zahŕňajúce začervenanie, zápal, podráždenie, bolesť, tvorbu modrín a svrbenie) boli hlásené
u pacientov liečených liekom Fiasp (10,0 % vs. 8,3 % u komparátora). Tieto reakcie sú zvyčajne mierne a prechodné a zvyčajne počas ďalšej liečby vymiznú.
Pediatrická populácia
Bezpečnosť a účinnosť bola skúmaná v indikáciu potvrdzujúcom skúšaní u detí s diabetom 1. typu vo veku od 2 rokov až do menej ako 18 rokov. V skúšaní sa liečilo liekom Fiasp 519 pacientov. Celkovo frekvencia, typ a závažnosť nežiaducich reakcií v pediatrickej populácii nepreukázali rozdiely
v skúsenosti s dospelou populáciou. Lipodystrofia (vrátane lipohypertrofie, lipoatrofie) v mieste podania injekcie bola hlásená častejšie v tejto štúdií u pediatrických pacientov v porovnaní so štúdiami u dospelých (pozri vyššie). V pediatrickej populácii bola lipodystrofia hlásená s frekvenciou 2,1 % pre Fiasp a oproti 1,6 % pre NovoRapid.
Ďalšie osobitné skupiny pacientovPodľa výsledkov klinických skúšaní inzulínu aspartátu vo všeobecnosti, frekvencia, typ a závažnosť
nežiaducich reakcií pozorovaných u starších pacientov a pacientov s poruchou funkcie obličiek alebo pečene nevykazujú žiadne rozdiely v porovnaní so skúsenosťami v bežnej populácii. Bezpečnostný profil u veľmi starých pacientov (≥ 75 rokov) alebo pacientov so strednou až závažnou poruchou funkcie obličiek alebo pečene je obmedzený. Fiasp sa podával starším pacientom s cieľom zhodnotenia farmakokinetických vlastností (pozri časť 5.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePredávkovanie inzulínom nie je možné presne definovať, ak však pacient dostáva viac inzulínu, ako potrebuje, môžu sa postupne rozvinúť nasledujúce štádiá hypoglykémie:
• V prípade miernej hypoglykémie je možné podať perorálne pacientovi glukózu alebo iné produkty obsahujúce cukor. Preto sa odporúča, aby mal diabetik vždy pri sebe produkty obsahujúce cukor.
• Pri závažnej hypoglykémii, ak sa pacient nedokáže liečiť sám, môže mu podať intramuskulárne alebo subkutánne glukagón (0,5 až 1 mg), osoba oboznámená s podávaním injekcie, alebo mu môže podať zdravotnícky pracovník intravenózne glukózu. Ak pacient do 10 až 15 minút nezareagoval na glukagón, musí sa mu podať intravenózne glukóza. Po nadobudnutí vedomia sa odporúča podať pacientovi perorálne cukor, ako prevenciu proti recidíve.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Lieky používané na liečbu diabetu. Inzulíny a analógy na injekciu, rýchlo pôsobiace
ATC kód A10AB05.
Mechanizmus účinkuFiasp je typ rýchlo účinkujúceho inzulínu aspartátu.
Primárnou aktivitou lieku Fiasp je regulácia metabolizmu glukózy. Inzulíny, vrátane inzulínu aspartátu, liečiva v lieku Fiasp, vykonávajú svoju špecifickú činnosť väzbou na inzulínové receptory.
Inzulín naviazaný na receptor znižuje hladinu glukózy v krvi dôsledkom uľahčeného vychytávania glukózy v kostrovom svale a tukovom tkanive a inhibíciou výstupu glukózy z pečene. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a podporuje proteosyntézu.
Farmakodynamické účinkyFiasp je typ inzulínu aspartátu podávaný v čase jedla, u ktorého pridaný nikotínamid (vitamín B3)
vedie k rýchlejšej iniciácii absorpcie inzulínu v porovnaní s liekom NovoRapid.
Nástup účinku bol o 5 minút skorší a čas do maximálnej rýchlosti infúzie glukózy bol o 11 minút skorší u lieku Fiasp ako u lieku NovoRapid. Maximálny účinok znižujúci hladinu glukózy u lieku
Fiasp sa prejavil medzi 1 až 3 hodinami po podaní injekcie. Účinok na zníženie hladiny glukózy počas
prvých 30 minút (AUCGIR 0-30 min) bol 51 mg/kg s liekom Fiasp a 29 mg/kg s liekom NovoRapid
(Fiasp/NovoRapid pomer: 1,74 [1,47;2,10]95% CI). Celkový účinok na zníženie hladiny glukózy a maximálny (GIRmax) účinok na zníženie hladiny glukózy boli u liekov Fiasp a NovoRapid porovnateľné. Celkový a maximálny účinok lieku Fiasp na zníženie hladiny glukózy sa lineárne zvyšujú s rastúcou dávkou v rámci terapeutického rozsahu dávok.
Fiasp má skorší nástup účinku v porovnaní s liekom NovoRapid (pozri časť 5.2), čo vedie
k následnému zvýšeniu účinku znižujúceho glukózu. To to je potrebné brať do úvahy pri predpisovaní lieku Fiasp.
Trvanie účinku bolo u lieku Fiasp v porovnaní s liekom NovoRapid kratšie a trvalo 3 – 5 hodín. Variabilita medzi dňami u pacientov ohľadom účinku znižujúceho hladinu glukózy bola u lieku Fiasp
nízka u skorého (AUCGIR, 0 – 1 h, KV~26 %), celkového (AUCGIR, 0 – 12 h, KV~18 %) a maximálneho
účinku na zníženie hladiny glukózy (GIRmax, KV~19 %).
Klinická účinnosť a bezpečnosťFiasp bol skúmaný u 2 068 dospelých pacientov s diabetom 1. typu (1 143 pacientov) a 2. typu
(925 pacientov) v 3 randomizovaných skúšaniach účinnosti a bezpečnosti (18–26 týždňov liečby). Ďalej bol Fiasp skúmaný u 777 pediatrických účastníkov klinického skúšania s diabetom 1. typu
v randomizovanom skúšaní účinnosti a bezpečnosti (26 týždňov liečby). V tomto skúšaní neboli
randomizované žiadne deti do 2 rokov.
Pacienti s diabetes mellitus 1. typuÚčinnosť liečby liekom Fiasp pri dosahovaní glykemickej kontroly bola hodnotená, keď sa podával počas jedla alebo po jedle. Fiasp podaný v čase jedla bol voči lieku NovoRapid pri znižovaní HbA1c non-inferiórny a zlepšenie HbA1c bolo štatisticky signifikantné v prospech lieku Fiasp. Fiasp podávaný po jedle dosiahol podobné zníženie HbA1c ako NovoRapid dávkovaný v čase jedla (Tabuľka 3).
 Tabuľka 3 Výsledky 26-týždňovej klinickej štúdie bazál/bolusu u pacientov s diabetom 1. typu
Tabuľka 3 Výsledky 26-týždňovej klinickej štúdie bazál/bolusu u pacientov s diabetom 1. typu
F
i
asp v čase jedla
+ inzulín detemir
F
i
asp po jedle
+ inzulín detemir
N
ovoRapid v čase jedla
 + inzulín detemir
+ inzulín detemir
 N
N 381 382 380
HbA1c (%)Východisková hodnota Koniec štúdie 7,6 7,3 7,6 7,5 7,6 7,4
Upravená zmena oproti východiskovej hodnote -0,32 -0,13 -0,17
 Odhadovaný rozdiel pri liečbe -0,15 [-0,23;-0,07]
Odhadovaný rozdiel pri liečbe -0,15 [-0,23;-0,07]CE
0,04 [-0,04;0,12]D
HbA1c (mmol/mol)Východisková hodnota Koniec štúdie 59,7 56,4 59,9 58,6 59,3 57,6
Upravená zmena oproti východiskovej hodnote -3,46 -1,37 -1,84
 Odhadovaný rozdiel pri liečbe -1,62 [-2,50;-0,73]
Odhadovaný rozdiel pri liečbe -1,62 [-2,50;-0,73]CE
0,47 [-0,41;1,36]D
Zvýšenie hladiny glukózy 2 hodinypo jedle (mmol/l)AVýchodisková hodnota Koniec štúdie 6,1 5,9 6,1 6,7 6,2 6,6
Upravená zmena oproti východiskovej hodnote
|
-0,29
|
0,67
|
0,38
|
O
dhadovaný rozdiel pri liečbe
|
-
0,67 [-1,29;-0,04]CE
|
0,30 [-0,34;0,93]D
|
|
Z
výšenie hladiny glukózy 1 hodinu
|
|
|
|
p
o jedle (mmol/l)
A
|
|
|
|
Východisková hodnota Koniec štúdie
|
5,4 4,7
|
5,4 6,6
|
5,7 5,9
|
Upravená zmena oproti východiskovej hodnote
|
-0,84
|
1,27
|
0,34
|
O
dhadovaný rozdiel pri liečbe
|
-
1,18 [-1,65;-0,71]CE
|
0,93 [0,46;1,40]D
|
|
T
e
l
e
s
n
á hmotnosť (kg)
|
|
|
|
Východisková hodnota Koniec štúdie
|
78,6 79,2
|
80,5 81,2
|
80,2 80,7
|
Upravená zmena oproti východiskovej hodnote
|
0,67
|
0,70
|
0,55
|
O
dhadovaný rozdiel pri liečbe
|
0,12 [-0,30;0,55]C
|
0,16 [-0,27;0,58]D
|
|
P
ozorovaná rýchlosť závažnej alebo
|
|
|
|
B
G potvrdenej hypoglykémie
B
za
|
|
|
|
p
acientorok expozície (percento
|
|
|
|
p
acientov)
|
59,0 (92,7)
|
54,4 (95,0)
|
58,7 (97,4)
|
O
dhadovaný pomer rýchlostí
|
1,01 [0,88;1,15]C
|
0,92 [0,81;1,06]D
|
|
Východisková hodnota a hodnota na konci štúdie sú založené na priemere posledných pozorovaných dostupných hodnôt. 95 % interval spoľahlivosti je uvedený v „[]”
A Test s jedlom
B Závažná hypoglykémia (epizóda vyžadujúca asistenciu inej osoby) alebo hypoglykémia potvrdená hladinou glukózy v krvi (blood glucose, BG) definovaná ako epizódy potvrdené glykémiou < 3,1 mmol/l bez ohľadu na príznaky
C Rozdiel je pre Fiasp v čase jedla – NovoRapid v čase jedla
D Rozdiel je pre Fiasp po jedle – liek NovoRapid v čase jedla
E Štatisticky významné v prospech lieku Fiasp podaného v čase jedla
33,3 % pacientov liečených liekom Fiasp v čase jedla dosiahlo cieľovú hodnotu HbA1c < 7 %
v porovnaní s 23,3 % pacientov liečených liekom Fiasp po jedle a 28,2 % pacientov liečených liekom NovoRapid v čase jedla. Odhadovaná pravdepodobnosť dosiahnutia HbA1c < 7 % bola štatisticky signifikantne vyššia u lieku Fiasp v čase jedla v porovnaní s liekom NovoRapid v čase jedla (pomer pravdepodobnosti: 1,47 [1,02; 2,13]95% CI). Medzi liekom Fiasp podávaným po jedle a liekom NovoRapid podávaným v čase jedla nebol preukázaný žiadny štatisticky signifikantný rozdiel.
Fiasp podávaný v čase jedla poskytol signifikantne nižšiu PPG (postprandial glycaemia) po 1 hodine a po 2 hodinách v porovnaní s liekom NovoRapid podávaným v čase jedla. Fiasp podávaný po jedle dosiahol vyššiu PPG po 1 hodine a porovnateľnú PPG po 2 hodinách ako liek NovoRapid dávkovaný v čase jedla (Tabuľka 3).
Medián celkovej dávky bolusového inzulínu na konci štúdie bol podobný u lieku Fiasp podávaného
v čase jedla, lieku Fiasp podávaného po jedle a lieku NovoRapid podávaného v čase jedla (zmena od východiskovej hodnoty po hodnotu na konci štúdie: Fiasp podávaný v čase jedla:
0,33 → 0,39 jednotky/kg/deň; Fiasp podávaný po jedle: 0,35 → 0,39 jednotky/kg/deň; a NovoRapid podávaný v čase jedla: 0,36 → 0,38 jednotky/kg/deň). Zmeny mediánu celkovej dávky bazálneho inzulínu od východiskovej hodnoty po hodnotu na konci štúdie boli porovnateľné u lieku Fiasp podávaného v čase jedla (0,41 → 0,39 jednotky/kg/deň), lieku Fiasp podávaného po jedle
(0,43 → 0,42 jednotky/kg/deň) a lieku NovoRapid podávaného v čase jedla
(0,43 → 0,43 jednotky/kg/deň).
Pacienti s diabetes mellitus 2. typuZníženie HbA1c od východiskovej hodnoty po hodnotu na konci štúdie bolo non-inferiórne voči tomu, ktoré sa dosiahlo s liekom NovoRapid (Tabuľka 4).

 Tabuľka 4 Výsledky 26-týždňovej klinickej štúdie bazál/bolusu u pacientov s diabetom 2. typu
Tabuľka 4 Výsledky 26-týždňovej klinickej štúdie bazál/bolusu u pacientov s diabetom 2. typu
F
i
asp
+ inzulín glargín
N
ovoRapid
+ inzulín glargín
N 345 344
 HbA1c (%)
HbA1c (%)Východisková hodnota Koniec štúdie 8,0 6,6 7,9 6,6
Upravená zmena oproti východiskovej hodnote -1,38 -1,36
Odhadovaný rozdiel pri liečbe -0,02 [-0,15;0,10] HbA1c (mmol/mol)
HbA1c (mmol/mol)Východisková hodnota Koniec štúdie 63,5 49,0 62,7 48,6
Upravená zmena oproti východiskovej hodnote
|
-15,10
|
|
-14,86
|
O
dhadovaný rozdiel pri liečbe
|
|
-
0,24 [-1,60;1,11]
|
|
Z
výšenie hladiny glukózy 2 hodiny po
|
|
|
|
j
e
d
l
e (mmol/l)
A
|
|
|
|
Východisková hodnota Koniec štúdie
|
7,6 4,6
|
|
7,3 4,9
|
Upravená zmena oproti východiskovej hodnote
|
-3,24
|
|
-2,87
|
O
dhadovaný rozdiel pri liečbe
|
|
-
0,36 [-0,81;0,08]
|
|
Z
výšenie hladiny glukózy 1 hodinu po
|
|
|
|
j
e
d
l
e (mmol/l)A
|
|
|
|
Východisková hodnota Koniec štúdie
|
6,0 4,1
|
|
5,9 4,6
|
Upravená zmena oproti východiskovej hodnote
|
-2,14
|
|
-1,55
|
O
dhadovaný rozdiel pri liečbe
|
|
-
0,59 [-1,09;-0,09]C
|
|
T
e
l
e
s
n
á hmotnosť (kg)
|
|
|
|
Východisková hodnota Koniec štúdie
|
89,0 91,6
|
|
88,3 90,8
|
Upravená zmena oproti východiskovej hodnote
|
2,68
|
|
2,67
|
O
dhadovaný rozdiel pri liečbe
|
|
0,00 [-0,60;0,61]
|
|
P
ozorovaná rýchlosť závažnej alebo
|
|
|
|
B
G potvrdenej hypoglykémie
B
za
|
|
|
|
p
acientorok expozície (percento
|
|
|
|
p
acientov)
'
|
17,9 (76,8)
|
|
16,6 (73,3)
|
O
dhadovaný pomer rýchlostí
|
|
1,09 [0,88;1,36]
|
|
Východisková hodnota a hodnota na konci štúdie sú založené na priemere posledných pozorovaných dostupných hodnôt. 95 % interval spoľahlivosti je uvedený v „[]”
A Test s jedlom
B Závažná hypoglykémia (epizóda vyžadujúca asistenciu inej osoby) alebo hypoglykémia potvrdená hladinou glukózy v krvi (blood glucose, BG) definovaná ako epizódy potvrdené glykémiou < 3,1 mmol/l bez ohľadu na príznaky
C Štatisticky významné v prospech lieku Fiasp
Dávkovanie po jedle nebolo skúmané u pacientov s diabetom 2. typu.
74,8 % pacientov liečených liekom Fiasp dosiahlo cieľovú hodnotu HbA1c < 7 % v porovnaní so
75,9 % pacientov liečených liekom NovoRapid. V odhadovanej pravdepodobnosti dosiahnutia HbA1c
< 7 % nebol medzi liekmi Fiasp a NovoRapid žiadny štatisticky signifikantný rozdiel.
Medián celkovej dávky bolusového inzulínu na konci štúdie bol podobný u lieku Fiasp a lieku
NovoRapid (zmena od východiskovej hodnoty po hodnotu na konci štúdie: Fiasp:
0,21 → 0,49 jednotky/kg/deň a NovoRapid: 0,21 → 0,51 jednotky/kg/deň). Zmeny mediánu celkovej dávky bazálneho inzulínu od východiskovej hodnoty po hodnotu na konci štúdie boli porovnateľné
u lieku Fiasp (0,56 → 0,53 jednotky/kg/deň) a lieku NovoRapid (0,52 → 0,48 jednotky/kg/deň).
Staršie osobyV troch kontrolovaných klinických štúdiách 192 z 1 219 (16 %) pacientov liečených liekom Fiasp
s diabetom 1. typu alebo 2. typu bolo vo veku ≥ 65 rokov a 24 z 1 219 (2 %) bolo vo veku ≥ 75 rokov. Medzi staršími a mladšími pacientmi nebol v bezpečnosti alebo účinnosti pozorovaný žiadny celkový rozdiel.
Kontinuálna subkutánna inzulínová infúzia (CSII)
6-týždňová randomizovaná (2:1) dvojito-zaslepená klinická štúdia s paralelnými skupinami a aktívnou kontrolou hodnotila kompatibilitu liekov Fiasp a NovoRapid podávaných systémom CSII u dospelých pacientov s diabetom 1. typu. Ani v skupine lieku Fiasp (N = 25), ani v skupine lieku NovoRapid
(N = 12) neboli žiadne mikroskopicky potvrdené epizódy upchatia infúznej súpravy. V skupine lieku
Fiasp boli dvaja pacienti, z ktorých každý nahlásil dve reakcie v mieste podávania infúzie súvisiace s liečbou.
V 2-týždňovej skríženej štúdii preukázal Fiasp väčší vplyv na znižovanie hladiny glukózy po jedle
po štandardizovanom teste s jedlom pri 1-hodinovej a 2-hodinovej PPG odpovedi (rozdiel
v liečbe: -0,50 mmol/l [-1,07; 0,07]95 % CI resp. -0,99 mmol/l [-1,95; -0,03]95 % CI) pri porovnaní s liekom NovoRapid v zostave CSII.
Pediatrická populácia
Účinnosť a bezpečnosť lieku Fiasp boli skúmané v 1:1:1 randomizovanom klinickom skúšaní
s aktívnym komparátorom u detí a dospievajúch s diabetom 1. typu, vo veku 1 až 18 rokov, počas 26
týždňov (N=777). V tomto skúšaní účinnosti a bezpečnosti sa porovnával Fiasp, ktorý sa podával
v čase jedla (0–2 minúty pred jedlom) alebo po jedle (20 minút po začiatku jedla) a NovoRapid, ktorý sa podával v čase jedla, pričom obidva sa používali v kombinácii s inzulínom degludekom.
Pacienti v ramene Fiasp v čase jedla zahŕňali 16 detí vo veku 2–5 rokov, 100 detí vo veku 6–11 rokov a 144 dospievajúcich vo veku 12–17 rokov. Pacienti v ramene Fiasp po jedle zahŕňali 16 detí vo veku
2–5 rokov, 100 detí vo veku 6–11 rokov a 144 dospievajúcich vo veku 12–17 rokov.
Fiasp podávaný v čase jedla preukázal superioritu v glykemickej kontrole v porovnaní s NovoRapid
v čase jedla, pokiaľ ide o zmenu HbA1c (
estimated treatment difference ETD: -0,17 % [-0,30; -0,03]95% CI). Fiasp podávaný po jedle preukázal non-inferioritu v glykemickej kontrole v porovnaní
s NovoRapid v čase jedla (
estimated treatment difference ETD: 0,13 % [-0,01; 0,26]95% CI).
Fiasp podávaný v čase jedla preukázal štatisticky výrazné zlepšenie v 1-hodinovom prírastku glukózy po jedle po všetkých troch hlavných jedlách v porovnaní s NovoRapid (meranie pomocou SMPG,
self- monitoring). NovoRapid v čase jedla bol výhodnejší v porovnaní s Fiasp po jedle.
V porovnaní s liekom NovoRapid sa celkovo nepozorovalo žiadne zvýšené riziko závažnej alebo glykémiou potvrdenej hypoglykémie.
Pozorované účinky a bezpečnostné profily boli porovnateľné medzi všetkými vekovými skupinami.
5.2 Farmakokinetické vlastnostiAbsorpciaFiasp je typ inzulínu aspartátu podávaný v čase jedla, u ktorého pridaný nikotínamid (vitamín B3)
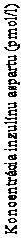
vedie k rýchlejšej počiatočnej absorpcii inzulínu. Inzulín sa v krvnom obehu objavil približne 4 minúty po podaní (Obrázok 1). Nástup objavenia bol dvakrát taký rýchly (čo je o 5 minút skôr), čas do 50 % maximálnej koncentrácie bol o 9 minút kratší u lieku Fiasp v porovnaní s liekom NovoRapid a počas prvých 15 minút bolo dostupných štyrikrát viac inzulínu, počas prvých 30 minút bolo dostupných dvakrát viac inzulínu.
Fiasp
NovoRapid
Čas (min)
Obrázok 1 Priemerný profil inzulínu u pacientov s diabetom 1. typu po subkutánnej injekcii.Celková expozícia inzulínu bola u liekov Fiasp a NovoRapid porovnateľná. Priemerná Cmax pre dávku
0,2 jednotky/kg telesnej hmotnosti je 298 pmol/l a je porovnateľná s liekom NovoRapid.
Celková expozícia a maximálna koncentrácia inzulínu sa proporcionálne zvyšujú s rastúcou subkutánnou dávkou lieku Fiasp v rámci terapeutického rozsahu dávok.
Absolútna biologická dostupnosť inzulínu aspartátu po subkutánnom podávaní lieku Fiasp do brucha, ramena a stehna bola približne 80 %.
Po podávaní lieku Fiasp je rýchly nástup objavenia zachovaný nezávisle na mieste podávania. Čas
do maximálnej koncentrácie a celková expozícia inzulínu aspartátu boli porovnateľné medzi bruchom,
ramenom a stehnom. Skorá expozícia inzulínu a maximálna koncentrácia boli porovnateľné medzi bruchom a ramenom, ale nižšie pri stehne.
Kontinuálna subkutánna inzulínová infúzia (CSII)Nástup expozície v zostave CSII (čas do maximálnej koncentrácie) bol o 26 minút kratší u lieku Fiasp
ako u lieku NovoRapid, čo viedlo k približne trojnásobnému množstvu inzulínu dostupného počas
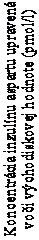
prvých 30 minút (Obrázok 2).
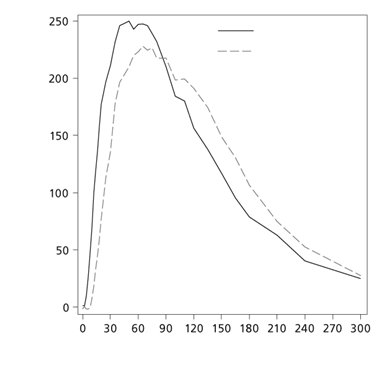
Fiasp
NovoRapid
Čas od podávania bolusovej injekcie (min)
Obrázok 2 Priemerné profily inzulínu u pacientov s diabetom 1. typu v zostave CSII (0 –5 hodín) upravené pre infúziu bazálneho inzulínuDistribúciaInzulín aspartát má podobne ako bežný ľudský inzulín nízku väzbu na plazmatické proteíny (< 10 %).
Distribučný objem (Vd) po intravenóznom podávaní bol 0,22 l/kg (t. j. 15,4 l u 70 kg účastníka), čo zodpovedá objemu extracelulárnej tekutiny v tele.
BiotransformáciaDegradácia inzulínu aspartátu je podobná degradácii ľudského inzulínu. Všetky vzniknuté metabolity
sú neaktívne.
ElimináciaPolčas premeny lieku Fiasp po subkutánnom podávaní je 57 minút a je porovnateľný s liekom
NovoRapid.
Po intravenóznom podávaní lieku Fiasp bol klírens rýchly (1,0 l/h/kg) a polčas eliminácie bol
10 minút.
Osobitné skupiny pacientov
Staršie osoby
U starších pacientov s diabetom 1. typu ukázal Fiasp skorší nástup expozície a vyššiu skorú expozíciu
inzulínu, pričom si zachoval podobnú celkovú expozíciu a maximálnu koncentráciu v porovnaní s liekom NovoRapid.
Celková expozícia inzulínu aspartátu a maximálna koncentrácia po podávaní lieku Fiasp boli o 30 %
vyššie u starších ľudí ako u mladších dospelých.
Pohlavie
Vplyv pohlavia na farmakokinetiku lieku Fiasp bol hodnotený v analýze medzi farmakokinetickými štúdiami. Fiasp ukázal porovnateľný skorší nástup expozície a vyššiu skorú expozíciu inzulínu, pričom sa zachovala podobná celková expozícia a maximálna koncentrácia v porovnaní s liekom NovoRapid
u ženských aj mužských pacientov s diabetom 1. typu.
Skorá a maximálna expozícia inzulínu lieku Fiasp boli porovnateľné u ženských aj mužských pacientov s diabetom 1. typu. Avšak celková expozícia inzulínu bola väčšia u žien v porovnaní s mužskými pacientmi s diabetom 1. typu.
Obezita
Počiatočná rýchlosť absorpcie bola pomalšia pri rastúcom BMI, pričom celková expozícia bola podobná medzi rôznymi úrovňami BMI: V porovnaní s liekom NovoRapid bol vplyv BMI
na vstrebávanie nižší u lieku Fiasp, čo viedlo k relatívne vyššej počiatočnej expozícii.
Rasa a etnická príslušnosť
Vplyv rasy a etnickej príslušnosti (černošská oproti belošskej a hispánska oproti nehispánskej)
na celkovú expozíciu inzulínu lieku Fiasp bol založený na výsledkoch populačnej farmakokinetickej analýzy u pacientov s diabetom 1. typu. U lieku Fiasp nebol zistený žiadny rozdiel v expozícii
medzi skúmanými rasovými a etnickými skupinami.
Porucha funkcie pečene
Jednodávková farmakokinetická štúdia inzulínu aspartátu bola vykonaná u lieku NovoRapid
u 24 subjektov s poruchou funkcie pečene v rozmedzí od normálnej po závažnú poruchu. U účastníkov s poruchou funkcie pečene bola rýchlosť vstrebávania znížená a variabilnejšia.
Porucha funkcie obličiek
Jednodávková farmakokinetická štúdia inzulínu aspartátu bola vykonaná u lieku NovoRapid
u 18 subjektov s funkciou obličiek v rozmedzí od normálnej po vážnu poruchu. Žiadny zjavný vplyv hodnôt klírensu kreatinínu na AUC, Cmax, CL/F a Tmax inzulínu aspartátu nebol zistený. Údaje boli
obmedzené u pacientov so strednou a závažnou poruchou funkcie obličiek. Pacienti so zlyhávaním obličiek vyžadujúci liečbu dialýzou neboli skúmaní.
Pediatrická populácia
U detí (6 – 11 rokov) a mladistvých (12 – 18 rokov) ukázal Fiasp skorší nástup expozície a vyššiu skorú expozíciu inzulínu, pričom si zachoval podobnú celkovú expozíciu a maximálnu koncentráciu v porovnaní s liekom NovoRapid.
Nástup a skorá expozícia inzulínu pri lieku Fiasp boli podobné u detí a mladistvých v porovnaní
s dospelými. Celková expozícia lieku Fiasp bola nižšia u detí a mladistvých v porovnaní s dospelými, keď bolo dávkovanie 0,2 jednotky/kg telesnej hmotnosti, pričom bola maximálna sérová koncentrácia inzulínu aspartátu podobná u všetkých vekových skupín.
5
.
3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a reprodukčnej toxicity po expozícii inzulínu aspartátu neodhalili žiadne osobitné riziko pre ľudí. V in vitro testoch zahŕňajúcich väzby na inzulínové a IGF-1 receptorové miesta a pri sledovaní vplyvu na rast buniek sa inzulín aspartát správal veľmi podobne
ako ľudský inzulín. Štúdie tiež dokázali, že disociácia väzieb medzi inzulínovými receptormi inzulínu aspartátu je rovnaká ako u ľudského inzulínu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
fenol metakrezol glycerol
octan zinočnatý
dihydrát hydrogénfosforečnanu sodného hydrochlorid arginínu
nikotínamid (vitamín B3)
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie riediť ani miešať so žiadnymi inými liekmi okrem infúznych roztokov, ako je opísané v časti 4.2.
6.3 Čas použiteľnosti
30 mesiacov.
Fiasp100jednotiek/ml FlexTouchinjekčnýroztokvnaplnenompere
Po prvom otvorení alebo keď sa nosí ako rezerva, je možné liek uchovávať maximálne 4 týždne. Uchovávajte pri teplote do 30°C. Môže sa uchovávať v chladničke (2 °C – 8 °C). Neuchovávajte
v mrazničke. Ponechajte kryt na pere na ochranu pred svetlom.
Fiasp100jednotiek/ml Penfillinjekčnýroztokvnáplni
Po prvom otvorení alebo keď sa nosí ako rezerva, je možné liek uchovávať maximálne 4 týždne. Uchovávajte pri teplote do 30°C. Neuchovávajte v chladničke. Neuchovávajte v mrazničke. Ak sa náplň nosí ako rezerva a nie je použitá, uchováva sa vo vonkajšom obale na ochranu pred svetlom.
Fiasp100jednotiek/mlinjekčnýroztokvinjekčnejliekovke
Po prvom otvorení možno liek uchovávať maximálne 4 týždne (vrátane času v zásobníku pumpy, pozri časť 6.6). Uchovávajte pri teplote do 30°C. Môže sa uchovávať v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Fiasp100jednotiek/mlPumpCartinjekčnýroztokvnáplni
Počas používania alebo keď sa nosí ako rezerva sa tento liek môže uchovávať maximálne 2 týždne pri
teplote do 30 °C. Potom je možné ho používať počas 7 dní pri teplote do 37 °C v inzulínových infúznych pumpách, ako sú inzulínové pumpy Accu-Chek Insight a YpsoPump, ktoré sú určené na používanie s touto náplňou. Neuchovávajte v chladničke. Neuchovávajte v mrazničke. Ak sa náplň nosí ako rezerva a nepoužíva sa, má sa uchovávať vo vonkajšom obale na ochranu pred svetlom
6
.
4 Špeciálne upozornenia na uchovávanie
F
i
a
s
p
1
0
0
j
e
dn
o
t
i
e
k
/
m
l FlexTouch
i
n
j
e
k
č
n
ý
r
o
z
to
k
v
naplnenom
pere
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Neuchovávajte v blízkosti mraziacej časti. Ponechajte kryt na pere na ochranu pred svetlom.
Fiasp100jednotiek/ml Penfillinjekčnýroztokvnáplni
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Neuchovávajte v blízkosti
mraziacej časti. Náplň uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Fiasp100jednotiek/mlinjekčnýroztokvinjekčnejliekovke
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Neuchovávajte v blízkosti mraziacej časti. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Fiasp100jednotiek/mlPumpCartinjekčnýroztokvnáplni
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Neuchovávajte v blízkosti mraziacej jednotky. Náplň uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po prvom otvorení, alebo keď sa nosí ako rezerva, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Fiasp100jednotiek/ml FlexTouchinjekčnýroztokvnaplnenompere
Jednorazové naplnené pero na viac dávok vyrobené z polypropylénu, polyoxymetylénu, polykarbonátu a akrylonitrilbutadiénstyrénu obsahujúce náplň (sklo typu 1) s piestom (halobutyl) a zátkou (halobutyl/polyizoprén).
Každé naplnené pero obsahuje 3 ml roztoku.
Veľkosti balenia sú 1 (s ihlami a bez ihiel) naplnené pero, 5 (bez ihiel) naplnených pier a skupinové balenie obsahujúce 10 (2 balenia po 5) (bez ihiel) naplnených pier.
Fiasp100jednotiek/ml Penfillinjekčnýroztokvnáplni
Náplň (sklo typu 1) s piestom (halobutyl) a zátkou (halobutyl/polyizoprén) v škatuľke. Každá náplň obsahuje 3 ml roztoku.
Veľkosti balenia sú 5 alebo 10 náplní.
Fiasp100jednotiek/mlinjekčnýroztokvinjekčnejliekovke
Injekčná liekovka (sklo typu 1) uzavretá halobutyl/polyizoprénovým gumovým diskom a ochranným
plastovým viečkom, aby bola injekčná liekovka chránená proti nedovolenej manipulácii, v škatuľke. Každá injekčná liekovka obsahuje 10 ml roztoku.
Veľkosti balenia sú 1 injekčná liekovka, 5 injekčných liekoviek a skupinové balenie obsahujúce
5 (5 balení po 1) injekčných liekoviek.
Fiasp100jednotiek/mlPumpCartinjekčnýroztokvnáplni
Náplň (sklo typu 1) s piestom (halobutyl) a gumovým uzáverom (halobutyl/polyizoprén) v škatuľke. Každá náplň obsahuje 1,6 ml roztoku.
Veľkosti balenia 5 náplní a multibalenie obsahujúce 25 (5 balení po 5) náplní.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Fiasp sa nesmie použiť, ak roztok nie je číry a bezfarebný. Fiasp, ktorý bol zmrazený, sa nesmie použiť.
Fiasp100jednotiek/ml FlexTouchinjekčnýroztokvnaplnenompere
Ihly a naplnené perá sa nesmú poskytovať iným osobám. Náplň sa nesmie znova napĺňať. Pacient má po každej injekcii ihlu zlikvidovať.
F
i
a
s
p
1
0
0
j
e
dn
o
t
i
e
k
/
m
l Penfill
i
n
j
e
k
č
n
ý
r
o
z
to
k
v
náplni
Ihly a náplne sa nesmú poskytovať iným osobám. Náplň sa nesmie znova napĺňať. Pacient má po každej injekcii ihlu zlikvidovať.
Fiasp100jednotiek/mlinjekčnýroztokvinjekčnejliekovke Ihly a injekčné striekačky sa nesmú poskytovať iným osobám. Pacient má po každej injekcii ihlu zlikvidovať.
Keď sa Fiasp odoberie z injekčnej liekovky, môže sa používať v infúznej pumpe (CSII) maximálne
6 dní, ako je opísané v časti 4.2 a písomnej informácii. Hadičky, ktorých vnútorné povrchové materiály tvorí polyetylén alebo polyolefín, boli hodnotené a zistilo sa, že sú kompatibilné
s používaním pumpy.
Fiasp100jednotiek/mlPumpCartinjekčnýroztokvnáplniNáplň sa nesmie poskytovať inej osobe alebo znova napĺňať.
Náplň (PumpCart) je určená na použitie len s inzulínovými infúznymi pumpami, ktoré sa majú používať s touto náplňou, ako sú inzulínové pumpy Accu-Chek Insight a YpsoPump, ako je popísané v časti 4.2. Hadičky, v ktorých sú materiály vnútorného povrchu vyrobené z polyetylénu alebo polyolefínu boli zhodnotené a zistilo sa, že sú kompatibilné s používaním pumpy.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLAEU/1/16/1160/001
EU/1/16/1160/002
EU/1/16/1160/003
EU/1/16/1160/004
EU/1/16/1160/005
EU/1/16/1160/006
EU/1/16/1160/007
EU/1/16/1160/008
EU/1/16/1160/009
EU/1/16/1160/010
EU/1/16/1160/011
EU/1/16/1160/012
EU/1/16/1160/013
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 9. januára 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu