
i s dekompenzovaným ochorením pečene (pozri časti 4.4, 4.5 a 4.8).
4.4 Osobitné upozornenia a opatrenia pri používaní
Poruchy imunitného systému
Podanie cytokínov pacientom s už existujúcou monoklonálnou gamapatiou bolo spojené s rozvojom systémového syndrómu zvýšenej permeability kapilár s príznakmi podobnými šoku a s fatálnym
koncom.
G
astrointestinálne poruchy
V priebehu liečby Extaviou sa pozorovali prípady pankreatitídy, často spojené s
hypertriglyceridémiou.
Poruchy nervového systému
Extavia sa musí podávať opatrne pacientom s predchádzajúcimi alebo súčasnými depresívnymi
poruchami, najmä tým, u ktorých sa už vyskytli samovražedné myšlienky (pozri časť 4.3). O depresii a samovražedných myšlienkach je známe, že sa vyskytujú so zvýšenou frekvenciou u populácie
pacientov s roztrúsenou sklerózou a v súvislosti s používaním interferónov. Pacienti liečení Extaviou
sa musia upozorniť aby okamžite hlásili akékoľvek príznaky depresie a/alebo samovražedné myšlienky svojmu ošetrujúcemu lekárovi. Pacientov, u ktorých sa depresia prejaví, je počas liečby Extaviou nutné starostlivo sledovať a zodpovedajúco liečiť. Musí sa zvážiť ukončenie liečby Extaviou (pozri taktiež časti 4.3 a 4.8).
Extavia sa má podávať opatrne pacientom so záchvatmi kŕčov v anamnéze, pacientom liečeným antiepileptikami a najmä pacientom s epilepsiou, ktorá nie je antiepileptikami adekvátne kontrolovaná (pozri časti 4.5 a 4.8).
Tento liek obsahuje ľudský albumín, a preto predstavuje potenciálne riziko prenosu vírusových
ochorení. Teoretické riziko prenosu Creutzfeldtovej-Jakobovej choroby (CJD) nemožno vylúčiť.
Laboratórne testy
U pacientov s tyreoidálnou dysfunkciou v anamnéze, alebo ak je to klinicky indikované, sa odporúčajú pravidelné tyreoidálne funkčné testy.
Okrem laboratórnych testov, ktoré sa obvykle vyžadujú na sledovanie pacientov s roztrúsenou sklerózou, sa pred začatím liečby Extaviou a následne v pravidelných intervaloch počas liečby a v prípade absencie klinických príznakov aj po jej skončení odporúča vyšetrenie úplného krvného obrazu a diferenciálneho počtu bielych krviniek, počtu trombocytov a rozbor krvi vrátane pečeňových testov (napríklad aspartátaminotransferáza, sérová glutamátoxalacetátaminotransferáza (SGOT), alanínaminotransferáza, sérová glutamátpyruvátaminotransferáza (SGPT) a gama- glutamyltransferáza).
Pacienti s anémiou, trombocytopéniou alebo leukopéniou (samostatne alebo v kombinácii) môžu vyžadovať dôkladnejšie sledovanie úplného krvného obrazu, diferenciálneho počtu a počtu trombocytov.. Pacientov, u ktorých sa rozvinie neutropénia, treba dôkladne sledovať s ohľadom na výskyt horúčky alebo infekcie Boli hlásené prípady trombocytopénie s veľkým poklesom počtu krvných doštičiek.
Poruchypečeneažlčovýchciest
Počas klinického skúšania sa u pacientov liečených Extaviou veľmi často vyskytlo asymptomatické zvýšenie sérových transamináz, vo väčšine prípadov mierne a prechodné. Podobne ako pri iných
interferónoch beta sa u pacientov liečených Extaviou zaznamenali prípady závažného poškodenia
pečene vrátane zlyhania pečene. Najzávažnejšie prípady sa často vyskytovali u pacientov vystavených
ďalším liečivám alebo látkam, o ktorých sa vie, že sú spojené s hepatotoxicitou alebo v prípade komorbídnych zdravotných stavov (napr. metastázujúce malígne ochorenie, ťažká infekcia a sepsa, abúzus alkoholu).
Pacienti sa musia sledovať kvôli znakom pečeňového poškodenia. Výskyt zvýšených sérových transamináz je dôvodom k starostlivému sledovaniu a vyšetrovaniu. Ak je zvýšenie hladín signifikantné alebo ak je spojené sklinickými príznakmi ako je žltačka, musí sa zvážiť vysadenie Extavie. Ak nie sú klinické dôkazy poškodenia pečene, možno po úprave hladín pečeňových enzýmov zvážiť obnovenie terapie pri riadnom priebežnom sledovaní pečeňových funkcií.
T
r
ombotická mikroangiopatia (TMA)
Pri liekoch obsahujúcich interferón beta boli hlásené prípady trombotickej mikroangiopatie, prejavujúce sa ako trombotická trombocytopenická purpura (TTP) alebo hemolyticko-uremický syndróm (HUS), vrátane smrteľných prípadov. Udalosti boli hlásené v rôznych obdobiach liečby a môžu sa vyskytnúť po niekoľkých týždňoch až niekoľkých rokoch od začiatku liečby interferónom beta. K prvým klinickým príznakom patrí trombocytopénia, novovzniknutá hypertenzia, horúčka, príznaky súvisiace s centrálnym nervovým systémom (napr. zmätenosť, paréza) a porušená funkcia obličiek. Laboratórne nálezy naznačujúce TMA zahŕňajú znížený počet trombocytov, zvýšenú koncentráciu laktátdehydrogenázy (LDH) v sére v dôsledku hemolýzy a schistocyty (fragmentáciu erytrocytov) v krvnom nátere. Pri objavení sa klinických príznakov TMA sa preto odporúča ďalšie testovanie počtu trombocytov, sérovej LDH, krvných náterov a funkcie obličiek. Ak sa diagnostikuje TMA, je potrebná bezodkladná liečba (so zvážením výmeny plazmy) a odporúča sa okamžité ukončenie liečby Extaviou.
Poruchyobličiekamočovýchciest
Pri podávaní interferónu beta pacientom so závažným zlyhaním činnosti obličiek treba postupovať opatrne a zvážiť dôkladné sledovanie.
Nefrotický syndróm
Počas liečby interferónmi beta boli hlásené udalosti nefrotického syndrómu s rôznymi druhmi základnej nefropatie vrátane kolabujúcej fokálne segmentovej glomerulosklerózy (FSGS), ochorenia
s minimálnymi zmenami (MCD), membránovoproliferatívnej glomerulonefritídy (MPGN)
a membránovej glomerulopatie (MGN). Udalosti sa zaznamenali v rôznom čase počas liečby a môžu sa vyskytnúť po niekoľkých rokoch liečby interferónom beta. Odporúča sa pravidelné monitorovanie
včasných príznakov a prejavov, napr. edému, proteinúrie a poruchy funkcie obličiek, najmä
u pacientov s vyšším rizikom choroby obličiek. Potrebná je okamžitá liečba nefrotického syndrómu a má sa zvážiť ukončenie liečby Extaviou.
Poruchy srdca
Extavia sa tiež musí používať opatrne u pacientov s srdcovými poruchami. U pacientov so závažným
ochorením srdca, ako je napríklad kongestívne zlyhanie srdca, ochorenie koronárnych artérií alebo
arytmia, sa musí sledovať zhoršenie jeho stavu, najmä na začiatku liečby Extaviou.
Aj keď Extavia nemá žiadne známe priame toxické účinky na srdce, príznaky podobné chrípke spojené s používaním beta interferónov môžu byť pre pacientov so závažným ochorením srdca zaťažujúce. Počas postmarketingového obdobia u pacientov so závažným ochorením srdca v anamnéze boli na začiatku liečby Extaviou hlásené veľmi zriedkavé prípady prechodného zhoršenia ochorenia srdca.
Zaznamenali sa prípady kardiomyopatie. Pri jej výskyte a ak je podozrenie na súvislosť s Extaviou, liečba sa musí prerušiť.
Celkové poruchy a reakcie v mieste podania
Môžu sa objaviť ťažké reakcie z precitlivenosti (závažné akútne stavy ako bronchspazmus, anafylaxia
a urtikária). Ak sú tieto reakcie závažné, liečba Extaviou sa musí prerušiť a musia sa zahájiť potrebné liečebné opatrenia.
U pacientov liečených Extaviou sa zaznamenali nekrózy v mieste podania injekcie (pozri časť 4.8). Môžu byť rozsiahle a zahrňovať svalovú fasciu i tukové tkanivo a výsledkom potom môžu byť jazvy. Niekedy je nutná excízia nekrotického tkaniva, menej často i kožná transplantácia a hojenie môže trvať až 6 mesiacov.
Pacienta treba poučiť, že ak zaznamená akékoľvek porušenie kože, ktoré môže byť spojené s opuchom alebo drenážou tekutiny z miesta injekcie, musí pred ďalšou injekciou Extavie konzultovať nález so svojím lekárom.
Ak má pacient početné lézie, liečba Extaviou sa musí prerušiť, až kým nedôjde k ich zhojeniu. Keď nie je nekróza príliš rozsiahla, pacient s ojedinelými poškodeniami môže v liečbe pokračovať, pretože u niektorých pacientov došlo ku zhojeniu nekróz v mieste vpichu i počas pokračujúcej liečby Extaviou.
Aby sa minimalizovalo riziko vzniku nekrózy v mieste injekcie, je nutné pacienta poučiť o tom, ako:
- použiť aseptickú techniku pri podaní injekcie
- striedať miesta vpichu injekcie pri podaní každej dávky
Výskyt reakcií v mieste vpichu sa môže znížiť pomocou autoinjektora. V pivotnej štúdii pacientov s jednou klinickou príhodou naznačujúcou roztrúsenú sklerózu sa u väčšiny pacientov používal autoinjektor. Reakcie a nekrózy v mieste vpichu sa pozorovali menej často v tejto štúdii než v iných pivotných štúdiách.
Proces aplikácie injekcií samotným pacientom je treba pravidelne kontrolovať, najmä vtedy, ak vznikne reakcia v mieste vpichu.
Imunogenicita
Podobne ako u všetkých terapeutických proteínov, existuje možnosť imunogenicity. V kontrolovaných klinických štúdiách sa každé 3 mesiace zhromažďovali vzorky séra na účely sledovania rozvoja
protilátok na Extaviu.
V rôznych kontrolovaných klinických štúdiách došlo u 23 % až 41 % pacientov ku vzniku sérovej neutralizačnej aktivity proti interferónu beta-1b potvrdenej nálezom minimálne dvoch po sebe idúcich pozitívnych titrov. U 43 % až 55 % týchto pacientov došlo počas nasledujúceho pozorovacieho obdobia v príslušnej štúdii ku zmene na trvalý stav bez prítomnosti protilátok (založené na dvoch po sebe idúcich negatívnych titroch).
Rozvoj neutralizačnej aktivity je spojený so znížením klinickej účinnosti len s ohľadom na aktivitu relapsov. Niektoré analýzy naznačujú, že tento účinok môže byť výraznejší u pacientov s vyššou hladinou titra neutralizačnej aktivity.
V štúdii u pacientov s jednou klinickou príhodou naznačujúcou roztrúsenú sklerózu sa pozorovala neutralizačná aktivita meraná každých 6 mesiacov najmenej raz u 32 % (89) pacientov okamžite liečených Extaviou. Z týchto pacientov sa podľa posledného dostupného hodnotenia u 60 % (53) obnovil negatívny stav počas obdobia 5 rokov. Počas tohto obdobia sa rozvoj neutralizačnej aktivity spájal s významným zvýšením nových aktívnych lézií a objemu T2 lézií pri zobrazení prostredníctvom magnetickej rezonancie. Avšak nezdalo sa, že je to spojené so znížením klinickej účinnosti (s ohľadom na čas do vzniku klinicky jednoznačnej roztrúsenej sklerózy (CDMS), čas do progresie potvrdenej EDSS a výskyt relapsov).
S rozvojom neutralizačnej aktivity neboli spojené žiadne nové nežiaduce účinky.
In vitro bola dokázaná krížová reakcia Extavie s prirodzeným interferónom beta. Toto testovanie však
neprebehlo in vivo a jeho klinický význam je neistý.
O pacientoch, u ktorých sa rozvinula neutralizačná aktivita a ktorí ukončili liečbu Extaviou je málo údajov, a tieto údaje sú nepreukázateľné.
Rozhodnutie, či pokračovať v liečbe alebo ju prerušiť má byť založené skôr na klinickej aktivite ochorenia ako na stave neutralizačnej aktivity.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v ml, t.j. v podstate zanedbateľné množstvo
sodíka.
O
soby
s
precitlivenosťou
na latex
Snímateľný uzáver hrotu naplnenej injekčnej striekačky Extavie obsahuje derivát prírodného latexu. Hoci sa v uzávere nezistil žiadny prírodný latex, bezpečné použitie naplnenej injekčnej striekačky Extavie sa neskúmalo u osôb s precitlivenosťou na latex, preto existuje možné riziko reakcií
z precitlivenosti, ktoré sa nedajú úplne vylúčiť.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Účinok podávania 250 mikrogramov (8,0 miliónov IU) Extavie každý druhý deň pacientom s roztrúsenou sklerózou na ich liekový metabolizmus je neznámy. Kortikosteroidy alebo liečba ACTH počas relapsov v priebehu až 28 dní boli pacientmi liečenými Extaviou dobre tolerované.
Vzhľadom na nedostatok klinických skúseností u pacientov s roztrúsenou sklerózou liečených Extaviou a imunomodulanciami inými ako kortikosteroidy alebo ACTH, sa tento spôsob liečby neodporúča.
Interferóny znižujú u ľudí i zvierat aktivitu enzýmov závislých od pečeňového cytochrómu P450. Opatrne sa má Extavia podávať v kombinácii s liekmi, ktoré majú úzky terapeutický index a ich klírens je silno závislý od systému pečeňového cytochrómu P450, napr. antiepileptiká. Veľká opatrnosť je potrebná aj pri akejkoľvek súčasnej liečbe, ktorá ovplyvňuje hematopoetický systém.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
Ženy v reprodukčnom veku musia používať vhodnú antikoncepciu.
Gravidita
O použití Extavie v gravidite sú obmedzené informácie. Dostupné údaje naznačujú možnosť zvýšeného rizika spontánneho potratu. Začatie liečby je počas gravidity kontraindikované (pozri časť
4.3). Ak pacientka liečená Extaviou počas liečby otehotnie alebo graviditu plánuje, je nutné ju
upozorniť na možné riziká a musí sa zvážiť prerušenie liečby (pozri časť5.3). U pacientok s vysokým počtom relapsov pred začiatkom liečby sa musí zvážiť riziko závažného relapsu po vysadení Extavie oproti možnému zvýšeniu rizika spontánneho potratu.
Laktácia
Nie je známe, či sa interferón beta-1b vylučuje do ľudského mlieka. Vzhľadom na nebezpečenstvo závažných nežiaducich reakcií u dojčených detí je treba rozhodnúť, či prerušiť dojčenie alebo liečbu Extaviou.
Fertilita
Nevykonalo sa žiadne sledovanie fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Nežiaduce udalosti súvisiace s centrálnym nervovým systémom spojené s používaním Extavie by
mohli u vnímavých pacientov ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Z
hrnutie
profilu
bezpečnosti
Na začiatku liečby sú nežiaduce účinky časté ale zvyčajne sa s pokračujúcou liečbou zmierňujú. Najčastejšie pozorovanými nežiaducimi účinkami je komplex príznakov podobných chrípke (horúčka, zimnica, bolesť kĺbov, nevoľnosť, potenie, bolesť hlavy, bolesť svalov), ktorý je spôsobený najmä farmakologickými účinkami lieku, a reakcie v mieste vpichu. Po podaní Extavie sa často vyskytujú reakcie v mieste vpichu. S liečbou Extaviou 250 mikrogramov (8,0 miliónov IU) boli významne spojené príznaky ako začervenanie, opuch, zmena farby, zápal, bolesť, precitlivenosť, nekróza a nešpecifické reakcie.
Na začiatku liečby sa vo všeobecnosti odporúča titrácia dávky, aby sa zvýšila znášanlivosť Extavie (pozri časť 4.2). Príznaky podobné chrípke sa môžu potlačiť aj podávaním nesteroidových protizápalových liekov. Výskyt reakcií v mieste vpichu sa môže znížiť pomocou autoinjektora.
Tabuľkovýzoznamnežiaducichreakcií
V nasledujúcich tabuľkách sa používa najvhodnejší termín MedDRA na opis určitej reakcie a jej synoným a súvisiacich stavov.
Nasledujúce zoznamy nežiaducich udalostí sú založené na hláseniach z klinických skúšaní (Tabuľka 1, nežiaduce udalosti a laboratórne abnormality) a zo sledovania použitia Extavie po uvedení na trh (Tabuľka 2, frekvencie – pokiaľ sú známe – pochádzajú zo zlúčených klinických skúšaní (veľmi časté
≥1/10, časté ≥1/100 až <1/10, menej časté ≥1/1 000 až <1/100, zriedkavé ≥1/10 000 až <1/1 000,
veľmi zriedkavé <1/10 000)). Skúsenosti s Extaviou u pacientov s roztrúsenou sklerózou (MS) sú obmedzené. V dôsledku toho doposiaľ nemuseli byť zaznamenané nežiaduce udalosti s veľmi zriedkavým výskytom.
Tabuľka 1 Nežiaduce udalosti a laboratórne abnormality s incidenciou ≥10 % a zodpovedajúce percentá pri použití placeba; významne súvisiace nežiaduce účinky <10 % na základe hlásení z klinických skúšaní
T
rieda orgánových
systémov
N
ežiaduca udalosť
a laboratórne abnormality
Infekcie a nákazy
Jeden prípad
naznačujúci
roztrúsenú sklerózu (BENEFIT)
E
x
t
avia
250
mi
krogramov (placebo) n=292 (n=176)
Sekundárne
progresívna roztrúsená
skleróza
(
európska
štúdia)
E
x
t
avia
250
mi
krogramov (placebo) n=360 (n=358)
Sekundárne
progresívna roztrúsená
skleróza
(
štúdia Severnej Ameriky) Extavia
250
mi
krogramov (placebo) n=317 (n=308)
R
elaps-
remitujúca roztrúsená
skleróza
E
x
t
avia
250
mi
krogramov (placebo) n=124 (n=123)
Infekcia 6 % (3 %) 13 % (11 %) 11 % (10 %) 14 % (13 %) Absces 0 % (1 %) 4 % (2 %) 4 % (5 %) 1 % (6 %) Poruchy krvi a lymfatického systému
Znížený počet
lymfocytov (<1500/mm³)
´ L °
Znížený celkový počet
neutrofilov (<1500/mm³)
´ L * °
Znížený počet leukocytov
(<3000/mm³) ´ L * °
79 % (45 %) 53 % (28 %) 88 % (68 %) 82 % (67 %)
11 % (2 %) 18 % (5 %) 4 % (10 %) 18 % (5 %)
11 % (2 %) 13 % (4 %) 13 % (4 %) 16 % (4 %)
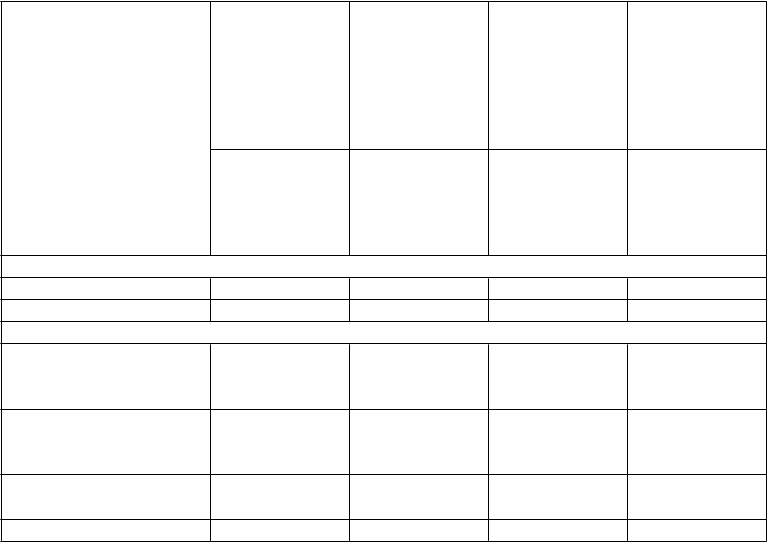
Lymfadenopatia 1 % (1 %) 3 % (1 %) 11 % (5 %) 14 % (11 %)
P
oruchy metabolizmu a výživy
Znížená hladina glukózy v krvi (<55 mg/dl) ´ Psychické poruchy
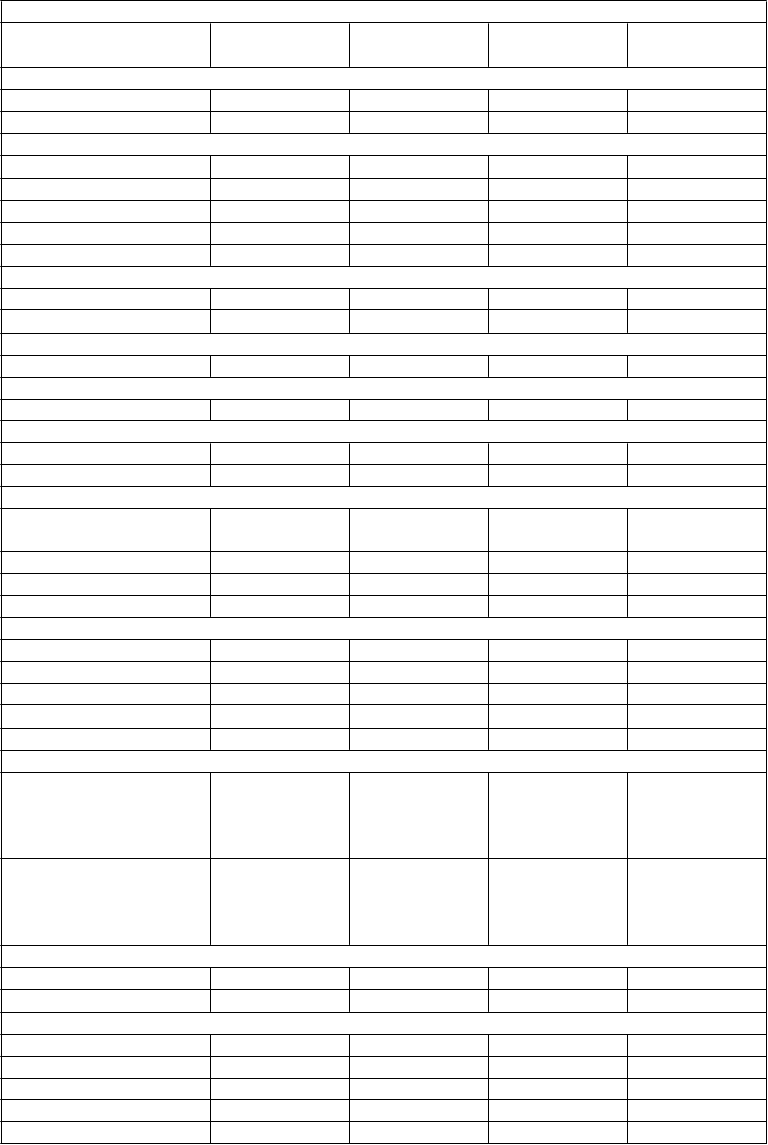
3 % (5 %) 27 % (27 %) 5 % (3 %) 15 % (13 %)
Depresia 10 % (11 %) 24 % (31 %) 44 % (41 %) 25 % (24 %) Úzkosť 3 % (5 %) 6 % (5 %) 10 % (11 %) 15 % (13 %) Poruchy nervového systému
Bolesť hlavy L 27 % (17 %) 47 % (41 %) 55 % (46 %) 84 % (77 %) Závrat 3 % (4 %) 14 % (14 %) 28 % (26 %) 35 % (28 %)
Nespavosť 8 % (4 %) 12 % (8 %) 26 % (25 %) 31 % (33 %) Migréna 2 % (2 %) 4 % (3 %) 5 % (4 %) 12 % (7 %) Parestézia 16 % (17 %) 35 % (39 %) 40 % (43 %) 19 % (21 %) Poruchy oka
Konjunktivitída 1 % (1 %) 2 % (3 %) 6 % (6 %) 12 % (10 %) Poruchy zraku L 3 % (1 %) 11 % (15 %) 11 % (11 %) 7 % (4 %)
Poruchy ucha a labyrintu
Bolesť uší 0 % (1 %) <1 % (1 %) 6 % (8 %) 16 % (15 %)
Poruchy srdca a srdcovej činnosti
Palpitácie * 1 % (1 %) 2 % (3 %) 5 % (2 %) 8 % (2 %)
Poruchy ciev
Vazodilatácia 0 % (0 %) 6 % (4 %) 13 % (8 %) 18 % (17 %) Hypertenzia° 2 % (0 %) 4 % (2 %) 9 % (8 %) 7 % (2 %) Poruchy dýchacej sústavy, hrudníka a mediastína
Infekcia horných
dýchacích ciest
18 % (19 %) 3 % (2 %)
Sinusitída 4 % (6 %) 6 % (6 %) 16 % (18 %) 36 % (26 %) Zhoršenie kašľa 2 % (2 %) 5 % (10 %) 11 % (15 %) 31 % (23 %) Dyspnoe * 0 % (0 %) 3 % (2 %) 8 % (6 %) 8 % (2 %) Poruchy gastrointestinálneho traktu
Hnačka 4 % (2 %) 7 % (10 %) 21 % (19 %) 35 % (29 %)
Zápcha 1 % (1 %) 12 % (12 %) 22 % (24 %) 24 % (18 %) Nauzea 3 % (4 %) 13 % (13 %) 32 % (30 %) 48 % (49 %) Vracanie L 5 % (1 %) 4 % (6 %) 10 % (12 %) 21 % (19 %) Bolesť brucha ° 5 % (3 %) 11 % (6 %) 18 % (16 %) 32 % (24 %) Poruchy pečene a žlčových ciest
Zvýšená hladina
alanínaminotransferázy (SGPT >5-násobok základnej hodnoty) ´ L * ° Zvýšená hladina aspartátaminotransferázy (SGOT >5-násobok základnej hodnoty) ´ L * °
18 % (5 %) 14 % (5 %) 4 % (2 %) 19 % (6 %)
6 % (1 %) 4 % (1 %) 2 % (1 %) 4 % (0 %)
 P
oruchy kože a podkožného tkaniva
P
oruchy kože a podkožného tkaniva
Kožné poruchy 1 % (0 %) 4 % (4 %) 19 % (17 %) 6 % (8 %) Vyrážka L ° 11 % (3 %) 20 % (12 %) 26 % (20 %) 27 % (32 %)
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaHypertónia° 2 % (1 %) 41 % (31 %) 57 % (57 %) 26 % (24 %) Myalgia * ° 8 % (8 %) 23 % (9 %) 19 % (29 %) 44 % (28 %) Myasténia 2 % (2 %) 39 % (40 %) 57 % (60 %) 13 % (10 %) Bolesť chrbta 10 % (7 %) 26 % (24 %) 31 % (32 %) 36 % (37 %) Bolesť končatín 6 % (3 %) 14 % (12 %) 0 % (0 %)
P
oruchy obličiek a močových ciest
Retencia moču 1 % (1 %) 4 % (6 %) 15 % (13 %)
Prítomnosť bielkovín v v moči (>1+)´
25 % (26 %) 14 % (11 %) 5 % (5 %) 5 % (3 %)
Časté močenie 1 % (1 %) 6 % (5 %) 12 % (11 %) 3 % (5 %) Inkontinencia 1 % (1 %) 8 % (15 %) 20 % (19 %) 2 % (1 %) Urgentné močenie 1 % (1 %) 8 % (7 %) 21 % (17 %) 4 % (2 %) Poruchy reprodukčného systému a prsníkov
Dysmenorea 2 % (0 %) <1 % (<1 %) 6 % (5 %) 18 % (11 %) Menštruačné poruchy * 1 % (2 %) 9 % (13 %) 10 % (8 %) 17 % (8 %) Metroragia 2 % (0 %) 12 % (6 %) 10 % (10 %) 15 % (8 %) Impotencia 1 % (0 %) 7 % (4 %) 10 % (11 %) 2 % (1 %) Celkové poruchy a reakcie v mieste podania
Reakcie v miesta vpichu
(rôzne) L * ° §
Nekróza v mieste vpichu
* °
Príznaky podobné chrípke & L *°
52 % (11 %) 78 % (20 %) 89 % (37 %) 85 % (37 %)
1 % (0 %) 5 % (0 %) 6 % (0 %) 5 % (0 %)
44 % (18 %) 61 % (40 %) 43 % (33 %) 52 % (48 %)

Horúčka L * ° 13 % (5 %) 40 % (13 %) 29 % (24 %) 59 % (41 %)
Bolesť 4 % (4 %) 31 % (25 %) 59 % (59 %) 52 % (48 %) Bolesť na hrudi ° 1 % (0 %) 5 % (4 %) 15 % (8 %) 15 % (15 %) Periférne opuchy 0 % (0 %) 7 % (7 %) 21 % (18 %) 7 % (8 %) Asténia * 22 % (17 %) 63 % (58 %) 64 % (58 %) 49 % (35 %) Zimnica L * ° 5 % (1 %) 23 % (7 %) 22 % (12 %) 46 % (19 %) Potenie * 2 % (1 %) 6 % (6 %) 10 % (10 %) 23 % (11 %) Nevoľnosť * 0 % (1 %) 8 % (5 %) 6 % (2 %) 15 % (3 %) Na popis určitej reakcie, jej synoným a súvisiacich stavov je uvedený najvhodnejší pojem podľa klasifikácie MedDRA.
´ Laboratórne abnormality
L Signifikantne spojené s liečbou Extaviou pre pacientov s prvou príhodou naznačujúcou
roztrúsenú sklerózu, p<0,05
* Signifikantne spojené s liečbou Extaviou pre RRRS, p<0,05
° Signifikantne spojené s liečbou Extaviou pre SPRS, p<0,05
§ Reakcie v mieste vpichu (rôzne) zahŕňa všetky nežiaduce udalosti v mieste vpichu, t.j. nasledujúce termíny: krvácanie miesta vpichu, precitlivenosť miesta vpichu, zápal miesta
vpichu, zdurenie miesta vpichu, nekróza miesta vpichu, bolesť miesta vpichu, reakcia v mieste
vpichu, opuch miesta vpichu a atrofia miesta vpichu
& „Komplex príznakov podobných chrípke“ označuje chrípkový syndróm a/alebo kombináciu najmenej dvoch nasledujúcich nežiaducich udalostí: horúčka, zimnica, myalgia, nevoľnosť, potenie.
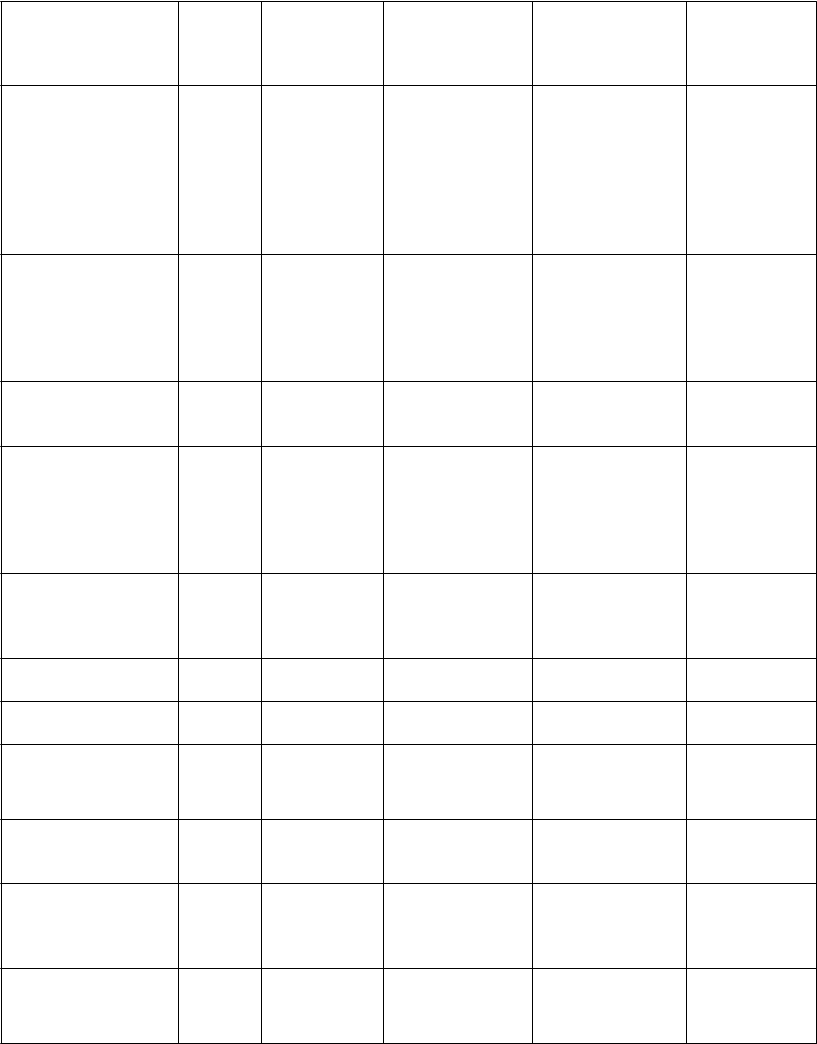
T
abuľka 2 Nežiaduce reakcie na liek (ADR) identifikované pri sledovaní po uvedení na trh
(f
re
kv
e
n
ci
e – ak sú známe – vyrátané zo zlúčených údajov z klinických skúšaní
n
=
1 093)
T
rieda orgánových
s
ystémov
V
e
ľ
m
i
č
a
st
é
(³1/10)
Časté
(³1/100 až
<1/10)
Menej časté
(³1/1 000 až
<1/100)
Zriedkavé
(³1/10 000 až
<1/1 000)
Frekvencia
neznáma
P
oruchy krvi a
l
ymfatického systému
P
oruchy imunitného systému
P
oruchy endokrinného systému
Anémia Trombocytopénia Trombotická
mikroangiopatia vrátane trombotickej trombocytopenic- kej purpury/hemo- lyticko-uremické- ho syndrómu# Anafylaktické reakcie
Hypotyreóza Hypertyreóza, Poruchy funkcie štítnej žľazy
Syndróm presakovania kapilár pri existujúcej monoklonálnej gamapatii*
P
oruchy metabolizmu a výživy
Zvýšenie telesnej hmotnosti, Zníženie telesnej hmotnosti
Zvýšenie triacylglycerolov v krvi
Anorexia*
P
sychické poruchy Stav zmätenosti
Poruchy nervového systému
Pokus
o samovraždu (pozri aj časť 4.4), Emočná labilita Kŕče
P
oruchy srdca a srdcovej činnosti Poruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
Tachykardia Kardiomyopatia*
Bronchospazmus* Pľúcna arteriálna hypertenzia**
Pankreatitída
 P
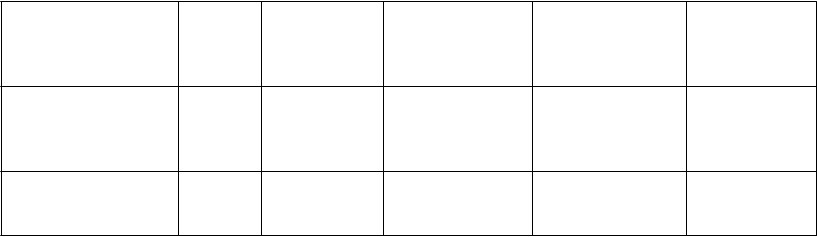
oruchy pečene a
ž
l
čových ciest
P
oruchy kože a podkožného tkaniva
P
oruchy pečene a
ž
l
čových ciest
P
oruchy kože a podkožného tkaniva
Zvýšenie bilirubínu v krvi
Urtikária, Pruritus, Alopécia
Zvýšenie gamaglutamyl- transferázy, Hepatitída
Zmena farby kože
Poškodenie pečene (vrátane hepatitídy), Zlyhanie pečene*
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Artralgia Lupus erythematosus vyvolaný liekom
P
o
r
u
c
h obličiek a močových ciest
P
oruchy reprodukčného systému a prsníkov
Menorágia
Nefrotický syndróm, glomeruloskleróza (pozri časť 4.4)* , #
* ADR zistené len po uvedení lieku na trh.
# Skupinový údaj pre lieky obsahujúce interferón beta (pozri časť 4.4).
** Označenie triedy pre lieky obsahujúce interferón je uvedené ďalej pod nadpisom Pľúcna arteriálna
hypertenzia.
PľúcnaarteriálnahypertenziaPri používaní liekov obsahujúcich interferón beta boli hlásené prípady pľúcnej arteriálnej hypertenzie (PAH). Udalosti boli hlásené v rôznych časových bodoch až do niekoľkých rokov po začatí liečby interferónom beta.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieInterferón beta-1b sa podával dospelým pacientom s karcinómom v individuálnych dávkach až
5 500 mikrogramov (176 miliónov IU) intravenózne, trikrát týždenne bez závažných nežiaducich účinkov zhoršujúcich vitálne funkcie.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: imunostimulanciá, interferóny, ATC kód: L03AB08
Interferóny patria do skupiny cytokínov, čo sú prirodzene sa vyskytujúce proteíny. Interferóny majú molekulovú hmotnosť od 15 000 do 21 000 daltonov. Sú známe tri veľké skupiny interferónov: alfa, beta a gama. Interferón alfa, interferón beta a interferón gama majú prekrývajúcu sa a napriek tomu odlišnú biologickú účinnosť. Účinnosť interferónu beta-1b je druhovo špecifická a preto najviac relevantných farmakologických informácií, týkajúcich sa interferónu beta-1b, sa získalo zo štúdií na kultúrach ľudských buniek alebo štúdií
in vivo u ľudí.
Mechanizmus účinku
Interferón beta-1b má antivírusovú i imunoregulačnú aktivitu. Mechanizmus účinku interferónu beta-
1b u roztrúsenej sklerózy doposiaľ nie je presne známy. Isté však je, že vlastnosti interferónu beta-1b
modifikujúce biologickú odpoveď sú sprostredkované jeho interakciou so špecifickými bunkovými receptormi nachádzajúcimi sa na povrchu ľudských buniek. Väzba interferónu beta-1b na tieto receptory indukuje expresiu množstva génových produktov, ktoré sú považované za mediátory biologického účinku interferónu beta-1b. Mnoho týchto produktov sa zistilo v sére a v bunkových frakciách krvi odobratej pacientom liečeným interferónom beta-1b. Interferón beta-1b znižuje väzbovú afinitu a zvyšuje internalizáciu a degradáciu receptorov interferónu gama. Interferón beta-1b tiež zosilňuje supresorovú aktivitu mononukleárnych buniek v periférnej krvi.'
Klinickáúčinnosťabezpečnosť
Nevykonávali sa zvláštne sledovania týkajúce sa vplyvu Extavie na kardiovaskulárny systém,
respiračný systém a funkciu endokrinných orgánov.
Relaps-remitujúca roztrúsená skleróza (RR-MS)
Vykonala sa jedna kontrolovaná klinická štúdia s Extaviou u pacientov s relaps-remitujúcou roztrúsenou sklerózou, ktorí boli schopní chodiť sami bez pomoci (začiatočné EDSS 0 – 5,5).
U pacientov dostávajúcich Extaviu došlo ku zníženiu frekvencie (o 30 %) a závažnosti klinických relapsov a v počte hospitalizácií vzťahujúcich sa na ochorenie. Naviac sa predĺžil interval bez
relapsov. Nie je dôkaz o účinku Extavie na trvanie relapsov alebo na príznaky medzi dvoma relapsami, a nepozoroval sa významný účinok na progresiu ochorenia u relaps-remitujúcej roztrúsenej sklerózy.
Sekundárne progresívna roztrúsená skleróza (SP-MS)
Vykonali sa dve kontrolované klinické štúdie s Extaviou u 1 657 pacientov so sekundárne progresívnou formou roztrúsenej sklerózy (úvodné EDSS 3 – 6,5, t.j. pacienti boli schopní chodiť).
Neštudovali sa pacienti s miernym ochorením a pacienti, ktorí neboli schopní chodiť. Tieto dve štúdie
priniesli nekonzistentné výsledky pre koncový ukazovateľ – stanovenie času nástupu potvrdenej
progresie, predstavovaný dobou oneskorenia progresie invalidity:
Prvá z týchto dvoch štúdií demonštrovala u pacientov, ktorí sa liečili Extaviou, štatisticky významné oddialenie progresie invalidity (Hazard Ratio = 0,69, 95 % interval spoľahlivosti (0,55, 0,86), p=0,0010, čo zodpovedá 31 % redukcii rizika Extaviou) a oddialenie progresie k ťažkej invalidite, kedy sa pacienti stávajú závislí od invalidného kresla (Hazard Ratio = 0,61, 95 % interval spoľahlivosti (0,44, 0,85), p=0,0036, čo zodpovedá 39 % redukcii rizika Extaviou). Tento účinok pokračoval počas celého obdobia sledovania až do 33 mesiacov. Liečebný efekt sa pozoroval na všetkých úrovniach hodnotených schopností a bol nezávislý od aktivity relapsov.
V druhej štúdii, ktorá hodnotila liečbu Extaviou pri sekundárne progresívnej roztrúsenej skleróze sa nepozorovalo žiadne časové oneskorenie progresie postihnutia. To je dôkazom toho, že pacienti zahrnutí do tejto štúdie mali celkovo menej aktívne ochorenie než pacienti v prvej štúdii sekundárne progresívnej roztrúsenej sklerózy.
V retrospektívnych meta-analýzach vrátane údajov z oboch štúdií sa zistil štatisticky významný celkový liečebný účinok (p=0,0076; 8,0 miliónov IU Extavie oproti všetkým pacientom dostávajúcim placebo).
Retrospektívne analýzy v podskupinách ukázali, že liečebný efekt na progresiu postihnutia je najpravdepodobnejší u pacientov s aktívnym ochorením pred začiatkom liečby (Hazard Ratio = 0,72,
95 % interval spoľahlivosti (0,59, 0,88), p=0,0011, čo zodpovedá 28 % redukcii rizika Extaviou u
pacientov s relapsami alebo s vyjadrenou EDSS progresiou, 8,0 miliónov IU Extavie oproti všetkým pacientom dostávajúcim placebo). Z týchto retrospektívnych analýz podskupín je zrejmé, že relapsy ako aj vyjadrená progresia EDSS (EDSS >1 bod alebo >0,5 bodu pre EDSS > =6 v predošlých dvoch rokoch) môžu pomôcť identifikovať pacientov s aktívnym ochorením.
V oboch štúdiách došlo k zníženiu (30 %) frekvencie klinických relapsov u pacientov so sekundárne progresívnou roztrúsenou sklerózou, ktorí dostávali Extaviu. Nie je dôkaz o tom, že by Extavia mala efekt na trvanie relapsov.
Jedna klinická príhoda naznačujúca roztrúsenú sklerózu
Vykonala sa jedna kontrolovaná klinická štúdia s Extaviou u pacientov s jednou klinickou príhodou a výsledkami zobrazenia pomocou magnetickej rezonancie (MRI) naznačujúcimi roztrúsenú sklerózu (najmenej dve klinicky latentné lézie na T2-váženom NMR). Zahrnutí boli pacienti s monofokálnym alebo multifokálnym prepuknutím ochorenia (t. j. pacienti s klinickým dôkazom jednej lézie centrálneho nervového systému v prípade monofokálneho prepuknutia resp. aspoň dvoch lézií centrálneho nervového systému v prípade multifokálneho prepuknutia). Muselo sa vylúčiť akékoľvek ochorenie iné ako roztrúsená skleróza, ktoré by mohlo lepšie vysvetliť znaky a príznaky u pacienta. Táto štúdia pozostávala z dvoch fáz, fázy kontrolovanej placebom, po ktorej nasledovala vopred naplánovaná fáza následného sledovania. Fáza kontrolovaná placebom trvala buď 2 roky, alebo dovtedy, kým sa u pacienta vyvinula klinicky jednoznačná roztrúsená skleróza (CDMS), podľa toho, čo nastalo skôr. Po fáze kontrolovanej placebom pacienti vstúpili do vopred naplánovanej fázy ďalšieho sledovania s Extaviou, aby sa vyhodnotili účinky okamžitého začatia liečby Extaviou oproti neskorému, pri čom sa porovnali pacienti pôvodne randomizovaní do skupiny Extavie („skupina okamžitej liečby“) alebo placeba („skupina neskorej liečby“). Údaj o pôvodne pridelenej liečbe zostal pre pacientov a skúšajúcich lekárov zaslepený.
Vo fáze kontrolovanej placebom Extavia spomalila postup ochorenia od prvej klinickej príhody po klinicky jednoznačnú roztrúsenú sklerózu (CDMS) štatisticky a klinicky významným spôsobom, čo zodpovedalo zníženiu rizika o 47 % (miera rizika = 0,53, interval spoľahlivosti 95 % (0,39, 0,73), p<0,0001). Počas dvojročného trvania štúdie sa CDMS vyskytla u 45 % pacientov v skupine s placebom v porovnaní s 28 % pacientov v skupine s Extaviou (Kaplan-Meierove odhady). Extavia predĺžila čas do vzniku CDMS o 363 dní, od 255 dní v skupine s placebom po 618 dní v skupine s Extaviou (na základe 25. percentilov). Tento účinok liečby bol nesporný ešte po ďalšom roku následného sledovania, keď sa riziko znížilo o 41 % (miera rizika = 0,59, 95 % interval spoľahlivosti (0,42, 0,83), p=0,0011). Počas troch rokov trvania štúdie sa CDMS vyskytla u 51 % pacientov
v skupine neskorej liečby v porovnaní s 37 % v skupine okamžitej liečby (odhady podľa Kaplana- Meiera). Pretrvávanie účinku liečby sa pozorovalo napriek tomu, že väčšina pacientov zo skupiny placeba sa liečila Extaviou v treťom roku štúdie.
Robustnosť liečebného účinku bola preukázaná aj oneskorením progresie roztrúsenej sklerózy na základe McDonaldovho kritéria. Po dvoch rokoch bolo riziko v skupine placeba 85 % a v skupine Extavie 69 % (miera rizika = 0,57, interval spoľahlivosti 95 % (0,46, 0,71), p<0,00001).
Po 3 rokoch vopred naplánovaná predbežná analýza ukázala progresiu EDSS (potvrdené zvýšenie EDSS väčšie alebo rovné 1,0 v porovnaní s východiskovou hodnotou), ku ktorej došlo u 24 % pacientov v skupine neskorej liečby v porovnaní so 16 % v skupine okamžitej liečby [miera rizika =
0,6, 95 % interval spoľahlivosti (0,39, 0,92), p=0,022]. Nie je preukázaná prospešnosť vzhľadom na
potvrdenú progresiu postihnutia u väčšiny pacientov, ktorí dostali „okamžitú“ liečbu. Následné sledovanie pacientov pokračuje, aby sa získali ďalšie údaje. Nepozorovalo sa zlepšenie kvality života, ktoré by sa dalo pripísať Extavii (stanovené prostredníctvom FAMS – Functional Assessment of MS: Treatment Outcomes Index).
Analýzy podskupín na základe základných faktorov preukázali významný účinok vo všetkých hodnotených podskupinách. Signifikantný účinok sa dosiahol aj u pacientov s menej roztrúseným a menej aktívnym ochorením v čase prvej príhody. Riziko progresie na CDMS v priebehu dvoch rokov bolo u pacientov s monofokálnym prepuknutím pre placebo 47 % a pre Extaviu 24 %, bez zvýraznenia s gadolíniom (Gd) bolo 41 % a 20 %, s menej ako 9 léziami T2 39 % a 18 %. Ďalšie analýzy podskupiny indikovali vysoké riziko progresie na CDMS v priebehu 2 rokov u monofokálnych pacientov s najmenej 9 léziami T2 (55 % riziko pre placebo, 26 % pre Extaviu) alebo so zvýraznením pomocou Gd (63 % oproti 33 %). U multifokálnych pacientov bolo riziko vzniku CDMS nezávislé od nálezov NMR pri základnej hodnote. čo indikovalo vysoké riziko pre vznik CDMS z dôvodu roztrúsenia ochorenia podloženého klinickými nálezmi. Avšak dlhodobý vplyv včasnej liečby
Extaviou je neznámy aj v týchto vysoko rizikových podskupinách, pretože táto štúdia bola určená skôr na vyhodnotenie času do vzniku CDMS, než dlhodobého rozvoja ochorenia. Okrem toho, zatiaľ nie je k dispozícii žiadna všeobecne uznávaná definícia vysoko rizikového pacienta, hoci opatrnejší prístup
má akceptovať najmenej deväť T2 hyperintenzívnych lézií na úvodnom snímku a najmenej jednu novú
T2 léziu alebo jednu novú, gadolíniom zvýraznenú léziu na kontrolnom snímku, urobenom aspoň
1 mesiac po úvodnom snímku. V každom prípade, liečba sa má zvážiť iba pre pacientov
klasifikovaných ako vysoko rizikoví.
Liečba Extaviou bola dobre znášaná v štúdii u pacientov s jednou klinickou príhodou, čo naznačuje vysoká miera dokončenia štúdie (92,8 % v skupine s Extaviou). Aby sa zvýšila znášanlivosť Extavie v štúdii pacientov s prvou klinickou príhodou, na začiatku liečby sa použila titrácia dávky a podávali sa nesteroidové protizápalové lieky. Väčšina pacientov v štúdii navyše používala autoinjektor.
RR-MS, SP-MS a jedna klinická príhoda naznačujúca MS
Vo všetkých štúdiách roztrúsenej sklerózy Extavia bola účinná v znížení aktivity ochorenia (akútny
zápal v centrálnom nervovom systéme a trvalé poškodenie tkaniva) meranom zobrazením pomocou magnetickej rezonancie (NMR). Vzťah aktivity ochorenia roztrúsenou sklerózou hodnotenej pomocou NMR a klinickým nálezom nie je ešte v súčasnosti úplne pochopený.
5.2 Farmakokinetické vlastnosti
Sérové hladiny Extavie sa sledovali u pacientov a dobrovoľníkov pomocou biologickej skúšky, ktorá nebola úplne špecifická. Maximálne sérové hladiny asi 40 IU/ml boli namerané za 1-8 hodín po subkutánnej injekcii 500 mikrogramov (16,0 miliónov IU) interferónu beta-1b. Z rôznych štúdií sa
stanovila priemerná hodnota klírensu nie viac ako 30 ml.min nie viac ako 5 hodín.
-1 -1
.kg
a polčas dispozičnej fázy zo séra
Podávanie injekcií Extavie každý druhý deň nevedie ku zvýšeniu sérovej hladiny a farmakokinetika sa
pravdepodobne počas liečby nemení.
Absolútna biologická dostupnosť subkutánne podaného interferónu beta-1b je približne 50 %.
5.3 Predklinické údaje o bezpečnosti
Štúdie akútnej toxicity sa nevykonali. Pretože hlodavce nereagujú na ľudský interferón beta, štúdie s opakovaným podávaním sa vykonali na opiciach rodu makak. Pozorovala sa prechodná hypertermia, výrazné zvýšenie počtu lymfocytov a výrazný pokles trombocytov a segmentovaných neutrofilov.
Dlhodobé štúdie sa nevykonali. Reprodukčné štúdie vykonávané na opiciach rodu makak dokázali maternálnu toxicitu a zvýšenie výskytu potratov, vyúsťujúcu do prenatálnej mortality. U prežívajúcich zvierat sa nepozorovali žiadne malformácie.
Sledovanie fertility sa nevykonalo. Nepozoroval sa vplyv na estrálny cyklus u opíc. Skúsenosti s
ostatnými interferónmi poukazujú na možnosť zhoršenia fertility samcov i samíc.
V jedinej štúdii na genotoxicitu (Amesov test) sa žiadny mutagénny efekt nepozoroval. Štúdie karcinogenity sa nevykonali. Test na transformáciu buniek in vitro nepreukázal žiadne príznaky karcinogénneho potenciálu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Ľudský albumín
Manitol (E421)
Rozpúšťadlo Chlorid sodný Voda na injekciu
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem dodávaného rozpúšťadla, ktoré je uvedené v časti
6.6.
6.3 Čas použiteľnosti
2 roky.
Po rekonštitúcii sa odporúča použiť liek ihneď. Stabilita po rekonštitúcii sa však preukázala počas
3 hodín pri 2°C - 8°C.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25°C.
Neuchovávajte v mrazničke.
Podmienky na uchovávanie rekonštituovaného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok
3 ml injekčná liekovka (číre sklo typu I) so zátkou z butylkaučuku (typ I) a hliníkovou obrubou, ktorá obsahuje 300 mikrogramov (9,6 miliónov IU) prášku (rekombinantného interferónu beta-1b).
Rozpúšťadlo
2,25-ml kalibrovaná naplnená injekčná striekačka (s vyznačením dávok: 0,25 ml, 0,5 ml, 0,75 ml,
1,0 ml) (sklo typu I) s 1,2 ml rozpúšťadla.
Veľkostibalení
- Balenie obsahujúce 5 injekčných liekoviek s práškom a 5 naplnených injekčných striekačiek s rozpúšťadlom
- Balenie obsahujúce 14 injekčných liekoviek s práškom a 14 naplnených injekčných striekačiek s
rozpúšťadlom
- Balenie obsahujúce 15 injekčných liekoviek s práškom a 15 naplnených injekčných striekačiek
s rozpúšťadlom
- Balenie obsahujúce 14 injekčných liekoviek s práškom a 15 naplnených injekčných striekačiek
s rozpúšťadlom
- Spoločné balenie na 3 mesiace obsahujúce 42 (3x14) injekčných liekoviek s práškom a 42
(3x14) naplnených injekčných striekačiek s rozpúšťadlom
- Spoločné balenie na 3 mesiace obsahujúce 45 (3x15) injekčných liekoviek s práškom a 45
(3x15) naplnených injekčných striekačiek s rozpúšťadlom
- Spoločné balenie na 3 mesiace obsahujúce 42 (3x14) injekčných liekoviek s práškom a 45
(3x15) naplnených injekčných striekačiek s rozpúšťadlom
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomUzáver hrotu naplnenej injekčnej striekačky obsahuje derivát prírodného latexu. Preto uzáver hrotu môže obsahovať prírodný latex, s ktorým nemajú manipulovať osoby s precitlivenosťou na túto látku.
RekonštitúciaNa rekonštitúciu prášku sa má použiť dodaná naplnená injekčná striekačka s rozpúšťadlom s ihlou
alebo adaptérom na injekčnú liekovku na injikovanie 1,2 ml rozpúšťadla (injekčný roztok chloridu
sodného 5,4 mg/ml (0,54 %)) do injekčnej liekovky s Extaviou. Prášok sa má kompletne rozpustiť bez trepania. Po rekonštitúcii sa má odobrať 1,0 ml roztoku z injekčnej liekovky do injekčnej striekačky na podanie 250 mikrogramov Extavie.
KontrolapredpoužitímRekonštituovaný liek sa má pred použitím vizuálne skontrolovať. Rekonštituovaný liek je bezfarebný až žltkastý a mierne opalizujúci až opalizujúci.
Liek sa musí zlikvidovať pred použitím, ak je sfarbený alebo obsahuje mechanické nečistoty.
LikvidáciaNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited Frimley Business Park Camberley GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/08/454/008-014
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. máj 2008
Dátum posledného predĺženia registrácie: 20. máj 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu