
ge004.png" />* priemerné energie sú uvedené pre častice beta
Lutécium (177Lu) sa rozpadá emisiou žiarenia beta na stabilné hafnium (177Hf). Úplný zoznam
pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Rádiofarmaceutický prekurzor, roztok.
Číry bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
EndolucinBeta je rádiofarmaceutický prekurzor a nie je určený na priame použitie u pacientov. Používa sa len na rádioaktívne označovanie nosných molekúl, ktoré boli špecificky vyvinuté a schválené na rádioaktívne označenie chloridom lutecitým (177Lu).
4.2 Dávkovanie a spôsob podávania
EndolucinBeta smú používať len špecialisti, ktorí majú skúsenosti s in vitro rádioaktívnym
označovaním.
Dávkovanie
Množstvo lieku EndolucinBeta potrebné na rádioaktívne označenie a množstvo lieku označeného
lutéciom (177Lu), ktorý sa následne podáva, bude závisieť od rádioaktívne označeného lieku a od jeho zamýšľaného použitia. Pozri súhrn charakteristických vlastností lieku/písomnú informáciu pre používateľa pre konkrétny liek, ktorý má byť rádioaktívne označený.
Pediatrická populácia
Ďalšie informácie týkajúce sa pediatrického použitia liekov označených lutéciom (177Lu) sú uvedené v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre liek, ktorý má byť rádioaktívne označený.
Spôsob podávania
EndolucinBeta je určený na in vitro rádioaktívne označovanie liekov, ktoré sa následne podávajú
schválenou cestou.
EndolucinBeta sa nemá podávať priamo pacientovi.
Pokyny na prípravu lieku pred podaním pozri časť 12.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Potvrdená alebo predpokladaná gravidita, alebo keď gravidita nebola vylúčená (pozri časť 4.6).
Informácie o kontraindikáciách konkrétnych liekov označených lutéciom (177Lu) pripravených rádioaktívnym označením liekom EndolucinBeta sa nachádzajú v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa ku konkrétnemu lieku, ktorý má byť rádioaktívne označený.
4.4 Osobitné upozornenia a opatrenia pri používaní
Individuálne odôvodnenie prínosov a rizík
Expozícia žiareniu u každého pacienta musí byť odôvodnená pravdepodobným prínosom. Podávaná
rádioaktivita má byť v každom prípade čo najnižšia, ale dostatočná na získanie potrebného
terapeutického účinku.
EndolucinBeta sa nemá podávať priamo pacientovi, ale musí sa použiť na rádioaktívne označenie
nosných molekúl, ako sú monoklonálne protilátky, peptidy, vitamíny alebo iné substráty.
Osobitné upozornenia
Informácie týkajúce sa osobitných upozornení a opatrení pri používaní liekov označených lutéciom
(177Lu) nájdete v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre liek, ktorý má byť rádioaktívne označený.
Porucha funkcie obličiek a kostnej drene
Vzhľadom na možné zvýšené vystavenie žiareniu je potrebné dôkladné posúdenie pomeru prínosu a
rizika u týchto pacientov. Odporúčajú sa vykonať individuálne hodnotenia radiačnej dozimetrie v konkrétnych orgánoch, ktoré nemusia byť cieľovým orgánom liečby.
Ochrana pred žiarením
Z aproximácie bodového zdroja vyplýva, že priemerná miera dávky zaznamenaná 20 hodín po podaní
dávky 7,3 GBq rádiofarmaka označeného liekom EndolucinBeta (reziduálna rádioaktivita 1,5 GBq)
osobou vo vzdialenosti 1 meter od stredu tela pacienta s abdominálnym polomerom 15 cm je 3,5 µSv/h. Zdvojnásobenie vzdialenosti od pacienta na 2 metre znižuje mieru dávky o faktor 4 na 0,9 µSv/h. Tá istá dávka u pacienta s abdominálnym polomerom 25 cm vedie k miere dávky pri vzdialenosti 1 meter 2,6
µSv/h. Všeobecne akceptovaná prahová hodnota na prepustenie ošetreného pacienta z nemocnice je 20
µSv/hod. Expozičný limit pre nemocničný personál je vo väčšine krajín rovnaký ako pre širokú
verejnosť, a to 1 mSv/rok. Keď berieme mieru dávky 3,5 µSv/h ako priemer, nemocničný personál by mohol pracovať približne 300 hodín/rok v tesnej blízkosti pacientov, ktorým bolo podané rádiofarmakum označené liekom EndolucinBeta bez použitia ochrany proti žiareniu. Od personálu špecializovaného na nukleárnu medicínu sa samozrejme očakáva, že bude používať štandardnú ochranu proti žiareniu.
Akákoľvek iná osoba v tesnej blízkosti ošetrovaného pacienta má byť informovaná o možnostiach
zníženia svojej expozície v dôsledku žiarenia emitovaného z pacienta.
Ďalšie opatrenia pre príbuzných, opatrovateľov a nemocničný personál sú uvedené v časti 6.6.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie chloridu lutecitého (177Lu) s inými liekmi.
Informácie týkajúce sa interakcií súvisiacich s použitím liekov označených lutéciom (177Lu) sú uvedené v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre liek, ktorý má byť rádioaktívne označený.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Keď majú byť žene vo fertilnom veku podané rádiofarmaká, je dôležité zistiť, či nie je gravidná.
Každá žena, ktorá nedostala menštruáciu, sa má považovať za gravidnú, kým sa nepreukáže opak. Ak
sú pochybnosti o možnej gravidite ženy (ak žena nedostala menštruáciu, ak je menštruácia veľmi nepravidelná atď.), pacientke treba ponúknuť iné metódy, pri ktorých sa nepoužíva ionizujúce žiarenie (ak sú takéto metódy k dispozícii). Pred použitím liekov označených lutéciom 177Lu sa má vylúčiť gravidita pomocou primeraného/validovaného testu.
G
r
avidita
Použitie liekov označených lutéciom (177Lu) je z dôvodu rizika ionizujúceho ožiarenia plodu
kontraindikované počas potvrdenej alebo predpokladanej gravidity alebo keď gravidita nebola vylúčená (pozri časť 4.3).
DojčeniePred podaním rádiofarmák dojčiacej matke treba zvážiť, či nemožno toto podanie rádionuklidu odložiť
do času, keď matka prestane dojčiť, a vybrať najvhodnejšie rádiofarmaká s ohľadom na vylučovanie
rádioaktivity do materského mlieka. Ak sa podanie lieku považuje za nevyhnutné, dojčenie sa má prerušiť a získané mlieko sa má zlikvidovať.
FertilitaNa základe údajov z literatúry a použitia konzervatívneho prístupu (maximálna dávka pre pacienta
10 GBq, priemerný výťažok pri postupe označovania, žiadne ďalšie opatrenia) sa môže usúdiť, že lieky označené lutéciom 177Lu nevedú k reprodukčnej toxicite vrátane spermatogenetického poškodenia semenníkov alebo genetického poškodenia semenníkov alebo vaječníkov.
Ďalšie informácie o používaní liekov označených lutéciom (177Lu) týkajúce sa fertlity sú uvedené v súhrne charakteristických vlastností lieku pre liek, ktorý má byť rádioaktívne označený.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeÚčinky na schopnosť viesť vozidlá a obsluhovať stroje po ošetrení liekmi označenými lutéciom (177Lu) sú uvedené v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre liek, ktorý má byť rádioaktívne označený.
4.8 Nežiaduce účinkyNežiaduce reakcie po podaní lieku označeného lutéciom (177Lu) pripraveného rádioaktívnym označením liekom EndolucinBeta budú závisieť od konkrétneho použitého lieku. Informácie tohto druhu sú
uvedené v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre liek, ktorý má byť rádioaktívne označený.
Vystavenie ionizujúcemu žiareniu súvisí s indukciou rakoviny a potenciálnym vznikom dedičných chýb. Dávka ožiarenia pri terapeutickej expozícii môže viesť k vyššiemu výskytu rakoviny a mutácií. Vo všetkých prípadoch je potrebné zabezpečiť, aby boli riziká súvisiace s ožiarením nižšie než riziká samotného ochorenia.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
prílohe V.
4.9 Predávkovanie
Prítomnosť voľného chloridu lutecitého (177Lu) v tele po neúmyselnom podaní lieku EndolucinBeta spôsobí zvýšenú toxicitu kostnej drene a poškodenie hematopoetických kmeňových buniek. Preto sa v prípade neúmyselného podania lieku EndolucinBeta musí znížiť rádiotoxicita pre pacienta okamžitým (t. j. do 1 hodiny) podaním prípravkov obsahujúcich chelátory, ako je Ca-DTPA alebo Ca-EDTA, aby sa zvýšila eliminácia rádionuklidu z organizmu.
V zdravotníckych zariadeniach, v ktorých sa používa liek EndolucinBeta na rádioaktívne
označovanie nosných molekúl na terapeutické účely, musia byť k dispozícii tieto prípravky:
- Ca-DTPA (kalcium-trinátriumdietyléntriamínpentaacetát) alebo
- Ca-EDTA (dinátrium-kalciumetyléndiamíntetraacetát).
Tieto chelátovacie činidlá pomáhajú vylúčiť rádiotoxicitu lutécia (177Lu) výmenou medzi vápnikovým iónom v komplexe a lutéciovým (177Lu) iónom. Vzhľadom na schopnosť chelátovacích ligandov (DTPA, EDTA) vytvárať komplexy rozpustné vo vode sa tieto komplexy a naviazané lutécium (177Lu) rýchlo vylúčia obličkami.
1 g chelátovacích činidiel sa má podávať pomalou intravenóznou injekciou počas 3 – 4 minút alebo infúziou (1 g na 100 – 250 ml glukózy alebo injekčného roztoku chloridu sodného 9 mg/ml (0,9 %)).
Chelátotvorná účinnosť je najvyššia bezprostredne alebo do jednej hodiny expozície, keď
rádionuklid cirkuluje alebo je dostupný v tkanivových tekutinách a plazme. Interval po expozícii > 1 hodina však nevylučuje podanie a účinok chelátora so zníženou účinnosťou. Intravenózne podanie nemá trvať viac ako 2 hodiny.
V každom prípade sa musia sledovať krvné parametre pacienta a v prípade dôkazu rádiotoxicity sa musia
okamžite vykonať príslušné opatrenia.
Toxicita voľného lutécia (177Lu) v dôsledku in vivo uvoľňovania z označenej biomolekuly v tele počas terapie by mohla byť znížená následným podaním chelátovacích činidiel.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné terapeutické rádiofarmaká, ATC kód: zatiaľ nepridelený.
Farmakodynamické vlastnosti liekov označených lutéciom (177Lu) pripravených pred podaním rádioaktívnym označením liekom EndolucinBeta budú závisieť od povahy lieku, ktorý má byť rádioaktívne označený. Pozri súhrn charakteristických vlastností lieku/písomnú informáciu pre používateľa pre konkrétny liek, ktorý má byť rádioaktívne označený.
Lutécium (177Lu) emituje β-častice strednej maximálnej energie (0,498 MeV) s maximálnou penetráciou do tkanív približne 2 mm. Lutécium (177Lu) emituje aj γ-lúče nízkej energie, čo umožňuje štúdie scintigrafie, biodistribúcie a dozimetrie s rovnakými liekmi označenými lutéciom (177Lu).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
EndolucinBeta vo všetkých podskupinách pediatrickej populácie na základe toho, že konkrétny liek nepredstavuje významný terapeutický prínos oproti existujúcim liečbam pre pediatrických pacientov. Táto výnimka však neplatí pre žiadne terapeutické použitie lieku v spojení s nosnou molekulou (pre informácie o použití v pediatrickej populácii pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti liekov označených lutéciom (177Lu) pripravených pred podaním rádioaktívnym označením liekom EndolucinBeta budú závisieť od povahy lieku, ktorý má byť rádioaktívne označený.
Distribúcia po neúmyselnom intravenóznom podaní chloridu lutecitého (177Lu)
U samcov a samíc potkana sa chlorid lutecitý (177Lu) po intravenóznom podaní rýchlo vylučuje z krvi: 5
minút po injekcii sa v krvi zistilo len 1,52 % injekčne podanej rádioaktivity (% ID) (čo zodpovedá 0,08 % ID/g) a 1 hodinu po dávke neostáva žiadna rádioaktivita nad hladinou pozadia. Chlorid lutecitý (177Lu) sa distribuuje hlavne do pečene, sleziny a kostí. Po jednej hodine je množstvo v pečeni 9,56 % injekčne podanej rádioaktivity na gram (% ID/g) a v slezine 5,26 % ID/g. V kostiach sa obsah zvyšuje z 0,01 % ID/g po 5 minútach na 0,23 % ID/g po 12 hodinách. Nasledujúcich 28 dní sa môže v kostiach pozorovať ďalší príjem lutécia 177Lu, čo je čiastočne kompenzované rádioaktívnym rozpadom. Vzhľadom na rádioaktívny polčas lutécia 177Lu 6,647 dňa je zvyšná rádioaktivita v kostiach po 28 dňoch len asi 0,06 % ID/g.
Vylučovanie stolicou a močom je pomalé. Výsledkom vylučovania a rádioaktívneho rozpadu je
celková zvyšná rádioaktivita v tele po 28 dňoch asi 1,8 % injekčne podanej dávky.
5.3 Predklinické údaje o bezpečnosti
Toxikologické vlastnosti liekov označených lutéciom (177Lu) pripravených pred podaním rádioaktívnym označením liekom EndolucinBeta budú závisieť od povahy lieku, ktorý má byť rádioaktívne označený.
Toxicita nerádioaktívneho chloridu lutecitého sa skúmala u rôznych druhov cicavcov a boli použité rôzne cesty podania. Zistilo sa, že intraperitoneálna LD50 u myší je približne 315 mg/kg. U mačiek sa nepozorovali žiadne farmakologické účinky na respiračnú a kardiovaskulárnu funkciu až do kumulatívnej intravenóznej dávky 10 mg/kg. Vysoká dávka 10 GBq chloridu lutecitého 177Lu obsahuje 2,4 µg lutécia, čo zodpovedá dávke pre človeka 0,034 µg/kg. Táto dávka je približne o 7 rádov nižšia ako intraperitoneálna LD50 u myší a o viac než 5 rádov nižšia ako hladina NOEL pozorovaná u mačiek. Preto sa môže vylúčiť toxicita liekov označených liekom EndolucinBeta (177Lu) v dôsledku kovových iónov lutécia.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Roztok kyseliny chlorovodíkovej
6.2 Inkompatibility
Rádioaktívne označovanie liekov, ako sú monoklonálne protilátky, peptidy, vitamíny alebo iné substráty chloridom lutecitým (177Lu), je veľmi citlivé na prítomnosť stopových kovových nečistôt.
Je dôležité, aby boli všetky sklenené predmety, injekčné ihly atď. používané pri príprave rádioaktívne označeného lieku dôkladne očistené, čím sa zabezpečí neprítomnosť týchto stopových kovových nečistôt. S cieľom minimalizovať hladiny stopových kovových nečistôt sa majú používať len injekčné ihly (napríklad nekovové) s dokázanou odolnosťou voči zriedenej kyseline.
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi okrem tých, ktoré majú byť rádioaktívne označené.
6.3 Čas použiteľnosti
Do 9 dní od dátumu výroby.
Z mikrobiologického hľadiska sa má liek použiť okamžite, ak metóda odoberania lieku z injekčnej liekovky alebo akékoľvek zasahovanie do injekčnej liekovky nevylučuje riziko mikrobiálnej kontaminácie.
Ak sa nepoužije okamžite, za čas a podmienky uchovávania lieku pred použitím zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred zbytočným žiarením.
Uchovávanie rádiofarmák má byť v súlade s vnútroštátnymi nariadeniami o rádioaktívnych látkach. Tento liek si nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
2 ml alebo 10 ml bezfarebná injekčná liekovka zo skla typu I s dnom v tvare písmena V (2 ml) alebo s
plochým dnom (10 ml), s brómbutylovou zátkou, uzavretá hliníkovým tesnením.
Injekčné liekovky sú pre ochranné tienenie umiestnené v olovenom kontajneri a zabalené v kovovej plechovke a vo vonkajšom obale.'
Veľkosť balenia: 1 injekčná liekovka
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
EndolucinBeta nie je určený na priame použitie u pacientov.
Všeobecné upozornenie
Rádiofarmaká môžu preberať, používať a podávať len oprávnené osoby v stanovených klinických
podmienkach. Ich príjem, uchovávanie, používanie, preprava a likvidácia podliehajú nariadeniam a/alebo príslušným licenciám príslušnej oficiálnej organizácie.
Rádiofarmaká sa majú pripravovať spôsobom, ktorý zodpovedá požiadavkám na bezpečnosť radiácie a kvality lieku. Musia byť dodržané príslušné aseptické opatrenia.
Pre pokyny na bezprostrednú prípravu lieku pred podaním pozri časť 12.
Liek sa nemá používať, ak sa kedykoľvek počas jeho prípravy naruší celistvosť tejto nádoby. Postup podávania lieku sa má uskutočniť tak, aby sa minimalizovalo riziko kontaminácie lieku a
ožiarenie pracovníkov. Je povinné primerané tienenie.
Intenzita dávky na povrchu a absorbovaná dávka závisia od mnohých faktorov. Merania na mieste a počas práce sú rozhodujúce a majú sa vykonávať na presnejšie a smerodajnejšie stanovenie celkovej dávky žiarenia, ktorej je vystavený personál. Zdravotníckym pracovníkom sa odporúča, aby obmedzili čas blízkeho kontaktu s pacientmi, ktorí dostali injekciu rádiofarmaka označeného lutéciom (177Lu). Na sledovanie pacientov sa odporúča používať systém televíznych monitorov. Vzhľadom na dlhý polčas rozpadu lutécia (177Lu) sa osobitne odporúča vyhýbať sa vnútornej kontaminácii. Preto je povinné používať vysokokvalitné ochranné rukavice (latex/nitril) pri akomkoľvek priamom kontakte s rádiofarmakom (injekčná liekovka/injekčná striekačka) a s pacientom. Na minimalizovanie vystavenia žiareniu pri opakovanom vystavení nie je k dispozícii žiadne odporúčanie okrem prísneho dodržiavania odporúčaní uvedených vyššie.
Pri podávaní rádiofarmák vzniká riziko vonkajšieho ožiarenia ďalších osôb alebo kontaminácie zapríčinenej vyliatím moču, zvratkov atď. Preto sa musia dodržiavať opatrenia na ochranu pred žiarením v súlade s vnútroštátnymi nariadeniami.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa musí zlikvidovať v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
ITG Isotope Technologies Garching GmbH Lichtenbergstrasse 1
D-85748 Garching
Nemecko
8. REGISTRAČNÉ ČÍSLA
2 ml injekčná liekovka: EU/1/16/1105/001
10 ml injekčná liekovka: EU/1/16/1105/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
11. DOZIMETRIA
Dávka žiarenia, ktorú jednotlivé orgány prijmú po intravenóznom podaní lieku označeného lutéciom
(177Lu), závisí od konkrétnej molekuly, ktorá je rádioaktívne označená.
Informácie o radiačnej dozimetrii jednotlivých liekov po podaní rádioaktívne označeného prípravku sú dostupné v súhrne charakteristických vlastností lieku/písomnej informácii pre používateľa pre konkrétny liek, ktorý má byť rádioaktívne označený.
Nasledujúca dozimetrická tabuľka je uvedená s cieľom vyhodnotiť príspevok nekonjugovaného lutécia (177Lu) k dávke žiarenia po podaní lieku označeného lutéciom (177Lu) alebo vyplývajúcej z náhodnej intravenóznej injekcie lieku EndolucinBeta.
Dozimetrické odhady boli založené na štúdii biodistribúcie u potkanov uskutočnenej podľa brožúry MIRD č. 16 a výpočty boli vykonané pomocou softvérového balíka OLINDA 1.1. Časové body pre merania boli 5 minút, 1 hodina, 12 hodín, 2 dni, 7 dní a 28 dní.
T
a
buľka 2: Odhadnuté dávky žiarenia absorbované orgánmi a účinné dávky (mSv/MBq) po neúmyselnom intravenóznom podaní
177
L
uCl
3
s
kupinám ľudí rôzneho veku na základe údajov získaných od
potkanov (n=24)
A
bsorbovaná dávka na jednotku podanej rádioaktivity (mSv/MBq)
O
rgán
D
o
s
p
e
l
í
(
73,7 kg)
15-roční
(
56,8 kg)
10-roční
(
33,2 kg)
5-roční
(
19,8 kg)
1-roční
(
9,7 kg)
Nadobličky 0,2130 0,3070 0,4450 6,0400 0,9120
Mozog 0,0056 0,0068 0,0089 1,3500 0,0197
Prsníky 0,0107 0,0134 0,0239 0,0377 0,0697
Stena žlčníka 0,1090 0,1240 0,1610 0,2530 0,4500
LLI stena 0,0104 0,0097 0,0167 0,0292 0,0522
Tenké črevo 0,1090 0,0244 0,0434 0,0731 0,1260
Stena žalúdka 0,0556 0,0381 0,0648 0,1040 0,1860
ULI stena 0,0297 0,0334 0,0609 0,1050 0,1830
Stena srdca 0,0415 0,0535 0,0805 0,1190 0,2090
Obličky 0,3720 0,4490 0,6460 0,956 1,7200
Pečeň 5,5600 7,5600 11,900 17,900 35,700
Pľúca 0,0574 0,0808 0,1140 0,1720 0,3230
Sval 0,0143 0,0180 0,0260 0,0386 0,0697
Vaječníky 0,0106 0,0129 0,0224 0,0379 0,0709
Pankreas 0,0663 0,0818 0,1250 0,1900 0,3050
Červená dreň 0,5910 0,6670 1,2300 2,6200 6,6000
Osteogénne bunky 2,1500 2,8100 4,5900 7,8000 18,800
Koža 0,0073 0,0091 0,0140 0,0217 0,0412
Slezina 5,7300 8,5000 13,500 21,600 40,700
Semenníky 0,0022 0,0029 0,0049 0,0088 0,0188
Týmus 0,0102 0,0128 0,0179 0,0276 0,0469
Štítna žľaza 0,0058 0,0075 0,0113 0,0206 0,0377
Stena močového
mechúra
0,0043 0,0056 0,0116 0,0247 0,0435
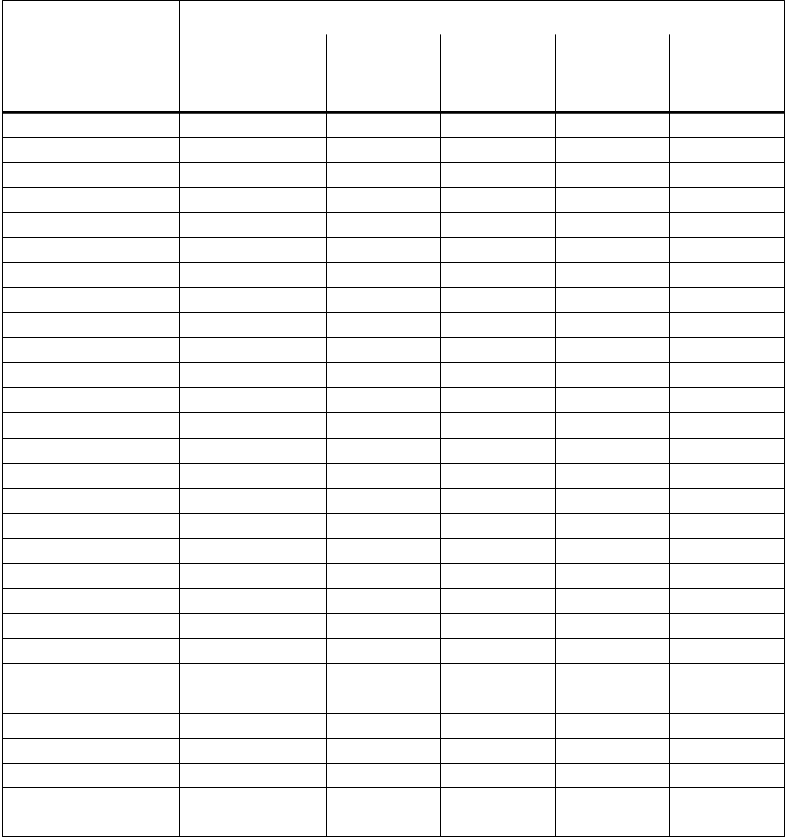
Maternica 0,0085 0,0102 0,0184 0,0331 0,0635
Zvyšok tela 0,2330 0,2990 0,5060 0,8380 1,6900
Efektívna dávka(mSv/MBq) 0,534 0,721 1,160 1,88 3,88Efektívna dávka pre dospelého s hmotnosťou 73,7 kg v dôsledku neúmyselne podanej intravenóznej
rádioaktivity 1 GBq by bola 534 mSv.
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁKPred použitím sa musia skontrolovať balenie a rádioaktivita. Rádioaktivitu možno odmerať pomocou
ionizačnej komory.
Lutécium (177Lu) je emitor žiarenia beta(-)/gama. Merania rádioaktivity pomocou ionizačnej komory
sú veľmi citlivé na geometrické faktory, a preto sa majú vykonávať len v geometrických podmienkach,
ktoré boli primerane validované.
Musia sa dodržiavať zvyčajné opatrenia týkajúce sa sterility a rádioaktivity.
Odoberanie lieku sa má vykonávať za aseptických podmienok. Injekčné liekovky sa nesmú otvárať pred vydezinfikovaním zátky, po vydezinfikovaní zátky sa má roztok odobrať cez zátku pomocou injekčnej striekačky určenej na jednu dávku vybavenej vhodným ochranným tienením a jednorazovou sterilnou ihlou alebo pomocou schváleného systému automatickej aplikácie.
Ak je celistvosť injekčnej liekovky narušená, liek sa nesmie použiť.
K injekčnej liekovke obsahujúcej chlorid lutecitý (177Lu) je potrebné pridať komplexotvorné činidlo a ďalšie reagenty. Voľné lutécium (177Lu) sa absorbuje a hromadí v kostiach. To by potenciálne mohlo viesť k osteosarkómom. Pred intravenóznym podaním konjugátov označených lutéciom (177Lu) sa odporúča pridať väzbové činidlo, napríklad DTPA, aby sa vytvoril komplex s voľným lutéciom (177Lu), ak je prítomné, čo vedie k rýchlemu vylúčeniu lutécia (177Lu) obličkami.
Je potrebné zabezpečiť primeranú kontrolu kvality rádiochemickej čistoty rádiofarmák pripravených na použitie získaných po rádioaktívnom označení liekom EndolucinBeta. Limity rádiochemických nečistôt sa majú stanoviť s ohľadom na rádiotoxikologický potenciál lutécia-177. Voľné, nenaviazané lutécium-
177 sa má teda minimalizovať.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.