
r />Spinálna/epidurálna anestézia alebo punkcia
Pri použití neuraxiálnej anestézie (spinálna/epidurálna anestézia) alebo spinálnej/epidurálnej punkcie sú pacienti liečení antitrombotikami na prevenciu trombembolických komplikácií vystavení riziku
epidurálneho alebo spinálneho hematómu, čo môže viesť k dlhodobej alebo permanentnej paralýze.
Riziko vzniku týchto udalostí sa môže zvýšiť pri zavedení epidurálnych katétrov v pooperačnom období alebo pri súbežnom používaní liekov, ktoré ovplyvňujú hemostázu. Zavedené epidurálne alebo intratekálne katétre sa musia odstrániť minimálne 5 hodín pred prvou dávkou Eliquisu. Riziko môže zvýšiť aj traumatizujúca alebo opakovaná epidurálna alebo spinálna punkcia. U pacientov je nutné často sledovať znaky a príznaky neurologického poškodenia (napr. necitlivosť alebo slabosť nôh, dysfunkcia čriev alebo močového mechúra). Ak sa zaznamená neurologická porucha, je nevyhnutná urgentná diagnostika a liečba. Pred neuraxiálnou intervenciou má lekár u pacientov s antikoagulačnou liečbou alebo u pacientov, ktorým sa má antikoagulačná liečba podať z dôvodu tromboprofylaxie, zvážiť potenciálny prínos oproti riziku.
Neexistujú žiadne klinické skúsenosti s používaním apixabanu spolu so zavedenými intratekálnymi alebo epidurálnymi katétrami. V prípade takejto potreby a vychádzajúc z farmakokinetických údajov, musí uplynúť interval 20 – 30 hodín (t. j. 2 x biologický polčas) medzi poslednou dávkou apixabanu
a odstránením katétra a minimálne jedna dávka sa má vynechať pred odstránením katétra. Nasledujúca dávka apixabanu sa môže podať minimálne 5 hodín po odstránení katétra. Tak ako u všetkých nových antikoagulancií sú skúsenosti s neuraxiálnou blokádou obmedzené a preto sa odporúča veľká
opatrnosť pri používaní apixabanu za prítomnosti neuraxiálnej blokády.
Hemodynamicky nestabilní pacienti s PE alebo pacienti, u ktorých sa vyžaduje trombolýza alebopľúcna embolektómia
Eliquis sa neodporúča ako alternatíva k nefrakcionovanému heparínu u pacientov s pľúcnou embóliou, ktorí sú hemodynamicky nestabilní alebo môžu podstúpiť trombolýzu alebo pľúcnu embolektómiu, pretože sa bezpečnosť a účinnosť apixabanu v týchto klinických situáciách nestanovili.
Pacienti s aktívnou formou rakoviny
Účinnosť a bezpečnosť apixabanu pri liečbe DVT, liečbe PE a na prevenciu rekurentnej DVT a PE (VTEt) u pacientov s aktívnou formou rakoviny neboli stanovené.
Pacienti s poruchou funkcie obličiek
Obmedzené klinické údaje naznačujú, že plazmatické koncentrácie apixabanu sú zvýšené u pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu 15 – 29 ml/min), ktoré môže viesť
k zvýšenému riziku krvácania. Na prevenciu VTE pri elektívnom chirurgickom zákroku na výmenu
bedrového alebo kolenného kĺbu (VTEp) sa má na liečbu DVT, liečbu PE a prevenciu rekurentnej
DVT a PE (VTEt) apixaban používať s opatrnosťou u pacientov s poruchou funkciou obličiek (klírens kreatinínu 15-29 ml/min) (pozri časti 4.2 a 5.2).
Na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF majú pacienti
s ťažkou poruchou funkcie obličiek (klírens kreatinínu 15 – 29 ml/min) a pacienti so sérovou hladinou kreatinínu ≥ 1,5 mg/dl (133 mikromol/l) súvisiacou s vekom ≥ 80 rokov alebo telesnou hmotnosťou
≤ 60 kg dostávať nižšiu dávku apixabanu 2,5 mg dvakrát denne (pozri časť 4.2).
U pacientov s klírensom kreatinínu ≤ 15 ml/min alebo u pacientov podstupujúcich dialýzu neexistujú žiadne klinické skúsenosti, preto sa apixaban neodporúča (pozri časti 4.2 a 5.2).
Starší pacienti
Zvyšujúci sa vek môže zvýšiť riziko krvácania (pozri časť 5.2).
Tiež súbežné podávanie Eliquisu s ASA u starších pacientov sa má používať opatrne z dôvodu potenciálne vyššieho rizika krvácania.
Telesná hmotnosť
Nízka telesná hmotnosť (< 60 kg) môže zvýšiť riziko krvácania (pozri časť5.2).
Pacienti s poruchou funkcie pečene
Eliquis je kontraindikovaný u pacientov s ochorením pečene spojeným s koagulopatiou a klinicky významným rizikom krvácania (pozri časť 4.3).
Neodporúča sa u pacientov s ťažkou poruchou funkcie pečene (pozri časť 5.2).
U pacientov s ľahkou alebo stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre A
alebo B) sa má používať s opatrnosťou (pozri časti 4.2 a 5.2).
Pacienti so zvýšenou hladinou pečeňových enzýmov (ALT/AST > 2 x ULN) alebo celkového bilirubínu ≥ 1,5 x ULN boli vylúčení z klinických štúdií. Preto sa má Eliquis u týchto pacientov používať s opatrnosťou (pozri časť 5.2). Pred začatím liečby Eliquisom sa má uskutočniť vyšetrenie funkcie pečene ako súčasť štandardného klinického hodnotenia.
Interakcia s inhibítormi cytochrómu P450 3A4 (CYP3A4) a P-glykoproteínu (P-gp)
Použitie Eliquisu sa neodporúča u pacientov súbežne užívajúcich systémovú liečbu silnými inhibítormi CYP3A4 a P-gp, ako azolové antimykotiká (napr. ketokonazol, itrakonazol, vorikonazol, pozakonazol) a inhibítory HIV proteáz (napr. ritonavir). Tieto liečivá môžu zvýšiť expozíciu apixabanu dvojnásobne (pozri časť 4.5), v prítomnosti ďalších faktorov, ktoré zvyšujú expozíciu apixabanu (napr. ťažká porucha funkcie obličiek), ešte viac.
Interakcia s induktormi CYP3A4 a P-gp
Súbežné použitie Eliquisu so silnými induktormi CYP3A4 a P-gp (napr. rifampicín, fenytoín, karbamazepín, fenobarbital alebo ľubovník bodkovaný) môže viesť k ~50 % zníženiu expozície apixabanu. V klinickom skúšaní u pacientov s atriálnou fibriláciou sa pozorovala znížená účinnosť
a vyššie riziko krvácania v porovnaní so samotným podaním apixabanu, ak sa apixaban podával spolu
so silnými induktormi CYP3A4 a zároveň P-gp.
Na pacientov užívajúcich súbežnú systémovú liečbu silnými induktormi CYP3A4 a aj P-gp sa vzťahujú nasledujúce odporúčania (pozri časť 4.5):
- na prevenciu VTE pri elektívnom chirurgickom zákroku na výmenu bedrového alebo kolenného kĺbu, na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF a na prevenciu rekurentnej DVT a PE sa má apixaban používať s opatrnosťou,
- na liečbu DVT a liečbu PE sa apixaban nemá používať, pretože sa účinnosť môže oslabiť. Chirurgický výkon pre fraktúru bedrového kĺbu
V klinických štúdiách na hodnotenie účinnosti a bezpečnosti u pacientov, ktorí absolvujú chirurgický výkon pre fraktúru bedrového kĺbu sa apixaban neskúmal. Preto sa u týchto pacientov neodporúča.
Laboratórne parametre
Parametre zrážavosti [napr. protrombínový čas (prothrombin time, PT), INR a aktivovaný čiastočný tromboplastínový čas (activated partial thromboplastin time, aPTT)] sú ovplyvnené tak, ako sa predpokladá podľa mechanizmu účinku apixabanu. Zmeny pozorované v týchto testoch zrážavosti pri očakávaných terapeutických dávkach sú malé a podliehajú vysokému stupňu variability (pozri časť 5.1).
Informácie o pomocných látkach
Eliquis obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Inhibítory CYP3A4 a P-gp
Súbežné podávanie apixabanu s ketokonazolom (400 mg jedenkrát denne), silným inhibítorom CYP3A4 a P-gp, viedlo ku dvojnásobnému zvýšeniu priemernej AUC apixabanu a 1,6-násobnému zvýšeniu priemernej cmax apixabanu.
Použitie Eliquisu sa neodporúča u pacientov, ktorým súbežne podáva systémová liečba silnými inhibítormi CYP3A4 a P-gp, ako azolové antimykotiká (napr. ketokonazol, itrakonazol, vorikonazol a pozakonazol) a inhibítory HIV proteáz (napr. ritonavir) (pozri časť 4.4).
Predpokladá sa, že liečivá, ktoré sa nepovažujú za silné inhibítory CYP3A4 ani P-gp (napr. diltiazem, naproxén, amiodaron, verapamil, chinidín) zvyšujú plazmatickú koncentráciu apixabanu v menšom rozsahu. Napríklad Diltiazem (360 mg jedenkrát denne), ktorý sa považuje za stredne silný inhibítor CYP3A4 a slabý inhibítor P-gp, viedol k 1,4-násobnému zvýšeniu priemernej AUC apixabanu a 1,3- násobnému zvýšeniu cmax. Naproxén (jednorazová dávka 500 mg), inhibítor P-gp, ale nie inhibítor CYP3A4, viedol k 1,5-násobnému zvýšeniu priemernej AUC a 1,6-násobnému zvýšeniu priemernej cmax apixabanu. Pri súbežnom podávaní s menej silnými inhibítormi CYP3A4 a/alebo P-gp sa úprava dávky nevyžaduje.
Induktory CYP3A4 a P-gp
Súbežné podávanie apixabanu s rifampicínom, silným induktorom CYP3A4 a P-gp, viedlo k približne
54 % zníženiu priemernej AUC a 42 % zníženiu priemernej cmax apixabanu. Súbežné používanie apixabanu s inými silnými induktormi CYP3A4 a P-gp (napr. fenytoín, karbamazepín, fenobarbital alebo ľubovník bodkovaný) môže tiež viesť k zníženiu plazmatických koncentrácií apixabanu. Pri súbežnej liečbe takýmito liekmi sa nevyžaduje úprava dávky apixabanu, avšak u pacientov užívajúcich súbežnú systémovú liečbu silnými induktormi CYP3A4 a P-gp sa má apixaban na prevenciu VTE pri elektívnom chirurgickom zákroku na výmenu bedrového alebo kolenného kĺbu, na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF a na prevenciu rekurentnej DVT a PE používať s opatrnosťou.
Apixaban sa neodporúča na liečbu DVT a PE u pacientov užívajúcich súbežnú systémovú liečbu silnými induktormi CYP3A4 a P-gp, pretože sa účinnosť môže oslabiť (pozri časť 4.4).
Antikoagulanciá, inhibítory agregácie trombocytov a NSAIDs
Z dôvodu zvýšeného rizika krvácania je súbežná liečba inými antikoagulanciami kontraindikovaná
(pozri časť 4.3).
Po kombinovanom podaní enoxaparínu (v jednorazovej dávke 40 mg) s apixabanom (v jednorazovej dávke 5 mg) sa pozoroval aditívny účinok na aktivitu anti-faktora Xa.
Keď sa apixaban podal súbežne s 325 mg ASA jedenkrát denne, farmakokinetické alebo farmakodynamické interakcie neboli zjavné.
Súbežné podanie apixabanu s klopidogrelom (75 mg jedenkrát denne) alebo s kombináciou 75 mg klopidogrelu a 162 mg ASA jedenkrát denne alebo s prasugrelom (60 mg, po ktorých nasledovalo
10 mg jedenkrát denne) v klinických štúdiách fázy I nevykazovalo významný vzostup v čase
krvácania ani ďalšiu inhibíciu agregácie trombocytov v porovnaní s podaním protidoštičkových látok bez apixabanu. Vzostupy testov zrážavosti (PT, INR a aPTT) sa zhodovali s účinkami samotného apixabanu.
Naproxén (500 mg), inhibítor P-gp, spôsobil 1,5-násobné zvýšenie priemernej AUC a 1,6-násobné zvýšenie cmax apixabanu. Korešpondujúce zvýšenia v testoch zrážavosti sa pozorovali pri apixabane. Nepozorovali sa zmeny v účinku naproxénu na agregáciu trombocytov indukovanú kyselinou arachidónovou a po súbežnom podaní apixabanu s naproxénom sa nepozorovalo predĺženie času krvácania.
Napriek týmto zisteniam sa môžu vyskytnúť jedinci so silnejšou farmakodynamickou odpoveďou na súbežné podávanie protidoštičkových látok s apixabanom. Pri súbežnom podávaní Eliquisu s NSAIDs (vrátane kyseliny acetylsalicylovej) je potrebná opatrnosť, pretože tieto lieky obvykle zvyšujú riziko krvácania. Významné zvýšenie rizika krvácania bolo hlásené v prípade trojkombinácie apixabanu, ASA a klopidogrelu v klinickej štúdii u pacientov s akútnym koronárnym syndrómom (pozri časť 4.4).
Lieky spájané s ťažkým krvácaním sa neodporúčajú užívať súbežne s Eliquisom: trombolytiká, antagonisty receptora GPIIb/IIIa, tienopyridíny (napr. klopidogrel), dipyridamol, dextrán a sulfinpyrazón.
Iné súbežné liečby
Nepozorovali sa žiadne klinicky významné farmakokinetické alebo farmakodynamické interakcie pri súbežnom podávaní apixabanu s atenololom alebo famotidínom. Súbežné podávanie 10 mg apixabanu
so 100 mg atenololu nemalo klinicky významný účinok na farmakokinetiku apixabanu. Po súbežnom podaní týchto dvoch liečiv bola priemerná AUC apixabanu nižšia o 15 % a cmax nižšia 18 %, ako keď sa podali samostatne. Podanie 10 mg apixabanu so 40 mg famotidínu nemalo žiadny účinok na AUC alebo cmax apixabanu.
Účinok apixabanu na iné lieky
Štúdie in vitro preukázali, že apixaban nemá žiadny inhibičný účinok na aktivitu CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6 alebo CYP3A4 (IC50 > 45 (M) a má slabý inhibičný účinok na aktivitu CYP2C19 (IC50 > 20 (M) pri koncentráciách, ktoré sú významne väčšie ako najvyššie plazmatické koncentrácie pozorované u pacientov. Apixaban neindukoval CYP1A2, CYP2B6, CYP3A4/5 pri koncentrácii do 20 (M. Preto sa neočakáva, že by apixaban ovplyvňoval metabolický klírens súbežne podaných liekov, ktoré sú metabolizované týmito enzýmami. Apixaban nie je významným inhibítorom P-gp.
V štúdiách so zdravými jedincami (pozri nižšie), apixaban významne nemenil farmakokinetiku digoxínu, naproxénu alebo atenololu.
Digoxín
Súbežné podanie apixabanu (20 mg jedenkrát denne) a digoxínu (0,25 mg jedenkrát denne), substrátu P-gp, neovplyvnilo AUC alebo cmax digoxínu. Preto apixaban neinhibuje transport substrátu sprostredkovaného P-gp.
Naproxén
Súbežné podanie jednorazovej dávky apixabanu (10 mg) a naproxénu (500 mg), bežne používaného
NSAID, nemalo žiadny účinok na AUC alebo cmax naproxénu.
Atenolol
Súbežné podanie jednorazovej dávky apixabanu (10 mg) a atenololu (100 mg), bežného betablokátora, nezmenilo farmakokinetiku atenololu.
Aktívne uhlie
Podanie aktívneho uhlia znižuje expozíciu apixabanu (pozri časť 4.9).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití apixabanu u gravidných žien. Štúdie na zvieratách nenaznačujú priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity. Neodporúča sa
užívať apixaban počas gravidity.
Dojčenie
Nie je známe či sa apixaban alebo jeho metabolity vylučujú do ľudského mlieka. Dostupné údaje u zvierat preukázali vylučovanie apixabanu do mlieka. V mlieku potkanov sa zistil vysoký pomer
hladiny apixabanu v mlieku voči plazme (cmax okolo 8, AUC okolo 30), pravdepodobne z dôvodu aktívneho transportu do mlieka. Riziko pre novorodencov a dojčatá nemožno vylúčiť.
Musí sa rozhodnúť, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu apixabanom. Fertilita
Štúdie na zvieratách, ktorým sa podával apixaban, nepreukázali žiadny účinok na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Eliquis nemá, alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Bezpečnosť apixabanu sa skúmala v 7 klinických štúdiách fázy III zahŕňajúcich viac ako
21 000 pacientov: viac ako 5 000 pacientov v štúdiách VTEp počas priemernej celkovej expozície
20 dní, viac ako 11 000 pacientov v štúdiách NVAF počas priemernej celkovej expozície 1,7 rokov
a viac ako 4 000 pacientov v štúdiách liečby VTE (VTEt) počas priemernej celkovej expozície 221 dní
(pozri časť 5.1).
Častými nežiaducimi reakciami boli krvácanie, kontúzia, epistaxa a hematóm (profil nežiaducich reakcií a frekvencie podľa indikácie, pozri v tabuľke 2).
V štúdiách VTEp sa celkovo u 11 % z pacientov liečených 2,5 mg apixabanu dvakrát denne objavili nežiaduce reakcie. V štúdiách apixabanu oproti enoxaparínu bol celkový výskyt nežiaducich reakcií súvisiacich s krvácaním pri apixabane 10 %.
V štúdiách NVAF bol celkový výskyt nežiaducich reakcií súvisiacich s krvácaním pri apixabane
24,3 % v štúdii apixabanu oproti warfarínu a 9,6 % v štúdii s apixabanom oproti kyseline acetylsalicylovej. V štúdii apixabanu oproti warfarínu bol výskyt závažných ISTH krvácaní gastrointestinálneho traktu (zahŕňajúcich hornú časť GI, dolnú časť GI a rektálne krvácanie) pri apixabane 0,76 %/rok. Výskyt závažného intraokulárneho ISTH krvácania bol pri apixabane
0,18 %/rok.
V štúdiách VTEt bol celkový výskyt nežiaducich reakcií súvisiacich s krvácaním pri apixabane 15,6 %
v štúdii apixabanu oproti enoxaparínu/warfarínu a 13,3 % v štúdii apixabanu oproti placebu (pozri časť 5.1).
Zoznam nežiaducich reakcií v tabuľke
Tabuľka 2 uvádza nežiaduce reakcie zoradené do skupín podľa orgánových systémov a podľa frekvencie vyjadrenej nasledujúcimi kategóriami: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej
časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000);
neznáme (z dostupných údajov) pre VTEp, NVAF a VTEt.
Tabuľka 2
Trieda orgánových systémov Prevencia VTEu dospelých pacientov, ktorí podstúpili elektívny chirurgickýzákrok na výmenu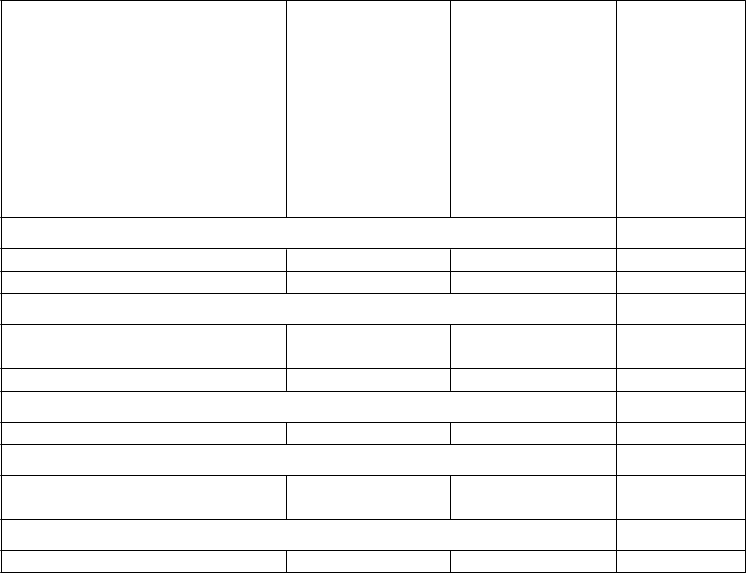 bedrového alebo kolenného kĺbu (VTEp)Prevencia cievnej mozgovej príhody a systémovej embólieu dospelýchpacientov s NVAF s jedným alebo viacerými rizikovými faktormi (NVAF)Liečba DVTa PEa prevencia rekurentnej DVT a PE (VTEt)
bedrového alebo kolenného kĺbu (VTEp)Prevencia cievnej mozgovej príhody a systémovej embólieu dospelýchpacientov s NVAF s jedným alebo viacerými rizikovými faktormi (NVAF)Liečba DVTa PEa prevencia rekurentnej DVT a PE (VTEt)
Poruchy krvi a lymfatického systému
Anémia Časté - - Trombocytopénia Menej časté - - Poruchy imunitného systému
Precitlivenosť, alergický edém a anafylaxia
Zriedkavé Menej časté -
Pruritus Menej časté Menej časté Menej časté*
Poruchy nervového systému
Krvácanie do mozgu - Menej časté Zriedkavé
Poruchy oka
Krvácanie do oka (vrátane spojovkového krvácania) Poruchy ciev
Zriedkavé Časté Menej časté
Krvácanie, hematómy Časté Časté Časté
Trieda orgánových systémov Prevencia VTE
u dospelých pacientov, ktorí podstúpili elektívny chirurgický
zákrok na výmenu bedrového alebo kolenného kĺbu (VTEp)
Prevencia cievnej mozgovej príhody a systémovej embólie
u dospelých
pacientov s NVAF s jedným alebo viacerými rizikovými faktormi (NVAF)
Liečba DVT
a PE
a prevencia rekurentnej DVT a PE (VTEt)
Hypotenzia (vrátane procedurálnej hypotenzie)
Menej časté - -
Intraabdominálne krvácanie - Menej časté -
Poruchy dýchacej sústavy, hrudníka a mediastína
Epistaxa Menej časté Časté Časté Hemoptýza Zriedkavé Menej časté Menej časté Krvácanie do respiračného traktu - Zriedkavé Zriedkavé Poruchy gastrointestinálneho traktu
Nauzea Časté - - Gastrointestinálne krvácanie Menej časté Časté Časté
Hemoroidálne krvácanie, krvácanie
z úst
- Menej časté -
Hematochézia Menej časté Menej časté Menej časté
Rektálne krvácanie, gingiválne krvácanie
Zriedkavé Časté Časté
Retroperitoneálne krvácanie - Zriedkavé -
Poruchy pečene a žlčových ciest
Zvýšené transaminázy, zvýšená aspartátaminotransferáza, zvýšená gamma-glutamyltransferáza, abnormálny test pečeňovej funkcie, zvýšená hladina alkalickej fosfatázy v krvi, zvýšený bilirubín v krvi Poruchy kože a podkožného tkaniva
Menej časté - -
Kožná vyrážka - Menej časté -
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Krvácanie do svalov Zriedkavé - -
Poruchy obličiek a močových ciest
Hematúria Menej časté Časté Časté
Poruchy reprodukčného systému a prsníkov
Abnormálne vaginálne krvácanie, urogenitálne krvácanie
Celkové poruchy a reakcie v mieste podania
- Menej časté Menej časté
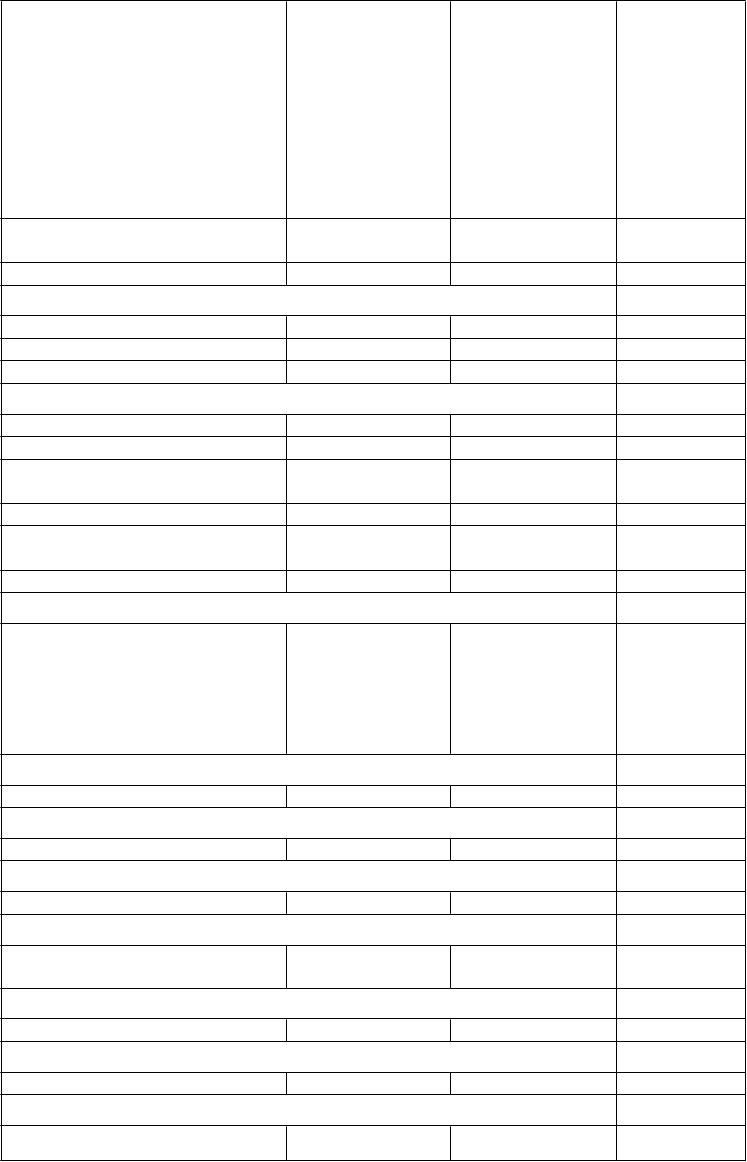
Krvácanie v mieste aplikácie - Menej časté -
Laboratórne a funkčné vyšetreniaPozitívny test na okultné krvácanie - Menej časté Menej časté
Úrazy, otravy a komplikácie liečebného postupuKontúzia Časté Časté Časté
Trieda orgánových systémov Prevencia VTE
u dospelých pacientov, ktorí podstúpili elektívny chirurgický
 zákrok na výmenu bedrového alebo kolenného kĺbu (VTEp)
Prevencia cievnej mozgovej príhody a systémovej embólie
u dospelých
pacientov s NVAF s jedným alebo viacerými rizikovými faktormi (NVAF)
Liečba DVT
a PE
a prevencia rekurentnej DVT a PE (VTEt)
zákrok na výmenu bedrového alebo kolenného kĺbu (VTEp)
Prevencia cievnej mozgovej príhody a systémovej embólie
u dospelých
pacientov s NVAF s jedným alebo viacerými rizikovými faktormi (NVAF)
Liečba DVT
a PE
a prevencia rekurentnej DVT a PE (VTEt)
Hemorágia po zákroku (vrátane postprocedurálneho hematómu,
krvácania z rán, hematómu v mieste
prepichnutia cievy a krvácanie
v mieste zavedenia katétra) sekrécia z rany, krvácanie v mieste incízie (vrátane hematómu v mieste
incízie), operačná hemorágia
Traumatická hemorágia, postprocedurálna hemorágia, krvácanie v mieste incízie
Menej časté - -
- Menej časté Menej časté
* V štúdii CV185057 (dlhodobá prevencia VTE) sa nevyskytol generalizovaný pruritus
Použitie Eliquisu sa môže spájať so zvýšeným rizikom skrytého alebo otvoreného krvácania
z akéhokoľvek tkaniva alebo orgánu, ktoré môže vyústiť do posthemoragickej anémie. Príznaky a závažnosť sa budú líšiť podľa lokality a stupňa alebo rozsahu krvácania (pozri časti 4.4 a 5.1).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieProti Eliquisu neexistuje antidotum. Predávkovanie apixabanom môže viesť ku zvýšenému riziku krvácania. V prípade komplikácií spôsobených krvácaním sa musí liečba ukončiť a vyšetriť zdroj krvácania. Je potrebné zvážiť začatie vhodnej liečby, napr. chirurgickej hemostázy alebo transfúzie čerstvej zmrazenej plazmy.
V kontrolovaných klinických štúdiách sa u zdravých jedincov, ktorým sa podával apixaban perorálne v dávkach do 50 mg denne počas 3 – 7 dní (25 mg dvakrát denne (BID) počas 7 dní alebo 50 mg jedenkrát denne (od) počas 3 dni), neprejavili žiadne klinicky významné nežiaduce účinky.
U zdravých osôb znížilo podanie aktívneho uhlia 2 a 6 hodín po požití 20 mg dávky apixabanu priemernú AUC apixabanu o 50 % a 27 %, v uvedenom poradí, a nemalo žiadny vplyv na Cmax. Keď bolo aktívne uhlie podané 2 a 6 hodín po apixabane, priemerný polčas apixabanu klesol z 13,4 hodín, kedy sa apixaban podal samostatne, na 5,3 hodín a 4,9 hodín v uvedenom poradí. Podávanie aktívneho uhlia môže byť teda užitočné pri zvládaní predávkovania apixabanom alebo náhodného požitia.
Ak sa život ohrozujúce krvácanie nedá zvládnuť pomocou opatrení uvedených vyššie, možno zvážiť podanie koncentrátov protrombínového komplexu (prothrombin complex concentrates, PCCs) alebo rekombinantného faktora VIIa. Zrušenie farmakodynamických účinkov Eliquisu preukázané zmenami v teste na tvorbu trombínu bolo zrejmé na konci infúzie a začiatočné hodnoty boli dosiahnuté
v priebehu 4 hodín po začatí 30 minútovej infúzie 4-faktorového PCC u zdravých jedincov. Nie sú však žiadne klinické skúsenosti s použitím 4-faktorových PCCs na zastavenie krvácania
u jednotlivcov, ktorí dostali Eliquis. V súčasnosti nie sú žiadne skúsenosti s použitím
rekombinantného faktora VIIa u jedincov užívajúcich apixaban. Môže sa zvážiť opätovné dávkovanie rekombinantného faktora VIIa a titrovať ho v závislosti od zlepšenia krvácania.
V závislosti na lokálnej dostupnosti sa v prípade rozsiahleho krvácania môže zvážiť konzultácia experta na koaguláciu.
Hemodialýza znížila AUC apixabanu o 14 % u pacientov s terminálnym štádiom ochorenia obličiek (ESRD), keď sa podávala jednorazová dávka apixabanu 5 mg perorálne. Preto je nepravdepodobné, že by hemodialýza bola účinným prostriedkom pri liečbe predávkovania apixabanom.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antitrombotiká, priamy faktor Xa inhibítorov, ATC kód: B01AF02
Mechanizmus účinku
Apixaban je silný, perorálny, reverzibilný, priamy a vysoko selektívny inhibítor faktora Xa. Pre svoju antitrombotickú aktivitu si nevyžaduje antitrombín III. Apixaban inhibuje voľný a na krvnú zrazeninu viazaný faktor Xa a aktivitu protrombinázy. Apixaban nemá žiadne priame účinky na agregáciu trombocytov, ale nepriamo inhibuje agregáciu trombocytov vyvolanú trombínom. Inhibíciou faktora Xa apixaban zabraňuje tvorbe trombínu a vzniku trombu. Predklinické štúdie s apixabanom na zvieratách preukázali antitrombotický účinok v prevencii arteriálnej a venóznej trombózy v dávkach, ktoré zachovávajú (umožňujú) hemostázu.
Farmakodynamické účinky
Farmakodynamické účinky apixabanu reflektujú mechanizmus účinku (inhibícia FXa). V dôsledku inhibície FXa apixaban predlžuje testy zrážavosti, ako protrombínový čas (PT), INR a aktivovaný parciálny tromboplastínový čas (aPTT). Zmeny pozorované v týchto testoch zrážavosti v očakávaných terapeutických dávkach sú malé a podliehajú vysokému stupňu variability. Neodporúčajú sa
na hodnotenie farmakodynamických účinkov apixabanu. V teste na tvorbu trombínu znížil apixaban potenciál endogénneho trombínu, mieru tvorby trombínu v ľudskej plazme.
Apixaban vykazuje aj anti-FXa aktivitu, čo je zrejmé zo zníženia enzýmovej aktivity faktora Xa
v mnohých komerčných súpravách anti-FXa, avšak výsledky medzi jednotlivými súpravami sa líšia. Údaje z klinických štúdií sú dostupné len z chromogénneho testu Rotachrom® Heparin. Anti-FXa aktivita vykazuje blízky priamy lineárny vzťah s plazmatickou koncentráciou apixabanu,
s maximálnymi hodnotami v čase maximálnych koncentrácií apixabanu v plazme. Vzťah medzi plazmatickými koncentráciami apixabanu a anti-FXa aktivitou je približne lineárny v širokom rozpätí dávkovania apixabanu.
Tabuľka 3 zobrazuje očakávanú expozíciu v rovnovážnom stave a anti-faktorovú Xa aktivitu pre každú indikáciu. U pacientov užívajúcich apixaban na prevenciu VTE po náhrade bedrového alebo kolenného kĺbu výsledky ukazujú menej než 1,6-násobnú fluktuáciu od maximálnej k minimálnej úrovni. U pacientov s nevalvulárnou fibriláciou predsiení užívajúcich apixaban na prevenciu cievnej mozgovej príhody a systémovej embólie, výsledky ukazujú menej ako 1,7-násobnú fluktuáciu od maximálnej k minimálnej úrovni. U pacientov užívajúcich apixaban na liečbu DVT a PE alebo na prevenciu rekurentnej DVT a PE výsledky ukazujú menej ako 2,2-násobnú fluktuáciu od maximálnej k minimálnej úrovni.
Tabuľka 3: Očakávaná expozícia apixabanu v rovnovážnom stave a anti-faktorová Xa aktivita
Apix.
C
ma
x
(ng/ml)
Apix.
C
mi
n
(ng/ml)
Apix.
Anti-faktorová Xa aktivita, max. (IU/ml)
Apix.
Anti-faktorová Xa aktivita,
m
in. (IU/ml)
Medián [5., 95. percentil]
Prevencia VTE: elektívny chirurgický výkon na nahradenie bedrového alebo kolenného kĺbu
2,5 mg dvakrát denne
77 [41; 146] 51 [23; 109] 1,3 [0,67; 2,4] 0,84 [0,37; 1,8]
Prevencia cievnej mozgovej príhody a systémovej embólie: NVAF
2,5 mg dvakrát denne*
5 mg dvakrát denne
123 [69; 221] 79 [34; 162] 1,8 [1,0; 3,3] 1,2 [0,51; 2,4]
171 [91; 321] 103 [41; 230] 2,6 [1,4; 4,8] 1,5 [0,61; 3,4]
Liečba DVT, liečba PE a prevencia rekurentnej DVT a PE (VTEt)
2,5 mg dvakrát denne
5 mg dvakrát denne
10 mg dvakrát denne
67 [30; 153] 32 [11; 90] 1,0 [0,46; 2,5] 0,49 [0,17; 1,4]
132 [59; 302] 63 [22; 177] 2,1 [0,91; 5,2] 1,0 [0,33; 2,9]
251 [111; 572] 120 [41; 335] 4,2 [1,8; 10,8] 1,9 [0,64; 5,8]
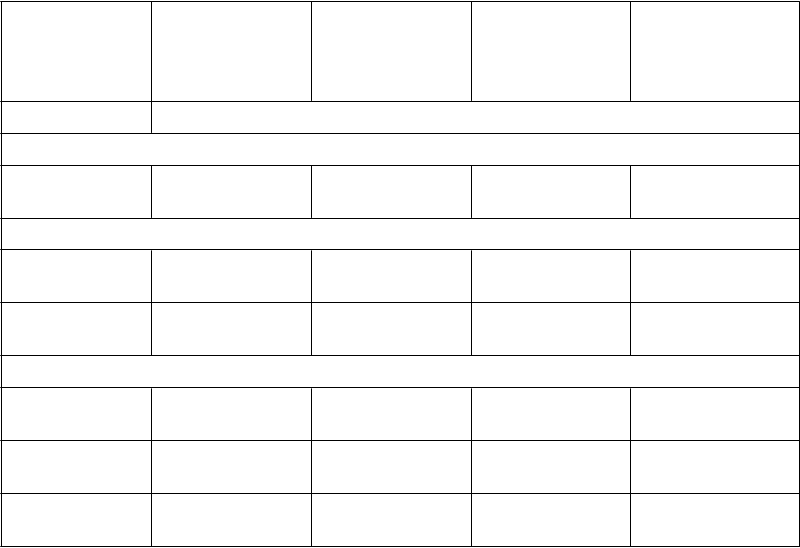
* Populácia so zníženou dávkou, ktorá je založená na 2 z 3 kritérií zníženia dávky v štúdii ARISTOTLE.
Hoci si liečba apixabanom nevyžaduje pravidelné monitorovanie expozície, kalibrovaný kvantitatívny test na anti-faktor Xa môže byť užitočný vo výnimočných situáciách, kedy znalosť expozície apixabanu môže pomôcť kvalifikovanému klinickému rozhodnutiu (napr. predávkovanie a urgentný chirurgický výkon).
Klinická účinnosť a bezpečnosťPrevencia VTE (VTEp): elektívny chirurgický výkon na nahradenie bedrového alebo kolenného kĺbuKlinický program s apixabanom bol navrhnutý tak, aby ukázal účinnosť a bezpečnosť apixabanu
v prevencii VTE u širokého spektra dospelých pacientov absolvujúcich elektívny chirurgický výkon
na náhradu bedrového alebo kolenného kĺbu. Celkové množstvo 8 464 pacientov sa randomizovalo do dvoch pivotných, dvojito zaslepených, medzinárodných štúdií porovnávajúcich 2,5 mg apixabanu
podávaného perorálne dvakrát denne (4 236 pacientov) alebo 40 mg enoxaparínu podávaného
jedenkrát denne (4 228 pacientov). Zahrnutých bolo 1 262 (618 v skupine s apixabanom) 75-ročných alebo starších pacientov, 1 004 pacientov (499 v skupine s apixabanom) s nízkou telesnou hmotnosťou (≤ 60 kg), 1 495 pacientov (743 v skupine s apixabanom) s BMI ≥ 33 kg/m2 a 415 pacientov (203
v skupine s apixabanom) so stredne ťažkou poruchou funkcie obličiek.
Štúdie ADVANCE-3 sa zúčastnilo 5 407 pacientov absolvujúcich elektívny chirurgický výkon na náhradu bedrového kĺbu a štúdie ADVANCE-2 sa zúčastnilo 3 057 pacientov absolvujúcich elektívny chirurgický výkon na náhradu kolenného kĺbu. Jedinci dostávali buď 2,5 mg apixabanu perorálne dvakrát denne, alebo 40 mg enoxaparín subkutánne jedenkrát denne. Prvá dávka apixabanu sa podávala 12 – 24 hodín po operácii, zatiaľ čo enoxaparín sa začal podávať 9 – 15 hodín pred operáciou. Apixaban aj enoxaparín sa v štúdii ADVANCE-3 podávali 32 – 38 dní a v štúdii ADVANCE-2 10-14 dní.
Podľa anamnestických údajov populácie skúmanej v štúdiách ADVANCE-3 a ADVANCE-2 (8 464 pacientov) malo 46 % hypertenziu, 10 % hyperlipidémiu, 9 % diabetes a 8 % chorobu koronárnych artérií.
V porovnaní s enoxaparínom apixaban pri elektívnej náhrade bedrového alebo kolenného kĺbu preukázal štatisticky vyššie zníženie primárneho koncového ukazovateľa, zloženého zo všetkých VTE (venózneho trombembolizmu)/všetkých prípadov úmrtí a hlavného koncového ukazovateľa VTE, zloženého z proximálnej DVT (distálnej venóznej trombózy), nefatálnej PE (pľúcnej embólie)
a úmrtia v súvislosti s VTE (pozri tabuľku 4).
Tabuľka 4: Výsledky účinnosti z pivotných štúdií fázy III
Štúdia ADVANCE-3 (bedrový kĺb) ADVANCE-2 (koleno)
Terapeutická dávka v štúdii
Dĺžka liečby
Apixaban
2,5 mg p.
o. dvakrát
denne
35 ± 3 dni
Enoxaparín
40 mg s. c. raz
denne
35 ± 3 dni
hodnota p Apixaban
2,5 mg p.
o. dvakrát
denne
12 ± 2 dni
Enoxaparín
40 mg s. c. raz
denne
12 ± 2 dni
hodnota p
Celkový počet VTE/všetkých prípadov úmrtí
Počet príhod/pacientov Miera výskytu príhod Relatívne riziko
95 % CI
27/1 949
1,39 %
0,36 (0,22; 0,54)
74/1 917
3,86 %
< 0,0001
147/976
15,06 %
0,62 (0,51; 0,74)
243/997
24,37 %
< 0,0001
Hlavný koncový ukazovateľ VTE
Počet príhod/pacientov Miera výskytu príhod Relatívne riziko
95 % CI
10/2 199
0,45 %
0,40 (0,15; 0,80)
25/2 195
1,14 %
0,0107
13/1 195
1,09 %
0,50 (0,26; 0,97)
26/1 199
2,17 %
0,0373
Bezpečnostné koncové ukazovatele rozsiahleho krvácania, zložené zo závažného a klinicky
významného nezávažného (clinically relevant non-major, CRNM) krvácania a všetkých príhod krvácania ukazujú podobné hodnoty u pacientov liečených 2,5 mg apixabanu v porovnaní so 40 mg
enoxaparínu (pozri tabuľku 5). Všetky kritériá krvácania zahŕňali krvácanie v mieste zákroku.
Tabuľka 5: Výsledky krvácania z pivotných štúdií fázy III*
ADVANCE-3 ADVANCE-2
Apixaban
2,5 mg
p. o. dvakrát denne
35 ± 3 dni
Enoxaparín
40 mg
s. c. raz denne
35 ± 3 dni
Apixaban
2,5 mg
p. o. dvakrát denne
12 ± 2 dni
Enoxaparín
40 mg
s. c. raz denne
12 ± 2 dni
Všetci liečení n = 2 673 n = 2 659 n = 1 501 n = 1 508
Obdobie liečby 1
Závažné 22 (0,8 %) 18 (0,7 %) 9 (0,6 %) 14 (0,9 %) Fatálne 0 0 0 0
Závažné + CRNM
129 (4,8 %) 134 (5,0 %) 53 (3,5 %) 72 (4,8 %)
Všetky 313 (11,7 %) 334 (12,6 %) 104 (6,9 %) 126 (8,4 %)
Pooperačné obdobie liečby 2
Závažné 9 (0,3 %) 11 (0,4 %) 4 (0,3 %) 9 (0,6 %) Fatálne 0 0 0 0
Závažné +
CRNM
96 (3,6 %) 115 (4,3 %) 41 (2,7 %) 56 (3,7 %)
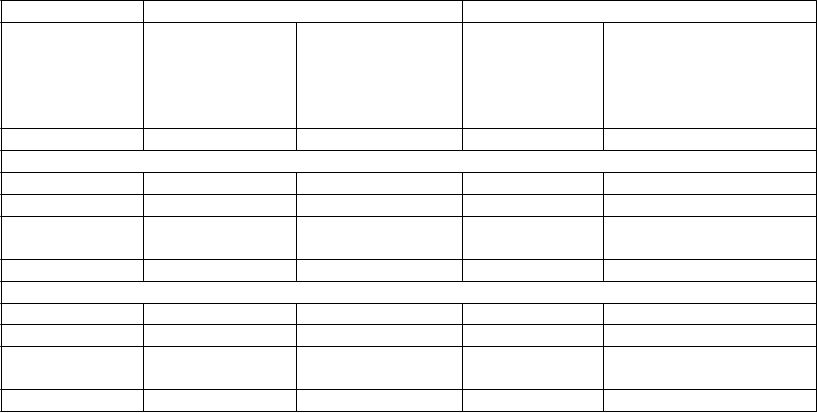

Všetky 261 (9,8 %) 293 (11,0 %) 89 (5,9 %) 103 (6,8 %)
* Všetky kritériá na hodnotenie krvácania zahŕňali aj krvácanie v mieste zákroku.
1 Zahŕňa príhody, ktoré sa objavili po prvej dávke enoxaparínu (pred operáciou).
2 Zahŕňa príhody, ktoré sa objavili po prvej dávke apixabanu (po operácii).
Celkový výskyt nežiaducich reakcií, ako krvácanie, anémia, abnormality hladín transamináz (napr. hladiny ALT) bol v štúdiách fázy II a III, pri elektívnom chirurgickom výkone na nahradenie bedrového alebo kolenného kĺbu, u pacientov liečených apixabanom numericky nižšie v porovnaní s enoxaparínom.
V štúdii s pacientmi absolvujúcimi náhradu kolenného kĺbu sa počas plánovaného obdobia liečby diagnostikovali v skupine s apixabanom 4 príhody pľúcnej embólie (PE) oproti žiadnemu prípadu v skupine s enoxaparínom. K tomuto vyššiemu počtu PE nemožno poskytnúť žiadne vysvetlenie.
Prevencia mozgovej príhody a systémovej embólie u pacientov s nevalvulárnou fibriláciou predsiení
(NVAF)
Celkovo 23 799 pacientov bolo randomizovaných do klinického programu (ARISTOTLE: porovnanie apixabanu a warfarínu, AVERROES: porovnanie apixabanu a ASA) zahŕňajúc 11 927 pacientov randomizovaných na apixaban. Program bol navrhnutý na preukázanie účinnosti a bezpečnosti apixabanu na prevenciu mozgovej príhody a systémovej embólie u pacientov s nevalvulárnou fibriláciou predsiení (NVAF) a s jedným alebo viacerými ďalšími rizikovými faktormi, ako:
· predchádzajúca mozgová príhoda alebo prechodný ischemický atak (TIA)
· vek ≥ 75 rokov
· hypertenzia
· diabetes mellitus
· symptomatické srdcové zlyhanie (NYHA trieda ≥ II)
ŠTÚDIA ARISTOTLE
V štúdii ARISTOTLE bolo celkovo 18 201 pacientov randomizovaných na dvojito zaslepenú liečbu apixabanom v dávke 5 mg dvakrát denne (alebo 2,5 mg dvakrát denne u vybraných pacientov [4,7 %], pozri časť 4.2) alebo warfarínom (cieľový rozsah INR 2,0 – 3,0). Pacienti boli v štúdii vystavení skúmanému liečivu v priemere 20 mesiacov. Priemerný vek bol 69,1 rokov, priemerné CHADS2 skóre bolo 2,1 a 18,9 % pacientov malo v minulosti mozgovú príhodu alebo TIA.
Apixaban v štúdii dosiahol štatisticky významnú prevahu v primárnom koncovom ukazovateli prevencie mozgovej príhody (hemoragickej alebo ischemickej) a systémovej embólie (pozri tabuľku 6) v porovnaní s warfarínom.
Tabuľka 6: Výsledky účinnosti u pacientov s fibriláciou predsiení v štúdii ARISTOTLE
Apixaban
N=
9 120
n (%/rok)
Warfarín
N=
9 081
n (%/rok)
Pomer rizika
(95 % IS) p-hodnota
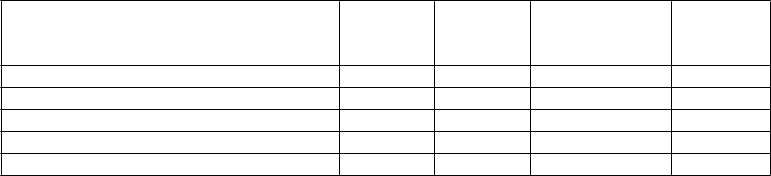
Mozgová príhoda alebo systémová embólia 212 (1,27) 265 (1,60) 0,79 (0,66; 0,95) 0,0114
Mozgová príhoda
Ischemická alebo nešpecifická 162 (0,97) 175 (1,05) 0,92 (0,74; 1,13) Hemoragická 40 (0,24) 78 (0,47) 0,51 (0,35; 0,75) Systémová embólia 15 (0,09) 17 (0,10) 0,87 (0,44; 1,75)
Medián percenta času, kedy boli pacienti randomizovaní na warfarín v terapeutickom rozsahu (TTR)
(INR 2 - 3), bol 66 %.
Apixaban preukázal zníženie mozgovej príhody a systémovej embólie v porovnaní s warfarínom naprieč rôznymi úrovňami TTR podľa centier; v rámci najvyššieho kvartilu TTR podľa centier bol pomer rizika pre apixaban oproti warfarínu 0,73 (95 % IS; 0,38; 1,40).
Kľúčové sekundárne koncové ukazovatele závažného krvácania a úmrtia z akejkoľvek príčiny sa testovali pomocou vopred špecifikovanej hierarchickej testovacej stratégie na kontrolu celkovej chyby typu I v klinickom skúšaní. Štatisticky významná prevaha sa tiež dosiahla v kľúčových sekundárnych
koncových ukazovateľoch závažného krvácania a tiež v úmrtí z akejkoľvek príčiny (pozri tabuľku 7). Pri zlepšenom sledovaní INR sa znížili pozorované benefity apixabanu v porovnaní s warfarínom týkajúce sa úmrtia z akejkoľvek príčiny.
Tabuľka 7: Sekundárne koncové ukazovatele u pacientov s fibriláciou predsiení v štúdii ARISTOTLE
Výsledky krvácania
Apixaban N = 9 088 n (%/rok)
Warfarín N = 9 052 n (%/rok)
Pomer rizika
(95 % IS)
p-hodnota
Závažné* 327 (2,13) 462 (3,09) 0,69 (0,60; 0,80) < 0,0001
Fatálne 10 (0,06) 37 (0,24) Intrakraniálne 52 (0,33) 122 (0,80)
Závažné + CRNM 613 (4,07) 877 (6,01) 0,68 (0,61; 0,75) < 0,0001
Všetky 2 356 (18,1) 3 060 (25,8) 0,71 (0,68; 0,75) < 0,0001
Iné koncové ukazovatele
Úmrtie z akejkoľvek príčiny
603 (3,52) 669 (3,94) 0,89 (0,80; 1,00) 0,0465
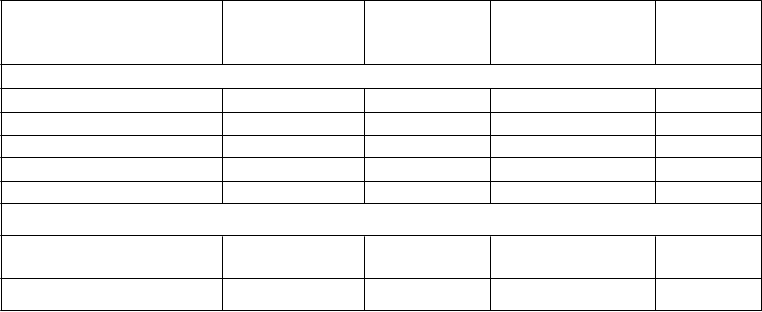
Infarkt myokardu 90 (0,53) 102 (0,61) 0,88 (0,66; 1,17)
*Závažné krvácanie definované podľa kritérií Medzinárodnej spoločnosti pre trombózu a hemostázu
(International Society on Thrombosis and Haemostasis - ISTH).
Celková miera prerušenia z dôvodu nežiaducich reakcií v štúdii ARISTOTLE bola 1,8 % pre apixaban a 2,6 % pre warfarín.
Výsledky účinnosti pre vopred špecifikované podskupiny, vrátane CHADS2 skóre, veku, telesnej hmotnosti, pohlavia, stavu funkcie obličiek, predchádzajúcej mozgovej príhody alebo TIA a diabetu, boli zhodné s primárnymi výsledkami účinnosti pre celkovú populáciu skúmanú v klinickom skúšaní.
Incidencia ISTH (International Society on Thrombosis and Haemostasis) definovaných závažných gastrointestinálnych krvácaní (vrátane krvácania do horného GI traktu, do dolného GI traktu
a rektálneho krvácania) bolo 0,76 %/rok na apixabane a 0,86 %/rok na warfaríne.
Výsledky závažného krvácania pre vopred špecifikované podskupiny, vrátane CHADS2 skóre, veku, telesnej hmotnosti, pohlavia, stavu funkcie obličiek, predchádzajúcej mozgovej príhody alebo TIA
a diabetu, boli zhodné s výsledkami pre celkovú populáciu skúmanú v klinickom skúšaní.
ŠTÚDIA AVERROESV štúdii AVERROES bolo randomizovaných celkovo 5 598 pacientov, považovaných skúšajúcimi za nevhodných pre VKA, na liečbu s apixabanom v dávke 5 mg dvakrát denne (alebo 2,5 mg dvakrát
denne u vybraných pacientov [6,4 %], pozri časť 4.2) alebo ASA. ASA sa podávala jedenkrát denne
v dávke 81 mg (64%), 162 (26,9 %), 243 (2,1 %) alebo 324 mg (6,6 %) podľa uváženia skúšajúceho. Pacienti boli vystavení skúmanému lieku v priemere 14 mesiacov. Priemerný vek bol 69,9 rokov, priemerné CHADS2 skóre bolo 2,0 a 13,6 % pacientov malo v minulosti mozgovú príhodu alebo TIA.
Časté dôvody nevhodnosti pre liečbu VKA v štúdii AVERROES zahŕňali neschopnosť/nepravdepodobnosť dosiahnutia INR v požadovaných intervaloch (42,6 %), pacient odmietol liečbu s VKA (37,4 %), CHADS2 skóre = 1 a lekár neodporučil VKA (21,3 %), na pacienta sa nedalo spoľahnúť, že bude užívať liek VKA podľa predpisu (15,0 %) a náročnosť/očakávaná náročnosť kontaktovania pacienta v prípade urgentnej zmeny dávky (11,7 %).
Štúdia AVERROES bola ukončená predčasne na základe odporúčania nezávislého Výboru pre monitorovanie údajov z dôvodu jasného dôkazu zníženia mozgovej príhody a systémovej embólie s prijateľným bezpečnostným profilom.
Celková miera prerušenia z dôvodu nežiaducich reakcií v štúdii AVERROES bola 1,5 % pre apixaban a 1,3 % pre ASA.
V štúdii dosiahol apixaban štatisticky významnú prevahu v primárnom koncovom ukazovateli prevencie mozgovej príhody (hemoragickej, ischemickej alebo nešpecifikovanej) alebo systémovej embólie (pozri tabuľku 8) v porovnaní s ASA.
Tabuľka 8: Kľúčové výsledky účinnosti u pacientov s fibriláciou predsiení v štúdii AVERROES
Apixaban
N = 2 807
n (%/rok)
ASA
N = 2 791
n (%/rok)
Pomer rizika
(95 % IS)
p- hodnota
Mozgová príhoda alebo systémová embólia*
Mozgová príhoda
51 (1,62) 113 (3,63) 0,45 (0,32; 0,62) < 0,0001
Ischemická alebo nešpecifická 43 (1,37) 97 (3,11) 0,44 (0,31; 0,63) Hemoragická 6 (0,19) 9 (0,28) 0,67 (0,24; 1,88)
Systémová embólia 2 (0,06) 13 (0,41) 0,15 (0,03; 0,68)
Mozgová príhoda, systémová embólia, IM alebo vaskulárne úmrtie*†
132 (4,21) 197 (6,35) 0,66 (0,53; 0,83) 0,003
Infarkt myokardu 24 (0,76) 28 (0,89) 0,86 (0,50; 1,48) Vaskulárne úmrtie 84 (2,65) 96 (3,03) 0,87 (0,65; 1,17)
Úmrtie z akejkoľvek príčiny † 111 (3,51) 140 (4,42) 0,79 (0,62; 1,02) 0,068
* Hodnotené sekvenčnou testovacou stratégiou navrhnutou na kontrolu celkovej chyby typu I v klinickom skúšaní
† Sekundárny koncový ukazovateľ.
V incidencii závažného krvácania sa nezistil žiadny štatisticky významný rozdiel medzi apixabanom a ASA (pozri tabuľku 9).
Tabuľka 9: Krvácavé udalosti u pacientov s fibriláciou predsiení v štúdii AVERROES
Apixaban N = 2 798 n (%/rok)
ASA
N = 2 780
n (%/rok)
Pomer rizika
(95 % IS)
p- hodnota

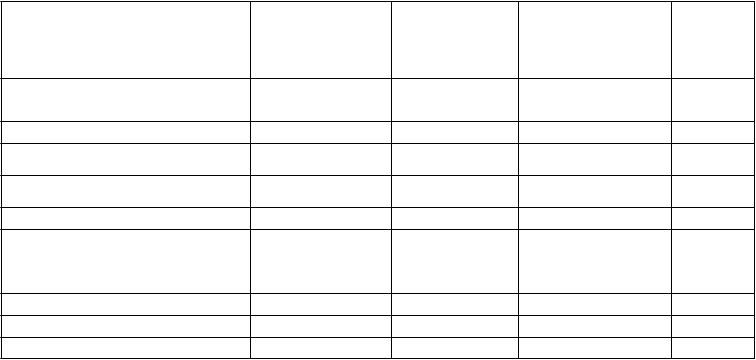
Závažné* 45 (1,41) 29 (0,92) 1,54 (0,96; 2,45) 0,0716
Fatálne, n 5 (0,16) 5 (0,16) Intrakraniálne, n 11 (0,34) 11 (0,35)
Závažné + CRNM† 140 (4,46) 101 (3,24) 1,38 (1,07; 1,78) 0,0144
Všetky 325 (10,85) 250 (8,32) 1,30 (1,10; 1,53) 0,0017
* Závažné krvácanie definované podľa kritérií Medzinárodnej spoločnosti pre trombózu a hemostázu (ISTH).
† Klinicky relevantné, nezávažné
Liečba DVT, liečba PE a prevencia rekurentnej DVT a PE (VTEt)Klinický program (AMPLIFY: apixaban oproti enoxaparínu/warfarínu, AMPLIFY-EXT: apixaban oproti placebu) bol navrhnutý tak, aby preukázal účinnosť a bezpečnosť apixabanu v liečbe DVT
a/alebo PE (AMPLIFY) a predĺženej terapie na prevenciu rekurentnej DVT a/alebo PE nasledujúcej po 6 až 12 mesiacoch antikoagulačnej liečby DVT a/alebo PE (AMPLIFY-EXT). Obidve štúdie boli
randomizované, dvojito zaslepené, multinárodné skúšania s paralelnými skupinami u pacientov so symptomatickou proximálnou DVT alebo symptomatickou PE. Všetky kľúčové ukazovatele bezpečnosti a účinnosti boli posudzované nezávislou zaslepenou komisiou.
ŠTÚDIA AMPLIFYV štúdii AMPLIFY bolo randomizovaných celkovo 5 395 pacientov liečených apixabanom 10 mg perorálne dvakrát denne počas 7 dní, po ktorých nasledovala liečba apixabanom 5 mg perorálne dvakrát denne počas 6 mesiacov, alebo enoxaparínom v dávke 1 mg/kg dvakrát denne subkutánne počas minimálne 5 dní (do INR ≥ 2) a warfarínom (cieľový rozsah INR 2,0 – 3,0) perorálne počas
6 mesiacov.
Priemerný vek bol 56,9 rokov a 89,8 % randomizovaných pacientov malo nevyprovokované príhody
VTE.
U pacientov randomizovaných na warfarín bolo priemerné percentuálne vyjadrenie času
v terapeutickom rozsahu (INR 2,0 – 3,0) 60,9. Pri apixabane sa preukázalo zníženie výskytu rekurentnej symptomatickej VTE alebo úmrtia súvisiaceho s VTE naprieč rôznymi úrovňami TTR podľa centier; v rámci najvyššieho kvartilu TTR podľa centier bolo relatívne riziko pri apixabane oproti enoxaparínu/warfarínu 0,79 (95 % IS, 0,39; 1,61).
V štúdii sa preukázalo, že apixaban je noninferiórny voči enoxaparínu/warfarínu v kombinovanom primárnom cieľovom ukazovateli posudzovanej rekurentnej VTE (DVT bez fatálneho konca alebo PE bez fatálneho konca) alebo úmrtia súvisiaceho s VTE (pozri tabuľku 10).
Tabuľka 10: Výsledky účinnosti v štúdii AMPLIFY
Apixaban N = 2 609 n (%)
Enoxaparín/
warfarín
N = 2 635
 n (%)
Relatívne riziko
(95 % IS)
n (%)
Relatívne riziko
(95 % IS)
VTE alebo úmrtie súvisiace s VTE
59 (2,3) 71 (2,7) 0,84 (0,60; 1,18)*
DVT 20 (0,7) 33 (1,2) PE 27 (1,0) 23 (0,9)
Úmrtie súvisiace s VTE
VTE alebo úmrtie
z akejkoľvek príčiny
Úmrtie súvisiace s VTE alebo CV
VTE, úmrtie súvisiace s VTE alebo závažné krvácanie
12 (0,4) 15 (0,6)
84 (3,2) 104 (4,0) 0,82 (0,61; 1,08)
61 (2,3) 77 (2,9) 0,80 (0,57; 1,11)
73 (2,8) 118 (4,5) 0,62 (0,47; 0,83)
* Noniferiórne v porovnaní s enoxaparínom/warfarínom (hodnota p < 0,0001)
Účinnosť apixabanu bola v úvodnej liečbe VTE konzistentná medzi pacientmi, ktorí sa liečili na PE
[relatívne riziko 0,9; 95 % IS (0,5; 1,6)] alebo DVT [relatívne riziko 0,8; 95 % IS (0,5; 1,3)]. Účinnosť v podskupinách zahŕňajúcich vek, pohlavie, index telesnej hmotnosti (BMI), funkciu obličiek, rozsah
indexu PE, polohu DVT trombu a predchádzajúce používanie parenterálneho heparínu bola vo všeobecnosti konzistentná.
Primárnym cieľovým ukazovateľom bezpečnosti bolo závažné krvácanie. V štúdii bol apixaban štatisticky superiórny voči enoxaparínu/warfarínu v primárnom cieľovom ukazovateli bezpečnosti
[relatívne riziko 0,31; 95 % interval spoľahlivosti (0,17; 0,55), hodnota p < 0,0001] (pozri tabuľku 11).
Tabuľka 11: Výsledky krvácania v štúdii AMPLIFY
Apixaban N = 2 676 n (%)
Enoxaparín/
warfarín
N = 2 689
n (%)
Relatívne riziko
(95 % IS)
Závažné 15 (0,6) 49 (1,8) 0,31 (0,17; 0,55) Závažné + CRNM 115 (4,3) 261 (9,7) 0,44 (0,36; 0,55) Nezávažné 313 (11,7) 505 (18,8) 0,62 (0,54; 0,70)
Všetky 402 (15,0) 676 (25,1) 0,59 (0,53; 0,66)
Posudzované závažné krvácanie a CRNM krvácanie v ktoromkoľvek anatomickom mieste bolo vo
všeobecnosti nižšie v skupine s apixabanom na základe porovnania s enoxaparínom/warfarínom. Posudzované závažné ISTH gastrointestinálne krvácanie sa objavilo u 6 (0,2 %) pacientov liečených
apixabanom a 17 (0,6 %) pacientov liečených enoxaparínom/warfarínom.
ŠTÚDIA AMPLIFY-EXT
V štúdii AMPLIFY-EXT bolo randomizovaných celkovo 2 482 pacientov na liečbu apixabanom
2,5 mg perorálne dvakrát denne, apixabanom 5 mg perorálne dvakrát denne alebo placebom počas
12 mesiacov po dokončení 6 až 12 mesiacov úvodnej antikoagulačnej liečby. Z týchto pacientov sa
836 pacientov (33,7 %) zúčastnilo štúdie AMPLIFY pred zaradením do štúdie AMPLIFY-EXT.
Priemerný vek bol 56,7 rokov a 91,7 % randomizovaných pacientov malo nevyprovokované príhody
VTE.
V štúdii boli obidve dávky apixabanu štatisticky superiórne voči placebu v primárnom cieľovom ukazovateli rekurentnej symptomatickej VTE (DVT bez fatálneho konca alebo PE bez fatálneho konca) alebo úmrtia z akejkoľvek príčiny (pozri tabuľku 12).
Tabuľka 12: Výsledky účinnosti v štúdii AMPLIFY-EXT
Apixaban Apixaban Placebo Relatívne riziko (95 % IS)
2,5 mg
(
N = 840)
5,0 mg
(
N = 813) (N = 829)
n (%)
Apix 2,5 mg oproti placebu
Apix 5,0 mg oproti placebu
Rekurentná VTE alebo úmrtie
z akejkoľvek príčiny
19 (2,3) 14 (1,7) 77 (9,3) 0,24 (0,15; 0,40)¥
0,19 (0,11; 0,33)¥
DVT* 6 (0,7) 7 (0,9) 53 (6,4)
PE* 7 (0,8) 4 (0,5) 13 (1,6)

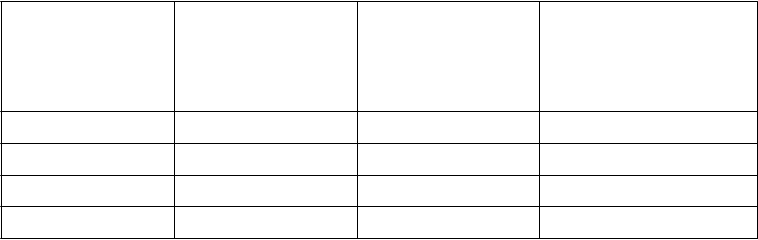
Úmrtie z akej- koľvek príčiny
Rekurentná VTE alebo úmrtie súvisiace
s VTE
6 (0,7) 3 (0,4) 11 (1,3)
14 (1,7) 14 (1,7) 73 (8,8) 0,19 (0,11; 0,33)
0,20 (0,11; 0,34)
Apixaban Apixaban Placebo Relatívne riziko (95 % IS)
2,5 mg
(
N = 840)
5,0 mg
(
N = 813) (N = 829)
Apix 2,5 mg oproti placebu
Apix 5,0 mg oproti placebu
Rekurentná VTE alebo úmrtie súvisiace
s CV
DVT bez fatálneho konca†
PE bez fatálneho konca†
Úmrtie súvisiace s VTE
¥ hodnota p < 0,0001
14 (1,7) 14 (1,7) 76 (9,2) 0,18 (0,10; 0,32)
6 (0,7) 8 (1,0) 53 (6,4) 0,11 (0,05; 0,26)
8 (1,0) 4 (0,5) 15 (1,8) 0,51 (0,22; 1,21)
2 (0,2) 3 (0,4) 7 (0,8) 0,28 (0,06; 1,37)
0,19 (0,11; 0,33)
0,15 (0,07; 0,32)
0,27 (0,09; 0,80)
0,45 (0,12; 1,71)
* U pacientov s viac ako jednou príhodou prispievajúcou ku kompozitnému cieľovému ukazovateľu sa hlásila len prvá príhoda (napr. ak sa u jedinca objavila DVT a potom aj PE, hlásila sa len DVT)
† U konkrétnych jednotlivcov sa mohla objaviť viac ako jedna udalosť a mohla byť uvedená v obidvoch klasifikáciách.
Účinnosť apixabanu na prevenciu rekurentnej VTE sa naprieč podskupinami zahŕňajúcimi vek, pohlavie, BMI a funkciu obličiek zachovala.
Primárnym cieľovým ukazovateľom bezpečnosti bolo závažné krvácanie počas obdobia liečby. Výskyt závažného krvácania pri obidvoch dávkach apixabanu sa v štúdii štatisticky neodlišoval od placeba. Neobjavil sa žiadny štatisticky významný rozdiel vo výskyte závažného + CRNM krvácania, nezávažného krvácania a všetkých krvácaní medzi pacientami liečenými 2,5 mg apixabanu dvakrát denne a pacientami užívajúcimi placebo (pozri tabuľku 13).
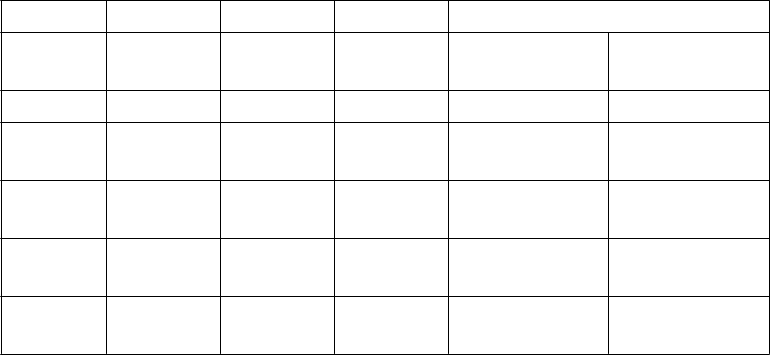
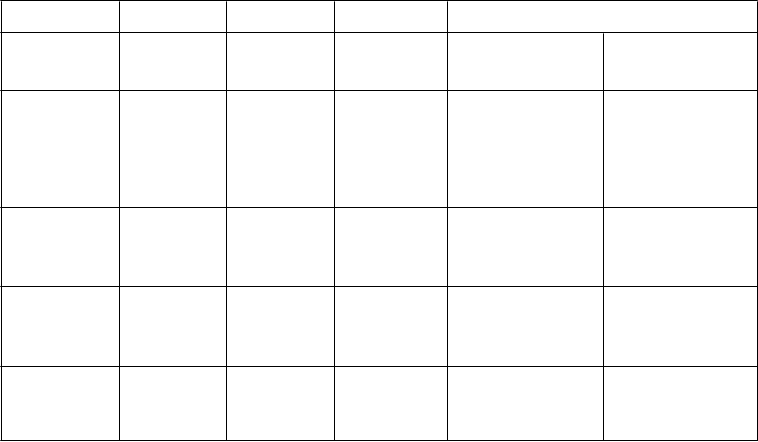
Tabuľka 13: Výsledky krvácania v štúdii AMPLIFY-EXT
Apixaban Apixaban Placebo Relatívne riziko (95 % IS)
2,5 mg
(N = 840)
5,0 mg
(N = 811) (N = 826)
n (%)
Apix 2,5 mg
oproti placebu
Apix 5,0 mg
oproti placebu
Závažné 2 (0,2) 1 (0,1) 4 (0,5) 0,49 (0,09; 2,64)
0,25 (0,03; 2,24)
Závažné + CRNM
27 (3,2) 35 (4,3) 22 (2,7) 1,20 (0,69; 2,10)
1,62 (0,96; 2,73)
Nezávažné 75 (8,9) 98 (12,1) 58 (7,0) 1,26 (0,91; 1,75)
Všetky 94 (11,2) 121 (14,9) 74 (9,0) 1,24 (0,93; 1,65)
1,70 (1,25; 2,31)
1,65 (1,26; 2,16)
Posudzované závažné ISTH gastrointestinálne krvácanie sa objavilo u 1 (0,1 %) pacienta liečeného
apixabanom v dávke 5 mg dvakrát denne, v dávke 2,5 mg dvakrát denne sa táketo krvácanie neobjavilo u žiadneho pacienta a objavilo sa u 1 (0,1 %) pacienta užívajúceho placebo.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Eliquisom v jednej
alebo vo viacerých podskupinách pediatrickej populácie v prípade venóznej alebo arteriálnej embólie a trombózy (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absolútna biologická dostupnosť apixabanu je približne 50 % pri dávkach do 10 mg. Apixaban sa absorbuje rýchlo s maximálnymi koncentráciami (cmax) objavujúcimi sa 3 až 4 hodiny po užití tablety. Pri dávke 10 mg užitie s jedlom neovplyvňuje AUC alebo cmax. Apixaban sa môže užívať s jedlom alebo bez jedla.
Apixaban vykazuje lineárnu farmakokinetiku so zvyšovaním expozície priamo úmerne k dávke pri perorálnych dávkach do 10 mg. Pri dávkach ( 25 mg apixaban vykazuje disolučne limitovanú absorpciu so zníženou biologickou dostupnosťou. Parametre expozície apixabanu vykazujú nízku až strednú variabilitu. čo sa odráža v inraindividuálnej (~ 20 % CV) a interindividuálnej variabilite
(~ 30 % CV).
Po podaní 10 mg apixabanu perorálne vo forme 2 rozdrvených 5 mg tabliet rozpustených v 30 ml
vody bola expozícia porovnateľná s expozíciou po perorálnom podaní 2 celých 5 mg tabliet. Po podaní
10 mg apixabanu perorálne vo forme 2 rozdrvených 5 mg tabliet rozmiešaných v 30 g jablčného pyré bola Cmax o 20 % nižšia a AUC o 16 % nižšia v porovnaní s podaním 2 celých 5 mg tabliet. Zníženie expozície sa nepovažuje za klinicky relevantné.
Po podaní rozdrvenej 5 mg tablety apixabanu rozpustenej v 60 ml D5W a podanej cez nazogastrickú trubicu bola expozícia podobná ako expozícia pozorovaná v iných klinických štúdiách zahŕňajúcich zdravých jedincov dostávajúcich jednorazovú dávku apixabanu 5 mg perorálne.
Na základe predpokladaného farmakokinetického profilu apixabanu v závislosti od dávky sú výsledky biologickej dostupnosti z vykonaných štúdií použiteľné pri nižších dávkach apixabanu.
Distribúcia
Väzba na plazmatické proteíny u ľudí je približne 87 %. Distribučný objem (Vss) je približne 21 litrov.
Biotransformácia a eliminácia
Apixaban má viacero spôsobov eliminácie. Z podanej dávky apixabanu u ľudí sa približne 25 % mení na metabolity, väčšina metabolitov sa vylučuje stolicou. Renálna exkrécia apixabanu tvorí približne
27 % celkového klírensu. V klinických a predklinických štúdiách sa pozorovali ďalšie spôsoby exkrécie – biliárna a priama intestinálna.
Apixaban má celkový klírens okolo 3,3 l/h a eliminačný polčas približne 12 hodín.
O-demetylácia a hydroxylácia na mieste 3-oxopiperidinylu sú hlavnými miestami biotransformácie. Apixaban sa metabolizuje najmä prostredníctvom CYP3A4/5, s miernym prispením CYP1A2, 2C8,
2C9, 2C19 a 2J2. V ľudskej plazme je najdôležitejšou zložkou nezmenený apixaban bez prítomnosti aktívnych cirkulujúcich metabolitov. Apixaban je substrátom transportných proteínov, P-gp a proteínu zodpovedného za rezistenciu pri rakovine prsníka (breast cancer resistance protein, BCRP).
Porucha funkcie obličiek
Nepozoroval sa žiadny vplyv porušenej funkcie obličiek na maximálnu plazmatickú koncentráciu apixabanu. Stanovením klírensu kreatinínu sa zistilo, že zvýšenie expozície apixabanu korelovalo so znížením funkcie obličiek. U jedincov s ľahkým (klírens kreatinínu 51 – 80 ml/min), stredne ťažkou (klírens kreatinínu 30 – 50 ml/min) a ťažkou (klírens kreatinínu 15 – 29 ml/min) poruchou
funkcie obličiek sa plazmatické koncentrácie (AUC) apixabanu, v porovnaní s jedincami s normálnym
klírensom kreatinínu, zvýšili o 16, 29 a 44 % v uvedenom poradí. Porucha funkcie obličiek nemala žiadny evidentný vplyv na vzťah medzi plazmatickou koncentráciou apixabanu a anti-FXa aktivitou.
U osôb s terminálnym štádiom ochorenia obličiek (end-stage renal disease - ESRD) sa AUC apixabanu zvýšila o 36 %, keď sa podávala jednorazová dávka apixabanu 5 mg bezprostredne po hemodialýze v porovnaní s AUC pozorovanou u osôb s normálnou funkciou obličiek. Hemodialýza, ktorá začala dve hodiny po podaní jednorazovej dávky 5 mg apixabanu, znížila AUC apixabanu o
14 % u týchto pacientov s ESRD, čo zodpovedá klírensu apixabanu dialýzou 18 ml/min. Preto je nepravdepodobné, že by hemodialýza bola účinným prostriedkom pri liečbe predávkovania apixabanu.
Porucha funkcie pečeneV štúdii, ktorá porovnávala 8 jedincov s ľahkou poruchou funkcie pečene (Childovo-Pughovo skóre 5 (n = 6) a 6 (n = 2)) a 8 jedincov so stredne ťažkou poruchou funkcie pečene (Childovo–Pughovo skóre
B 7 (n = 6) a 8 (n = 2)) so 16 zdravými jedincami kontrolnej skupiny sa farmakokinetika
a farmakodynamika dávky 5 mg apixabanu u jedincov s poruchou funkcie pečene nezmenila. Zmeny v anti-FXa aktivite a INR boli medzi jedincami s ľahkým až stredne ťažkou poruchou funkcie pečene
a zdravými jedincami porovnateľné.
Starší pacientiStarší pacienti (nad 65 rokov) vykazovali vyššie plazmatické koncentrácie ako mladší pacienti s priemernými hodnotami AUC vyššími približne o 32 % a žiadny rozdiel v Cmax.
PohlavieExpozícia apixabanu bola približne o 18 % vyššia u žien ako u mužov.
Etnický pôvod a rasaVýsledky v štúdiách fázy I neukázali odlíšiteľné rozdiely vo farmakokinetike medzi belochmi, aziatmi a černochmi. Závery z analýzy farmakokinetiky u pacientov, ktorým sa podal apixaban boli zvyčajne
konzistentné s výsledkami fázy I.
Telesná hmotnosťV porovnaní s expozíciou apixabanu u jedincov s telesnou hmotnosťou 65 až 85 kg, u jedincov s telesnou hmotnosťou > 120 kg bola expozícia apixabanu približne o 30 % nižšia a u jedincov
s hmotnosťou < 50 kg bola expozícia približne o 30 % vyššia.
Farmakokinetický/farmakodynamický vzťah
Vzťah farmakokinetiky/farmakodynamiky (FK/FD) medzi koncentráciou apixabanu v plazme
a niekoľkými farmakodynamickými koncovými ukazovateľmi (anti-FXa aktivita, INR, PT, aPTT) sa hodnotil po podaní širokého rozpätia dávok (0,5 – 50 mg). Vzťah medzi koncentráciou apixabanu
v plazme a anti-FXa aktivitou sa najlepšie popísal lineárnym modelom. Vzťah FK/FD pozorovaný
u pacientov bol konzistentný s výsledkami u zdravých jedincov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, fertility a embryo-fetálneho vývoja a juvenilnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Najvýznamnejšie pozorované účinky v štúdiách toxicity po opakovanom podávaní boli také, ktoré súviseli s farmakologickým pôsobením apixabanu na koagulačné parametre krvi. V štúdiách toxicity sa zistilo malé až žiadne zvýšenie tendencie ku krvácavosti. Keďže to môže byť spôsobené nižšou citlivosťou druhov použitých predklinických štúdiách v porovnaní s ľuďmi, pri extrapolácii na ľudí sa má tento výsledok interpretovať s opatrnosťou.
6. FARAMCEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety: Bezvodá laktóza
Mikrokryštalická celulóza (E 460) Sodná soľ kroskarmelózy
Nátriumlaurylsulfát
Magnéziumstearát (E 470b)
Filmový obal: Monohydrát laktózy Hypromelóza (E 464) Oxid titaničitý (E 171) Triacetín (E 1518)
Žltý oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Blistre ALU-PVC/PVdC. Škatuľky po 10, 20, 60, 168 a 200 filmom obalených tabliet. Perforované ALU-PVC/PVdC blistre s oddelenými jednotlivými dávkami s obsahom 60 alebo
100 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Bristol-Myers Squibb/Pfizer EEIG, Bristol-Myers Squibb House, Uxbridge Business Park, Sanderson Road,Uxbridge, Middlesex UB8 1DH
Veľká Británia
8. REGISTRAČNÉ ČÍSLO
EU/1/11/691/001
EU/1/11/691/002
EU/1/11/691/003
EU/1/11/691/004
EU/1/11/691/005
EU/1/11/691/013
EU/1/11/691/015
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 18. máj 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Eliquis 5 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 5 mg apixabanu. Pomocné látky so známym účinkom
Každá 5 mg filmom obalená tableta obsahuje 102,86 mg laktózy (pozri časť 4.4).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Ružové, oválne tablety na jednej strane označené „894“ a „5“ na strane druhej.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Prevencia mozgovej príhody a systémovej embólie u dospelých pacientov s nevalvulárnou fibriláciou predsiení (non-valvular atrial fibrillation - NVAF) s jedným alebo viacerými rizikovými faktormi, ako napríklad prekonaná cievna mozgová príhoda alebo tranzitórny ischemický atak (TIA); vek
≥ 75 rokov; hypertenzia, diabetes mellitus; symptomatické srdcové zlyhanie (NYHA trieda ≥ II).
Liečba hlbokej venóznej trombózy (deep vein thrombosis, DVT) a pľúcnej embólie (PE) a prevencia rekurentnej DVT a PE u dospelých (hemodynamicky nestabilní pacienti s PE, pozri časť 4.4).
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Prevencia mozgovej príhody a systémovej embólie u pacientov s nevalvulárnou fibriláciou predsiení
(NVAF)
Odporúčaná dávka je 5 mg apixabanu, ktorá sa užíva perorálne dvakrát denne.
Zníženie dávky
U pacientov s NVAF a minimálne s dvoma nasledujúcimi charakteristikami: vek ≥ 80 rokov, telesná hmotnosť ≤ 60 kg alebo sérový kreatinín ≥ 1,5 mg/dl (133 mikromol/l) je odporúčaná dávka
apixabanu 2,5 mg užívaná perorálne dvakrát denne.
Liečba má pokračovať dlhodobo.
Liečba DVT, liečba PE a prevencia rekurentnej DVT a PE (VTEt)
Odporúčaná dávka apixabanu na liečbu akútnej DVT a liečbu PE je 10 mg užívaných perorálne dvakrát denne počas prvých 7 dní, po ktorých nasleduje 5 mg užívaných perorálne dvakrát denne. Na
základe dostupných lekárskych odporúčaní sa má krátke trvanie liečby (minimálne 3 mesiace)
zakladať na prítomnosti dočasných rizikových faktorov (napr. chirurgický zákrok v nedávnej minulosti, trauma, imobilizácia).
Odporúčaná dávka apixabanu na prevenciu rekurentnej DVT a PE je 2,5 mg užívaných perorálne dvakrát denne. Ak sa indikuje na prevenciu rekurentnej DVT a PE, dávka 2,5 mg dvakrát denne sa má
začať podávať po ukončení 6-mesačnej liečby apixabanom dávkou 5 mg dvakrát denne alebo iným antikoagulantom, ako je to vyznačené v tabuľke 1 nižšie (pozri tiež časť 5.1).
Tabuľka 1:
Dávkovací režim Maximálna denná dávka
Liečba DVT alebo PE 10 mg dvakrát denne počas prvých
7 dní,
po ktorých nasleduje 5 mg dvakrát denne
20 mg
10 mg
Prevencia rekurentnej DVT a/alebo PE po ukončení 6- mesačnej liečby DVT alebo PE
2,5 mg dvakrát denne 5 mg

Dĺžka trvania celkovej liečby má byť individuálne nastavená po starostlivom zhodnotení prínosu
liečby oproti riziku krvácania (pozri časť 4.4).
Vynechanie dávkyAk sa vynechá dávka, pacient má užiť Eliquis okamžite a potom pokračovať v užívaní dvakrát denne ako predtým.
Zmena liečbyZmena liečby z parenterálnych antikoagulancií na Eliquis (a naopak) sa môže uskutočniť pri ďalšej plánovanej dávke (pozri časť 4.5). Tieto lieky sa nemajú podávať súbežne.
Zmena liečby antagonistom vitamínu K (VKA) na EliquisPri zmene liečby z antagonistu vitamínu K (VKA) na Eliquis sa má prerušiť liečba warfarínom alebo iná liečba s VKA a liečba Eliquisom sa má začať vtedy, keď je medzinárodný normalizovaný index
(INR) < 2.
Zmena liečby z Eliquisu na liečbu VKAPri zmene liečby z Eliquisu na liečbu VKA sa má pokračovať v podávaní Eliquisu minimálne 2 dni po začatí liečby VKA. Po 2 dňoch súčasného podávania Eliquisu s liečbou VKA, sa má vyšetriť INR pred
ďalšou plánovanou dávkou Eliquisu. Súčasné podávanie Eliquisu a liečby VKA má pokračovať,
dokiaľ sa nedosiahne hodnota INR ≥ 2.
Porucha funkcie obličiekU pacientov s ľahkou alebo stredne ťažkou poruchou funkcie obličiek nie je potrebná úprava dávky
(pozri časť 5.2).
Na pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu 15 – 29 ml/mm) sa vzťahujú nasledujúce odporúčania (pozri časti 4.4 a 5.2):
- na liečbu DVT, liečbu PE a prevenciu rekurentnej DVT a PE (VTEt) sa má apixaban používať s opatrnosťou,
- na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF:
- pacienti majú dostávať nižšiu dávku apixabanu 2,5 mg dvakrát denne,
- pacienti s kreatinínom v sére ≥ 1,5 mg/dl (133 mikromol/l), čo súvisí s vekom ≥ 80 rokov
alebo telesnou hmotnosťou ≤ 60 kg majú tiež užívať nižšiu dávku apixabanu 2,5 mg dvakrát denne.
U pacientov s klírensom kreatinínu < 15 ml/min alebo u pacientov podstupujúcich dialýzu nie sú k dispozícii žiadne klinické skúsenosti, preto sa apixaban u týchto pacientov neodporúča (pozri časti 4.4 a 5.2).
Porucha funkcie pečene
Eliquis je kontraindikovaný u pacientov s ochorením pečene spojeným s koagulopatiou a klinicky významným rizikom krvácania (pozri časť 4.3).
Neodporúča sa u pacientov s ťažkou poruchou funkcie pečene (pozri časti 4.4 a 5.2).
U pacientov s ľahkou alebo stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre A alebo B) sa má používať s opatrnosťou. U pacientov s ľahkou alebo stredne ťažkou poruchou funkcie pečene sa úprava dávky nevyžaduje (pozri časti 4.4 a 5.2).
Pacienti so zvýšenou hladinou pečeňových enzýmov alanínaminotransferázy (ALT)/aspartátaminotransferázy (AST) > 2 x ULN (ULN – upper limit of normal, horná hranica referenčného rozpätia) alebo celkového bilirubínu ≥ 1,5 x ULN boli vylúčení z klinických štúdií. Preto sa má Eliquis u týchto pacientov používať s opatrnosťou (pozri časti 4.4 a 5.2). Pred začatím liečby Eliquisom sa má uskutočniť vyšetrenie funkcie pečene ako súčasť štandardného klinického
hodnotenia.
Telesná hmotnosť
VTEt – Úprava dávky sa nevyžaduje (pozri časti 4.4 a 5.2).
NVAF – Úprava dávky sa nevyžaduje, pokiaľ nevyhovuje kritériám pre zníženie dávky (pozri
Zníženie dávky na začiatku časti 4.2).
Pohlavie
Úprava dávky sa nevyžaduje (pozri časť 5.2).
Starší pacienti
VTEt – Úprava dávky sa nevyžaduje (pozri časti 4.4 a 5.2).
NVAF – Úprava dávky sa nevyžaduje, pokiaľ nevyhovuje kritériám pre zníženie dávky (pozri
Zníženie dávky na začiatku časti 4.2).
Kardioverzia (NVAF)
Pacienti môžu apixaban užívať aj počas kardioverzie.
Pediatrická populácia
Bezpečnosť a účinnosť Eliquisu u detí a dospievajúcich vo veku do 18 rokov sa nestanovila. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Perorálne použitie.
Eliquis sa má prehltnúť a zapiť vodou, s jedlom alebo bez jedla.
Pacienti, ktorí nedokážu prehltnúť celé tablety, môžu tablety Eliquisu rozdrviť a rozpustiť vo vode, v 5 % dextróze vo vode (D5W) alebo v jablčnom džúse alebo rozmiešať v jablčnom pyré a ihneď vypiť (pozri časť 5.2). Alternatívne sa tablety Eliquisu môžu rozdrviť a rozpustiť v 60 ml vody alebo D5W a ihneď podať cez nazogastrickú trubicu (pozri časť 5.2). Rozdrvené tablety Eliquisu sú stabilné vo vode, D5W, jablčnom džúse a jablčnom pyré do 4 hodín.
4.3 Kontraindikácie
· Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
· Aktívne klinicky významné krvácanie.
· Ochorenie pečene spojené s koagulopatiou a klinicky významným rizikom krvácania (pozri časť 5.2).
· Lézia alebo ochorenie, ak sa považuje za významný rizikový faktor závažné krvácanie. To môže zahŕňať súčasnú alebo nedávnu gastrointestinálnu ulceráciu, prítomnosť malígnych novotvarov
s vysokým rizikom krvácania, nedávne poranenie mozgu alebo chrbtice, nedávny chirurgický
zákrok na mozgu, mieche alebo očiach, nedávnu intrakraniálnu hemorágiu, známe alebo suspektné ezofagálne varixy, artériovenózne malformácie, vaskulárne aneuryzmy alebo významné intraspinálne alebo intracerebrálne vaskulárne abnormality.
· Súbežná liečba s akoukoľvek inou antikoagulačnou látkou napr. nefrakcionovaným heparínom (unfractionated heparin - UFH), heparínmi s nízkou molekulárnou hmotnosťou (enoxaparín, dalteparín atď.), derivátmi heparínu (fondaparín atď.), perorálnymi antikoagulanciami (warfarín,
rivaroxaban, dabigatran atď.) okrem špecifických okolností vyžadujúcich zmenu antikoagulačnej liečby (pozri časť 4.2) alebo keď sa UFH podáva v dávkach potrebných na udržanie priechodného centrálneho žilového alebo arteriálneho katétra (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Riziko krvácania
Tak ako pri iných antikoagulanciách, aj pri podávaní Eliquisu je potrebné pacientov pozorne sledovať pre príznaky krvácania. V prípadoch, kde je zvýšené riziko krvácania sa odporúča opatrnosť. Ak sa
objaví závažné krvácanie, podávanie Eliquisu sa má prerušiť (pozri časti 4.8 a 4.9).
Hoci si liečba apixabanom nevyžaduje pravidelné monitorovanie expozície, kalibrovaný kvantitatívny test na anti-faktor Xa môže byť užitočný vo výnimočných situáciách, kedy znalosť expozície apixabanu môže pomôcť kvalifikovanému klinickému rozhodnutiu, napr. predávkovanie a urgentný chirurgický výkon (pozri časť 5.1).
Interakcia s inými liekmi ovplyvňujúcimi hemostázu
Z dôvodu zvýšeného rizika krvácania je súbežná liečba inými antikoagulanciami kontraindikovaná
(pozri časť 4.3).
Súbežné používanie Eliquisu s protidoštičkovými liečivami zvyšuje riziko krvácania (pozri časť 4.5). Opatrnosť je nutná, ak sú pacienti súbežne liečení nesteroidnými antiflogistikami (non-steroidal anti-
inflammatory drugs, NSAIDs), vrátane kyseliny acetylsalicylovej.
Po chirurgickom zákroku sa neodporúča použiť iné inhibítory agregácie krvných doštičiek súbežne s Eliquisom (pozri časť 4.5).
U pacientov s atriálnou fibriláciou a ochoreniami, ktoré si vyžadujú protidoštičkovú liečbu jednou alebo dvoma liečivami, sa majú starostlivo posúdiť potenciálne prínosy a potenciálne riziká pred kombinovaním tejto liečby s Eliquisom.
V klinickom skúšaní u pacientov s atriálnou fibriláciou zvýšilo súbežné použitie ASA riziko závažného krvácania pri apixabane z 1,8 % za rok na 3,4 % za rok a zvýšilo riziko krvácania pri warfaríne z 2,7 % za rok na 4,6 % za rok. V tomto klinickom skúšaní bolo obmedzené (2,1 %) použitie súbežnej duálnej protidoštičkovej liečby.
V klinickom skúšaní u vysokorizikových pacientov po akútnom koronárnom syndróme charakterizovaných viacerými srdcovými a nesrdcovými komorbiditami, ktorí dostávali ASA alebo kombináciu ASA a klopidogrelu, sa zaznamenalo významné zvýšenie rizika ISTH (International Society on Thrombosis and Haemostasis) závažného krvácania pri apixabane (5,13 % za rok)
v porovnaní s placebom (2,04 % za rok).
Použitie trombolytík na liečbu akútnej ischemickej mozgovej príhody.
S použitím trombolytík na liečbu akútnej ischemickej mozgovej príhody u pacientov, ktorým sa podáva apixaban, existujú len veľmi obmedzené skúsenosti.
Pacienti s protetickými srdcovými chlopňami
Bezpečnosť a účinnosť Eliquisu sa neskúmali u pacientov s protetickými srdcovými chlopňami s atriálnou fibriláciou alebo bez nej. Z tohto dôvodu sa u týchto pacientov použitie Eliquisu neodporúča.
Chirurgický zákrok a invazívne procedúry
Eliquis sa má vysadiť najmenej 48 hodín pred elektívnym chirurgickým zákrokom alebo invazívnymi procedúrami so stredným alebo vysokým rizikom krvácania. To zahŕňa zákroky, pre ktoré nemožno
vylúčiť pravdepodobnosť klinicky významného krvácania alebo pre ktoré by bolo riziko krvácania
neprípustné.
Eliquis sa má vysadiť najmenej 24 hodín pred elektívnym chirurgickým zákrokom alebo invazívnymi procedúrami s nízkym rizikom krvácania. To zahŕňa zákroky, pri ktorých sa očakáva akékoľvek minimálne alebo ľahko zvládnuteľné krvácanie v nekritickým miestach.
Ak chirurgický zákrok alebo invazívne procedúry nie je možné odložiť, je potrebná primeraná opatrnosť s prihliadnutím na zvýšené riziko krvácania. Toto riziko krvácania sa má zvážiť oproti naliehavosti zákroku.
Eliquis sa môže znovu nasadiť čo najskôr po invazívnej procedúre alebo chirurgickom zákroku za podmienky, že to dovolí klinický stav a ak je ustálená primeraná hemostáza (informácie o kardioverzii pozri časť 4.2).
Dočasné prerušenie liečby
Prerušenie podávania antikoagulancií, vrátane Eliquisu, pre aktívne krvácanie, elektívny chirurgický zákrok alebo invazívne procedúry, vystavuje pacientov zvýšenému riziku trombózy. Prerušeniam liečby sa má zabrániť a ak sa musí z akéhokoľvek dôvodu podávanie antikoagulancií a Eliquisu dočasne prerušiť, liečba sa má čo najskôr znovu nasadiť.
Hemodynamicky nestabilní pacienti s PE alebo pacienti, u ktorých sa vyžaduje trombolýza alebopľúcna embolektómia
Eliquis sa neodporúča ako alternatíva k nefrakcionovanému heparínu u pacientov s pľúcnou embóliou, ktorí sú hemodynamicky nestabilní alebo môžu podstúpiť trombolýzu alebo pľúcnu embolektómiu, pretože sa bezpečnosť a účinnosť apixabanu v týchto klinických situáciách nestanovili.
Pacienti s aktívnou formou rakoviny
Účinnosť a bezpečnosť apixabanu pri liečbe DVT, liečbe PE a na prevenciu rekurentnej DVT a PE (VTEt) u pacientov s aktívnou formou rakoviny neboli stanovené.
Pacienti s poruchou funkcie obličiek
Obmedzené klinické údaje naznačujú, že plazmatické koncentrácie apixabanu sú zvýšené u pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu 15 – 29 ml/min), ktoré môže viesť
k zvýšenému riziku krvácania. Na liečbu DVT, liečbu PE a prevenciu rekurentnej DVT a PE (VTEt)
apixaban používať s opatrnosťou u pacientov s poruchou funkcie obličiek (klírens kreatinínu 15 –
29 ml/min) (pozri časti 4.2 a 5.2).
Na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF majú pacienti
s ťažkou poruchou funkcie obličiek (klírens kreatinínu 15 – 29 ml/min) a pacienti so sérovou hladinou kreatinínu ≥ 1,5 mg/dl (133 mikromol/l) súvisiacou s vekom ≥ 80 rokov alebo telesnou hmotnosťou
≤ 60 kg dostávať nižšiu dávku apixabanu 2,5 mg dvakrát denne (pozri časť 4.2).
U pacientov s klírensom kreatinínu ≤ 15 ml/min alebo u pacientov podstupujúcich dialýzu neexistujú žiadne klinické skúsenosti, preto sa apixaban neodporúča (pozri časti 4.2 a 5.2).
Starší pacienti
Zvyšujúci sa vek môže zvýšiť riziko krvácania (pozri časť 5.2).
Tiež súbežné podávanie Eliquisu s ASA u starších pacientov sa má používať opatrne z dôvodu potenciálne vyššieho rizika krvácania.
Telesná hmotnosť
Nízka telesná hmotnosť (< 60 kg) môže zvýšiť riziko krvácania (pozri časť 5.2).
Pacieti s poruchou funkcie pečene
Eliquis je kontraindikovaný u pacientov s ochorením pečene spojeným s koagulopatiou a klinicky významným rizikom krvácania (pozri časť 4.3).
Neodporúča sa u pacientov s ťažkou poruchou funkcie pečene (pozri časť 5.2).
U pacientov s ľahkou alebo stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre A
alebo B) sa má používať s opatrnosťou (pozri časti 4.2 a 5.2).
Pacienti so zvýšenou hladinou pečeňových enzýmov (ALT/AST > 2 x ULN) alebo celkového bilirubínu ≥ 1,5 x ULN boli vylúčení z klinických štúdií. Preto sa má Eliquis u týchto pacientov používať s opatrnosťou (pozri časť 5.2). Pred začatím liečby Eliquisom sa má uskutočniť vyšetrenie funkcie pečene ako súčasť štandardného klinického hodnotenia.
Interakcia s inhibítormi cytochrómu P450 3A4 (CYP3A4) a P-glykoproteínu (P-gp) Použitie Eliquisu sa neodporúča u pacientov súbežne užívajúcich systémovú liečbu silnými inhibítormi CYP3A4 a P-gp, ako azolové antimykotiká (napr. ketokonazol, itrakonazol, vorikonazol, pozakonazol) a inhibítory HIV proteáz (napr. ritonavir). Tieto liečivá môžu zvýšiť expozíciu apixabanu dvojnásobne (pozri časť 4.5), v prítomnosti ďalších faktorov, ktoré zvyšujú expozíciu apixabanu (napr. ťažká porucha funkcie obličiek), ešte viac.
Interakcia s induktormi CYP3A4 a P-gp
Súbežné použitie Eliquisu so silnými induktormi CYP3A4 a P-gp (napr. rifampicín, fenytoín, karbamazepín, fenobarbital alebo ľubovník bodkovaný) môže viesť k ~50 % zníženiu expozície apixabanu. V klinickom skúšaní u pacientov s atriálnou fibriláciou sa pozorovala znížená účinnosť
a vyššie riziko krvácania v porovnaní so samotným podaním apixabanu, ak sa apixaban podával spolu
so silnými induktormi CYP3A4 a zároveň P-gp.
Na pacientov užívajúcich súbežnú systémovú liečbu silnými induktormi CYP3A4 a aj P-gp sa vzťahujú nasledujúce odporúčania (pozri časť 4.5):
- na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF a na prevenciu rekurentnej DVT a PE sa má apixaban používať s opatrnosťou,
- na liečbu DVT a liečbu PE sa apixaban nemá používať, pretože sa účinnosť môže oslabiť. Laboratórne parametre
Parametre zrážavosti [napr. protrombínový čas (prothrombin time,PT), INR a aktivovaný čiastočný tromboplastínový čas (activated partial thromboplastin time, aPTT)] sú ovplyvnené tak, ako sa
predpokladá podľa mechanizmu účinku apixabanu. Zmeny pozorované v týchto testoch zrážavosti pri očakávaných terapeutických dávkach sú malé a podliehajú vysokému stupňu variability (pozri
časť 5.1).
Informácie o pomocných látkach
Eliquis obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Inhibítory CYP3A4 a P-gp
Súbežné podávanie apixabanu s ketokonazolom (400 mg jedenkrát denne), silným inhibítorom
CYP3A4 a P-gp, viedlo ku dvojnásobnému zvýšeniu priemernej AUC apixabanu a 1,6-násobnému zvýšeniu priemernej cmax apixabanu.
Použitie Eliquisu sa neodporúča u pacientov, ktorým súbežne podáva systémová liečba silnými inhibítormi CYP3A4 a P-gp, ako azolové antimykotiká (napr. ketokonazol, itrakonazol, vorikonazol a pozakonazol) a inhibítory HIV proteáz (napr. ritonavir) (pozri časť 4.4).
Predpokladá sa, že liečivá, ktoré sa nepovažujú za silné inhibítory CYP3A4 ani P-gp (napr. diltiazem, naproxén, amiodaron, verapamil, chinidín) zvyšujú plazmatickú koncentráciu apixabanu v menšom rozsahu. Napríklad Diltiazem (360 mg jedenkrát denne), ktorý sa považuje za stredne silný inhibítor CYP3A4 a slabý inhibítor P-gp, viedol k 1,4-násobnému zvýšeniu priemernej AUC apixabanu a 1,3- násobnému zvýšeniu cmax. Naproxén (jednorazová dávka 500 mg), inhibítor P-gp, ale nie inhibítor CYP3A4, viedol k 1,5-násobnému zvýšeniu priemernej AUC a 1,6-násobnému zvýšeniu priemernej cmax apixabanu. Pri súbežnom podávaní s menej silnými inhibítormi CYP3A4 a/alebo P-gp sa úprava dávky nevyžaduje.
Induktory CYP3A4 a P-gp
Súbežné podávanie apixabanu s rifampicínom, silným induktorom CYP3A4 a P-gp, viedlo k približne
54 % zníženiu priemernej AUC a 42 % zníženiu priemernej cmax apixabanu. Súbežné používanie apixabanu s inými silnými induktormi CYP3A4 a P-gp (napr. fenytoín, karbamazepín, fenobarbital alebo ľubovník bodkovaný) môže tiež viesť k zníženiu plazmatických koncentrácií apixabanu. Pri súbežnej liečbe takýmito liekmi sa nevyžaduje úprava dávky apixabanu, avšak u pacientov užívajúcich súbežnú systémovú liečbu silnými induktormi CYP3A4 a aj P-gp sa má apixaban na prevenciu cievnej mozgovej príhody a systémovej embólie u pacientov s NVAF a na prevenciu rekurentnej DVT a PE používať s opatrnosťou. Apixaban sa neodporúča na liečbu DVT a PE u pacientov užívajúcich
súbežnú systémovú liečbu silnými induktormi CYP3A4 a P-gp, pretože sa účinnosť môže oslabiť
(pozri časť 4.4).
Antikoagulanciá, inhibítory agregácie trombocytov a NSAIDs
Z dôvodu zvýšeného rizika krvácania je súbežná liečba inými antikoagulanciami kontraindikovaná
(pozri časť 4.3).
Po kombinovanom podaní enoxaparínu (v jednorazovej dávke 40 mg) s apixabanom (v jednorazovej dávke 5 mg) sa pozoroval aditívny účinok na aktivitu anti-faktora Xa.
Keď sa apixaban podal súbežne s 325 mg ASA jedenkrát denne, farmakokinetické alebo farmakodynamické interakcie neboli zjavné.
Súbežné podanie apixabanu s klopidogrelom (75 mg jedenkrát denne) alebo s kombináciou 75 mg klopidogrelu a 162 mg ASA jedenkrát denne alebo s prasugrelom (60 mg, po ktorých nasledovalo
10 mg jedenkrát denne) v klinických štúdiách fázy I nevykazovalo významný vzostup v čase krvácania ani ďalšiu inhibíciu agregácie trombocytov v porovnaní s podaním protidoštičkových látok bez apixabanu. Vzostupy testov zrážavosti (PT, INR a aPTT) sa zhodovali s účinkami samotného
apixabanu.
Naproxén (500 mg), inhibítor P-gp, spôsobil 1,5-násobné zvýšenie priemernej AUC a 1,6-násobné zvýšenie cmax apixabanu. Korešpondujúce zvýšenia v testoch zrážavosti sa pozorovali pri apixabane. Nepozorovali sa zmeny v účinku naproxénu na agregáciu trombocytov indukovanú kyselinou arachidónovou a po súbežnom podaní apixabanu s naproxénom sa nepozorovalo predĺženie času krvácania.
Napriek týmto zisteniam sa môžu vyskytnúť jedinci so silnejšou farmakodynamickou odpoveďou na súbežné podávanie protidoštičkových látok s apixabanom. Pri súbežnom podávaní Eliquisu s NSAIDs (vrátane kyseliny acetylsalicylovej) je potrebná opatrnosť, pretože tieto lieky obvykle zvyšujú riziko krvácania. Významné zvýšenie rizika krvácania bolo hlásené v prípade trojkombinácie apixabanu, ASA a klopidogrelu v klinickej štúdii u pacientov s akútnym koronárnym syndrómom (pozri časť 4.4).
Lieky spájané s ťažkým krvácaním sa neodporúčajú užívať súbežne s Eliquisom: trombolytiká, antagonisty receptora GPIIb/IIIa, tienopyridíny (napr. klopidogrel), dipyridamol, dextrán a sulfinpyrazón.'
Iné súbežné liečby
Nepozorovali sa žiadne klinicky významné farmakokinetické alebo farmakodynamické interakcie pri súbežnom podávaní apixabanu s atenololom alebo famotidínom. Súbežné podávanie 10 mg apixabanu
so 100 mg atenololu nemalo klinicky významný účinok na farmakokinetiku apixabanu. Po súbežnom
podaní týchto dvoch liečiv bola priemerná AUC apixabanu nižšia o 15 % a cmax nižšia 18 %, ako keď sa podali samostatne. Podanie 10 mg apixabanu so 40 mg famotidínu nemalo žiadny účinok na AUC alebo cmax apixabanu.
Účinok apixabanu na iné lieky
Štúdie in vitro preukázali, že apixaban nemá žiadny inhibičný účinok na aktivitu CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6 alebo CYP3A4 (IC50 > 45 (M) a má slabý inhibičný účinok na aktivitu CYP2C19 (IC50 > 20 (M) pri koncentráciách, ktoré sú významne väčšie ako najvyššie plazmatické koncentrácie pozorované u pacientov. Apixaban neindukoval CYP1A2, CYP2B6, CYP3A4/5 pri koncentrácii do 20 (M. Preto sa neočakáva, že by apixaban ovplyvňoval metabolický klírens súbežne podaných liekov, ktoré sú metabolizované týmito enzýmami. Apixaban nie je významným inhibítorom P-gp.
V štúdiách so zdravými jedincami (pozri nižšie), apixaban významne nemenil farmakokinetiku digoxínu, naproxénu alebo atenololu.
Digoxín
Súbežné podanie apixabanu (20 mg jedenkrát denne) a digoxínu (0,25 mg jedenkrát denne), substrátu P-gp, neovplyvnilo AUC alebo cmax digoxínu. Preto apixaban neinhibuje transport substrátu sprostredkovaného P-gp.
Naproxén
Súbežné podanie jednorazovej dávky apixabanu (10 mg) a naproxénu (500 mg), bežne používaného
NSAID, nemalo žiadny účinok na AUC alebo cmax naproxénu.
Atenolol
Súbežné podanie jednorazovej dávky apixabanu (10 mg) a atenololu (100 mg), bežného betablokátora,
nezmenilo farmakokinetiku atenololu.
Aktívne uhlie
Podanie aktívneho uhlia znižuje expozíciu apixabanu (pozri časť 4.9).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití apixabanu u gravidných žien. Štúdie na zvieratách nenaznačujú priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity. Neodporúča sa
užívať apixaban počas gravidity.
Dojčenie
Nie je známe či sa apixaban alebo jeho metabolity vylučujú do ľudského mlieka. Dostupné údaje u zvierat preukázali vylučovanie apixabanu do mlieka. V mlieku potkanov sa zistil vysoký pomer
hladiny apixabanu v mlieku voči plazme (cmax okolo 8, AUC okolo 30), pravdepodobne z dôvodu aktívneho transportu do mlieka. Riziko pre novorodencov a dojčatá nemožno vylúčiť.
Musí sa rozhodnúť, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu apixabanom. Fertilita
Štúdie na zvieratách, ktorým sa podával apixaban, nepreukázali žiadny účinok na fertilitu (pozri
časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Eliquis nemá, alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Bezpečnosť apixabanu sa skúmala v 4 klinických štúdiách fázy III zahŕňajúcich viac ako
15 000 pacientov: viac ako 11 000 pacientov v štúdiách NVAF a viac ako 4 000 pacientov v štúdiách liečby VTE (VTEt) počas priemernej celkovej expozície 1,7 rokov a 221 dní (pozri časť 5.1).
Častými nežiaducimi reakciami bolo krvácanie, kontúzia, epistaxa a hematóm (profil nežiaducich reakcií a frekvencie podľa indikácie, pozri v tabuľke 2).
V štúdiách NVAF bol celkový výskyt nežiaducich reakcií súvisiacich s krvácaním pri apixabane
24,3 % v štúdii apixabanu oproti warfarínu a 9,6 % v štúdii s apixabanom oproti kyseline acetylsalicylovej. V štúdii apixabanu oproti warfarínu bol výskyt závažných ISTH krvácaní
gastrointestinálneho traktu (zahŕňajúcich hornú časť GI, dolnú časť GI a rektálne krvácanie) pri
apixabane 0,76 %/rok. Výskyt závažného intraokulárneho ISTH krvácania bol pri apixabane
0,18 %/rok.
V štúdiách VTEt bol celkový výskyt nežiaducich reakcií súvisiacich s krvácaním pri apixabane 15,6 %
v štúdii apixabanu oproti enoxaparínu/warfarínu a 13,3 % v štúdii apixabanu oproti placebu (pozri časť 5.1).
Zoznam nežiaducich reakcií v tabuľke
Tabuľka 2 uvádza nežiaduce reakcie zoradené do skupín podľa orgánových systémov a podľa frekvencie vyjadrenej nasledujúcimi kategóriami: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000);
neznáme (z dostupných údajov) pre NVAF a VTEt.
Tabuľka 2
Trieda orgánových systémov Prevencia cievnej mozgovej príhody a systémovej embólie u dospelých pacientov s NVAF s jedným alebo
viacerými rizikovými faktormi (NVAF)
Poruchy imunitného systému
Liečba DVT
a PE a prevencia rekurentnej DVT a PE (VTEt)
Precitlivenosť, alergický edém a anafylaxia
Menej časté -
Pruritus Menej časté Menej časté*
Poruchy nervového systému
Krvácanie do mozgu Menej časté Zriedkavé
Poruchy oka
Krvácanie do oka (vrátane spojovkového krvácania) Poruchy ciev
Časté Menej časté
Krvácanie, hematómy Časté Časté Intraabdominálne krvácanie Menej časté -
Poruchy dýchacej sústavy, hrudníka a mediastínaEpistaxa Časté Časté Hemoptýza Menej časté Menej časté Krvácanie do respiračného traktu Zriedkavé Zriedkavé
Trieda orgánových systémov Prevencia cievnej mozgovej príhody a systémovej embólie u dospelých pacientov s NVAF s jedným alebo
viacerými rizikovými faktormi (NVAF)
Poruchy gastrointestinálneho traktu
Liečba DVT
a PE a prevencia rekurentnej DVT a PE (VTEt)
Gastrointestinálne krvácanie Časté Časté
Hemoroidálne krvácanie, krvácanie z úst
Menej časté -
Hematochézia Menej časté Menej časté
Rektálne krvácanie, gingiválne krvácanie
Časté Časté
Retroperitoneálne krvácanie Zriedkavé -
Poruchy kože a podkožného tkaniva
Kožná vyrážka Menej časté -
Poruchy obličiek a močových ciest
Hematúria Časté Časté
Poruchy reprodukčného systému a prsníkov
Abnormálne vaginálne krvácanie, urogenitálne krvácanie
Celkové poruchy a reakcie v mieste podania
Menej časté Menej časté
Krvácanie v mieste aplikácie Menej časté -
Laboratórne a funkčné vyšetrenia
Pozitívny test na okultné krvácanie Menej časté Menej časté
Úrazy, otravy a komplikácie liečebného postupu
Kontúzia Časté Časté
Traumatická hemorágia, postprocedurálna hemorágia, krvácanie v mieste incízie
Menej časté Menej časté

* V štúdii CV185057 (dlhodobá prevencia VTE) sa nevyskytol generalizovaný pruritus
Použitie Eliquisu sa môže spájať so zvýšeným rizikom skrytého alebo otvoreného krvácania
z akéhokoľvek tkaniva alebo orgánu, ktoré môže vyústiť do posthemoragickej anémie. Príznaky a závažnosť sa budú líšiť podľa lokality a stupňa alebo rozsahu krvácania (pozri časti 4.4 a 5.1).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieProti Eliquisu neexistuje antidotum. Predávkovanie apixabanom môže viesť ku zvýšenému riziku krvácania. V prípade komplikácií spôsobených krvácaním sa musí liečba ukončiť a vyšetriť zdroj krvácania. Je potrebné zvážiť začatie vhodnej liečby, napr. chirurgickej hemostázy alebo transfúzie čerstvej zmrazenej plazmy.
V kontrolovaných klinických štúdiách sa u zdravých jedincov, ktorým sa podával apixaban perorálne v dávkach do 50 mg denne počas 3 – 7 dní (25 mg dvakrát denne (BID) počas 7 dní alebo 50 mg jedenkrát denne (od) počas 3 dni), neprejavili žiadne klinicky významné nežiaduce účinky.
U zdravých osôb znížilo podanie aktívneho uhlia 2 a 6 hodín po požití 20 mg dávky apixabanu priemernú AUC apixabanu o 50 % a 27 %, v uvedenom poradí, a nemalo žiadny vplyv na Cmax. Keď bolo aktívne uhlie podané 2 a 6 hodín po apixabane, priemerný polčas apixabanu klesol z 13,4 hodín na 5,3 hodín a 4,9 hodín, v uvedenom poradí, keď sa apixaban podal samotne. Podávanie aktívneho uhlia môže byť teda užitočné pri zvládaní predávkovania apixabanom alebo náhodného požitia.
Ak sa život ohrozujúce krvácanie nedá zvládnuť pomocou opatrení uvedených vyššie, možno zvážiť podanie koncentrátov protrombínového komplexu (prothrombin complex concentrates, PCCs) alebo rekombinantného faktora VIIa. Zrušenie farmakodynamických účinkov Eliquisu preukázané zmenami v teste na tvorbu trombínu bolo zrejmé na konci infúzie a začiatočné hodnoty boli dosiahnuté
v priebehu 4 hodín po začatí 30 minútovej infúzie 4-faktorového PCC u zdravých jedincov. Nie sú však žiadne klinické skúsenosti s použitím 4-faktorových PCCs na zastavenie krvácania
u jednotlivcov, ktorí dostali Eliquis. V súčasnosti nie sú žiadne skúsenosti s použitím
rekombinantného faktora VIIa u jedincov užívajúcich apixaban. Môže sa zvážiť opätovné dávkovanie rekombinantného faktora VIIa a titrovať ho v závislosti od zlepšenia krvácania.
V závislosti na lokálnej dostupnosti sa v prípade rozsiahleho krvácania môže zvážiť konzultácia experta na koaguláciu.
Hemodialýza znížila AUC apixabanu o 14 % u pacientov s terminálnym štádiom ochorenia obličiek (ESRD), keď sa podávala jednorazová dávka apixabanu 5 mg perorálne. Preto je nepravdepodobné, že by hemodialýza bola účinným prostriedkom pri liečbe predávkovania apixabanom.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antitrombotiká, priamy faktor Xa inhibítorov, ATC kód: B01AF02
Mechanizmus účinku
Apixaban je silný, perorálny, reverzibilný, priamy a vysoko selektívny inhibítor faktora Xa. Pre svoju antitrombotickú aktivitu si nevyžaduje antitrombín III. Apixaban inhibuje voľný a na krvnú zrazeninu
viazaný faktor Xa a aktivitu protrombinázy. Apixaban nemá žiadne priame účinky na agregáciu
trombocytov, ale nepriamo inhibuje agregáciu trombocytov vyvolanú trombínom. Inhibíciou faktora
Xa apixaban zabraňuje tvorbe trombínu a vzniku trombu. Predklinické štúdie s apixabanom na zvieratách preukázali antitrombotický účinok v prevencii arteriálnej a venóznej trombózy v dávkach, ktoré zachovávajú (umožňujú) hemostázu.
Farmakodynamické účinky
Farmakodynamické účinky apixabanu reflektujú mechanizmus účinku (inhibícia FXa). V dôsledku inhibície FXa apixaban predlžuje testy zrážavosti, ako protrombínový čas (PT), INR a aktivovaný parciálny tromboplastínový čas (aPTT). Zmeny pozorované v týchto testoch zrážavosti v očakávaných terapeutických dávkach sú malé a podliehajú vysokému stupňu variability. Neodporúčajú sa
na hodnotenie farmakodynamických účinkov apixabanu. V teste na tvorbu trombínu znížil apixaban
potenciál endogénneho trombínu, mieru tvorby trombínu v ľudskej plazme.
Apixaban vykazuje aj anti-FXa aktivitu, čo je zrejmé zo zníženia enzýmovej aktivity faktora Xa
v mnohých komerčných súpravách anti-FXa, avšak výsledky medzi jednotlivými súpravami sa líšia. Údaje z klinických štúdií sú dostupné len z chromogénneho testu Rotachrom® Heparin. Anti-FXa aktivita vykazuje blízky priamy lineárny vzťah s plazmatickou koncentráciou apixabanu,
s maximálnymi hodnotami v čase maximálnych koncentrácií apixabanu v plazme. Vzťah medzi plazmatickými koncentráciami apixabanu a anti-FXa aktivitou je približne lineárny v širokom rozpätí dávkovania apixabanu.
Tabuľka 3 zobrazuje očakávanú expozíciu v rovnovážnom stave a anti-faktorovú Xa aktivitu pre každú indikáciu. U pacientov s nevalvulárnou fibriláciou predsiení užívajúcich apixaban na prevenciu cievnej mozgovej príhody a systémovej embólie výsledky ukazujú menej ako 1,7-násobnú fluktuáciu
od maximálnej k minimálnej úrovni. U pacientov užívajúcich apixaban na liečbu DVT a PE alebo na prevenciu rekurentnej DVT a PE, výsledky ukazujú menej ako 2,2-násobnú fluktuáciu od maximálnej k minimálnej úrovni.
Tabuľka 3: Očakávaná expozícia apixabanu v rovnovážnom stave a anti-faktorová Xa aktivita
Apix. C
ma
x
(ng/ml)
Apix. C
mi
n
(ng/ml)
Apix.
Anti-faktorová Xa aktivita, max. (IU/ml)
Apix.
Anti-faktorová Xa aktivita, min. (IU/ml)
Medián [5., 95. percentil]
Prevencia mozgovej príhody a systémovej embólie: NVAF
2,5 mg dvakrát denne*
5 mg dvakrát denne
123 [69; 221] 79 [34; 162] 1,8 [1,0; 3,3] 1,2 [0,51; 2,4]
171 [91; 321] 103 [41; 230] 2,6 [1,4; 4,8] 1,5 [0,61; 3,4]
Liečba DVT, liečba PE a prevencia
rekurentnej
DV
T a PE (VTEt)
2,5 mg dvakrát denne
5 mg dvakrát denne
10 mg dvakrát denne
67 [30; 153] 32 [11; 90] 1,0 [0,46; 2,5] 0,49 [0,17; 1,4]
132 [59; 302] 63 [22; 177] 2,1 [0,91; 5,2] 1,0 [0,33; 2,9]
251 [111; 572] 120 [41; 335] 4,2 [1,8; 10,8] 1,9 [0,64; 5,8]
*Populácia so zníženou dávkou, ktorá je založená na 2 z 3 kritérií zníženia dávky v štúdii ARISTOTLE
Hoci si liečba apixabanom nevyžaduje pravidelné monitorovanie expozície, kalibrovaný kvantitatívny test na anti-faktor Xa môže byť užitočný vo výnimočných situáciách, kedy znalosť expozície apixabanu môže pomôcť kvalifikovanému klinickému rozhodnutiu (napr. predávkovanie a urgentný chirurgický výkon).
Klinická účinnosť a bezpečnosťPrevencia mozgovej príhody a systémovej embólie u pacientov s nevalvulárnou fibriláciou predsiení(NVAF)Celkovo 23 799 pacientov bolo randomizovaných do klinického programu (ARISTOTLE: porovnanie apixabanu a warfarínu, AVERROES: porovnanie apixabanu a ASA) zahŕňajúc 11 927 pacientov randomizovaných na apixaban. Program bol navrhnutý na preukázanie účinnosti a bezpečnosti apixabanu na prevenciu mozgovej príhody a systémovej embólie u pacientov s nevalvulárnou fibriláciou predsiení (NVAF) a s jedným alebo viacerými ďalšími rizikovými faktormi, ako:
· predchádzajúca mozgová príhoda alebo prechodný ischemický atak (TIA)
· vek ≥ 75 rokov
· hypertenzia
· diabetes mellitus
· symptomatické srdcové zlyhanie (NYHA trieda ≥ II)
ŠTÚDIA ARISTOTLEV štúdii ARISTOTLE bolo celkovo 18 201 pacientov randomizovaných na dvojito zaslepenú liečbu apixabanom v dávke 5 mg dvakrát denne (alebo 2,5 mg dvakrát denne u vybraných pacientov [4,7 %],
pozri časť 4.2) alebo warfarínom (cieľový rozsah INR 2,0 – 3,0). Pacienti boli v štúdii vystavení
skúmanému liečivu v priemere 20 mesiacov. Priemerný vek bol 69,1 rokov, priemerné CHADS2 skóre bolo 2,1 a 18,9 % pacientov malo v minulosti mozgovú príhodu alebo TIA.
Apixaban v štúdii dosiahol štatisticky významnú prevahu v primárnom koncovom ukazovateli prevencie mozgovej príhody (hemoragickej alebo ischemickej) a systémovej embólie (pozri tabuľku 4) v porovnaní s warfarínom.
Tabuľka 4: Výsledky účinnosti u pacientov s fibriláciou predsiení v štúdii ARISTOTLE
Apixaban
N=
9 120
n (%/rok)
Warfarín
N=
9 081
n (%/rok)
Pomer rizika
(
95 % IS) p-hodnota
Mozgová príhoda alebo systémová embólia 212 (1,27) 265 (1,60) 0,79 (0,66; 0,95) 0,0114
Mozgová príhoda
Ischemická alebo nešpecifická 162 (0,97) 175 (1,05) 0,92 (0,74; 1,13) Hemoragická 40 (0,24) 78 (0,47) 0,51 (0,35; 0,75) Systémová embólia 15 (0,09) 17 (0,10) 0,87 (0,44; 1,75)
Medián percenta času, kedy boli pacienti randomizovaní na warfarín v terapeutickom rozsahu (TTR)
(INR 2 - 3), bol 66 %.
Apixaban preukázal zníženie mozgovej príhody a systémovej embólie v porovnaní s warfarínom naprieč rôznymi úrovňami TTR podľa centier; v rámci najvyššieho kvartilu TTR podľa centier bol pomer rizika pre apixaban oproti warfarínu 0,73 (95 % IS; 0,38; 1,40).
Kľúčové sekundárne koncové ukazovatele závažného krvácania a úmrtia z akejkoľvek príčiny sa testovali pomocou vopred špecifikovanej hierarchickej testovacej stratégie na kontrolu celkovej chyby typu I v klinickom skúšaní. Štatisticky významná prevaha sa tiež dosiahla v kľúčových sekundárnych koncových ukazovateľoch závažného krvácania a tiež v úmrtí z akejkoľvek príčiny (pozri tabuľku 5). Pri zlepšenom sledovaní INR sa znížili pozorované benefity apixabanu v porovnaní s warfarínom týkajúce sa úmrtia z akejkoľvek príčiny.
Tabuľka 5: Sekundárne koncové ukazovatele u pacientov s fibriláciou predsiení v štúdii ARISTOTLE
Výsledky krvácania
Apixaban N = 9 088 n (%/rok)
Warfarín N = 9 052 n (%/rok)
Pomer rizika
(95 % IS)
p-hodnota
Závažné* 327 (2,13) 462 (3,09) 0,69 (0,60; 0,80) < 0,0001
Fatálne 10 (0,06) 37 (0,24) Intrakraniálne 52 (0,33) 122 (0,80)
Závažné + CRNM† 613 (4,07) 877 (6,01) 0,68 (0,61; 0,75) < 0,0001
Všetky 2 356 (18,1) 3 060 (25,8) 0,71 (0,68; 0,75) < 0,0001
Iné koncové ukazovatele
Úmrtie z akejkoľvek príčiny
603 (3,52) 669 (3,94) 0,89 (0,80; 1,00) 0,0465
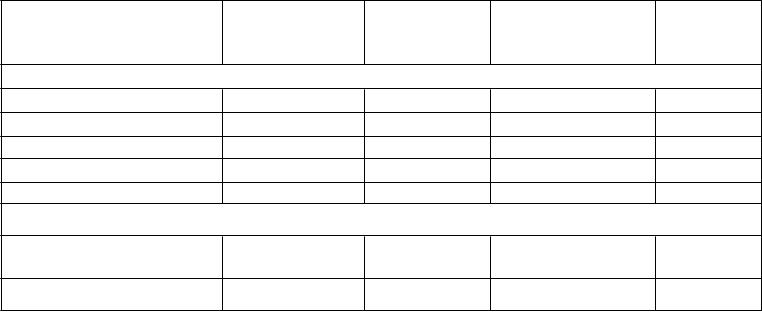
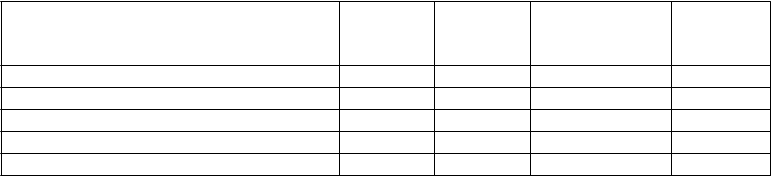
Infarkt myokardu 90 (0,53) 102 (0,61) 0,88 (0,66; 1,17)
*Závažné krvácanie definované podľa kritérií Medzinárodnej spoločnosti pre trombózu a hemostázu
(International Society on Thrombosis and Haemostasis - ISTH).
†klinicky relevantné, nezávažné
Celková miera prerušenia z dôvodu nežiaducich reakcií v štúdii ARISTOTLE bola 1,8 % pre apixaban a 2,6 % pre warfarín.
Výsledky účinnosti pre vopred špecifikované podskupiny, vrátane CHADS2 skóre, veku, telesnej hmotnosti, pohlavia, stavu funkcie obličiek, predchádzajúcej mozgovej príhody alebo TIA a diabetu, boli zhodné s primárnymi výsledkami účinnosti pre celkovú populáciu skúmanú v klinickom skúšaní.
Incidencia ISTH (International Society on Thrombosis and Haemostasis) definovaných závažných gastrointestinálnych krvácaní (vrátane krvácania do horného GI traktu, do dolného GI traktu
a rektálneho krvácania) bolo 0,76 %/rok na apixabane a 0,86 %/rok na warfaríne.
Výsledky závažného krvácania pre vopred špecifikované podskupiny, vrátane CHADS2 skóre, veku, telesnej hmotnosti, pohlavia, stavu funkcie obličiek, predchádzajúcej mozgovej príhody alebo TIA
a diabetu, boli zhodné s výsledkami pre celkovú populáciu skúmanú v klinickom skúšaní.
ŠTÚDIA AVERROES
V štúdii AVERROES bolo randomizovaných celkovo 5 598 pacientov, považovaných skúšajúcimi za nevhodných pre VKA, na liečbu s apixabanom v dávke 5 mg dvakrát denne (alebo 2,5 mg dvakrát
denne u vybraných pacientov [6,4 %], pozri časť 4.2) alebo ASA. ASA sa podávala jedenkrát denne
v dávke 81 mg (64%), 162 (26,9 %), 243 (2,1 %) alebo 324 mg (6,6 %) podľa uváženia skúšajúceho. Pacienti boli vystavení skúmanému lieku v priemere 14 mesiacov. Priemerný vek bol 69,9 rokov,
priemerné CHADS2 skóre bolo 2,0 a 13,6 % pacientov malo v minulosti mozgovú príhodu alebo TIA.
Časté dôvody nevhodnosti pre liečbu VKA v štúdii AVERROES zahŕňali neschopnosť/nepravdepodobnosť dosiahnutia INR v požadovaných intervaloch (42,6 %), pacient odmietol liečbu s VKA (37,4 %), CHADS2 skóre = 1 a lekár neodporučil VKA (21,3 %), na pacienta sa nedalo spoľahnúť, že bude užívať liek VKA podľa predpisu (15,0 %) a náročnosť/očakávaná náročnosť kontaktovania pacienta v prípade urgentnej zmeny dávky (11,7 %).
Štúdia AVERROES bola ukončená predčasne na základe odporúčania nezávislého Výboru pre monitorovanie údajov z dôvodu jasného dôkazu zníženia mozgovej príhody a systémovej embólie s prijateľným bezpečnostným profilom.
Celková miera prerušenia z dôvodu nežiaducich reakcií v štúdii AVERROES bola 1,5 % pre apixaban a 1,3 % pre ASA.
V štúdii dosiahol apixaban štatisticky významnú prevahu v primárnom koncovom ukazovateli prevencie mozgovej príhody (hemoragickej, ischemickej alebo nešpecifikovanej) alebo systémovej embólie (pozri tabuľku 6) v porovnaní s ASA.
Tabuľka 6: Kľúčové výsledky účinnosti u pacientov s fibriláciou predsiení v štúdii AVERROES
Apixaban
N = 2 807
n (%/rok)
ASA
N = 2 791
n (%/rok)
Pomer rizika
(95 % IS)
p- hodnota
Mozgová príhoda alebo systémová embólia*
Mozgová príhoda
51 (1,62) 113 (3,63) 0,45 (0,32; 0,62) < 0,0001
Ischemická alebo nešpecifická 43 (1,37) 97 (3,11) 0,44 (0,31; 0,63) Hemoragická 6 (0,19) 9 (0,28) 0,67 (0,24; 1,88)
Systémová embólia 2 (0,06) 13 (0,41) 0,15 (0,03; 0,68)
Mozgová príhoda, systémová embólia, IM alebo vaskulárne úmrtie*†
132 (4,21) 197 (6,35) 0,66 (0,53; 0,83) 0,003

Infarkt myokardu 24 (0,76) 28 (0,89) 0,86 (0,50; 1,48) Vaskulárne úmrtie 84 (2,65) 96 (3,03) 0,87 (0,65; 1,17)
Úmrtie z akejkoľvek príčiny † 111 (3,51) 140 (4,42) 0,79 (0,62; 1,02) 0,068
* Hodnotené sekvenčnou testovacou stratégiou navrhnutou na kontrolu celkovej chyby typu I v klinickom skúšaní
† Sekundárny koncový ukazovateľ.
V incidencii závažného krvácania sa nezistil žiadny štatisticky významný rozdiel medzi apixabanom a ASA (pozri tabuľku 7).
Tabuľka 7: Krvácavé udalosti u pacientov s fibriláciou predsiení v štúdii AVERROES
Apixaban N = 2 798 n (%/rok)
ASA
N = 2 780
n (%/rok)
Pomer rizika
(95 % IS)
p- hodnota
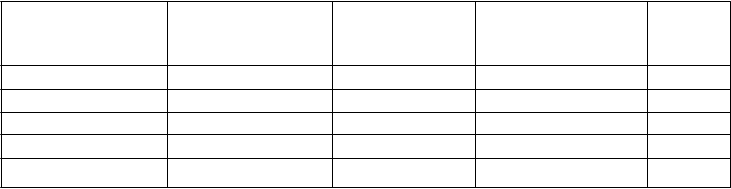
Závažné* 45 (1,41) 29 (0,92) 1,54 (0,96; 2,45) 0,0716
Fatálne, n 5 (0,16) 5 (0,16) Intrakraniálne, n 11 (0,34) 11 (0,35)
Závažné + CRNM† 140 (4,46) 101 (3,24) 1,38 (1,07; 1,78) 0,0144
Všetky 325 (10,85) 250 (8,32) 1,30 (1,10; 1,53) 0,0017
* Závažné krvácanie definované podľa kritérií Medzinárodnej spoločnosti pre trombózu a hemostázu (ISTH).
†klinicky relevantné, nezávažné
Liečba DVT, liečba PE a prevencia rekurentnej DVT a PE (VTEt)Klinický program (AMPLIFY: apixaban oproti enoxaparínu/warfarínu, AMPLIFY-EXT: apixaban oproti placebu) bol navrhnutý tak, aby preukázal účinnosť a bezpečnosť apixabanu v liečbe DVT a/alebo PE (AMPLIFY) a predĺženej terapie na prevenciu rekurentnej DVT a/alebo PE nasledujúcej po 6 až 12 mesiacoch antikoagulačnej liečby DVT a/alebo PE (AMPLIFY-EXT). Obidve štúdie boli randomizované, dvojito zaslepené, multinárodné skúšania s paralelnými skupinami u pacientov so symptomatickou proximálnou DVT alebo symptomatickou PE. Všetky kľúčové ukazovatele bezpečnosti a účinnosti boli posudzované nezávislou zaslepenou komisiou.
ŠTÚDIA AMPLIFYV štúdii AMPLIFY bolo randomizovaných celkovo 5 395 pacientov liečených apixabanom10 mg perorálne dvakrát denne počas 7 dní, po ktorých nasledovala liečba apixabanom 5 mg perorálne dvakrát denne počas 6 mesiacov, alebo enoxaparínom v dávke 1 mg/kg dvakrát denne subkutánne počas minimálne 5 dní (do INR ≥ 2) a warfarínom (cieľový rozsah INR 2,0 – 3,0) perorálne počas
6 mesiacov.
Priemerný vek bol 56,9 rokov a 89,8 % randomizovaných pacientov malo nevyprovokované príhody
VTE. U pacientov randomizovaných na warfarín bolo priemerné percentuálne vyjadrenie času v terapeutickom rozsahu (INR 2,0 – 3,0) 60,9. Pri apixabane sa preukázalo zníženie výskytu rekurentnej symptomatickej VTE alebo úmrtia súvisiaceho s VTE naprieč rôznymi úrovňami TTR podľa centier; v rámci najvyššieho kvartilu TTR podľa centier bolo relatívne riziko pri apixabane oproti enoxaparínu/warfarínu 0,79 (95 % IS, 0,39; 1,61).
V štúdii sa preukázalo, že apixaban je noninferiórny voči enoxaparínu/warfarínu v kombinovanom primárnom cieľovom ukazovateli posudzovanej rekurentnej symptomatickej VTE (DVT bez fatálneho konca alebo PE bez fatálneho konca) alebo úmrtia súvisiaceho s VTE (pozri tabuľku 8).
Tabuľka 8: Výsledky účinnosti v štúdii AMPLIFY
Apixaban N = 2 609 n (%)
Enoxaparín/
warfarín
N = 2 635
 n (%)
Relatívne riziko
(95 % IS)
n (%)
Relatívne riziko
(95 % IS)
VTE alebo úmrtie súvisiace s VTE
59 (2,3) 71 (2,7) 0,84 (0,60; 1,18)*
DVT 20 (0,7) 33 (1,2) PE 27 (1,0) 23 (0,9)
Úmrtie súvisiace s VTE
VTE alebo úmrtie
z akejkoľvek príčiny
Úmrtie súvisiace s VTE alebo CV
VTE, úmrtie súvisiace s VTE alebo závažné krvácanie
12 (0,4) 15 (0,6)
84 (3,2) 104 (4,0) 0,82 (0,61; 1,08)
61 (2,3) 77 (2,9) 0,80 (0,57; 1,11)
73 (2,8) 118 (4,5) 0,62 (0,47; 0,83)
* Noniferiórne v porovnaní s enoxaparínom/warfarínom (hodnota p < 0,0001)
Účinnosť apixabanu bola v úvodnej liečbe VTE konzistentná medzi pacientmi, ktorí sa liečili na PE
[relatívne riziko 0,9; 95 % IS (0,5; 1,6)] alebo DVT [relatívne riziko 0,8; 95 % IS (0,5; 1,3)]. Účinnosť v podskupinách zahŕňajúcich vek, pohlavie, index telesnej hmotnosti (BMI), funkciu obličiek, rozsah
indexu PE, polohu DVT trombu a predchádzajúce používanie parenterálneho heparínu bola vo
všeobecnosti konzistentná.
Primárnym cieľovým ukazovateľom bezpečnosti bolo závažné krvácanie. V štúdii bol apixaban štatisticky superiórny voči enoxaparínu/warfarínu v primárnom cieľovom ukazovateli bezpečnosti
[relatívne riziko 0,31; 95 % interval spoľahlivosti (0,17; 0,55), hodnota p < 0,0001] (pozri tabuľku 9).
Tabuľka 9: Výsledky krvácania v štúdii AMPLIFY
Apixaban N = 2 676 n (%)Enoxaparín/warfarínN = 2 689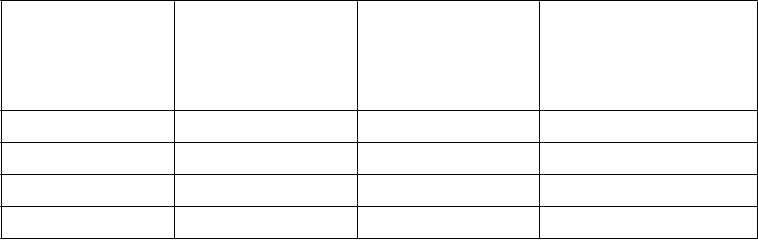 n (%)Relatívne riziko(95 % IS)
n (%)Relatívne riziko(95 % IS)
Závažné 15 (0,6) 49 (1,8) 0,31 (0,17; 0,55) Závažné + CRNM 115 (4,3) 261 (9,7) 0,44 (0,36; 0,55) Nezávažné 313 (11,7) 505 (18,8) 0,62 (0,54; 0,70)
Všetky 402 (15,0) 676 (25,1) 0,59 (0,53; 0,66)
Posudzované závažné krvácanie a CRNM krvácanie v ktoromkoľvek anatomickom mieste bolo vo
všeobecnosti nižšie v skupine s apixabanom na základe porovnania s enoxaparínom/warfarínom. Posudzované závažné ISTH gastrointestinálne krvácanie sa objavilo u 6 (0,2 %) pacientov liečených
apixabanom a 17 (0,6 %) pacientov liečených enoxaparínom/warfarínom.
ŠTÚDIA AMPLIFY-EXT
V štúdii AMPLIFY-EXT bolo randomizovaných celkovo 2 482 pacientov na liečbu apixabanom
2,5 mg perorálne dvakrát denne, apixabanom 5 mg perorálne dvakrát denne alebo placebom počas
12 mesiacov po dokončení 6 až 12 mesiacov úvodnej antikoagulačnej liečby. Z týchto pacientov sa
836 pacientov (33,7 %) zúčastnilo štúdie AMPLIFY pred zaradením do štúdie AMPLIFY-EXT. Priemerný vek bol 56,7 rokov a 91,7 % randomizovaných pacientov malo nevyprovokované príhody VTE.
V štúdii boli obidve dávky apixabanu štatisticky superiórne voči placebu v primárnom cieľovom ukazovateli rekurentnej symptomatickej VTE (DVT bez fatálneho konca alebo PE bez fatálneho konca) alebo úmrtia z akejkoľvek príčiny (pozri tabuľku 10).
Tabuľka 10: Výsledky účinnosti v štúdii AMPLIFY-EXT
Apixaban Apixaban Placebo Relatívne riziko (95 % IS)
2,5 mg
(
N = 840)
5,0 mg
(
N = 813) (N = 829)
n (%)
Apix 2,5 mg oproti placebu
Apix 5,0 mg oproti placebu
Rekurentná VTE alebo úmrtie
z akejkoľvek príčiny
19 (2,3) 14 (1,7) 77 (9,3) 0,24 (0,15; 0,40)¥
0,19 (0,11; 0,33)¥
DVT* 6 (0,7) 7 (0,9) 53 (6,4)
PE* 7 (0,8) 4 (0,5) 13 (1,6)
Úmrtie z akej- koľvek príčiny
Rekurentná VTE alebo úmrtie súvisiace
s VTE
Rekurentná VTE alebo úmrtie súvisiace
s CV
DVT bez fatálneho konca†
PE bez fatálneho konca†
Úmrtie súvisiace s VTE
6 (0,7) 3 (0,4) 11 (1,3)
14 (1,7) 14 (1,7) 73 (8,8) 0,19 (0,11; 0,33)
14 (1,7) 14 (1,7) 76 (9,2) 0,18 (0,10; 0,32)
6 (0,7) 8 (1,0) 53 (6,4) 0,11 (0,05; 0,26)
8 (1,0) 4 (0,5) 15 (1,8) 0,51 (0,22; 1,21)
2 (0,2) 3 (0,4) 7 (0,8) 0,28 (0,06; 1,37)
0,20 (0,11; 0,34)
0,19 (0,11; 0,33)
0,15 (0,07; 0,32)
0,27 (0,09; 0,80)
0,45 (0,12; 1,71)

¥ hodnota p < 0,0001
* U pacientov s viac ako jednou príhodou prispievajúcou ku kompozitnému cieľovému ukazovateľu sa hlásila len prvá príhoda (napr. ak sa u jedinca objavila DVT a potom aj PE, hlásila sa len DVT)
† U konkrétnych jednotlivcov sa mohla objaviť viac ako jedna udalosť a mohla byť uvedená v obidvoch klasifikáciách.
Účinnosť apixabanu na prevenciu rekurentnej VTE sa naprieč podskupinami zahŕňajúcimi vek, pohlavie, BMI a funkciu obličiek zachovala.
Primárnym cieľovým ukazovateľom bezpečnosti bolo závažné krvácanie počas obdobia liečby. Výskyt závažného krvácania pri obidvoch dávkach apixabanu sa v štúdii štatisticky neodlišoval od placeba. Neobjavil sa žiadny štatisticky významný rozdiel vo výskyte závažného + CRNM krvácania, nezávažného krvácania a všetkých krvácaní medzi pacientami liečenými 2,5 mg apixabanu dvakrát denne a pacientami užívajúcimi placebo (pozri tabuľku 11).
Tabuľka 11: Výsledky krvácania v štúdii AMPLIFY-EXT
Apixaban Apixaban Placebo Relatívne riziko (95 % IS)
2,5 mg
(N = 840)
5,0 mg
(N = 811) (N = 826)
n (%)
Apix 2,5 mg
oproti placebu
Apix 5,0 mg
oproti placebu
Závažné 2 (0,2) 1 (0,1) 4 (0,5) 0,49 (0,09; 2,64)
0,25 (0,03; 2,24)
Závažné + CRNM
27 (3,2) 35 (4,3) 22 (2,7) 1,20 (0,69; 2,10)
1,62 (0,96; 2,73)
Nezávažné 75 (8,9) 98 (12,1) 58 (7,0) 1,26 (0,91; 1,75)
Všetky 94 (11,2) 121 (14,9) 74 (9,0) 1,24 (0,93; 1,65)
1,70 (1,25; 2,31)
1,65 (1,26; 2,16)
Posudzované závažné ISTH gastrointestinálne krvácanie sa objavilo u 1 (0,1 %) pacienta liečeného
apixabanom v dávke 5 mg dvakrát denne, v dávke 2,5 mg dvakrát denne sa táketo krvácanie neobjavilo u žiadneho pacienta a objavilo sa u 1 (0,1 %) pacienta užívajúceho placebo.
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Eliquisom v jednej
alebo vo viacerých podskupinách pediatrickej populácie v prípade venóznej alebo arteriálnej embólie a trombózy (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaAbsolútna biologická dostupnosť apixabanu je približne 50 % pri dávkach do 10 mg. Apixaban sa absorbuje rýchlo s maximálnymi koncentráciami (cmax) objavujúcimi sa 3 až 4 hodiny po užití tablety. Pri dávke 10 mg užitie s jedlom neovplyvňuje AUC alebo cmax. Apixaban sa môže užívať s jedlom alebo bez jedla.
Apixaban vykazuje lineárnu farmakokinetiku so zvyšovaním expozície priamo úmerne k dávke pri perorálnych dávkach do 10 mg. Pri dávkach ( 25 mg apixaban vykazuje disolučne limitovanú absorpciu so zníženou biologickou dostupnosťou. Parametre expozície apixabanu vykazujú nízku až strednú variabilitu. čo sa odráža v inraindividuálnej (~ 20 % CV) a interindividuálnej variabilite
(~ 30 % CV).
Po podaní 10 mg apixabanu perorálne vo forme 2 rozdrvených 5 mg tabliet rozpustených v 30 ml
vody bola expozícia porovnateľná s expozíciou po perorálnom podaní 2 celých 5 mg tabliet. Po podaní
10 mg apixabanu perorálne vo forme 2 rozdrvených 5 mg tabliet rozmiešaných v 30 g jablčného pyré bola Cmax o 20 % nižšia a AUC o 16 % nižšia v porovnaní s podaním 2 celých 5 mg tabliet. Zníženie expozície sa nepovažuje za klinicky relevantné.
Po podaní rozdrvenej 5 mg tablety apixabanu rozpustenej v 60 ml D5W a podanej cez nazogastrickú trubicu bola expozícia podobná ako expozícia pozorovaná v iných klinických štúdiách zahŕňajúcich zdravých jedincov dostávajúcich jednorazovú dávku apixabanu 5 mg perorálne.
Na základe predpokladaného farmakokinetického profilu apixabanu v závislosti od dávky sú výsledky biologickej dostupnosti z vykonaných štúdií použiteľné pri nižších dávkach apixabanu.
Distribúcia
Väzba na plazmatické proteíny u ľudí je približne 87 %. Distribučný objem (Vss) je približne 21 litrov.
Biotransformácia a eliminácia
Apixaban má viacero spôsobov eliminácie. Z podanej dávky apixabanu u ľudí sa približne 25 % mení na metabolity, väčšina metabolitov sa vylučuje stolicou. Renálna exkrécia apixabanu tvorí približne
27 % celkového klírensu. V klinických a predklinických štúdiách sa pozorovali ďalšie spôsoby
exkrécie – biliárna a priama intestinálna.
Apixaban má celkový klírens okolo 3,3 l/h a eliminačný polčas približne 12 hodín.
O-demetylácia a hydroxylácia na mieste 3-oxopiperidinylu sú hlavnými miestami biotransformácie. Apixaban sa metabolizuje najmä prostredníctvom CYP3A4/5, s miernym prispením CYP1A2, 2C8,
2C9, 2C19 a 2J2. V ľudskej plazme je najdôležitejšou zložkou nezmenený apixaban bez prítomnosti aktívnych cirkulujúcich metabolitov. Apixaban je substrátom transportných proteínov, P-gp a proteínu
zodpovedného za rezistenciu pri rakovine prsníka (breast cancer resistance protein, BCRP).
Porucha funkcie obličiek
Nepozoroval sa žiadny vplyv porušenej funkcie obličiek na maximálnu plazmatickú koncentráciu apixabanu. Stanovením klírensu kreatinínu sa zistilo, že zvýšenie expozície apixabanu korelovalo
so znížením funkcie obličiek. U jedincov s ľahkou (klírens kreatinínu 51 – 80 ml/min), stredne ťažkou
(klírens kreatinínu 30 – 50 ml/min) a ťažkou (klírens kreatinínu 15 – 29 ml/min) poruchou funkcie obličiek sa plazmatické koncentrácie (AUC) apixabanu, v porovnaní s jedincami s normálnym
klírensom kreatinínu, zvýšili o 16, 29 a 44 % v uvedenom poradí. Porucha funkcie obličiek nemala
žiadny evidentný vplyv na vzťah medzi plazmatickou koncentráciou apixabanu a anti-FXa aktivitou.
U osôb s terminálnym štádiom ochorenia obličiek (end-stage renal disease - ESRD) sa AUC apixabanu zvýšila o 36 %, keď sa podávala jednorazová dávka apixabanu 5 mg bezprostredne po hemodialýze v porovnaní s AUC pozorovanou u osôb s normálnou funkciou obličiek. Hemodialýza, ktorá začala dve hodiny po podaní jednorazovej dávky 5 mg apixabanu, znížila AUC apixabanu o
14 % u týchto pacientov s ESRD, čo zodpovedá klírensu apixabanu dialýzou 18 ml/min. Preto je nepravdepodobné, že by hemodialýza bola účinným prostriedkom pri liečbe predávkovania apixabanu.
Porucha funkcie pečene
V štúdii, ktorá porovnávala 8 jedincov s ľahkou poruchou funkcie pečene (Childovo-Pughovo skóre 5 (n = 6) a 6 (n = 2)) a 8 jedincov so stredne ťažkou poruchou funkcie pečene (Childovo–Pughovo skóre B 7 (n = 6) a 8 (n = 2)) so 16 zdravými jedincami kontrolnej skupiny sa farmakokinetika
a farmakodynamika dávky 5 mg apixabanu u jedincov s poruchou funkcie pečene nezmenila. Zmeny v anti-FXa aktivite a INR boli medzi jedincami s ľahkou až stredne ťažkou poruchou funkcie pečene
a zdravými jedincami porovnateľné.
Starší pacienti
Starší pacienti (nad 65 rokov) vykazovali vyššie plazmatické koncentrácie ako mladší pacienti s priemernými hodnotami AUC vyššími približne o 32 % a žiadny rozdiel v Cmax.
Pohlavie
Expozícia apixabanu bola približne o 18 % vyššia u žien ako u mužov.
Etnický pôvod a rasa
Výsledky v štúdiách fázy I neukázali odlíšiteľné rozdiely vo farmakokinetike medzi belochmi, aziatmi a černochmi. Závery z analýzy farmakokinetiky u pacientov, ktorým sa podal apixaban boli zvyčajne konzistentné s výsledkami fázy I.
Telesná hmotnosťV porovnaní s expozíciou apixabanu u jedincov s telesnou hmotnosťou 65 až 85 kg, u jedincov s telesnou hmotnosťou > 120 kg bola expozícia apixabanu približne o 30 % nižšia a u jedincov
s hmotnosťou < 50 kg bola expozícia približne o 30 % vyššia.
 Farmakokinetický/farmakodynamický vzťah
Farmakokinetický/farmakodynamický vzťah Vzťah farmakokinetiky/farmakodynamiky (FK/FD) medzi koncentráciou apixabanu v plazme a niekoľkými farmakodynamickými koncovými ukazovateľmi (anti-FXa aktivita, INR, PT, aPTT) sa hodnotil po podaní širokého rozpätia dávok (0,5 –
50 mg). Vzťah medzi koncentráciou apixabanu v plazme a anti-FXa aktivitou sa najlepšie popísal lineárnym modelom. Vzťah FK/FD pozorovaný u pacientov bol konzistentný s výsledkami u zdravých
jedincov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, fertility a embryo-fetálneho vývoja a juvenilnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Najvýznamnejšie pozorované účinky v štúdiách toxicity po opakovanom podávaní boli také, ktoré súviseli s farmakologickým pôsobením apixabanu na koagulačné parametre krvi. V štúdiách toxicity sa zistilo malé až žiadne zvýšenie tendencie ku krvácavosti. Keďže to môže byť spôsobené nižšou citlivosťou druhov použitých predklinických štúdiách v porovnaní s ľuďmi, pri extrapolácii na ľudí sa má tento výsledok interpretovať s opatrnosťou.
6. FARAMCEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokJadro tablety: Bezvodá laktóza
Mikrokryštalická celulóza (E 460)
Sodná soľ kroskarmelózy Nátriumlaurylsulfát Magnéziumstearát (E 470b)
Filmový obal: Monohydrát laktózy Hypromelóza (E 464) Oxid titaničitý (E 171) Triacetín (E 1518)
Červený oxid železitý (E 172)
6.2 InkompatibilityNeaplikovateľné
6.3 Čas použiteľnosti3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistre ALU-PVC/PVdC. Škatuľky po 14, 20, 28, 56, 60, 168 a 200 filmom obalených tabliet. Perforované ALU-PVC/PVdC blistre s oddelenými jednotlivými dávkami. Škatuľky po 100 filmom
obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBristol-Myers Squibb/Pfizer EEIG, Bristol-Myers Squibb House, Uxbridge Business Park, Sanderson Road,Uxbridge, Middlesex UB8 1DH
Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/11/691/006
EU/1/11/691/007
EU/1/11/691/008
EU/1/11/691/009
EU/1/11/691/010
EU/1/11/691/011
EU/1/11/691/012
EU/1/11/691/014
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 18. máj 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.