
obsahujúcich fentanyl
Z dôvodu odlišných absorpčných profilov sa prechod nesmie vykonať v pomere 1:1. Ak sa prechádza z iného perorálneho fentanyl citrátového lieku, je nutná nezávislá titrácia dávky Effentorou, pretože biologická dostupnosť jednotlivých liekov sa významne odlišuje. Avšak u týchto pacientov, je možné zvážiť úvodnú dávku nad 100 mikrogramov.
Spôsob titrácie
Ak sa počas titrácie nedosiahne adekvátne zvládnutie bolesti do 30 minút od začiatku podania jednej tablety, môže sa použiť druhá tableta rovnakej sily Effentory.
Ak si liečba príhody BTP vyžadovala viac ako jednu tabletu, odporúča sa zvýšiť dávku pri liečbe
nasledujúcej príhody BTP na najbližšiu vyššiu dostupnú silu.
Počas titrácie sa môže použiť viac tabliet: najviac štyri 100 mikrogramové alebo najviac štyri 200 mikrogramové tablety sa môžu použiť na liečbu jednotlivej príhody BTP počas titrácie dávky podľa nasledovnej schémy:
• Ak úvodná 100 mikrogramová tableta nie je účinná, poučte pacienta, aby pri liečbe budúcej príhody BTP použil dve 100 mikrogramové tablety. Odporúča sa umiestniť do úst jednu tabletu vľavo a druhú tabletu vpravo. Ak sa takáto dávka považuje za účinnú dávku, pri liečbe nasledujúcej príhody BTP pokračujte s jednou 200 mikrogramovou tabletou Effentory.
• Ak sa jedna 200 mikrogramová tableta Effentory (alebo dve 100 mikrogramové tablety) nepovažuje za účinnú, poučte pacienta, aby užil dve 200 mikrogramové tablety (alebo štyri 100 mikrogramové tablety) na liečbu nasledujúcej príhody BTP. Odporúča sa umiestniť do úst dve tablety vľavo a dve tablety vpravo. Ak sa takáto dávka považuje za účinnú dávku, pri liečbe nasledujúcej príhody BTP pokračujte s jednou 400 mikrogramovou tabletou Effentory.
• Pre titráciu 600 mikrogramov a 800 mikrogramov sa majú použiť 200 mikrogramové tablety.
Dávky nad 800 mikrogramov neboli hodnotené v klinických štúdiách.
Na liečbu jednotlivých príhod BTP sa nemajú použiť viac ako dve tablety, okrem titrácie, kedy je možno použiť až štyri tablety, ako je uvedené vyššie.
Pacienti majú počkať aspoň 4 hodiny pred liečbou ďalšej príhody BTP Effentorou.
Udržiavacia terapia
Po dosiahnutí účinnej dávky počas titrácie môže pacient pokračovať v užívaní tejto dávky v jednej tablete danej sily. Epizódy prelomovej bolesti sa môžu líšiť v intenzite a požadovaná dávka Effentory sa môže časom zvýšiť vzhľadom na progresiu základnej nádorovej choroby. V týchto prípadoch možno užiť druhú tabletu Effentory s rovnakou silou. Ak sa niekoľkokrát za sebou vyžadovalo použitie druhej tablety Effentory, musí sa upraviť zvyčajná udržiavacia dávka (pozri nižšie). Pacienti musia počkať aspoň 4 hodiny pred ďalšou liečbou BTP epizódy Effentorou počas udržiavacej liečby.
Opätovná úprava dávky
Udržiavacia dávka Effentory sa má zvýšiť, ak pacient pri niekoľkých po sebe nasledujúcich príhodách
BTP vyžaduje pre liečbu príhody BTP viac ako jednu tabletu. V prípade opätovnej úpravy dávky platia tie isté princípy ako pre titráciu dávky (viď vyššie).
Opätovná úprava dávky základnej opioidnej liečby môže byť potrebná, ak má pacient stabilne viac
ako štyri príhody BTP počas 24 hodín.
Ukončenie liečby
Effentora sa má okamžite vysadiť, ak už pacient viac nepociťuje epizódy prelomovej bolesti. Liečba perzistentnej základnej bolesti má zostať podľa predpisu.
Ak je potrebné ukončiť všetku opiátovú liečbu, pacienta musí pozorne sledovať lekár, aby sa zvládlo
riziko náhlych abstinenčných účinkov.
Poškodenie pečene alebo obličiek
Effentora sa má podávať s opatrnosťou pacientom so stredne závažným a závažným poškodením
pečene alebo obličiek (pozri časť 4.4).
Pacienti s xerostómiou
Pacientom s xerostómiou sa pred podaním Effentory odporúča vypiť vodu na zvlhčenie ústnej dutiny. Ak toto odporúčanie nepomôže k riadnemu rozpúšťaniu tablety šumením, možno odporučiť zmenu liečby.
Použitie u starších osôb (starších ako 65 rokov)
V klinických štúdiách mali pacienti starší ako 65 rokov tendenciu titrovať skôr nižšie účinné dávky
v porovnaní s mladšími pacientmi. Odporúča sa zvýšená opatrnosť pri titrácii dávky Effentory
u starších pacientov.
Pediatrická populácia
Bezpečnosť a účinnosť Effentory u detí vo veku 0 až 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Akonáhle je tableta Effentora vystavená vlhkosti, rozbieha sa efervescentná reakcia, ktorou sa
uvoľňuje liečivo. Preto majú byť pacienti poučení, aby neotvárali blister, kým nie sú pripravení
umiestniť tabletu do ústnej dutiny.
Otvorenie blistrového balenia
Pacient musí byť poučený, aby sa nepokúšal pretlačiť tabletu cez blister, keďže to by bukálnu tabletu mohlo poškodiť. Správna metóda výberu tablety z blistra je nasledujúca:
Oddeľte jednu z blistrových jednotiek z blistrovej karty tým, že ju odtrhnete v mieste perforácie. Potom blister prehnite pozdĺž čiary vytlačenej na zadnej strane fólie tak, ako je to naznačené. Odstránením fólie zo zadnej strany sa dostanete k tablete.
Pacienti sa musia poučiť, aby sa tabletu nepokúšali rozdrviť či rozdeliť.
Akonáhle je tableta vybratá z blistrového balenia, nemá sa už skladovať, pretože jej integrita už nemôže byť zaručená a vzniká riziko náhodného požitia tablety.
Podanie tablety
Pacienti majú uvoľniť tabletu z blistra a ihneď umiestniť celú tabletu do ústnej dutiny (blízko stoličky medzi tvár a ďasná).
Tableta Effentora sa nemá cmúľať, hrýzť ani prehĺtať, keďže to spôsobí nižšiu koncentráciu v plazme
v porovnaní s predpísaným použitím.
Effentora má byť umiestnená a zostať v ústnej dutine po dobu dostatočnú na rozpustenie tablety, čo je zvyčajne 14-25 minút.
Prípadne sa tableta môže umiestniť sublinguálne (pozri časť 5.2).
Ak zostanú nejaké zvyšky tablety Effentora v ústach po 30 minútach, možno ich prehltnúť a zapiť
pohárom vody.
Zdá sa, že doba potrebná k úplnému rozpadnutiu tablety po podaní cez sliznicu úst neovplyvňuje
skorú systémovú expozíciu fentanylu.
Pacient nemá konzumovať žiadne jedlá ani nápoje, pokiaľ je tableta v ústnej dutine.
V prípade dráždenia ústnej sliznice sa odporúča zmena umiestnenia tablety v ústnej dutine.
4.3 Kontraindikácie
• Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Pacienti bez udržovacej liečby opioidmi kvôli zvýšenému riziku útlmu dýchania.
• Závažný útlm dýchania alebo závažná obštrukcia pľúc.
• Liečba akútnej bolesti okrem prelomovej bolesti.
4.4 Osobitné upozornenia a opatrenia pri používaní
N
áhodné použitie u detí
Pacienti a zdravotníci, ktorí sa o pacientov starajú, musia byť informovaní o tom, že Effentora obsahuje liečivo v množstve, ktoré môže byť najmä pre dieťa smrteľné. Preto musia uchovávať všetky tablety mimo dohľadu a dosahu detí.
Sledovanie pacienta
Z dôvodu minimalizácie rizík nežiaducich účinkov spojených s opioidmi a na stanovenie účinnej dávky je absolútne nevyhnutné starostlivé sledovanie pacienta odborným zdravotníckym pracovníkom počas procesu titrovania dávky.
Udržiavacialiečbaopioidmi
Skôr ako sa začne s terapiou Effentorou, je dôležité stabilizovať udržiavaciu liečbu opioidmi používanými k liečbe pretrvávajúcej bolesti pacienta a je dôležité, aby sa počas užívania Effentory pokračovalo v udržiavacej liečbe pacienta opioidmi.
Respiračnádepresia
Rovnako ako u všetkých opioidov, existuje pri použití fentanylu riziko klinicky významného útlmu dýchania. Nesprávna voľba pacienta (napr. použitie u pacientov bez udržovacej liečby opioidmi) a/alebo nesprávne dávkovanie viedli k fatálnym následkom s Effentorou ako aj s inými liekmi
s obsahom fentanylu.
Effentora sa má používať len pri stavoch uvedených v časti 4.1.
Chronickáobštrukčnáchorobapľúc
Opatrnosť je nevyhnutná najmä pri titrácii Effentory u pacientov s nezávažnou chronickou obštrukčnou chorobou pľúc alebo iným zdravotným stavom, ktorý ich predisponuje k útlmu dýchania, keďže aj bežné terapeutické dávky Effentory môžu ešte viac spomaliť dýchanie a prípadne spôsobiť
až respiračné zlyhanie.
Alkohol
Súbežné užívanie alkoholu s fentanylom môže viesť k zvýšeniu tlmivého účinku, čo môže mať fatálne
následky (pozri časť 4.5).
Zvýšený intrakraniálny tlak, porucha vedomia
Mimoriadnu opatrnosť si vyžaduje podávanie Effentory pacientom, ktorí by mohli byť zvlášť citliví na intrakraniálny účinok zadržiavania CO2 ako napr. pacienti s preukázaným zvýšeným intrakraniálnym tlakom alebo zníženou úrovňou vedomia. Opioidy môžu prekryť klinický prejav pacienta s poraneniami hlavy a mali by sa použiť iba v klinicky oprávnených prípadoch.
Poruchy srdca
Fentanyl môže spôsobiť bradykardiu. Pacienti s predchádzajúcou alebo už existujúcou bradyarytmiou
majú užívať fentanyl s opatrnosťou.
Poškodeniefunkciepečeneaobličiek
Effentora by mala byť podávaná s opatrnosťou aj pacientom s poškodením pečene alebo obličiek. Vplyv pečeňového alebo obličkového poškodenia na farmakokinetiku tohto lieku sa nehodnotil, avšak pri intravenóznom podaní sa ukázalo, že klírens fentanylu bol zmenený pri pečeňovom alebo obličkovom poškodení v dôsledku zmien metabolického klírens a plazmatických proteínov. Znížené pečeňové a obličkové funkcie môžu po podaní obe zvýšiť dostupnosť prehltnutého fentanylu a znížiť jeho systémový klírens, čo môže viesť k zvýšenému a predĺženému opioidnému účinku. Preto má byť pacientom so stredným až závažným poškodením pečene a obličiek venovaná zvláštna starostlivosť počas procesu titrácie.
Podanie lieku pacientom s hypovolémiou a hypotenziou má byť starostlivo zvážené.
Serotonínový syndróm
Pri súbežnom podávaní Effentory s liekmi, ktoré ovplyvňujú serotonínergické neurotransmiterové systémy, sa odporúča opatrnosť.
Pri súbežnom používaní so serotonínergickými liekmi, ako sú napríklad selektívne inhibítory spätného vychytávania serotonínu (SSRI) a inhibítory spätného vychytávania serotonínu a norepinefrínu
(SNRI), a s liekmi zhoršujúcimi metabolizmus serotonínu (vrátane inhibítorov monoamínoxidázy
[IMAO]), môže dôjsť k rozvoju serotonínového syndrómu potenciálne ohrozujúceho život. K tomu
môže dochádzať v rámci odporúčanej dávky.
Serotonínový syndróm môže zahŕňať zmeny duševného stavu (napríklad agitáciu, halucinácie, kómu), autonómnu nestabilitu (napríklad tachykardiu, nestabilný krvný tlak, hypertermiu), neuromuskulárne anomálie (napríklad hyperreflexiu, poruchu koordinácie, stuhnutosť) a/alebo gastrointestinálne symptómy (napríklad nevoľnosť, vracanie, hnačku).
Ak existuje podozrenie na serotonínový syndróm, liečba Effentorou sa má ukončiť. Tolerancia,závislosť
Po opakovanom podaní opioidov ako je fentanyl sa môže vyvinúť tolerancia a psychická a/alebo
fyzická závislosť. Avšak iatrogénna závislosť po liečebnom použití opioidov je vzácna.
Diéta s kontrolovaným príjmom sodíka
Effentora 100 mikrogramov bukálne tablety obsahuje 10 mg sodíka v jednej tablete.
Effentora 200, 400, 600 a 800 mikrogramov bukálne tablety obsahujú 20 mg sodíka v jednej tablete. Má sa vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Anafylaxia a precitlivenosť
Anafylaxia a precitlivenosť boli hlásené v súvislosti s použitím perorálnych liekov s obsahom fentanylu absorbovaného sliznicou (pozri časť 4.8).
4.5 Liekové a iné interakcie
Látky,ktoréovplyvňujúaktivituCYP3A4
Fentanyl sa metabolizuje najmä prostredníctvom ľudského cytochrómu P450, izoenzýmom 3A4, takže
potenciálne interakcie môžu nastať pri súčasnom podaní látok, ktoré ovplyvňujú aktivitu CYP3A4.
Induktory CYP3A4
Súčasné podanie s látkami, ktoré indukujú aktivitu 3A4 môže viesť k zníženiu účinku Effentory.
Inhibítory CYP3A4
Súčasné použitie Effentory so silnými inhibítormi CYP3A4 (napr. ritonavirom, ketokonazolom, itrakonazolom, troleandomycínom, klaritromycínom a nelfinavirom) alebo strednými CYP3A4 inhibítormi (napr. amprenavirom, aprepitantom, diltiazémom, erytromycínom, flukonazolom, fosamprenavirom, grepfruitovým džúsom a verapamilom) môže spôsobiť zvýšenie plazmatických koncentrácií fentanylu a potenciálne spôsobiť závažné nežiaduce účinky liečiva vrátane fatálnej respiračnej depresie. Pacienti, ktorí dostávajú Effentoru súčasne so stredne silnými alebo silnými inhibítormi CYP3A4 by mali byť starostlivo monitorovaní po dlhší časový úsek. Dávka by sa mala zvyšovať iba opatrne.
Látky,ktorémôžuzvýšiťtlmivýúčinoknaCNS
Súbežné podávanie fentanylu s inými látkami spôsobujúcimi útlm centrálneho nervového systému - vrátane iných opioidov, sedatív alebo hypnotík, celkových anestetík, fenotiazinov, trankvilizérov, myorelaxans, sedatívnych antihistaminík a alkoholu - môže mať tlmiaci účinok, čo môže mať fatálne následky (pozri časť 4.4).
Čiastočnéopioidnéagonisty/antagonisty
Súčasné podávanie čiastočných opioidových agonistov/antagonistov (napr.buprenorfin, nalbufin a pentazocín) sa neodporúča. Majú vysokú afinitu k opioidovým receptorom s relatívne nízkou vlastnou aktivitou a preto čiastočne antagonizujú analgetický účinok
fentanylu a môžu vyvolať abstinenčné príznaky u pacientov závislých na opioidoch.
Serotonínergické látky
Súbežné podávanie fentanylu s nejakým serotonínergickým liekom, napríklad so selektívnym inhibítorom spätného vychytávania serotonínu (SSRI), inhibítorom spätného vychytávania serotonínu a norepinefrínu (SNRI) alebo inhibítorom monoamínoxidázy (IMAO), môže zvyšovať riziko vzniku serotonínového syndrómu, čo je stav potenciálne ohrozujúci život. Používanie Effentory sa neodporúča u pacientov, ktorí v posledných 14 dňoch užívali IMAO, pretože bola hlásená závažná
a nepredvídateľná potenciácia opioidných analgetík inhibítormi MAO.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití fentanylu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre človeka nie je známe. Effentora sa nemá používať počas gravidity, ak to nie je jednoznačne nevyhnutné.
Pri dlhodobom používaní fentanylu počas gravidity existuje riziko vzniku neonatálneho opioidného abstinenčného syndrómu, ktorý môže byť život ohrozujúci, ak sa nerozpozná a nelieči a ktorý si vyžaduje liečbu podľa protokolov vyvinutých odborníkmi pre neonatológiu. Ak sa u gravidnej ženy vyžaduje dlhodobé používanie opioidov, je nutné pacientku upozorniť na riziko vzniku neonatálneho opioidného abstinenčného syndrómu a zabezpečiť dostupnosť vhodnej liečby (pozri časť 4.8).
Keďže fentanyl prechádza placentou a môže spôsobiť útlm dýchania plodu, neodporúča sa použitie fentanylu počas celého pôrodu (vrátane cisárskeho rezu). Ak je Effentora použitá, musí byť pre dieťa pripravené antidótum.
Laktácia
Fentanyl prechádza do materského mlieka a môže spôsobiť u dojčeného dieťaťa sedáciu a útlm dýchania. Fentanyl sa nemá používať u dojčiacich žien a dojčenie sa nemá opätovne začať aspoň 5 dní po poslednom podaní fentanylu.
Fertilita
Nie sú dostupné údaje o fertilite u ľudí. Štúdie na zvieratách preukázali poruchu fertility u samcov
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Avšak opioidné analgetiká znižujú mentálnu a/alebo telesnú schopnosť potrebnú k vykonávaniu potenciálne nebezpečných úloh (napr. vedenie vozidla alebo obsluhovanie stroja). Pacientom má byť odporúčané, aby neviedli vozidlo ani neobsluhovali stroje, ak sa u nich počas užívania Effentory prejaví ospalosť, závraty alebo poruchy videnia a aby neviedli vozidlo ani neobsluhovali stroje, až kým nezistia, ako reagujú na liečbu.
4.8 Nežiaduce účinky
Súhrnnýbezpečnostnýprofil
U Effentory možno očakávať typické nežiaduce reakcie opioidov. Tieto často odoznejú alebo sa
v priebehu užívania tohto lieku ich intenzita zníži s tým, ako je pacient vytitrovaný na najvhodnejšiu dávku. Avšak všetci pacienti by mali byť veľmi dôsledne sledovaní, či sa u nich neprejavia najzávažnejšie nežiaduce účinky, ktorými sú útlm dýchania (potenciálne vedúci k apnoe alebo zástave dychu), útlm cirkulácie, hypotenzia a šok.
Klinické štúdie Effentory boli zamerané na vyhodnotenie bezpečnosti a účinnosti pri liečbe BTP
a všetci pacienti užívali na liečbu pretrvávajúcej bolesti súčasne s Effentorou aj opioidy ako napríklad morfín s postupným uvoľňovaním alebo transdermálny fentanyl. Preto nie je možné jednoznačne vyhodnotiť účinok samotnej Effentory.
Tabuľkovýprehľadnežiaducichreakcií
Nasledovné nežiaduce reakcie boli hlásené s Effentorou a/alebo inými zlúčeninami obsahujúcimi fentanyl počas klinických štúdií a z postmarketingových skúseností. Nežiaduce reakcie sú uvedené nižšie ako preferované výrazy podľa triedy orgánových sytémov MedDRA a frekvencie výskytu (frekvencie sú definované ako: veľmi časté ≥1/10, časté ≥1/100 až <1/10, menej časté ≥ 1/1000 až <
1/100 zriedkavé ≥1/10 000 až <1/1000, neznáme (z dostupných údajov); V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti:
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Infekcie a nákazy Poruchy krvi
a lymfatickéh
o systému Poruchy imunitného systému Poruchy endokrinného systému
Poruchy metabolizmu a výživy Psychické
Kandidóza ústnej dutiny
Anémia
Neutropénia
Anorexia
Faryngitída Pustuly v ústnej dutine
Trombocytopénia
Preci-
tlivenosť*
Hypo- gonadizmus
Euforická nálada
Adrenálna nedosta- točnosť, nedostatok androgénu
poruchy Depresia
Anxieta
Stav zmätenosti
Nespavosť
Nervozita
Halucinácie Vizuálne halucinácie
Zmeny mentálneho stavu
Lieková závislosť (návyk)* Dezorientácia
Poruchy nervového systému
Závraty
Bolesť hlavy
Porucha chuti Ospalosť Letargia
Tras Sedácia Hypoestézia Migréna
Znížená úroveň vedomia Poruchy pozornosti Poruchy rovnováhy Dysartria
Kognitívne poruchy Motorické poruchy
Strata vedomia* Kŕče

Poruchy oka Poruchy videnia Očná hyperémia Rozmazané videnie
Znížená ostrosť
videnia
Abnormálne pocity v oku Fotopsia
Poruchy ucha a labyrintu
Poruchy srdca a srdcovej činnosti
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Vertigo Tinnitus Nepríjemný pocit v ušiach
Tachykardia Bradykardia
Poruchy ciev Hypotenzia
Hypertenzia
Návaly tepla
Sčervenanie
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestin álneho traktu
Nauzea
Dávenie
Dyspnoe Faryngolaryngeál na bolesť
Zápcha Stomatitída Sucho v ústach Hnačka
Bolesť brucha Gastro- ezofageálny reflux Žalúdočné ťažkosti Dyspepsia Bolesť zubov
Respiračná
depresia
Syndróm apnoe v spánku
Ileus
Ulcerácie v ústach Znížená citlivosť v ústach
Ústny diskomfort Zmena farby ústnej sliznice Poruchy mäkkých tkanív úst Glosodýnia Pľuzgiere na jazyku
Bolesť ďasien
Ulcerácie na jazyku
Poruchy jazyka
Ezofagitída
Popraskané pery
Ťažkosti so
zubami
Pľuzgiere ústnej sliznice Suché pery
Respiračná
zástava*

Poruchy
pečene a žlčových ciest Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Pruritus Hyperhydróza Vyrážky
Myalgia
Bolesť chrbta
Biliárna dilatácia
Studený pot Opuchy v tvári Generalizovaný pruritus Alopécia Zášklby svalov Svalová slabosť
Lámavosť
nechtov
Poruchy
obličiek
a močových
ciest
Veľmi časté Časté Menej časté Zriedkavé Neznáme
Retencia moču
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Reakcie v mieste podania vrátane krvácania, bolesti, vredu, dráždenia, parestézie, anestézie, erytému, edému, opuchu a vezikulám
Periférny edém, únava
Asténia, Abstinenčný syndróm lieku* Zimnica
Zníženie telesnej hmotnosti
Pád
Pocit nevoľnosti Malátnosť Diskomfort na hrudníku Abnormálne pocity
Pocity nervozity Pocity smädu Pocity chladu Pocity horúčavy Znížený počet krvných doštičiek Zvýšenie srdcovej frekvencie Zníženie hematokritu Zníženie hemoglobínu
Pyrexia Neonatálny abstinenčný syndróm (pozri
časť 4.6)

* Pozri časť „Popis vybraných nežiaducich reakcií“.
Popis vybraných nežiaducich reakciíTolerancia, fyzická a psychická závislosť sa môže vyvinúť po opakovanom podaní opioidov ako je
fentanyl (pozri časť 4.4).
Abstinenčné príznaky z vysadenia opioidu ako sú nauzea, dávenie, hnačka, úzkosť, zimnica, tras
a potenie sa pozorovali pri používaní fentanylu vstrebávaného cez sliznicu.
V súvislosti s predávkovaním sa pozorovala strata vedomia a respiračná zástava (pozri časť 4.9). Reakcie z precitlivenosti boli hlásené po uvedení lieku na trh vrátane vyrážky, erytému, opuchu pier
a tváre a žihľavky (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyDá sa predpokladať, že príznaky predávkovania fentanylom budú vo svojej podstate podobné
príznakom predávkovania intravenóznym fentanylom a inými opioidmi a sú len vystupňovaním jeho farmakologických účinkov, pričom najzávažnejšie signifikantné účinky sú zmena mentálneho stavu,
strata vedomia, hypotenzia, útlm dýchania, ťažkosti s dýchaním a zlyhanie dýchania, ktoré viedli k úmrtiu.
Liečba
Okamžité riešenie predávkovania opioidom zahŕňa odstránenie bukálnej tablety Effentora, ak je ešte
stále v ústach, zaistenie voľných dýchacích ciest, fyzická a verbálna stimulácia pacienta, zhodnotenie úrovne vedomia, stavu dýchania a obehu a, v prípade potreby, asistovanú ventiláciu.
Predávkovanie (náhodné požitie) u osoby, ktorá neužíva opioidy
Pre liečbu predávkovania (náhodným požitím) u osoby, ktorá neužíva opioidy, sa musí zaistiť intravenózny prístup a nasadiť klinicky indikovaný naloxón alebo iný opioidný antagonista. Trvanie útlmu dýchania môže byť dlhšie ako účinok opioidného antagonistu (napr. polčas naloxónu sa pohybuje od 30 do 81 minút) a môže byť nutné jeho opakované podanie. Presnejšie informácie
o takomto použití nájdete v Súhrne charakteristických vlastností lieku príslušného opioidného antagonistu.
Predávkovanie u pacientov na udržiavacej liečbe opioidmi
Pre liečbu predávkovania pacientov na udržiavacej liečbe opioidmi sa musí zaistiť intravenózny prístup. Rozvážne použitie naloxónu alebo iného opioidného antagonistu môže byť v niektorých prípadoch oprávnené, ale je spojené s rizikom vzniku akútneho abstinenčného syndrómu.
Hoci po užití Effentory nebola pozorovaná svalová stuhnutosť interferujúca s dýchaním, takáto stuhnutosť sa môže vyskytnúť pri užití fentanylu a iných opioidov. Ak sa vyskytne, jej zvládnutie spočíva v použití asistovaného dýchania, opioidného antagonistu a - ako posledná možnosť - v podaní neuromuskulárneho blokátora.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: analgetiká; ópioidné analgetiká (anodyná); ATC kód: N02AB03.
Mechanizmusúčinkuafarmakodynamickéúčinky
Fentanyl je ópioidné analgetikum, ktoré pôsobí predovšetkým na µ–receptor. Jeho primárnymi terapeutickými účinkami sú analgézia a sedácia. Sekundárnymi farmakologickými účinkami sú útlm dýchania, bradykardia, hypotermia, obstipácia, mióza, fyzická závislosť a eufória.
Analgetický účinok fentanylu závisí na jeho plazmatickej hladine. Vo všeobecnosti platí, že účinná
koncentrácia a koncentrácia, pri ktorej sa prejavuje toxicita, sa zvyšujú s rastúcou toleranciou
k opioidom. Rýchlosť rozvoja tolerancie sa veľmi líši medzi jednotlivcami. Preto je potrebné dávku
Effentory individuálne titrovať, aby sa dosiahol požadovaný účinok (pozri časť 4.2).
Každý agonista opioidných µ-receptorov, vrátane fentanylu, spôsobuje na dávke závislý útlm dýchania. Riziko útlmu dýchania je nižšie u pacientov na dlhodobej opioidnej liečbe, keďže sa u týchto pacientov vyvinie tolerancia na útlm dýchania.
Opioidy môžu ovplyvniť činnosť hypotalamo-hypofýzo-nadobličkovej alebo hypotalamo-hypofýzo- gonádovej osi. Niektoré viditeľné zmeny zahŕňajú zvýšenie sérovej hladiny prolaktínu a zníženia plazmatických hladín kortizolu a testosterónu. Ako dôsledok týchto hormonálnych zmien sa môžu prejaviť klinické prejavy a príznaky (pozri tiež časť 4.8).'
Klinickáúčinnosťabezpečnosť
Bezpečnosť a účinnosť Effentory sa hodnotila u pacientov užívajúcich liek pri nástupe príhody prelomovej bolesti. Preventívne používanie Effentory pri predvídateľných epizódach bolesti nebolo
v klinických hodnoteniach skúmané. Dve dvojito zaslepené, randomizované, placebom kontrolované, skrížené štúdie boli vykonané na celkovom počte 248 pacientov s BTP a rakovinou, u ktorých sa vyskytli v priemere 1 až 4 príhody BTP za deň pri súčasnom užívaní udržiavacej opioidnej terapie. Počas úvodnej otvorenej (angl. „open label“) štúdie boli pacienti titrovaní na účinnú dávku Effentory. Pacienti, u ktorých bola stanovená účinná dávka, vstúpili do dvojito zaslepenej fázy štúdie. Hlavnou meranou premennou účinnosti bolo hodnotenie intenzity bolesti pacientmi. Pacienti hodnotili
intenzitu bolesti na 11-bodovej stupnici. Intenzita bolesti bola pri každej príhode BTP stanovená vždy
pred liečbou a potom niekoľkokrát po liečbe.
Šesťdesiatim siedmim percentám pacientov bolo možné vytitrovať účinnú dávku.
V pilotnej klinickej štúdii (štúdia 1), hlavným cieľom bola priemerná hodnota rozdielov v hodnoteniach bolesti od podania lieku po nasledujúcich 60 minút, vrátane (SPID60); výsledok bol štatisticky významný v porovnaní s placebom (p<0,0001).

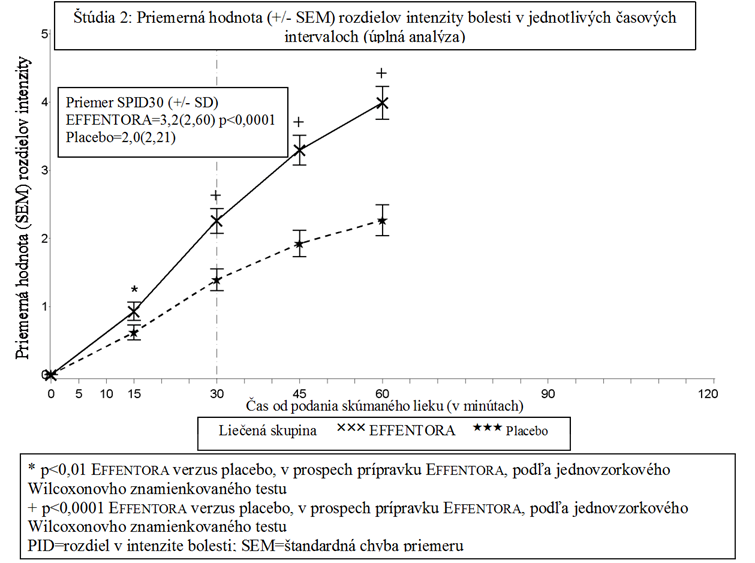
V druhej pilotnej štúdii (štúdia 2) bolo primárnym cieľom SPID30, čo bolo taktiež štatisticky
významné v porovnaní s placebom (p<0,0001).
Štatisticky významné zlepšenie v rozdiele intenzity bolesti pri použití Effentory versus placebo bolo zaznamenané už po 10 minútach v Štúdii 1 a už po 15 minútach (prvé meranie po podaní) v Štúdii 2. Tieto rozdiely boli významné aj v každom ďalšom časovom bode oboch štúdií.
5.2 Farmakokinetické vlastnostiVšeobecný úvodFentanyl je vysoko lipofilný a cez ústnu sliznicu sa veľmi rýchlo vstrebáva, o niečo pomaľšie bežnou gastrointestinálnou cestou. Podlieha first-pass efektu v pečeni a taktiež intestinálnemu metabolizmu. Jeho metabolity neprispievajú k terapeutickému účinku fentanylu.
V Effentore je použitá technológia liekovej formy, ktorá využíva efervescentnú reakciu zlepšujúcu rýchlosť a množstvo fentanylu absorbovaného cez sliznicu úst. Prechodné zmeny pH, ku ktorým dochádza pri efervescentnej reakcii, môžu zlepšovať rozpúšťanie (pri nižšom pH) a permeáciu cez membránu (pri vyššom pH).
Kľudová doba (angl. „dwell time“ - definovaná ako časový úsek potrebný na to, aby sa tableta po bukálnom podaní úplne rozpustila), neovplyvňuje skorú systémovú expozíciu fentanylu. Porovnávacia štúdia medzi podaním jednej 400 μg tablety Effentory podanej buď bukálne (t.j. medzi líce a ďasno) alebo sublinguálne splnila kritéria bioekvivalencie.
Vplyv obličkového alebo pečeňového poškodenia na farmakokinetiku Effentory sa v štúdiách neskúmal.
A
bsorpcia:
Po podaní Effentory cez ústnu sliznicu sa fentanyl rýchlo absorbuje s celkovou biologickou dostupnosťou 65%. Absorpčný profil Effentory je tvorený najmä rýchlou úvodnou absorpciou zo sliznice ústnej dutiny, pričom maximálna plazmatická koncentrácia zistená z krvných vzoriek sa dosiahne zvyčajne do jednej hodiny po orálnom podaní. Približne 50% podanej dávky sa rýchle vstrebáva cez sliznicu a stáva sa systémovo dostupným. Zostávajúca polovica celkovej podanej dávky sa prehltne a pomaly absorbuje z tráviaceho traktu. Asi 30% z prehltnutého množstva (50% z celkovej dávky) unikne elimináciou pečeňovým a intestinálnym first-pass efektom a stáva sa systémovo dostupným.
Hlavné farmakokinetické parametre sú uvedené v nasledujúcej tabuľke.
Farmakokinetické parametre* u dospelých jedincov, ktorí užívajú Effentoru
F
armakokinetický
parameter (stredná hodnota)
Effentora 400 mikrogramov
C
elková biologická dostupnosť 65% (
±20%)
Podiel absorbovaný sliznicou 48% (
±31,8%)
 Tmax (v minútach) ** 46,8
Tmax (v minútach) ** 46,8 (20-240)
Cmax (ng/ml) 1,02 (± 0,42)
AUC0-tmax (ng.hr/ml) 0,40 (± 0,18)
AUC0-inf (ng.hr/ml) 6,48 (± 2,98)
* Na základe venóznych krvných vzoriek (plazma). Koncentrácie fentanylu získané v sére boli
vyššie ako v plazme. Sérové AUC a Cmax boli približne o 20 % a 30 % vyššie ako plazmové AUC a
Cmax v jednotlivých prípadoch. Dôvod spôsobujúci tento rozdiel nie je známy.
** Údaje pre Tmax prezentované ako medián (rozsah).
Vo farmakokinetických štúdiách, ktoré porovnávali absolútnu a relatívnu biologickú dostupnosť Effentory a perorálneho fentanyl citrátu vstrebávaného cez ústnu sliznicu (OTFC), sa ukázalo, že rýchlosť a množstvo absorbovaného fentanylu u Effentory bolo o 30% až 50% vyššie ako po podaní perorálneho fentanyl citrátu vstrebávaného cez ústnu sliznicu. Ak sa prechádza z iného perorálneho fentanyl citrátového lieku, je nutná nezávislá titrácia dávky Effentorou, pretože biologická dostupnosť jednotlivých liekov sa významne odlišuje. Avšak u týchto pacientov, je možné zvážiť úvodnú dávku nad 100 mikrogramov.

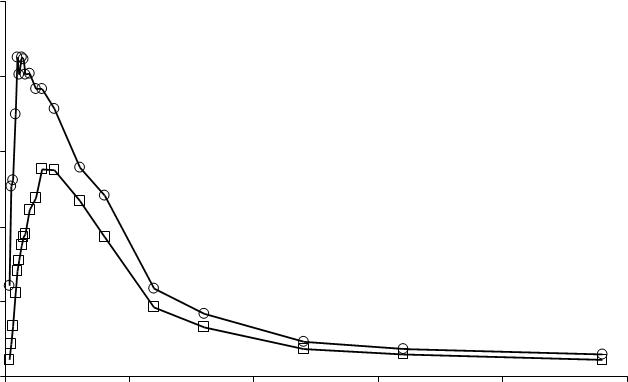
Priemerná plazmatická koncentrácia v čase

Profily po jednotlivej dávke prípravku
EFFENTORA a OTFC u zdravých jedincov
1.0

1.0
400 mcg
EFFENTORA
OTFC (normalizované na 400 mcg)
0.8
0.8
0.6
0.6
0.4
0.4
0.2

0.2
0.0
0 1 2 3 4 5 6
0.0
0 5 10 15 20 25
Čas po podaní dávky (v hodinách)
Dáta OTFC boli spracované po úprave (800 mcg na 400 mcg)
V klinických štúdiách boli pozorované rozdiely v množstve systémovo vstrebanej dávky Effentory
u pacientov s mukozitídou 1. stupňa. Cmax a AUC0-8 boli o 1% až 25% vyššie u pacientov
s mukozitídou v porovnaní s pacientmi bez mukozitídy. Pozorované rozdiely neboli signifikantné.
Distribúcia
Fentanyl je vysoko lipofilný a dobre sa distribuuje z krvného obehu s veľkým zdanlivým distribučným objemom. Po bukálnom podaní Effentory podstupuje fentanyl úvodnú rýchlu distribúciu, ktorá vyrovnáva hladiny fentanylu medzi plazmou a vysoko prekrvenými tkanivami (mozog, srdce a pľúca). Potom dochádza k redistribúcii fentanylu medzi kompartment hlbších tkanív (svaly a tuk) a plazmu.
80% až 85% fentanylu sa viaže na plazmatické proteíny. Hlavným proteínom, na ktorý sa viaže je alfa-1-kyslý glykoproteín, ale do istej miery to sú aj albumín a lipoproteíny. Voľná frakcia fentanylu sa zvyšuje s acidózou.
Biotransformácia
V klinických štúdiách sa nepopisovali metabolické cesty po bukálnom podaní lieku Effentora. Fentanyl sa metabolizuje v pečeni a mukóze črevnej steny na norfentanyl izoformou enzýmu CYP3A4. V štúdiach na zvieratách nie je norfentanyl farmakologicky aktívny. Viac ako 90% podanej dávky fentanylu sa eliminuje biotransformáciou na N-dealkylované a hydroxylované inaktívne metabolity.
Eliminácia
Po intravenóznom podaní fentanylu sa menej ako 7% podanej dávky vylúči v nezmenenej forme močom a iba asi 1% sa nezmenené vylúči stolicou. Metabolity sa vylučujú predovšetkým do moču, kým vylučovanie stolicou je menej významné.
Terminálna eliminačná fáza fentanylu po podaní Effentory je výsledkom redistribúcie medzi plazmou
a kompartmentom hlbších tkanív. Táto fáza eliminácie je pomalá, jej dôsledkom je stredný polčas
terminálnej eliminácie t1/2 po bukálnom podaní efervescentnej formy asi 22 hodín a po intravenóznom podaní asi 18 hodín. Celkový plazmatický klírens fentanylu po intravenóznom podaní je asi 42 l/h.
Linearita/nelinearita
Linearita bola preukázaná pri dávkach od 100 mikrogramov do 1000 mikrogramov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po
opakovanom podávaní, genotoxicity a karcinogenity neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách toxicity embryo-fetálneho vývoja vykonaných na potkanoch a králikoch sa nezistili látkou
spôsobené malformácie alebo vývojové zmeny, keď sa liek podal počas obdobia organogenézy.
V štúdii fertility a skorého embryonálneho vývoja u potkanov sa pozoroval samcami sprostredkovaný účinok pri vysokých dávkach (300 μg/kg/deň, s.c.) a považuje sa za sekundárny k sedatívnym účinkom fentanylu v štúdiách so zvieratami.
V štúdiách pre- a postnatálneho vývoja u potkanov bol stupeň prežitia mláďat podstatne nižší pri dávkach spôsobujúcich závažnú materskú toxicitu. Ďalšie nálezy pri dávkach spôsobujúcich materskú toxicitu u F1 mláďat boli oneskorený fyzický vývoj, vývoj zmyslových orgánov, reflexov a správanie. Tieto účinky môžu byť buď nepriamymi účinkami spôsobenými zmenou materskej starostlivosti a/alebo zníženým stupňom laktácie alebo priamym účinkom fentanylu na mláďatá.
Štúdie karcinogenity (26-týždňový dermálny alternatívny biotest s Tg.AC transgénnymi myšami; dvojročná štúdia subkutánnej karcinogenity u potkanov) s fentanylom nepreukázali nálezy naznačujúce onkogénny potenciál. Vyhodnotenie vzoriek rezov mozgu zo štúdie karcinogenity vykonávanej na potkanoch odhalilo lézie na mozgu zvierat, ktorým sa podávali vysoké dávky fentanyl citrátu. Význam týchto nálezov pre ľudí je neznámy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Sodná soľ karboxymetylškrobu typ A Hydrogenuhličitan sodný
Uhličitan sodný bezvodný Kyselina citrónová bezvodná Magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Blister z PVC/hliníkovej fólie/polyamidu/PVC zalaminovaný hliníkovou fóliou s papierovou/polyesterovou plombou.
Blistrové balenia sa dodávajú v škatuliach po 4 alebo 28 tabletách. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuPacienti a osoby, ktoré sa o nich starajú, musia byť poučení, aby zlikvidovali všetky neotvorené
tablety, ktoré zostali z predpísaného množstva, a ktoré už nepotrebujú.
Všetky použité alebo nepoužité lieky, ktoré už viac nepotrebujete, a odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITEVA B.V. Swensweg 5
2031 GA Haarlem
Holandsko
8. REGISTRAČNÉ ČÍSLAEffentora 100 mikrogramov bukálne tabletyEU/1/08/441/001-002
Effentora 200 mikrogramov bukálne tabletyEU/1/08/441/003-004
Effentora 400 mikrogramov bukálne tabletyEU/1/08/441/005-006
Effentora 600 mikrogramov bukálne tabletyEU/1/08/441/007-008
Effentora 800 mikrogramov bukálne tabletyEU/1/08/441/009-010
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 4. apríl 2008
Dátum posledného predĺženia registrácie: 20. február 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.