
až do 100 mg. Nasleduje perorálna liečba klesajúcimi dávkami.
- Aktívna fáza reumatického systémového ochorenia ako je systémový lupus erythematosus:
Denné dávky 6 - 16 mg.
- Aktívna reumatoidná artritída so závažným, progredujúcim priebehom:
Denné dávky 12 - 16 mg pri rýchlych deštrukčných formách. Pri mimokĺbových prejavoch sa odporúčajú denné dávky 6 - 12 mg.
- Závažné infekčné choroby s toxickými stavmi (napr. tuberkulóza, týfus) iba so súbežnou liečbou antiinfektívami:
Denné dávky 4 - 20 mg i.v.. V individuálnych prípadoch (napr. týfus) je začiatočná dávka až do
200 mg.
- Paliatívna liečba malígnych tumorov:
Začiatočná dávka 8 - 16 mg/deň, pri dlhodobej liečbe 4 - 12 mg/deň.
- Profylaxia a liečba cytostatikami vyvolaného vracania pri antiemetickej liečbe:
10 - 20 mg i.v. pred začatím chemoterapie, potom podľa potreby 4 - 8 mg dva až trikrát denne počas 1 - 3 dní (stredne emetogénna chemoterapia) alebo do 6 dní (vysoko emetogénna
chemoterapia).
- Profylaxia a liečba pooperačného vracania:
Jednorazová dávka 8 - 20 mg i.v. pred začiatkom operácie.
Subkutánne podávanie:
- Paliatívna liečba malígnych tumorov, profylaxia a liečba cytostatikami vyvolanej nevoľnosti a vracania (chemotherapy-induced nausea and vomiting, CINV)
V paliatívnej starostlivosti môže byť Dexamethasone hameln podávaný subkutánnou injekciou alebo kontinuálnou subkutánnou infúziou (continuous subcutaneous infusion, CSCI). Dávky sa zvyčajne pohybujú v rozmedzí 4,8 - 19,3 mg počas 24 hodín, pričom treba zvážiť národné klinické pokyny a dávky upraviť podľa individuálnej odpovede pacienta.
Pediatrická populácia
- Opuch mozgu spôsobený bakteriálnou meningitídou:
U detí 0,4 mg/kg telesnej hmotnosti každých 12 hodín počas 2 dní. Liečbu začať pred prvou
dávkou antibiotík.
- Posttraumatický šok a profylaxia posttraumatického šokového syndrómu pľúc (acute respiratory distress syndrome, ARDS):
Začiatočná dávka u detí je 40 mg i.v., opakovaná dávka po 12 hodinách.
- Liečba COVID-19:
Dospievajúcim vo veku 12 rokov a starším sa odporúča podať 6 mg/dávka i.v. jedenkrát denne do
10 dní. Trvanie liečby sa má zohľadniť podľa klinickej odpovede a individuálnych požiadaviek
pacienta.
- Anafylaktický šok:
U detí 40 mg i.v. po predchádzajúcej aplikácii injekcie adrenalínu. Dávka sa môže v prípade potreby opakovať.
- Závažný akútny astmatický záchvat:
0,15 - 0,3 mg/kg telesnej hmotnosti i.v. alebo 1,2 mg/kg telesnej hmotnosti ako bolus, následne
0,3 mg/kg každých 4 - 6 hodín. Dodatočne sa môže intravenózne podať aminofylín.
- Profylaxia a liečba pooperačného vracania:
U detí starších ako dva roky 0,15 – 0,5 mg/kg telesnej hmotnosti. Maximálna dávka je 16 mg.
Dexamethasone hameln sa nemá použiť u predčasne narodených a donosených novorodencoch (pozri
časti 2 a 4.4).
Dexamethasone hameln obsahuje propylénglykol (20 mg v 1 ml) a preto sa má používať opatrne u dojčiat a detí mladších ako 5 rokov, najmä ak sú potrebné vyššie dávky alebo sa zvažuje dlhodobá liečba (pozri časti 2 a 4.4).
Lokál ne použit i e
Pri lokálnej infiltračnej a intraartikulárnej liečbe sa obvykle odporúča dávka 4 - 8 mg. Pri aplikácii do malých kĺbov sa zvyčajne podáva dávka nižšia, a to 2 mg.
Paci enti s por uchou f unkci e peč ene a obli čiek
Vzhľadom na obsah propylénglykolu v lieku je potrebné u pacientov s poruchou funkcie pečene alebo obličiek lekárske monitorovanie (pozri časti 2 a 4.4).
Pri hypotyreóze alebo cirhóze pečene môžu byť postačujúce nízke dávky alebo môže byť potrebné zníženie dávky.
Spôsob podávani a
Dĺžka liečby závisí od indikácie.
Dexamethasone hameln sa môže podávať bez miešania alebo riedenia.
Intravenózna, intramuskulárna, intraartikulárna injekcia alebo infiltrácia.
Alternatívne sa môže Dexamethasone hameln pridať, bez zníženia sily lieku, do 0,9% chloridu sodného,
5% glukózy alebo Ringerovho roztoku a podať intravenóznou infúziou:
- u dospelých nepretržite, prerušovane alebo pomocou infúznej trubice
- u detí počas 15 - 20 minút
V paliatívnej starostlivosti sa môže Dexamethasone hameln zriediť 0,9% chloridom sodným a podať pomocou kontinuálnej subkutánnej infúzie (continuous subcutaneous infusion, CSCI).
Infúzne roztoky sa musia použiť do 24 hodín, pričom je potrebné dodržať aseptické opatrenia.
Intraartikulárna injekcia sa má podať za prísnych aseptických podmienok. Na účinnú úľavu od príznakov zvyčajne postačuje jedna intraartikulárna injekcia. Ak je potrebná opakovaná injekcia, nemá sa podať skôr ako po 3 - 4 týždňoch. Na jeden kĺb sa nesmie použiť viac ako 3 - 4 injekcie. Vyžaduje sa lekárska kontrola kĺbu, najmä po opakovaných injekciách.
Lokálna infiltrácia sa má podať za prísnych aseptických opatrení do oblasti s najväčšou bolesťou alebo
vyhnúť sa častým injekciám.
V prípade, že sú pri jednorazovej liečbe potrebné vysoké dávky, má sa zvážiť použitie liekov s
dexametazónom s vyššou silou/objemom.
Pokyny na riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pre lokálnu intraartikulárnu injekciu: infekcia v liečenom kĺbe alebo v jeho bezprostrednej blízkosti, bakteriálna artritída, nestabilita liečeného kĺbu, sklon ku krvácaniu (spontánny alebo vyvolaný antikoagulanciami), periartikulárna kalcifikácia, vaskulárna nekróza kostí, ruptúra šľachy, Charcotov kĺb.
- Pre lokálnu infiltračnú liečbu: ak infekcia v mieste podania nie je primárne liečená
antiinfektívami.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri použití lieku Dexamethasone hameln sa u niektorých pacientov pozorovali ojedinelé prípady závažných anafylaktických reakcií s obehovým kolapsom, zástavou srdca, arytmiou, bronchospazmom a/alebo hypotenziou alebo hypertenziou.
Kvôli imunosupresii môže viesť liečba liekom Dexamethasone hameln k zvýšenému riziku bakteriálnych, vírusových, parazitických, oportúnnych a plesňových infekcií. Môže maskovať príznaky existujúcej alebo vyvíjajúcej sa infekcie, čím sa diagnostika sťažuje. Latentné infekcie, ako je tuberkulóza alebo hepatitída B, sa môžu reaktivovať.
Ak počas liečby liekom Dexamethasone hameln vzniknú neobvyklé stresovové situácie alebo fyzický
stres (trauma, chirurgický zákrok, pôrod, atď.), môže byť potrebné dočasné zvýšenie dávky.
Pacientom, ktorí sú už liečení systémovými (perorálnymi) kortikosteroidmi z iných dôvodov (napr. pacienti s chronickou obštrukčnou chorobou pľúc), ale nepotrebujú suplementárnu oxygenoterapiu sa systémové kortikosteroidy nemajú vysadiť.
Osobit né upozornenia
Pre nasledujúce indikácie má byť použitá liečba liekom Dexamethasone hameln iba ak je to nevyhnutne
potrebné a má byť podaná aj cielená antiinfekčná liečba:
- akútne vírusové infekcie (hepatitída B, herpes zoster, herpes simplex, varicella, herpetická keratitída)
- HBsAG-pozitívna chronicko-aktívna hepatitída
- približne 8 týždňov pred a 2 týždne po očkovaniach živými vakcínami
- systémové mykózy
- parazitózy (napr. nematódy)
- u pacientov s podozrením alebo potvrdenou strongyloidázou (infekcia mrlami) môžu glukokortikoidy viesť k aktivácii a masovej proliferácii týchto parazitov
- poliomyelitída
- lymfadenitída po BCG-očkovaní
- akútne a chronické bakteriálne infekcie
- pri tuberkulóze v anamnéze môže byť použitý len s antituberkulostatikami
Pre nasledujúce indikácie má byť použitá liečba liekom Dexamethasone hameln iba ak je to nevyhnutne
potrebné, pričom má byť podaná aj prídavná špecifická liečba:
- gastrointestinálne vredy
- osteoporóza
- závažná srdcová nedostatočnosť
- ťažko kontrolovateľný vysoký krvný tlak
- ťažko kontrolovateľný diabetes mellitus
- psychické problémy (aj v anamnéze) vrátane suicidality. Odporúča sa neurologické alebo psychiatrické monitorovanie.
- glaukóm so zatvoreným uhlom a glaukóm s otvoreným uhlom. Odporúča sa oftalmologické
monitorovanie a doplnková liečba.
- vredy rohovky a poranenia rohovky. Odporúča sa oftalmologické monitorovanie a doplnková liečba.
Poruchy videnia
Poruchy videnia môžu byť hlásené pri systémovom a lokálnom použití kortikosteroidov. Ak sa u pacienta objavia symptómy, ako je rozmazané videnie alebo iné poruchy videnia, pacient má byť odporučený k oftalmológovi na posúdenie možných príčin, medzi ktoré môže patriť sivý zákal, glaukóm alebo zriedkavé ochorenia, ako je napríklad centrálna serózna chorioretinopatia (central serous chorioretinopathy, CSCR), ktoré boli hlásené po použití systémových a lokálnych kortikosteroidov.
Z dôvodu rizika perforácie čreva sa môže liek Dexamethasone hameln používať iba v nevyhnutných prípadoch a je potrebné zabezpečiť monitoring pacienta pri nasledujúcich súbežných indikáciách:
- závažná ulcerózna kolitída s rizikom perforácie, s možnosťou bez peritoneálneho podráždenia
- divertikulitída
- enteroanastomóza (okamžite po operácii).
Prejavy peritoneálnej iritácie po gastrointestinálnej perforácii nemusia byť prítomné u pacientov, ktorí dostávajú vysoké dávky glukokortikoidov.
Počas podávania lieku Dexamethasone hameln môžu mať pacienti s diabetom zvýšenú potrebu inzulínu alebo perorálnych antidiabetík.
Počas liečby liekom Dexamethasone hameln je potrebné pravidelne kontrolovať krvný tlak obzvlášť pri podávaní vysokých dávok a u pacientov s ťažko regulovateľným vysokým krvným tlakom.
Pacienti so závažnou srdcovou nedostatočnosťou musia byť pozorne sledovaní vzhľadom na riziko zhoršenia stavu.
U pacientov liečených vysokými dávkami dexametazónu sa môže vyskytnúť bradykardia. Môžu sa vyskytnúť závažné anafylaktické reakcie.
Pri súbežnom užívaní glukokortikoidov a fluórchinolónov sa zvyšuje riziko porúch šliach, tenditídy
a ruptúry šliach.
Počas liečby liekom Dexamethasone hameln môže dôjsť k zhoršeniu pre-existujúcej myasthenia gravis.
Vakcinácia inaktivovanými vakcínami je vo všeobecnosti možná. Avšak je potrebné vziať do úvahy, že vyššie dávky kortikoidov môžu mať vplyv na imunitnú reakciu a na úspešnosť vakcinácie.
Pri vysokých dávkach kortikosteroidov sa má zaistiť dostatočný príjem draslíka a môže byť potrebné diétne obmedzenie príjmu sodíka. Majú sa monitorovať hladiny draslíka v sére.
Pri súbežnom podávaní inhibítorov CYP3A4, vrátane liekov obsahujúcich kobicistát, sa zvyšuje riziko systémových nežiadúcich účinkov. Tejto kombinácii sa treba vyhnúť, s výnimkou prípadov, kedy prínos liečby prevažuje zvýšené riziko systémových nežiaducich účinkov kortikosteroidov. V takom prípade sa majú u pacientov sledovať systémové účinky kortikosteroidov.
Náhle prerušenie liečby liekom Dexamethasone hameln po približne 10 dňoch môže mať za následok exacerbáciu alebo relaps základného ochorenia a akútnej adrenokortikálnej nedostatočnosti/abstinenčný syndróm z prerušenia liečby kortizónom. Preto sa má dávka pomaly znižovať, ak sa má liečba ukončiť.
Niektoré vírusové ochorenia, ako ovčie kiahne alebo osýpky, môžu byť u pacientov liečených glukokortikoidmi veľmi závažné. Pacientom s oslabenou imunitou, ktorí v minulosti nemali ovčie kiahne alebo osýpky hrozí mimoriadne riziko. Ak sú títo ľudia počas liečby liekom Dexamethasone hameln v kontakte s osobami infikovanými ovčími kiahňami alebo osýpkami, musí sa v prípade potreby začať preventívna liečba.
V rámci skúseností po uvedení lieku na trh bol u pacientov s hematologickými malignitami po použití dexametazónu samotného alebo v kombinácii s inými chemoterapeutickými liekmi hlásený syndróm z rozpadu nádoru (tumor lysis syndrome, TLS). Pacienti s vysokým rizikom TLS, napríklad pacienti s vysokou rýchlosťou proliferácie, vysokou nádorovou záťažou a vysokou citlivosťou na cytotoxické lieky majú byť pozorne sledovaní a majú sa zaviesť príslušné opatrenia.
Intravenózne podávanie má byť pomalou injekciou, počas 2 - 3 minút. Po príliš rýchlom podaní sa môžu vyskytnúť krátke a neškodné nežiaduce účinky, ako nepríjemné pichanie alebo parestézia. Tieto môžu trvať až do 3 minút.
Dexamethasone hameln je určený na krátkodobé použitie. Pri použití počas dlhšieho obdobia sa majú zvážiť ďalšie upozornenia a opatrenia, ako sú opísané pri dlhodobom podávaní liekov obsahujúcich glukokortikoidy.
Po lokálnom podaní sa majú vziať do úvahy možné systémové nežiaduce účinky a interakcie. Intraartikulárne podávanie glukokortikoidov zvyšuje riziko infekcií kĺbov. Dlhodobé podávanie a
opakované injekcie glukokortikoidov do nosných kĺbov môžu zhoršiť zmeny kĺbov súvisiace s
opotrebovaním. Je to pravdepodobne kvôli nadmernému zaťaženiu postihnutých kĺbov po zmiernení bolesti alebo iných príznakov.
Det i a dospi evaj úci
V o fáze r ast u detí sa musí st arostl i vo zváži ť po mer pr í nosu a ri zi ka l i ečby liekom Dexamethasone
hameln.
Predčasne narodení novorodenci
Dostupné dôkazy poukazujú na dlhodobé nežiaduce účinky na neurologický vývin po skorej liečbe (<
96 hodín po narodení) u predčasne narodených novorodencov s chronickým ochorením pľúc pri začiatočnej dávke 0,25 mg/kg dvakrát denne.
Propylénglykol
Vzhľadom na obsah propylénglykolu v lieku (20 mg v 1 ml) je potrebná opatrnosť u dojčiat a detí mladších ako 5 rokov, ak sa použijú vysoké dávky lieku Dexamethasone hameln a/alebo liečba trvá dlhšiu dobu (pozri časti 2 a 4.2). Nasledujúce skupiny pediatrickej populácie sú obzvlášť rizikové pre vznik propylénglykolovej toxicity:
- Novorodenci (novonarodené dojčatá mladšie ako 4 týždne)
Dexamethasone hameln sa nemá používať u predčasne narodených alebo donosených novorodencov. Liek môže byť použitý u novorodencov iba po dôkladnom individuálnom posúdení, ak prínos liečby
prevažuje jej riziko.
Ak sú u novorodencov potrebné vyššie dávky lieku Dexamethasone hameln ako 0,05 ml/kg/deň, príjem propylénglykolu môže prekročiť maximálny prah bezpečnosti 1 mg/kg/deň. Prekročenie tohto prahu bezpečnosti môže u novorodencov spôsobiť závažné nežiaduce účinky, ak sa súbežne podáva akýkoľvek substrát pre alkoholdehydrogenázu, ako je etanol, najmä ak sa podávajú iné lieky, ktoré obsahujú propylénglykol alebo alkohol. Je potrebné dôkladne sledovať akýkoľvek prejav toxicity.
- Dojčatá (deti staršie ako 4 týždne) a deti mladšie ako 5 rokov
Ak sú potrebné vyššie dávky lieku Dexamethasone hameln ako 2,5 ml/kg/deň, príjem propylénglykolu môže prekročiť maximálny prah bezpečnosti 50 mg/kg/deň. Súbežné podávanie propylénglykolu v dávkach 50 mg/kg/deň, a vyšších, s akýmkoľvek substrátom pre alkoholdehydrogenázu (ako je napr. etanol) môže vyvolať závažné nežiaduce účinky u dojčiat a detí mladších ako 5 rokov, najmä ak užívajú iné lieky, ktoré obsahujú propylénglykol alebo alkohol. U tejto skupiny pacientov sa má liek Dexamethasone hameln používať s opatrnosťou.
Vo fáze rastu detí sa musí starostlivo zvážiť pomer prínosu a rizika liečby liekom Dexamethasone hameln.
St arš ie osoby
U starších pacientov je zvýšené riziko osteoporózy, preto je potrebné starostlivo zvážiť pomer prínosu
a rizika liečby liekom Dexamethasone hameln.
Porucha f unkc ie peče ne a obl iči ek
Vzhľadom na obsah propylénglykolu v lieku je u pacientov s renálnou insuficienciou alebo so
zlyhávaním pečene potrebný častý lekársky monitoring, pretože boli hlásené rôzne nežiaduce účinky, prisudzované propylénglykolu, ako porucha funkcie obličiek (akútna tubulárna nekróza), akútne zlyhávanie obličiek a porucha funkcie pečene (pozri časti 2 a 4.2). Denná expozícia propylénglykolu u týchto pacientov nemá prekročiť 50 mg/kg, čo zodpovedá 2,5 ml/kg/deň lieku Dexamethasone hameln.
Užívanie lieku Dexamethasone hameln môže viesť k pozitívnym výsledkom dopingových testov.
Sodík
Tento liek obsahuje 43 mg (1,9 mmol) sodíka v každej maximálnej jednotlivej dávke (350 mg pre osobu s telesnou hmotnosťou 70 kg), čo zodpovedá 2,15% WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
4.5 Liekové a iné interakcie
Súbežné užívanie nesteroidových protizápalových liekov (nonsteroidal anti-inflammatory drugs,
NSAID), salicylátov a indometacínu zvyšuje riziko gastrointestinálnych vredov a krvácania.
Estrogény (napr. inhibítory ovulácie) môžu predlžovať biologický polčas glukokortikoidov a preto môže byť účinok kortikoidov zvýšený.
Lieky, ktoré indukujú CYP3A4, ako fenytoín, barbituráty, karbamazepín, primidón a rifampicín môžu zvyšovať metabolický klírens kortikosteroidov, čo vedie k zníženiu hladiny v krvi a k zníženej fyziologickej aktivite. Môže byť potrebné dávku upraviť.
Inhibítory CYP3A4 (vrátane ketokonazolu, itrakonazolu, ritonaviru a kobicistátu) môžu znížiť klírens dexametazónu, čo môže viesť k zvýšeniu účinku a potlačeniu funkcie nadobličiek/Cushingovmu syndrómu. Tejto kombinácii sa treba vyhnúť, s výnimkou prípadov, kedy prínos liečby prevažuje zvýšené riziko systémových nežiaducich účinkov kortikosteroidov. V takom prípade sa majú u pacientov sledovať systémové účinky kortikosteroidov.
Efedrín môže zrýchliť metabolizmus glukokortikoidov a tým znížiť ich účinnosť.
Súbežná liečba inhibítormi angiotenzín konvertujúceho enzýmu (angiotensin-converting enzyme, ACE)
zvyšuje riziko zmien v krvnom obraze.
Toxicita digoxínu (srdcového glykozidu) môže byť kortikosteroidami zvýšená kvôli nerovnováhe elektrolytov (nedostatku draslíka).
Ak sa kortikosteroidy podávajú súčasne s diuretikami alebo preháňadlami znižujúcimi hladinu draslíka, je potrebné pacientov starostlivo sledovať kvôli vzniku hypokaliémie v dôsledku zvýšeného vylučovania draslíka.
Súčasná liečba kortikosteroidmi môže zmeniť účinok kumarínových antikoagulancií. U pacientov, ktorí súbežne užívajú kortikosteroidy a kumarínové antikoagulanciá, je nevyhnutné časté sledovanie protrombínového času, aby sa zabránilo spontánnemu krvácaniu. V prípade súbežného užívania môže byť nevyhnutná úprava dávky antikoagulancia.
Kortikosteroidy znižujú žiaduci účinok hypoglykemizujúcich liekov (vrátane inzulínu).
Súbežné použitie glukokortikoidov a atropínu alebo iných anticholinergík môže viesť k zvýšeniu
vnútroočného tlaku.
Pri súbežnom použití glukokortikoidov a nedepolarizujúcich myorelaxancií sa môže vyskytnúť dlhšia
relaxácia svalov.
Kortikosteroidy môžu spôsobiť pokles koncentrácie prazikvantelu v krvi.
Pri súbežnom použití dexametazónu a chlorochínu, hydroxychlorochínu a meflochínu existuje zvýšené riziko myopatií a kardiomyopatií.
Po podaní protirelínu môže byť spomalený nárast hormónu štítnej žlazy (thyroid stimulating hormone, TSH).
Pri súbežnom podávaní imunosupresív je zvýšená citlivosť na infekcie a možné zhoršenie alebo manifestácia latentných infekcií. V kombinácii s cyklosporínom sú hladiny cyklosporínu v krvi zvýšené a existuje zvýšené riziko mozgových záchvatov.
Súbežné použitie s fluórchinolónmi môže zvyšovať riziko porúch šliach.
Kožné reakcie pri alergických testoch môžu byť potlačené.
4.6 Fertilita, gravidita a laktácia
Gravidita
Dexametazón prechádza cez placentu.
Počas gravidity, obzvlášť v prvom trimestri, sa má dexametazón podávať iba po dôkladnom zvážení prínosov a rizika. Kortikosteroidy sa majú použiť len ak predpokladaný prínos pre matku prevýši možné
riziko pre plod.
Pri dlhodobej alebo opakovanej liečbe glukokortikoidmi počas tehotenstva nie je možné vylúčiť poruchy
rastu plodu.
Podávanie kortikosteroidov gravidným zvieratám môže spôsobiť abnormality vývinu plodu vrátane rázštepu podnebia, spomalenia vnútromaternicového rastu a môže mať vplyv na rast a vývin mozgu. Neexistuje žiadny dôkaz, že kortikosteroidy spôsobujú zvýšenú incidenciu kongenitálnych abnormalít, ako je rázštep podnebia/pery u ľudí (pozri časť 5.3).
Ak sa glukokortikoidy podávajú ku koncu tehotenstva, existuje riziko atrofie kôry nadobličiek, čo môže vyžadovať substitučnú liečbu u novorodencov.
Dexamethasone hameln obsahuje propylénglykol. Hoci sa na zvieratách a u ľudí nepreukázalo, že propylénglykol spôsobuje reprodukčnú a vývinovú toxicitu, môže sa dostať k plodu.
Počas tehotenstva sa má liek Dexamethasone hameln používať opatrne. Možné prínosy a riziká spojené
s liečbou steroidmi a propylénglykolom je potrebné prehodnotiť dôkladne a na individuálnej báze.
Doj če ni e
Dexametazón prechádza do materského mlieka. Neboli zaznamenané žiadne prípady poškodenia dieťaťa.
Dexamethasone hameln sa má počas dojčenia používať s opatrnosťou a iba v nevyhnutných prípadoch.
Potencionálne prínosy a riziká liečby je potrebné prehodnotiť dôkladne a na individuálnej báze.
Ak si ochorenie vyžaduje vyššie dávky, dojčenie sa musí prerušiť.
Dexamethasone hameln obsahuje propylénglykol. Hoci sa na zvieratách a u ľudí nepreukázalo, že propylénglykol spôsobuje reprodukčnú a vývinovú toxicitu, bol prítomný v mlieku.
Dexamethasone hameln sa má počas dojčenia používať s opatrnosťou. Je potrebné starostlivo a na
individuálnej báze prehodnotiť možné prínosy a riziká spojené s liečbou steroidmi a propylénglykolom.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeDexamethasone hameln nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá
a obsluhovať stroje; to isté platí pre prácu v nebezpečnom prostredí.
4.8 Nežiaduce účinkyRiziko nežiaducich účinkov je počas krátkodobej liečby dexametazónom nízke. Avšak pri krátkodobej liečbe vysokými parenterálnymi dávkami sa môžu vyskytnúť zmeny v elektrolytoch, výskyt opuchov, prípadné zvýšenie krvného tlaku, zástava srdca, poruchy srdcového rytmu alebo záchvaty, a je možné pozorovať aj klinické prejavy infekcií. Pozornosť sa má venovať možným žalúdočným a črevným vredom (často vyvolaných stresom), pretože liečba kortikoidmi môže znížiť ich príznaky a znížiť glukózovú toleranciu.
Frekvencia predpokladaných nežiaducich účinkov, vrátane supresie hypotalamo-hypofýzovo-
nadobličkovej osi, závisí od účinnosti lieku, dávky, načasovania dávky a trvania liečby (pozri časť 4.4).
Frekvencia nežiaducich účinkov je uvedená podľa nasledujúcej konvencie:
Veľmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1000 až < 1/100)
Zriedkavé (≥ 1/10000 až < 1/1000) Veľmi zriedkavé (< 1/10000) Neznáme (z dostupných údajov)
Trieda orgánových systémov
| Frekvencia
| Nežiaduce účinky
|
Infekcie a nákazy
| Neznáme
| Maskovanie infekcií, manifestácia, exacerbácia alebo reaktivácia vírusových infekcií, plesňových infekcií, bakteriálnych, parazitických a oportúnnych infekcií, aktivácia strongyloidázy (pozri časť 4.4).
|
Poruchy krvi a lymfatického systému
| Neznáme
| Mierna leukocytóza, lymfocytopénia, eozinopénia, polycytémia.
|
Poruchy imunitného systému
| Neznáme
| Reakcie z precitlivenosti (napr. exantém vyvolaný liekmi), závažné anafylaktické reakcie, ako sú arytmie, bronchospazmus, hyper- alebo hypotenzia, obehový kolaps, zástava srdca, oslabenie imunitného systému.
|
Poruchy endokrinného systému
|
Neznáme
|
Cushingov syndróm (typické príznaky: mesiačikovitá tvár, centrálna obezita a pletora), supresia nadobličiek (pozri časť 4.4).
|
Poruchy metabolizmu a
výživy
|
Neznáme
|
Retencia sodíka s edémom, zvýšené vylučovanie draslíka (riziko arytmií), zvýšenie telesnej hmotnosti, znížená glukózová tolerancia, diabetes mellitus, hypercholesterolémia a hypertriglyceridémia, zvýšená chuť do jedla.
|
Psychické poruchy
|
Neznáme
|
Depresia, podráždenosť, eufória, zvýšená nálada, psychózy, mánia, halucinácie, emocionálna labilita, úzkosť, poruchy spánku, suicidalita.
|
Poruchy nervového systému
|
Neznáme
|
Pseudotumor cerebri, manifestácia latentnej epilepsie, zvýšenie citlivosti na záchvaty pri manifestnej epilepsii.
|
Poruchy oka
|
Neznáme
|
Katarakta, najmä so zadnou subkapsulárnou opacitou, glaukómom, zhoršením príznakov spojených s vredom rohovky, zvýšeným výskytom vírusových, plesňových a bakteriálnych infekcií oka, zhoršením bakteriálnych infekcií rohovky, ptózou, mydriázou, chemózou, iatrogénnou perforáciou skléry, chioretinopatiou. Zriedkavé prípady reverzibilného exoftalmu a rozmazané videnie (pozri tiež časť 4.4).
|
Poruchy ciev
|
Neznáme
|
Hypertenzia, zvýšený výskyt artériosklerózy a trombózy, vaskulitída (tiež ako abstinenčný syndróm po dlhodobej liečbe), zvýšená krehkosť kapilár.
|
Poruchy gastrointestinálneho
traktu
|
Neznáme
|
Gastrointestinálne vredy, gastrointestinálne krvácanie, pankreatitída, žalúdočné ťažkosti.
|
Poruchy kože a podkožného
tkaniva
|
Neznáme
|
Striae rubra, atrofia, telangiektázia, petechie, ekchymóza, hypertrichóza, steroidmi indukované akné, rosacee podobná (periorálna) dermatitída, zmeny pigmentácie kože.
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
Neznáme
|
Myopatia, svalová atrofia a slabosť, steroidová myopatia, osteoporóza (závislá od dávky, možná aj pri krátkodobom podávaní), aseptická nekróza kostí, poruchy šľachy, tendinitída, pretrhnutie šľachy, epidurálna lipomatóza, inhibícia rastu u detí.
|
Poruchy reprodukčného systému a prsníkov
|
Neznáme
|
Poruchy sekrécie pohlavných hormónov (ktoré spôsobujú nepravidelnú menštruáciu až po amenoreu, hirsutizmus, impotencia).
|
Celkové poruchy a reakcie v
mieste podania
|
Neznáme
|
Oneskorené hojenie rán.
|
Lokálne podávanie:
Lokálne podráždenie a neznášanlivosť sú možné (pocit tepla, dlhodobá bolesť). Atrofia kože a atrofia subkutánneho tkaniva v mieste podania injekcie sa nedajú vylúčiť, ak sa kortikoidy neaplikujú opatrne
do kĺbovej dutiny.
Hl ás eni e podozr ení na nežiaduc e r ea kcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie Prí znaky:Akútna intoxikácia dexametazónom nie je známa. V prípade chronického predávkovania sa dá očakávať zvýšenie nežiaducich účinkov (pozri časť 4.8), najmä účinkov na endokrinný systém, metabolizmus a
elektrolyty.
Antidotum nie je k dispozícii. Reakcie spôsobené chronickou intoxikáciou si väčšinou nevyžadujú liečbu, pokiaľ pacient nie je v stave, kedy je neobvykle náchylný na nežiaduce účinky kortikosteroidov. V takom prípade sa má podľa potreby začať symptomatická liečba.
Anafylaktickú reakciu a reakciu z hypersenzitivity možno liečiť adrenalínom, pretlakovým umelým dýchaním a aminofylínom.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: kortikosteroidy na systémové použitie, glukokortikoidy, ATC kód:
H02AB02
Far makod ynami cké úč i nky Dexametazón je mono-fluórovaný glukokortikoid s výraznými antialergickými, protizápalovými a membránu stabilizačnými vlastnosťami a účinkami na metabolizmus sacharidov, bielkovín a tukov.
Dexametazón má účinky iných základných glukokortikoidov a patrí k najúčinnejším látkam tejto skupiny. Dexametazón má približne 7,5-krát väčší glukokortikoidný účinok ako prednizolón a prednizón a v porovnaní s hydrokortizónom je 30-krát účinnejší, bez mineralokortikoidných účinkov.
Glukokortikoidy, ako dexametazón, prejavujú svoje biologické účinky aktiváciou transkripcie génov citlivých na kortikosteroidy. Protizápalové, imunosupresívne a antiproliferatívne účinky sú spôsobené, okrem iných mechanizmov, zníženou tvorbou, uvoľňovaním a aktivitou zápalových mediátorov, inhibíciou špecifických funkcií a migráciou zápalových buniek. Kortikosteroidy môžu okrem toho zabrániť účinku senzibilizovaných T-lymfocytov a makrofágov na cieľové bunky.
Ak sa vyžaduje dlhodobá liečba kortikoidmi, musí sa zvážiť možnosť vyvolania prechodnej adrenálnej insuficiencie. Potlačenie osi hypotalamus-hypofýza-nadobličky tiež závisí od individuálnych faktorov.
Kl i ni ck á účinnosť a bez pečnosť – COVID-19 K li ni cká úč innosť Štúdia RECOVERY (Randomized Evaluation of COVid-19 thERapY)1 je skúšajúcim-iniciovaná, individuálne randomizovaná, kontrolovaná, otvorená štúdia adaptívnej platformy na vyhodnotenie
účinkov potenciálnej liečby pacientov hospitalizovaných s COVID-19.
Do štúdie sa zapojilo 176 nemocničných zariadení vo Veľkej Británii.

6425 pacientov bolo randomizovaných na liečbu buď dexametazónom (2104 pacientov), alebo štandardným postupom (4321 pacientov). U 89 % pacientov bola laboratórne potvrdená infekcia SARS- CoV-2.
1
www.recoverytrial.net
Pri randomizácii 16 % pacientov dostávalo liečbu invazívnou mechanickou ventiláciou alebo mimotelovou membránovou oxygenáciou, 60 % dostávalo iba kyslík (s neinvazívnou ventiláciou alebo bez nej) a 24 % nedostávalo žiadnu liečbu.
Priemerný vek pacientov bol 66,1 +/- 15,7 rokov. 36 % pacientov boli ženy. 24 % pacientov malo v
anamnéze diabetes, 27 % srdcové choroby a 21 % chronické pľúcne choroby.
Primárny koncový ukazovateľMortalita po 28 dňoch bola signifikantne nižšia v skupine s dexametazónom ako v skupine so štandardným postupom, pričom úmrtia boli hlásené u 482 z 2104 pacientov (22,9 %) a u 1110 z 4321 pacientov (25,7 %) v uvedenom poradí (pomer výskytu 0,83; 95 % interval spoľahlivosti [IS] 0,75 až'
0,93; p < 0,001).
V skupine s dexametazónom bol výskyt úmrtí nižší ako v skupine so štandardným postupom u pacientov
liečených invazívnou mechanickou ventiláciou (29,3 % oproti 41,4 %; pomer výskytu 0,64; 95 % IS
0,51 až 0,81) a u pacientov so suplementárnou oxygenoterapiou bez invazívnej mechanickej ventilácie
(23,3 % oproti 26,2 %; pomer výskytu 0,82; 95 % IS 0,72 až 0,94).
Nezistil sa jasný účinok dexametazónu u pacientov, ktorí pri randomizácii nedostávali žiadnu respiračnú
podporu (17,8 % oproti 14,0 %; pomer výskytu 1,19; 95 %, IS 0,91 až 1,55).
Sekundárne koncové ukazovatelePacienti v skupine s dexametazónom mali kratšiu hospitalizáciu ako pacienti v skupine so štandardným postupom (medián 12 dní oproti 13 dní) a väčšiu pravdepodobnosť prežitia do 28 dní (pomer výskytu
1,10; 95 % IS 1,03 až 1,17).
V súlade s primárnym koncovým ukazovateľom bol najväčší účinok pri prepustení do 28 dní pozorovaný u pacientov, ktorí pri randomizácii dostávali invazívnu mechanickú ventiláciu (pomer
výskytu 1,48; 95 % IS 1,16 až 1,90), potom v skupine dostávajúcej iba kyslík (pomer výskytu 1,15; 95
% IS 1,06 až 1,24), bez priaznivého účinku u pacientov, ktorí kyslík nedostávali (pomer výskytu 0,96;
95 % IS 0,85 až 1,08).
Výsledky Dexametazón Štandardný Pomer výskytu
(n = 2104) postup alebo pomer
(n = 4321) rizika
(95 % IS)*
Počet pacientov/celkový počet pacientov (%)
Primárny koncový ukazovateľ
|
Mortalita po 28 dňoch 482/2104 (22,9) 1110/4321 (25,7) 0,83 (0,75 – 0,93)
|
Sekundárne koncové ukazovatele
|
Prepustenie z nemocnice do 28 dní 1413/2104 (67,2) 2745/4321 (63,5) 1,10 (1,03 – 1,17)
Invazívna mechanická ventilácia 456/1780 (25,6) 994/3638 (27,3) 0,92 (0,84 – 1,01)
alebo úmrtie†
Invazívna mechanická ventilácia 102/1780 (5,7) 285/3638 (7,8) 0,77 (0,62 – 0,95)
Úmrtie 387/1780 (21,7) 827/3638 (22,7) 0,93 (0,84 – 1,03)
|
* Pomer výskytu bol upravený pre vek, s ohľadom na výsledky mortality po 28 dňoch a prepustenia
z nemocnice. Pomer rizika bol upravený pre vek s ohľadom na liečbu invazívnou mechanickou ventiláciou alebo úmrtie a pre jednotlivé subkategórie.
† Z tejto kategórie sú vylúčení pacienti, ktorí boli randomizovaní na liečbu invazívnou mechanickou ventiláciou.
Bezpeč nosť So skúmanou liečbou súviseli štyri závažné nežiaduce udalosti (ZNU): dve ZNU hyperglykémie, jedna ZNU psychóza vyvolaná steroidmi a jedna ZNU krvácania z hornej časti gastrointestinálneho traktu. Všetky udalosti boli vyriešené.
Anal ýza pods kupí n
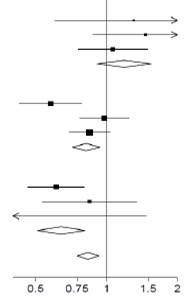
Úči nky al okáci e DEXAM ETAZÓNU na mort alit u po 28 dňoch, podľa veku a re spirač nej podpory pri
randomizáci i
2
| Dexametazón
| Štandardný postup
|
| RR (95 % IS)
|
Bez kyslíku (χ12 = 0,70; p = 0,40)
|
|
< 70
≥ 70 < 80
≥ 80
Medzisúčet
| 10/197 (5,1 %)
25/114 (21,9 %)
54/190 (28,4 %)
89/501 (17,8 %)
| 18/462 (3,9 %)
35/224 (15,6 %)
92/348 (26,4 %)
145/1034 (14,0 %)
| 1,31 (0,60 - 2,83)
1,46 (0,88 - 2,45)
1,06 (0,76 - 1,49)
1,19 (0,91 - 1,55)
|
Len kyslík (χ12 = 2,54; p = 0,11)
|
|
< 70
≥ 70 < 80
≥ 80
Medzisúčet
| 53/675 (7,9 %)
104/306 (34,0 %)
141/298 (47,3 %)
298/1279 (23,3 %)
| 193/1473 (13,1 %)
178/531 (33,5 %)
311/600 (51,8 %)
682/2604 (26,2 %)
| 0,58 (0,43 - 0,78)
0,98 (0,77 - 1,25)
0,85 (0,70 - 1,04)
0,82 (0,72 - 0,94)
|
Mechanická ventilácia (χ12 = 0,28; p = 0,60)
|
|
< 70
≥ 70 < 80
≥ 80
Medzisúčet
| 66/269 (24,5 %)
26/49 (53,1 %)
3/6 (50,0 %)
95/324 (29,3 %)
| 217/569 (38,1 %)
58/104 (55,8 %)
8/10 (80,0 %)
283/683 (41,4 %)
| 0,61 (0,46 - 0,81)
0,85 (0,53 - 1,34)
0,39 (0,10 - 1,47)
0,64 (0,51 - 0,81)
|
Všetci
pacienti
| 482/2104 (22,9 %)
| 1110/4321 (25,7 %)
| 0,83 (0,75 - 0,93)
p < 0,001
|
Dexametazón
zlepšenie
| Štandardný postup
zlepšenie
|
| | | | | |
Úči nky al okáci e DEXAM ETAZÓNU na mort alit u po 28 dňoch, podľa respirač nej podpory pri randomizáci i a anamnézy chronick ých oc hore ní 3
| Dexametazón
| Štandardný postup
|
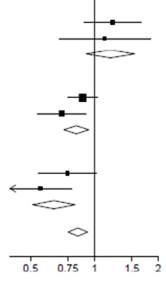
| RR (95 % IS)
|
Bez kyslíku (χ12 = 0,08; p = 0,78)
|
|
Predchádzajúce ochorenie
Bez predchádzajúceho
ochorenia
Medzisúčet
| 65/313 (20,8 %)
24/188 (12,8 %)
89/501 (17,8 %)
| 100/598 (16,7 %)
45/436 (10,3 %)
145/1034 (14,0 %)
| 1,22 (0,89 - 1,66)
1,12 (0,68 - 1,83)
1,19 (0,91 - 1,55)
|
Len kyslík (χ12 = 2.05; p = 0,15)
|
|
Predchádzajúce ochorenie
Bez predchádzajúceho
ochorenia
Medzisúčet
| 221/702 (31,5 %)
77/577 (13,3 %)
298/1279 (23,3 %)
| 481/1473 (32,7 %)
201/1131 (17,8 %)
682/2604 (26,2 %)
| 0,88 (0,75 - 1,03)
0,70 (0,54 - 0,91)
0,82 (0,72 - 0,94)
|
Mechanická ventilácia (χ12 = 1,52; p = 0,22)
|
|
Predchádzajúce ochorenie
Bez predchádzajúceho
ochorenia
Medzisúčet
| 51/159 (32,1 %)
44/165 (26,7 %)
95/324 (29,3 %)
| 150/346 (43,4 %)
133/337 (39,5 %)
283/683 (41,4 %)
| 0,75 (0,54 - 1,02)
0,56 (0,40 - 0,78
0,64 (0, 51 - 0,81)
|
Všetci pacienti
| 482/2104 (22,9 %)
| 1110/4321 (25,7 %)
| 0,83 (0,75 - 0,93)
p < 0,001
|
Dexametazón
zlepšenie
| Štandardný postup
zlepšenie
|
| | | | | |
2 3 (zdroj: Horby P. et al., 2020; https:/
/www.medrxiv.org/content/10.1101/2020.06.22.20137273v1;
5.2 Farmakokinetické vlastnosti
D
i
stri búcia
Väzba dexametazónu na plazmatické bielkoviny je menšia ako u väčšiny ostatných kortikosteroidov a odhaduje sa na asi 77 %. Dexametazón sa viaže v závislosti od dávky na plazmatické albumíny. Pri veľmi vysokých dávkach najväčšia časť voľne cirkuluje v krvi. Pri hypoalbuminémii stúpa podiel neviazaného (aktívneho) kortikoidu. Po intravenóznom podaní rádioaktívne označeného dexametazónu u ľudí je maximálna koncentrácia dexametazónu v mozgovomiechovom moku, približne 1/6 jeho plazmatickej koncentrácie. Plazmatický polčas dexametazónu je približne 190 minút.
Vďaka svojmu biologickému polčasu viac ako 36 hodín patrí dexametazón ku glukokortikoidom s veľmi dlhým účinkom. Pri dlhodobom podávaní môže dôjsť k jeho hromadeniu a predávkovaniu kvôli jeho dlhému trvaniu účinku.
Eli mi náci a
Priemerný (sérový) eliminačný polčas dexametazónu u dospelých je približne 250 minút (+ 80 minút).
Vylučuje sa prevažne obličkami vo forme voľného dexametazónalkoholu. Je čiastočne metabolizovaný. Metabolity sa vylučujú tiež prevažne obličkami ako glukonáty alebo sírany. Až 65 % dávky sa vylúči močom do 24 hodín. Renálna dysfunkcia významne neovplyvňuje elimináciu dexametazónu. Eliminačný polčas je pri závažných ochoreniach pečene predĺžený.
5.3 Predklinické údaje o bezpečnosti
Akút na toxicita:
LD50 pre dexametazón je po jednorazovej perorálnej aplikácii do 7 dní u myší 16 g/kg telesnej hmotnosti a u potkanov viac ako 3 g/kg telesnej hmotnosti. Po jednorazovej subkutánnej aplikácii je LD50 u myší viac ako 700 mg/kg telesnej hmotnosti a u potkanov približne 120 mg/kg telesnej hmotnosti v prvých 7 dňoch. Pri 21-dňovom pozorovaní sa tieto hodnoty znižujú, čo sa považuje za dôsledok závažných infekčných chorôb zapríčinených hormonálne vyvolanou imunosupresiou.
Chronick á toxicita:
Neexistujú žiadne údaje o chronickej toxicite u ľudí alebo zvierat. Prejavy intoxikácie vyvolané kortikoidmi neboli nikdy hlásené. V prípade relatívne dlhodobej liečby dávkami vyššími ako 1,5 mg/deň možno očakávať výrazné nežiaduce účinky (pozri časť 4.8).
Mutagénny a k arci nogénny pot enci ál :
Dostupné výsledky štúdií pre glukokortikoidy neodhalili žiadne dôkazy o klinicky významných genotoxických vlastnostiach.
Reprodukč ná t oxi ci t a:
V štúdiách na zvieratách bol rázštep podnebia pozorovaný u potkanov, myší, škrečkov, králikov, psov
a primátov; nie u koní a oviec. V niektorých prípadoch boli tieto divergencie kombinované s poruchami centrálneho nervového systému a srdca. U primátov sa účinky na mozog pozorovali po expozícii. Taktiež sa môže spomaliť vnútromaternicový rast. Všetky tieto účinky boli pozorované pri vysokých dávkach.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Propylénglykol
Edetan disodný
Voda na injekcie
6.2 Inkompatibility
Dexametazón nie je fyzikálne kompatibilný s daunorubicínom, doxorubicínom, vankomycínom, difenhydramínom (s lorazepamom a metoklopramidom) a metaraminol bitartrátom a nemá sa miešať s roztokmi obsahujúcimi tieto lieky. Nie je tiež kompatibilný s doxapramom a glykopyrolátom v injekčnej striekačke a s ciprofloxacínom, idarubicínom a midazolamom (zmes 1:1) podávaným injekciou v mieste Y.
Údaje o kompatibilite dexametazónu podávaného nepretržite počas 24 hodín pomocou s.c. injekčnej striekačky:
- kompatibilný s metoklopramidom a morfínom
- možná inkompatibilita s oktreotidom (analóg somatostatínu)
- precipituje s nasledujúcimi liekmi: cyklizín, midazolam, haloperidol, levomepromazín.
6.3 Čas použiteľnosti
Neot vor ené ampulky: 2 roky
Ot vor ené ampul ky: Liek sa má použiť ihneď po prvom otvorení.
Zr i ede ný r ozt ok:
Chemická a fyzikálna stabilita roztoku bola preukázaná počas 24 hodín pri teplote 25 °C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, za čas a podmienky uchovávania pred použitím zodpovedá používateľ a za normálnych okolností by nemal
presiahnuť 24 hodín pri teplote 2 - 8 °C, pokiaľ riedenie neprebehlo za kontrolovaných a validovaných aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C. Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre podmienky na uchovávanie po prvom otvorení alebo riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Ampulka z bezfarebného neutrálneho skla typu I s jednobodovým miestom zlomu (OPC), s nominálnym objemom 1 ml alebo 2 ml.
Balenie obsahuje 5 alebo 10 ampuliek.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pri podaní lieku Dexamethasone hameln intravenóznou infúziou sa ako rozpúšťadlo odporúča 5 % roztok glukózy, 0,9 % chlorid sodný a Ringerov roztok. Presná koncentrácia dexametazónu v infúzii sa má určiť podľa požadovanej dávky, príjmu tekutín pacienta a požadovanej rýchlosti odkvapkávania.
V paliatívnej starostlivosti môže byť liek Dexamethasone hameln riedený s 0,9 % chloridom sodným a podaný kontinuálnou subkutánnou infúziou (continuous subcutaneous infusion, CSCI).
Pred použitím je potrebné liek vizuálne skontrolovať. Roztok použite len vtedy, ak je číry a bez
viditeľných častíc.
Len na jednorazové použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
hameln pharma gmbh
Inselstraße 1
31787 Hameln
Nemecko
8. REGISTRAČNÉ ČÍSLO
56/0194/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
07/2021