
až 3 dni).
Systémové nežiaduce reakcie sa vyskytovali menej často po druhej a tretej injekcii Dengvaxie v porovnaní s prvou injekciou.
Veľmi zriedkavo boli zaznamenané alergie, vrátane anafylaktických reakcií.
Celkovo tie isté nežiaduce reakcie ale s nižšou frekvenciou výskytu boli pozorované u jedincov s dengue séropozitivitou.
b. Tabuľkovýzoznamnežiaducichreakcií
Nežiaduce reakcie sú uvedené podľa frekvencie výskytu s použitím nasledujúcej konvencie:
Veľmi časté: ≥ 1/10
Časté: ≥ 1/100 až < 1/10
Menej časté: ≥ 1/1 000 až < 1/100
Zriedkavé: ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé: (<1/10 000)
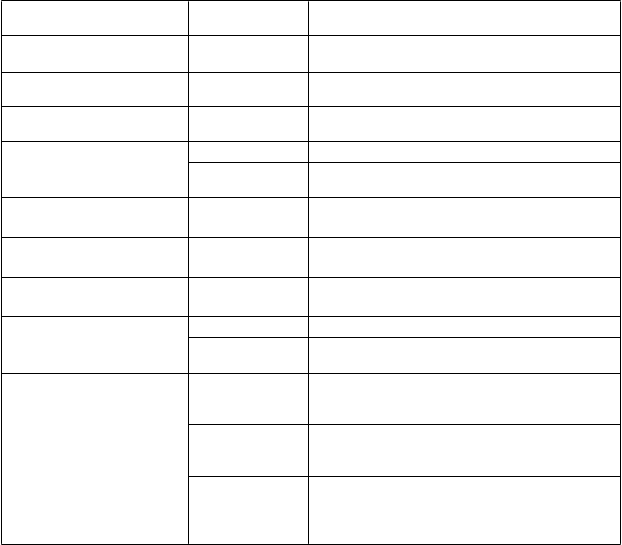
Nežiaduce reakcie zozbierané počas 28 dní po každej injekcii z klinických štúdií u 9 až 45-ročných, v skupine hodnotiacej reaktogénnosť u 1306 dospelých a 3067 detí a nežiaduce reakcie pozorované počas komerčného používania sú uvedené v Tabuľke 1 pre deti vo veku od 9 do 17 rokov a v Tabuľke 2 pre dospelých vo veku od 18 do 45 rokov.
Tabuľka 1: Nežiaduce reakcie z klinických štúdií a hlásené počas komerčného používania u detí
(9 až 17 rokov)
T
rieda orgánových
systémov
F
r
ekvencia Nežiaduce reakcie
Infekcie a nákazy Zriedkavé Infekcia horných dýchacích ciest
P
oruchy imunitného
systému
P
oruchy nervového systému
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
C
elkové poruchy a reakcie v mieste podania
Veľmi zriedkavé Alergia, vrátane anafylaktických reakcií*
Veľmi časté Bolesť hlavy
Zriedkavé Závrat
Zriedkavé Orofaryngeálna bolesť
Kašeľ
Rinorea
Zriedkavé Nauzea
Menej časté Urtikária Zriedkavé Vyrážka Veľmi časté Myalgia Zriedkavé Bolesť krku
Veľmi časté Bolesť v mieste podania injekcie Celkový pocit nepohodlia Asténia
Horúčka
Časté Reakcie v mieste podania injekcie (erytém, opuch) Menej časté Reakcie v mieste podania injekcie (hematóm,
pruritus)
Zatvrdnutie v mieste podania injekcie

* Nežiaduce reakcie zo spontánnych hlásení.
T
abuľka 2: Nežiaduce reakcie z klinických štúdií a hlásené počas komerčného používania u dospelých (18 až 45 rokov)
T
rieda orgánových
systémov
F
r
ekvencia Nežiaduce udalosti
Infekcie a nákazy Menej časté Infekcia horných dýchacích ciest
Nazofaryngitída
P
oruchy krvi a lymfatického systému Poruchy imunitného systému
P
oruchy nervového systému
Menej časté Lymfadenopatia
Veľmi zriedkavé Alergia, vrátane anafylaktických reakcií* Veľmi časté Bolesť hlavy
Menej časté Závrat
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
C
elkové poruchy a reakcie v mieste podania
Menej časté Orofaryngeálna bolesť
Kašeľ
Menej časté Nauzea
Sucho v ústach
Menej časté Vyrážka
Generalizovaná vyrážka
Veľmi časté Myalgia
Menej časté Bolesť krku
Artralgia
Veľmi časté Bolesť v mieste podania injekcie Celkový pocit nepohodlia Asténia
Časté Horúčka
Reakcie v mieste podania injekcie (erytém, hematóm, opuch, pruritus)
Menej časté Zatvrdnutie v mieste podania injekcie
Pocit tepla v mieste vpichu
Zimnica
Únava

* Nežiaduce reakcie zo spontánnych hlásení.
c.
Hospitalizáciaa/aleboklinickyzávažnáhorúčkadenguevúdajochodlhodobomsledovaníbezpečnostiVo výskumnej analýze dlhodobého sledovania po prvej injekcii v troch štúdiach účinnosti bolo
pozorované zvýšené riziko hospitalizácie v dôsledku horúčky dengue, vrátane klinicky závažnej horúčky dengue (prevažne Hemoragická Horúčka Dengue stupňa 1 alebo 2 [WHO 1997]) u
očkovaných, ktorí neboli v minulosti infikovaní dengue. Počas 5-ročného obdobia sa u jedincov bez
predchádzajúcej infekcie dengue zvyšuje riziko závažnej dengue 2,43-násobne (95 % CI: 0,47; 12,56) u jedincov vo veku od 9 do 16 rokov očkovaných Dengvaxiou v porovnaní s neočkovanými jedincami v tej istej vekovej skupine. U jedincov vo veku 9 rokov a starších sa odhadovalo, že počas nasledujúcich 5 rokov sa môže po očkovaní vyskytnúť približne 5 ďalších hospitalizácií v dôsledku horúčky dengue alebo 2 ďalšie závažné prípady horúčky dengue na 1 000 očkovaných, ktorí neboli v minulosti infikovaní dengue. Odhady z dlhodobej analýzy naznačujú, že k zvýšenému riziku došlo najmä počas tretieho roka nasledujúceho po prvej injekcii.
Toto zvýšené riziko nebolo pozorované u jedincov, ktorí boli v minulosti infikovaní vírusom dengue, pričom sa odhadovalo, že možno predchádzať 15 hospitalizáciam v dôsledku horúčky dengue alebo 4 závažným prípadom horúčky dengue na 1 000 očkovaných, ktorí boli v minulosti infikovaní vírusom dengue počas 5 rokov nasledujúcich po prvej injekcii.
Vyššie popísané odhady pre 5-ročné obdobie sú odvodené z údajov získaných z pivotných klinických skúšaní v krajinách s čiastočnou séroprevalenciou dengue a epidemiologickou súvislosťou. Tieto údaje nemôžu byť extrapolované na iné oblasti s rozdielnou séroprevalenciou a epidemiologickou situáciou.
d.
PediatrickápopuláciaPediatrické údaje u jedincov vo veku od 9 do 17 rokovV pediatrickej populácii bola pozorovaná horúčka s vyššou frekvenciou (veľmi častá) ako u dospelých
(častá).
Urtikária (menej častá) bola zaznamenaná iba u jedincov vo veku od 9 do 17 rokov (žiadna u dospelých).
Pediatrické údaje u jedincov mladších ako 9 rokov, t.j. mimo vekovú indikáciuSkupina jedincov mladších ako 9 rokov v skupine, kde sa hodnotila reaktogenita zahŕňa nasledujúcich
2 960 jedincov: 1 287 jedincov mladších ako 2 roky, 905 jedincov vo veku od 2 do 5 rokov a 768
jedincov vo veku od 6 do 8 rokov.
U jedincov vo veku od 2 do 8 rokov, v porovnaní s jedincami staršími ako 9 rokov, bol častejšie hlásený erytém v mieste podania injekcie a opuch (frekvencia: veľmi častá) a boli hlásené ďalšie nežiaduce udalosti (frekvencia: menej častá): hemoragia v mieste podania injekcie, znížená chuť do jedla a vracanie.
U jedincov vo veku od 2 do 8 rokov bez predchádzajúcej infekcie dengue údaje o dlhodobom
sledovaní bezpečnosti poukazujú na zvýšené riziko horúčky dengue vyžadujúce hospitalizáciu, vrátane klinicky závažnej horúčky dengue u očkovaných jedincov v porovnaní s neočkovanými jedincami.
U jedincov mladších ako 2 roky, najčastejšími hlásenými nežiaducimi reakciami po každej injekcii Dengvaxie boli horúčka, podráždenosť, strata chute do jedla, nezvyčajný plač a citlivosť v mieste podania injekcie.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli zaznamenané žiadne prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: vírusové očkovacie látky, ATC kód: J07BX/ ešte nebol pridelený
1.
MechanizmusúčinkuDengvaxia obsahuje živé oslabené vírusy. Po podaní sa vírusy lokálne replikujú a vyvolajú
neutralizujúce protilátky a bunkami sprostredkovanú imunitnú odpoveď proti štyrom sérotypom vírusu horúčky dengue (pozri podrobné informácie nižšie, odstavec 3. Imunogenita).
2.
KlinickáúčinnosťKlinická účinnosť Dengvaxie bola hodnotená v 3 štúdiach: jedna podporná štúdia účinnosti Fázy IIb
(CYD23) v Thajsku a 2 pivotné rozsiahle štúdie účinnosti Fázy III, CYD14 v Ázii (Indonézia,
Malajzia, Filipíny, Thajsko, Vietnam) a CYD15 v Latinskej Amerike (Brazília, Kolumbia, Honduras, Mexiko, Portoriko).
Kontrolná skupina v štúdiach dengue bola definovaná jedincami, ktorým bola podaná aspoň jedna injekcia placeba alebo porovnávaná očkovacia látka.
Vo fáze IIb štúdie bolo randomizovaných celkovo 4 002 jedincov vo veku od 4 do 11 rokov, ktorým bola podaná Dengvaxia alebo kontrolná látka, bez ohľadu na predchádzajúcu dengue infekciu. Účinnosť u jedincov vo veku od 9 do 11 rokov bola hodnotená u 1 554 jedincov (1 032 v skupine s očkovacou látkou a 522 v kontrolnej skupine).
V dvoch pivotných štúdiach fázy III (CYD14 a CYD15) bolo randomizovaných celkovo 31 000 jedincov vo veku od 2 do 16 rokov, ktorým bola podaná Dengvaxia alebo placebo, bez ohľadu na predchádzajúcu dengue infekciu. Účinnosť u jedincov vo veku od 9 rokov a starších bola hodnotená u
17 230 jedincov, ktorým bola podaná Dengvaxia (3 316 jedincov v CYD14 a 13 914 v CYD15) a
8 596 jedincov, ktorým bolo podané placebo (1 656 v CYD14 a 6940 v CYD15).
Na začiatku štúdií CYD14 a CYD15 sa séroprevalencia horúčky dengue pre celkovú skúšanú populáciu pohybovala od 52,8 % - 81,1 % v CYD14 (Ázia-Pacifik) a 55,7 % - 92,7 % v CYD15 (Latinská Amerika).
Účinnosť bola hodnotená počas aktívnej fázy v rozsahu 25 mesiacov, počas ktorých bolo navrhnuté sledovanie, aby boli v čo najväčšej miere zachytené všetky symptomatické virologicky potvrdené prípady dengue (virologically-confirmed dengue, VCD), bez ohľadu na ich závažnosť. Aktívne zisťovanie symptomatických prípadov dengue začalo v deň prvej injekcie a bolo predmetom sledovania u každého jedinca aspoň počas 13 mesiacov po tretej injekcii. Z tohto dôvodu táto fáza zahŕňala pozorovanie primárneho koncového bodu počas obdobia od 28 dní po tretej injekcii až do ukončenia aktívnej fázy.
Pre primárny koncový bod, výskyt symptomatických VCD prípadov vyskytujúcich sa počas 12
mesačného obdobia po 28 dňoch od podania tretej injekcie bol porovnaný s kontrolnou skupinou.
Analýzy účinnosti očkovacej látky podľa dengue sérostatusu merané neutralizačným testom zníženia počtu plakov (plaque reduction neutralization test, PRNT50) vo východiskovom stave (pred prvou injekciou) boli vykonané v skupine hodnotiacej imunogenitu u 2000 jedincov v CYD14 aj v CYD15 a u 300 jedincov v CYD23. Z 2 930 jedincov vo veku od 9 do 16 rokov v tejto podskupine (približne 80
%), ktorí mali východiskovú dengue séropozitivitu, bolo 1974 jedincov očkovaných Dengvaxiou (901
jedincov v CYD14 a 1 073 v CYD15) a 956 jedincom bolo podané placebo (444 v CYD14 a 512 v
CYD15) (pozri tiež podskupinu 3).
2.1
Údaje
klinickej
účinnosti
u
jedincov
vo
veku
od
9
do
16
rokov
v
endemických
oblastiach
s
akýmkoľvek
východiskovým
sérostatusom
Výsledky účinnosti očkovacej látky (vaccine efficacy, VE) v súlade s primárnym koncovým bodom
(symptomatické VCD prípady vyskytujúce sa počas 12 mesačného obdobia začínajúceho po 28 dňoch od podania tretej injekcie) u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus)
sú uvedené v Tabuľke 3 pre štúdie CYD14, CYD15 a CYD23.
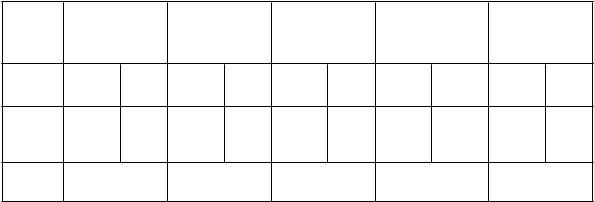
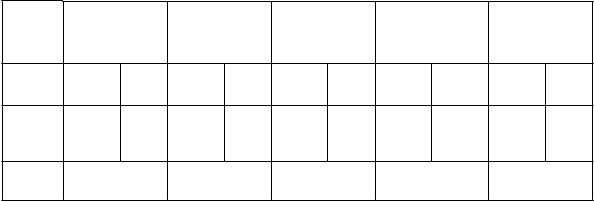
Tabuľka 3: VE proti symptomatickým VCD prípadom horúčky dengue počas 12 mesačného obdobia začínajúceho po 28 dňoch od podania tretej injekcie vyvolaných ktorýmkoľvek zo 4 sérotypov u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus).
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené *
CYD14+CYD15+ CYD23
Skupina s Kontroln očkovaco
Skupina s Kontroln očkovaco
Skupina s Kontroln očkovacou
Skupina s
očkovacou
Kontrolná
Skupina s Kontroln očkovacou
Počet
u látkou
á skupina
u látkou
á skupina
látkou
á skupina
látkou
skupina
látkou
á skupina
p
r
í
p
a
d
o
v
/ osoba- roky
34/3199 55/1585 185/
12458
236/6157 6/1033 10/514 219/15657 291/ 7742 225/16690 301/8256
V
E %
(
95
%
C
I)
69,4 (52,2; 80,6)
61,3 (52,8; 68,2)
70,1 (9,3; 91,1)
62,8 (55,7; 68,8)
63,0 (56,1; 68,9)
N: počet jedincov v štúdii
Počet prípadov: počet jedincov aspoň s jednou symptomatickou virologicky potvrdenou epizódou dengue v posudzovanom období.
Osoba-roky: súčet rizikového obdobia (v rokoch) pre jedincov počas obdobia štúdie. CI: interval spoľahlivosti.
* Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
U jedincov vo veku od 9 do 16 rokov bola preukázaná účinnosť Dengvaxie proti symptomatickým virologicky potvrdeným prípadom (VCD) horúčky dengue vyvolaných ktorýmkoľvek zo 4 sérotypov vo všetkých troch štúdiach, CYD14, CYD15 a CYD23 (pozri Tabuľka 3).
Účinnosť očkovacej látky (Vaccine Efficacy, VE) proti symptomatickým VCD, závažným a hospitalizovaným prípadom VCD počas 25-mesačného obdobia po prvej injekcii, ktorá bola sekundárnym cieľom u jedincov vo veku od 9 do 16 rokov je uvedená v Tabuľke 4 pre akýkoľvek východiskový sérostatus pre štúdie CYD14, CYD15 a CYD23.
Pri závažných VCD prípadoch sa sledovali dva typy koncových bodov: klinicky závažné VCD
prípady a VCD prípady, ktoré spĺňali kritéria podľa WHO 1997 pre hemoragickú horúčku dengue
(Dengue Hemorrhagic Fever, DHF).
Účinnosť očkovacej látky bola preukázaná pre tieto koncové body v CYD14 a CYD15 (pozri
Tabuľku 4).
Účinnosť očkovacej látky proti symptomatickým VCD je mierna pre sérotypy 1 a 2 a vyššia pre sérotypy 3 a 4 (pozri Tabuľku 4).
T
abuľka 4: VE proti symptomatickým, hospitalizovaným alebo závažným prípadom VCD počas
25 mesačného obdobia po prvej injekcii u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus)
Symptomatické VCD
CYD14
VE % (95 % CI)
N = 4972
CYD15
VE % (95 % CI)
N = 20 854
Z
d
ružené
CYD14+CYD15
VE % (95 % CI)*
N = 25 826
CYD23
VE % (95 %CI)
N = 1554
Z
d
ružené*
CYD14+CYD15+ CYD23
VE %
(9
5 % CI) N = 27 380
A
k
ý
k
o
ľvek sérotyp 67,8 (57,7; 75,6)
Sérotyp 1 65,7 (46,6; 78,2)
Sérotyp 2 36,8
(-10,1; 63,3)
Sérotyp 3 69,5 (31,9; 87,0)
Sérotyp 4 87,9 (75,5; 94,6)
Hospitalizované VCD† 81,6 (60,7; 92,0)
64,7 (58,7; 69,8)
54,8 (40,2; 65,9)
50,2 (31,8; 63,6)
74,2 (63,9; 81,7)
80,9 (70,9; 87,7)
80,3 (64,7; 89,5)
65,6 (60,7; 69,9)
58,4 (47,7; 66,9)
47,1 (31,3; 59,2)
73,6 (64,4; 80,4)
83,.2 (76,2; 88,2)
80,8 (70,1; 87,7)
43,3
(-18,9 ; 72,7)
78,4 (5,4 ; 96,4)
5,9
(-178,6 ; 65,1)
-1,2
(-5870,2 ; 94,7)
100,0
(-1873,3 ;
100,0)
72,5 (19,0 ; 91,7)
64,9 (60,0 ; 69,2)
59,2 (48,9 ; 67,4)
44,6 (28,9 ; 56,9)
73,0 (63,7 ; 79,9)
83,3 (76,4 ; 88,2)
79,7 (69,6 ; 86,5)
K
linicky závažné VCD
prípady
†
DHF spĺňajúce všetky
WHO kritéria
N: počet jedincov v štúdii
CI: interval spoľahlivosti
90,9 (58,4; 99,0)
90,9 (58,4; 99,0)
95,5 (68,8; 99,9)
95,0 (64,9; 99,9)
93,2 (77,3; 98,0)
92,9 (76,1; 97,9)
49,4
(-3870,3 ; 99,4)
100,0
(-1871,5 ;
100,0)
91,3 (74,9 ; 97,0)
93,2 (77,3 ; 98,0)
VE sa počíta použitím hustoty výskytu (prípadov na 100 osoba-rokov v riziku)
*Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
†Účinnosť v porovnaní s hospitalizovanými a závažnými VCD nebola primárnym cieľom a hraničná hodnota na definovanie
štatistickej významnosti nebola vopred stanovená.
2.2Údajeklinickejúčinnostiujedincovvovekuod9do16rokovvendemickýchoblastiachsvýchodiskovoudengueséropozitivitou
Výsledky účinnosti očkovacej látky (vaccine efficacy, VE) v súlade s prieskumnou analýzou
symptomatických VCD prípadov vyskytujúcich sa počas 12 mesačného obdobia, ktoré začína 28 dní po podaní tretej injekcie u jedincov vo veku od 9 do 16 rokov s východiskovou séropozitivitou sú
uvedené v Tabuľke 5 pre imunopodskupinu štúdií CYD14, CYD15 a CYD23.
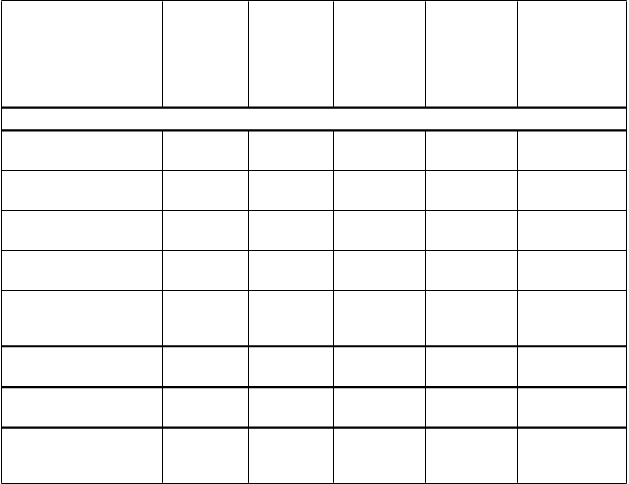
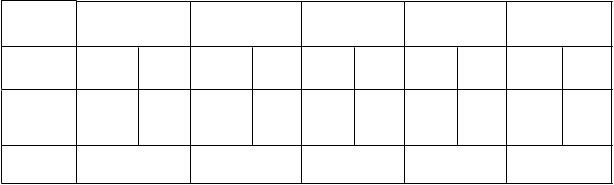
Tabuľka 5: VE proti symptomatickým prípadom VCD počas 12 mesačného obdobia, ktoré začína 28 dní po tretej injekcii s akýmkoľvek zo 4 sérotypov (dengue východisková séropozitivita)
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené *
CYD14+CYD15+ CYD23
Skupina s
Kontrolná
Skupina s
Kontrolná Skupina s Kontrolná Skupina s Kontrolná Skupina s Kontrolná
očkovacou
látkou
skupina
očkovacou

látkou
skupina
očkovacou skupina látkou
očkovacou skupina látkou
očkovacou
látkou
skupina
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené * CYD14+CYD15+ CYD23
Skupina s
Skupina s
Skupina s
Skupina s
Skupina s
očkovacou Kontrolná
očkovacou Kontrolná očkovacouKontrolná očkovacouKontrolná očkovacou Kontrolná
Počet
látkou
skupina
látkou
skupina
látkou
skupina
látkou
skupina
látkou
skupina
p
r
í
p
a
d
o
v /
o
soba-roky
4/471 9/241 7/1002 17/472 0/55 0/19 11/1473 26/713 11/1528 26/732
V
E %
(95%CI)
77,2
(18,3; 94,9)
80,6
(50,7; 93,2) NC
79,4
(58,4; 89,8)
79,4
(58,4; 89,8)
N: počet jedincov v štúdii
Počet prípadov: počet jedincov aspoň s jednou symptomatickou virologicky potvrdenou epizódou dengue v posudzovanom období.
Osoba-roky: súčet rizikového obdobia (v rokoch) pre jedincov počas obdobia štúdie.
CI: interval spoľahlivosti
NC: nezapočítané (nedostatok prípadov v skupine s očkovacou látkou a v kontrolnej skupine nedovoľuje započítať ani VE
ani CI)
* Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
Účinnosť očkovacej látky (VE) proti symptomatickým VCD počas 25-mesačného obdobia po prvej injekcii u jedincov vo veku od 9 do 16 rokov s východiskovou dengue séropozitivitou a pre skupinu hodnotiacu imunogenitu pre združené CYD14 + CYD15 + CYD23 sa odhaduje na 81,9 % (95 % CI:
67,2; 90,0).
U jedincov vo veku od 9 do 16 rokov s východiskovou dengue séropozitivitou (skupina hodnotiaca imunogenitu) bol zaznamenaný jeden klinicky závažný prípad VCD a jeden WHO DHF VCD prípad počas 25-mesačného obdobia po prvej injekcii v kontrolnej skupine v každej jednotlivej štúdii (CYD14 a CYD15) oproti žiadnému prípadu v skupine s očkovacou látkou. V kontrolnej skupine v
CYD14 boli hlásené štyri prípady VCD vyžadujúce hospitalizáciu a v CYD15 dva prípady vyžadujúce hospitalizáciu oproti žiadnému prípadu v skupine s očkovacou látkou. Tieto údaje nie sú presvedčivé vzhľadom na nízky počet prípadov v skupine hodnotiacej imunogenitu. Avšak extrapolácia účinnosti očkovacej látky (1- miera rizika) získaná v prieskumnej analýze (združené CYD14 + CYD15 + CYD23) počas 25-mesačného obdobia po prvej injekcii sa odhaduje na 89,2 % (95 % CI: 78,5; 94,6) pre VCD vyžadujúce hospitalizáciu a 95,3 % (95 % CI: 68,9; 99,3) pre závažné VCD.
2.3 Údajeklinickejúčinnostiujedincovvovekuod17do45rokovvendemickýchoblastiach
U jedincov vo veku od 17 do 45 rokov z endemických oblastí nebola vykonaná žiadna štúdia klinickej
účinnosti. Klinická účinnosť očkovacej látky je založená na prepojení údajov imunogenity (pozri nižšie časť 3.2).
2.4Ostatnépediatrickéúdajezoštúdiíúčinnostiujedincovvovekuod2do8rokov,t.j.mimoindikačnéhoveku
Účinnosť u jedincov vo veku od 2 do 8 rokov bola hodnotená u 2 443 jedincov (1 634 v skupine s
očkovanou látkou a 809 v kontrolnej skupine) vo fáze IIb štúdie a u 5 300 jedincov (3 532 jedincov v skupine s očkovacou látkou a 1 768 v kontrolnej skupine) v pivotnej Fáze III štúdie (CYD14). Účinnosť očkovacej látky proti symptomatickým VCD prípadom počas 12-mesačného obdobia, ktoré začína 28 dní po podaní tretej injekcie, spôsobeným ktorýmkoľvek zo 4 sérotypov bola 40,5 % (95 % CI: 22,7; 54,2) (združené CYD14 + CYD23). Účinnosť očkovacej látky proti symptomatickým, závažným a hospitalizovaným VCD počas 25-mesačného obdobia po prvej injekcii, spôsobeným ktorýmkoľve sérotypom (združené CYD14 + CYD23) bola 42,2 % (95 % CI: 30,6; 51,8), 45,1 %
(95 % CI: 29,3; 76,7) a 47,6 % (95 % CI: 23,7; 64,0) v uvedenom poradí.
2.5Dlhodobáochrana
Počas obdobia 5 rokov po prvej injekcii u jedincov vo veku 9 rokov a starších, s predchádzajúcou dengue infekciou sa extrapolácia účinnosti očkovacej látky (1- miera rizika) (získaná z prieskumnej analýzy) odhaduje na 79 % (95 % CI: 69; 86) pre hospitalizované VCD a 84 % (95 % CI: 63; 93) pre závažné VCD.
3. Imunogenita
Počas klinického vývoja boli zozbierané údaje o imunogenite celkovo od približne 5 700 jedincov vo
veku od 9 mesiacov do 60 rokov, ktorí dostali aspoň jednu injekciu očkovacej látky.
Spomedzi týchto 5 700 jedincov, celkovo 3 104 jedincom vo veku od 9 do 45 rokov z endemických oblastí bola podaná aspoň jedna injekcia Dengvaxie. Väčšina týchto jedincov bola vo veku od 9 do 17 rokov (n = 2 810).
Počas klinického vývoja boli merané titre neutralizujúcich protilátok pre každý sérotyp pomocou neutralizačného testu redukcie plaku (plaque reduction neutralization test, PRNT) a opísané ako geometrický priemer titrov (geometric mean titers, GMTs).
Vzťah medzi hladinami geometrického priemeru titrov (GMTs) po podaní injekcie 3 a pravdepodobnosťou ochorenia bol preukázaný v štúdiach účinnosti.
Vyššie titre po podaní injekcie 3 sú spojené s nižším rizikom ochorenia dengue a vyššou účinnosťou
očkovacej látky, hoci imunologická korelácia ochrany nebola stanovená.
V nasledujúcich Tabuľkách bol východiskový dengue sérostatus (pred prvou injekciou) stanovený ako:
· Dengue séropozitivita, ak je PRNT50 titer ≥ 10 [1/dil] (dolná hranica stanoviteľnosti, the lower limit of quantification, LLOQ) proti aspoň jednému sérotypu.
· Dengue séronegativita, ak je PRNT50 titer < dolná hranica kvantifikácie proti ktorémukoľvek zo
4 sérotypov.
3.1. Údajeoimunogeniteujedincovvovekuod9do17rokovvendemickýchoblastiach
GMTs po podaní dávky 3 u jedincov vo veku od 9 do 16 rokov v CYD14 a CYD15 sú opísané v
Tabuľke 6.
Tabuľka 6: Imunogenita u dengue séropozitívnych jedincov vo veku od 9 do 16 rokov v CYD14
a CYD15 z endemických oblastí
Sérotyp 1 Sérotyp 2 Sérotyp 3 Sérotyp 4
Štúd
i
a N
CYD14 485
1 GMT pred podaním (95 % CI)167
3 GMT po podaní(95 % CI)437
1 GMT pred podaním (95 % CI)319
3 GMT po podaní(95 % CI)
793
1 GMT pred podaním (95 % CI)160
3 GMT po podaní(95 % CI)443
1 GMT pred podaním (95 % CI)83,8
3 GMT po podaní(95 % CI)272
(138; 202) (373; 511) (274; 373) (704; 892) (135; 190) (387; 507)
(72,0; 97,6)
(245; 302)
CYD15 1048
278
703
306
860
261
762
73,3
306
(247; 313) (634; 781) (277; 338) (796; 930) (235; 289) (699; 830)
N: počet jedincov s dostupným titrom protilátok pre relevantný koncový bod
(66,6; 80,7)
(286; 328)
Dengue séropozitívni jedinci sú jedinci s titrom vyšším alebo rovnakým LLOQ proti aspoň jednému východiskovému dengue sérotypu
CI: Interval spoľahlivosti
CYD14: Indonézia, Malajzia, Filipíny, Thajsko, Vietnam. CYD15: Brazília, Kolumbia, Honduras, Mexiko, Portoriko.
3.2. Údajeoimunogeniteujedincovvovekuod18do45rokovvendemickýchoblastiach
Imunogenita konečnej formulácie CYD dengue očkovacej látky u dospelých vo veku od 18 do 45
rokov v endemických oblastiach bola hodnotená v 3 štúdiach uskutočnených v Ázii-Tichomorí
(CYD22 vo Vietname, CYD28 v Singapure a CYD47 v Indii).
3 GMTs po podaní dávky 3 u jedincov vo veku od 18 do 45 rokov sú opísané v Tabuľke 7.
Tabuľka 7: Imunogenita u dengue séropozitívnych jedincov vo veku od 18 do 45 rokov z endemických oblastí
Sérotyp 1 Sérotyp 2 Sérotyp 3 Sérotyp 4
Štúd
i
a N
CYD22 19
1 GMT pred podaním (95 % CI)408
3 GMT po podaní(95 % CI)785
1 GMT pred podaním (95 % CI)437
3 GMT po podaní(95 % CI)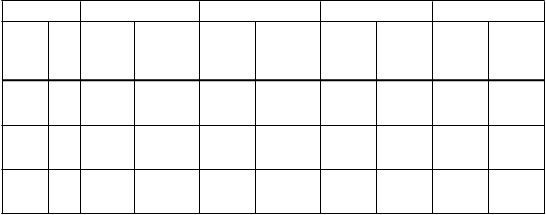
937
1 GMT pred podaním (95 % CI)192
3 GMT po podaní(95 % CI)482
1 GMT pred podaním (95 % CI)86,5
3 GMT po podaní(95 % CI)387
(205; 810) (379; 1626)
(240; 797)
(586; 1499)
(117; 313) (357; 651) (41,2; 182) (253; 591)
CYD28 66
59,8
235
67,1
236
48,4
239
22,1
211
(36,8;97,4)
(135; 409)
(40,9; 110)
(144; 387)
(32,9;71,0) (166; 342) (14,7;33,4) (155; 287)
CYD47 109
324
688
363
644
394
961
80,7
413
(236; 445)
(524; 901)
(269; 490)
(509; 814)
(299; 519) (763;1211) (613; 106) (331; 516)
N: počet jedincov s dostupným titrom protilátok s relevantným koncovým bodom
Séropozitívni jedinci sú jedinci s titrom vyšším alebo rovnakým ako LLOQ oproti aspoň jednému východiskovému dengue sérotypmu
CI: Interval spoľahlivosti
CYD28: Málo endemická krajina.
CYD22: Vietnam; CYD28: Singapur; CYD47: India.
Premostenie účinnosti je založené na vyššie dostupných údajoch a celkových výsledkoch. Údaje imunogenity dostupné zo štúdií u dospelých vo veku od 18 do 45 rokov v endemických regiónoch ukazujú, že GMTs po podaní injekcie 3 pre každý sérotyp sú vo všeobecnosti vyššie u dospelých ako u detí a dospievajúcich v CYD14 a CYD15. Z tohto dôvodu sa u dospelých v endemických oblastiach očakáva ochrana, hoci rozsah účinnosti v porovnaní s účinnosťou pozorovanou u detí a dospievajúcich je neznáma.
3.3. Dlhodobépretrvávanieprotilátok
Pokles GMTs pre všetky 4 sérotypy bol pozorovaný jeden rok po tretej injekcii. Počas nasledujúcich 2
až 4 rokov sa GMTs ustálili a ostali vyššie ako GMTs pred očkovaním. Hladiny GMTs závisia od veku a východiskového stavu séra dengue.
5.2 Farmakokinetické vlastnosti
Neboli vykonané žiadne farmakokinetické štúdie s Dengvaxiou.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe toxicity po opakovanom podávaní, vrátane hodnotenia lokálnej tolerancie a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
V distribučnej štúdii a štúdii exkrécie nebolo zaznamenané žiadne uvoľňovanie RNA Dengvaxie, a teda neexistuje žiadne riziko šírenia do životného prostredia alebo prenosu z očkovacích látok. Štúdie
neurovirulencie ukazujú, že CYD očkovacia látka proti horúčke dengue nie je neurotoxická.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok:
Esenciálne aminokyseliny, vrátane fenylalanínu
Neesenciálne aminokyseliny
Arginíniumchlorid
Sacharóza
Dihydrát trehalózy
Sorbitol (E420) Trometamol Močovina
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 Inkompatibility
Dengvaxia sa nesmie miešať so žiadnou inou očkovacou látkou alebo liekom.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii s priloženým rozpúšťadlom sa musí Dengvaxia použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii Dengvaxie, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
· Prášok (1 dávka) v injekčnej liekovke (sklo typ I), so zátkou (halobutyl) a kombinovaným uzáverom (alumínum, polypropylén) + 0,5 ml rozpúšťadla v naplnenej injekčnej striekačke (sklo typ I), s piestovou zátkou (halobutyl) a uzáverom (elastomér) s 2 samostatnými ihlami.
Balenie po 1 alebo 10.
· Prášok (1 dávka) v injekčnej liekovke (sklo typ I), so zátkou (halobutyl) a kombinovaným uzáverom (alumínum, polypropylén) + 0,5 ml rozpúšťadla v naplnenej injekčnej striekačke (sklo typ I), s piestovou zátkou (halobutyl) a uzáverom (elastomér).
Balenie po 1 alebo 10.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Treba sa vyhnúť kontaktu s dezinfekciou, pretože môže deaktivovať vírusy v očkovacej látke. Dengvaxia sa pred podaním musí rekonštituovať.
Dengvaxia sa rekonštituuje prenesením celého obsahu rozpúšťadla (0,4 % roztoku chloridu sodného) dodaného v modro označenej naplnenej injekčnej striekačke do injekčnej liekovky s mrazom sušeným práškom so žltozeleným kombinovaným uzáverom.
1. Na prenesenie rozpúšťadla použite naplnenú injekčnú striekačku s pripojenou sterilnou ihlou.
2. Preneste celý obsah naplnenej injekčnej striekačky do injekčnej liekovky s práškom.
3. Jemne krúžte, kým sa prášok úplne nerozpustí.
Suspenziu je potrebné pred podaním vizuálne skontrolovať. Po rekonštitúcii je Dengvaxia číra bezfarebná kvapalina s možnou prítomnosťou bielych až priesvitných čiastočiek (endogénnej povahy).
Po úplnom rozpustení sa 0,5 ml dávka rekonštituovanej suspenzie natiahne do rovnakej striekačky. K
injekčnej striekačke sa musí pripojiť nová sterilná ihla.
Po rekonštitúcii s dodaným rozpúšťadlom sa Dengvaxia musí použiť okamžite.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISanofi Pasteur
14 Espace Henry Vallée
69007 Lyon
France
8. REGISTRAČNÉ ČÍSLOEU/1/18/1338/001
EU/1/18/1338/002
EU/1/18/1338/003
EU/1/18/1338/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu <a na internetovej stránke Štátneho ústavu pre kontrolu liečiv
http://www.sukl.sk>.

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUDengvaxia, prášok a disperzné prostredie na injekčnú suspenziu vo viacdávkovom obale
Tetravalentná očkovacia látka proti dengue (živá, atenuovaná)
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEJedna dávka (0,5 ml) po rekonštitúcii obsahuje:
Chimérický vírusový sérotyp žltej horúčky dengue 1 (živý, oslabený)*... 4,5 – 6,0 log10 CCID50/dávka** Chimérický vírusový sérotyp žltej horúčky dengue 2 (živý, oslabený)*... 4,5 – 6,0 log10 CCID50/dávka** Chimérický vírusový sérotyp žltej horúčky dengue 3 (živý, oslabený)*... 4,5 – 6,0 log10 CCID50/dávka** Chimérický vírusový sérotyp žltej horúčky dengue 4 (živý, oslabený)*... 4,5 – 6,0 log10 CCID50/dávka**
*Pomnožené na Vero bunkách, metódou rekombinantnej DNA. Táto očkovacia látka obsahuje
geneticky modifikované organizmy (GMO).
**CCID50: 50% infekčnej dávky bunkovej kultúry.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAPrášok a disperzné prostredie na injekčnú suspenziu
Očkovacia látka je pred rekonštitúciou biely, homogénny, lyofilizovaný prášok s možným zatiahnutím na báze (možná kruhová zrazenina).
Disperzné prostredie (rozpúšťadlo) je číry bezfarebný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieDengvaxia je indikovaná na prevenciu ochorenia horúčkou dengue spôsobeného vírusovými sérotypmi dengue 1, 2, 3 a 4 u jedincov vo veku od 9 do 45 rokov s predchádzajúcou infekciou vírusom dengue a žijúcich v endemických oblastiach (pozri časti 4.2, 4.4 a 4.8).
Použitie Dengvaxie má byť v súlade s oficiálnymi odporúčaniami.
4.2 Dávkovanie a spôsob podávaniaDávkovanieDeti a dospelí vo veku od 9 do 45 rokovOčkovacia schéma pozostáva z 3 injekcií jednej rekonštituovanej dávky (0,5 ml) podaných v 6
mesačných intervaloch.
Ostatná pediatrická populáciaDengvaxia sa nesmie používať u detí mladších ako 9 rokov (pozri časť 4.8).
U očkovaných jedincov vo veku od 2 do 8 rokov bez predchádzajúcej infekcie dengue, bezpečnostné údaje o dlhodobom sledovaní preukázali zvýšené riziko ochorenia dengue vyžadujúce hospitalizáciu, vrátane klinicky závažnej dengue. Dostupné údaje nie sú dostatočné, aby potvrdili bezpečnosť a účinnosť u jedincov, ktorí boli v minulosti infikovaní vírusom dengue a sú mladší ako 9 rokov.
Spôsob podávania
Predchádzajúca infekcia dengue musí byť posúdená laboratórnymi testami, ktoré potvrdia prekonanie
horúčky dengue v minulosti alebo vhodným testovaním séra (pozri časť 4.4).
Očkovanie sa má vykonávať subkutánnou (s.c.) injekciou prednostne do ramena v oblasti deltového svalu.
Nepodávajte intravaskulárnou injekciou.
Pokyny na rekonštitúciu Dengvaxie pred podaním sú uvedené v časti 6.6.
4.3 Kontraindikácie
· Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1, alebo po predchádzajúcom podaní Dengvaxie alebo očkovacej látky s rovnakým zložením.
· Jedinci s vrodenou alebo získanou bunkovou imunitnou nedostatočnosťou, vrátane imunosupresívnej liečby, napr. chemoterapia alebo vysoké dávky systémových kortikosteroidov (napr. 20 mg alebo 2 mg/kg prednizónu počas 2 týždňov alebo dlhšie) počas 4 týždňov pred očkovaním.
· Jedinci so symptomatickou HIV infekciou alebo asymptomatickou HIV infekciou, keď sú sprevádzané dôkazom o narušenej funkcii imunity.
· Tehotné ženy (pozri časť 4.6).
· Dojčiace ženy (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Ochrana
Ochranná imunitná odpoveď na Dengvaxiu nemusí byť vyvolaná u všetkých očkovaných jedincov. Aj
po podaní očkovacej látky sa odporúča pokračovať v používaní ochranných prostriedkov proti uštipnutiu komárom.
Osobitné skupinypacientov
Jedinci, ktorí v minulosti neboli infikovaní vírusom dengue, alebo ktorí nevedia, či boli infikovaní
Jedinci, ktorí neboli v minulosti infikovaní vírusom dengue, alebo ktorí nevedia, či boli infikovaní sa nemajú očkovať, pretože u týchto jedincov bolo počas dlhodobých kontrol klinických skúšaní (pozri časť 4.8) pozorované zvýšené riziko hospitalizácií pre horúčku dengue a klinicky závažnú horúčku dengue (prevažne stupňa 1 alebo 2 hemoragickej horúčky dengue).
V prípade, že nie je k dispozícii dokumentácia o predošlej infekcii vírusom dengue, musí byť predchádzajúca infekcia potvrdená testami séra pred očkovaním. Aby sa zabránilo očkovaniu na základe falošne pozitívnych výsledkov, majú sa používať iba skúšobné metódy vykonávané primeraným spôsobom za špecifických podmienok a krížovou reakciou, vychádzajúc z miestnej epidemiológie ochorenia.
Turisti
Nie sú k dispozícii údaje o bezpečnosti, imunogenite alebo účinnosti podporujúce očkovanie u jedincov žijúcich v neendemických oblastiach a u cestujúcich do endemických oblastí, preto sa
očkovanie u týchto jedincov neodporúča
Ohniská nákazy
Dengvaxia sa nemá používať v súvislosti s vypuknutou epidémiou dengue v neendemických oblastiach.
Iné skupiny
Podávanie Dengvaxie sa musí odložiť u jedincov trpiacich stredne závažným až závažným horúčkovitým alebo akútnym ochorením.
Pred očkovaním je potrebné vykonať podrobnú anamnézu jednotlivca (najmä predchádzajúcich očkovaní a prípadných nežiaducich reakcií, ktoré sa po očkovaní objavili).
V prípade vzniku anafylaktickej reakcie po podaní očkovacej látky musí byť vždy ihneď k dispozícii primeraná lekárska starostlivosť a dohľad.
Po podaní očkovacej látky, alebo dokonca ešte predtým, sa môže vyskytnúť synkopa (mdloba) ako psychogénna odpoveď na injekčnú ihlu. Je potrebné zaviesť postupy na zabránenie vzniku úrazov z pádu a na riešenie synkopy.
Ženy v plodnom veku musia užívať účinnú antikoncepciu aspoň počas jedného mesiaca po každej dávke (pozri časť 4.6).
Dengvaxia sa za žiadnych okolností nesmie podávať intravaskulárne.
4.5 Liekové a iné interakcie
Pre pacientov, ktorí dostávajú imunoglobulínovú liečbu alebo krvné produkty s obsahom imunoglobulínov, napr. krv alebo plazmu sa odporúča počkať s podávaním Dengvaxie aspoň 6 týždňov, ale ak je to možné až 3 mesiace od ukončenia liečby, aby sa zabránilo neutralizácii oslabených vírusov obsiahnutých v očkovacej látke.
Dengvaxia sa nemá podávať jedincom, ktorí počas 4 týždňov pred očkovaním dostávajú imunosupresívnu liečbu, napr. chemoterapiu alebo vysoké dávky systémových kortikosteroidov (pozri časť 4.3).
Keďže neexistujú údaje o súbežnom podávaní očkovacej látky Dengvaxia s inými očkovacími látkami v populácii vo veku 9 rokov a staršej, súbežné podávanie Dengvaxie s inými očkovacími látkami sa neodporúča.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej
toxicity (pozri časť 5.3).
Je k dispozícii iba obmedzené množstvo údajov o použití Dengvaxie u gravidných žien. Tieto údaje nie sú dostatočné na to, aby sa vylúčil potenciálny vplyv Dengvaxie na graviditu, prenatálny vývin,
pôrod a postnatálny vývin.
Dengvaxia je živá oslabená očkovacia látka, preto je Dengvaxia počas gravidity kontraindikovaná
(pozri časť 4.3).
Ženy v plodnom veku musia užívať účinnú antikoncepciu aspoň počas jedného mesiaca po každej dávke.
Dojčenie
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska dojčenia.
Sú k dispozícii veľmi obmedzené skúsenosti ohľadom vylučovania vírusu dengue do ľudského mlieka. Keďže Dengvaxia je živá oslabená očkovacia látka a sú iba veľmi obmedzené skúsenosti z
postmarketingových údajov s Dengvaxiou u dojčiacich žien, táto očkovacia látka je počas dojčenia
kontraindikovaná (pozri časť 4.3).
Fertilita
Neboli vykonané žiadne špecifické štúdie súvisiace s fertilitou.
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska plodnosti žien
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Dengvaxia má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
a. Súhrnbezpečnostnéhoprofilu
U jedincov vo veku od 9 do 45 rokov boli najčastejšie hlásenými nežiaducimi reakciami, bez ohľadu
na vstupný sérostatus pred očkovaním, bolesť hlavy (54 %), bolesť v mieste podania injekcie (49 %), celkový pocit nepohodlia (44 %), myalgia (43 %), asténia (34 %) a horúčka (16 %).
Nežiaduce reakcie sa vyskytovali počas 3 dní nasledujúcich po očkovaní, okrem horúčky, ktorá sa objavila počas14 dní po injekcii. Nežiaduce reakcie boli zvyčajne mierne až stredne závažné a krátkodobé (0 až 3 dni).
Systémové nežiaduce reakcie sa vyskytovali menej často po druhej a tretej injekcii Dengvaxie v porovnaní s prvou injekciou.
Veľmi zriedkavo boli zaznamenané alergie, vrátane anafylaktických reakcií.
Celkovo tie isté nežiaduce reakcie ale s nižšou frekvenciou výskytu boli pozorované u jedincov s dengue séropozitivitou.
b. Tabuľkovýzoznamnežiaducichreakcií
Nežiaduce reakcie sú uvedené podľa frekvencie výskytu s použitím nasledujúcej konvencie:
Veľmi časté: ≥ 1/10
Časté: ≥ 1/100 až < 1/10
Menej časté: ≥ 1/1 000 až < 1/100
Zriedkavé: ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé: (<1/10 000)
Nežiaduce reakcie zozbierané počas 28 dní po každej injekcii z klinických štúdií u 9 až 45-ročných, v skupine hodnotiacej reaktogénnosť u 1 306 dospelých a 3067 detí a nežiaduce reakcie pozorované počas komerčného používania sú uvedené v Tabuľke 1 pre deti vo veku od 9 do 17 rokov a v Tabuľke 2 pre dospelých vo veku od 18 do 45 rokov.
Tabuľka 1: Nežiaduce reakcie z klinických štúdií a hlásené počas komerčného používania u detí
(9 až 17 rokov)
T
rieda orgánových
systémov
F
r
ekvencia Nežiaduce reakcie
Infekcie a nákazy Zriedkavé Infekcia horných dýchacích ciest
P
oruchy imunitného
systému
P
oruchy nervového systému
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
C
elkové poruchy a reakcie v mieste podania
Veľmi zriedkavé Alergia, vrátane anafylaktických reakcií*
Veľmi časté Bolesť hlavy
Zriedkavé Závrat
Zriedkavé Orofaryngeálna bolesť
Kašeľ
Rinorea
Zriedkavé Nauzea
Menej časté Urtikária Zriedkavé Vyrážka Veľmi časté Myalgia Zriedkavé Bolesť v krku
Veľmi časté Bolesť v mieste podania injekcie Celkový pocit nepohodlia Asténia
Horúčka
Časté Reakcie v mieste podania injekcie (erytém, opuch) Menej časté Reakcie v mieste podania injekcie (hematóm,
pruritus)
Zatvrdnutie v mieste podania injekcie

* Nežiaduce reakcie zo spontánnych hlásení.
T
abuľka 2: Nežiaduce reakcie z klinických štúdií a hlásené počas komerčného používania u dospelých (18 až 45 rokov)
T
rieda orgánových
systémov
F
r
ekvencia Nežiaduce udalosti
Infekcie a nákazy Menej časté Infekcia horných dýchacích ciest
Nazofaryngitída
P
oruchy krvi a lymfatického systému Poruchy imunitného systému
P
oruchy nervového systému
Menej časté Lymfadenopatia
Veľmi zriedkavé Alergia, vrátane anafylaktických reakcií* Veľmi časté Bolesť hlavy
Menej časté Závrat
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
C
elkové poruchy a reakcie v mieste podania
Menej časté Orofaryngeálna bolesť
Kašeľ
Menej časté Nauzea
Sucho v ústach
Menej časté Vyrážka
Generalizovaná vyrážka
Veľmi časté Myalgia
Menej časté Bolesť v krku
Artralgia
Veľmi časté Bolesť v mieste podania injekcie Celkový pocit nepohodlia Asténia
Časté Horúčka
Reakcie v mieste podania injekcie (erytém, hematóm, opuch, pruritus)
Menej časté Zatvrdnutie v mieste podania injekcie
Pocit tepla v mieste vpichu
Zimnica
Únava
* Nežiaduce reakcie zo spontánnych hlásení.
c.
Hospitalizáciaa/aleboklinickyzávažnáhorúčkadenguevúdajochodlhodobomsledovaníbezpečnostiVo výskumnej analýze dlhodobého sledovania po prvej injekcii v troch štúdiach účinnosti bolo
pozorované zvýšené riziko hospitalizácie v dôsledku horúčky dengue, vrátane klinicky závažnej horúčky dengue (prevažne Hemoragická Horúčka Dengue stupňa 1 alebo 2 [WHO 1997]) u
očkovaných, ktorí neboli v minulosti infikovaní dengue. Počas 5-ročného obdobia sa u jedincov bez
predchádzajúcej infekcie dengue zvyšuje riziko závažnej dengue 2,43-násobne (95 % CI: 0,47; 12,56) u jedincov vo veku od 9 do 16 rokov očkovaných Dengvaxiou v porovnaní s neočkovanými jedincami v tej istej vekovej skupine. U jedincov vo veku 9 rokov a starších sa odhadovalo, že počas nasledujúcich 5 rokov sa môže po očkovaní vyskytnúť približne 5 ďalších hospitalizácií v dôsledku horúčky dengue alebo 2 ďalšie závažné prípady horúčky dengue na 1 000 očkovaných, ktorí neboli v minulosti infikovaní dengue. Odhady z dlhodobej analýzy naznačujú, že k zvýšenému riziku došlo najmä počas tretieho roka nasledujúceho po prvej injekcii.
Toto zvýšené riziko nebolo pozorované u jedincov, ktorí boli v minulosti infikovaní vírusom dengue, pričom sa odhadovalo, že možno predchádzať 15 hospitalizáciam v dôsledku horúčky dengue alebo 4 závažným prípadom horúčky dengue na 1 000 očkovaných, ktorí boli v minulosti infikovaní vírusom dengue počas 5 rokov nasledujúcich po prvej injekcii.
Vyššie popísané odhady pre 5-ročné obdobie sú odvodené z údajov získaných z pivotných klinických skúšaní v krajinách s čiastočnou séroprevalenciou dengue a epidemiologickou súvislosťou. Tieto údaje nemôžu byť extrapolované na iné oblasti s rozdielnou séroprevalenciou a epidemiologickou situáciou.
d.
PediatrickápopuláciaPediatrické údaje u jedincov vo veku od 9 do 17 rokovV pediatrickej populácii bola pozorovaná horúčka s vyššou frekvenciou (veľmi častá) ako u dospelých
(častá).
Urtikária (menej častá) bola zaznamenaná iba u jedincov vo veku od 9 do 17 rokov (žiadna u dospelých).
Pediatrické údaje u jedincov mladších ako 9 rokov, t.j. mimo vekovú indikáciuSkupina jedincov mladších ako 9 rokov v skupine, kde sa hodnotila reaktogenita zahŕňa nasledujúcich
2 960 jedincov: 1 287 jedincov mladších ako 2 roky, 905 jedincov vo veku od 2 do 5 rokov a 768
jedincov vo veku od 6 do 8 rokov.
U jedincov vo veku od 2 do 8 rokov, v porovnaní s jedincami staršími ako 9 rokov, bol častejšie hlásený erytém v mieste podania injekcie a opuch (frekvencia: veľmi častá) a boli hlásené ďalšie nežiaduce udalosti (frekvencia: menej častá): hemoragia v mieste podania injekcie, znížená chuť do jedla a vracanie.
U jedincov vo veku od 2 do 8 rokov bez predchádzajúcej infekcie dengue údaje o dlhodobom
sledovaní bezpečnosti poukazujú na zvýšené riziko horúčky dengue vyžadujúce hospitalizáciu, vrátane klinicky závažnej horúčky dengue u očkovaných jedincov v porovnaní s neočkovanými jedincami.
U jedincov mladších ako 2 roky, najčastejšími hlásenými nežiaducimi reakciami po každej injekcii Dengvaxie boli horúčka, podráždenosť, strata chute do jedla, nezvyčajný plač a citlivosť v mieste podania injekcie.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli zaznamenané žiadne prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: vírusové očkovacie látky, ATC kód: J07BX/ ešte nebol pridelený
1.
MechanizmusúčinkuDengvaxia obsahuje živé oslabené vírusy. Po podaní sa vírusy lokálne replikujú a vyvolajú
neutralizujúce protilátky a bunkami sprostredkovanú imunitnú odpoveď proti štyrom sérotypom vírusu horúčky dengue (pozri podrobné informácie nižšie, odstavec 3. Imunogenita).
2.
KlinickáúčinnosťKlinická účinnosť Dengvaxie bola hodnotená v 3 štúdiach: jedna podporná štúdia účinnosti Fázy IIb
(CYD23) v Thajsku a 2 pivotné rozsiahle štúdie účinnosti Fázy III, CYD14 v Ázii (Indonézia,
Malajzia, Filipíny, Thajsko, Vietnam) a CYD15 v Latinskej Amerike (Brazília, Kolumbia, Honduras, Mexiko, Portoriko).
Kontrolná skupina v štúdiach dengue bola definovaná jedincami, ktorým bola podaná aspoň jedna injekcia placeba alebo porovnávaná očkovacia látka.
Vo fáze IIb štúdie bolo randomizovaných celkovo 4 002 jedincov vo veku od 4 do 11 rokov, ktorým bola podaná Dengvaxia alebo kontrolná látka, bez ohľadu na predchádzajúcu dengue infekciu. Účinnosť u jedincov vo veku od 9 do 11 rokov bola hodnotená u 1 554 jedincov (1 032 v skupine s očkovacou látkou a 522 v kontrolnej skupine).'
V dvoch pivotných štúdiach fázy III (CYD14 a CYD15) bolo randomizovaných celkovo 31 000 jedincov vo veku od 2 do 16 rokov, ktorým bola podaná Dengvaxia alebo placebo, bez ohľadu na predchádzajúcu dengue infekciu. Účinnosť u jedincov vo veku od 9 rokov a starších bola hodnotená u
17 230 jedincov, ktorým bola podaná Dengvaxia (3 316 jedincov v CYD14 a 13 914 v CYD15) a
8 596 jedincov, ktorým bolo podané placebo (1 656 v CYD14 a 6940 v CYD15).
Na začiatku štúdií CYD14 a CYD15 sa séroprevalencia horúčky dengue pre celkovú skúšanú populáciu pohybovala od 52,8 % - 81,1 % v CYD14 (Ázia-Pacifik) a 55,7 % - 92,7 % v CYD15 (Latinská Amerika).
Účinnosť bola hodnotená počas aktívnej fázy v rozsahu 25 mesiacov, počas ktorých bolo navrhnuté sledovanie, aby boli v čo najväčšej miere zachytené všetky symptomatické virologicky potvrdené prípady dengue (virologically-confirmed dengue, VCD), bez ohľadu na ich závažnosť. Aktívne zisťovanie symptomatických prípadov dengue začalo v deň prvej injekcie a bolo predmetom sledovania u každého jedinca aspoň počas 13 mesiacov po tretej injekcii. Z tohto dôvodu táto fáza zahŕňala pozorovanie primárneho koncového bodu počas obdobia od 28 dní po tretej injekcii až do ukončenia aktívnej fázy.
Pre primárny koncový bod, výskyt symptomatických VCD prípadov vyskytujúcich sa počas 12
mesačného obdobia po 28 dňoch od podania tretej injekcie bol porovnaný s kontrolnou skupinou.
Analýzy účinnosti očkovacej látky podľa dengue sérostatusu merané neutralizačným testom zníženia počtu plakov (plaque reduction neutralization test, PRNT50) vo východiskovom stave (pred prvou injekciou) boli vykonané v skupine hodnotiacej imunogenitu u 2 000 jedincov v CYD14 aj v CYD15 a u 300 jedincov v CYD23 (pozri tiež podskupinu 3). Z 2 930 jedincov vo veku od 9 do 16 rokov v tejto podskupine (približne 80 %), ktorí mali východiskovú dengue séropozitivitu, bolo 1 974 jedincov očkovaných Dengvaxiou (901 jedincov v CYD14 a 1 073 v CYD15) a 956 jedincom bolo podané placebo (444 v CYD14 a 512 v CYD15) (pozri tiež podskupinu 3).
2.1
Údaje
klinickej
účinnosti
u
jedincov
vo
veku
od
9
do
16
rokov
v
endemických
oblastiach
s
akýmkoľvek
východiskovým
sérostatusom
Výsledky účinnosti očkovacej látky (vaccine efficacy, VE) v súlade s primárnym koncovým bodom
(symptomatické VCD prípady vyskytujúce sa počas 12 mesačného obdobia začínajúceho po 28 dňoch od podania tretej injekcie) u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus)
sú uvedené v Tabuľke 3 pre štúdie CYD14, CYD15 a CYD23.
Tabuľka 3: VE proti symptomatickým VCD prípadom horúčky dengue počas 12 mesačného obdobia začínajúceho po 28 dňoch od podania tretej injekcie vyvolaných ktorýmkoľvek zo 4 sérotypov u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus)
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené *
CYD14+CYD15+ CYD23
Skupina s Kontroln očkovaco
Skupina s Kontroln očkovaco
Skupina s Kontroln očkovacou
Skupina s
očkovacou
Kontrolná
Skupina s Kontroln očkovacou
Počet
u látkou
á skupina
u látkou
á skupina
látkou
á skupina
látkou
skupina
látkou
á skupina
p
r
í
p
a
d
o
v
/ osoba- roky
34/3199 55/1585 185/
12458
236/6157 6/1033 10/514 219/15657 291/ 7742 225/16690 301/8256
V
E %
(
95
%
C
I)
69,4 (52,2; 80,6)
61,3 (52,8; 68,2)
70,1 (9,3; 91,1)
62,8 (55,7; 68,8)
63,0 (56,1; 68,9)
N: počet jedincov v štúdii
Počet prípadov: počet jedincov aspoň s jednou symptomatickou virologicky potvrdenou epizódou dengue v posudzovanom období.
Osoba-roky: súčet rizikového obdobia (v rokoch) pre jedincov počas obdobia štúdie. CI: interval spoľahlivosti.
* Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
U jedincov vo veku od 9 do 16 rokov bola preukázaná účinnosť Dengvaxie proti symptomatickým virologicky potvrdeným prípadom (VCD) horúčky dengue vyvolaných ktorýmkoľvek zo 4 sérotypov vo všetkých troch štúdiach, CYD14, CYD15 a CYD23 (pozri Tabuľka 3).
Účinnosť očkovacej látky (Vaccine Efficacy, VE) proti symptomatickým VCD, závažným a hospitalizovaným prípadom VCD počas 25-mesačného obdobia po prvej injekcii, ktorá bola sekundárnym cieľom u jedincov vo veku od 9 do 16 rokov je uvedená v Tabuľke 4 pre akýkoľvek východiskový sérostatus pre štúdie CYD14, CYD15 a CYD23.
Pri závažných VCD prípadoch sa sledovali dva typy koncových bodov: klinicky závažné VCD
prípady a VCD prípady, ktoré spĺňali kritéria podľa WHO 1 997 pre hemoragickú horúčku dengue
(Dengue Hemorrhagic Fever, DHF).
Účinnosť očkovacej látky bola preukázaná pre tieto koncové body v CYD14 a CYD15 (pozri
Tabuľku 4).
Účinnosť očkovacej látky proti symptomatickým VCD je mierna pre sérotypy 1 a 2 a vyššia pre sérotypy 3 a 4 (pozri Tabuľku 4).
T
abuľka 4: VE proti symptomatickým, hospitalizovaným alebo závažným prípadom VCD počas
25 mesačného obdobia po prvej injekcii u jedincov vo veku od 9 do 16 rokov (akýkoľvek východiskový sérostatus)
Symptomatické VCD
CYD14
VE % (95 % CI)
N = 4972
CYD15
VE % (95 % CI)
N = 20 854
Z
d
ružené
CYD14+CYD15
VE % (95 % CI)*
N = 25 826
CYD23
VE % (95 %CI)
N = 1554
Z
d
ružené*
CYD14+CYD15+ CYD23
VE %
(9
5 % CI) N = 27 380
A
k
ý
k
o
ľvek sérotyp 67,8 (57,7; 75,6)
Sérotyp 1 65,7 (46,6; 78,2)
Sérotyp 2 36,8
(-10,1; 63,3)
Sérotyp 3 69,5 (31,9; 87,0)
Sérotyp 4 87,9 (75,5; 94,6)
Hospitalizované VCD† 81,6 (60,7; 92,0)
64,7 (58,7; 69,8)
54,8 (40,2; 65,9)
50,2 (31,8; 63,6)
74,2 (63,9; 81,7)
80,9 (70,9; 87,7)
80,3 (64,7; 89,5)
65,6 (60,7; 69,9)
58,4 (47,7; 66,9)
47,1 (31,3; 59,2)
73,6 (64,4; 80,4)
83,.2 (76,2; 88,2)
80,8 (70,1; 87,7)
43,3
(-18,9 ; 72,7)
78,4 (5,4 ; 96,4)
5,9
(-178,6 ; 65,1)
-1,2
(-5870,2 ; 94,7)
100,0
(-1873,3 ;
100,0)
72,5 (19,0 ; 91,7)
64,9 (60,0 ; 69,2)
59,2 (48,9 ; 67,4)
44,6 (28,9 ; 56,9)
73,0 (63,7 ; 79,9)
83,3 (76,4 ; 88,2)
79,7 (69,6 ; 86,5)
K
linicky závažné VCD
prípady
†
DHF spĺňajúce všetky
WHO kritéria
N: počet jedincov v štúdii
CI: interval spoľahlivosti
90,9 (58,4; 99,0)
90,9 (58,4; 99,0)
95,5 (68,8; 99,9)
95,0 (64,9; 99,9)
93,2 (77,3; 98,0)
92,9 (76,1; 97,9)
49,4
(-3870,3 ; 99,4)
100,0
(-1871,5 ;
100,0)
91,3 (74,9 ; 97,0)
93,2 (77,3 ; 98,0)
VE sa počíta použitím hustoty výskytu (prípadov na 100 osoba-rokov v riziku) NC: nezapočítané
*Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
†Účinnosť v porovnaní s hospitalizovanými a závažnými VCD nebola primárnym cieľom a hraničná hodnota na definovanie
štatistickej významnosti nebola vopred stanovená.
2.2Údajeklinickejúčinnostiujedincovvovekuod9do16rokovvendemickýchoblastiachsvýchodiskovoudengueséropozitivitou
Výsledky účinnosti očkovacej látky (vaccine efficacy, VE) v súlade s prieskumnou analýzou
symptomatických VCD prípadov vyskytujúcich sa počas 12 mesačného obdobia, ktoré začína 28 dní po podaní tretej injekcie u jedincov vo veku od 9 do 16 rokov s východiskovou séropozitivitou sú
uvedené v Tabuľke 5 pre imunopodskupinu štúdií CYD14, CYD15 a CYD23.
Tabuľka 5: VE proti symptomatickým prípadom VCD počas 12 mesačného obdobia, ktoré začína 28 dní po tretej injekcii s akýmkoľvek zo 4 sérotypov (dengue východisková séropozitivita)
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené *
CYD14+CYD15+ CYD23
Skupina s
Kontrolná
Skupina s
Kontrolná Skupina s Kontrolná Skupina s Kontrolná Skupina s Kontrolná

očkovacou
látkou
skupina
očkovacou

látkou
skupina
očkovacou skupina látkou
očkovacou skupina látkou
očkovacou
látkou
skupina
CYD14 CYD15 CYD23
Združené
CYD14+CYD15
Združené * CYD14+CYD15+ CYD23
Skupina s
Skupina s
Skupina s
Skupina s
Skupina s
očkovacou Kontrolná
očkovacou Kontrolná očkovacouKontrolná očkovacouKontrolná očkovacou Kontrolná
Počet
látkou
skupina
látkou
skupina
látkou
skupina
látkou
skupina
látkou
skupina
p
r
í
p
a
d
o
v /
o
soba-roky
4/471 9/241 7/1002 17/472 0/55 0/19 11/1473 26/713 11/1528 26/732
V
E %
(95%CI)
77,2
(18,3; 94,9)
80,6

(50,7; 93,2) NC
79,4
(58,4; 89,8)
79,4
(58,4; 89,8)
N: počet jedincov v štúdii
Počet prípadov: počet jedincov aspoň s jednou symptomatickou virologicky potvrdenou epizódou dengue v posudzovanom období.
Osoba-roky: súčet rizikového obdobia (v rokoch) pre jedincov počas obdobia štúdie.
CI: interval spoľahlivosti
NC: nezapočítané (nedostatok prípadov v skupine s očkovacou látkou a v kontrolnej skupine nedovoľuje započítať ani VE
ani CI)
* Združené výsledky CYD14, 15 a 23 musia byť interpretované opatrne kvôli rozdielom v teste potvrdzujúcom horúčku dengue a definíciou akútneho horúčkovitého ochorenia medzi CYD14/15 a CYD23.
Účinnosť očkovacej látky (VE) proti symptomatickým VCD počas 25-mesačného obdobia po prvej injekcii u jedincov vo veku od 9 do 16 rokov s východiskovou dengue séropozitivitou a pre skupinu hodnotiacu imunogenitu pre združené CYD14 + CYD15 + CYD23 sa odhaduje na 81,9 % (95 % CI:
67,2; 90,0).
U jedincov vo veku od 9 do 16 rokov s východiskovou dengue séropozitivitou (skupina hodnotiaca imunogenitu) bol zaznamenaný jeden klinicky závažný prípad VCD a jeden WHO DHF VCD prípad počas 25-mesačného obdobia po prvej injekcii v kontrolnej skupine v každej jednotlivej štúdii (CYD14 a CYD15) oproti žiadnému prípadu v skupine s očkovacou látkou. V kontrolnej skupine v
CYD14 boli hlásené štyri prípady VCD vyžadujúce hospitalizáciu a v CYD15 dva prípady vyžadujúce hospitalizáciu oproti žiadnému prípadu v skupine s očkovacou látkou. Tieto údaje nie sú presvedčivé vzhľadom na nízky počet prípadov v skupine hodnotiacej imunogenitu. Avšak extrapolácia účinnosti očkovacej látky (1- miera rizika) získaná v prieskumnej analýze (združené CYD14 + CYD15 + CYD23) počas 25-mesačného obdobia po prvej injekcii sa odhaduje na 89,2 % (95 % CI: 78,5; 94,6) pre VCD vyžadujúce hospitalizáciu a 95,3 % (95 % CI: 68,9; 99,3) pre závažné VCD.
2.3 Údajeklinickejúčinnostiujedincovvovekuod17do45rokovvendemickýchoblastiach
U jedincov vo veku od 17 do 45 rokov z endemických oblastí nebola vykonaná žiadna štúdia klinickej
účinnosti. Klinická účinnosť očkovacej látky je založená na prepojení údajov imunogenity (pozri nižšie časť 3.2).
2.4Ostatnépediatrickéúdajezoštúdiíúčinnostiujedincovvovekuod2do8rokov,t.j.mimoindikačnéhoveku
Účinnosť u jedincov vo veku od 2 do 8 rokov bola hodnotená u 2 443 jedincov (1 634 v skupine s
očkovanou látkou a 809 v kontrolnej skupine) vo fáze IIb štúdie a u 5 300 jedincov (3 532 jedincov v skupine s očkovacou látkou a 1 768 v kontrolnej skupine) v pivotnej Fáze III štúdie (CYD14). Účinnosť očkovacej látky proti symptomatickým VCD prípadom počas 12-mesačného obdobia, ktoré začína 28 dní po podaní tretej injekcie, spôsobeným ktorýmkoľvek zo 4 sérotypov bola 40,5 % (95 % CI: 22,7; 54,2) (združené CYD14 + CYD23). Účinnosť očkovacej látky proti symptomatickým, závažným a hospitalizovaným VCD počas 25-mesačného obdobia po prvej injekcii, spôsobeným ktorýmkoľve sérotypom (združené CYD14 + CYD23) bola 42,2 % (95 % CI: 30,6; 51,8), 45,1 %
(95 % CI: 29,3; 76,7) a 47,6 % (95 % CI: 23,7; 64,0) v uvedenom poradí.
2.5Dlhodobáochrana
Počas obdobia 5 rokov po prvej injekcii u jedincov vo veku 9 rokov a starších, s predchádzajúcou dengue infekciou sa extrapolácia účinnosti očkovacej látky (1- miera rizika) (získaná z prieskumnej analýzy) odhaduje na 79 % (95 % CI: 69; 86) pre hospitalizované VCD a 84 % (95 % CI: 63; 93) pre závažné VCD.
3. Imunogenita
Počas klinického vývoja boli zozbierané údaje o imunogenite celkovo od približne 5 700 jedincov vo
veku od 9 mesiacov do 60 rokov, ktorí dostali aspoň jednu injekciu očkovacej látky.
Spomedzi týchto 5 700 jedincov, celkovo 3 104 jedincom vo veku od 9 do 45 rokov z endemických oblastí bola podaná aspoň jedna injekcia Dengvaxie. Väčšina týchto jedincov bola vo veku od 9 do 17 rokov (n = 2 810).
Počas klinického vývoja boli merané titre neutralizujúcich protilátok pre každý sérotyp pomocou neutralizačného testu redukcie plaku (plaque reduction neutralization test, PRNT) a opísané ako geometrický priemer titrov (geometric mean titers, GMTs).
Vzťah medzi hladinami geometrického priemeru titrov (GMTs) po podaní injekcie 3 a pravdepodobnosťou ochorenia bol preukázaný v štúdiach účinnosti.
Vyššie titre po podaní injekcie 3 sú spojené s nižším rizikom ochorenia dengue a vyššou účinnosťou
očkovacej látky, hoci imunologická korelácia ochrany nebola stanovená.
V nasledujúcich Tabuľkách bol východiskový dengue sérostatus (pred prvou injekciou) stanovený ako:
· Dengue séropozitivita, ak je PRNT50 titer ≥ 10 [1/dil] (dolná hranica stanoviteľnosti, the lower limit of quantification, LLOQ) proti aspoň jednému sérotypu.
· Dengue séronegativita, ak je PRNT50 titer < dolná hranica kvantifikácie proti ktorémukoľvek zo 4 sérotypov.
3.1. Údajeoimunogeniteujedincovvovekuod9do17rokovvendemickýchoblastiach
GMTs po podaní dávky 3 u jedincov vo veku od 9 do 16 rokov v CYD14 a CYD15 sú opísané v
Tabuľke 6.
Tabuľka 6: Imunogenita u dengue séropozitívnych jedincov vo veku od 9 do 16 rokov v CYD14
a CYD15 z endemických oblastí
Sérotyp 1 Sérotyp 2 Sérotyp 3 Sérotyp 4
Štúd
i
a N
CYD14 485
1 GMT pred podaním (95 % CI)167
3 GMT po podaní(95 % CI)437
1 GMT pred podaním (95 % CI)319
3 GMT po podaní(95 % CI)
793
1 GMT pred podaním (95 % CI)160
3 GMT po podaní(95 % CI)443
1 GMT pred podaním (95 % CI)83,8
3 GMT po podaní(95 % CI)272
(138; 202) (373; 511) (274; 373) (704; 892) (135; 190) (387; 507)
(72,0; 97,6)
(245; 302)
CYD15 1048
278
703
306
860
261
762
73,3
306
(247; 313) (634; 781) (277; 338) (796; 930) (235; 289) (699; 830)
N: počet jedincov s dostupným titrom protilátok pre relevantný koncový bod
(66,6; 80,7)
(286; 328)
Dengue séropozitívni jedinci sú jedinci s titrom vyšším alebo rovnakým LLOQ proti aspoň jednému východiskovému dengue sérotypu
CI: Interval spoľahlivosti
CYD14: Indonézia, Malajzia, Filipíny, Thajsko, Vietnam. CYD15: Brazília, Kolumbia, Honduras, Mexiko, Portoriko.
3.2. Údajeoimunogeniteujedincovvovekuod18do45rokovvendemickýchoblastiach
Imunogenita konečnej formulácie CYD dengue očkovacej látky u dospelých vo veku od 18 do 45
rokov v endemických oblastiach bola hodnotená v 3 štúdiach uskutočnených v Ázii-Tichomorí
(CYD22 vo Vietname, CYD28 v Singapure a CYD47 v Indii).
GMTs po podaní dávky 3 u jedincov vo veku od 18 do 45 rokov sú opísané v Tabuľke 7.
Tabuľka 7: Imunogenita u dengue séropozitívnych jedincov vo veku od 18 do 45 rokov z endemických oblastí
Sérotyp 1 Sérotyp 2 Sérotyp 3 Sérotyp 4
Štúd
i
a N
CYD22 19
1 GMT pred podaním (95 % CI)408
3 GMT po podaní(95 % CI)785
1 GMT pred podaním (95 % CI)437
3 GMT po podaní(95 % CI)
937
1 GMT pred podaním (95 % CI)192
3 GMT po podaní(95 % CI)482
1 GMT pred podaním (95 % CI)86,5
3 GMT po podaní(95 % CI)387
(205; 810) (379; 1626)
(240; 797)
(586; 1499)
(117; 313) (357; 651) (41,2; 182) (253; 591)
CYD28 66
59,8
235
67,1
236
48,4
239
22,1
211
(36,8;97,4)
(135; 409)
(40,9; 110)
(144; 387)
(32,9;71,0) (166; 342) (14,7;33,4) (155; 287)
CYD47 109
324
688
363
644
394
961
80,7
413
(236; 445)
(524; 901)
(269; 490)
(509; 814)
(299; 519) (763;1211) (613; 106) (331; 516)
N: počet jedincov s dostupným titrom protilátok s relevantným koncovým bodom
Séropozitívni jedinci sú jedinci s titrom vyšším alebo rovnakým ako LLOQ oproti aspoň jednému východiskovému dengue sérotypmu
CI: Interval spoľahlivosti
CYD28: Málo endemická krajina.
CYD22: Vietnam; CYD28: Singapur; CYD47: India.
Premostenie účinnosti je založené na vyššie dostupných údajoch a celkových výsledkoch. Údaje imunogenity dostupné zo štúdií u dospelých vo veku od 18 do 45 rokov v endemických regiónoch ukazujú, že GMTs po podaní injekcie 3 pre každý sérotyp sú vo všeobecnosti vyššie u dospelých ako u detí a dospievajúcich v CYD14 a CYD15. Z tohto dôvodu sa u dospelých v endemických oblastiach očakáva ochrana, hoci rozsah účinnosti v porovnaní s účinnosťou pozorovanou u detí a dospievajúcich je neznáma.
3.3. Dlhodobépretrvávanieprotilátok
Pokles GMTs pre všetky 4 sérotypy bol pozorovaný jeden rok po tretej injekcii. Počas nasledujúcich 2
až 4 rokov sa GMTs ustálili a ostali vyššie ako GMTs pred očkovaním. Hladiny GMTs závisia od veku a východiskového stavu séra dengue.
5.2 Farmakokinetické vlastnosti
Neboli vykonané žiadne farmakokinetické štúdie s Dengvaxiou.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe toxicity po opakovanom podávaní, vrátane hodnotenia lokálnej tolerancie a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
V distribučnej štúdii a štúdii exkrécie nebolo zaznamenané žiadne uvoľňovanie RNA Dengvaxie, a teda neexistuje žiadne riziko šírenia do životného prostredia alebo prenosu z očkovacích látok. Štúdie
neurovirulencie ukazujú, že CYD očkovacia látka proti horúčke dengue nie je neurotoxická.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok:
Esenciálne aminokyseliny, vrátane fenylalanínu
Neesenciálne aminokyseliny
Arginíniumchlorid
Sacharóza
Dihydrát trehalózy
Sorbitol (E420) Trometamol Močovina
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 Inkompatibility
Dengvaxia sa nesmie miešať so žiadnou inou očkovacou látkou alebo liekom.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii s priloženým rozpúšťadlom sa musí Dengvaxia uchovávať v chladničke (2 °C až
8 °C) a musí sa použiť do 6 hodín.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii Dengvaxie, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
· Prášok (5 dávok) v injekčnej liekovke (sklo typ I), so zátkou (halobutyl) a kombinovaným uzáverom (alumínum, polypropylén) + 2,5 ml rozpúšťadla v injekčnej liekovke (sklo typ I), so zátkou (halobutyl) a kombinovaným uzáverom (alumínum, polypropylén).
Balenie po 5.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Treba sa vyhnúť kontaktu s dezinfekciou, pretože môže deaktivovať vírusy v očkovacej látke. Dengvaxia sa pred podaním musí rekonštituovať.
Dengvaxia sa rekonštituuje prenesením celého obsahu rozpúšťadla (0,9 % roztoku chloridu sodného)
dodaného v injekčnej liekovke s 5 dávkami s tmavosivým kombinovaným uzáverom do injekčnej
liekovky s 5 dávkami mrazom sušeného prášku s hnedým kombinovaným uzáverom, a to pomocou sterilnej striekačky a ihly.
1. Na prenesenie rozpúšťadla použite sterilnú striekačku a ihlu.
2. Preneste celý obsah injekčnej liekovky s roztokom (s tmavosivým kombinovaným uzáverom)
do injekčnej liekovky s práškom (s hnedým kombinovaným uzáverom).
3. Jemne krúžte, kým sa prášok úplne nerozpustí.
Suspenziu je potrebné pred podaním vizuálne skontrolovať. Po rekonštitúcii je Dengvaxia číra bezfarebná kvapalina s možnou prítomnosťou bielych až priesvitných čiastočiek (endogénnej povahy).
Po úplnom rozpustení sa 0,5 ml dávka rekonštituovanej suspenzie natiahne do rovnakej striekačky. Na vytiahnutie každej z 5 dávok použite novú sterilnú striekačku a ihlu. Odporúčaná veľkosť ihly je 23G alebo 25G.
Pred každou injekciou znovu jemne pomiešajte rekonštituovanú suspenziu krúživým pohybom. Po rekonštitúcii s dodaným rozpúšťadlom sa Dengvaxia musí použiť do 6 hodín.
Čiastočne použité injekčné liekovky sa musia uchovávať medzi 2 °C a 8 °C (t.j. v chladničke) a chrániť pred svetlom.
Všetky zostávajúce dávky očkovacej látky sa na konci imunizácie alebo po 6 hodinách od rekonštitúcie, podľa toho, čo nastane skôr, musia zlikvidovať.
Čiastočne použitá viacdávková injekčná liekovka sa musí okamžite zlikvidovať, ak:
· Nebolo plne dodržané sterilné vytiahnutie dávky.
· Na rekonštitúciu alebo vytiahnutie každej z predchádzajúcich dávok nebola použitá nová sterilná striekačka a ihla.
· Je podozrenie, že čiastočne použitá injekčná liekovka bola kontaminovaná.
· Existuje viditeľný dôkaz kontaminácie, ako napríklad zmena vzhľadu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi Pasteur
14 Espace Henry Vallée
69007 Lyon
France
8. REGISTRAČNÉ ČÍSLO
EU/1/18/1338/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu <a na internetovej stránke Štátneho ústavu pre kontrolu liečiv
http://www.sukl.sk>.