
alebo % normálu) x
0,5
ALEBO
zvýšenie hladiny faktora X (IU/dl alebo % normálu) = [celková dávka (IU)/telesná hmotnosť
/kg)] x 2
Nasledujúce príklady predpokladajú východiskovú hladinu faktora X pacienta < 1 IU/dl:
1. Dávka 2 000 IU Coagadexu podaná 70 kg pacientovi má priniesť výsledok maximálneho zvýšenia faktora X po podaní 2 000 x {[2,0 IU/dl]/[IU/kg]}/[70 kg] = 57 IU/dl (t. j. 57 % normálu)
2. Maximálna hladina faktora X 90 % normálu sa požaduje u 40 kg dieťaťa. V tejto situácii bude
vhodná dávka nasledovná:
40 kg x 90 IU/dl/{[2 IU/dl]/[IU/kg]} = 1800 IU.
Dávka a frekvencia podania má byť založená na individuálnej klinickej odpovedi. Farmakokinetika (napr. polčas, in vivo výťažnosť) a klinické odpovede na Coagadex môžu byť u pacientov rôzne. Aj keď dávku je možné odhadnúť pomocou vyššie uvedených výpočtov, vždy, keď to bude možné, vykonajte príslušné laboratórne testy, ako napríklad sériové analýzy faktora X na usmernenie úpravy dávky.
Kontrola a prevencia krvácavých udalostí
Pri liečbe krvácavých udalostí: 25 IU/kg Coagadexu podajte pri prvom prejave krvácania, alebo pred očakávaným začiatkom menštruálneho krvácania. Zopakujte pri 24 hodinovom intervale až do zastavenia krvácania. Každé individuálne krvácanie hodnoťte na základe jeho závažnosti.
Pri sekundárnej profylaxii proti opakovanému krvácaniu, alebo krátkodobej profylaxii pred očakávanou fyzickou námahou alebo zubným vyšetrením: podajte 25 IU/kg Coagadexu a zopakujte podľa potreby.
O používaní Coagadexu na dlhodobú profylaxiu existujú iba obmedzené údaje, ale dávky 24,6 až 28
IU/kg jedenkrát týždenne alebo 25 IU/kg každé dva týždne sa používali niekoľko týždňov alebo mesiacov (pozri časť 5.1).
Perioperačný manažment
Pred operáciou: vypočítajte dávku Coagadexu na zvýšenie hladiny faktora X v plazme na 70 -
90 IU/dl. Starostlivá kontrola dávky a trvania liečby je obzvlášť dôležitá v prípadoch závažnej operácie.
Požadovaná dávka (IU) = telesná hmotnosť (kg) x požadované zvýšenie faktora X (IU/dl) x 0,5
Požadované zvýšenie faktora X je rozdiel medzi hladinou faktora X pacienta v plazme a požadovanou
hladinou a je založené na pozorovanej výťažnosti 2 IU/dl na IU/kg.
Napríklad: na zvýšenie hladiny faktora X v plazme z 15 IU/dl na 90 IU/dl u 70 kg pacienta je vhodná dávka:
70 x (90 - 15) x 0,5 = 2 625 IU.
Po operácii: dávku stanovte tak, ako je potrebné na udržanie hladín faktora X v plazme na minime
50 IU/dl, až kým u pacienta nezanikne riziko krvácania spôsobené operáciou.
Odporúča sa, aby boli hladiny faktora X v plazme po infúzii merané u každého pacienta pred operáciou a po nej, čím sa získajú a udržia hemostatické hladiny.
Staršia populácia
Nie je potrebná žiadna úprava dávky.
Poškodenie obličiek
Nie je potrebná žiadna úprava dávky.
Poškodenie pečene
Nie je potrebná žiadna úprava dávky.
Pediatrická populácia
Bezpečnosť a účinnosť Coagadexu u detí vo veku nižšom ako 12 rokov neboli doteraz stanovené.
Spôsob podávania
Intravenózne použitie.
Po rekonštitúcii sa má liek podať intravenóznym spôsobom pri odporúčanej rýchlosti 10 ml/min a najviac 20 ml/min.
Pri domácej liečbe má byť pacient patrične vyškolený a pravidelne kontrolovaný.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
Reakcie precitlivenosti alergického typu vrátane anafylaxie sú možné. Coagadex obsahuje stopy ľudských proteínov, iných ako faktor X. Pacienta je potrebné poučiť o prvých prejavoch reakcií precitlivenosti vrátane angioedému, zápalu miesta vpichu infúzie (napr. pálenie, štípanie, erytém), zimnice, kašľa, závratu, horúčky, návalov horúčav, generalizovanej urtikárie, bolesti hlavy, žihľavky, hypotenzie, letargie, bolesti svalov a kostí, nevoľnosti, pruritu, vyrážky, nepokoja, tachykardie, tiesnivého pocitu na hrudníku, mravčenia, vracania a chrčania. Ak sa vyskytnú niektoré z týchto príznakov, pacient má byť poučený, aby okamžite prerušil užívanie lieku a kontaktoval svojho lekára. V prípade šoku májú byť dodržané súčasné lekárske postupy na liečbu šoku.
Inhibítory
Formovanie neutralizujúcich protilátok (inhibítory) na faktor X je možnou komplikáciou pri manažmente osôb s nedostatkom faktora X.
Vo všeobecnosti majú byť všetci pacienti liečení Coagadexom starostlivo monitorovaní na tvorbu inhibítorov pomocou príslušných klinických pozorovaní a laboratórnych testov. Ak nie sú dosiahnuté očakávané hladiny faktora X, alebo ak sa nepodarí dostať krvácanie pod kontrolu pomocou očakávanej dávky, vykonajte analýzu, ktorá bude merať koncentráciu inhibítora faktora X.
Prenosné látky
Štandardné opatrenia na predchádzanie infekciám, ktoré sú následkom používania liekov pripravených
z ľudskej krvi alebo plazmy zahŕňajú výber darcov, kontrolu jednotlivých odberov krvi a zmiešanej plazmy zameranú na špecifické markery infekcie a vykonanie efektívnych výrobných krokov na inaktiváciu/odstránenie vírusov. Napriek tomu sa možnosť prenosu pôvodcov infekcie pri podávaní
liekov pripravených z ľudskej krvi alebo plazmy nedá úplne vylúčiť. Toto platí aj pre neznáme alebo
objavujúce sa vírusy a iné patogény.
Prijaté opatrenia sa považujú za účinné u vírusov s obalom ako sú HIV, HBV a HCV a u vírusov bez obalu ako sú HAV a parvovírus B19.
Očkovanie proti hepatitíde typu A a B u pacientov, ktorí pravidelne alebo opakovane dostávajú ľudský
faktor X z ľudskej plazmy, môže byť opodstatnené.
Pri podávaní lieku Coagadex pacientovi sa dôrazne odporúča vždy zaznamenať názov a číslo šarže
lieku, aby bolo k dispozícii prepojenie medzi pacientom a číslom šarže lieku.
Obsah sodíka
Coagadex obsahuje najviac 0,4 mmol/ml (9,2 mg/ml) sodíka. Má sa to vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
4.5 Liekové a iné interakcie
Účinok Coagadexu môže by narušený inhibítormi faktora Xa, priamymi alebo nepriamymi. Tieto antitrombotické látky sa nemajú používať u pacientov s nedostatkom faktora X. Coagadex sa nemá používať ako protilátka proti účinkom priamych perorálnych antikoagulačných liekov (DOAC)
u pacientov, ktorí netrpia nedostatkom faktora X.
4.6 Fertilita, gravidita a laktácia
Gravidita
Z dôvodu zriedkavosti dedičného nedostatku faktora X, nie sú dostupné skúsenosti týkajúce sa používania Coagadexu počas tehotenstva a dojčenia. Preto by sa má Coagadex používať počas tehotenstva a laktácia iba, ak je jasne indikovaný.
Dojčenie
Z dôvodu zriedkavosti dedičného nedostatku faktora X, nie sú dostupné skúsenosti týkajúce sa používania Coagadexu počas tehotenstva a dojčenia. Preto by sa má Coagadex používať počas dojčenia, ak je jasne indikovaný.
Fertilita
Reprodukčné štúdie na zvieratách neboli s liekom Coagadex vykonané.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Coagadex nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce reakcie na liek bol erytém na mieste podania infúzie, bolesť v mieste
podania infúzie, únava a bolesť chrbta.
Precitlivenosť alebo alergické reakcie (ako napríklad angioedém, pálivý alebo bodavý pocit v mieste podania infúzie, zimnica, návaly tepla, generalizovaná urtikária, bolesť hlavy, žihľavka, hypotenzia, letargia, nevoľnosť, nepokoj, tachykardia, zvieravý pocit na hrudi, mravčenie, vracanie, sipot) boli pozorované zriedkavo pri liečbe iných hemofílií a v niektorých prípadoch mohli prejsť do závažnej anafylaxie (vrátane šoku). Reakcie precitlivenosti, alergické reakcie a anafylaxia neboli hlásené v klinických skúšaniach s Coagadexom.
T
abuľkový zoznamnežiaducichreakcií
Nasledujúce nežiaduce reakcie boli hlásené v klinických skúšaniach u 18 pacientoch liečených liekom
Coagadex. Frekvencie boli zhodnotené podľa nasledujúcej konvencie: veľmi časté (≥1/10 pacientov),
časté (≥1/100 až <1/10). Frekvencie menej častých (≥1/1 000 až <1/100), zriedkavých (≥1/10 000 až
<1/1 000) alebo veľmi zriedkavých (<1/10 000) reakcií nie je možné z dostupných údajov vyhodnotiť.
Zoznam nežiaducich reakcií (Adverse Reactions, ADRs) u 18 liečených pacientov
T
rieda orgánových systémov podľa databázy
MedDRA
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Nežiaduca reakcia Frekvencia
Bolesť chrbta Časté
Celkové poruchy a reakcie v mieste podania Erytém v mieste vpichu infúzie Únava
Bolesť v mieste
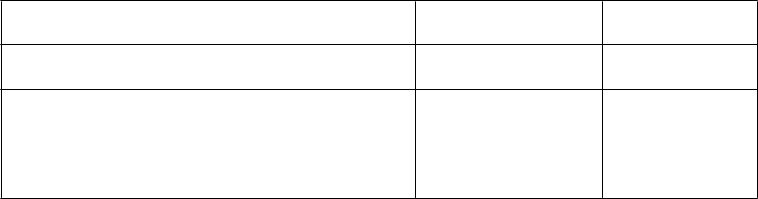
vpichu
Časté
Pediatrická populácia
Očakáva sa, že frekvencia, typ a závažnosť nežiaducich reakcií u detí bude rovnaká ako u dospelých pacientov.
Informácie o bezpečnosti s ohľadom na prenosné látky nájdete v časti 4.4.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieV klinických skúšaniach bol hlásený jeden náhodný prípad predávkovania, kde bolo účastníkovi podané približne 80 IU/kg Coagadexu na liečbu krvácania. V súvislosti s týmto predávkovaním neboli hlásené žiadne nežiaduce reakcie. Pri predávkovaní existuje riziko vzniku tromboembolizmu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, vitamín K a iné hemostatiká, koagulačný faktor X,
ATC kód: B02BD13.
MechanizmusúčinkuFaktor X je neaktívny zymogén, ktorý je možné aktivovať faktorom IXa (po vnútornej dráhe) alebo faktorom VIIa (po vonkajšej dráhe). Faktor X sa zmení z jeho neaktívnej formy na aktívnu formu (faktor Xa) odštiepením 52-článkového peptidu od ťažkého reťazca. Faktor Xa spojený s faktorom Va na povrchu fosfolipidu vytvára protrombinázový komplex, ktorý aktivuje protrombín na trombín v prítomnosti iónov vápnika. Trombín následne pôsobí na rozpustný fibrinogén a faktor XIII a vytvára priečne viazanú fibrínovú zrazeninu.
Farmakodynamické
účinky
Coagadex je získaný z ľudskej plazmy a používaný ako náhrada prirodzene existujúceho koagulačného faktora X u pacientov s dedičným nedostatkom faktora X.
Klinická účinnosť
V multicentrickom, otvorenom, nerandomizovanom klinickom skúšaní na hodnotenie
farmakokinetiky, bezpečnosti a účinnosti Coagadexu 16 účastníkov (vo veku 12 rokov a viac) so
stredne ťažkým až závažným dedičným nedostatkom faktora X (FX: C < 5 IU/dl) dostali dávku
25 IU/kg Coagadexu na liečbu spontánnych, traumatických a menoragických krvácavých udalostí.
Účinnosť Coagadexu pri liečbe krvácavých udalostí bola hodnotená účastníkom a/alebo skúšajúcim lekárom pre každú novú krvácavú udalosť pomocou vopred stanovenej ordinálnej hodnotiacej stupnice špecifickej pre krvácanie so škálou vynikajúci, dobrý, slabý a nehodnotiteľný. Z 208 krvácavých udalostí liečených Coagadexom bolo 187 krvácavých udalostí u 15 účastníkov hodnotených na účinnosť. Deväťdesiatosem (53 %) predstavovalo veľké krvácavé udalosti a 88 (47 %) boli malé krvácavé udalosti (jedno krvácanie nebolo hodnotené). Coagadex bol hodnotený ako dobrý (7 %) alebo vynikajúci (91 %) pri liečbe 98 % krvácavých udalostí. Zo 187 krvácavých udalostí v analýze účinnosti bolo 155 krvácaní (83 %) liečených jednou infúziou, 28 krvácaní (15 %) dvoma infúziami, 3 krvácania (2 %) tromi infúziami a 1 krvácanie (0,5 %) štyrmi infúziami. Priemerná dávka na infúziu bola 25,4 IU/kg a celková dávka Coagadexu bola 30,4 IU/kg. Štyri krvácavé udalosti u dvoch účastníkov boli zaradené do skupiny zlyhanie liečby. Odporúčaná dávka 25 IU/kg Coagadexu na liečbu krvácania bola udržiavaná počas skúšania u 14 zo 16 účastníkov. Zvyšní dvaja účastníci dostávala dávky do 30 IU/kg a 33 IU/kg.
Ako preventívne opatrenie bolo podaných celkom 184 infúzií. Rutinná profylaxia bola použitá u dvoch účastníkov. Jeden účastník použil dávku 28 IU/kg jedenkrát týždenne počas 8 týždňov a neskôr 25 IU/kg každé 2 týždne po dobu viac ako 5 mesiacov. Druhý účastník použil 24,6 IU/kg jedenkrát týždenne počas 8,5 mesiaca. Ani u jedného účastníka v tomto období nedošlo ku krvácaniu.
Bezpečnosť a účinnosť Coagadexu pre perioperačný manažment boli hodnotené u piatich účastníkov vo veku 14 až 59 rokov s miernym (n = 2), stredne ťažkým (n = 1) a závažným (n = 2) ochorením, ktorí podstúpili celkovo sedem chirurgických procedúr.
U všetkých chirurgických procedúr bol Coagadex hodnotený ako vynikajúci (bez pooperačného krvácania, bez potreby transfúzie krvi, a strata krvi nepresahovala očakávané hodnoty) pri kontrole straty krvi počas a po operácii. U veľkej operácie bolo potrebných priemerne 13 infúzií (v rozsahu od
2 do 15 infúzií) a priemerná kumulatívna dávka 181 IU/kg (v rozsahu od 45 do 210 IU/kg) na udržanie
hemostázy. U malej operácie bolo potrebných priemerne 2,5 infúzií (v rozsahu od 1 až 4 infúzií)
a priemerná kumulatívna dávka 89 IU/kg (v rozsahu od 51 až 127 IU/kg) na udržanie hemostázy.
5.2 Farmakokinetické vlastnosti
V klinickom skúšaní Coagadexu u účastníkov so závažným alebo stredne závažným nedostatkom faktora X (bazálne FX:C < 5 IU/dl), bola farmakokinetika Coagadexu hodnotená u 16 účastníkov po podaní nominálnej dávky 25 IU/kg. Farmakokinetické (FK) parametre boli vypočítané z merania aktivity faktora X:C (jednostupňový test zrážania) v plazme po odpočítaní hodnoty pred podaním dávky. Kombinácia hodnôt IR pre FX:C pri východiskovej návšteve (n = 16) a opakované FK hodnotenie (n = 15) poskytlo celkový geometrický priemer IR 2,07 IU/dl pre podané IU/kg (n = 31). Podobne kombinácia hodnôt t½ pri východiskovej návšteve a opakované FK hodnotenie poskytlo celkový geometrický priemer t½ 29,36 hodín. Systémová expozícia na FX:C pri opakovanej FK návšteve (aspoň 6 mesiacov neskôr) bola ekvivalentná expozícii pri východiskovej návšteve, keďže pomer všetkých opakovaných FK parametrov / FK parametrov pri východiskovej návšteve bol v rozsahu 90 % až 110 %.
Priemerná (CV %) prírastková výťažnosť je 2,08 (18,1). Priemerná (CV %) maximálna koncentrácia v plazme (Cmax) bola 0,504 (17,2) IU/ml.
Priemerná (CV %) plocha pod krivkou (AUC0-144hod) bola 17,1 (21,0) IU.hod/ml.
Ľudský koagulačný faktor X je vo veľkej miere zachytávaný v cievnom kompartmente: priemerný
zdanlivý distribučný objem (Vss) bol 56,3 (24,0) ml/kg.
Priemerný (CV %) polčas ľudského koagulačného faktora X bol 30,3 (22,8) hod. a klírens bol 1,35
(21,7) ml/kg/hod.
Poškodenie funkcie obličiek
Neboli vykonané žiadne farmakokinetické skúšania, ale nepredpokladá sa, že by pohlavie alebo renálna funkcia mali vplyv na farmakokinetický profil Coagadexu.
Poškodeniefunkciepečene
Neboli vykonané žiadne farmakokinetické skúšania, ale nepredpokladá sa, že by pohlavie alebo hepatická funkcia mali vplyv na famakokinetický profil Coagadexu.
Starší
Neboli vykonané žiadne farmakokinetické skúšania, ale nepredpokladá sa, že by vek mal vplyv na famakokinetický profil Coagadexu.
Dlhodobé používanie
O dlhodobom používaní existujú iba obmedzené údaje.
Pediatrická populácia'
Farmakokinetické skúšania neboli vykonané u detí mladších ako 12 rokov. Údaje o prírastkovej výťažnosti sú obmedzené, ale javia sa ako podobné údajom pozorovaným na populácii vo veku 12 rokov alebo staršej populácii.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednom a opakovanom podávaní, trombogenicity a lokálnej znášanlivosti neodhalili žiadne osobitné riziko pre ľudí.
Skúšania genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu sa neuskutočnili, keďže ľudský koagulačný faktor X v plazme (obsiahnutý v lieku Coagadex) je endogénny proteín.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Kyselina citrónová
Hydroxid sodný (na úpravu pH)
Dihydrát hydrogénfosforečňanu disodného
Chlorid sodný
Sacharóza
Rozpúšťadlo
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
Liek sa má rekonštituovať iba pomocou prenosového zariadenia Mix2Vial, ktoré sa dodáva v balení.
6.3 Čas použiteľnosti
3 roky.
Po rekonštitúcii by mal byť liek z mikrobiologického hľadiska použitý okamžite.
Chemická a fyzikálna stabilita roztoku sa však preukázala počas 1 hodiny pri teplote okolia (25 °C +/-
2 °C).
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte pri teplote do 30 oC. Neuchovávajte v mrazničke.
Uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Vnútorný obal
Injekčná liekovka s práškom: 250 IU alebo 500 IU ľudského koagulačného faktora X v injekčnej liekovke zo skla typu I so zátkou z halobytulovej gumy, utesnené ľahko odnímateľným polypropylénovým uzáverom s obrubou s hliníkovým povrchom.
Injekčná liekovka s rozpúšťadlom: 2,5 ml alebo 5 ml rozpúšťadla v injekčnej liekovke vyrobenej zo
skla typu 1., uzatvorenej zátkou z halobytulovej gumy a zapečatením. Prenosové zariadenie (Mix2Vial).
Veľkostibalenia
Coagadex 250 IU
1 injekčná liekovka 250 IU prášku ľudského koagulačného faktora X na injekčný roztok
1 injekčná liekovka 2,5 ml vody na injekcie
1 prenosové zariadenie (Mix2Vial)
Coagadex 500 IU
1 injekčná liekovka 500 IU prášku ľudského koagulačného faktora X na injekčný roztok
1 injekčná liekovka 5 ml vody na injekcie
1 prenosové zariadenie (Mix2Vial)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Prášok sa má rekonštituovať iba vodou na injekcie, ktorá je dodávaná v balení. 250 IU balenie má byť
rekonštituované 2,5 ml vody na injekcie a 500 IU balenie 5 ml vody na injekcie. Vodu na injekcie nepoužívajte, ak sú v nej viditeľné tuhé čiastočky.
Injekčné liekovky je potrebné nechať ohriať na izbovú teplotu (najviac 30 oC) pred odstránením
odnímateľného uzáveru z injekčnej liekovky s práškom.
K
rok 1: Odstráňte uzáver z injekčnej liekovky s práškom a vyčistite vrchnú časť zátky alkoholovým tampónom.
Zopakujte tento krok aj pre injekčnú liekovku rozpúšťadla.
Odlepte vrchnú časť balenia prenosového zariadenia, ale nechajte zariadenie v balení.
Krok 2: Umiestnite modrý koniec prenosového zariadenia na injekčnú liekovku rozpúšťadla a zatlačte smerom nadol, až kým hrot neprenikne cez gumový uzáver a nezapadne na miesto.
Odstráňte vonkajšie plastové balenie z prenosového zariadenia a zlikvidujte ho.
Dbajte však na to, aby ste sa nedotkli odhaleného konca zariadenia.
Krok 3: Prevráťte injekčnú liekovku rozpúšťadla so stále pripojeným prenosovým zariadením.
Umiestnite priezračný koniec prenosového zariadenia na injekčnú liekovku s
práškom a zatlačte smerom nadol, až kým hrot neprenikne cez gumový uzáver a nezapadne na miesto.
Krok 4: Rozpúšťadlo bude vtiahnuté do injekčnej liekovky s práškom vákuom, ktorý sa v nej nachádza.
Injekčnou liekovkou jemne pokrúžte, aby ste sa uistili, že prášok je dôkladne
premiešaný. Injekčnou liekovkou netraste.
Máte získať priezračný alebo jemne perleťový roztok, obyčajne za menej ako 1
minútu (maximálne 5 minút).
Krok 5: Oddeľte prázdnu injekčnú liekovku rozpúšťadla a modrú časť od priezračnej časti odskrutkovaním proti smeru hodinových ručičiek.
Vtiahnite vzduch do injekčnej striekačky vytiahnutím piesta po značku požadovaného objemu vody, ktorá má byť pridaná. Pripojte injekčnú striekačku k priezračnej časti prenosového zariadenia a vtlačte vzduch do injekčnej liekovky.
Krok 6: Okamžite prevráťte injekčnú liekovku s roztokom, ktorý bude
natiahnutý do injekčnej striekačky.
Odpojte naplnenú injekčnú striekačku od zariadenia.
Pri podávaní lieku dodržiavajte bežné bezpečnostné postupy.
P
oznámka: Ak na prípravu dávky používate viac ako jednu injekčnú liekovku, zopakujte kroky 1
až 6 s tým, že roztok natiahnete do rovnakej injekčnej striekačky.
Prenosové zariadenie dodávané s liekom je sterilné a nemôže sa použiť viackrát. Po ukončení procesu rekonštitúcie vyhoďte do nádoby určenej na ostré predmety.
Roztok má byť pri podávaní bezfarebný, číry alebo jemne opalizačný. Roztok, ktorý je zakalený alebo má nečistoty, nepoužívajte. Rekonštituované lieky je potrebné pred podaním vizuálne skontrolovať, či sa v nich nenachádzajú tuhé čiastočky alebo zmena sfarbenia.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBio Products Laboratory Limited, Dagger Lane,
Elstree, Hertfordshire, WD6 3BX,
Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/16/1087/001
EU/1/16/1087/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu