
r />Liečba ochorenia má byť vedená lekármi, ktorí majú vedomosti a praktické skúsenosti s liečbou
Gaucherovej choroby.
Dávkovanie
Vzhľadom na rozmanitosť a multisystémovú povahu Gaucherovej choroby, by sa mali dávky pre každého pacienta určiť individuálne, na základe komplexného zhodnotenia všetkých klinických prejavov choroby. Po spoľahlivom zistení individuálnych odpovedí pacienta na všetky príslušné klinické prejavy možno upraviť dávkovanie a frekvenciu podávania s cieľom buď udržiavať už dosiahnuté optimálne parametre pre všetky klinické prejavy alebo ďalej zlepšiť tie klinické parametre, ktoré ešte neboli normalizované.
Rozsah režimov dávkovania sa ukázal byť účinný na niektoré alebo všetky nie neurologické prejavy choroby. Počiatočné dávky 60 U/kg telesnej hmotnosti každé 2 týždne ukázali zlepšenie hematologických a viscerálnych parametrov počas 6 mesiacov liečby a pokračovanie v terapii potom buď zlepšilo kostné ochorenie alebo zastavilo jeho progresiu.
Aplikovanie nízkych dávok 15 U/kg telesnej hmotnosti raz za 2 týždne sa prejavilo zlepšením hematologických parametrov a organomegálie, nie však kostných parametrov. Obvyklá frekvencia
podávania infúzií je raz za 2 týždne. Súčasne to je frekvencia infúzií, pre ktorú je k dispozícii najviac
informácií.
Pediatrická populácia
Nie je nutná úprava dávky pre deti a dospievajúcich.
Účinnosť Cerezymu na neurologické príznaky u pacientov s chronickou neuronopatiou pri Gaucherovej chorobe nebola stanovená, a preto neexistuje žiadne špeciálne odporúčané dávkovanie pri týchto manifestáciách (pozri časť 5.1.).
Spôsob podávania
Po rekonštitúcii a nariedení (pozri časť 6.6) sa prípravok aplikuje intravenózne. Pri úvodných
infúziách sa má Cerezyme podávať rýchlosťou, ktorá neprekročí 0,5 jednotky na kg telesnej hmotnosti za minútu. Pri následnom podávaní možno rýchlosť infúzie zvýšiť, avšak nesmie prekročiť 1 jednotku na kg telesnej hmotnosti za minútu. Zvyšovanie rýchlosti infúzie sa musí uskutočňovať pod dohľadom zdravotníckeho pracovníka.
Podávanie infúzie Cerezymu doma sa môže zvážiť u pacientov, ktorí infúzie dobre tolerujú počas niekoľkých mesiacov. O podávaní infúzie pacientovi doma sa má rozhodnúť po zhodnotení a odporúčaní lekára, ktorý pacienta lieči. Podanie infúzie Cerezymu pacientom alebo opatrovateľom doma si vyžaduje zaškolenie zdravotníkom v podmienkach kliniky. Pacient alebo opatrovateľ dostanú pokyny o infúznej technike a vedení liečebného denníka. Pacienti, u ktorých sa objavia nežiaduce udalosti v priebehu infúzie, musia okamžite zastaviť podávanie infúzie a vyhľadať lekára. Nasledujúce infúzie sa možno budú musieť vykonať v podmienkach kliniky. Dávka a rýchlosť infúzie podávanej doma majú zostať konštantné a nemajú sa meniť bez dohľadu zdravotníka.
Pokyny na rekonštitúciu a riedenie lieku pred podaním, pozri časť 6.6.
Lekárom a zdravotníckym pracovníkom sa odporúča, aby pacientov s Gaucherovou chorobou, vrátane pacientov s chronickými neuronopatickými prejavmi choroby registrovali v „ICGG registri pacientov
s Gaucherovou chorobou“ (pozri časť 5.1).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypersenzitivita
Súčasné výsledky využívajúce skríning ELISA, nasledovaný potvrdzovacím rádioimunoprecipitačným testom naznačujú, že počas prvého roku terapie sa približne u 15 % liečených pacientov vytvoria IgG protilátky proti imigluceráze. Pritom sa ukazuje, že u pacientov, u ktorých sa vytvoria IgG protilátky, sa tak stane najčastejšie počas prvých 6 mesiacov terapie a zriedka sa tieto protilátky na Cerezyme vyvinú po 12 mesiacoch liečby. Odporúča sa, aby u pacientov, u ktorých je podozrenie na zníženú odozvu voči liečbe, bol pravidelne monitorovaná tvorba IgG protilátok voči imigluceráze.
Pacienti s protilátkami proti imigluceráze majú vyššie riziko hypersenzitívnej reakcie (pozri časť 4.8). Ak je u pacienta podozrenie na hypersenzitívnu reakciu, doporučuje sa vyšetrenie na protilátky proti imigluceráze. Podobne ako u všetkých intravenóznych proteínových výrobkov, sú možné, vyskytujú sa však menej často, závažné hypersenzitívne reakcie alergického typu. Ak sa tieto reakcie vyskytnú, odporúča sa okamžite prerušiť aplikáciu infúzie Cerezymu a začať príslušnú liečbu. Musia byť dodržané aktuálne medicínske postupy pre neodkladnú liečbu.
Pri podávaní Cerezymu (imiglucerázy) pacientom, u ktorých sa vyvinuli protilátky alebo príznaky
hypersenzitivity voči Ceredase (algluceráze), treba postupovať opatrne.
Sodík
Tento liek obsahuje sodík a aplikuje sa ako intravenózny roztok 0,9-percentného chloridu sodného
(pozri časť 6.6). Berte do úvahy pacientovu diétu s obmedzením soli.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Výsledky z pozorovania obmedzeného poč tu 150 tehotenstiev (ide najmä o spontánne
hlásenia a literárne údaje) naznač ujú, ž e použ itie Cerezymu má priaznivé úč inky pri kontrole základnej Gaucherovej choroby poč as gravidity. Aj keď je ich štatistická
evidencia nízka, tieto údaje naznačujú, že podávanie Cerezymu nemá žiadne toxické
účinky spojené s malformáciou plodu. Zriedkavo bolo hlásené úmrtie plodu, aj keď nie je jasné, č i toto úmrtie súvisí s už ívaním Cerezymu alebo so základnou Gaucherovou chorobou.
Neboli uskutočnené žiadne štúdie na zvieratách za účelom odhadu účinkov podávania Cerezymu na graviditu, embryonálny/fetálny vývoj, pôrod a postnatálny vývoj. Nie je známe, č i Cerezyme prechádza cez placentu k vyvíjajúcemu sa plodu.
U gravidných pacientiek s Gaucherovou chorobou a pacientiek, ktoré plánujú byť gravidné, je potrebné pre kaž dú graviditu stanoviť odhad rizík a prínosov lieč by. U pacientiek s Gaucherovou chorobou, ktoré otehotnejú, sa môž e poč as gravidity
a š estonedelia vyskytnúť perióda zvýš enej aktivity ochorenia. Sem patrí zvýš ené riziko prejavov na kostre, zhorš enie cytopénie, krvácanie, zvýš ená potreba transfúzií. Je známe, ž e gravidita a laktácia negatívne ovplyvň ujú homeostázu
vápnika matky a ž e zrýchľ ujú metabolizmus kostí. To môž e prispieť k ď alš iemu zať až eniu kostry pri Gaucherovej chorobe.
U ešte neliečených žien odporúčame zvážiť začatie liečby za účelom dosiahnutia optimálneho zdravotného stavu ešte pred počatím. U žien liečených Cerezymom je potrebné zvážiť pokračovanie v liečbe počas gravidity. Podrobné sledovanie gravidity a klinických prejavov Gaucherovej choroby je nevyhnutné pre individualizáciu dávky podľa potrieb pacientky ako aj jej odpovede na liečbu.
D o jčeni e
Nie je známe, či sa liečivo vylučuje do materského mlieka, avšak predpokladá sa, že sa enzým
v gastrointestinálnom trakte dieťaťa rozloží.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Cerezyme nemá žiadny alebo zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zoznamnežiaducichreakciíusporiadanývtabuľke
Nežiaduce reakcie sú uvedené v nasledujúcej tabuľke a zoradené podľa orgánových systémov a
frekvencie výskytu (časté (³ 1/100 až < 1/10), menej časté (³ 1/1 000 až < 1/100) a zriedkavé
(³1/10 000 až <1/1 000)). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Triedy orgánových
systémov podľa MedRA Poruch nervového systému
Poruchy srdca a srdcovej
činnosti
Časté Menej časté Zriedkavé
Závraty, bolesti hlavy, parestézie* Tachykardia*, cyanóza*
Poruchy ciev Začervenanie*, hypotenzia*
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Dyspnoe*, kašeľ*
Vracanie,
nevoľnosť, kŕče
v bruchu, hnačky
Poruchy imunitného systému
Poruchy kože a podkožného tkaniva Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Reakcie z precitlivenosti Anafylaktoidné reakcie
Žihľavka/angioedém*, svrbenie*, vyrážky*
Bolesť kĺbov, bolesti
chrbta*
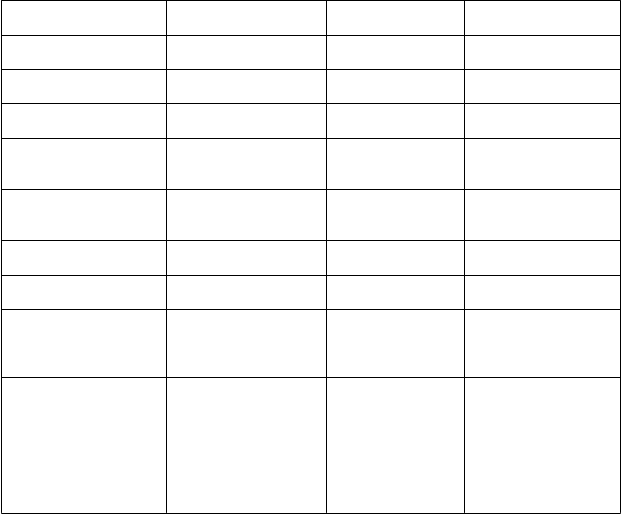
Celkové poruchy a
reakcie v mieste podania
Ťažkosti v mieste
podávania infúzie, pálenie v mieste
podávania infúzie,
opuch v mieste podávania, sterilný
absces v mieste
podávania injekcie,

ťažkosti v hrudníku*, horúčka, triaška, únava
Príznaky naznačujúce precitlivenosť (označené* v tabuľke) boli zaznamenané celkovo u približne 3 %
pacientov. Tieto účinky sa prejavili počas infúzií alebo krátko po nich. Tieto príznaky vo všeobecnosti reagujú na liečbu antihistaminikami a/alebo kortikosteroidmi. Pacienti majú byť poučení, aby pri výskyte týchto symptómov prerušili infúziu a spojili sa so svojím lekárom.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNebol hlásený žiadny prípad predávkovania. U pacientov sa používali dávky do 240 U/kg telesnej
hmotnosti raz za dva týždne.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Enzýmy imigluceráza (rekombinantná makrofágová
b-glukocerebrozidáza). ATC kód: A16AB02.
MechanizmusúčinkuGaucherova choroba je zriedkavá recesívne dedičná metabolická porucha spôsobovaná nedostatkom lyzozomálneho enzýmu kyslej b-glukozidázy. Tento enzým štiepi glukozylceramid, kľúčovú zložku lipidickej štruktúry bunkových membrán, na glukózu a ceramid. U jednotlivcov s Gaucherovou chorobou je degradácia glukozylceramidu nedostatočná, čo spôsobuje hromadenie veľkých množstiev tejto látky vnútri lyzozómov makrofágov (nazývaných aj „Gaucherove bunky“), čo spôsobuje rozsiahlu sekundárnu patológiu.
Gaucherove bunky sa typicky nachádzajú v pečeni, slezine a kostnej dreni a príležitostne v pľúcach, obličkách a v čreve. Klinicky predstavuje Gaucherova choroba heterogénne spektrum fenotypov. Najčastejšími prejavmi ochorenia sú hepatosplenomegália, trombocytopénia, anémia a kostná patológia. Kostné abnormality sú bežnou a často najviac oslabujúcou a invalidizujúcou črtou Gaucherovej choroby. K takýmto kostným prejavom patrí infiltrácia kostnej drene, osteonekróza, bolesti kostí a kostná kríza, osteopénia a osteoporóza, patologické fraktúry a poruchy rastu. Gaucherova choroba je spojená so zvýšenou tvorbou glukózy a zvýšeným výdajom energie v pokoji, čo môže prispievať k únave a kachexii. Pacienti s Gaucherovou chorobou môžu mať tiež nízky zápalový profil. Okrem toho bola Gaucherova choroba dávaná do súvislosti so zvýšeným rizikom abnormalít tvorby imunoglobulínu, ako je hyperimunoglobulinémia, polyklonálna gamopatia, monoklonálna gamopatia nedefinovaného významu (MGUS) a mnohopočetné myelómy. Pri prirodzenom vývoji Gaucherova choroba spravidla vykazuje progresiu, časom spojenú s rizikom nevratných komplikácií v rôznych orgánoch. Klinické prejavy Gaucherovej choroby môžu mať nepriaznivý vplyv na kvalitu života. Gaucherova choroba je spojovaná so zvýšenou morbiditou a predčasnou mortalitou.
Symptómy a príznaky vyskytujúce sa v detstve sú spravidla prejavom závažnejšej Gaucherovej choroby. U detí môže Gaucherova choroba viesť k spomaleniu rastu a oneskoreniu puberty.
Známou komplikáciou Gaucherovej choroby je pľúcna hypertenzia. Pacienti, ktorí sa podrobili splenektómii, majú zvýšené riziko pľúcnej hypertenzie. Liečba Cerezymom vo väčšine prípadov znižuje potrebu splenektómie a včasná liečba Cerezymom sa spája so znížením rizika pľúcnej hypertenzie. Po diagnostikovaní Gaucherovej choroby a neskôr po určitom čase sa odporúča bežné
vyšetrenie na pľúcnu hypertenziu. Predovšetkým tí pacienti, ktorým bola diagnostikovaná pľúcna hypertenzia, majú dostávať adekvátne dávky Cerezymu na zaručenie kontroly základnej Gaucherovej choroby a mala by byť zvážená aj potreba ďalších terapií špecifických pre pľúcnu hypertenziu.
Farmakodynamickéúčinky
Imigluceráza (rekombinantná makrofágová kyslá ß-glukozidáza) nahradzuje nedostatok enzýmovej aktivity a hydrolyzuje glukozylceramid, čím koriguje východiskovú patofyziológiou a predchádza sekundárnej patológii. Cerezyme zmenšuje veľkosť sleziny a pečene, zlepšuje alebo normalizuje trombocytopéniu a anémiu, zlepšuje alebo normalizuje hustotu minerálov v kostiach a zaťaženie kostnej drene, oslabuje alebo eliminuje bolesti kostí a kostnú krízu. Cerezyme znižuje výdaj energie v pokoji. Cerezyme preukázal, že zlepšuje psychické i fyzické aspekty kvality života pri Gaucherovej chorobe. Cerezyme znižuje chitotriozidázu, biomarker hromadenia glukozylceramidu v makrofágoch a odpovede na liečbu. Bolo preukázané, že Cerezyme u detí umožňuje normálny pubertálny vývoj a vyvoláva dobiehanie rastu, čo vedie k normálnej výške a hustote minerálov v kostiach v dospelosti.
Klinickáúčinnosťabezpečnosť
Miera a rozsah odpovede na liečbu Cerezymom sú závislé od dávky. Zlepšenia v orgánových systémoch s rýchlejšou rýchlosťou výmeny, napr. hematologické, možno vo všeobecnosti zaznamenať
oveľa rýchlejšie ako v orgánoch s pomalšou výmenou, ako sú kosti.
V analýze Registra Gaucherovej choroby ICGG na veľkej kohorte pacientov (n = 528) s Gaucherovou
chorobou 1. typu bol pozorovaný časovo a dávkovo závislý účinok Cerezyme na hematologické a viscerálne parametre (počet krvných doštičiek, koncentrácia hemoglobínu, objem sleziny a pečene) v rozsahu dávkovania 15, 30 a 60 U/kg telesnej hmotnosti raz za 2 týždne. U pacientov liečených
60 U/kg telesnej hmotnosti každé 2 týždne sa preukázalo rýchlejšie zlepšovanie stavu a väčší maximálny účinok liečby v porovnaní s pacientmi, ktorí dostávali nižšie dávky.
Podobne aj v analýze Registra Gaucherovej choroby ICGG hustoty minerálov v kostiach použitím dvojitej röntgenovej absorpciometrie (DXA) na 342 pacientoch bola po 8 rokoch liečby dosiahnutá normálna hustota minerálov v kostiach s dávkou Cerezymu 60 U/kg telesnej hmotnosti raz za 2 týždne, nie však s nižšími dávkami 15 a 30 U/kg telesnej hmotnosti raz za 2 týždne (Wenstrup a kol,
2007).
V štúdii skúmajúcej 2 kohorty pacientov liečených s mediánom dávky 80 U/kg telesnej hmotnosti každé 4 týždne a s mediánom dávky 30 U/kg telesnej hmotnosti každé 4 týždne, spomedzi pacientov s bodovým hodnotením zaťaženia kostnej drene ³ 6 dosiahlo viac pacientov z kohorty s vyššou dávkou (33 %; n = 22) zníženie skóre o 2 body po 24 mesiacoch liečby Cerezymom v porovnaní s pacientmi v kohorte s nižšou dávkou (10 %; n = 13) (de Fost a kol, 2006).
Liečba Cerezymom s dávkou 60 U/kg telesnej hmotnosti raz za 2 týždne preukázala zlepšenie z hľadiska bolesti kostí už po 3 mesiacoch, zníženie kostnej krízy do 12 mesiacov a zlepšenie hustoty minerálov v kostiach po 24 mesiacoch liečby (Sims a kol, 2008).
Obvyklá frekvencia infúzií je raz za 2 týždne (pozri časť 4.2). Udržiavacia terapia raz za 4 týždne s kumulatívnou dávkou ako pri dvojtýždennom dávkovaní bola skúmaná u dospelých pacientov so stabilnou reziduálnou Gaucherovou chorobou 1. typu. Zdrúžený koncový parameter bol predom definovaný ako zmeny oproti východzím hodnotám hemoglobínu, krvných doštičiek, objemu pečene a sleziny, kostnej krízy a kostnej choroby. Dosiahnutie alebo udrženie uznávaných liečebných cieľov Gaucherovej choroby pre hematologické a viscerálné parametre bolo prídatným výstupným
parametrom. Po 24 mesiacoch dosiahlo zdrúžený koncový parameter 63% pacientov liečených raz za
4 týždne a 81% pacientov liečených raz za 2 týždne, rozdiel nebol štatisticky významný na intervale spoľahlivosti 95% (-0,357; 0,058). 89% pacientov liečených raz za 4 týždne a 100% pacientov
liečených raz za 2 týždne dosiahlo prídatný koncový parameter založený na liečebných cieľoch,
rozdiel nebol statisticky významný na intervale spoľahlivosti 95% (-0,231; 0,060). Infúzný režim raz za štyri týždne môže byť liečebnou možnosťou pre niektorých dospelých pacientov so stabilnou reziduálnou Gaucherovou chorobou 1. typu, ale klinické dáta sú obmedzené.'
Neboli vykonané žiadne kontrolované klinické štúdie o účinnosti Cerezymu na neurologické prejavy choroby. Preto sa nedajú robiť závery o účinku substitučnej enzýmovej terapie na neurologické prejavy choroby.
Lekárom a zdravotníckym pracovníkom sa odporúča, aby pacientov s Gaucherovou chorobou, vrátane pacientov s chronickými neuronopatickými prejavmi choroby registrovali v „ ICGG registri pacientov s Gaucherovou chorobou“. Údaje o pacientovi sa budú v tomto Registri zhromažďovať anonymne. Ciele „Gaucherského Registra ICGG“ sú zvýšiť pochopenie Gaucherovej choroby a vyhodnotiť účinnosť substitučnej enzýmovej terapie, a viesť v konečnom dôsledku k zlepšeniu bezpečného
a účinného používania Cerezymu.
5.2 Farmakokinetické vlastnosti
Počas 1 hodinovej intravenóznej infúzie 4 dávok (7,5, 15, 30, 60 U/kg) imiglucerázy sa dosiahol rovnovážny stav enzýmovej aktivity v priebehu 30 minút. Následne po infúzii plazmatická enzýmová aktivita prudko poklesla s polčasom v rozmedzí od 3,6 do 10,4 minút. Plazmatický klírens kolísal
v rozmedzí od 9,8 do 20,3 ml/min/kg (stredná hodnota ± SD, 14,5 ± 4,0 ml/min/kg). Distribučný objem korigovaný hmotnosťou pacienta kolísal v rozmedzí 0,09 a 0,15 l/kg (stredná hodnota ± SD
0,12 ± 0,02 l/kg). Zdá sa, že tieto premenné nie sú závislé na dávke alebo na dobe trvania infúzie,
avšak pre každú dávku a rýchlosť infúzie boli sledovaní len 1 alebo 2 pacienti.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podaní a jednorazovej toxicity, genotoxicity, neodhalili žiadne osobitné riziko pre ľudí
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol,
nátriumcitrát (na úpravu pH),
monohydrát kyseliny citrónovej (na úpravu pH), polysorbát 80.
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Neotvorenéinjekčnéliekovky:
2 roky
Zriedený roztok:
Z hľadiska mikrobiologickej bezpečnosti sa má liek ihneď použiť. Ak sa nespotrebuje ihneď,
zodpovedá za prechodné uchovávanie a podmienky pred ďalším použitím užívateľ a liek sa nemá
skladovať dlhšie ako 24 hodín pri teplote 2–8 °C, chránený pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke pri teplote (2°C – 8°C). Podmienky na uchovávanie po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Cerezyme sa dodáva v borokremičitanových (priehľadných) liekovkách typu I s objemom 20 ml. Uzáver je zo silikonizovaného butylového tesnenia s vyklápacím bezpečnostným uzáverom.
Cerezyme 200 U prášoknainfúznykoncentrát
Aby bol poskytnutý dostatočný objem na presné odmeranie dávky, každá injekčná liekovka obsahuje o
0,3 ml viac.
Veľkosť balenia: 1 alebo 25 injekčných liekoviek v kartóne. Na trh nemusia byť uvedené všetky veľkosti balenia.
Cerezyme 400 U prášoknainfúznykoncentrát
Aby bol poskytnutý dostatočný objem na presné odmeranie dávky, každá injekčná liekovka obsahuje o
0,6 ml viac.
Veľkosť balenia: 1, 5 alebo 25 injekčných liekoviek v kartóne.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne upozornenia na likvidáciu a iné zaobchádzanie s liekom
Každá injekčná liekovka Cerezymu je len na jedno použitie.
Prášok na infúzny koncentrát sa musí rozpustiť vo vode na injekcie, zriediť 0,9 %-ným intravenóznym roztokom chloridu sodného a potom podať intravenóznou infúziou.
V súlade s individuálnym dávkovacím režimom pacienta sa určí počet injekčných liekoviek na
nariedenie a tieto sa vyberú z chladničky.
Príležitostne sa môžu dávky upraviť malými korekciami, aby sa zabránilo vyhadzovaniu čiastočne použitých injekčných liekoviek. Dávkovanie sa môže zaokrúhliť na objem najbližšej plnej injekčnej liekovky za predpokladu, že celková mesačná dávka zostane v podstate nezmenená.
Použitie aseptickejtechniky
Rekonštitúcia
Cerezyme 200 U prášoknainfúznykoncentrát
Rekonštituujte obsah každej injekčnej liekovky v 5,1 ml vody na injekciu; vyhnite sa prudkému
vstreknutiu vody a jemným premiešaním sa vyhnite tvorbe peny. Objem roztoku je 5,3 ml. pH
rekonštituovaného roztoku je približne 6,1.
Cerezyme 400 U prášoknainfúznykoncentrát
Rekonštituujte obsah každej injekčnej liekovky v 10,2 ml vody na injekciu; vyhnite sa prudkému
vstreknutiu vody a jemným premiešaním sa vyhnite tvorbe peny. Objem roztoku je 10,6 ml. pH
rekonštituovaného roztoku je približne 6,1.
Po rekonštitúcii je to priezračná bezfarebná tekutina neobsahujúca cudzorodé látky. Rekonštituovaný roztok musí byť ďalej riedený. Pred ďalším riedením pozorne skontrolujte roztok v každej injekčnej liekovke, či neobsahuje cudzie častice alebo či nie je zafarbený. Nepoužívajte injekčné liekovky, ktoré vykazujú prítomnosť cudzích častíc či zafarbenie. Koncentrát po rozpustení ihneďzrieďte a neskladujte na neskoršie použitie.
Riedenie
Cerezyme 200 U prášoknainfúznykoncentrát
Rekonštituovaný roztok obsahuje 40 jednotiek imiglucerázy v jednom mililitri. Rekonštituovaný objem umožňuje presný odber 5,0 ml (zodpovedajúcich 200 jednotkám) z každej injekčnej liekovky.
Odoberte 5,0 ml rozpusteného roztoku z každej injekčnej liekovky a zmiešajte s ďalšími odobratými objemami. Potom zrieďte celý objem s
0,9%-ným intravenóznym roztokom chloridu sodného tak, aby sa dosiahol celkový objem od 100 do 200 ml. Infúzny roztok opatrne premiešajte.
Cerezyme 400 U prášoknainfúznykoncentrátRekonštituovaný roztok obsahuje 40 jednotiek imiglucerázy v jednom mililitri. Rekonštituovaný objem umožňuje presný odber 10,0 ml (zodpovedajúcich 400 jednotkám) z každej injekčnej liekovky.
Odoberte 10,0 ml rozpusteného roztoku z každej injekčnej liekovky a zmiešajte s ďalšími odobratými
objemami. Potom zrieďte celý objem s
0,9%-ným intravenóznym roztokom chloridu sodného tak, aby
sa dosiahol celkový objem od 100 do 200 ml. Infúzny roztok opatrne premiešajte.
PodávanieZriedený roztok sa odporúča podávať vnútorným 0,2 µm filtrom s nízkou väzbou proteínov na odstránenie proteínových častíc. Tým sa zabráni zníženiu aktivity imiglucerázy. Doporučuje sa, aby bol rekonštituovaný roztok podaný do 3 hodín. Liek rozriedený 0,9%-ným intravenóznym roztokom chloridu sodného zostane chemicky stabilný až 24 hodín, ak sa bude skladovať pri teplote medzi 2 °C až 8 °C a chrániť pred svetlom; mikrobiologická bezpečnosť bude záležať od toho, či rozpustenie a rozriedenie prebehlo asepticky.
Cerezyme neobsahuje žiadne konzervačné látky. Všetky nepoužité lieky alebo odpad vzniknutý
z liekov majú byť zlikvidované v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGenzyme Europe B.V., Gooimeer 10 1411 DD Naarden, Holandsko
8. REGISTRAČNÉ ČÍSLAEU/1/97/053/001 Cerezyme 200 U 1 injekčná liekovka s práškom na infúzny koncentrát EU/1/97/053/002 Cerezyme 200 U 25 injekčných liekoviek s práškom na infúzny koncentrát EU/1/97/053/003 Cerezyme 400 U 1 injekčná liekovka s práškom na infúzny koncentrát EU/1/97/053/004 Cerezyme 400 U 5 injekčných liekoviek s práškom na infúzny koncentrát EU/1/97/053/005 Cerezyme 400 U 25 injekčných liekoviek s práškom na infúzny koncentrát
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 17. novembra 1997
Dátum posledného predĺženia registrácie: 17. septembra 2007
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto výrobku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu