
teľné prípady (pozri časť 4.8). Ak dôjde k závažným zmenám, liečba Caprodezom sa má ukončiť.
U pacientov, ktorí majú objektívnu progresiu ochorenia spolu so zvýšenou hladinou špecifického prostatického antigénu PSA, sa má zvážiť ukončenie liečby Caprodezom.
Preukázalo sa, že bikalutamid inhibuje cytochróm P450 (CYP3A4), preto je pri súbežnom podávaní s liekmi metabolizovanými predovšetkým CYP3A4 potrebná opatrnosť (pozri časti 4.3 a 4.5).
V zriedkavých prípadoch boli hlásené fotosenzitívne reakcie u pacientov užívajúcich bikalutamid. Pacienti majú byť poučení, aby sa vyhli priamemu vystaveniu nadmernému slnečnému žiareniu alebo ultrafialovému žiareniu, keď užívajú Caprodez a môžu zvážiť použitie opaľovacích krémov. V prípadoch, keď je fotosenzitívna reakcia pretrvávajúcejšia a/alebo závažnejšia, má sa začať vhodná symptomatická liečba.
Liečba androgénnou depriváciou môže predĺžiť QT interval.
U pacientov, ktorí majú rizikové faktory pre vznik predĺženia QT intervalu v anamnéze a u pacientov užívajúcich súbežne lieky, ktoré môžu predĺžiť QT interval (pozri časť 4.5), majú lekári pred začiatkom liečby Caprodezom vyhodnotiť pomer prínosu a rizika, vrátane možného vzniku torsade de pointes.
Antiandrogénna terapia môže spôsobiť morfologické zmeny spermií. Aj keď sa účinok bikalutamidu na morfológiu spermií nehodnotil a u pacientov, ktorí dostávali bikalutamid, neboli hlásené žiadne takéto zmeny, pacienti a/alebo ich partneri majú počas liečby Caprodezom a počas 130 dní po liečbe používať adekvátnu antikoncepciu.
U pacientov liečených súbežne s bikalutamidom bolo hlásené zosilnenie účinkov kumarínových antikoagulancií, čo môže viesť k zvýšeniu protrombínového času (PT) a medzinárodného normalizovaného pomeru (INR). Niektoré prípady boli spojené s rizikom krvácania. Odporúča sa starostlivé sledovanie PT/INR a má sa zvážiť úprava dávky antikoagulancií (pozri časti 4.5 a 4.8).
Informácieopomocnýchlátkach
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v tablete, t.j. v podstate zanedbateľné množstvo sodíka.
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
In vitro štúdie preukázali, že (R)-bikalutamid je inhibítor CYP3A4 so slabšími inhibičnými účinkami na aktivitu CYP2C9, 2C19 a 2D6. Hoci klinické štúdie s antipyrínom ako markerom aktivity cytochrómu P450 (CYP) nepreukázali žiadny dôkaz o liekovej interakcii s bikalutamidom, priemerná hodnota expozície (AUC – plocha pod časovou krivkou koncentrácie) midazolamu sa zvýšila až o 80 % po súbežnom podávaní s bikalutamidom počas 28 dní. Pre lieky s úzkym terapeutickým indexom by mohlo byť takéto zvýšenie významné. Preto je súbežné používanie terfenadínu, astemizolu a cisapridu kontraindikované (pozri časť 4.3) a pri súbežnom podávaní Caprodezu s látkami, ako je cyklosporín a blokátory vápnikových kanálov, je potrebná opatrnosť. Zníženie dávky je nutné, pokiaľ sa preukáže zosilnený alebo nežiaduci účinok týchto liečiv. Pri cyklosporíne sa odporúča starostlivo sledovať plazmatické koncentrácie a klinický stav, a to na začiatku liečby Caprodezom alebo po jej ukončení.
Opatrnosť je potrebná pri predpisovaní Caprodezu s inými liekmi, ktoré môžu inhibovať oxidáciu lieku, napr. s cimetidínom a ketokonazolom. Teoreticky by to mohlo mať za následok zvýšené plazmatické koncentrácie bikalutamidu, čo by mohlo viesť k zvýšenému výskytu nežiaducich účinkov.
In vitro štúdie preukázali, že bikalutamid môže vytesňovať kumarínové antikoagulancium, warfarín, z jeho proteínových väzbových miest. Pri súbežnom podávaní s bikalutamidom boli hlásené prípady zvýšeného účinku warfarínu a iných kumarínových antikoagulancií. Preto ak sa Caprodez začína podávať pacientom, ktorí súčasne užívajú kumarínové antikoagulanciá, odporúča sa dôsledne sledovať PT/INR a zvážiť úpravu dávky antikoagulancia (pozri časti 4.4 a 4.8).
Vzhľadom na to, že liečba androgénnou depriváciou môže predĺžiť QT interval, súbežné užívanie Caprodezu s liekmi, o ktorých je známe, že predlžujú QT interval alebo s liekmi, ktoré môžu vyvolať torsade de pointes, ako sú antiarytmiká triedy IA (napr. chinidín, disopyramid) alebo triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadón, moxifloxacín, antipsychotiká, sa má starostlivo zhodnotiť (pozri časť 4.4).
Pediatrickápopulácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Bikalutamid je kontraindikovaný u žien a nesmie sa podávať tehotným ženám.
Dojčenie
Bikalutamid je kontraindikovaný u žien a nesmie sa podávať dojčiacim matkám.
Fertilita
V štúdiách na zvieratách sa pozorovalo reverzibilné poškodenie plodnosti u samcov (pozri časť 5.3). U
človeka by sa malo predpokladať obdobie subfertility alebo infertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Nie je pravdepodobné, že Caprodez ovplyvňuje schopnosť pacientov viesť vozidlá a obsluhovať stroje. Treba však mať na zreteli, že niekedy sa môže vyskytnúť ospalosť. Všetci takto ovplyvnení pacienti majú byť opatrní.
4.8 Nežiaduce účinky
V tejto časti sú definované nežiaduce účinky nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 1: Frekvencia výskytu nežiaducich reakcií
Trieda orgánových systémov Frekvencia Nežiaduca udalosť
Poruchy krvi a lymfatického systému
Časté anémia
Poruchy imunitného systému Menej časté hypersenzitivita, angioedém a urtikária
Poruchy metabolizmu a výživy Časté znížená chuť do jedla Psychické poruchy Časté znížené libido, depresia Poruchy nervového systému Časté závrat, ospalosť
Poruchy srdca a srdcovej
činnosti Poruchy ciev Poruchy dýchacej
hrudníka a mediastína
Poruchy gastrointestinálneho
traktu
Neznáme predĺženie QT intervalu (pozri
časti 4.4 a 4.5)
| Časté
| návaly tepla
|
|
| sústavy,
| Menej časté
| intersticiálna
| choroba
| pľúce
|
|
|
(hlásené boli úmrtia)
Časté bolesť brucha, zápcha, dyspepsia, flatulencia, nauzea
Poruchy pečene a žlčových ciest Časté hepatotoxicita, žltačka, hypertransaminazémiaa
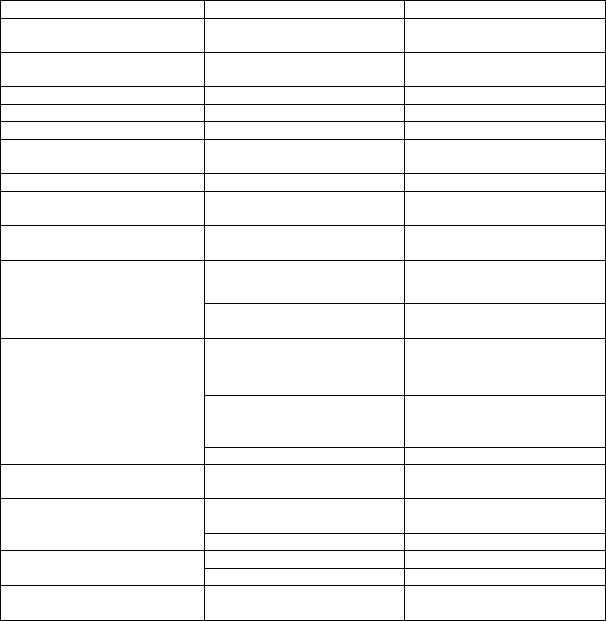
Zriedkavé zlyhávanie pečened (hlásené boli úmrtia)
Poruchy kože a podkožného
tkaniva
Veľmi časté vyrážka
Časté alopécia,
hirzutizmus/obnovenie rastu
vlasov, suchá kožac, pruritus
Zriedkavé fotosenzitívna reakcia
Poruchy
| obličiek a močových
| Časté
| hematúria
|
|
ciest
|
|
|
|
|
Poruchy
| reprodukčného
| Veľmi časté
| gynekomastia
| a citlivosť
|
systému a prsníkov
prsníkovb
|
|
|
Časté
|
erektilná dysfunkcia
|
Celkové
|
poruchy
|
a reakcie
|
Veľmi časté
|
asténia
|
|
|
v mieste podania
Laboratórne a funkčné vyšetrenia
Časté bolesť na hrudníku, edém
Časté zvýšenie telesnej hmotnosti
a Zmeny pečene sú zriedkavo závažné a boli často prechodné, pri pokračovaní v liečbe alebo po jej
skončení ustúpili alebo sa zmiernili.
b U väčšiny pacientov užívajúcich 150 mg bikalutamidu v monoterapii sa vyskytovala gynekomastia
a/alebo bolesť prsníka. V štúdiách sa tieto príznaky považovali za závažné u 5 % pacientov.
Gynekomastia nemusí po ukončení liečby spontánne ustúpiť, najmä po dlhodobej liečbe.
c Vzhľadom na konvencie kódovania v EPC štúdiách, nežiaduca udalosť „suchá koža“ bola kódovaná na základe COSTART terminológie ako „vyrážka“. Preto nie je možné určiť osobitné deskriptory
frekvencie pre dávku 150 mg bikalutamidu, aj keď rovnaká frekvencia bola predpokladaná pre dávku
50 mg.
d Uvedená ako nežiaduca reakcia na liek získaná z prehľadov údajov po uvedení lieku na trh. Frekvencia bola získaná z výskytu hlásených nežiaducich udalostí zlyhávania pečene u pacientov liečených 150 mg bikalutamidu v otvorenom ramene EPC štúdií.
e Uvedená ako nežiaduca reakcia na liek získaná z prehľadov údajov po uvedení lieku na trh. Frekvencia bola získaná z výskytu hlásených nežiaducich udalostí intersticiálnej pneumónie v randomizovanej
perióde liečby 150 mg v EPC štúdiách.
Zvýšený PT/INR: Po uvedení na trh boli hlásené prípady interakcií kumarínových antikoagulancií s bikalutamidom (pozri časti 4.4 a 4.5).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieU ľudí nie sú k dispozícii žiadne skúsenosti s predávkovaním. Špecifické antidotum neexistuje, liečba má byť symptomatická. Dialýza nemusí byť prospešná, pretože bikalutamid sa vo vysokej miere viaže na bielkoviny a nevylučuje sa močom v nezmenenej forme. Indikovaná je všeobecná podporná starostlivosť vrátane častého monitorovania vitálnych funkcií.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Endokrinná liečba, antiandrogény, ATC kód: L02BB03
MechanizmusúčinkuBikalutamid je nesteroidný antiandrogén bez ďalšej endokrinnej aktivity. Viaže sa na androgénový receptor bez aktivácie génovej expresie, a tým inhibuje androgénnu stimuláciu. Výsledkom tejto inhibície je regresia tumoru prostaty. U niektorých pacientov sa prerušenie liečby bikalutamidom môže klinicky prejaviť “syndrómom z vysadenia antiandrogénu”.
KlinickáúčinnosťabezpečnosťÚčinnosť bikalutamidu 150 mg sa sledovala u ľudí s lokalizovaným (T1-T2, N0 alebo NX, M0) alebo
lokálne pokročilým (T3-T4, žiadne N, M0; T1-T2, N+, M0) karcinómom prostaty bez metastáz v kombinovanej analýze troch placebom kontrolovaných, dvojito zaslepených štúdií u 8 113 pacientov, kde sa bikalutamid podával ako okamžitá hormonálna liečba alebo ako prídavná liečba k radikálnej prostatektómii alebo rádioterapii (najmä radiácia s použitím externého žiarenia). V mediáne sledovania
9,7 rokov sa u 36,6 % pacientov užívajúcich bikalutamid a u 38,17 % pacientov užívajúcich placebo prejavila objektívna progresia ochorenia.
Zníženie rizika objektívnej progresie ochorenia sa pozorovalo vo väčšine skupín pacientov, avšak najvýraznejšie bolo u pacientov s najväčším rizikom progresie ochorenia. Lekári sa preto môžu rozhodnúť, že optimálnou liečebnou stratégiou liečby u skupiny pacientov s nízkym rizikom progresie ochorenia, najmä pri prídavnej liečbe po radikálnej prostatektómii, je odložiť hormonálnu liečbu dovtedy, kým sa neobjavia príznaky progresie ochorenia.
Nepozoroval sa žiadny celkový rozdiel v prežívaní pri sledovaní s mediánom sledovania 9,7 roka s mortalitou 31,4 % (HR = 1,01; 95 % IS – interval spoľahlivosti 0,94 až 1,09). Niektoré tendencie však boli zjavné vo výskumných analýzach podskupín.
V nasledovných tabuľkách sú zhrnuté údaje o prežívaní bez progresie ochorenia a údaje o celkovom prežívaní na základe odhadu podľa Kaplana-Meiera u pacientov s lokálne pokročilým ochorením:
 T
abuľka 2: Podiel pacientov s lokálne pokročilým ochorením s progresiou ochorenia podľa liečebných podskupín
T
abuľka 2: Podiel pacientov s lokálne pokročilým ochorením s progresiou ochorenia podľa liečebných podskupín
A
nalyzovaná
populácia
R
ameno liečby
P
r
í
pady (%) po 3 rokoch
P
r
í
pady (%)
po 5 rokoch
P
r
í
pady (%) po 7 rokoch
P
r
í
pady (%)
po 10 rokoch
Pod aktívnym
Rádioterapia
(n=305)
bikalutamid
sledovaním lekára
| 150 mg
|
|
|
|
| (n=657)
| placebo
| 39,8 %
| 59,7 %
| 70,7 %
| 79,1 %
|
|
|
bikalutamid
150 mg
19,7 % 36,3 % 52,1 % 73,2 %
13,9 % 33,0 % 42,1 % 62,7 %
Radikálna prostatektómia (n=1 719)
placebo 30,7 % 49,4 % 58,6 % 72,2 %
bikalutamid
150 mg 7,5 % 14,4 % 19,8 % 29,9 %
placebo 11,7 % 19,4 % 23,2 % 30,9 %
T
abuľka 3: Celkové prežívanie u pacientov s lokálne pokročilým ochorením podľa liečebných
podskupín
A
nalyzovaná
P
r
í
pady
(
%
) po
|
3
|
P
r
í
pady
(
%
) po
|
5
|
P
r
í
pady
(
%
) po
|
7
|
P
r
í
pady
po
|
(
%
)
10
|
rokoch
|
|
rokoch
|
|
rokoch
|
|
rokoch
|
|
14,2 %
|
|
29,4 %
|
|
42,2 %
|
|
65,0 %
|
|
17,0 %
|
'
|
36,4 %
|
|
53,7 %
|
|
67,5 %
|
|
8,2 %
|
|
20,9 %
|
|
30,0 %
|
|
48,5 %
|
|
12,6 %
|
|
23,1 %
|
|
38,1 %
|
|
53,3 %
|
|
4,6 %
|
|
10,0 %
|
|
14,6 %
|
|
22,4 %
|
|
4,2 %
|
|
8,7 %
|
|
12,6 %
|
|
20,2 %
|
|
|
|
populácia
R
ameno liečby
Pod aktívnym sledovaním lekára (n=657)
Rádioterapia (n=305) Radikálna
prostatektómia
(n=1 719)
bikalutamid
150 mg

placebo bikalutamid
150 mg
placebo bikalutamid
150 mg
placebo
U pacientov s lokalizovaným ochorením užívajúcich samotný bikalutamid sa nepozoroval signifikantný
rozdiel v prežívaní bez progresie ochorenia. U pacientov s lokalizovaným ochorením užívajúcich
bikalutamid ako prídavnú liečbu po rádioterapii (HR=0,98; 95 % IS 0,80 až 1,20) alebo radikálnej prostatektómii (HR=1,03; 95 % IS 0,85 až 1,25) nebol pozorovaný signifikantný rozdiel v celkovom prežívaní. U pacientov s lokalizovaným ochorením, ktorí boli pod prísnym dohľadom lekára, bola tendencia k nižšej miere prežívania v porovnaní s pacientmi užívajúcimi placebo (HR=1,15; 95 % IS
1,00 až 1,32). Pomer prínosu a rizika liečby bikalutamidom sa preto u tejto skupiny pacientov s
lokalizovaným ochorením nepovažuje za výhodný.
V samostatnom programe sa účinnosť kombinovaného bikalutamidu 150 mg na liečbu pacientov s lokálne pokročilým nemetastatickým karcinómom prostaty, u ktorých bola indikovaná okamžitá kastrácia, preukázala kombinovanou analýzou 2 štúdií so 480 predtým neliečenými pacientmi s karcinómom prostaty bez metastáz (M0). Pri 56 % úmrtnosti a mediáne sledovania 6,3 roka sa nezistil významný rozdiel medzi bikalutamidom a kastráciou v prežívaní (HR = 1,05 [IS 0,81 až 1,36]); rovnocennosť týchto dvoch liečebných stratégií sa však nedala štatisticky uzavrieť.
V kombinovanej analýze 2 štúdií s 805 predtým neliečenými pacientmi s metastatickým ochorením (M1) a mortalitou 43 % sa dokázalo, že bikalutamid v dávke 150 mg je menej účinný ako kastrácia, čo sa týka doby prežívania (HR = 1,30 [IS 1,04 až 1,65]), s číselným rozdielom v odhadovanom čase do smrti 42 dní (6 týždňov) v priebehu priemerného obdobia prežívania 2 roky.
Bikalutamid je racemát, ktorého antiandrogénny účinok sa vyskytuje takmer výlučne vo forme (R)-
enantioméru. Pediatrickápopulácia
U pediatrických pacientov sa nevykonali žiadne štúdie (pozri časti 4.3 a 4.6).
5.2 Farmakokinetické vlastnosti
Absorpcia
Bikalutamid sa po perorálnom podaní dobre absorbuje. Neexistuje žiaden dôkaz o akomkoľvek klinicky významnom vplyve jedla na biologickú dostupnosť.
Distribúcia
Bikalutamid sa vo veľkej miere viaže na bielkoviny: (racemát 96 %, (R)-enantiomér > 99 %) a v značnej
miere sa metabolizuje (oxidáciou a glukuronidáciou); jeho metabolity sa vylučujú obličkami a žlčou v približne rovnakých pomeroch.
Biotransformácia
(S)-enantiomér sa rýchlo vylučuje v porovnaní s (R)-enantiomérom, ktorý má plazmatický eliminačný polčas asi 1 týždeň.
Pri dennom podávaní bikalutamidu 150 mg sa (R)-enantiomér hromadí približne 10-násobne v plazme v dôsledku svojho dlhého polčasu.
Počas denného podávania bikalutamidu 150 mg sa pozorujú ustálené plazmatické koncentrácie (R) - enantioméru približne 22 mikrogramov/ml. V rovnovážnom stave predstavuje prevažne aktívny (R) - enantiomér 99 % všetkých cirkulujúcich enantiomérov.
Eliminácia
V klinickej štúdii bola priemerná koncentrácia R-bikalutamidu v sperme mužov dostávajúcich
bikalutamid 150 mg 4,9 mikrogramov/ml. Množstvo bikalutamidu, ktoré sa potenciálne môže dostať do tela partnerky počas pohlavného styku je malé a rovná sa približne 0,3 mikrogramu/kg. Toto množstvo je nižšie ako je množstvo potrebné na vyvolanie zmien u potomstva laboratórnych zvierat.
Osobitné skupiny
Farmakokinetika (R)-enantioméru nie je ovplyvnená vekom, poruchou funkcie obličiek ani miernou až stredne závažnou poruchou funkcie pečene. Existujú dôkazy o pomalšej eliminácii (R)-enantioméru z plazmy u osôb so závažnou poruchou funkcie pečene.
5.3 Predklinické údaje o bezpečnosti
Bikalutamid je silný antiandrogén a induktor oxidázy so zmiešanou funkciou u zvierat. Zmeny cieľových orgánov, vrátane indukcie tumoru (Leydigove bunky, štítna žľaza, pečeň), u zvierat jednoznačne súvisia s touto aktivitou. Indukcia enzýmov sa u človeka nepozorovala. U všetkých skúmaných druhov sa pozorovala atrofia semenotvorných kanálikov a predpokladá sa, že sa jedná o skupinový účinok antiandrogénov. Úplný zvrat atrofie semenníkov sa vyskytol 4 mesiace po ukončení dávkovania v 6-mesačnej štúdii na potkanoch (pri dávkach približne 0,6-násobku terapeutických koncentrácií u ľudí pri odporúčanej dávke 150 mg). V 12-mesačnej štúdii na potkanoch (pri dávkach približne 0,9-násobku ľudskej koncentrácie pri odporúčanej dávke pre človeka 150 mg) sa nepozorovalo žiadne zotavenie po 24 týždňoch po ukončení dávkovania. Po 12 mesiacoch opakovaného dávkovania psom (pri dávkach približne 3-násobku terapeutických koncentrácií u ľudí pri odporúčanej dávke pre ľudí 150 mg) bol výskyt testikulárnej atrofie u psov a kontrolných psov rovnaký po 6-mesačnom období zotavenia. V štúdii fertility (pri dávkach približne 0,6-násobku terapeutických koncentrácií u ľudí pri odporúčanej dávke pre ľudí 150 mg) mali samce potkanov zvýšený čas do úspešného párenia ihneď po
11 týždňoch dávkovania; zvrat bol pozorovaný po 7 týždňoch po podaní dávky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
monohydrát laktózy povidón K-25 karboxymetylškrob A, sodná soľ stearát horečnatý
Filmovýobaltablety hypromelóza (5cP) oxid titaničitý (E171) propylénglykol
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
5 rokov
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Priehľadné PVC/PVDC/ALU blistre v škatuľke.
Balenie obsahuje 10, 14, 20, 28, 30, 40, 50, 56, 60, 80, 84, 90, 98, 100, 140, 200 alebo 280 filmom
obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
ARDEZ Pharma, spol. s r.o. V Borovičkách 278
252 26 Kosoř
Česká republika
8. REGISTRAČNÉ ČÍSLO
44/0189/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
07/2021