
/>
Návod na použitie
BUDIAIR 0,2 mg, inhalačný roztok v tlakovej nádobe vloženej do štandardnéhoumelohmotného orálneho aplikátora:
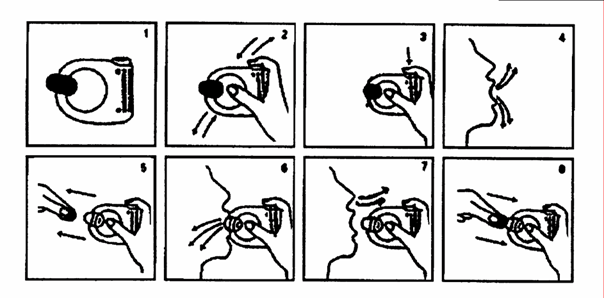
Najprv je potrebné tlakovú nádobu v umelohmotnom obale (inhalátor) dobre zatriasť a vystreknúť
jednu dávku do vzduchu, aby ste sa presvedčili, či inhalátor funguje.
Pred každým použitím dodržujte nasledujúci postup:
1.Odstráňte ochranný kryt z náustku.
2.Tlakovú nádobu v umelohmotnom obale (inhalátor) v zvislej polohe (náustkom dole a dnom tlakovej nádoby hore) silne potraste.
3.Zhlboka vydýchnite (čo najviac, ale iba tak, aby Vám to nebolo nepríjemné)
4.Nádobku držte otočenú s náustkom smerom dole k tvári a vložte náustok do úst medzi zuby a pevne zovrite perami.
5.Začnite sa pomaly a plynulo nadychovať ústami, a hneď potom ako začnete s nádychom, stlačte hornú časť inhalátora (dno tlakovej nádoby) smerom dole, aby sa uvoľnila odmeraná dávka
aerosolu. Dávku aerosolu uvolnenú z inhalátora plynulo vdýchnite čo najhlbšie do pľúc.
Zadržte dych tak dlho, ako je to možné, vytiahnite inhalátor z úst a pomaly vydýchnite nosom.

Ak je potrebná ešte jedna inhalácia, podržte inhalátor vo zvislej polohe, pokiaľ sa pripravíte k vdýchnutiu druhej dávky, približne pol minúty, a potom zopakujte kroky 2 až 5.
Po aplikácii vždy nasaďte ochranný kryt na náustok, aby ste zabránili jeho znečisteniu (zaneseniu prachu, vlasov).
Dôležité upozornenie: Kroky 3, 4 a 5 nerobte príliš rýchlo.
Ak spozorujete, že z hornej časti inhalátora, z okolia náustku alebo z Vašich úst unikla "hmla", mali by ste začať znovu od kroku 2.
Pacientom s oslabenou rukou alebo deťom sa odporúča stlačiť inhalátor oboma rukami súčasne. Ak máte s používaním inhalátora nejaké problémy povedzte to svojmu lekárovi alebo lekárnikovi.
Čistenie umelohmotného orálneho aplikátora:Aby sa zabezpečila správna funkcia tlakovej nádoby s dávkovačom, je potrebné pravidelné (3 - 4 krát týždenne) čistenie orálneho umelohmotného aplikátora. Dajte dolu ochranný kryt náustku, vyberte hliníkovú tlakovú nádobu z umelohmotného aplikátora. Eventuálne usadeniny v umelohmotnom
aplikátore vypláchnite vlažnou vodou. Umelohmotný aplikátor potom dobre osušte, nasaďte do neho
tlakovú nádobu a nasaďte ochranný kryt na náustok. Hliníkovú tlakovú nádobu nedávajte do vody!
BUDIAIR 0,2 mg, inhalačný roztok v tlakovej nádobe vloženej do JetSpacer® (špeciálnehoumelohmotného orálneho aplikátora)1.Tlaková nádoba nachádzajúca sa v špeciálnom orálnom aplikátore JetSpacer® je v stave pripravenom na použitie.
2.Držte JetSpacer® presne podľa vyobrazenia na obrázku 2 (dnom tlakovej nádoby hore) a silne potraste.
3.Stlačte dno tlakovej nádoby smerom dole, až po vyfúknutie, kedy sa uvoľní odmeraná dávka aerosolu, do priestoru JetSpaceru. Farebný ochranný kryt náustku JetSpaceru pri tomto kroku
musí byť správne nasadený.
4.Zhlboka vydýchnite (čo najviac, ale iba tak, aby Vám to nebolo nepríjemné).
5.Odstráňte ochranný kryt náustku JetSpaceru.
6.Náustok vložte do úst medzi zuby a pevne zovrite perami. Zhlboka a pomaly sa nadychujte ústami. Zadržte dych tak dlho, ako je to možné, cca 10 sekúnd.
7.Vytiahnite Jetspacer z úst. Pomaly vydýchnite nosom.
Ak je potrebných viac inhalácií lieku, zopakujte postup aplikácie podľa bodov 2 až 6, toľkokrát koľko predpísal lekár.
8.Po aplikácii vždy nasaďte ochranný kryt na náustok JetSpaceru.
 Č
istenie JetSpacera (umelohmotného orálneho aplikátora)
Č
istenie JetSpacera (umelohmotného orálneho aplikátora)
Z Jet Spacera vyberte hliníkovú tlakovú nádobu, odstráňte farebný kryt náustku. Premyte umelohmotný JetSpacer vlažnou vodou a nechajte ho dobre vysušiť. Potom tlakovú nádobu opäť vložte do JetSpacera a nasaďte ochranný kryt na náustok.
Hliníkovú tlakovú nádobu nedávajte do vody!
4.3. KontraindikácieBUDIAIR 0,2 mg sa nesmie podávať pri známej precitlivenosti na budezonid alebo ktorúkoľvek pomocnú látku lieku.
V prípade pľúcnej mykózy alebo tuberkulózy sa BUDIAIR 0,2 mg môže použiť iba ako doplnok primárnej cielenej chemoterapickej/antibiotickej liečby.
Počas gravidity, predovšetkým v priebehu prvých troch mesiacov, sa BUDIAIR môže použiť iba po starostlivom zvážení pomeru prospechu a rizika z liečby, ak očakávaný prospech pre matku prevyšuje
možné riziko pre plod.
Nakoľko nie je známy podiel budezonidu, ktorý sa vylučuje do materského mlieka, odporúča sa pri nevyhnutnej terapii matky, prerušiť prirodzené dojčenie dieťaťa.
4.4. Špeciálne upozorneniaJe dôležité upozorniť pacienta, že kortikosteroidy sú lieky k preventívnemu podávaniu používané k ovplyvneniu zápalu dýchacích ciest, majú pomalý nástup účinku, a preto by mali byť aplikované pravidelne aj v období, keď je ochorenie bez príznakov. Inhalačné kortikosteroidy majú iba minimálny
priamy bronchodilatačný účinok, a preto by nemali byť používané ako primárna liečba u akútnych
astmatických záchvatoch. V týchto prípadoch sú indikované krátkodobo účinné inhalačné bronchodilatátory s rýchlym nástupom účinku.
Pacient by mal byť poučený, že má informovať prípadných ďalších svojich lekárov, že užíva alebo užíval kortikosteroidy.
Kortikosteroidy môžu maskovať príznaky infekcie. Opatrnosť je potrebná predovšetkým u vírusových infekcií, ako je varicella a u neliečených plesňových a bakteriálnych infekcií respiračného systému.
V týchto prípadoch by mala byť ihneď nasadená vhodná protiinfekčná liečba a je potrebné starostlivo zvážiť riziko a prínos podávania inhalačných kortikosteroidov.
Pacienti s bronchiálnou astmou alebo s chronickým obštrukčným ochorením pľúc, ktorí nie sú liečeníkortikosteroidmi:Liečba liekom BUDIAIR 0,2 mg vedie k zlepšeniu stavu u väčšiny týchto pacientov už po prvom týždni liečby. Pri ťažkej bronchiálnej mukóznej obštrukcii je prienik liečiva do bronchiálnej sliznice výrazne znížený. V tomto prípade sa najprv odporúča intenzívna krátkodobá liečba (približne 2 týždne)
vysokými dávkami perorálnych resp. parenterálnych kortikosteroidov, aby sa dosiahla lepšia absorpcia
aerosólu do bronchiálnej sliznice. Perorálne alebo parenterálne kortikosteroidy pri súčasnej liečbe inhalačnými kortikosteroidmi je potom možné postupne vysadiť. Pri zhoršení dýchania v dôsledku bakteriálnej infekcie treba dávkovanie budezonidu zvýšiť a zároveň zahájiť antibiotickú liečbu.
Pacienti s bronchiálnou astmou alebo s chronickým obštrukčným ochorením pľúc, ktorí sú liečení
systémovými kortikosteroidmi (perorálnymi resp. parenterálnymi):
Ak je pacient stabilizovaný, odporúča sa znižovať perorálnu resp. parenterálnu dávku kortikosteroidov.
U pacientov liečených systémovo perorálnymi alebo parenterálnymi kortikosteroidmi sa často objavuje redukcia adrenálnej funkcie. K jej zlepšeniu dochádza pomaly, po znížení systémových dávok kortikoidov. Znižovanie dávok systémových steroidov musí byť preto postupné. Vo všeobecnosti sa môže budezonid súčasne ako doplnok podávať jeden týždeň. Perorálna alebo parenterálna dávka steroidov by sa mala podľa klinického stavu pacienta znižovať o 5 mg za týždeň, v závažných prípadoch o 2,5 mg prednizolonu (ekvivalent).
Ak po prvom mesiaci od zmeny na liek BUDIAIR 0,2 mg, dôjde ku komplikáciám (napr. závažná infekcia, poranenie a/alebo chirurgický zákrok) alebo k akútnemu zhoršeniu bronchiálnej mukóznej obštrukcie, použije sa najvyššie dávkovanie budezonidu; eventuálne sa indikuje krátkodobá doplnková liečba perorálnymi steroidmi.
Pri prechode z perorálnej resp. z parenterálnej kortikoidálnej liečby na inhalačnú, sa môže vyskytnúť fenóm podobný alergiám (napr. alergické kožné prejavy a alergická rinitída), ktoré boli predtým potlačené systémovým účinkom kortikoidov
Počas dlhodobej liečby dennými dávkami do 0,8 mg budezonidu sa u väčšiny pacientov nezaznamenalo signifikantné zníženie adrenokortikálnej funkcie. Pri dlhodobom podávaní denných dávok do 1,6 mg budezonidu nemožno vylúčiť klinicky významné ovplyvnenie plazmatickej hladiny kortizolu. Pri podávaní denných dávok budezonidu do 1,6 mg spolu s perorálnou doplnkovou kortikoidovou terapiou, zlepšenie adrenálnej funkcie možno dosiahnuť substitúciou systémových kortikoidov na začiatku liečby.
Pri zosilnení terapeutickej účinnosti zvýšením dávok budezonidu je potrebné rátať aj so zvýšeným výskytom systémových nežiaducich účinkov. V zásade je lepšie podávať vyššie dávky formou inhalácie, ako kombinovať inhaláciu s perorálnou kortikosteroidovou liečbou.
4.5. Liekové a iné interakcie
Neboli pozorované interakcie budezonidu s inými liečivami, ktoré sa používajú na liečbu astmy. CYP3A4, ktorý patrí do skupiny enzýmov príbuzných s cytochrómom P 450, je priamo zodpovený za
metabolizmus budezonidu. Inhibítory tohto enzýmu napr. ketokonazol, preto môžu zvyšovať expozíciu organizmu voči budezonidu (pozri časť 4. 4. ).
Cimetidín podaný v odporúčaných dávkach má malý, klinicky nevýznamný účinok na farmakokinetiku
perorálne podaného budezonidu.
4.6. Používanie v gravidite a počas laktácie
Liečbu budezonidom počas gravidity treba prísne posúdiť z hľadiska pomeru potreby liečby pre matku a možného rizika pre plod. Keďže nie je známe, aký podiel budezonidu sa vylučuje do materského
mlieka, počas liečby liekom BUDIAIR 0,2 mg sa neodporúča dojčiť.
4.7. Ovplyvnenie schopnosti viesť motorové vozidlá a obsluhovať stroje
Nie je známe.
4.8. Nežiaduce účinky
Infekcie
Zriedkavé:
Kvasinková kolonizácia (kandidóza) slizníc v ústach a hrdle.
U týchto pacientov sa odporúča liečba lokálnymi protiplesňovými liečivami (antimykotikami), bez nutnosti prerušiť inhalácia lieku BUDIAIR® 0,2mg. Skúsenosti ukazujú, že výskyt kandidózy je výrazne nižší, ak sa liek používa pred jedlom a/alebo sa po každom použití lieku dobre vypláchnu ústa.
Hormonálny systém
Môže byť ovplyvnená súhra hormónov medzimozgovo-hypofyzárneho systému a nadobličiek, čo môže spôsobiť zvýšenú citlivosť k vzniku infekcií a poruchu adaptácie na stres. V zriedkavých prípadoch sa môžu objaviť príznaky systémového účinku glukokortikosteroidov, vrátane hypofunkcie nadobličky
a spomalenia rýchlosti rastu.
Nervový systém
Zriedkavé:
Nervozita, nepokoj, depresia a poruchy správania .
Dýchacísystém:
Zriedkavé:
Môže sa objaviť paradoxný bronchospazmus a kašeľ.
Lokálne reakcie:
Menej časté:
Mierne podráždenie sliznice hrdla s problematickým prehĺtaním a zachrípnutím.
Odporúča sa, aby pacienti trpiaci podráždením slizníc, zachrípnutím alebo kandidózou, používali BUDIAIR® 0,2mg so špeciálnym orálnym aplikátorom Jetspacerom. Znižuje sa tak ukladanie čiastočiek v ústach a hrdle, pričom sa zároveň zvyšuje množstvo liečiva v dolných dýchacích cestách.
Zriedkavé:
Reakcie z precitlivenosti, ako napr. vyrážka, žihľavka, kontaktná dermatitída, angioedém ako aj kožné podliatiny.'
4.9. Predávkovanie
Doposiaľ sa nezaznamenalo akútne predávkovanie po použití lieku BUDIAIR 0,2 mg. Ako následok dlhodobého predávkovania sa môžu objaviť neželané systémové glukokortikoidné účinky. Prvým
príznakom môže byť zvýšený sklon k vzniku infekcií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné inhalačné antiastmatiká - glukokortikoidy
ATC kód: R03BA02 (budezonid)
In vitro štúdie u experimentálnych zvierat dokázali, že budezonid brzdí uvoľňovanie mediátorov zápalu. Mediátory sú biologické molekuly, ktoré sa nachádzajú v proforme v jednotlivých bunkách (napr. histamín, kinín alebo sa na základe podnetov prostredníctvom prostaglandínov alebo leukotriénov sa v bunkách novo syntetizujú z membránových štruktúr obsahujúcich kyselinu arachidónovú).
Stabilizujúci účinok budezonidu na žírne bunky sa skúmal pri antigén indukovanom IgE sprostredkovanom bronchospazme. Nezistili sa žiadne zmeny bronchiálnej sliznice ani po niekoľkoročnej liečbe budezonidom, tieto zistenia sa potvrdili aj histologickými skúškami.
Štúdie tiež preukázali, že je možné budezonidom nahradiť priemernú dávku 5-10 mg prednizolonu podávaného perorálne.
5.2. Farmakokinetické vlastnosti
Pri inhalácii aerosolovej dávky sa asi iba 15 % z celkového množstva účinnej látky v aerosole dostane do bronchov. Uvedený podiel je možné zvýšiť inhalačnými pomôckami (perorálnymi aplikátormi).
Zvyškový podiel liečiva, ktorý zostáva deponovaný v oro-pharyngeálnom priestore, podlieha po jeho
prehltnutí first pass efektu (90%). Podiel budesonidu, ktorý sa dostal do dolných dýchacích ciest sa v priebehu cca 30 minút resorbuje do systémovej cirkulácie, a vylučuje sa s polčasom eliminácie asi 2,8 hod.
5.3. Predklinické údaje o bezpečnosti
Akútna toxicita:
Akútna toxicita budezonidu bola určená u myší a u potkanov pri rôznych aplikačných cestách.
Výsledky:
druh
| spôsob podania
| LD50 (mg/kg)
|
myš
| perorálne
| > 800
|
potkan
| subkutánne
| 20
|
potkan
| perorálne
| 400
|
Subakútna a chronická toxicita:Budezonid podávaný inhalačne psom a potkanom počas 12 mesiacov, nevyvolal v dýchacom systéme žiadne príznaky lokálnej toxicity ani pri dávkach 10 až 40-násobne vyšších ako sú terapeutické dávky.
Reprodukčná toxicita:Glukokortikoidy v reprodukčných štúdiách u zvierat vykazovali teratogénny účinok (rázštep podnebia, skeletálne abnormality). Klinická signifikantnosť týchto účinkov však zatiaľ nie je objasnená.
U hlodavcov budezonid spôsoboval typické zmeny, aké sa pozorujú aj u iných glukokortikoidov, tieto poškodenia sa však vyskytovali v menšej miere v porovnaní s inými lokálnymi kortikoidmi.
Mutagenita:Mutagénne vlastnosti budezonidu sa skúmali v šiestich rôznych testovacích modeloch. Budezonid nebol mutagénny ani klastogénny v žiadnom z týchto testov.
Karcinogenita:V jednej zo štúdií na karcinogenitu sa zaznamenal zvýšený výskyt mozgového gliómu u samčekov potkanov, čo sa však v opakovanej štúdii nepotvrdilo. V tejto štúdii výskyt v skupine liečenej budezonidom, prednizolonom, triamcinolonacetonidom a v kontrolnej skupine sa výrazne neodlišoval. Poškodenie pečene (najmä hepatocelulárne neoplazmy), ktoré sa pozorovalo v prvej štúdii na karcinogenitu budezonidu, ako aj v opakovanej štúdii, sa v rovnakej miere zistilo aj pri iných glukokortikoidoch. Tieto účinky sú najpravdepodobnejšie receptorovými účinkami, preto sa vyskytujú v celej skupine.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokglycerolum 85%, ethanolum anhydricum, norfluranum (HFA/134a)
6.2. InkompatibilityNie sú známe.
6.3. Čas použiteľnosti18 mesiacov
6.4. Upozornenia na podmienky a spôsob skladovaniaNeskladovať pri teplote vyššej ako 25°C.
Nádoba je pod stálym tlakom, chrániť pred vysokými teplotami, priamym slnečným žiarením a mrazom.
6.5. Vlastnosti a zloženie obalu, veľkosť baleniaa) 1 x 1 tlaková nádoba s obsahom 11,2 ml roztoku s dávkovačom pre 200 aerosólových dávok/aplikácií (1 aerosólová dávka je 56 mg),
štandardný orálny aplikátor,
písomná informácia pre používateľa, papierová skladačka
b) 1 x 1 tlaková nádoba s obsahom 11,2 ml roztoku s dávkovačom pre 200 aerosólových dávok/aplikácií (1 aerosólová dávka je 56 mg),
špeciálny orálny aplikátor JetSpacer® písomná informácia pre používateľa, papierová skladačka
6.6. Upozornenia na spôsob zaobchádzania s liekom Nestriekajte pri otvorenom ohni ani nad rozžeravenými objektmi! Tlakovú nádobu neotvárajte nasilu a ani nevhadzujte do ohňa! Liek uschovávajte mimo dosahu detí !
7. Držiteľ rozhodnutia o registrácii
CHIESI Farmaceutici SpA
Via Palermo 26/A, 43100 Parma
Taliansko
8. Registračné číslo
9. Dátum registrácie/Predĺženie registrácie
10. Dátum poslednej revízie textu
apríl 2004