
eku, odoberte ochranné viečko
jemnýmstlačením šípok označených po stranách a potiahnutím smerom von (pozri obrázok 1).
 OBRÁZOK 1
OBRÁZOK 1• Skontrolujte, že nič neblokuje náustok.
• Inhalátor Genuair držte vo
vodorovnej polohe tak, že náustok smeruje k vám a zelené tlačidlo
smerom
nahor (pozri obrázok 2).
Držte zelené tlačidlo smerom nahor. NENAKLÁŇAJTE.
O
BR
Á
ZOK 2
K
R
O
K 1: STLAČTEa UVOĽNITEzelené tlačidlo a úplne vydýchnite mimo inhalátora.
• Skôr ako si vložíte inhalátor do úst, stlačte zelené tlačidlo celkom dolu (pozri obrázok 3), a
potom ho UVOĽNITE(pozri obrázok 4).
NENECHAJTE ZELENÉ TLAČIDLO STLAČENÉ.
STLAČTE
zelené tlačidlo
celkom dolu
UVOĽNITEzelené tlačidlo

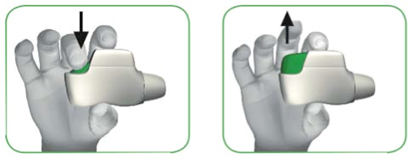 O
BR
Á
ZOK 3 OBRÁZOK 4
Z
astavenie a kontrola: Uistite sa, že je dávka pripravená na inhaláciu
O
BR
Á
ZOK 3 OBRÁZOK 4
Z
astavenie a kontrola: Uistite sa, že je dávka pripravená na inhaláciu
• Uistite sa, že farebné kontrolné okienko zmenilo farbu
na zelenú (pozri obrázok 5).
• Zelené kontrolné okienko potvrdzuje, že je liek pripravený na inhaláciu.
Pripravené na použitieZELENÉOBRÁZOK 5
A
K ZOSTANE FAREBNÉ KONTROLNÉ OKIENKO ČERVENÉ, ZOPAKUJTE ČINNOSTI
STLAČENIA
A UVOĽNENIA (POZRI KROK 1).
• Skôr ako si inhalátor vložíte do úst, úplne vydýchnite. Nevydychujte do inhalátora.
KROK 2: SILNO a
HLBOKOsa nadýchnite cez náustok.
• Perami pevne obopnite náustok inhalátora Genuair a
SILNOa
HLBOKOsa nadýchnite ústami
(pozri obrázok 6).
Tento silný, hlboký nádych vysaje liek cez inhalátor do vašich pľúc.
POZOR: POČAS INHALÁCIE NEDRŽTE ZELENÉ TLAČIDLO STLAČENÉ.SPRÁVNE NESPRÁVNEOBRÁZOK 6
TLAČIDLO STLAČENÉ.SPRÁVNE NESPRÁVNEOBRÁZOK 6• Pri nádychu budete počuť „
KLIKNUTIE“, ktoré signalizuje, že inhalátor Genuair používate
správne.
• Pokračujte v nádychu aj potom, ako budete počuť „KLIKNUTIE“, aby ste určite užili celú
dávku.
• Vyberte si inhalátor Genuair z úst a zadržte dych tak dlho, pokiaľ vám to nie je nepríjemné,
potom pomaly vydýchnite nosom.
Poznámka: Niektorí pacienti môžu pri inhalovaní lieku pociťovať jemnú chuť. Pokiaľ po inhalácii nič
necítite, neužite ďalšiu (dodatočnú) dávku.
Z
astavenie a kontrola: Uistite sa, že ste inhalovali správne
• Uistite sa, že farebné kontrolné okienko zmenilo farbu na
červenú (pozri obrázok 7).
To potvrdzuje, že ste správne inhalovali celú dávku.
Správna inhaláciaČERVENÉOBRÁZOK 7AK ZOSTANE FAREBNÉ KONTROLNÉ OKIENKO ZELENÉ, ZOPAKUJTE SILNÚA HLBOKÚ INHALÁCIU CEZ NÁUSTOK (POZRI KROK 2).• Ak sa okienko aj naďalej nemení na
červené, možno ste pred inhaláciou zabudli uvoľniť zelené tlačidlo alebo možno ste neinhalovali správne. Ak k tomu dôjde, skúste to znova.
Uistite sa, že ste UVOĽNILI zelené tlačidlo, a SILNO a hlboko sa nadýchnite cez náustok.Poznámka: Ak ani po niekoľkých pokusoch nedokážete správne inhalovať, obráťte sa na svojho
lekára.
• Keď okienko zmení farbu na červenú, nasaďte ochranné viečko tak, že ho zatlačíte späť na
náustok (pozri obrázok 8).
 OBRÁZOK 8Kedy je potrebné si zaobstarať nový inhalátor Genuair?
OBRÁZOK 8Kedy je potrebné si zaobstarať nový inhalátor Genuair?• Inhalátor Genuair je vybavený
indikátorom dávok, ktorý vám ukazuje, koľko dávok približne zostáva v inhalátore. Indikátor dávok pomaly klesá, zobrazujúc
intervaly po 10 (60, 50, 40, 30,
20, 10, 0) (pozri obrázok A). Každý inhalátor Genuair obsahuje aspoň 60 dávok.
• Keď sa v indikátore dávok objaví
červená pásikavá plocha (pozri obrázok A), znamená to, že
sa blížite k svojej poslednej dávke a mali by ste si zaobstarať nový inhalátor Genuair.
Indikátor dávok klesá v intervaloch po 10: 60, 50, 40, 30, 20, 10, 0.Červená pásikaváplochaIndikátor dávokOBRÁZOK A
po 10: 60, 50, 40, 30, 20, 10, 0.Červená pásikaváplochaIndikátor dávokOBRÁZOK APoznámka: Ak sa vám zdá, že je váš inhalátor Genuair poškodený, alebo ak stratíte ochranné viečko,
inhalátor máte vymeniť. Inhalátor Genuair NEMUSÍTE čistiť. Ak to však chcete urobiť, utrite vonkajšiu časť náustku suchou papierovou vreckovkou alebo papierovou utierkou. Na čistenie inhalátora Genuair NIKDY nepoužívajte vodu, pretože by to mohlo poškodiť váš liek.
A
ko viete, že je inhalátor Genuair prázdny?
• Keď sa v strednej časti indikátora dávok objaví 0 (nula), zostávajúce dávky v inhalátore
Genuair máte doužívať.
• Keď sa na inhaláciu pripraví posledná dávka, zelené tlačidlo sa nevráti do svojej hornej polohy, ale zostane zablokované v strednej polohe (pozri obrázok B). Aj keď je zelené tlačidlo zablokované, môžete inhalovať svoju poslednú dávku. Potom sa inhalátor Genuair viac nedá použiť a máte začať používať nový inhalátor Genuair.
ZablokovanéOBRÁZOK B4.3 KontraindikáciePrecitlivenosť na aklidíniumbromid, atropín alebo jeho deriváty, vrátane ipratropia, oxitropia alebo
tiotropia, alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníAstma:Bretaris Genuair sa nemá používať pri astme; klinické skúšania s aklidíniumbromidom na astmu nie sú vykonané.
Paradoxný bronchospazmus:Tak ako iné inhalačné liečby, aj podanie Bretaris Genuairu môže spôsobiť paradoxný bronchospazmus. Ak k tomu dôjde, liečba Bretaris Genuairom sa má ukončiť a majú sa zvážiť iné liečby.
Zhoršenie ochorenia:Aklidíniumbromid je udržiavací bronchodilatátor a nemá sa používať na zmiernenie akútnych záchvatov bronchospazmu, t.j. ako záchranná liečba. V prípade zmeny intenzity CHOCHP počas toho, ako sa pacient lieči aklidíniumbromidom, teda pacient zvažuje potrebu doplnkovej záchrannej liečby, sa má vykonať opätovné vyhodnotenie stavu pacienta a režimu liečby pacienta.
Účinkynakardiovaskulárnysystém:Profil bezpečnosti u kardiovaskulárneho systému je charakterizovaný anticholinergickými účinkami. Bretaris Genuair by sa mal používať s opatrnosťou u pacientov s infarktom myokardu počas predchádzajúcich 6 mesiacov, nestabilnou angínou pektoris, nedávno diagnostikovanou arytmiou počas predchádzajúcich 3 mesiacov alebo s hospitalizáciou počas predchádzajúcich 12 mesiacov z dôvodu srdcového zlyhania triedy III a IV podľa Newyorskej srdcovej spoločnosti. Takýto pacienti boli z klinických skúšaní vylúčení a tieto stavy môžu byť ovplyvnené anticholinergickým mechanizmom účinku.
Anticholinergická aktivita:Sucho v ústach, ktoré sa pozorovalo pri anticholinergickej liečbe, sa môže z dlhodobého hľadiska
spájať so vznikom zubného kazu.
V súlade s jeho anticholinergickou aktivitou sa má aklidíniumbromid používať s opatrnosťou u pacientov so symptomatickou hyperpláziou prostaty alebo obštrukciou hrdla močového mechúra alebo glaukómom s ostrým uhlom (aj keď je priamy kontakt lieku s očami veľmi nepravdepodobný).
Pomocné látky:
Pacienti so zriedkavými dedičnými problémami intolerancie galaktózy, lapónskym deficitom laktázy alebo malabsorpciou glukózy-galaktózy by tento liek nemali používať.
4.5 Liekové a iné interakcie
Súbežné podávanie aklidíniumbromidu s inými liekmi obsahujúcimi anticholinergiká sa neskúmalo a
neodporúča sa.
Hoci sa nevykonali žiadne formálne štúdie interakcií lieku in vivo, inhalovaný aklidíniumbromid sa používal súbežne s inými liekmi na CHOCHP vrátane sympatomimetických bronchodilatátorov, metylxantínov a perorálnych a inhalačných steroidov bez klinického záznamu liekových interakcií.
Štúdie in vitro ukázali, že sa nepredpokladá, že aklidíniumbromid alebo metabolity aklidíniumbromidu v terapeutickej dávke spôsobujú interakcie s liekmi substrátov P-glykoproteínu (P-gp) alebo liekmi metabolizovanými enzýmami cytochrómu P450 (CYP450) a esterázami (pozri časť 5.2).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití aklidíniumbromidu u gravidných žien.
Štúdie na zvieratách preukázali fetotoxicitu iba pri hladinách dávok oveľa vyšších ako sú maximálne
expozície aklidíniumbromidu u ľudí (pozri časť 5.3). Aklidíniumbromid sa má používať počas gravidity iba vtedy, ak očakávaný prospech preváži potenciálne riziká.
Laktácia
Nie je známe, či sa aklidíniumbromid a/alebo jeho metabolity vylučujú do ľudského mlieka. Keďže štúdie na zvieratách preukázali vylučovanie malých množstiev aklidíniumbromidu a/alebo
metabolitov do mlieka, rozhodnutie, či ukončiť dojčenie alebo či ukončiť liečbu aklidíniumbromidom, sa musí urobiť po zohľadnení prospechu dojčenia pre dieťa a prospechu dlhodobej liečby aklidíniumbromidom pre ženu.
Fertilita
Štúdie na potkanoch preukázali mierne zníženú fertilitu iba pri hladinách dávok oveľa vyšších ako sú maximálne expozície aklidíniumbromidu u ľudí (pozri časť 5.3). Nepovažuje sa za pravdepodobné, že aklidíniumbromid podávaný v odporúčanej dávke ovplyvní fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Aklidíniumbromid nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Výskyt bolesti hlavy alebo rozmazané videnie môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi reakciami Bretaris Genuairu boli bolesť hlavy (6,6%)
a nazofaryngitída (5,5%).
T
abuľkový
súhrn
nežiaducich
reakcií
Frekvencie priradené nežiaducim účinkom uvedeným nižšie sa zakladajú na odhadovaných pomeroch incidencie nežiaducich reakcií (t.j. prípadov prisúdených Bretaris Genuairu) pozorovanej pri Bretaris Genuaire 322 µg (636 pacientov) v súhrnnej analýze jednej šesťmesačnej a dvoch trojmesačných randomizovaných, placebom kontrolovaných klinických skúšaní.
Frekvencia nežiaducich reakcií je definovaná podľa nasledovnej konvencie: veľmi časté (≥1/10);
časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi
zriedkavé (<1/10 000) a neznáme (z dostupných údajov).
Trieda orgánového systému
| Preferovaný termín
| Frekvencia
|
Infekcie a nákazy
| Sinusitída
| Časté
|
Nazofaryngitída
| Časté
|
Poruchy nervového systému
| Bolesť hlavy
| Časté
|
Poruchy oka
| Rozmazané videnie
| Menej časté
|
Poruchy srdca a srdcovej činnosti
| Tachykardia
| Menej časté
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Kašeľ
| Časté
|
Dysfónia
| Menej časté
|
Poruchy gastrointestinálneho traktu
| Hnačka
| Časté
|
Sucho v ústach
| Menej časté
|
Poruchy obličiek a močových ciest
| Zadržiavanie moču
| Menej časté
|
4.9 PredávkovanieVysoké dávky aklidíniumbromidu môžu viesť k anticholinergickým znakom a symptómom. Jednorazové inhalované dávky do 6 000 µg aklidíniumbromidu však boli podané zdravým jedincom bez systémových anticholinergických nežiaducich účinkov. Okrem toho sa u zdravých jedincov nepozorovali žiadne klinicky významné nežiaduce účinky po dávke až do 800 µg aklidíniumbromidu podávanej dvakrát denne počas 7 dní.
Akútna intoxikácia neúmyselným požitím lieku s aklidíniumbromidom je nepravdepodobná z dôvodu jeho nízkej perorálnej biologickej dostupnosti a dávkovaciemu mechanizmu inhalátora Genuair, ktorý sa spúšťa dychom.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Anticholinergiká; ATC kód : R03BB05.
Aklidíniumbromid je kompetitívny, selektívny antagonista muskarínových receptorov (tiež známy ako anticholinergikum) s dlhším rezidenčným časom na receptoroch M3 než na receptoroch M2 .
Receptory M3 sprostredkovávajú kontrakciu hladkého svalstva dýchacích ciest. Inhalovaný
aklidíniumbromid pôsobí lokálne v pľúcach tým, že antagonizuje receptory M3 hladkého svalstva
dýchacích ciest a indukuje bronchodilatáciu. Predklinické štúdie
in vitro a
in vivo preukázali rýchlu,
od dávky závislú a dlhotrvajúcu inhibíciu acetylcholínom indukovanej bronchokonstrikcie spôsobenú aklidíniom. Aklidíniumbromid sa rýchle rozkladá v plazme, preto je úroveň systémových anticholinergických vedľajších účinkov nízka.
Farmakodynamické
účinky
Štúdie klinickej účinnosti preukázali, že Bretaris Genuair poskytol klinicky významné zlepšenia funkcie pľúc (merané ako úsilný výdych za 1 sekundu [FEV1 ]) počas 12 hodín po rannom a večernom podaní, ktoré boli evidentné do 30 minút od prvej dávky (so zvýšením o 124-133 ml oproti východiskovej hodnote). Maximálna bronchodilatácia sa dosiahla do 1-3 hodín po podaní dávky
s priemernými maximálnymi zlepšeniami v FEV1 v rovnovážnom stave 227-268 ml v porovnaní s východiskovými hodnotami.
Elektrofyziológia srdcaNepozorovali sa žiadne účinky na interval QT (upravené použitím Fridericiovej alebo Bazettovej metódy alebo individuálne upravené), ak sa aklidíniumbromid (200 µg alebo 800 µg) podával raz denne počas 3 dní zdravým jedincom v podrobnej štúdii QT.
Okrem toho sa nepozorovali žiadne klinicky významné účinky Bretaris Genuairu na srdcový rytmus pri 24-hodinovom monitorovaní Holterom po 3 mesiacoch liečby u 336 pacientov (z ktorých
164 užívalo Bretaris Genuair 322 µg dvakrát denne).
KlinickáúčinnosťFáza III programu klinického vývoja Bretaris Genuairu zahŕňala 269 pacientov liečených Bretaris Genuairom 322 µg dvakrát denne v jednej šesťmesačnej randomizovanej, placebom kontrolovanej štúdii a 190 pacientov liečených Bretaris Genuairom 322 µg dvakrát denne v jednej trojmesačnej randomizovanej, placebom kontrolovanej štúdii. Účinnosť sa hodnotila mierou funkcie pľúc a symptomatických výsledkov, ako je dýchavičnosť, zdravotný stav špecifický pre ochorenie, používanie záchrannej liečby a výskyt exacerbácií. V dlhodobých štúdiách bezpečnosti sa Bretaris Genuair spájal s bronchodilatačnou účinnosťou pri podávaní v rámci liečby presahujúcej obdobie
1 roku.
BronchodilatáciaV 6-mesačnej štúdii dosiahli pacienti užívajúci Bretaris Genuair 322 µg dvakrát denne klinicky významné zlepšenie funkcie ich pľúc (merané ako FEV1 ). Maximálne bronchodilatačné účinky boli zjavné od prvého dňa a zachovali sa počas 6-mesačného obdobia liečby. Po 6 mesiacoch liečby
bolo priemerné zlepšenie ranného FEV1 pred dávkou (minimálny) v porovnaní s placebom 128 ml
(95 % CI=85-170; p<0,0001).
Podobné pozorovania sa po Bretaris Genuaire získali v 3-mesačnej štúdii.
Zdravotný stav špecifický pre ochorenie a zlepšenia symptómovBretaris Genuair poskytol klinicky významné zlepšenia v dýchavičnosti (hodnotené pomocou indexu prechodného dyspnoe [Transition Dyspnoea Index; TDI]) a zdravotného stavu špecifického pre ochorenie (hodnotené pomocou respiračného dotazníka Nemocnice Sv. Juraja v Londýne [St.
George’s Respiratory Questionnaire; SGRQ]). Tabuľka nižšie ukazuje zmiernenie symptómov získané po 6 mesiacoch liečby Bretaris Genuairom.
Premenná
| Liečba
| Zlepšenie oproti placebu
|
Hodnota p
|
Bretaris Genuair
| Placebo
|
TDI
|
Percento pacientov, ktorí dosiahli MCIDa
|
56,9
|
45,5
| 1,68-násobnýc nárast'
pravdepodobnosti
|
0,004
|
Priemerná zmena oproti východiskovej hodnote
|
1,9
|
0,9
|
1,0 jednotka
|
< 0,001
|
SGRQ
|
Percento pacientov, ktorí dosiahli MCIDb
|
57,3
|
41,0
| 1,87-násobnýc nárast
pravdepodobnosti
|
< 0,001
|
Priemerná zmena oproti východiskovej hodnote
|
-7,4
|
-2,8
|
- 4,6 jednotky
|
< 0,0001
|
a Minimálny klinicky významný rozdiel (Minimum clinically important difference, MCID) zmeny
aspoň 1 jednotky v TDI.

b MCID zmeny aspoň - 4 jednotiek v SGRQ.
c Pomer pravdepodobností, nárast pravdepodobnosti dosiahnutia MCID v porovnaní s placebom.
Pacienti liečení Bretaris Genuairom si vyžadovali menej záchranného lieku ako pacienti liečení
placebom (zníženie o 0,95 vdychov denne počas 6 mesiacov [p=0,005]). Bretaris Genuair zlepšil aj
denné symptómy CHOCHP (dyspnoe, kašeľ a produkcia hlienu) a symptómy počas noci a skoro ráno.
Súhrnná analýza účinnosti 6-mesačných a 3-mesačných placebom kontrolovaných štúdií preukázala štatisticky významné zníženie miery stredných až silných exacerbácií (vyžadujúcich si liečbu antibiotikami alebo kortikosteroidmi alebo hospitalizáciu) s aklidíniom 322 µg v porovnaní s placebom (pomer na pacienta za rok: 0,31 verzus 0,44; p=0,0149).
Deti a dospievajúciEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdii pre Bretaris Genuair vo všetkých vekových podskupinách detí a dospievajúcich pre CHOCHP (pre informácie o použití u detí a dospievajúcich, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaAklidíniumbromid sa v pľúcach rýchlo absorbuje, čím sa maximálna koncentrácia v plazme dosahuje do 5 minút od inhalácie u zdravých jedincov a obvykle do prvých 15 minút u pacientov s CHOCHP. Frakcia inhalovanej dávky, ktorá sa dostane do systémového obehu ako nezmenené aklidínium, je veľmi nízka, menej ako 5 %.
Dosiahnuté maximálne koncentrácie v plazme po inhalácii jednorazových dávok 400 µg
aklidíniumbromidu suchého prášku pacientmi s CHOCHP boli približne 80 pg/ml. Rovnovážne hladiny v plazme sa dosiahli do siedmich dní podávania dávok dvakrát denne a vzhľadom na krátky polčas, možno rovnovážny stav dosiahnuť čoskoro po prvej dávke. Pri opakovanom podávaní sa v rovnovážnom stave nepozorovala kumulácia.
DistribúciaCelková depozícia inhalovaného aklidíniumbromidu pomocou inhalátora Genuair pľúcami bola v priemere približne 30 % odmeranej dávky.
Väzba aklidíniumbromidu na plazmatické proteíny stanovená
in vitro najpravdepodobnejšie
korešpondovala s väzbou metabolitov na proteíny z dôvodu rýchlej hydrolýzy aklidíniumbromidu
v plazme; väzba na plazmatické proteíny bola 87 % pre metabolit kyseliny karboxylovej a 15 % pre metabolit alkoholu. Hlavný plazmový proteín, ktorý viaže aklidíniumbromid, je albumín.
BiotransformáciaAklidíniumbromid sa rýchlo a v rozsiahlej miere hydrolyzuje na svoje farmakologicky neaktívne deriváty alkoholu a kyseliny karboxylovej. K hydrolýze dochádza chemicky (neenzymaticky) aj enzymaticky esterázami. Hlavnou esterázou u ľudí, ktorá sa zapája do hydrolýzy, je butyrylcholínesteráza. Hladiny metabolitu kyseliny v plazme sú približne 100-násobne vyššie ako hladiny metabolitu alkoholu a nezmeneného liečiva po inhalácii.
Nízka absolútna biologická dostupnosť inhalovaného aklidíniumbromidu (<5%) je z dôvodu, že
aklidíniumbromid podstupuje rozsiahlu systémovú alebo pre systémovú hydrolýzu, či už je prijatý do
pľúc, alebo prehltnutý.
Biotransformácia prostredníctvom enzýmov CYP450 zohráva malú úlohu pri celkovom metabolickom klírense aklidíniumbromidu.
Štúdie
in vitro preukázali, že aklidíniumbromid v terapeutickej dávke alebo jeho metabolity neinhibujú ani neindukujú žiadny z enzýmov cytochrómu P450 (CYP450) a neinhibujú esterázy
(karboxylesteráza, acetylcholínesteráza a butyrylcholínesteráza). Štúdie in vitro preukázali, že aklidíniumbromid alebo metabolity aklidíniumbromidu nie sú substráty ani inhibítory
P-glykoproteínu.
Eliminácia
Konečný polčas vylučovania aklidíniumbromidu sú približne 2 až 3 hodiny.
Po intravenóznom podaní 400 µg rádioznačeného aklidíniumbromidu zdravým jedincom sa približne
1 % dávky vylúčilo ako nezmenený aklidíniumbromid v moči. Až 65 % dávky sa vylúčilo ako metabolity v moči a až 33 % ako metabolity v stolici.
Po inhalácii 200 µg a 400 µg aklidíniumbromidu zdravými jedincami alebo pacientmi s CHOCHP bolo vylučovanie nezmeneného aklidínia močom veľmi nízke, okolo 0,1 % podanej dávky, čo naznačuje, že renálny klírens zohráva malú úlohu pri celkovom klírense aklidínia z plazmy.
Linearita/nelinearita
V terapeutickom rozsahu vykázal aklidíniumbromid kinetickú linearitu a farmakokinetiku nezávislú od času.
Farmakokinetický/farmakodynamickývzťah
Keďže aklidíniumbromid účinkuje lokálne v pľúcach a rýchlo sa rozkladá v plazme, neexistuje priamy vzťah medzi farmakokinetikou a farmakodynamikou.
Osobitné skupiny pacientov
Starší pacienti
Farmakokinetické vlastnosti aklidíniumbromidu u pacientov so strednou ťažkou až ťažkou CHOCHP sa zdajú byť podobné, ako sú u pacientov vo veku 40-59 rokov a u pacientov vo veku ≥ 70 rokov. Preto sa u starších pacientov s CHOCHP nevyžaduje žiadna úprava dávky.
Pacienti s poškodením funkcie pečene
S pacientmi s poškodením funkcie pečene sa nevykonali žiadne štúdie. Keďže sa aklidíniumbromid metabolizuje hlavne chemickým a enzymatickým štiepením v plazme, je veľmi nepravdepodobné, že dysfunkcia pečene môže zmeniť jeho systémovú expozíciu. U pacientov s CHOCHP a s poškodením funkcie pečene sa nevyžaduje žiadna úprava dávky.
Pacienti s poškodením funkcie obličiek
Nepozorovali sa žiadne významné farmakokinetické rozdiely medzi jedincami s normálnou funkciou obličiek a jedincami s poškodením funkcie obličiek. Preto sa u pacientov s CHOCHP a s poškodením funkcie obličiek nevyžaduje úprava dávky ani dodatočné monitorovanie.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Účinky v predklinických štúdiách vo vzťahu k srdcovocievnym parametrom (zvýšená srdcová frekvencia u psov), reprodukčnej toxicite (účinky na fetotoxicitu) a fertilite (mierny pokles v miere počatí, počte žltých teliesok a pre- a postimplantačné straty) sa pozorovali iba pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
Nízka toxicita pozorovaná v predklinických štúdiách toxicity je čiastočne spôsobená rýchlym metabolizmom aklidíniumbromidu v plazme a nedostatkom významnej farmakologickej aktivity hlavných metabolitov. Tolerancia bezpečnosti pre systémovú expozíciu u ľudí pri 400 µg dvakrát
denne je v týchto štúdiách nad hladinami, pri ktorých sa nepozorovali žiadne nežiaduce účinky v rozsahu od 17- do 187-násobku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát laktózy.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
Musí sa použiť do 90 dní od otvorenia vrecka.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Inhalátor Genuair uchovávajte chránený vo vnútri zapečateného vrecka, kým nenastane čas na začatie
podávania.
6.5 Druh obalu a obsah balenia
Inhalačné zariadenie je viaczložkové zariadenie vyrobené z polykarbonátu,
akrylonitryl-butadién-styrénu, polyoxymetylénu, polyester-butylén-tereftalátu, polypropylénu, polystyrénu a nehrdzavejúcej ocele. Je bielej farby a jeho súčasťou je indikátor dávok a zelené tlačidlo dávkovania. Náustok je pokrytý odoberateľným zeleným ochranným viečkom. Inhalátor sa dodáva zapečatený v ochrannom hliníkovom laminátovom vrecku uloženom v papierovej škatuľke.
Škatuľka obsahujúca 1 inhalátor s 30 jednotlivými dávkami. Škatuľka obsahujúca 1 inhalátor so 60 jednotlivými dávkami.
Škatuľka obsahujúca 3 inhalátory, každý z nich so 60 jednotlivými dávkami.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne. Pokyny na použitie, prosím, pozri časť 4.2.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Almirall, S.A.
Ronda General Mitre, 151
E-08022 Barcelona
Španielsko
Tel. +34 93 291 30 00
Fax +34 93 291 31 80
8. REGISTRAČNÉ ČÍSLO
EU/1/12/781/001
EU/1/12/781/002
EU/1/12/781/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20.júla 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu