/tr>
1.25 Units
| 4 ml
| 8 ml
| -
|
Tento liek je určený len na jednorazové použitie a nepoužitý roztok musí byť zlikvidovaný.
Pre špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom, pozri časť 6.6.
Starší pacientiCelkovo, s výnimkou hyperaktívneho močového mechúra, príslušné štúdie na dávkovanie pre starších pacientov neboli vykonané. Odporúča sa najnižšia účinná dávka s najdlhším klinicky indikovaným intervalom medzi aplikáciami. Starší pacienti, ktorí majú významné zdravotné problémy v anamnéze a ktorí súčasne užívajú iné lieky, majú byť liečení s opatrnosťou (pre hyperaktívny močový mechúr pozri časti 4.8 a 5.1).
O použití lieku BOTOX 50 na liečbu glabelárnych vrások u pacientov starších ako 65 rokov sú k dispozícii len obmedzené údaje z klinických štúdií fázy 3 (pozri časť 5.1).
Klinické údaje z fázy 3 pre BOTOX v indikácii vrások v tvare stopy vrany u pacientov starších ako 65 rokov sú obmedzené (pozri časť 5.1).
Pediatrická populáciaBezpečnosť a účinnosť lieku BOTOX pri liečbe blefarospazmu, hemifaciálneho spazmu alebo cervikálnej dystónie u detí (do 12 rokov) nebola stanovená. Nie sú dostupné údaje.
Bezpečnosť a účinnosť lieku BOTOX pri liečbe primárnej hyperhidrózy axíl nebola u mladistvých do 12 rokov skúšaná. Bezpečnosť a účinnosť lieku BOTOX pri liečbe primárnej hyperhigrózy axíl u detí vo veku 12 až 17 rokov nebola zatiaľ stanovená. Údaje, ktoré sú v súčasnosti dostupné, sú popísané v častiach 4.8 a 5.1, ale na ich základe nie je možné odporučiť dávkovanie. Pozri časti 4.8 a 5.1.
Bezpečnosť a účinnosť lieku BOTOX pri liečbe vertikálnych vrások medzi obočím (známych ako glabelárne vrásky) pozorovaných pri maximálnom mračení sa alebo vrások v tvare stopy vrany, pozorovaných pri maximálnom úsmeve, nebola u jednotlivcoch do 18 rokov preukázaná. U osôb mladších ako 18 rokov sa použitie lieku BOTOX neodporúča (pozri časť 4.4).
Bezpečnosť a účinnosť lieku BOTOX pri liečbe hyperaktívneho močového mechúra alebo urinárnej inkontinencie spôsobenej neurogénnou hyperaktivitou detruzora u detí a dospievajúcich (mladších ako 18 rokov) nebola stanovená. Nie sú dostupné údaje.
Bezpečnosť a účinnosť lieku BOTOX pri liečbe spasticity hornej končatiny vplyvom cievnej mozgovej príhody u detí a mladistvých (mladších ako 18 rokov) nebola stanovená. Nie sú dostupné údaje.
Bezpečnosť a účinnosť lieku BOTOX pri prevencii chronickej migrény u detí a mladistvých (mladších ako 18 rokov) nebola stanovená. Nie sú dostupné údaje.
Spôsob podávaniaKonkrétne odporúčania pre každú indikáciu sú popísané dole.
BOTOX má podávať len lekár s príslušnou kvalifikáciou, doloženou odbornou znalosťou liečby a s použitím požadovaného vybavenia.
Všeobecne platná optimálna dávka a počet injekčných miest vo svale nebola pevne stanovená pre všetky indikácie. V týchto prípadoch by mal preto lekár zostaviť individuálny liečebný program. Optimálna veľkosť dávky by mala byť stanovená titráciou, ale maximálna odporúčaná dávka nesmie byť prekročená.
Blefarospazmus / hemifaciálny spazmus
Rekonštituovaný BOTOX sa aplikuje sterilnou ihlou veľkosti 27-30 G/0,40-0,30 mm. Elektromyografická kontrola nie je nutná. Úvodná odporučená dávka je 1,25 - 2,5 jednotiek podávaná do m. orbicularis oculi na hornej mihalnici mediálne a laterálne, na dolnej mihalnici len laterálne. Môže sa aplikovať tiež do iných miest, najmä ak spazmy ovplyvňujú vízus – do obočia, do hornej časti tváre alebo do m. orbicularis lateralis. Pokiaľ sa vyhneme injekcii do blízkosti m. levator palpebrae superioris, môžu byť komplikácie ptózy obmedzené. Pokiaľ sa vyhneme injekcii do mediálnej časti dolného viečka a tým zníženiu difúzie do m. inferior obliqus, obmedzíme komplikácie diplopie. Nasledujúce obrázky ukazujú možné injekčné miesta:
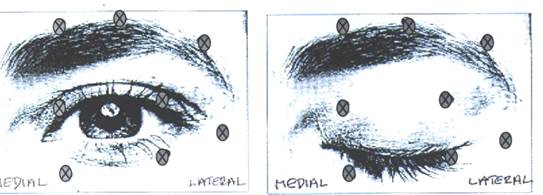
Efekt býva viditeľný behom 3 dní, maximum dosahuje za 1–2 týždne po aplikácii. Účinok každej aplikácie trvá asi 3 mesiace, potom je možné liečbu opakovať.
Pokiaľ je odpoveď na úvodnú liečbu nedostatočná, môže byť pri opakovanom sedení zvýšená až na dvojnásobok. Avšak, zvyšovanie dávky nad 5,0 jednotiek do každého aplikačného miesta sa javí ako málo prínosné. Úvodná dávka by nemala prekročiť 25 jednotiek na každé oko. Častejšia aplikácia ako 1-krát za 3 mesiace obyčajne neprináša zvýšenie účinnosti liečby. Celková dávka pri liečbe blefarospazmu by nemala prekročiť 100 jednotiek za 12 týždňov.
Pacienti s hemifaciálnym spazmom alebo poruchami inervácie n. VII, majú byť liečení ako pri unilaterálnom blefarospazme, podľa potreby sa injekcie aplikujú do postihnutých tvárových svalov.
Cervikálna dystóniaRekonštituovaný roztok lieku BOTOX sa aplikuje ihlou primeranej veľkosti (obvykle 25-30 G/0,50-0,30 mm).
Liečba cervikálnej dystónie v klinických štúdiách väčšinou zahŕňala injekcie lieku BOTOX do
m. sternocleidomastoideus, levator scapulae, scalenae, splenius capitis, semispinalis, longissimus a/alebo trapezius. Tento zoznam nie je úplný a nezahŕňa všetky svaly zodpovedné za polohu hlavy, ktoré môže byť potrebné liečiť.
Pri výbere vhodnej dávky je treba zohľadniť veľkosť svalovej hmoty a stupeň hypertrofie alebo atrofie. Vzorce svalovej aktivity u cervikálnej dystónie sa môžu samovoľne zmeniť bez zmien v klinických prejavoch dystónie.
Ak nastanú ťažkosti v lokalizácii jednotlivých svalov, je treba aplikovať BOTOX pod elektromyografickou kontrolou. V úvodných kontrolovaných klinických štúdiách k stanoveniu bezpečnosti a účinnosti pri cervikálnej dystónii boli dávky rekonštituovaného lieku BOTOX 50 Allergan Units v rozmedzí od 140 do 280 jednotiek. V novších štúdiách sa dávky pohybovali od 95 do 360 jednotiek (s približným priemerom 240 jednotiek). Úvodná dávka u nových pacientov, rovnako ako u inej liečby, sa má zahájiť najnižšou účinnou dávkou. Do žiadneho miesta by nemalo byť aplikované viac ako 50 jednotiek. Do m. sternocleidomastoideus by nemalo byť aplikované viac ako 100 jednotiek. Na zníženie incidencie dysfágie sa nesmie injikovať do m. sternocleidomastoideus obojstranne. Pri prvej aplikácii sa nesmie injikovať viac ako 200 jednotiek, ďalšie úpravy dávkovania nasledujú pri ďalších aplikáciách podľa odpovedi na prvú aplikáciu. Nikdy by nemala byť prekročená celková dávka 300 jednotiek pri jednej aplikácii. Optimálny počet injekčných miest závisí na veľkosti svalu.
Klinické zlepšenie všeobecne nastáva v priebehu prvých dvoch týždňov po aplikácii. Maximálny efekt zvyčajne nastane za 6 týždňov po aplikácii. Kratší interval liečby ako 10 týždňov sa neodporúča.
V klinických štúdiách sa ukázala značná variabilita v dĺžke účinku po aplikácii (od 2 do 33 týždňov), s priemernou dobou 12 týždňov.
Detská mozgová obrna
Rekonštituovaný roztok lieku BOTOX sa aplikuje sterilnou ihlou 23 – 26G/0,60-0,45 mm. Aplikuje sa na obe strany do mediálnej a laterálnej hlavy postihnutého m. gastrocnemius. Pri hemiplégii je úvodná odporúčaná celková dávka do postihnutej končatiny 4 jednotky/kg hmotnosti. Pri diplégii je úvodná odporúčaná celková dávka 6 jednotiek/kg hmotnosti rozdelená medzi postihnuté končatiny. Celková dávka nemá prekročiť 200 jednotiek.
Klinické zlepšenie všeobecne nastáva počas prvých dvoch týždňov po aplikácii. Aplikácia sa má opakovať, ak predchádzajúci liečebný účinok poklesne, ale nie častejšie ako raz za 3 mesiace. Dávkovací režim je možné prispôsobiť tak, aby medzi jednotlivými sedeniami bol interval minimálne 6 mesiacov.
Fokálna spasticita hornej končatiny vyvolaná cievnou mozgovou príhodou
Rekonštituovaný roztok lieku BOTOX je aplikovaný do povrchových svalov ihlou 25, 27 alebo 30 G a dlhou ihlou do hlbších svalov. K lokalizácii postihnutých svalov môže byť vhodné použiť elektromyografickú kontrolu alebo techniku nervovej stimulácie. Podanie injekcií lieku BOTOX do viacerých miest umožní rovnomerný kontakt s inervačnou oblasťou svalu a je obzvlášť užitočné u veľkých svalov.
Veľkosť dávky a počet injekčných miest by mal byť individuálne prispôsobený na základe veľkosti, počtu a lokalizácie postihnutých svalov, stupňu spasticity, prítomnosti lokálnej svalovej slabosti a reakcie pacienta na predchádzajúcu liečbu.
V kontrolovaných klinických štúdiách boli použité nasledovné dávky:
Sval
| Celková dávkovanie, počet miest aplikácie
|
Flexor digitorum profundus
| 15-50 jednotiek, 1-2 miesta
|
Flexor digitorum sublimis
| 15-50 jednotiek, 1-2 miesta
|
Flexor carpi radialis
| 15-60 jednotiek, 1-2 miesta
|
Flexor carpi ulnaris
| 10-50 jednotiek, 1-2 miesta
|
Adductor pollicis
| 20 jednotiek, 1-2 miesta
|
Flexor pollicis longus
| 20 jednotiek, 1-2 miesta
|
V kontrolovaných i otvorených nekontrolovaných klinických štúdiách sa používali v priebehu sedenia dávky medzi 200 až 240 jednotiek, ktoré boli rozdelené medzi vybrané svaly.
V kontrolovaných klinických štúdiách boli pacienti po jednorazovej liečbe sledovaní po dobu 12 týždňov. Zlepšenie svalového napätia nastalo behom 2 týždňov s maximálnym účinkom obvykle viditeľným behom 4-6 týždňov. V otvorených nekontrolovaných pokračujúcich štúdiách dostala väčšina pacientov ďalšiu injekciu vo chvíli, kedy účinok na svalový tonus klesal, čo nastalo v intervale 12-16 týždňov. Títo pacienti dostali až 4 injekcie s maximálnou celkovou dávkou až 960 jednotiek behom 54 týždňov. Ak ošetrujúci lekár uzná za vhodné, opakované dávky môžu byť podané, len čo sa účinok predchádzajúcej injekcie znižuje. Ďalšia injekcia by nemala byť podaná skôr než za 12 týždňov. Stupeň a charakter svalovej spasticity v dobe podania opakovanej injekcie môže viesť k zmene dávky lieku BOTOX a svalov, kam je dávka podaná. Je potrebné použiť najnižšiu účinnú dávku.
Primárna hyperhidróza axílRekonštituovaný roztok lieku BOTOX (50 jednotiek/2,0 ml; 100 jednotiek/4ml; 200 jednotiek/8ml) sa aplikuje ihlou 30G.
Do hyperhidrotickej oblasti každej axily sa podáva intradermálne 50 jednotiek lieku BOTOX rovnomerne rozložených na viaceré miesta hyperhidrotickej oblasti každej axily vzdialené približne 1-2 cm. Hyperhidrotická oblasť môže byť stanovená použitím štandardných farbiacich techník napr. Minorovým jódovo – škrobovým testom. Dávky vyššie ako 50 jednotiek na axilu neboli skúmané a preto sa neodporúčajú.
Klinické zlepšenie všeobecne nastáva počas prvého týždňa po aplikácii. Aplikácia sa má opakovať, ak klinický efekt predchádzajúcej aplikácie poklesne, a ošetrujúci lekár určí, že je nevyhnutná. Aplikácia by sa nemala opakovať častejšie ako raz za 16 týždňov (pozri časť 5.1).
Dysfunkcia močového mechúraPacienti by v čase liečby nemali trpieť infekciou močového traktu.
1 – 3 dni pred liečbou, v deň liečby a 1 – 3 dni po liečbe sa majú profylakticky podávať antibiotiká.
Odporúča sa, aby pacienti najmenej 3 dni pred injekčným postupom prerušili antiagregačnú liečbu.
Pacienti s antikoagulačnou liečbou musia byť pripravení vhodným spôsobom, aby sa znížilo riziko krvácania.
Liečba dysfunkcie močového mechúra s použitím lieku BOTOX má byť vykonaná lekárom, ktorý má skúsenosti s diagnostikou a liečbou tohto ochorenia (t.j. urológ, urogynekológ).
Hyperaktivita močového mechúraPred samotným injekčným postupom sa môže v závislosti od miestnej praxe použiť intravezikálna instilácia zriedeného anestetika so sedáciou alebo bez.Ak sa použije lokálna instilácia anestetika, močový mechúr sa musí pred ďalším krokom injekčného postupu vyprázdniť a vypláchnuť sterilným fyziologickým roztokom.
Odporúčaná dávka je 100 jednotiek lieku BOTOX vo forme injekcií s objemom 0,5 ml (5 jednotiek), ktoré sa aplikujú do 20 miest detruzora.
Rekonštituovaný BOTOX (100 jednotiek/10 ml) sa injekčne aplikuje do svalu detruzora pomocou flexibilného alebo pevného cystoskopu s výnimkou trigona.Močový mechúr musí byť naplnený dostatočným množstvom fyziologického roztoku, aby sa dosiahla adekvátna vizualizácia na aplikáciu injekcií, nadmernej distenzii sa však treba vyhnúť.
Injekčná ihla by mala byť pred začiatkom aplikácie injekcií naplnená asi 1 ml rekonštituovaného roztoku BOTOX (v závislosti od veľkosti ihly), aby sa odstránil všetok vzduch.
Ihla sa aplikuje približne 2 mm do detruzora a 20 injekcií s obsahom 0,5 ml (celkový objem 10 ml) sa rozmiestni v odstupoch približne 1 cm (pozri obrázok).Pri poslednej injekcii sa aplikuje približne 1 ml sterilného fyziologického roztoku tak, aby sa zabezpečilo podanie plnej dávky.Po aplikácii injekcií treba fyziologický roztok použitý na vizualizáciu močového mechúra z neho vypustiť.Pacienta treba najmenej 30 minút po výkone sledovať.
Ku klinickému zlepšeniu obyčajne dochádza do 2 týždňov.Opakovaná aplikácia sa zvažuje u pacientov po znížení klinického účinku predchádzajúcej injekcie (medián trvania vo fáze 3 klinických štúdií bol 166 dní [~24 týždňov]), nie však pred uplynutím 3 mesiacov od predchádzajúcej aplikácie injekcií do močového mechúra.
 Urinárna intontinencia spôsobená neurogénnou hyperaktivitou detruzora
Urinárna intontinencia spôsobená neurogénnou hyperaktivitou detruzoraPred vlastným injekčným postupom sa môže v závislosti od miestnej praxe použiť intravezikálna instilácia zriedeného anestetika so sedáciou alebo bez, prípadne celková anestéza.Ak sa použije lokálna instilácia anestetika, močový mechúr sa musí pred ďalším krokom injekčného postupu vyprázdniť a vypláchnuť sterilným fyziologickým roztokom.
Odporúčaná dávka je 200 jednotiek lieku BOTOX vo forme injekcií s objemom 1 ml (približne 6,7 jednotky), ktoré sa aplikujú do 30 miest detruzora.
Rekonštituovaný BOTOX (200 jednotiek/30 ml) sa injekčne aplikuje do svalu detruzora pomocou flexibilného alebo pevného cystoskopu s výnimkou trigona.Močový mechúr musí byť naplnený dostatočným množstvom fyziologického roztoku, aby sa dosiahla adekvátna vizualizácia na aplikáciu injekcií, nadmernej distenzii sa však treba vyhnúť.
Injekčná ihla musí byť pred začiatkom aplikácie injekcií naplnená asi 1 ml roztoku (v závislosti od veľkosti ihly), aby sa odstránil všetok vzduch.
Ihla sa aplikuje približne 2 mm do detruzora a 30 injekcií s obsahom 1 ml (celkový objem 30 ml) sa rozmiestni v odstupoch približne 1 cm (pozri obrázok vyššie).Pri poslednej injekcii sa aplikuje približne 1 ml sterilného fyziologického roztoku tak, aby sa zabezpečilo podanie plnej dávky.Po aplikácii injekcií treba fyziologický roztok použitý na vizualizáciu močového mechúra z neho vypustiť.Pacienta treba najmenej 30 minút po výkone sledovať.
Ku klinickému zlepšeniu obyčajne dochádza do 2 týždňov.Opakovaná aplikácia sa zvažuje u pacientov po znížení klinického účinku predchádzajúcej injekcie (medián trvania vo fáze 3 klinických štúdií bol 256 – 295 dní pre BOTOX s obsahom 200 jednotiek), nie však pred uplynutím 3 mesiacov od predchádzajúcej aplikácie injekcií do močového mechúra.
Prevencia chronickej migrényOdporúčaná rekonštituovaná dávka lieku BOTOX pre liečbu chronickej migrény je 155 až 195 jednotiek aplikovaná intramuskulárne (IM) 30G/0.5 palcovou (1,25 cm) ihlou (ako 0.1 ml (5 jednotiek) injekciami do 31 až 39 miest. Injekcie majú byť rozdelené do 7 špecifických svalových oblastí na hlave/krku, ako je uvedené v tabuľke dole. U pacientov s extrémne hrubou svalovou vrstvou môže byť potrebné použiť 1-palcovú (2,54 cm) ihlu. S výnimkou aplikácie do procerus svalu, kde sa má injikovať len na jedno miesto (do stredu), všetky svaly majú byť injikované bilaterálne s polovičným množstvom injikovaných miest naľavo a napravo.
Odporúčaná schéma ďalších aplikácií je každých 12 týždňov. Ak existuje miesto s prevládajúcou bolesťou, ďalšie injekcie môžu byť podané do jedného alebo oboch strán až do 3 špecifických svalov (occipitalis, temporalis a trapezius), až do maximálnej dávky pre sval ako je indikované v tabuľke dole.
Nasledovné diagramy ukazujú miesta aplikácie:

Dávkovanie lieku BOTOX podľa svalov:
| Odporúčaná dávka
|
Oblasť hlavy/krku
| Celkové dávkovanie (počet miest aplikácie)
|
Frontalisb
| 20 jednotiek (4 miesta)
|
Corrugatorb
| 10 jednotiek (2 miesta)
|
Procerus
| 5 jednotiek (1 miesto)
|
Occipitalisb
| 30 jednotiek (6 miest) až 40 jednotiek (až 8 miest)
|
Temporalisb
| 40 jednotiek (8 miest) až 50 jednotiek (až 10 miest)
|
Trapeziusb
| 30 jednotiek (6 miest) až 50 jednotiek (až 10 miest)
|
Skupina cervikálnych paraspinálnych svalovb
| 20 jednotiek (4 miesta)
|
Celková dávka:
| 155 až 195 jednotiek
31 to 39 miest
|
a 1 IM injekčné miesto = 0.1 ml = 5 jednotiek BOTOXu (riedenie 2 ml)
b Dávka aplikovaná bilaterálne
Kozmetické použitie lieku – glabelárne vrásky viditeľné pri maximálnom mračení sa Pri aplikácii lieku BOTOX do vertikálnych vrások medzi obočím, známych ako glabelárne vrásky, je nutné dbať na to, aby nedošlo k aplikácii do krvných ciev.
Rekonštituovaný roztok lieku BOTOX (50 jednotiek/1,25 ml; 100 jednotiek/2,5 ml; 200 jednotiek/5 ml) je aplikovaný sterilnou ihlou 30G. Do každého z 5 miest sa aplikuje 0,1 ml (4 jednotky): 2 injekcie do každého musculus corrugator a 1 injekcia do musculus procerus do celkovej dávky 20 jednotiek.
Pred aplikáciou je potrebné palec alebo ukazovák pevne pritlačiť pod orbitálny okraj, aby nedošlo k extravazácii pod orbitálny okraj. Ihla by počas aplikácie mala smerovať hore a do stredu. Z dôvodu zníženia rizika ptózy nie je možné aplikovať injekcie do oblasti levator palpebrae superioris, najmä u pacientov s väčšími komplexmi obočia a depresoru (depressor supercilii). Injekcie do musculus corrugator je nutné aplikovať do centrálnej časti tohto svalu, aspoň 1 cm nad oblúkom obočia.
Glabelárne vrásky vznikajú zvýšenou aktivitou musculus corrugator a musculus orbicularis oculi. Tieto svaly pohybujú obočím mediálne. Musculus procerus a musculus depresor supercilii ťahajú obočie dole. Tak sa vytvára zamračený alebo vrásčitý výraz. Umiestnenie, veľkosť a využívanie svalov sa individuálne podstatne rozlišuje. Vrásky vyvolané výrazom tváre vznikajú kolmo k smeru účinku kontrahovaných svalov tváre. Potrebná dávka pre odstránenie vrások závisí od celkového pozorovania schopnosti pacienta aktivovať povrchové svaly, do ktorých má byť injekcia aplikovaná.
Zlepšenie závažnosti vertikálnych vrások medzi obočím (glabelárnych vrások) sa všeobecne objavuje do jedného týždňa po liečbe. Účinnosť bola preukázaná až do 4 mesiacov po liečbe.
Po rekonštitúcii musí byť liek BOTOX použitý len na jednu aplikáciu injekcie (injekcií) pre jedného pacienta.
Intervaly medzi jednotlivými ošetreniami by nemali byť kratšie ako 3 mesiace.
Pri liečbe glabelárnych vrások viditeľných pri maximálnom mračení sa je možné v prípade nedostatočnej dávky a pri absencii akýchkoľvek nežiaducich účinkov sekundárne k prvej aplikácii, zvážiť pri druhej aplikácii použitie dávky až 40 alebo 50 jednotiek, pričom treba brať do úvahy analýzu predchádzajúceho zlyhania liečby.
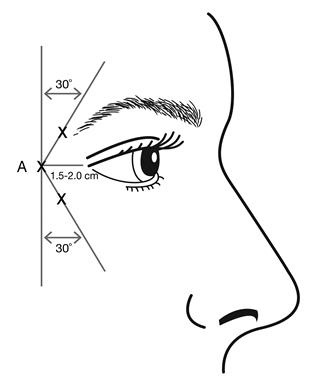
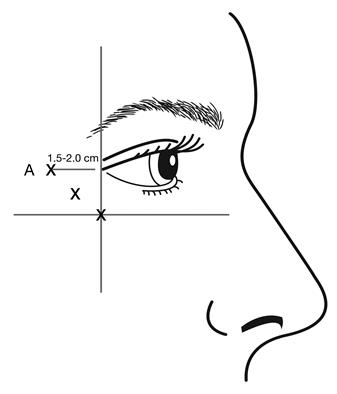
Kozmetické použitie lieku - vrásky očného kútika v tvare stopy vrany (Crow´s feet vrásky) viditeľné pri maximálnom úsmeveRekonštituovaný BOTOX (50 jednotiek/1,25 ml) sa aplikuje injekciou pomocou sterilnej ihly 30 G. Objem 0,1 ml (4 U) sa aplikuje injekčne do 3 miest na každej strane (celkom 6 miest aplikácie injekciou) do laterálneho m. orbicularis oculi s celkovou dávkou 24 jednotiek v celkovom objeme 0,6 ml (12 jednotiek na každú stranu).
Aby sa znížilo riziko ptózy viečka, nesmie byť prekročená dávky 4 jednotky do jedného injekčného miesta a tiež sa nesmie prekročiť počet injekčných miest. Injekcia má byť vedená temporálne k okraju orbity tak, aby bola zaistená bezpečná vzdialenosť od svalov, ktoré sú zodpovedné za eleváciu viečka.
Pri aplikácii injekcie držte skosený hrot ihly smerom hore a od oka.
Prvá injekcia (A) by mala byť aplikovaná asi 1,5 až 2,0 cm temporálne do laterálneho očného kútika a temporálne do orbitálnej hrany. Následné miesta aplikácie injekcií budú závisieť na tom, či vrásky v oblasti okolo očí sú nad a pod laterálnym očným kútikom (i) alebo primárne pod laterálnym očným kútikom (ii).
(i) (ii)
Pre súčasnú liečbu s glabelárnymi vráskami viditeľnými pri maximálnom mračení sa sa používa dávka 24 jednotiek pre vrásky očného kútika v tvare stopy vrany viditeľné pri maximálnom úsmeve a 20 jednotiek pre glabelárne vrásky (pozri inštrukcie pre podávanie u glabelárnych vrások). Pri súčasnej liečbe je celková dávka 44 jednotiek v celkovom objeme 1,1 ml.
Opatrnosť je potrebné venovať zaisteniu toho, aby BOTOX nebol aplikovaný injekciou do krvnej cievy počas aplikácie injekcie u vrások okolo očí.
K zlepšeniu závažnosti vrások očného kútika v tvare stopy vrany viditeľných pri maximálnom úsmeve podľa hodnotenia skúšajúceho došlo do jedného týždňa po liečbe. Efekt bol preukázaný v priemere po dobu 4 mesiacov po aplikácii injekcie.
Liečebné intervaly nesmú byť častejšie ako každé 3 mesiace.
Účinnosť a bezpečnosť opakovaného podávania lieku BOTOX dlhšieho ako 12 mesiacov nebola hodnotená.
Všetky indikácieV prípade zlyhania liečby po prvom sedení, napr. neprítomnosť signifikatného klinického zlepšenia oproti východziemu stavu za mesiac po liečbe, je potreba dodržať nasledujúci postup:
- klinické overenie účinku toxínu na injikovaný sval (môže zahŕňať elektromyografické vyšetrenie u špecialistov);
- analýza príčin zlyhania, napr. zlý výber injikovaných svalov, nedostatočná dávka, zlá injekčná technika, výskyt fixnej kontraktúry, príliš oslabený svalový antagonista, tvorba toxín-neutralizujúcich protilátok;
- prehodnotenie vhodnosti liečby botulotoxínom typu A;
- v prípade neprítomnosti nežiaducich účinkov závislých na prvej liečebnej kúre zahájte ďalšiu liečbu podľa nasledujúcich odporúčaní: 1) upravte dávku, berte do úvahy zlyhanie predchádzajúcej liečby, 2) použite EMG a 3) zachovajte trojmesačný interval medzi dvoma liečebnými kúrami.
V prípade zlyhania liečby alebo oslabenie účinku opakovane podávaných injekcií sa majú použiť alternatívne liečebné metódy.
4.3 KontraindikácieBOTOX je kontraindikovaný vo všetkých indikáciách:
· u pacientov so známou precitlivenosťou na Botulini toxinum typus A – haemagglutininum complex alebo akúkoľvek zo zložiek lieku;
· v prítomnosti infekcie v navrhovanom mieste aplikácie.
BOTOX je v liečbe dysfunkcie močového mechúra kontraindikovaný aj:
u pacientov s akútnou infekciou močového traktu počas liečby
u pacientov s akútnou retenciou moču počas liečby, ktorí nie sú rutinne katerizovaní.
u pacientov, ktorí nie sú v prípade potreby ochotní a/alebo schopní po liečbe začať katetrizovať.
BOTOX je v kozmetickej indikácii kontraindikovaný v nasledovnom prípade:
· u pacientov s mysténiou gravis alebo Lambert-Eatonovým syndrómom.
4.4 Osobitné upozornenia a opatrenia pri používaníNesmie sa prekračovať odporučené dávkovanie ani skracovať odporučené intervaly medzi aplikáciami kvôli možnosti predávkovania, nadmernej svalovej slabosti, vzdialenému šíreniu toxínu a tvorbe neutralizačných protilátok. Počiatočné dávkovanie u pacientov bez predchádzajúcej liečby má byť byť začaté s najnižšou odporúčanou dávkou pre špecifickú indikáciu.
Lekári i pacienti by si mali byť vedomí toho, že sa môžu objaviť nežiaduce účinky, i keď boli predchádzajúce injekcie dobre tolerované. Opatrnosť je potrebná v prípade každej aplikácie.
Boli hlásené nežiaduce účinky súvisiace so šírením toxínu do vzdialených miest od miesta podania (viď bod 4.8), ktoré mali niekedy za následok úmrtie a ktoré boli v niektorých prípadoch spojené s dysfágiou, pneumóniou a/alebo výraznou telesnou slabosťou. Tieto príznaky sú v súlade s mechanizmom účinku botulotoxínu a boli hlásené po hodinách až týždňoch po injekcii. Riziko príznakov je pravdepodobne vyššie u pacientov, ktorí majú predispozície k týmto príznakom a ďalšie zdravotné problémy, vrátane detí a dospelých liečených kvôli spasticite a liečených vysokými dávkami.
Starší a oslabení pacienti majú byť liečení s opatrnosťou.
Pred začiatkom liečby má byť u každého pacienta zvážený pomer prínosu a rizika.
Dysfágia bola hlásená tiež po aplikácii do iných miest než krčných svalov (pozri časť 4.4 -cervikálna dystónia).
BOTOX sa má používať so zvýšenou opatrnosťou a pod zvýšeným dohľadom u pacientov so subklinickým alebo klinickým výskytom porúch neuromuskulárneho prenosu: napr. myasthenia gravis alebo Lambert-Eaton syndrómom, u pacientov s periférnym neuropatickým ochorením (napr. amyotrofickou laterálnou sklerózou alebo motorickou neuropatiou) a u pacientov so základnými neurologickými ochoreniami. Títo pacienti majú zvýšenú citlivosť na lieky ako BOTOX, dokonca i v terapeutických dávkach čo môže vyvolať nadmernú svalovú slabosť a zvýšené riziko výskytu klinicky významných nežiaducich účinkov, vrátane vážnej dysfágie a respiračných porúch. U takýchto pacientov je potrebné botulotoxínové prípravky používať len pod dohľadom špecialistu, ak má prínos z liečby prevýšiť riziko. Pacientov s dysfágiou a aspiráciou v anamnéze je potrebné liečiť so extrémnou opatrnosťou.
Pacienti alebo ich ošetrovatelia majú byť upozornení, aby vyhľadali okamžite lekársku pomoc, ak sa objavia poruchy prehĺtania, reči alebo dýchania.
Podobne ako v iných prípadoch liečby, ktorá umožňuje zvýšenie aktivity po ošetrení, majú pacienti, ktorí pred liečbou viedli sedavý spôsob života, začať ďalšie aktivity postupne.
Je nevyhnutné poznať všetky dôležité anatomické vzťahy a zmeny spôsobené predchádzajúcimi operačnými výkonmi a potrebné je vyhnúť sa aplikácii injekcií do citlivých anatomických štruktúr.
Po aplikácii BOTOXU do oblasti blízko hrudníka bol hlásený s injekčnou procedúrou spojený pneumotorax. Opatrnosť sa vyžaduje pri injekcii aplikovanej v blízkosti pľúc (najmä pľúcnych vrcholov) a do ďalších citlivých anatomických štruktúr.
U pacientov, ktorým bol BOTOX v neschválenej indikácii injekčne aplikovaný priamo do slinných žliaz, do oblasti oro-linguálne-faryngeálnej a do pažeráka a žalúdku boli hlásené závažné nežiaduce účinky vrátane fatálnych následkov. Niektorí z týchto pacientov mali preexistujúcu dysfágiu alebo významnú slabosť.
Zriedkavo boli hlásené vážne a/alebo okamžité hypersenzitívne reakcie vrátane anafylaxie, sérového ochorenia, žihľavky, opuchu mäkkých tkanív a dyspnoe. Niektoré z týchto reakcií boli hlásené po použití lieku BOTOX samotného alebo v kombinácii s použitím iných liekov, ktoré vyvolávajú nežiaduce účinky. Pokiaľ sa objaví takáto reakcia, podávanie musí byť prerušené a je potrebné zahájiť príslušnú liečbu, ako je okamžité podanie adrenalínu. Je známy jeden prípad anafylaktického šoku, kedy pacient zomrel po aplikácii lieku BOTOX nesprávne nariedeného s 5 ml 1% lidokaínu.
Ako pri každej injekcii, môže dôjsť k úrazu. Injekčné podanie môže spôsobiť lokálnu infekciu v mieste vpichu, bolesť, zápal, parestéziu, zníženú citlivosť, opuch, erytém a/alebo krvácanie/podliatiny.
Bolesť a/alebo strach môžu vyvolať vazovagálnu odpoveď, napr. synkopu, hypotenziu.
Zvýšená opatrnosť pri použití lieku BOTOX je nutná, pokiaľ je v mieste plánovanej injekcie zápal alebo je prítomná výrazná slabosť alebo atrofia v cieľovom svale.
Zvýšená opatrnosť pri použití lieku BOTOX je tiež nutná u pacientov s periférnym neuropatickým ochorením (napr. amyotrofickou laterálnou sklerózou alebo motorickou neuropatiou).
Boli tiež hlásené nežiaduce účinky po podaní BOTOXU týkajúce sa kardiovaskulárneho systému, vrátane arytmie a infarktu myokardu, niektoré z nich mali fatálny priebeh. Niektorí z týchto pacientov mali rizikové faktory, vrátane kardiovaskulárneho ochorenia.
Bol hlásený nový alebo opakovaný výskyt záchvatov, obvykle u pacientov, ktorí majú predispozíciu k výskytu týchto stavov. Presná súvislosť týchto udalostí s injekciami botulotoxínu nebola stanovená. U detí boli tieto udalosti hlásené predovšetkým u pacientov liečených na spasticitu spojenú s detskou mozgovou obranou.
Tvorba protilátok proti botulotoxínu typu A môže znížiť účinnosť liečby liekom BOTOX, a to inaktiváciou biologickej aktivity toxínu.
Výsledky z niektorých štúdií ukazujú, že použitie lieku BOTOX v príliš častých alebo vysokých dávkach môže viesť k zvýšenej tvorbe protilátok. Ak je to vhodné, potenciál tvorby protilátok môže byť minimalizovaný aplikáciou najnižšej dávky pri najdlhších klinicky indikovaných intervaloch medzi injekciami.
Klinické fluktuácie počas opakovaného podania lieku BOTOX (rovnako ako u všetkých botulotoxínov) môžu byť následkom odlišných procesov rekonštitúcie roztoku, intervalov medzi injekciami, injikovaných svalov a ľahko rozdielnych hodnôt potencie dané použitými metódami biologického testovania.
Pediatrická populáciaBezpečnosť a účinnosť lieku BOTOX v indikáciách iných ako sú uvedené v časti 4.1, neboli stanovené. Po uvedení lieku na trh bolo u detských pacientov s ďalšími zdravotnými problémami, predovšetkým s mozgovou obrnou, veľmi vzácne hlásené možné šírenie toxínu do miest vzdialených od miesta podania. Všeobecne platí, že bola u týchto prípadov použitá vyššia ako odporúčaná dávka (pozri časť 4.8).
Je známych niekoľko veľmi zriedkavých prípadov, kedy po aplikácii lieku BOTOX u detí s detskou mozgovou obranou došlo k aspiračnej pneumónii vedúcej k úmrtiu, vrátane toho kedy bol BOTOX použitý v neschválenej indikácii (napr. oblasť krku). Zvýšená opatrnosť pri použití lieku BOTOX je nutná u detí s výrazným neurologickým postihnutím, dysfágiou alebo nedávnou aspiračnou pneumóniou alebo pľúcnym ochorením v anamnéze.
Pri liečbe pacientov so zlým zdravotným stavom je potrebné individuálne zvážiť pomer prínosu a rizika.
BlefarospazmusZnížené žmurkanie, ktoré nasleduje po injekcii botulotoxínu do plochého kruhového svalu (m. orbicularis oculi), môže viesť k odhaleniu rohovky, perzistentnému epiteliálnemu defektu a ulceráciám rohovky, najmä u pacientov s poruchou inervácie VII. hlavového nervu. Je potrebné zamerať sa na dôkladné vyšetrenie rohovkovej citlivosti u predtým operovaných očí, vyhnúť sa aplikácii do spodnej mihalnice, aby nedošlo k ektropii a okamžite a dôkladne liečiť každý defekt rohovkového epitelu. Táto liečba môže zahŕňať aplikáciu ochranných kvapiek, ochranných mastí, kontaktných šošoviek alebo uzatvorenie očnej štrbiny prelepením alebo i iným spôsobom.
V mäkkých tkanivách viečka ľahko vznikajú ekchymózy. Tie môžu byť minimalizované pôsobením mierneho tlaku na miesto aplikácie bezprostredne po injekcii.
Vzhľadom k anticholinernej aktivite botulotoxínu je potrebné dbať na zvýšenú opatrnosť pri liečbe pacientov s rizikom glaukómu s uzavretým uhlom.
Cervikálna dystóniaPacienti s cervikálnou dystóniou majú byť informovaní o možnom vzniku dysfágie, ktorá môže byť mierna, ale i závažná. Dysfágia môže pretrvávať dva až tri týždne, ale bolo hlásené, že trvala i päť mesiacov po injekcii. Dôsledkom dysfágie je možnosť aspirácie, dyspnoe a príležitostne potreba výživy sondou. Vo zriedkavých prípadoch bola po dysfágii hlásená aspiračná pneumónia a úmrtie.
Obmedzenie dávky injikovanej do m. sternoceidomastoideus na menej než 100 jednotiek môže znížiť riziko vzniku dysfágie. Bolo hlásené, že u pacientov s malou svalovou hmotou na krku alebo u pacientov, ktorí dostávajú injekcie bilaterálne, je väčšie riziko dysfágie. Dysfágii sa prisudzuje šíreniu toxínu do ezofageálnych svalov. Aplikácia lieku BOTOX do levator scapulae môže byť spojená so zvýšením rizika respiračnej infekcie a dysfágie.
Dysfágia môže prispieť k zhoršenému príjmu potravy i vody a k následnému zníženiu hmotnosti a dehydratácii. U pacientov so subklinickou dysfágiou môže byť zvýšené riziko vážnejšieho priebehu dysfágie po injekcii lieku BOTOX.
Fokálna spasticita spojená s detskou mozgovou obrnou a spasticita ruky a zápästia u dospelých po cievnej mozgovej príhodePri liečbe fokálnej spasticity bol BOTOX používaný len v spojení so štandardnou starostlivosťou a nie je určený ako náhrada týchto liečebných metód. Nie je pravdepodobné, že by BOTOX zlepšoval rozsah pohybu kĺbov poškodených fixnými kontraktúrami.
Po uvedení lieku na trh boli po liečbe botulotoxínom hlásené prípady úmrtia (niekedy spojené s aspiračnou pneumóniou) a vzdialené šírenie toxínu, a to u detí s ďalšími zdravotnými problémami, prevažne s detskou mozgovou obrnou. Pozri upozornenia v časti 4.4 Pediatrická populácia
Primárna hyperhidróza axílAnamnéza a lekárska prehliadka spolu s ďalšími špecifickými vyšetreniami sú nevyhnutné k vylúčeniu prípadov sekundárnej hyperhidrózy (napr. hypertyreóza, feochromocytom). To umožní vyhnúť sa symptomatickej liečbe hyperhidrózy bez diagnózy alebo liečby základného ochorenia.
Kozmetické použitie - vrásky Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na dávku 20 jednotiek, t.j. v podstate „neobsahuje sodík“.
Opatrnosť je potrebná pri použití lieku BOTOX za prítomnosti zápalu v mieste (miestach) aplikácie alebo ak svaly, do ktorých sa aplikuje, vykazujú zvýšenú slabosť alebo atrofiu.
Zvýšená opatrnosť pri kozmetickom použití lieku BOTOX je nutná u pacientov s kožnými zápalovými prejavmi v mieste aplikácie, zreteľnou faciálnou asymetriou, ptózou, dermatochalaziou, hlbokými kožnými jazvami alebo kožou so zvýšenou produkciou mazu, pretože títo pacienti neboli zaradení do 3. fázy klinických štúdií.
Je potrebné zabezpečiť, aby BOTOX nebol aplikovaný do krvného riečišťa do zvislých vrások medzi obočím, ktoré sú viditeľné pri maximálnom mračení sa (glabelárne vrásky), ako aj pri aplikácii do vrások očného kútika v tvare stopy vrany, ktoré sú viditeľné pri maximálnom úsmeve (pozri časť 4.2).
Použitie lieku BOTOX v kozmetickej indikácii sa neodporúča u pacientov mladších ako 18 rokov. U pacientov starších ako 65 rokov sú k dispozícii len obmedzené údaje z klinických štúdií fáze 3.
Existuje riziko vzniku poklesu viečka po liečbe. Prezrite si časť 4.2 s pokynmi týkajúcimi sa podávania, kde je uvedené, ako sa má minimalizovať riziko.
Dysfunkcia močového mechúraCystoskopiu je potrebné vykonávať s primeranou lekárskou pozornosťou.
U pacientov, ktorí nie sú katetrizovaní, je potrebné do 2 týždňov po liečbe posúdiť postmikčné rezíduum moču a potom pravidelne podľa potreby až do 12 týždňov. Pacient musí byť poučený, aby sa v prípade ťažkostí s vyprázdňovaním obrátil na svojho lekára, keďže môže byť potrebná katetrizácia.
Hyperaktívny močový mechúrMuži s diagnózou hyperaktívneho močového mechúra a príznakmi obštrukcie močových ciest nemajú byť liečení liekom BOTOX.
Urinárna inkontinencia spôsobená neurogénnou hyperaktivitou detruzoraMôže sa vyskytnúť autonómna dysreflexia súvisiaca so zákrokom. Môže byť nutná rýchla lekárska starostlivosť.
Prevencia chronickej migrényÚčinnosť lieku BOTOX nebola preukázaná pri profylaxii bolesti hlavy u pacientov s epizodickou migrénou (bolesť hlavy < 15 dní za mesiac).
4.5 Liekové a iné interakcieÚčinky botulotoxínu môžu byť teoreticky potencované aminoglykozidovými antibiotikami alebo inými liekmi, ktoré ovplyvňujú neurosvalový prenos (napr. nervosvalové blokátory)
Účinok podania rôznych sérotypov botulotoxínov v rovnakom čase alebo behom niekoľkých mesiacov nie je známy. Podanie ďalšieho botulotoxínu pred odoznením účinkov skôr podaného botulotoxínu môže vyvolať nadmernú nervosvalovú slabosť.
Neboli vykonané štúdie týkajúce sa interakcií. Neboli hlásené žiadne klinicky významné interakcie.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostačujúce údaje o použití botulotoxínu typu A u tehotných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri bod 5.3). Nie je známe možné riziko pre ľudí. BOTOX nemá byť používaný u tehotných žien, pokiaľ to nie je bezpodmienečne nutné.
LaktáciaNie je známe, či sa BOTOX vylučuje do materského mlieka. Počas laktácie sa neodporúča BOTOX používať.
FertilitaNie sú k dispozícii adekvátne údaje o účinkoch používania botulotoxínu typu A na plodnosť u žien vo fertilnom veku. Štúdie na potkaních samcoch a samiciach vykázali zníženú fertilitu (pozri bod. 5.3).
4.7 Ovplyvnenie schopnosti viesť motorové vozidlá a obsluhovať strojeNeboli vykonané žiadne štúdie týkajúce sa vplyvu na schopnosť viesť motorové vozidlá a obsluhovať stroje. Liek BOTOX však môže spôsobiť asténiu, svalovú slabosť, závraty a poruchy videnia, ktoré môžu mať vplyv na vedenie motorových vozidiel a obsluhu strojov.
4.8 Nežiaduce účinkyCelkovéV kontrolovaných klinických štúdiách boli zaznamenané nežiaduce účinky, ktoré hodnotitelia považovali za súvisiace s liekom BOTOX u 35 % pacientov s blefarospazmom, 28 % pacientov s cervikálnou dystóniou, 17 % s detskou mozgovou obrnou, 16 % s fokálnou spasticitou hornej končatiny v súvislosti s náhlou cievnou mozgovou príhodou a 11 % s primárnou hyperhidrózou axíl. V klinických štúdiách týkajúcich sa hyperaktívneho močového mechúra bola incidencia 26% pri prvej liečbe a 22% pri druhej liečbe.
V klinických štúdiách týkajúcich sa urinárnej inkontinencie spôsobenej neurogénnou hyperaktivitou detruzora bola incidencia 32 % pri prvej liečbe a klesla na 18 % pri druhej liečbe.
V klinických štúdiách zameraných na chronickú migrénu bol výskyt nežiaducich účinkov u 26 % pacientov pri prvej liečbe s poklesom na 11 % pri druhej liečbe-
Na základe údajov z kontrolovaných klinických štúdii, je možné očakávať výskyt nežiaducich účinkov po liečbe glabelárnych vrások viditeľných pri maximálnom mračení sa liekom BOTOX u 23,5% (placebo: 19,2%) pacientov. V prvom liečebnom cykle v hlavných kontrolovaných klinických štúdiach boli nežiaduce účinky hlásené u 7,6 % (24 jednotiek) pacientov po liečbe vrások okolo očí v tvare stopy vrany viditeľných pri maximálnom úsmeve, u 6,2 % (44 jednotiek:24 jednotiek) pacientov po liečbe vrások okolo očí v tvare stopy vrany so súčasným podávaním 20 jednotiek na liečbu glabelárnych vrások a u 4,5 % pacientov v skupine s placebom
Tieto nežiaduce reakcie môžu súvisieť s liečbou, injekčnou technikou alebo s obidvoma týmito faktormi.
Všeobecne nežiaduce účinky vznikli počas niekoľkých prvých dní po injekcií a boli prechodné, môžu však trvať niekoľko mesiacov alebo dlhšie.
Lokálna svalová slabosť predstavuje očakávané farmakologické pôsobenie botulotoxínu.
Blefaroptóza, ktorá vznikla v dôsledku kozmetického použitia na glabelárne vrásky a ktorá môže súvisieť s injekčnou technikou, súvisí s farmakologickým účinkom lieku BOTOX.
Rovnako ako u iných injekčných postupov môže byť výkon spojený s miestnou bolesťou, zápalom, parestézou, hypoasteziou, opuchom a edémom, erytémom, lokalizovanou infekciou, krvácaním a/alebo modrinami v dôsledku injekčného podania. Bolesť a/alebo strach súvisiaci s injekciou, môžu spôsobiť vazovagálne reakcie, vrátane prechodného symptomatického zníženia krvného tlaku alebo mdlôb. Po injekciách botulotoxínu bola tiež hlásená horúčka a chrípkový syndróm.
Nežiaduce účinky – frekvencia podľa indikácieFrekvencia nežiaducich účinkov pre každú indikáciu vychádza z klinických štúdií. Frekvencia je definovaná nasledujúcim spôsobom: veľmi časté (>1/10), časté (>1/100 až <1/10), menej časté (>1/1 000 až <1/100), zriedkavé (>1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000).
Blefarospazmus / hemifaciálny spazmusPoruchy nervového systémuMenej časté: Závraty, faciálna paréza a faciálna obrna.
Poruchy okaVeľmi časté: Ptóza očného viečka.
Časté: Keratitis punctata, lagoftalmus, suché oko, fotofóbia, podráždenie oka a zvýšená tvorba sĺz.
Menej časté: Keratitis, ektropium, diplopia, poruchy videnia a zastreté videnie.
Zriedkavé: Opuch očných viečok.
Veľmi zriedkavé: Ulcerózna keratitída, defekt rohovkového epitelu, perforácia rohovky.
Poruchy kože a podkožného tkanivaČasté: Ekchymóza.
Menej časté: Vyrážka/dermatitída.
Celkové poruchy a reakcie v mieste podania Časté: Podráždenie a opuch tváre.
Menej časté: Únava.
Cervikálna dystóniaInfekcie a nákazy Časté: Nádcha, infekcia horných ciest dýchacích.
Poruchy nervového systémuČasté: Závraty, zvýšené svalové napätie, znížená citlivosť, somnolencia a bolesť hlavy.
Poruchy oka Menej časté: Diplopia a ptóza očného viečka.
Poruchy dýchacej sústavy, hrudníka a mediastína Menej časté: Dušnosť a dystónia.
Poruchy gastrointestinálneho traktu Veľmi časté: Dysfágia (pozri časť „Ďalšie informácie“ dole).
Časté: Sucho v ústach a nevoľnosť.
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaVeľmi časté: Svalová slabosť.
Časté: Svalová stuhnutosť a bolestivosť.
Celkové poruchy a reakcie v mieste podania Veľmi časté: Bolesť.
Časté: Asténia, ochorenie podobné chrípke a malátnosť.
Menej časté: Horúčka.
Detská mozgová obrnaInfekcie a nákazyVeľmi časté: Vírusové infekcie a infekcie ucha.
Poruchy nervového systémuČasté: Somnolencia, poruchy chôdze a parestézia.
Poruchy podkožného tkaniva Časté: Vyrážka.
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: Bolesť svalov, svalová slabosť a bolesť končatín.
Poruchy obličiek a močových ciestČasté: Močová inkontinencia.
Úrazy, otravy a komplikácie liečebného postupuČasté: Pád.
Celkové poruchy a reakcie v mieste podania Časté: Malátnosť, bolesť v mieste injekcie a asténia.
Fokálna spasticita hornej končatiny spojená s cievnou mozgovou príhodouPsychické poruchy Menej časté: Depresie a nespavosť.
Poruchy nervového systémuČasté: Hypertónia.
Menej časté: Hypestézia, bolesť hlavy, parestézia, poruchy koordinácie a amnézia.
Poruchy ucha a labyrintuMenej časté: Vertigo.
Poruchy cievMenej časté: Ortostatická hypotenzia.
Poruchy gastrointestinálneho traktu Menej časté: Nauzea a orálna parestézia.
Poruchy kože a podkožného tkaniva Časté: Ekchymóza a purpura.
Menej časté: Dermatitis, svrbenie a vyrážka.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Časté: Bolesť končatín a svalová slabosť.
Menej časté: Artralgia a bursitis.
Celkové poruchy a reakcie v mieste podania Časté: Bolesť v mieste injekcie, pyrexia, ochorenie podobné chrípke, hemorágia a podráždenie v mieste injekcie.
Menej časté: Asténia, bolesť, citlivosť v mieste injekcie, malátnosť a periférny opuch.
Niektoré z menej častých nežiaducich účinkov môžu súvisieť s ochorením.
Primárna hyperhidróza axílPoruchy nervového systémuČasté: Bolesť hlavy a parestézia.
Poruchy ciev Časté: Návaly tepla.
Poruchy gastrointestinálneho traktu Menej časté: Nauzea.
Poruchy kože a podkožného tkaniva Časté: Hyperhidróza (potenie mimo axily), abnormálny zápach kože, svrbenie, podkožné uzliny a alopécia.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Časté: Bolesť končatín.
Menej časté: Svalová slabosť, myalgia a artropatia.
Celkové poruchy a reakcie v mieste podania Veľmi časté: Bolesť v mieste injekcie.
Časté: Bolesť, opuch v mieste injekcie, hemorágia v mieste injekcie, citlivosť a podráždenie v mieste injekcie, asténia a reakcie v mieste injekcie.
Pri liečbe primárnej hyperhidrózy axíl bolo do jedného mesiaca od aplikácie injekcie u 4,5% pacientov hlásené zvýšené potenie mimo axily, pričom nebol zistený žiadny špecifický vzorec s ohľadom na to, ktoré anatomické oblasti boli takto postihnuté. U približne 30% pacientov problémy ustúpili do štyroch mesiacov.
Menej často bola tiež hlásená slabosť ruky (0,7%), bola mierna, prechodná, nevyžadovala liečbu a odznela bez následkov. Tento nežiaduci účinok môže súvisieť s liečbou, injekčnou technikou alebo s oboma faktormi. Pri hlásení menej častej svalovej slabosti, je nutné zvážiť neurologické vyšetrenie. Navyše je pred ďalšou aplikáciou injekcie žiaduce prehodnotiť injekčnú techniku, aby bola zaistená intradermálna aplikácia injekcie.
V nekontrolovanej bezpečnostnej štúdii lieku BOTOX (50 jednotiek na axilu) u detí a dospievajúcich vo veku 12 až 17 rokov (N=144) sa u viac ako jedného pacienta (v oboch prípadoch u 2 pacientov) objavili bolesť v mieste injekcie a hyperhidróza (potenie mimo axily).
Kozmetické použitie – glabelárne vráskyInfekcie a nákazyMenej časté: Infekcia.
Psychické poruchy Menej časté: Úzkosť.
Poruchy nervového systémuČasté: Bolesť hlavy, parestézia
Menej časté: Závraty.
Poruchy oka Časté: Ptóza očného viečka.
Menej časté: Blefaroptóza, bolesť oka, poruchy videnia (vrátane rozmazaného videnia).
Poruchy gastrointestinálneho traktu Časté: Nauzea
Menej časté: Sucho v ústach.
Poruchy kože a podkožného tkaniva Časté: Erytém, napätie kože
Menej časté: Opuchy (tváre, viečok, periorbitálny opuch), fotosenzitívna reakcia, svrbenie, suchá pokožka.
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: Miestna svalová slabosť.
Menej časté: Svalové zášklby.
Celkové poruchy a reakcie v mieste podania Časté: Bolesť v tvári, opuch v mieste podania injekcie, ekchymóza, bolesť v mieste podania injekcie, podráždenie v mieste podania injekcie.
Menej časté: Príznaky podobné chrípke, asténia, horúčka.
Závažnosť dysfágie kolíše od miernej až po závažnú, s možnosťou aspirácie, a príležitostne môže
vyžadovať lekársku intervenciu , pozri časť 4.4.
Kozmetické použitie – vrásky očného kútika v tvare stopy vrany (Crow´s feet vrásky)Nasledujúce nežiaduce účinky boli hlásené v dvojito zaslepených, placebom kontrolovaných klinických štúdiách po injekcii lieku BOTOX 24 jednotiek u samostatných vrások očného kútika v tvare stopy vrany:
Poruchy okaČasté: Edém očných viečok
Celkové poruchy a reakcie v mieste podaniaČasté: Krvácanie v mieste aplikácie injekcie*, hematóm v mieste aplikácie injekcie*
Menej časté: Bolesť v mieste aplikácie injekcie*, parestézia v mieste podania injekcie
*nežiaduce účinky súvisiace s aplikáciouKozmetické použitie – vrásky očného kútika v tvare stopy vrany (Crow´s feet vrásky) a glabelárne vráskyNasledujúce nežiaduce účinky boli hlásené v dvojito zaslepených, placebom kontrolovaných klinických štúdiách po injekcii prípravku BOTOX 44 jednotiek (súčasná liečba vrások očného kútika v tvare stopy vrany a glabelárnych vrások):
Celkové poruchy a reakcie v mieste podaniaČasté: Hematóm v mieste aplikácie injekcie*
Menej časté: Krvácanie v mieste aplikácie injekcie*, bolesť v mieste aplikácie injekcie*
*nežiaduce účinky súvisiace s aplikáciouPo opakovanom dávkovaní nebola pozorovaná žiadna zmena v celkovom bezpečnostnom profile.
Chronická migrénaPoruchy nervového systémuČasté: Bolesť hlavy, migréna*, faciálna paréza.
Poruchy oka Časté: Pokles očného viečka.
Menej časté: opuch očného viečka
Poruchy kože a podkožného tkaniva Časté: Svrbenie, vyrážka
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: Bolesť krku, bolesť svalov, bolesť pohybového systému, svalová stuhnutosť, svalové kŕče, svalové napätie, svalová slabosť.
Celkové poruchy a reakcie v mieste podania Časté: Bolesť v mieste podania injekcie.
Menej časté: bolesť kože, bolesť čelusti.
Poruchy gastrointestinálneho traktuMenej časté: Dysfágia
V placebo-kontrolovaných štúdiách, bolesti hlavy a migréna, vrátane vážnych prípadov nepoddajnej alebo zhoršenej bolesti hlavy/migrény, boli hlásené častejšie pri lieku BOTOX (9%) ako s placebom (6%). Objavili sa najmä počas prvého mesiaca po injekciách a ich výskyt klesal s opakovaním liečby.
Hyperaktívny močový mechúrInfekcie a nákazyVeľmi časté: infekcia močového traktu
Časté: baktériuria
Poruchy obličiek a močových ciestVeľmi časté: dyzúria
Časté: retencia moču, reziduálny objem moču*, polakizúria
* zvýšený postmikčný reziduálny objem moču nevyžadujúci katetrizáciu
Nežiaduce účinky súvisiace s postupom, ktoré sa objavili ako časté boli dyzúria a hematúria.
Občasná katetrizácia bola začatá u 6,5% pacientov po liečbe liekom BOTOX verzus u 0,4% pacientov v placebo skupine.
V placebom kontrolovaných klinických štúdiách bolo 1242 pacientov, 41,4% pacientov (n = 514) malo ≥ 65 rokov a 14,7% (n = 182) malo ≥ 75 rokov. Žiadne všeobecné rozdiely v bezpečnostnom profile následkom BOTOX liečby neboli pozorované medzi pacientmi ≥ 65 rokov v porovnaní s pacientmi < 65 rokov v týchto štúdiách, s výnimkou infekcie močových miest kde incidencia bola vyššia u staršej skupiny v placebo skupine aj BOTOX skupine v porovnaní s mladšími pacientmi.
Pri opakovanom podaní neboli pozorované žiadne zmeny vo všeobecnom bezpečnostnom profile.
Urinárna inkontinencia spôsobená neurogénnou hyperaktivitou detruzoraInfekcie a nákazyVeľmi časté: infekcia močového traktu
Psychické poruchyČasté:nespavosť
Poruchy gastrointestinálneho traktuČasté:zápcha
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté:svalová slabosť, svalový spazmus
Poruchy obličiek a močových ciestVeľmi časté: zadržiavanie moču
Časté: Hematúria*, dysúria*, divertikul močového mechúra
Celkové ochorenia a reakcie v mieste podaniaČasté:únava, porucha chôdze
Úrazy, otravy a komplikácie liečebného postupuČasté:Autonómna dysreflexia*, pád
*nežiaduce reakcie súvisiace s podanímV klinických štúdiách boli hlásené infekcie močového traktu, a to u 49,2 % pacientov liečených 200 jednotkami lieku BOTOX a u 35,7 % pacientov liečených placebom (v skupine pacientov so sclerosis multiplex to bolo 53 % pacientov liečených 200 jednotkami lieku BOTOX, oproti 29,3 % s placebom, v skupine s poranením miechy to bolo u 45,4 % pacientov liečených 200 jednotkami lieku BOTOX oproti 41,7 % s placebom). Retencia moču bola hlásená u 17,2 % pacientov liečených 200 jednotkami lieku BOTOX a u 2,9 % pacientov liečených placebom (v skupine pacientov so sclerosis multiplex to bolo u 28,8 % pacientov liečených 200 jednotkami lieku BOTOX oproti 4,5 % s placebom, v skupine s poranením miechy to bolo u 5,4 % pacientov liečených 200 jednotkami lieku BOTOX oproti 1,4 % s placebom).
Pri opakovanom podávaní nebola zaznamenaná zmena typu nežiaducich reakcií.
U pacientov so sklerózou multiplex zaradených v pivotných štúdiách neboli zaznamenané rozdiely v ročnej miere exacerbácií MS (t. j. počet výskytov exacerbácií MS na pacienta za rok) (Botox=0,23, placebo = 0,20).
Spomedzi pacientov, ktorí neboli katetrizovaní pred začiatkom liečby, bola katetrizácia iniciovaná u 38,9 % po liečbe 200 jednotkami lieku BOTOX v porovnaní so 17,3 % v placebo skupine.
Ďalšie informácieNasledujúci zoznam obsahuje nežiaduce účinky. ktoré boli oznámené po uvedení lieku na trh bez ohľadu na indikáciu a sú uvedené ako doplnenie k nežiaducim účinkom uvedeným v časti 4.4 (Osobitné upozornenia a opatrenia pri používaní) a v časti 4.8.(Nežiaduce účinky) .
Poruchy kardiovaskulárneho systémuarytmia, infarkt myokardu
Poruchy ucha a labyrintu:hypoakuzia, tinnitus a závrat
Poruchy oka:glaukóm s uzavretým uhlom (pri liečbe blefarospasmu), strabizmus, rozmazané videnie a poruchy zraku
Gastrointestinálne poruchy:bolesť brucha, hnačka, zápcha, sucho v ústach, dysfágia, nauzea, vracanie
Celkové poruchy a reakcie v mieste podania:denervačná atrofia, malátnosť a horúčka
Poruchy imunitného systému:anafylaxia, angiodém, sérové ochorenie a žihľavka
Poruchy metabolizmu a výživy:anorexia
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva:svalová atrofia a myalgia
Poruchy nervového systému:brachiálna plexopatia, dysfónia, dysartria, faciálna paréza, hypestézia, svalová slabosť, myastenia gravis, periférna neuropatia, parestézia, radikulopatia, kŕče, synkopa a faciálna obrna, znížená citlivosť.
Poruchy dýchacej sústavy, hrudníka a mediastína:aspiračná pneumónia (niekedy s fatálnym koncom), dušnosť, respiračná depresia a respiračné zlyhanie, bronchospazmus
Poruchy kože a podkožného tkaniva:alopécia, psoriatiformná dermatitída, multiformný erytém, hyperhidróza, madaróza, pruritus a vyrážka
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovaniePredávkovanie liekom BOTOX Allergan Units je relatívny pojem a závisí na dávke, oblasti vpichu a vlastnostiach tkaniva pod miestom vpichu. Nebol hlásený žiadny prípad systémovej toxicity, ktorý by bol vyvolaný injekčným podaním lieku BOTOX Allergan Units. Zvýšené dávky môžu spôsobiť lokálnu alebo vzdialenú celkovú a silnú neuromuskulárnu paralýzu. Nebol hlásený žiadny prípad požitia lieku BOTOX Allergan Units. Bezprostredne po injekcii nie sú viditeľné známky predávkovania. Pokiaľ dôjde k náhodnej injekcii alebo požitiu lieku alebo podozreniu na predávkovanie, je nutné u pacienta niekoľko dní sledovať známky a príznaky systémovej slabosti v miestach vzdialených od miesta vpichu, čo môže zahŕňať ptózu, diplopiu, dysfágiu, dysartriu celkovú slabosť alebo respiračné zlyhanie. Títo pacienti by mali podstúpiť ďalšie lekárske posúdenie a mala by byť okamžite zavedená príslušná liečba, ktorá môže zahrňovať i hospitalizáciu.
Pri postihnutí svaloviny orofaryngu a pažeráka môže dôjsť k aspirácii, ktorá môže viesť k vzniku aspiračnej pneumónie. Ak vznikne paralýza dýchacích svalov alebo výrazné oslabenie, je potrebná, pokiaľ nedôjde k úprave, intubácia a riadené dýchanie a možno vznikne potreba tracheotomie a dlhotrvajúcej mechanickej ventilácie, ako dodatok všeobecnej podpornej liečby.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Fakmakodynamické vlastnostiFarmakoterapeutická skupina: Myorelaxancium, iné periférne pôsobiace myorelaxanciá, iný dermatologický prípravok
ATC kód: M03AX01
Komplex neurotoxínu Clostridium botulinum typ A blokuje periférne uvoľnenie acetylcholínu na presynaptických zakončeniach cholinergných nervov štiepením SNAP-25, proteínov nevyhnutných k úspešnému spojeniu a uvoľneniu acetylcholínu z vezikúl v nervových zakončeniach.
Po injekcii sa toxín rýchlo a s vysokou afinitou viaže na špecifické receptory bunkového povrchu. Potom nasleduje prenos toxínu cez plazmatickú membránu receptormi sprostredkovanou endocytózu. Nakoniec sa toxín uvoľňuje do cytozolu. Tento neskorší proces je uskutočnený postupnou inhibíciou acetylcholinu, klinické príznaky sa prejavujú behom 2-3 týždňov, s maximálnym účinkom 5-6 týždňov po injekcii.
Zotavenie po intramuskulárnej injekcii nastáva obvykle behom 12 týždňov, keď nervové zakončenia vyrastú a znovu sa spoja s koncovou platničkou. U pacientov, ktorým bolo do podpazušia intradermálne podaných 50 Units (cieľom sú ekkrinné potné žľazy), trval účinok priemerne 7,5 mesiaca po podaní prvej injekcie. Najviac u 27,5% pacientov trval účinok 1 rok a viac. Zotavenie nervových zakončení sympatika, ktorý inervuje potné žľazy, nebolo po intradermálnom podaní lieku BOTOX študované.
Neurotoxínový komplex lieku BOTOX je odvodený z novej bunkovej banky (Master Cell Bank). Nový prípravok BOTOX Allergan Units preukázal u dospelých v klinických štúdiách podobnú účinnosť v dávkach, ako predchádzajúci liek BOTOX Allergan Units. U detí neboli vykonané žiadne klinické štúdie s novým prípravkom.
Po injekcii do detruzora BOTOX ovplyvňuje činnosť eferentných dráh detruzora inhibíciou uvoľňovania acetylcholínu. Okrem toho BOTOX inhibuje aferentné neurotransmitery a senzorické dráhy.
KLINICKÉ ŠTÚDIEPrimárna hyperhidróza axílDvojito zaslepená multicentrická klinická štúdia bola uskutočnená u pacientov s perzistujúcou bilaterálnou primárnou hyperhidrózou, ktorá bola definovaná na základe gravimetrického merania za týchto podmienok: najmenej 50 mg spontánnej produkcie potu v každej axile za 5 minút pri izbovej teplote v kľude. 320 pacientov bolo randomizovaných tak, že 242 z nich dostalo 50 jednotiek lieku BOTOX a 78 placebo. Respondenti na liečbu boli tí, u ktorých došlo minimálne k 50% zníženiu axilárneho potenia oproti východziemu stavu. Pri prvom hodnotení 4 týždne po aplikácii bol podiel respondentov v skupine s liekom BOTOX 93,8% oproti 35,9% v skupine s placebom (p<0,001). Incidencia respondentov medzi pacientami v skupine s liekom BOTOX bola naďalej signifikantne vyššia (p<0,001), než u pacientov liečených placebom po celú dobu až do 16.týždňa.
Nasledujúca otvorená štúdia zahŕňa 207 vhodných pacientov, ktorí dostali až 3 kúry lieku BOTOX. Dve štúdie trvajúce 16 mesiacov (dvojito zaslepená 4 mesiace, pokračujúca otvorená 12 mesiacov) dokončilo celkom 174 pacientov. Incidencia klinických odpovedí v 16. týždni nasledujúcej po 1. kúre (n=287), 2. kúre (n=123) a 3. kúre (n=30) bola 85,0%, 86,2% a 80%. Priemerná doba trvania účinku vo všetkých štúdiách bola 7,5 mesiaca po prvej kúre, avšak u 27,5% pacientov trval účinok 1 rok a viac.
K dispozícii sú len obmedzené skúsenosti z klinických štúdií o použití lieku BOTOX v primárnej hyperhidróze axíl u detí vo veku od 12 do 18 rokov. Jediná, ročná, nekontrolovaná, bezpečnostná štúdia s opakovaným podávaním bola vykonaná u amerických detských pacientov vo veku 12 až 17 rokov (N = 144) s ťažkou primárnou hyperhidrózou axíl. Pacienti boli prevažne ženy (86,1%) a belosi (82,6%). Pacienti boli liečení dávkou 50 U na axilu pri celkovej dávke 100 U na pacienta za kúru. Avšak štúdie u mladistvých pri tomto dávkovaní neboli vykonané, takže žiadne odporúčanie ohľadom dávkovania nie je určené. Účinnosť a bezpečnosť lieku BOTOX v tejto skupine nebola presvedčivo preukázaná.
Hyperaktívny močový mechúrDve dvojito zaslepené, randomizované, multicentrické náhodné klinické štúdie 3. fázy s kontrolou placeba boli uskutočnené u pacientov s hyperaktívnym močovým mechúrom s príznakmi urinárnej inkontinencie, urgencie a frekvencie. Celkovo 1105 pacientov, ktorých príznaky neboli adekvátne liečené anticholínergickou liečbou (neadekvátna odpoveď alebo neznesiteľné nežiaduce účinky), boli randomizovaní tak, že dostávali buď 100 jednotiek lieku BOTOX (n=557) alebo placebo (n=548).
V oboch štúdiách boli zaznamenané podstatné zlepšenia v porovnaní s placebom v zmene od základnej úrovne v dennej frekvencii urinárnych epizód inkontinencie v prospech lieku BOTOX (100 jednotiek) v časovom primárnom bode v 12. týždni vrátane pomeru kontinentných pacientov. Použitím Stupnice Liečebného Prínosu bol podiel pacientov, ktorí pozitívne reagovali na liečbu (ich stav sa 'výrazne zlepšil' alebo 'zlepšil') podstatne vyšší v BOTOX skupine v porovnaní v placebo skupinou v oboch štúdiách. Boli zaznamenané výrazné zlepšenia v porovnaní s placebom u dennej frekvencie močenia, urgencie a epizód noktúria. Objem močenia bol tiež podstatne vyšší. Od 2. týždňa bolo zaznamenané podstatné zlepšenie u všetkých príznakov hyperaktívneho močového mechúra..
V porovnaní s placebom boli zaznamenané podstatné zlepšenia aj vo vykazovanom skóre pacientov týkajúcom sa kvality života súvisiacej s inkontinenciou podľa meraní Dotazníkom Kvality Života pri Inkontinencii (I-QOL) (vrátane vyhýbavého obmedzujúceho správania, psychosociálneho vplyvu a sociálneho strápnenia) a Kráľovským Zdravotným Dotazníkom (KHQ) (vrátane vplyvu inkontinencie, obmedzenia úloh, sociálne obmedzenia, fyzické obmedzenia, osobné vzťahy, emócie, meranie spánku/energie a zaťaženia/zvládania).
Neboli zistené žiadne celkové rozdiely v účinnosti liečbou liekom BOTOX u pacientov ≥ 65 rokov v porovnaní s pacientmi < 65 rokov.
Výsledky zhrňujúcich pivotných štúdií sú uvedené nižšie:
Primárne a sekundárne koncové body na začiatku a zmena od začiatku v zhrňujúcich pivotných štúdiách:
| Botox'
100 jednotiek
(N=557)
| Placebo
(N=548)
| hodnoty P
|
Týždenná frekvencia epizód urinárnej inkontinencie*
|
|
|
|
Priemerný základ
| 5.49
| 5.39
|
|
Priemerný základ v týždni 2
| -2.85
| -1.21
| < 0.001
|
Priemerný základ v týždni 6
| -3.11
| -1.22
| < 0.001
|
Priemerný základ v týždni12a
| -2.80
| -0.95
| < 0.001
|
Pomer s pozitívnou odpoveďou na liečbku použitím Stupnice liečebného prínosu (%)
|
|
|
|
Týždeň 2
| 64.4
| 34.7
| < 0.001
|
Týždeň 6
| 68.1
| 32.8
| < 0.001
|
Týždeň 12a
| 61.8
| 28.0
| < 0.001
|
Denná frekvencia epizód močenia
|
|
|
|
Priemerný základ
| 11.99
| 11.48
|
|
Priemerný základ v týždni 2
| -1.53
| -0.78
| < 0.001
|
Priemerný základ v týždni 6
| -2.18
| -0.97
| < 0.001
|
Priemerný základ v týždni12b
| -2.35
| -0.87
| < 0.001
|
Denná frekvencia naliehavých epizód
|
|
|
|
Priemerný základ
| 8.82
| 8.31
|
|
Priemerný základ v týždni 2
| -2.89
| -1.35
| < 0.001
|
Priemerný základ v týždni 6
| -3.56
| -1.40
| < 0.001
|
Priemerný základ v týždni12b
| -3.30
| -1.23
| < 0.001
|
Celkové skóre inkontinencia kvality života
|
|
|
|
Priemerný základ
| 34.1
| 34.7
|
|
Priemerný základ v týždni12bc
| +22.5
| +6.6
| < 0.001
|
Kráľovský zdravotný dotazník: obmedzenia úloh
|
|
|
|
Priemerný základ
| 65.4
| 61.2
|
|
Priemerný základ v týždni12bc
| -25.4
| -3.7
| < 0.001
|
Kráľovský zdravotný dotazník: sociálne obmedzenia
|
|
|
|
Priemerný základ
| 44.8
| 42.4
|
|
Priemerný základ v týždni12bc
| -16.8
| -2.5
| < 0.001
|
* Percentuálny podiel pacientov bez inkontinencie v 12. týždni bol 27,1 % v skupine lieku BOTOX a 8,4 % v skupine placebo. Pomery dosahujúce 75 % a 50% zníženie epizód inkontinencie v porovnaní so začiatkom boli 46,0 % a 60,5 % v skupine lieku BOTOX v porovnaní so 17,7% a 31,0% v placebo skupine.
a Druhé primárne koncové body
b Sekundárne koncové body
c Vopred definované minimálne dôležité zmeny od základu bolo +10 bodov pre I-QOL a -5 bodov pre KHQ
Medián trvania reakcie po liečbe liekom BOTOX na základe požiadania pacienta o opätovnú liečbu, bol 166 dní (približne 24 týždňov).
Len limitovaný počet pacientov mladších ako 40 rokov (n=88, 8.0%), mužov (n= 135, 12.2%) a pacientov nekavkazského pôvodu (n=101, 9.1%) bolo zaradených do štúdie 3. fáze. Dáta z týchto podskupín slúžila len ako podporné pre potvrdenie priaznivého terapeutického efektu.
Vyššia incidencia nežiaducich príhod - retencia moču, reziduálny objem moču a polakisuria boli pozorované u mužov v porovnaní so ženami. Výsledky ko-primárních parametrov pre mužov sú uvedené v nasledujúcej tabuľke:
Ko-primárne cieľové parametre účinnosti vo východzom stave a zmena oproti východziemu stavu podľa súhrnu pivotných štúdií u mužských pacientov:
| BOTOX 100 jednotiek
(N = 61)
| Placebo
(N = 74)
| Hodnota p
|
Denná frekvencia prípadov inkotinencie
|
|
|
|
Priemerný východzí stav
| 5,61
| 4,33
|
|
Priemerná zmena v 12. týždni
| -1,86
| -1,23
| 0,612
|
Podiel pozitívnej liečebnej odpovede s použitím stupnice liečebného prínosu (%)
|
|
|
|
12. týždeň
| 40,7
| 25,4
| 0,060
|
Celkovo 839 pacientov bolo hodnotených v dlhodobej rozšírenej štúdii (n= 758 žien, n=81 mužov). Pre všetky cieľové parametre účinnosti došlo u pacientov ku konzistentnej odpovedi na opakovanú liečbu.
V podskupine 345 pacientov ( n= 316 žien, n= 29 mužov), ktorí dosiahli 12. týždeň liečby (3. cyklus liečby), priemerné denné zníženie výskytu močovej inkontinencie bolo postupne
-3,07, -3,49 a -3,49 epizód v 12. týždni po prvej, druhej a tretej aplikácii 100 jednotiek lieku BOTOX.
Zodpovedajúci podiel pacientov s pozitívnou odpoveďou na liečbu pri použití stupnice liečebného prínosu bol 63,6%, 76,9%, a 77,3%.
V pivotných štúdiách nedošlo u žiadneho zo 615 pacientov s analyzovanými vzorkami k tvorbe neutralizačných protilátok.
Urinárna inkontinencia spôsobená neurogénnou hyperaktivitou detruzoraDve dvojito zaslepené multicentrické náhodné klinické štúdie 3. fázy s kontrolou placeba boli uskutočnené u pacientov s urinárnou inkontinenciou spôsobenou neurogénnou hyperaktivitou detruzora, ktorí sa buď spontánne vyprázdňovali alebo používali katetrizáciu. Celkovo bolo zaradených 691 pacientov s poranením miechy a sklerózou, ktorí neboli adekvátne liečení najmenej jedným anticholínergickým činiteľom. Títo pacienti boli randomizovaní tak, že dostávali buď 200 jednotiek lieku BOTOX (n=227), 300 jednotiek lieku BOTOX (n=223) alebo placebo (n=241).
V oboch štúdiách 3. fázy boli zaznamenané podstatné zlepšenia v porovnaní s placebom vo variabilite zmeny primárnej účinnosti od začiatku v týždňovej frekvencii epizód inkontinencie v prospech lieku BOTOX (200 jednotiek a 300 jednotiek) v časovom bode primárnej účinnosti v 6. týždni vrátane percentuálneho podielu kontinentných pacientov. Boli zaznamenané podstatné zlepšenia urodynamických parametrov vrátane zvýšenia maximálnej cystometrickej kapacity a zníženia najvyššieho tlaku detruzora počas prvej mimovoľnej kontrakcie detruzora. V porovnaní s placebom boli zaznamenané podstatné zlepšenia aj vo vykazovanom skóre pacientov týkajúcom sa kvality života súvisiacej s inkontinenciou podľa meraní dotazníkom kvality života pri inkontinencii (I-QOL) (vrátane vyhýbavého obmedzujúceho správania, psychosociálneho vplyvu a sociálneho strápnenia). Nebola preukázaná žiadna výhoda pri podaní 300 jednotiek lieku BOTOX v porovnaní s 200 jednotkami.
Súhrnný výsledky pivotných štúdií sú uvedené nižšie:
Primárne a sekundárne koncové body na začiatku a zmena od začiatku v zhrňujúcich pivotných štúdiách:
| BOTOX 200 jednotiek
(N=227)
| Placebo
(N=241)
| hodnoty p
|
Týždenná frekvencia urinárnej inkontinencie*
Priemerný základ
Priemerná zmena v 2. týždni
Priemerná zmena v 6a. týždni
Priemerná zmena v 12. týždni
|
32,4
-17,7
-21,3
-20,6
|
31,5
-9,0
-10,5
-9,9
|
p<0,001
p<0,001
p<0,001
|
Maximálna cystometrická kapacita (v ml)
Priemerný základ
Priemerná zmena v 6b. týždni
|
250,2
+153,6
|
253,5
+11,9
|
p<0,001
|
Maximálny tlak detruzora počas 1. mimovoľnej kontrakcie detruzora (v cmH20)
Priemerný základ
Priemerná zmena v 6b. týždni
|
51,5
-32,4
|
47,3
+1,1
|
p<0,001
|
Celkové skóre kvality života pri inkontinenciic,d
Priemerný základ
Priemerná zmena v 6b. týždni
Priemerná zmena v 12. týždni
|
35,37
+25,89
+28,89
|
35,32
+11,15
+8,86
|
p<0,001
p<0,001
|
*Percentuálny podiel suchých pacientov (kontinentných) v 6. týždni bol 37 % v skupine 200 jednotiek lieku BOTOX a 9 % v skupine placebo. Pomery dosahujúce aspoň 75 % zníženie epizód inkontinencie v porovnaní so začiatkom boli 63 % a 24 %. Pomery dosahujúce aspoň 50 % zníženie v porovnaní so začiatkom boli 76 % a 39 %. a Primárny koncový bodb Sekundárne koncové bodyc I-QOL škála celkového skóre je od 0 (maximálny problém) do 100 (vôbec žiadny problém). d V pivotných štúdiách bol vopred určený minimálny významný rozdiel (MID) v celkovom skóre I-QOL 8 bodov na základe odhadov MID v škále 4 – 11 bodov vykazovaných pacientmi s neurogénnou hyperaktivitou detruzora.Medián trvania reakcie v dvoch pivotných štúdiách na základe požiadania pacienta o opätovnú liečbu bol 256 – 295 dní (36 – 42 týždňov) v skupine s dávkou 200 jednotiek v porovnaní s 92 dňami (13 týždňami) v skupine placeba.
V prípade všetkých koncových bodov účinnosti mali pacienti konzistentnú reakciu pri opätovnej liečbe.
V pivotných štúdiách sa u žiadneho zo 475 pacientov s neurogénnou hyperaktivitou detruzora v analyzovaných vzorkách nevyvinuli neutralizujúce protilátky.
Prevencia chronickej migrényBOTOX blokuje uvoľňovanie neurotransmiterov súvisiacich so vznikom bolesti. Odhadovaný mechanizmus prevencie bolesti hlavy je blokovanie prenosu periférnych signálov do centrálnej nervovej sústavy, ktorá potláča centrálnu senzibilizáciu, ako bolo preukázané v predklinických a klinických štúdiách.
Pacienti s chronickou migrénou bez sprievodnej liečby bolesti hlavy, ktorí boli sledovaní v 2. fáze 3. klinickej štúdie mali počas 28 dní viac ako 50% obdobia s bolesťou hlavy/pravdepodobnou bolesťou hlavy a viac ako 4 epizódami bolesti hlavy. Pacientom bolo dovolené použiť akútnu liečbu bolesti hlavy (65.5% užívalo lieky proti akútnej bolesti počas východiskovej fázi).
Liečba liekom BOTOX ukázala štatisticky signifikantné (p<0.001) a klinicky významné zlepšenie v porovnaní s placebom a to 50%-né zníženie dní s bolesťou hlavy, týka sa to frekvencie stredných /vážnych dní s bolesťou hlavy a celkové množstvo hodín bolesti hlavy v dni, kedy sa bolesť vyskytla. Fungovanie pacientov, vitalita, psychická úzkosť a celková kvalita života bola signifikantne zlepšená (p<0.001) v porovnaní s placebom ako preukázal Headache Impact Test (HIT6).
Glabelárne vráskyV klinických štúdiách bolo zahrnutých 537 pacientov s miernymi až hlbokými vertikálnymi vráskami medzi obočím (glabelárne vrásky) viditeľnými počas maximálneho mračenia sa.
Injekcie BOTOX významne redukovali hĺbku glabelárnych vrások pozorovaných pri maximálnom mračení sa až do 4 mesiacov podľa hodnotení skúšajúcich lekárov, ktorí stanovovali hĺbku glabelárnych vrások pri maximálnom mračení sa, a podľa všeobecného pacientovho hodnotenia zmeny vzhľadu jeho/jej vertikálnych vrások medzi obočiami (glabelárne vrásky) pozorovaných pri maximálnom mračení sa. Žiadne klinické cieľové ukazovatele nezahrňovali objektívne hodnotenie psychologického vplyvu. Tridsať dní po podaní injekcie bolo 80 % (325/405) pacientov liečených BOTOXom považovaných skúšajúcimi lekármi za odpovedajúcich na liečbu (žiadna alebo mierna hĺbka pri maximálnom mračení sa), v porovnaní s 3 % (4/132) pacientov liečených placebom. V tom istom časovom bode hlásilo 89 % (362/405) pacientov liečených BOTOXom mierne alebo výraznejšie zlepšenie v porovnaní so 7 % (9/132) pacientov liečených placebom.
Injekcie BOTOX tiež významne redukovali hĺbku glabelárnych vrások v pokoji, keď sa pacienti nemračili. Z 537 pacientov zúčastňujúcich sa štúdie malo v pokoji 39 % (210/537) stredné až hlboké glabelárne vrásky (15 % nemalo v pokoji žiadne línie). V tejto skupine bolo 74 % (119/161) BOTOXom liečených pacientov považovaných za odpovedajúcich na liečbu tridsať dní po podaní injekcie (žiadna alebo mierna hĺbka vrások) v porovnaní s 20 % (10/49) placebom liečenými pacientmi.
K dispozícii sú obmedzené údaje z klinických štúdií fázy 3 s BOTOXom u pacientov starších ako 65 rokov. Len 6,0 % (32/537) osôb boli vo veku >65 rokov a výsledky účinnosti boli v tejto populácii nižšie.
Vrásky očného kútika v tvare stopy vrany (Crow´s feet vrásky)Do štúdie bolo zaradených bolo 1 362 pacientov s miernymi až hlbokými vráskami okolo očí v tvare stopy vrany pri maximálnom úsmeve buď samostatnými ((N=445, štúdia 191622-098) alebo s miernymi až hlbokýmiglabelárnymi vráskami pri maximálnom mračení sa (N=917, štúdia 191622-099).
Injekcie lieku BOTOX významne znížili závažnosť vrások okolo očí v tvare stopy vrany pozorovaných pri maximálnom úsmeve v porovnaní s placebom vo všetkých časových bodoch (p<0.001) po dobu až 5 mesiacov. To bolo merané podľa podielu pacientov, ktorí dosiahli hodnotenie závažnosti vrások okolo očí buď žiadne, alebo mierne pri maximálnom úsmeve v oboch pivotných štúdiách; do dňa 150 (ukončenie štúdie) v štúdii 191622-098 a do dňa 120 (ukončenie prvého liečebného cyklu) v štúdii 191622-099). Pri hodnotení skúšajúcim aj samotným pacientom bol podiel pacientov dosahujúcich žiadnu alebo miernu závažnosť vrások očného kútika v tvare stopy vrany pozorovaných pri maximálnom úsmeve, vyšší u pacientov s miernymi vráskami v tvare stopy vrany pri maximálnom úsmeve na začiatku liečby než u pacientov s hlbokými vráskami v tvare stopy vrany pri maximálnom úsmeve na začiatku liečby.
Tabuľka 1 zahŕňa výsledky na deň 30, čo bol časový bod primárneho cieľového ukazovateľa účinnosti.
V štúdii 191622-104 (predĺženie štúdie 191622-099) bolo zaradených 101 pacientov, v predošlej štúdii randomizovaných do skupiny s placebom, ktorí ako prvú liečbu dostali dávku 44 U. U pacientov liečených prípravkom BOTOX bol zaznamenaný na deň 30 po ich prvej aktívnej liečbe štatisticky významný prínos v primárnom cieľovom ukazovateli účinnosti v porovnaní s placebom. Miera odpovede bola podobná ako v skupine 44 jednotiek v deň 30 po prvej liečbe v štúdii 191622-099.
Štyri cykly lieku BOTOX v dávke 44 jednotiek na liečbu vrások očného kútika v tvare stopy vrany a glabelárnych vrások boli podané celkovo 123 pacientom.
Deň 30: Hodnotenie Crow´s feet vrások pri maximálnom úsmeve uskutočnené skúšajúcim a pacientom - percento odozvy (% pacientov, ktorí dosiahli hodnotenie závažnosti Crow´s feet vrások žiadne alebo mierne). Klinická štúdia
| Dávka
| BOTOX
| Placebo
| BOTOX
| Placebo
|
Hodnotenie skúšajúcim
| Hodnotenie pacientom
|
191622-098
| 24 U
(vrásky v tvare stopy vrany)
| 66,7%*
(148/222)
| 6,7%
(15/223)
| 58,1%*
(129/222)
| 5,4%
(12/223)
|
191622-099
| 24 U
(vrásky v tvare stopy vrany)
| 54,9%*
(168/306)
| 3,3%
(10/306)
| 45,8%*
(140/306)
| 3,3%
(10/306)
|
| 44 U
(24 U vrásky v tvare stopy vrany;
20 U glabelárne vrásky)
| 59,0%*
(180/305)
| 3,3%
(10/306)
| 48,5%*
(148/305)
| 3,3%
(10/306)
|
*p<0,001 (BOTOX vs placebo)
Zlepšenie vzhľadu vrások v tvare stopy vrany pri maximálnom úsmeve od východzieho stavu, hodnotené subjektom, bolo štatisticky významné (p<0,001) pre BOTOX (24 jednotiek a 44 jednotiek) v porovnaní s placebom v deň 30 a vo všetkých časových bodoch po každom liečebnom cykle v oboch pivotných štúdiách.
Liečba 24 U lieku BOTOX tiež výrazne znížila závažnosť vrások očného kútika v tvare stopy vrany v pokojnom stave. Z 528 liečených pacientov 63 % (330/528) malo mierne až hlboké vrásky očného kútika v tvare stopy vrany pri východiskovom stave. 58 % (192/330) z nich, ktorí boli liečení liekom BOTOX, boli považovaní za pacientov s odpoveďou na liečbu (žiadna alebo mierna závažnosťvrások) tridsať dní po podaní injekcie v porovnaní s 11 % (39/352) pacientov liečených placebom.
Zlepšenia v pacientských hodnoteniach veku a príťažlivosti boli takisto pozorované pri lieku BOTOX (24 U a 44 U) v porovnaní s placebom pri použití dotazníka na zistenie výsledkov tvárových vrások (FLO-11) v 30. deň, čo je časový bod primárneho cieľového ukazovateľa, (p<0,001) a vo všetkých následných časových bodoch v obdivoch kľúčových štúdiách.
V pivotných štúdiách bolo 3,9 % (53/1 362) pacientov starších ako 65 rokov. Pacienti v tejto vekovej skupine mali odpoveď na liečbu BOTOXOM (24 jednotiek a 44 jednotiek) podľa hodnotení skúšajúcim 36 % (v deň 30).. Pri analýze podľa vekových skupín ≤ 50 rokov a > 50 rokov vykázali obidve populácie štatisticky významné zlepšenie v porovnaním s placebom. Odpoveď na liečbu liekom BOTOX v dávke 24 jednotiek, hodnotená skúšajúcim, bola nižšia v skupine subjektov vo veku > 50 rokov ako u subjektov vo veku ≤ 50 rokov (42,0% a 71,2% v uvedenom poradí).
Celková odpoveď na liečbu liekom BOTOX je pri vráskach očného kútika v tvare stopy vrany viditeľných pri maximálnom úsmeve nižšia (60%) ako odpoveď na liečbu pozorovaná pri liečbe glabelárnych vrások viditeľných pri maximálnom mračení sa (80%).
U 916 pacientov (517 pacientov s dávkou 24 jednotiek a 399 pacientov s dávkou 44 jednotiek) liečených liekom BOTOX bola vo vzorkách analyzovaná tvorba protilátok. U žiadneho pacienta sa nevytvorili neutralizujúce protilátky.
5.2 Farmakokinetické vlastnostia) Všeobecná charakteristika liečivaŠtúdie distribúcie u potkanov naznačujú pomalú difúziu botulotoxínu typu A označeného I
125 po injekcii do m. gastrocnemius, po ktorom nasledoval rýchly systémový metabolizmus a vylúčenie močom. Množstvo rádioaktívne znečisteného materiálu vo svale sa znížilo na polovicu za približne 10 hodín. V mieste vpichu sa rádioaktivita viazala na veľké molekuly proteínov, zatiaľ čo v plazme sa viazala na malé molekuly, čo naznačuje rýchly systémový metabolizmus substrátu. Behom 24 hodín od podania dávky je 60% rádioaktivity vylúčeného močom. Toxín sa pravdepodobne metabolizuje proteázami a molekulárne zložky sa opätovne využijú v normálnej metabolickej ceste.
Klasické štúdie absorpcie, distribúcie, biotransformácie a eliminácie účinnej látky neboli vzhľadom k povahe lieku vykonané.
b) Charakteristika po podaní u pacientovJe pravdepodobné, že môže nastať malá systémová distribúcia terapeutických dávok lieku BOTOX. Klinické štúdie používajúce elektromyografickú techniku ukázali zvýšenie elektrofyziologickej neuromuskulárnej aktivity vo svaloch vzdialených od miesta injekcie, ktorá nebola sprevádzaná klinickými príznakmi.
5.3 Predklinické údaje o bezpečnostiReprodukčná štúdiaPokiaľ je gravidným myšiam, potkanom a králikom podaný intramuskulárne BOTOX behom obdobia organogenézie, vývoj bez nežiaducich účinkov (NOAEL) bol pri 4,1 resp. 0,125 jednotiek/kg. Vyššie dávky boli spojené s redukciou fetálnej hmotnosti alebo s oneskorenou osifikáciou a u králikov boli zaznamenané potraty.
Fertilita a reprodukciaReprodukčné NOAEL následkom i.m. injekcie lieku BOTOX bolo 4 jednotky/kg u samcov potkanov a 8 Units/ kg u samíc potkanov. Vyššie dávky boli spojené v závislosti na dávke so znížením fertility. Za predpokladu, že došlo k impregnácii, neboli preukázané žiadne nežiaduce účinky na množstvo alebo životaschopnosť embryí splodených alebo určených na liečenie samcov a samíc potkanov.
Ďalšie štúdieOkrem reprodukčnej toxikológie boli uskutočnené nasledujúce štúdie vo vzťahu k bezpečnosti lieku BOTOX: akútna toxicita, toxicita po opakovanej aplikácii, lokálna tolerancia, mutagenicita, antigenicita, kompatibilita s ľudskou krvou. Behom štúdií použitia klinicky relevantnej dávky sa neobjavilo žiadne zvláštne riziko pre ľudí. Maximálna odporúčaná dávka u ľudí behom jednej kúry je 300 jednotiek (zodpovedá 6 jednotiek/kg u osoby s hmotnosťou 50 kg). Publikovaná intramuskulárna LD
50 u juvenilných opíc je 39 jednotiek/kg.
Nebola zaznamenaná systémová toxicita u potkanov pri podaní jednej injekcie do detruzora <50 jednotiek/kg lieku BOTOX. Neboli zistené nežiaduce klinické účinky pri simulácii neúmyselnej injekcie, keď bola podaná jedna dávka lieku BOTOX (približne 7 jednotiek/kg) do prostatickej časti močovej rúry a proximálneho rekta, semenných vačkov a steny močového mechúra alebo maternice opíc (~3 jednotky/kg). V 9-mesačnej štúdii opakovanými injekciami do detruzora (4 injekcie) bola zaznamenaná ptóza pri dávkach 24 jednotiek/kg a úmrtnosť pri dávkach ≥24 jednotiek/kg. U opíc neboli zaznamenané žiadne nežiaduce účinky pri dávkach 12 jednotiek/kg, čo zodpovedá 3-násobne vyššej expozícii lieku BOTOX ako pri odporúčanej klinickej dávke 200 jednotiek na liečbu urinárnej inkontinencie spôsobenej neurogénnou hyperaktivitou detruzora (pre 50 kg osobu).
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokľudský albumín
chlorid sodný
6.2 InkompatibilityPretože neboli vykonané štúdie inkompatibility, nesmie byť tento liek miešaný so žiadnymi ďalšími liekmi.
6.3 Čas použiteľnostiNeotvorená injekčná liekovka lieku BOTOX a BOTOX 50 Allergan Units má čas použiteľnosti 3 roky.
Neotvorená injekčná liekovka lieku BOTOX 200 Allergan Units má čas použiteľnosti 3 roky.
Po rekonštitúcii v liekovke bola preukázaná stabilita po dobu 24 hodín pri teplote 2 °C až 8°C.
6.4 Upozornenie na podmienky a spôsob skladovaniaNeotvorené injekčné liekovky musia byť skladované v mraziacich boxoch pri teplotách –5°C a nižšej, alebo v chladničke pri teplote 2°C až 8 °C.
Uchovávanie lieku po rekonštitúcii: pozri bod 6.3.
Mikrobiologické štúdie a štúdie na účinnosť dokazujú, že rekonštituovaný roztok lieku môže byť skladovaný až do 5 dní pri teplote 2°C až 8°C.
Pretože liek neobsahuje konzervačné látky, doba skladovania a podmienky, za ktorých sa liek používa sú na zodpovednosti používateľa a rekonštituovaný roztok nemá byť skladovaný dlhšie ako 24 hodín pri teplote 2°C až 8°C.
6.5 Vlastnosti a zloženie obaluBOTOX 50 Allergan UnitsInjekčná liekovka z bezfarebného skla uzatvorená gumenou zátkou a hliníkovou pertľou s transparentným povrchom a s popisom Allergan 50 Units.
Veľkosť balenia: 1, 2, 3 alebo 6 injekčných liekoviek (5 ml)
Na trh nemusia byť uvedené všetky veľkosti balenia.
BOTOXInjekčná liekovka z bezfarebného skla uzatvorená gumenou zátkou a hliníkovou pertľou s transparentným povrchom a s popisom Allergan 100 Units.
Veľkosť balenia: 1 a 4 injekčné liekovky (10 ml)
Na trh nemusia byť uvedené všetky veľkosti balenia.
BOTOX 200 Allergan UnitsInjekčná liekovka z bezfarebného skla uzatvorená gumenou zátkou a hliníkovou pertľou s transparentným povrchom a s popisom Allergan 200 Units.
Veľkosť balenia: 1, 2, 3 a 6 injekčných liekoviek (10 ml)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzania s liekomOdporúča sa pripravovať roztok a plniť injekčnú striekačku na podložke z buničitej vaty, ktorá zachytí prípadné vystreknutie roztoku. BOTOX sa rekonštituuje sterilným fyziologickým roztokom bez konzervačných látok 9 mg/ml (0,9% chlorid sodný na injekciu). Pripravte si príslušné množstvo rozpúšťadla do striekačky (pozri časť 4.2).
Rozpúšťadlo sa smie do injekčnej liekovky aplikovať len veľmi opatrne, pretože bublinkami alebo prudkým miešaním stráca BOTOX účinnosť. Nepoužívajte a znehodnoťte injekčnú liekovku, ak rozpúšťadlo nie je vtiahnuté vákuom do injekčnej liekovky. Rekonštituovaný roztok lieku BOTOX je číry, bezfarebný až svetlo žltý roztok bez drobných častíc alebo zrazenín. Rekonštituovaný roztok lieku BOTOX by mal byť pred podaním vizuálne skontrolovaný (číry a bez častíc). Rekonštituovaný roztok lieku BOTOX sa pred podaním môže uchovávať v chladničke (pri teplote 2-8°C) najdlhšie 24 hodín. Dátum a čas rekonštitúcie má byť zaznamenaný na obale. Po rekonštitúcii lieku BOTOX na intradetrúzorovú injekciu v injekčnej striekačke ho ihneď spotrebujte. Liek je určený k jednorazovému použitiu, nespotrebovaný roztok je potrebné znehodnotiť.
Pre bezpečnú likvidáciu musia byť nepoužité injekčné liekovky po rekonštituovaní malým množstvom vody autoklávované.
Použité injekčné liekovky, striekačky, rozliaty roztok atď. by mali byť autoklávované alebo zvyšok lieku BOTOX inaktivovaný 0,5% roztokom chlórnanu po dobu 5 minút.
Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAllergan Pharmaceuticals Ireland, Westport, Írsko
8. REGISTRAČNÉ ČÍSLABOTOX 50 Allergan Units: 63/0604/09-S
BOTOX: 63/0021/93-S
BOTOX 200 Allergan Units: 63/0465/11-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEBOTOX 50 Allergan UnitsDátum prvej registrácie: 21. 10. 2009
Dátum posledného predĺženia registrácie:
BOTOX Dátum prvej registrácie: 08. 06. 1993
Dátum posledného predĺženia registrácie: 30.6.2004
BOTOX 200 Allergan UnitsDátum prvej registrácie: 18. 07. 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUJúl 2014