
dávka liečiv v pľúcach, stlačenie inhalátora sa musí koordinovať s inhaláciou.
Pacienti, ktorí majú ťažkosti s koordináciou stlačenia inhalátora s vdychovaním vzduchu, môžu používať Bevespi Aerosphere s inhalačným nadstavcom, aby sa zabezpečilo správne podanie lieku. Preukázala sa kompatibilita s inhalačným nadstavcom Aerochamber Plus Flow-Vu (pozri časť 5.2).
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Astma
Bevespi Aerosphere sa nemá používať na liečbu astmy.
Paradoxný bronchospazmus
V klinických štúdiách sa pri odporúčanej dávke Bevespi Aerosphere nepozoroval paradoxný
bronchospazmus. Pri výskyte paradoxného bronchospazmu sa má liečba liekom ukončiť a majú sa zvážiť iné liečby.
Nevhodnosť na akútne použitie
Bevespi Aerosphere nie je indikovaný na liečbu akútnych epizód bronchospazmu, t.j. ako záchranná
liečba.
Kardiovaskulárne účinky
Po podaní antagonistov muskarínových receptorov a sympatomimetík, vrátane glykopyrónia alebo formoterolu, sa môžu pozorovať kardiovaskulárne účinky, ako sú srdcové arytmie, napr. atriálna fibrilácia a tachykardia. Z klinických štúdií boli vylúčení pacienti s klinicky významným, nekontrolovaným kardiovaskulárnym ochorením. Bevespi Aerosphere sa má u pacientov so závažnými kardiovaskulárnymi poruchami, ako sú ischemická choroba srdca, tachyarytmie alebo závažné zlyhávanie srdca, používať s opatrnosťou.
Opatrne sa má postupovať aj u pacientov s tyreotoxikózou alebo známym, či suspektným predĺžením
QTc intervalu (pozri časť 4.5).
Hypokaliémia
β2-adrenergné agonisty môžu vyvolať významnú hypokaliémiu, ktorá môže zvýšiť náchylnosť voči srdcovým arytmiám. Pokles draslíka v sére je zvyčajne prechodný a nevyžaduje si užívanie
výživových doplnkov s obsahom draslíka. U pacientov so závažnou CHOCHP môže byť hypokaliémia zhoršená hypoxiou a súbežnou liečbou (pozri časť 4.5).
Hyperglykémia
Inhalácia vysokých dávok β2-adrenergných agonistov môže vyvolať zvýšenia plazmatickej hladiny glukózy.
Anticholinergná aktivita
Vzhľadom na svoju anticholinergnú aktivitu sa má Bevespi Aerosphere používať s opatrnosťou
u pacientov so symptomatickou hyperpláziou prostaty, retenciou moču alebo s glaukómom s úzkym uhlom (pozri časť 4.8).
Porucha funkcie obličiek
Vzhľadom na to, že glykopyrónium sa vylučuje prevažne obličkami, pacienti so závažnou poruchou
funkcie obličiek (klírens kreatinínu < 30 ml/min), vrátane pacientov s terminálnym štádiom ochorenia obličiek vyžadujúcim dialýzu, sa majú liečiť s Bevespi Aerosphere iba vtedy, ak očakávaný prínos preváži možné riziko (pozri časť 5.2).
Porucha funkcie pečene
U pacientov so závažnou poruchou funkcie pečene sa má Bevespi Aerosphere používať iba ak
očakávaný prínos preváži možné riziko (pozri časť 5.2). Týchto pacientov je potrebné sledovať pre možné nežiaduce reakcie.
4.5 Liekové a iné interakcie
Farmakokinetické interakcie
Klinické liekové interakčné štúdie s Bevespi Aerosphere sa neuskutočnili, potenciál pre metabolické
interakcie je však na základe štúdií in vitro považovaný za nízky (pozri časť 5.2).
Vzhľadom na to, že glykopyrónium sa vylučuje najmä renálnou cestou, pri liekoch ovplyvňujúcich mechanizmy renálnej exkrécie môže potenciálne dôjsť k liekovým interakciám. Glykopyrónium je substrátom renálnych transportérov OCT2 a MATE1/2K in vitro. Účinok cimetidínu, skúšobného inhibítora OCT2 a MATE1, na dispozíciu inhalačného glykopyrónia preukázal obmedzené zvýšenie jeho celkovej systémovej expozície (AUC0-t) o 22% a mierne zníženie renálneho klírensu o 23% kvôli súbežnému podávaniu cimetidínu.
Far
m
akodynamické interakcie
Iné antimuskariniká a lieky so sympatomimetickým účinkom
Súbežné podávanie Bevespi Aerosphere s inými anticholinergnými liekmi a/alebo liekmi obsahujúcimi dlhodobo pôsobiace β2-adrenergné agonisty sa neskúmalo a neodporúča sa, pretože to môže zosilniť známe nežiaduce reakcie inhalačných muskarínových antagonistov alebo
beta2-adrenergných agonistov (pozri časť 4.4 a časť 4.9).
Napriek tomu, že sa neuskutočnili žiadne formálne liekové interakčné štúdie s Bevespi Aerosphere in vivo, štúdie nenaznačujú žiadny klinický dôkaz interakcií pri súbežnom použití s inými liekmi na CHOCHP, vrátane krátkodobo pôsobiacich β2-adrenergných bronchodilatancií, metylxantínov
a perorálnych a inhalačných steroidov.
Hypokaliémia vyvolaná liekom
Súbežná liečba derivátmi metylxantínu, steroidmi alebo diuretikami nešetriacimi draslík môže zosilniť možný prvotný hypokaliemický účinok β2-adrenergných agonistov, pri ich súbežnom použití sa preto odporúča opatrnosť (pozri časť 4.4).
β-adrenergné blokátory
β-adrenergné blokátory (vrátane očných instilácií) môžu oslabiť alebo inhibovať účinok β2- adrenergných agonistov, ako je formoterol. Má sa vyhnúť súbežnému použitiu neselektívnych alebo
selektívnych β-adrenergných blokátorov, pokiaľ pre ich použitie nie sú nevyhnutné dôvody. Ak je potrebné použiť β-adrenergné blokátory (vrátane očných instlácií), uprednostňujú sa kardioselektívne β-adrenergné blokátory, hoci aj tie je potrebné podávať s opatrnosťou.
Iné farmakodynamické interakcie
Bevespi Aerosphere sa má podávať s opatrnosťou pacientom liečeným liekmi, o ktorých je známe, že
predlžujú QTc interval (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití Bevespi Aerosphere u gravidných žien.
Štúdie s jednorazovou dávkou u ľudí odhalili prechod veľmi malých množstiev glykopyrónia cez placentárnu bariéru. V štúdiách na zvieratách formoterol a glykopyrónium, ako samostatné zložky, spôsobili nežiaduce účinky v reprodukčných štúdiách pri veľmi vysokých dávkach/hladinách systémovej expozície (pozri časť 5.3).
Bevespi Aerosphere sa má používať počas gravidity iba v prípade, že očakávaný prínos preváži možné riziká.
Dojčenie
Nie je známe, či sa glykopyrónium alebo formoterol vylučujú do ľudského mlieka. Zaznamenal sa
dôkaz prechodu glykopyrónia a formoterolu do materského mlieka u potkanov.
Podávanie Bevespi Aerosphere ženám, ktoré dojčia, sa má zvážiť iba v prípade, ak je očakávaný prínos pre matku vyšší ako akékoľvek možné riziko pre dojča (pozri časť 5.3).
Fertilita
Štúdie u potkanov preukázali nežiaduce účinky na fertilitu iba pri hladinách dávky vyšších ako je
maximálna expozícia formoterolu u ľudí (pozri časť 5.3). Glykopyrónium nespôsobil žiadne nežiaduce účinky na fertilitu potkanov. Je nepravdepodobné, že Bevespi Aerosphere podávaný v odporúčanej dávke ovplyvní fertilitu u ľudí.
4.
7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Bevespi Aerosphere nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá
a obsluhovať stroje. Závrat a nauzea sú však častými vedľajšími účinkami, ktoré treba vziať do úvahy pri vedení vozidiel a obsluhe strojov.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Bezpečnostný profil je charakterizovaný anticholinergnými a β2-adrenergnými skupinovými účinkami súvisiacimi s jednotlivými zložkami kombinovaného lieku. Najčastejšie nežiaduce reakcie hlásené počas programu klinického vývoja (zahŕňajúcom 1 588 pacientov užívajúcich Bevespi Aerosphere) boli bolesť hlavy (1,9%), nevoľnosť (1,4%), svalové kŕče (1,4%) a závrat (1,3%).
Tabuľkový zoznam nežiaducich reakcií
Tabuľkový zoznam nežiaducich reakcií je založený na skúsenostiach s Bevespi Aerosphere
z klinických skúšaní a na skúsenostiach s jednotlivými zložkami.
Frekvencie nežiaducich reakcií sú odvodené podľa nasledujúceho pravidla: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
Tabuľka 1: Nežiaduce reakcie podľa frekvencie a triedy orgánových systémov
Trieda orgánových systémov Preferovaný názov Frekvencia
Poruchy imunitného systému reakcie z precitlivenosti zahŕňajúce vyrážku a pruritus
menej časté
Poruchy metabolizmu a výživy hyperglykémia1 menej časté
Psychické poruchy úzkosť časté
agitovanosť nepokoj nespavosť
Poruchy nervového systému bolesť hlavy1
závrat
menej časté
časté
tras1 menej časté
Poruchy srdca a srdcovej činnosti tachykardia palpitácie
srdcové arytmie (atriálna fibrilácia,
supraventrikulárna tachykardia a extrasystoly)
menej časté
Poruchy gastrointestinálneho traktu sucho v ústach2, nevoľnosť časté
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
svalové kŕče1 časté
Poruchy obličiek a močových ciest zadržiavanie moču2 menej časté
Celkové poruchy a reakcie v mieste podania
bolesť na hrudníku časté

1 nežiaduce reakcie súvisiace s formoterolom
2 nežiaduce reakcie súvisiace s glykopyróniom
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.
9 Predávkovanie
Predávkovanie Bevespi Aerosphere môže viesť k zvýrazneným anticholinergným a/alebo β2- adrenergným prejavom a príznakom, z ktorých najfrekventovanejšie zahŕňajú rozmazané videnie, sucho v ústach, nevoľnosť, svalové kŕče, tras, bolesť hlavy, palpitácie a systolickú hypertenziu.
V prípade predávkovania je potrebné pacientovi poskytnúť podpornú liečbu, podľa potreby spolu s vhodným sledovaním.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá proti obštrukčným chorobám dýchacích ciest: sympatomimetiká v kombinácii s anticholinergikami, ATC kód: R03AL07.
Mechanizmus účinku
Bevespi Aerosphere obsahuje dve bronchodilatanciá: glykopyrónium, dlhodobo pôsobiaci
muskarínový antagonista (tiež označovaný ako anticholinergikum) a formoterol, dlhodobo pôsobiaci β2-adrenergný agonista s rýchlym nástupom účinku.
Glykopyrónium má podobnú afinitu k podtypom muskarínových receptorov M1 až M5. V dýchacích cestách vykazuje farmakologické účinky prostredníctvom inhibície M3 receptorov v hladkom svalstve vedúcej k bronchodilatácii. Formoterol vyvoláva priamu relaxáciu hladkého svalstva dýchacích ciest
v dôsledku zvýšenia cyklického AMP prostredníctvom aktivácie adenylátcyklázy. Kombinácia týchto
liečiv s odlišnými mechanizmami účinku vedie k prídavnej účinnosti v porovnaní so samostatným použitím jednotlivých zložiek.
V dôsledku rozdielnej hustoty muskarínových receptorov a β2-adrenoreceptorov v centrálnej
a periférnej časti dýchacích ciest v pľúcach sú muskarínoví antagonisti účinnejší v relaxácii centrálnej časti dýchacích ciest a β2-adrenergní agonisti sú účinnejší v relaxácii periférnych dýchacích ciest; relaxácia centrálnych aj periférnych dýchacích ciest pri kombinovanej liečbe môže prispieť k jej priaznivým účinkom na funkciu pľúc.
Farmakodynamické účinky
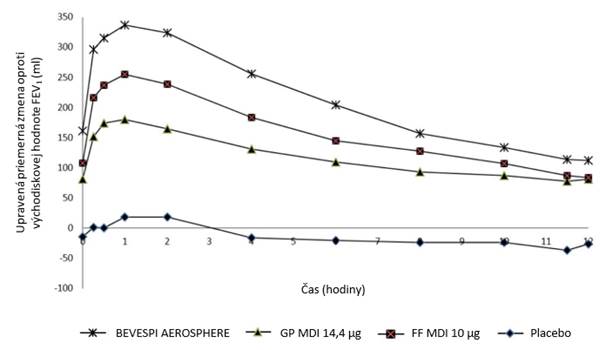
V troch 24-týždňových štúdiách fázy III (PINNACLE 1, PINNACLE 2 a PINNACLE 4) Bevespi
Aerosphere poskytol v porovnaní s placebom zlepšenia funkcie pľúc (podľa stanovenia ranného
minimálneho úsilného exspiračného objemu pred podaním dávky počas 1 sekundy [FEV1]),
s preukázaným nástupom účinku v priebehu 5 minút po podaní prvej dávky v 1. deň (zlepšenie oproti placebu o 187 ml v štúdii PINNACLE 1, 186 ml v PINNACLE 2 a 179 ml v PINNACLE 4
[p < 0,001]). Priemerný bronchodilatačný účinok odvodený zo sériových meraní FEV1 v 1. deň a v 12. týždni v štúdii PINNACLE 1 sú zobrazené na obrázku 1. V štúdii PINNACLE 2 boli výsledky
podobné výsledkom pozorovaným v štúdii PINNACLE 1.
Obrázo
k 1 – Priemerná zmena FEV
1
oproti východiskovej hodnote v priebehu času v 1. deň
a v 12. týždni
1. DEŇ
 12. TÝŽDEŇ
12. TÝŽDEŇ
 Elektrofyziológia srdca
Elektrofyziológia srdca
Placebom a aktívnou liečbou (moxifloxacín) kontrolovaná úplná štúdia vplyvu na QT interval u 69 zdravých osôb nepreukázala klinicky významný účinok na QT interval, s použitím prahu 10 ms. Najväčšie priemerné (horná hranica 90% intervalu spoľahlivosti) rozdiely východiskového
a individuálne upraveného intervalu QT oproti placebu boli 3,1 (4,7) ms pre Bevespi Aerosphere (14,4/10 mikrogramov) a 7,6 (9,2) ms pre glykopyrónium/formoterol pri 8-násobku odporúčanej dávky glykopyrónia a 4-násobku odporúčanej dávky formoterolu.
Klinic
k
á účinnosť
Klinický vývojový program Bevespi Aerosphere zahŕňal tri 24-týždňové, randomizované, dvojito
zaslepené, placebom kontrolované pivotné štúdie fázy III s paralelnými skupinami u 5 433 pacientov so stredne závažnou až veľmi závažnou CHOCHP (PINNACLE 1, PINNACLE 2 a PINNACLE 4).
Účinky na funkciu pľúc
V štúdiách PINNACLE 1, PINNACLE 2 a PINNACLE 4 preukázal Bevespi Aerosphere v porovnaní s placebom, glykopyróniom a s formoterolom zlepšenia minimálneho FEV1 počas 24 týždňov
(p < 0,0001) [pozri tabuľku 2]. V priebehu času nedošlo k žiadnemu oslabeniu bronchodilatačného účinku. Bevespi Aerosphere tiež v porovnaní s placebom, glykopyróniom a s formoterolom preukázal zlepšenia maximálneho FEV1 v priebehu 2 hodín po podaní dávky počas 24 týždňov (p < 0,0001)
[pozri tabuľku 2].
Pozorovali sa zlepšenia minimálneho FEV1 bez ohľadu na vek, pohlavie, stupeň obmedzenia priechodnosti dýchacích ciest, východiskové príznaky, fajčenie alebo použitie inhalačných kortikosteroidov.
Symptomatické výsledky
Dýchavičnosť:
V štúdiách PINNACLE 1 a PINNACLE 2 poskytol Bevespi Aerosphere zlepšenie dýchavičnosti, čo sa preukázalo na fokálnom skóre samostatne udávaného počítačového indexu prechodnej dýchavičnosti (self-administered computerised transitional dyspnoea index, SAC TDI) počas 24 týždňov v porovnaní s placebom a glykopyróniom (pozri tabuľku 2). V štúdii PINNACLE 2 sa pozorovali zlepšenia
v porovnaní s formoterolom (pozri tabuľku 2). V štúdii PINNACLE 4 poskytol Bevespi Aerosphere zlepšenie dýchavičnosti, čo sa preukázalo na fokálnom skóre TDI počas 24 týždňov v porovnaní
s placebom a glykopyróniom (pozri tabuľku 2).
Kvalita života súvisiaca so zdravím:
V štúdiách PINNACLE 1, PINNACLE 2 a PINNACLE 4 poskytol Bevespi Aerosphere zlepšenie kvality života súvisiacej so zdravím, špecifickej pre ochorenie, čo sa preukázalo na znížení celkového skóre respiračného dotazníka nemocnice St. George’s (St. George’s Respiratory Questionnaire, SGRQ) počas 24 týždňov v porovnaní s placebom a glykopyróniom [pozri tabuľku 2]. Zlepšenia
v porovnaní s formoterolom sa pozorovali v štúdiách PINNACLE 1 a PINNACLE 2.
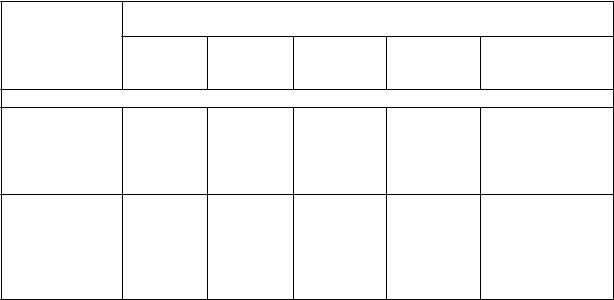
Tabuľka 2 – Funkcia pľúc, symptomatické výsledky a výsledky týkajúce sa kvality života súvisiacej so zdravím počas 24 týždňov
Liečebné porovnania
Liečebný rozdiel (95% interval spoľahlivosti, hodnota p)
 s Bevespi
Aer
osphere
PINNACLE 1
s Bevespi
Aer
osphere
PINNACLE 1
Bevespi Aerosphere (N = 526) oproti
placebu (N = 219)
Bevespi Aerosphere (N = 526) oproti glykopyróniu (N = 451)
MinimálnyFEV1 (ml)a158 (132, 183) p < 0,0001
60 (39, 80)
p < 0,0001
MaximálnyFEV1 (ml)288 (259, 317)
p < 0,0001#
123 (100, 146)
p < 0,0001#
Fokálne skóreb SAC- TDI/TDI0,47 (0,21; 0,72) p = 0,0003
0,27 (0,07; 0,47) p = 0,0086#
Celkové skóre SGRQ-2,39
(-4,07; -0,71)
p = 0,0053#
-1,90
(-3,24; 0,57)
p = 0,0052#
Denná záchranná liečba Ventolinom (inhalácií/deň)c-1,08
(-1,43; -0,73)
p < 0,0001#
-0,26
(-0,53; 0,01)
p = 0,0619
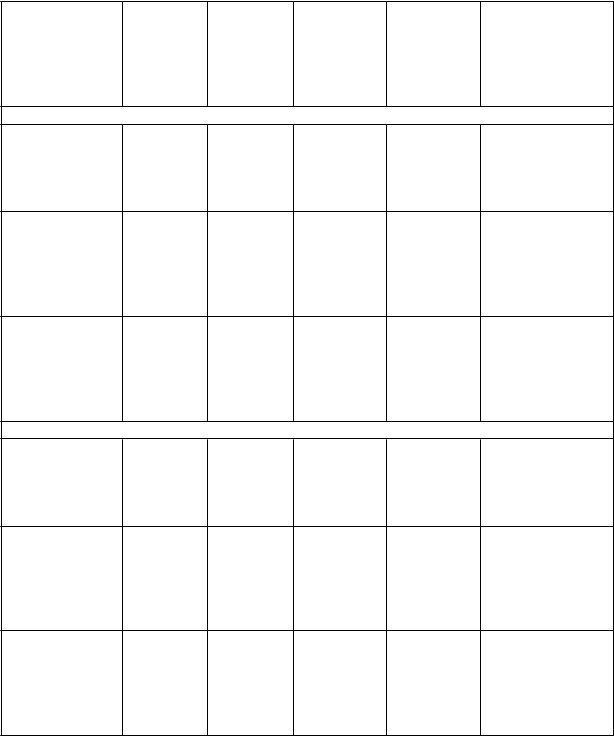
Bevespi Aerosphere (N = 526) oproti
formoterolium-
fumarátu (N = 449)
PINNACLE 2
Bevespi Aerosphere (N = 510) oproti
placebu (N = 223) Bevespi Aerosphere
(N = 510)
oproti glykopyróniu (N = 439) Bevespi Aerosphere (N = 510) oproti
formoterolium-
fumarátu (N = 437)
PINNACLE 4
Bevespi Aerosphere (N = 551) oproti
placebu (N = 235) Bevespi Aerosphere
(N = 551)
oproti glykopyróniu (N = 474) Bevespi Aerosphere (N = 551) oproti
formoterolium- fumarátu (N = 480)
64 (44, 84)
p < 0,0001
129 (103, 155) p < 0,0001
55 (34, 76)
p < 0,0001
57 (36, 78)
p < 0,0001
155 (129, 180) p < 0,0001
55 (35, 76)
p < 0,0001
72 (52, 92)
p < 0,0001
81 (59, 104)
p < 0,0001#
278 (249, 308) p < 0,0001
129 (106, 153) p < 0,0001
76 (52, 99)
p < 0,0001
293 (265, 321) p < 0,0001
141 (119, 163) p < 0,0001
97 (75, 119)
p < 0,0001
0,16
(-0,03; 0,36)
p = 0,1060
0,33 (0,11; 0,56) p = 0,0041
0,21 (0,03; 0,40) p = 0,0199
0,28 (0,10; 0,46) p = 0,0028
0,80 (0,47; 1,13) p < 0,0001
0,33 (0,07; 0,59) p = 0,0125
0,15
(-0,11; 0,41)
p = 0,2530
-0,75
(-2,08; 0,57)
p = 0,2640
-1,66
(-3,34; 0,02)
p = 0,0534
-1,28
(-2,62; 0,06)
p = 0,0605
-1,22
(-2,56; 0,13)
p = 0,0760
-3,50
(-5,18; -1,82)
p < 0,0001
-1,62
(-2,94; -0,30)
p = 0,0165
-0,27
(-1,59; 1,05)
p = 0,6908
-0,01
(-0,27; 0,26)
p = 0,9683
-1,04
(-1,37; -0,72)
p < 0,0001
-0,57
(-0,83; -0,31)
p < 0,0001
-0,29
(-0,55; -0,03)
p = 0,0274#
-0,98
(-1,47; -0,49)
p < 0,0001
-0,77
(-1,16; -0,38)
p < 0,0001
-0,41
(-0,80; -0,03)
p = 0,0345#
N počet v populácii podľa liečebného zámeru
a primárny ukazovateľ vo všetkých štúdiách
b V štúdiách PINNACLE 1 a PINNACLE 2 sa použil SAC-TDI. V štúdii PINNACLE 4 sa použil TDI. SAC-TDI
bol primárnym ukazovateľom iba v štúdiách PINNACLE 1 a PINNACLE 2.
c z populácie používateľov záchrannej liečby Ventolinom v štúdii PINNACLE 4
# V tejto štúdii bol použitý hierarchický štatistický testovací postup a toto porovnanie bolo pod porovnaním, ktoré nedosiahlo štatistickú významnosť. Štatistickú významnosť pre toto porovnanie preto nie je možné
odvodiť.
Exacerbácie CHOCHP:
Jednotlivé štúdie neboli špecificky navrhnuté tak, aby hodnotili účinok liečby na exacerbácie'
CHOCHP a ak sa vyskytla závažná exacerbácia alebo viac ako 2 stredne závažné exacerbácie, pacienti museli ukončiť účasť v štúdii.
Pediatrická
populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Bevespi
Aerosphere vo všetkých podskupinách pediatrickej populácie v liečbe CHOCHP (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Po inhalácii kombinácie glykopyrónia a formoterolu bola farmakokinetika každej zložky podobná farmakokinetike pozorovanej v prípade, keď sa každé liečivo podávalo samostatne. Pre farmakokinetické účely sa preto každá zložka môže brať do úvahy samostatne.
Vplyv inhalačného nadstavca
Použitie Bevespi Aerosphere s inhalačným nadstavcom Aerochamber Plus Flow-Vu zvýšilo
u pacientov s CHOCHP celkovú systémovú expozíciu glykopyrónia (stanovenú ako AUC0-12) o 16%, zatiaľ čo expozícia formoterolu bola nezmenená.
Absorpcia
Po inhalačnom podaní Bevespi Aerosphere u osôb s CHOCHP sa Cmax glykopyrónia objavila približne
po 5 minútach a Cmax formoterolu sa objavila v priebehu 20 až 60 minút. Rovnovážny stav sa dosiahne v priebehu 2 – 3 dní opakovaného dávkovania Bevespi Aerosphere a rozsah expozície je približne
2,3-násobne vyšší pre glykopyrónium a 1,5-násobne vyšší pre formoterol ako po prvej dávke.
Štúdia s Bevespi Aerosphere týkajúca sa ukladania lieku v pľúcach, vykonaná u zdravých dobrovoľníkov preukázala, že v priemere 38% nominálnej dávky sa ukladá v pľúcach. Pozorovala sa tvorba centrálnych aj periférnych depozitov.
Distribúcia
Glykopyrónium
Podľa populačnej farmakokinetickej analýzy sú odhadované pomery Vc/F (objem centrálneho kompartmentu) a Vp1/F (objem periférneho kompartmentu) pre glykopyrónium 741 l a 2 990 l,
v uvedenom poradí. V rámci rozsahu koncentrácií 2 – 500 nmol/l siahal rozsah väzby glykopyrónia na plazmatické proteíny od 43% do 54%.
Formoterol
Podľa populačnej farmakokinetickej analýzy sú odhadované pomery Vc/F (objem centrálneho kompartmentu) a Vp1/F (objem periférneho kompartmentu) pre formoterol 1 030 l a 647 l,
v uvedenom poradí. V rámci rozsahu koncentrácií 10 – 500 nmol/l sa väzba formoterolu na
plazmatické proteíny pohybovala v rozmedzí 46% až 58%.
Biotransformácia
Glykopyrónium
Na základe literatúry a štúdie na ľudských hepatocytoch in vitro metabolizmus zohráva menej významnú úlohu v celkovej eliminácii glykopyrónia. Zistilo sa, že CYP2D6 je prevládajúci enzým zapojený do metabolizmu glykopyrónia.
Štúdie in vitro naznačujú, že glykopyrónium neinhibuje žiadny podtyp cytochrómu P450 a neindukuje
CYP1A2, 2B6 alebo 3A4.
Formoterol
Primárny metabolizmus formoterolu je prostredníctvom priamej glukuronidácie a O-demetylácie
nasledovanej konjugáciou na neaktívne metabolity. Sekundárne metabolické dráhy zahŕňajú deformyláciu a sulfátovú konjugáciu. CYP2D6 a CYP2C boli identifikované ako primárne zodpovedné za O-demetyláciu.
Štúdie in vitro naznačujú, že formoterol v terapeuticky významných koncentráciách neinhibuje enzýmy CYP450.
Eliminácia
Po i.v. podaní dávky 0,2 mg rádioaktívne značeného glykopyrónia sa 85% dávky zachytilo v moči
v priebehu 48 hodín po podaní dávky a určitá časť rádioaktívne značenej dávky sa zachytila tiež v žlči. Terminálny eliminačný polčas glykopyrónia po perorálnej inhalácii, odvodený z populačnej farmakokinetickej analýzy, bol 15 hodín.
Exkrécia formoterolu sa skúmala u šiestich zdravých osôb po súbežnom podaní rádioaktívne značeného formoterolu perorálnou a i.v. cestou. V tejto štúdii sa 62% rádioaktívne značeného formoterolu vylúčilo v moči, zatiaľ čo 24% sa vylúčilo v stolici. Terminálny eliminačný polčas formoterolu po perorálnej inhalácii, odvodený z populačnej farmakokinetickej analýzy, bol 13 hodín.
Linearita/nelinearita
Po perorálnej inhalácii sa pri glykopyróniu (rozsah dávky: 14,4 až 115,2 µg) a formoterole (rozsah
dávky: 2,4 až 19,2 µg) pozorovala lineárna farmakokinetika.
Osobitné skupiny pacientov
Starší pacienti
Na základe dostupných údajov nie je potrebná žiadna úprava dávkovania Bevespi Aerosphere u geriatrických pacientov.
Porucha funkcie obličiek
Nevykonali sa žiadne štúdie na vyhodnotenie vplyvu poruchy funkcie obličiek na farmakokinetiku glykopyrónia a formoterolu. Vplyv poruchy funkcie obličiek na expozíciu glykopyrónia a formoterolu počas 12 týždňov sa hodnotil v populačnej farmakokinetickej analýze. Odhadovaná rýchlosť glomerulárnej filtrácie (estimated glomerular filtration rate, eGFR) sa pohybovala v rozmedzí
30-196 ml/min, čo predstavuje rozsah pri stredne závažnej až žiadnej poruche funkcie obličiek.
Systémová expozícia (AUC0-12) u osôb s CHOCHP so stredne závažnou až závažnou poruchou funkcie obličiek (eGFR 30-45 ml/min) je pre glykopyrónium približne o 30% vyššia v porovnaní s osobami
s CHOCHP s normálnou funkciou obličiek (eGFR > 90 ml/min). U osôb s CHOCHP s nízkou telesnou hmotnosťou a stredne závažnou až závažnou poruchou funkcie obličiek môže byť systémová
expozícia glykopyrónia približne dvojnásobná. Zistilo sa, že funkcia obličiek nemá vplyv na expozíciu formoterolu.
Porucha funkcie pečene
Nevykonali sa žiadne farmakokinetické štúdie s Bevespi Aerosphere u pacientov s poruchou funkcie pečene. Avšak, keďže sa formoterol eliminuje predovšetkým hepatálnym metabolizmom, u pacientov so závažnou poruchou funkcie pečene možno očakávať zvýšenú expozíciu. Glykopyrónium sa zo systémovej cirkulácie odstraňuje predovšetkým renálnou exkréciou a preto sa neočakáva, že porucha funkcie pečene bude viesť k nebezpečnej systémovej expozícii.
Iné osobitné skupiny pacientov
Vykonala sa populačná farmakokinetická analýza glykopyrónia na základe údajov zozbieraných u celkovo 311 osôb s CHOCHP. Farmakokinetiku glykopyrónia najlepšie popisoval dvojkompartmentový dispozičný model s absorpciou prvého poriadku a lineárnou elimináciou. Charakteristický klírens (CL/F) glykopyrónia bol 124 l/h.
Vykonala sa populačná farmakokinetická analýza formoterolu na základe údajov zozbieraných u celkovo 437 osôb s CHOCHP. Farmakokinetiku formoterolu najlepšie popisoval dvojkompartmentový dispozičný model s rýchlostnou konštantou absorpcie prvého poriadku
a lineárnou elimináciou. Charakteristický klírens (CL/F) formoterolu bol 99 l/h.
Na základe vplyvu veku, pohlavia a telesnej hmotnosti na farmakokinetické parametre glykopyrónia a formoterolu nie sú potrebné žiadne úpravy dávky.
Medzi zdravými osobami japonského a západného etnika sa pre obe liečivá nepozorovali žiadne významné rozdiely v celkovej systémovej expozícii (AUC). K dispozícii nie sú dostatočné farmakokinetické údaje na porovnanie expozícií u iných etník alebo rás.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity alebo karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Toxicita pozorovaná v štúdiách s kombináciou glykopyrónia a formoterolu u psov sa spájala
s farmakologickými účinkami formoterolu, vrátane účinkov najmä na kardiovaskulárny systém, zahŕňajúcimi hyperémiu, tachykardiu, arytmie a lézie myokardu. Toto sú známe farmakologické prejavy, ktoré sa pozorujú po podávaní vysokých dávok agonistov β-adrenoreceptorov. Nepozorovali sa žiadne významné účinky, ktoré by mohli byť pripísané glykopyróniu.
Reprodukčné štúdie na zvieratách s formoterolom preukázali mierne zníženú fertilitu u samcov potkana pri vysokých systémových expozíciách a straty pri implantácii rovnako, ako aj znížené skoré postnatálne prežívanie a pôrodnú hmotnosť pri značne vyšších systémových expozíciách ako sú expozície dosahované pri klinickom použití. Tieto experimentálne výsledky u zvierat však majú malý význam pre človeka. U potkanov a myší liečených formoterolom sa pozorovalo mierne zvýšenie výskytu leiomyómov maternice; tento účinok sa považuje za skupinový účinok u hlodavcov po dlhodobej expozícii vysokým dávkam agonistov β2-adrenoreceptorov.
Reprodukčné štúdie na zvieratách s glykopyróniom preukázali zníženú hmotnosť plodov u potkanov a králikov a pri značne vyšších systémových expozíciách ako sú expozície dosahované pri klinickom použití sa pozoroval nízky prírastok telesnej hmotnosti u mláďat potkanov pred odstavením. V 2- ročných štúdiách u potkanov a myší sa nepozoroval žiadny dôkaz karcinogenity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
norflurán
1,2-distearoyl-sn-glycero-3-fosfocholín
chlorid vápenatý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Liek sa má spotrebovať v priebehu 3 mesiacov po otvorení vrecka.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30 °C. Nevystavujte teplotám vyšším ako 50 °C.
Tlakový obal neprepichujte.
6.
5 Druh obalu a obsah balenia
Inhalátor je tlakovým inhalátorom s odmernou dávkou, pozostávajúci z hliníkového tlakového obalu s pripojeným ukazovateľom dávky, ktorý sa dodáva spolu s bielym plastovým dávkovačom
s náustkom s oranžovým ochranným krytom. Každý inhalátor je individuálne zabalený vo fóliovom
laminátovom vrecku obsahujúcom vrecúško s vysušovadlom a je balený v papierovej škatuľke.
Papierová škatuľka obsahujúca 1 inhalátor so 120 dávkami.
Viacnásobné balenie obsahujúce 3 inhalátory, pričom každý obsahuje 120 dávok.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami. Tlakový obal sa nesmie poškodiť, prepichnúť ani spáliť, aj keď je zjavne prázdny.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1339/001
EU/1/18/1339/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 18. december 2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu