náustok z úst a vydýchnite. Rovnako sa má postupovať pri druhej inhalácii.
5. Po použití nasaďte späť ochranný kryt.
Nádobka nie je priehľadná. Preto nie je možné vidieť, kedy je prázdna. Plná má obsahovať
200 dávok. Aj v prípade, že sa využili všetky dávky, môže sa zdať, že tlaková nádobka obsahuje ešte malé množstvo tekutiny. Treba však použiť nový inhalačný roztok, pretože zostatok nie je dostatočný na ďalšiu dávku.
Množstvo lieku v nádobke sa dá zistiť nasledovne:
Pretrasením nádobky zistíte, či v nej ešte nie je zvyšná kvapalina. Odstráňte z nádobky plastový náustok a vložte ju do nádoby s vodou. Obsah aerosólovej nádobky možno odhadnúť podľa jej polohy vo vode (obr. 2).
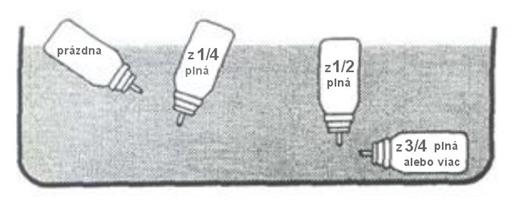
(Obr. 2)
Inhalátor čistite najmenej jedenkrát týždenne. Je dôležité udržiavať náustok inhalátora v čistote, aby sa predišlo hromadeniu liečiva a upchaniu spreja. Pri čistení najprv odstráňte kryt a nádobku z inhalátora. Premývajte teplou vodou pokým sú viditeľné usadeniny liečiva a/alebo nečistoty.
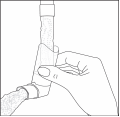
(Obr. 3)
Po čistení inhalátor vytraste a nechajte ho voľne uschnúť bez použitia akéhokoľvek ohrievača. Keď je náustok suchý, vráťte späť nádobku a kryt.
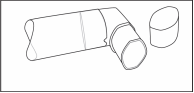
(Obr. 4)
Upozornenie:
Plastový náustok je špeciálne vyvinutý pre používanie Berodualu N tak, aby sa vždy zaručilo podanie správneho množstva lieku. Náustok sa nikdy nesmie použiť s iným inhalačným roztokom a ani Berodual N sa nesmie použiť s iným náustkom, len s tým, ktorý je priložený v balení s liekom.
Nádobka je pod tlakom a v žiadnom prípade sa nesmie otvárať násilím ani vystavovať teplotám vyšším ako 50 °C.
4.3. KontraindikáciePrecitlivenosťou na fenoteroliumhydrobromid, atropín a podobné látky alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Pacienti s hypertrofickou obštrukčnou kardiomyopatiou a tachyarytmiou.
4.4. Osobitné upozornenia a opatrenia pri používaníPri prvom použití Berodualu N s novým zložením môžu pacienti zaznamenať malý rozdiel v chuti v porovnaní so zložením s obsahom freónov (CFC). Pacienti sa nemusia obávať prechodu z jedného lieku na druhý. Treba im vysvetliť, že zloženia sa v praxi ukázali ako zameniteľné a zmenená chuť nemá vplyv na bezpečnosť alebo účinnosť nového zloženia.
V prípade akútneho náhleho zhoršenia dyspnoe (ťažkosti s dýchaním) treba okamžite vyhľadať lekársku pomoc.
Dlhodobé podávanie:
• Pri liečbe pacientov s bronchiálnou astmou sa má Berodual N používať iba v prípade potreby. U pacientov s miernou CHOCHP sa má pred pravidelným podávaním uprednostniť liečba podľa potreby (symptomaticky orientovaná).
• Ako prídavný liek alebo na zvýšenie protizápalovej liečby na kontrolu zápalu dýchacích ciest a prevenciu zhoršenia kontroly choroby dlhodobejšie užívanie je vhodné zvážiť u pacientov s bronchiálnou astmou a steroid-dependentnou CHOCHP.
Pravidelné užívanie väčšieho množstva liekov s obsahom beta
2-agonistu, ako je Berodual N, na kontrolu príznakov bronchiálnej obštrukcie, môže zhoršiť kontrolu choroby. Ak sa bronchiálna obštrukcia zhorší, je riskantné jednoducho zvýšiť príjem liekov obsahujúcich beta
2-agonistu, ako je Berodual N, nad odporúčanú dávku na dlhšie časové obdobie. V tejto situácii sa má prehodnotiť pacientov terapeutický plán a najmä primeranosť protizápalovej terapie s inhalovanými kortikosteroidmi, aby sa predišlo možnému život-ohrozujúcemu zhoršeniu kontroly choroby.
Ďalšie sympatomimetické bronchodilatanciá sa môžu užívať súčasne s Berodualom N len pod lekárskym dozorom.
V nasledovných prípadoch sa Berodual N môže použiť len po starostlivom vyhodnotení rizika a prínosu, najmä keď sa majú užívať dávky vyššie ako sú odporúčané: nedostatočne kontrolovaný diabetes mellitus, čerstvý infarkt myokardu, závažné organické srdcové alebo cievne choroby, hypertyreóza, feochromocytóm.
Pri podávaní sympatomimetík, vrátane lieku Berodual N, sa môžu pozorovať kardiovaskulárne poruchy. Na základe postmarketingových údajov a z publikovanej literatúry bol dokázaný iba zriedkavý výskyt ischémie myokardu, v spojitosti s beta-agonistami. Pacienti užívajúci Berodual N, ktorí majú predispozíciu k závažným srdcovým ochoreniam (napr. ischemická choroba srdca, arytmia alebo závažné srdcové zlyhanie), sa majú upozorniť na potrebu vyhľadania lekárskej pomoci v prípade, že budú pociťovať bolesť v oblasti hrudníka, resp. iné príznaky nasvedčujúce zhoršovaniu ochorenia srdca. Pozornosť je potrebné venovať predovšetkým zhodnoteniu príznakov, akými sú dýchavičnosť alebo bolesť v oblasti hrudníka, keďže tieto indikujú respiračné alebo srdcové poruchy.
Terapia beta
2-agonistom môže zapríčiniť vážnu hypokalémiu.
Berodual N sa má užívať opatrne u pacientov s predispozíciou ku glaukómu s úzkym uhlom alebo s už existujúcou obštrukciou výtokových močových ciest (napr. hyperpláziou prostaty, obštrukciou hrdla mechúra).
V prípadoch, keď aerosólový ipratropiumbromid buď sám alebo v kombinácii s adrenergným
beta2-agonistom náhodne dostal do očí, vyskytlo sa niekoľko prípadov očných komplikácií (mydriáza, zvýšený vnútroočný tlak, glaukóm s úzkym uhlom, bolesť oka). Preto pacientov treba inštruovať o správnom podávaní inhalačného roztoku Berodual N. Treba dbať na to, aby sa liek nedostal do očí.
Bolesť oka alebo nepríjemný pocit v oku, neostré videnie, farebné kruhy alebo obrazce spolu s červenými očami zapríčinenými prekrvením spojoviek a opuchom rohoviek môžu byť príznakom akútneho glaukómu s úzkym uhlom. Ak sa vyskytnú niektoré z týchto príznakov, treba začať liečbu očnými instiláciami a ihneď treba vyhľadať odbornú lekársku pomoc.
U pacientov s cystickou fibrózou sa môžu častejšie vyskytovať poruchy gastrointestinálnej motility.
Po podaní Berodualu N sa môžu vyskytnúť okamžité reakcie z precitlivenosti, čoho sú dôkazom zriedkavé prípady žihľavky, angioedému, vyrážky, bronchospazmu, orofaryngeálneho edému a
anafylaxie.
Použitie lieku Berodual N môže viesť k pozitívnym výsledkom pri testoch neklinického používania fenoterolu, napr. v kontexte zvyšovania výkonu športovcov (doping).
4.5. Liekové a iné interakcieĎalšie beta-adrenergiká, anticholinergiká a xantínové deriváty (ako teofylín) môžu zväčšiť bronchodilatačný účinok. Súčasné podávanie iných betamimetík, systémovo dostupných anticholinergík a xantínových derivátov (napr. teofylínu) môže zosilniť nežiaduce reakcie.
Súčasné podávanie betablokátorov môže viesť k potenciálne závažnej redukcii bronchodilatácie.
Beta
2-agonistom navodená hypokalémia sa pri sprievodnej liečbe xantínovými derivátmi, kortikosteroidmi a diuretikami môže zvýšiť. To sa musí vziať do úvahy najmä u pacientov s ťažkou obštrukciou dýchacích ciest. U pacientov užívajúcich digoxín môže hypokalémia vyústiť do zvýšenej náchylnosti na arytmiu. Navyše, hypoxia môže zhoršiť účinky hypokalémie na srdcový rytmus. Odporúča sa v každom prípade monitorovať hladiny sérového draslíka.
Lieky obsahujúce beta
2-agonistov sa pacientom liečeným inhibítormi monoaminooxidázy alebo tricyklickými antidepresívami musia podávať opatrne, pretože účinok beta-adrenergných agonistov sa môže zvýšiť.
Inhalácia halogénových hydrokarbónových anestetík ako halotan, trichlóretylén a enfluran môže zvýšiť citlivosť na kardiovaskulárne účinky beta-agonistov.
4.6. Fertilita, gravidita a laktáciaGravidita
Neexistujú dostatočné údaje o používaní Berodualu N u tehotných žien. Štúdie na zvieratách nenaznačili priamy alebo nepriamy škodlivý účinok, čo sa týka tehotenstva, embryonálneho/fetálneho vývinu, pôrodu alebo postnatálneho vývinu. Možné riziko pre ľudí je neznáme. Pri predpisovaní lieku tehotným ženám je potrebná zvýšená opatrnosť.
Má sa zvážiť potenciál beta 2-agonistov inhibovať kontrakcie maternice.
Užívanie ß-2 sympatomimetík na konci tehotenstva alebo vo vysokých dávkach môže mať negatívny vplyv na novorodenca (tremor, tachykardia, výkyvy krvnej glukózy, hypokalémia).
Laktácia
Predklinické štúdie ukázali, že fenoteroliumhydrobromid sa vylučuje do materského mlieka. Nie je známe, či sa ipratropiumbromid vylučuje do materského mlieka. Ale je nepravdepodobné, že by dieťa dostalo ipratropiumbromid v účinnom množstve, najmä ak sa používa vo forme aerosólu. Keďže sa však mnoho liekov vylučuje do materského mlieka, Berodual N sa má dojčiacim ženám podávať opatrne.
Fertilita
Klinické údaje o fertilite nie sú pre kombináciu ipratropiumbromidu a fenoteroliumhydrobromidu dostupné. Predklinické štúdie, vykonané s jednotlivými zložkami ipratropiumbromidom a fenoteroliumhydrobromidom neukázali žiadne nežiaduce účinky na fertilitu (pozri časť 5.3 Predklinické údaje o bezpečnosti).
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pacientov však treba upozorniť, že počas liečby liekom Berodual N môžu pocítiť nežiaduce účinky ako sú závrat, poruchy akomodácie, mydriáza a zastreté videnie. Preto je pri vedení vozidla alebo obsluhe strojov potrebná zvýšená opatrnosť. Ak pacient pocíti niektorý z vyššie uvedených nežiaducich účinkov, má sa potenciálne nebezpečným činnostiam ako sú vedenie vozidla alebo obsluha stroja vyhnúť.
4.8. Nežiaduce účinkyMnohé z uvedených nežiaducich účinkov možno pripísať anticholinergným vlastnostiam lieku Berodual N. Tak ako pri inej inhalačnej liečbe, aj pri liečbe Berodualom N môže dôjsť k prejavom lokálneho podráždenia. Nežiaduce účinky boli získané z klinických štúdií a na základe skúseností po uvedení lieku na trh.
Najčastejšie nežiaduce účinky, ktoré boli hlásené v klinických štúdiách, boli kašeľ, sucho v ústach, bolesť hlavy, tremor, nauzea, závrat, dysfónia, tachykardia, palpitácie, vracanie, zvýšený systolický krvný tlak a nervozita.
Odporúčaná frekvencia podľa konvencií:
Veľmi časté (môžu postihovať viac ako 1 z 10 osôb)
Časté (môžu postihovať menej ako 1 z 10 osôb)
Menej časté (môžu postihovať menej ako 1 zo 100 osôb)
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 osôb)
Neznáme (častosť sa nedá odhadnúť z dostupných údajov)
Poruchy imunitného systémuZriedkavé: hypersenzitivita*, anafylaktické reakcie*
Poruchy metabolizmu a výživyZriedkavé: hypokalémia*
Psychické poruchyMenej časté: nervozita
Zriedkavé: nepokoj, mentálne poruchy
Neznáme: hyperaktivita
Poruchy nervového systémuMenej časté: bolesť hlavy, závrat, tremor
Poruchy okaZriedkavé: glaukóm*, znížený vnútroočný tlak*, poruchy akomodácie*, mydriáza*, zastreté videnie*, bolesť oka*, opuch rohovky*, spojivková hyperémia*, dvojité videnie*
Poruchy srdca a srdcovej činnostiMenej časté: tachykardia, zrýchlený srdcový rytmus, palpitácie
Zriedkavé: arytmie, atriálna fibrilácia, supraventrikulárna tachykardia*, ischémia
myokardu
Poruchy dýchacej sústavy, hrudníka a mediastínaČasté: kašeľ
Menej časté: faryngitída, poruchy hlasu
Zriedkavé: podráždenie hrdla, bronchospazmus, opuch hrtana, laryngospazmus*,
paradoxný bronchospazmus*, sucho v hrdle*
Poruchy gastrointestinálneho traktuMenej časté: sucho v ústach, nevoľnosť, vracanie
Zriedkavé: stomatitída, glositída, porucha gastrointestinálnej motility, hnačka, zápcha*, opuch úst*
Poruchy kože a podkožného tkanivaZriedkavé: vyrážka, urtikária, svrbenie, angioedém*, hyperhidróza*
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaZriedkavé: myalgia, svalový kŕč, svalová slabosť
Poruchy obličiek a močových ciestZriedkavé: zadržiavanie moču
Laboratórne a funkčné vyšetreniaMenej časté: zvýšenie systolického krvného tlaku
Zriedkavé: zníženie diastolického krvného tlaku
*Nežiaduce účinky neboli pozorované v žiadnej klinickej štúdii s liekom BERODUAL N. Odhad sa zakladá na hornej hranici jeho 95 % konfidenčného intervalu, vypočítaného z celkového počtu liečených pacientov podľa smernice EU o SPC (3/4968 = 0,00060 čo sa vzťahuje na “zriedkavé”)
4.9. PredávkovanieSymptómyPredpokladá sa, že účinky predávkovania sa vzťahujú skôr na fenoteroliumhydrobromid.
Očakávané príznaky predávkovania sú ako pri zvýšenej beta-adrenergnej stimulácii, k najbežnejším patrí tachykardia, palpitácie, tras, hypertenzia, hypotenzia, zvýšenie pulzového tlaku, anginózna bolesť, arytmie a návaly horúčavy do tváre. Bola zistená metabolická acidóza, ak sa fenoterol podával vo vyšších dávkach ako sú odporúčané dávky pre schválené indikácie Berodualu N.
Po predávkovaní fenoterolom sa môže vyskytnúť hypokalémia. Majú sa sledovať hladiny draslíka v sére.
Očakávané príznaky predávkovania s ipratropiumbromidom (ako sú sucho v ústach, poruchy akomodácie očí) sú mierne, pretože systémová dostupnosť inhalovaného ipratropiumbromidu je veľmi nízka.
TerapiaPodávanie sedatív, trankvilizérov, v ťažkých prípadoch intenzívna terapia.
Blokátory beta-receptorov, najmä beta
1-selektívne, sú vhodné ako špecifické antidota, treba však myslieť na možné zvýšenie bronchiálnej obštrukcie a u pacientov trpiacich na bronchiálnu astmu alebo CHOCHP sa musí dávka určiť starostlivo pre riziko vzniku ťažkého bronchospazmu, ktorý môže byť smrteľný.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: bronchodilatanciá, antiastmatiká.
ATC kód: R03AK03
Štúdie s dĺžkou liečby do troch mesiacov zahŕňali dospelých pacientov s astmou a CHOCHP a deti s astmou, pri ktorých sa porovnávalo zloženie HFA (hnacia látka) a CFC (freón), ukázali, že obe zloženia sú terapeuticky rovnaké.
Berodual N obsahuje dve účinné bronchodilatačné zložky: ipratropiumbromid, prejavujúci anticholínergný účinok, a fenoteroliumhydrobromid - beta-adrenergný činiteľ.
Ipratropiumbromid je kvartérna amónna zložka s anticholinergnými (parasympatolytickými) vlastnosťami. V predklinických štúdiách inhibuje vagom sprostredkované reflexy antagonizovaním pôsobenia acetylcholínu, mediátora uvoľňovaného z nervus vagus. Anticholinergiká zabraňujú zvýšeniu vnútrobunkovej koncentrácie Ca
++ spôsobenej interakciou acetylcholínu s muskarínovým receptorom na bronchiálnom hladkom svale. Uvoľnenie Ca
++ je sprostredkované systémom druhého messengera, pozostávajúceho z IP3 (inozitoltrifostát) a DAG (diacylglycerol).
Bronchodilatácia nasledujúca po inhalácii ipratropiumbromidu je primárne lokálny, miestne špecifický nie systémový účinok.
Predklinicky a klinicky sa nedokázal žiadny škodlivý účinok ipratropiumbromidu na sekréciu mukózy dýchacích ciest, mukociliárny klírens alebo výmenu plynov.
Fenoteroliumhydrobromid je priamo účinkujúci sympatomimetický činiteľ, v terapeutických dávkach selektívne stimulujúci beta
2-receptory. K stimulácii beta
1-receptorov dochádza až pri vyšších dávkach (napr. dávkach podávaných pri tokolýze). Obsadenie beta
2-receptorov aktivizuje adenylátovú cyklázu prostredníctvom stimulačného proteínu G
S. Zvýšenie cyklického AMP aktivizuje proteínovú kinázu A, ktorá potom fosforyluje cieľové proteíny v bunkách hladkého svalstva. Toto následne vedie k fosforylácii myozínovej kinázy, inhibícii hydrolýzy fosfoinozitidu a otvoreniu vysoko vodivých kalciom aktivovaných draslíkových kanálov.
Fenoterololiumhydrobromid uvoľňuje hladké svalstvo bronchov a ciev a chráni pred bronchokonstrikčnými stimulmi, ako sú histamín, metacholín, studený vzduch a alergén (skorá reakcia). Po akútnom podaní sa inhibuje uvoľnenie bronchokonstrikčných a zápalových mediátorov z buniek. Po podaní vyšších dávok fenoterolu (0,6 mg) sa zvýšil mukociliárny klírens.
Vyššie plazmatické koncentrácie, ktoré sa častejšie dosahujú pri perorálnom alebo intravenóznom podaní, inhibujú motilitu maternice. Pri vyšších dávkach sa takisto pozorovali metabolické účinky: lipolýza, glykogenolýza, hyperglykémia a hypokaliémia, ktorú zapríčiňuje zvýšená absorpcia K
+ do kostrového svalstva. Beta-adrenergné účinky na srdce, ako je zrýchlenie pulzu a sťahy, sú zapríčinené pôsobením fenoterolu na cievy, stimuláciou srdcového beta
2-receptora a pri dávkach vyšších ako sú terapeutické, stimuláciou beta
1-receptora. Ako aj pri iných beta-adrenergných činiteľoch sú hlásené predĺženia QTc intervalu. Pri fenoterole, inhalačný aerosól, predĺženia QTc intervalu boli samostatné a boli pozorované pri dávkach vyšších ako sú odporúčané. Avšak systémová expozícia po podaní pomocou nebulizátora (roztok na inhaláciu) môže byť vyššia než po podaní odporúčaných dávok inhalačného aerosólu. Klinický význam tohto javu nie je stanovený. Častejšie pozorovaným účinkom beta-agonistu je tras. Na rozdiel od účinkov na bronchiálne hladké svalstvo systémové účinky beta-agonistu sú predmetom vývoja tolerancie.
Súčasné použitie týchto dvoch účinných zložiek rozširuje priedušky pôsobením na rozličné farmakologicky zasiahnuteľné miesta. Dve účinné zložky sa potom pri spazmolytickom pôsobení na bronchiálne svalstvo vzájomne dopĺňajú a umožňujú široké terapeutické využitie pri bronchopulmonálnych ochoreniach spojených s konstrikciou respiračného traktu. Navyše na dosiahnutie želaného účinku je potrebná len veľmi nízka dávka beta-adrenergnej zložky, čo umožňuje individuálne dávkovanie pre každého pacienta s minimom nežiaducich účinkov.
U pacientov s astmou a CHOCHP sa Berodual N ukázal účinnejší ako dvojitá dávka fenoterolu podaná bez ipratropia. Dve štúdie (jedna s astmatickými pacientami, jedna s pacientami s CHOCHP) preukázali, že Berodual N je rovnako účinný ako dvojitá dávka fenoterolu podaná bez ipratropia, ale v štúdiách odpovedí na opakované podávanie bol lepšie tolerovaný.
Pri akútnej bronchokonstrikcii je Berodual N účinný krátko po podaní, a preto je tiež vhodný na liečbu akútnych astmatických záchvatov.
5.2. Farmakokinetické vlastnostiTerapeutický účinok kombinácie ipratropiumbromidu a fenoteroliumhydrobromidu je spôsobený lokálnym pôsobením na dýchacie cesty. Farmakodynamika bronchodilatácie sa preto nevzťahuje na farmakokinetiku účinných zložiek lieku. '
Po inhalácii sa 10-39 % dávky všeobecne ukladá do pľúc v závislosti na liekovej forme, inhalačnej technike a pomôcke, kým zvyšok podanej dávky zostáva v náustku, ústach a v hornej časti dýchacej sústavy (orofarynx). Po použití odmerného aerosólu buď s hnacím plynom HFA 134a alebo CFC sa ukladajú v dýchacích cestách podobné množstvá dávky. Časť dávky uložená v pľúcach sa rýchlo dostáva do obehu (v priebehu minút). Podiel liečiva, uloženého v orofaryngu sa pomaly prehĺta a postupuje do tráviaceho traktu. Preto je systémová expozícia funkciou perorálnej a pľúcnej biologickej dostupnosti.
Nie sú dôkazy, že farmakokinetika oboch liečiv podaných súčasne je iná ako pri podaní jednotlivých liečiv samostatne.
Po inhalácii ipratropiumbromidu a fenoteroliumbromidu či už s hnacím plynom HFA 134a alebo CFC bola pre obe liečivá stanovená podobná kumulatívna renálna exkrécia 24 hodín, a liekové formy s HFA 134a alebo s CFC možno považovať za bioekvivalentné.
FenoteroliumhydrobromidPrehltnutá časť sa väčšinou metabolizuje na sulfátové zlúčeniny. Absolútna biodostupnosť po perorálnom podaní je nízka (približne 1,5 %).
Po intravenóznom podaní sa v 24 hodinovej vzorke moču našlo 15 % podaného voľného fenoterolu a 27 % konjugovaného fenoterolu. Po inhalácii lieku Berodual N sa približne 1 % inhalovanej dávky nahádza v 24 hodinovom moči ako voľný fenoterol. Podľa týchto údajov je systémová biologická dostupnosť inhalovaných dávok fenoteroliumhydrobromidu odhadovaná na 7 %.
Kinetické parametre popisujúce rozloženie fenoterolu boli vypočítané z plazmatických koncentrácií po i. v. podaní. Profily časov plazmatickej koncentrácie po intravenóznom podaní sa dajú popísať trojkompartmentovým modelom, kde koncový polčas je približne 3 hodiny. V tomto 3-kompartmentovom modeli je zdanlivý distribučný objem fenoterolu v stabilizovanom stave (Vdss) približne 189 l (≈ 2,7 l/kg).
Približne 40 % liečiva sa viaže na plazmatické bielkoviny. Predklinické štúdie s potkanmi ukázali, že fenoterol a jeho metabolity neprestupujú cez hematoencefalickú bariéru. Celkový klírens fenoterolu je 1,8 l/min a renálny klírens je 0,27 l/min.
V štúdii vylučovania v rovnovážnom stave bola kumulovaná renálna exkrécia (2 dni) rádioaktivity spájanej s liečivom (vrátane materskej látky a metabolitov) 65 % dávky po intravenóznom podaní a celková rádioaktivita vylúčená stolicou 14,8 % z dávky. Po perorálnom podaní bola celková izotopom značená látka v moči počas 48 hodín približne 39 % dávky a celková rádioaktivita vylúčená stolicou bola 40,2 % dávky.
IpratroipiumbromidKumulatívna renálna exkrécia (0-24 hod.) ipratropia (materská látka) sa odhaduje na 46 % intravenózne podanej dávky, menej ako 1 % perorálnej dávky a približne 3-13 % dávky inhalovanej pomocou perorálneho aerosólu Berodual N. Podľa týchto údajov sa celková systémová biologická dostupnosť perorálnych dávok ipratropiumbromidu odhaduje na 2 % a inhalovaného na 7-28 %. Berúc toto do úvahy, prehltnuté časti dávky ipratropiumbromidu neprispievajú významne k systémovej expozícii.
Kinetické parametre opisujúce rozloženie ipratropia boli vypočítané z plazmatických koncentrácií po
i. v. podaní. Bol pozorovaný rýchly dvojfázový pokles plazmatických koncentrácií. Zdanlivý distribučný objem v stabilizovanom stave (Vdss) je približne 176 l (≈ 2,4 l/kg). Liečivo sa minimálne (menej ako 20 %) viaže na plazmatické bielkoviny. Predklinické štúdie na potkanoch a psoch ukázali, že kvartérny amín ipratropium neprestupuje hematoencefalickou bariérou.
Polčas koncovej vylučovacej fázy je približne 1,6 hodiny. Celkový klírens ipratropia je 2,3 l/min a renálny klírens je 0,9 l/min. Po intravenóznom podaní sa približne 60 % dávky metabolizuje oxidáciou najmä v pečeni.
V štúdii vylučovania v rovnovážnom stave bola kumulovaná renálna exkrécia (6 dní) s liečivom súvisiacej rádioaktivity (vrátane materskej látky a všetkých metabolitov) 72,1 % po intravenóznom podaní, 9,3 % po perorálnom podaní a 3,2 % po inhalácii. Celková rádioaktivita vylúčená stolicou bola po intravenóznom podaní 6,3 %, 88,5 % po perorálnom podaní a 69,4 % po inhalácii. Hlavná cesta vylučovania izotopom značenej látky po intravenóznom podaní je obličkami. Vylučovací polčas izotopom značenej látky (materská látka a metabolity) je 3,6 hodín. Väzba hlavných metabolitov v moči na muskarínové receptory je zanedbateľná a metabolity možno považovať za neúčinné.
5.3. Predklinické údaje o bezpečnostiToxikologické štúdie s opakovanými dávkami kombinácie ipratropiumbromidu a fenoteroliumhydrobromidu ukázali, že toxikologické profily zloženia HFA (hnacieho plynu) a konvenčného CFC (freónu) sú podobné.
V štúdiách toxicity jedinej dávky s kombináciou ipratropiumbromid a fenoteroliumhydrobromid v pomere 1/2,5 (ipratropiumbromid/fenoteroliumhydrobromidu) u myší a potkanov po perorálnom, intravenóznom a inhalačnom podaní odhalili nízku hladinu akútnej toxicity. Pri porovnaní jednotlivých zložiek sa hodnoty LD
50 kombinácie pripísali viac zložke ipratropiumbromidu než fenoteroliumhydrobromidu bez náznaku potenciácie.
Štúdie toxicity opakovaných dávok s kombináciou ipratropiumbromid a fenoteroliumhydrobromid boli vykonané na potkanoch (perorálne, inhalačne) a psoch (intravenózne, inhalačne) počas 13 týždňov. Boli pozorované len menšie toxické účinky pri koncentráciách niekoľko sto-násobne vyšších, ako sú odporúčané dávky pre ľudí. V najväčšej terapeutickej skupine 4-týždňovej intravenóznej štúdie na psoch (84 µg/kg/deň) sa len u jedného zvieraťa vyskytli jazvy na myokarde ľavej komory. 13-týždňová štúdia perorálneho podávania u potkanov a 13-týždňová štúdia inhalačného podávania u psov nepreukázali žiadne toxikologické zmeny navyše, v porovnaní s jednotlivými zložkami.
V kombinácii neboli žiadne náznaky vzájomnej potenciácie jednotlivých zložiek. Všetky pozorované nežiaduce účinky sú dobre známe u fenoteroliumhydrobromidu a ipratropiumbromidu.
Po inhalačnom podaní kombinácie ipratropiumbromidu a fenoteroliumhydrobromidu potkanom a králikom sa neobjavili žiadne teratogénne účinky. Takisto sa neobjavili žiadne teratogénne účinky po podaní ipratropiumbromidu a po inhalačnom podaní fenoteroliumhydrobromidu. Po perorálnom podávaní dávok >25 mg/kg/deň (králici) a >38,5 mg/kg/deň (myši) indukoval fenoterolium-hydrobromid zvýšenie výskytu malformácií.
Pozorované malformácie sú považované za efekt triedy beta-agonistov. Pri dávkach ipratropiumbromidu do 90 mg/kg/deň a do 40 mg/kg/deň fenoteroliumhydrobromidu nedošlo k zhoršeniu fertility potkanov.
Štúdie zamerané na genotoxicitu kombinácie neboli vykonané. V skúškach
in vitro a
in vivo sa však ukázalo, že ani fenoteroliumhydrobromid, ani ipratropiumbromid nemá mutagénny potenciál.
Štúdie karcinogenity neboli s kombináciou vykonané. V dlhodobých štúdiách na myšiach a potkanoch neboli preukázané tumorigénne a karcinogénne účinky ipratropiumbromidu.
S fenoteroliumhydrobromidom boli vykonané štúdie karcinogenity po perorálnom (myši 18 mesiacov, potkany 24 mesiacov) a inhalačnom podaní (potkany 24 mesiacov). Po perorálnom podávaní dávok 25 mg/kg/deň sa objavil zvýšený výskyt leiomyómu maternice s vyriabilnou mitotickou aktivitou u myší a mezovariálneho leiomyómu u potkanov. Tieto nálezy sa môžu považovať za účinok v dôsledku lokálneho vplyvu beta-adrenergných látok hladkého svalstva maternice myší a potkanov. S ohľadom na súčasnú úroveň poznania sa tieto výsledky nedajú uplatniť u ľudí. Všetky ostatné zistené neoplazmy boli považované za bežné typy novotvarov spontánne vznikajúcich u týchto kmeňov a nepreukázali biologickú súvislosť zvýšenia výskytu vo vzťahu k liečbe fenoteroliumhydrobromidom.
Ukázalo sa, že dýchací trakt rovnako dobre znáša odmerný aerosól HFA aj odmerný aerosól CFC.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokNorflurán, bezvodá kyselina citrónová, čistená voda, bezvodý etanol.
6.2. InkompatibilityNeaplikovateľné.
6.3. Čas použiteľnosti3 roky
6.4. Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ºC.
Chráňte pred priamym slnečným svetlom, vysokou teplotou a mrazom.
6.5. Druh obalu a obsah baleniaKovová nádobka s dávkovacím ventilom, papierová škatuľka, písomná informácia pre používateľov.
Veľkosť balenia: 10 ml/200 dávok
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6. Špeciálne opatrenia na likvidáciuNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBoehringer Ingelheim International GmbH
Binger Strasse 173
D-55216 Ingelheim nad Rýnom
Nemecko
8. REGISTRAČNÉ ČÍSLO14/0121/83-C/S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE13.05.1983/bez časového obmedzenia
10. DÁTUM REVÍZIE TEXTUFebruár 2013
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke www.sukl.sk