
čba.
Paradoxný bronchospazmus
Tak ako aj iné druhy inhalačnej liečby, podanie tohto lieku môže mať za následok paradoxný
bronchospazmus, ktorý môže ohrozovať život. V prípade jeho výskytu sa má podávanie okamžite prerušiť a má sa začať alternatívna liečba.
Kardiovaskulárne účinky beta-agonistov
Tak ako iné lieky obsahujúce beta2-adrenergné agonisty, tento liek môže u niektorých pacientov
vyvolať klinicky významný kardiovaskulárny účinok, vyhodnotený na základe zvýšenej srdcovej
frekvencie, zvýšeného krvného tlaku a/alebo symptómov. Ak sa vyskytnú takéto účinky, môže byť potrebné liečbu prerušiť.
Tento liek sa má používať opatrne u pacientov s kardiovaskulárnymi poruchami (ischemická choroba srdca, akútny infarkt myokardu, srdcové arytmie, hypertenzia), epilepsiou alebo tyreotoxikózou, a
u pacientov s neobvyklou odpoveďou na beta2-adrenergné agonisty.
Pacienti s nestabilnou ischemickou chorobou srdca, infarktom myokardu v anamnéze za posledných
12 mesiacov, zlyhávaním ľavej komory triedy III/IV podľa New York Heart Association (NYHA), arytmiou, nekontrolovanou hypertenziou, cerebrovaskulárnym ochorením alebo syndrómom dlhého QT v anamnéze, ako aj pacienti liečení liekmi, o ktorých je známe, že predlžujú QTc, boli vylúčení zo štúdií v programe klinického vývoja indakaterolu/mometazónfuroátu. Výsledky týkajúce sa bezpečnosti u týchto populácií sa preto považujú za neznáme.
Zatiaľ čo pri beta2-adrenergných agonistoch bol hlásený výskyt elektrokardiografických (EKG) zmien, napr. sploštenie vlny T, predĺženie intervalu QT a depresia segmentu ST, klinická významnosť týchto pozorovaní nie je známa.
Dlhodobo pôsobiace beta2-adrenergné agonisty (LABA) alebo lieky obsahujúce kombináciu s LABA ako je Bemrist Breezhaler sa preto majú používať opatrne u pacientov so známym alebo suspektným predĺžením intervalu QT, alebo ktorí sú liečení liekmi ovplyvňujúcimi interval QT.
Hypokaliémia pri beta-agonistoch
U niektorých pacientov môžu beta2-adrenergné agonisty spôsobiť významnú hypokaliémiu, ktorá môže vyvolať nežiaduce kardiovaskulárne účinky. Pokles draslíka v sére je obyčajne prechodný a
nevyžaduje suplementáciu. U pacientov s ťažkou astmou môže hypoxia a súbežná liečba potenciovať hypokaliémiu, čo môže zvýšiť náchylnosť na srdcové arytmie (pozri časť 4.5).
Klinicky významná hypokaliémia sa nepozorovala v klinických štúdiách
indakaterolu/mometazónfuroátu pri odporúčanej terapeutickej dávke.
Hyperglykémia
Inhalácia vysokých dávok beta2-adrenergných agonistov a kortikosteroidov môže viesť k zvýšeniam glukózy v plazme. Na začiatku liečby sa má u pacientov s diabetom dôslednejšie sledovať glukóza
v plazme.
Tento liek sa neskúmal u pacientov s diabetom mellitus typu I alebo s nekontrolovaným diabetom mellitus typu II.
Prevencia orofaryngálnych infekcií
Na zníženie rizika orofaryngálnej kandidovej infekcie je potrebné pacientov poučiť, aby si po inhalácii
predpísanej dávky vypláchli ústa alebo vykloktali vodou bez prehĺtania alebo vyčistili zuby.
Systémové účinkykortikosteroidov
Systémové účinky inhalačných kortikosteroidov sa môžu vyskytnúť najmä pri dlhodobo
predpisovaných vysokých dávkach. Výskyt týchto účinkov je oveľa menej pravdepodobný ako
pri perorálnych kortikosteroidoch a môže sa líšiť u individuálnych pacientov a pri rôznych kortikosteroidových liekoch.
Možné systémové účinky môžu zahŕňať Cushingov syndróm, cushingoidné prejavy, útlm funkcie nadobličiek, spomalenie rastu u detí a dospievajúcich, zníženie hustoty kostných minerálov, katarakty, glaukóm a zriedkavejšie aj rôzne účinky na psychiku alebo správanie zahŕňajúce psychomotorickú hyperaktivitu, poruchy spánku, úzkosť, depresiu alebo agresivitu (hlavne u detí). Je preto dôležité, aby sa dávka inhalačného kortikosteroidu titrovala na najnižšiu dávku, pri ktorej sa udržiava účinná kontrola astmy.
Pri systémovom a lokálnom (vrátane intranazálneho, inhalačného a intraokulárneho) používaní kortikosteroidu môže byť nahlásená porucha zraku. U pacientov s príznakmi ako je rozmazané videnie alebo iné poruchy zraku sa má zvážiť doporučenie k očnému lekárovi za účelom vyhodnotiť možné príčiny porúch zraku, medzi ktoré môže patriť katarakta, glaukóm alebo zriedkavé choroby, ako je centrálna serózna chorioretinopatia (CSCR), ktoré boli hlásené po použití systémových a lokálnych kortikosteroidov.
Tento liek sa má podávať opatrne pacientom s tuberkulózou pľúc alebo pacientom s chronickými
alebo neliečenými infekciami.
Pomocné látky
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú používať
tento liek.
4.5 Liekové a iné interakcie
Osobitné interakčné štúdie s indakaterolom/mometazónfuroátom sa nevykonali. Údaje o potenciále pre interakcie sa zakladajú na potenciále oboch liečiv v monoterapii.
Lieky, o ktorých jeznáme,žepredlžujúinterval QTc
Tak ako iné lieky obsahujúce beta2-adrenergné agonisty, tento liek sa má podávať s opatrnosťou pacientom, ktorí sa liečia inhibítormi monoaminooxidázy, tricyklickými antidepresívami alebo liekmi,
o ktorých je známe, že predlžujú interval QT, keďže akýkoľvek ich účinok na interval QT sa môže potenciovať. Lieky, o ktorých je známe, že predlžujú interval QT, môžu zvyšovať riziko komorovej arytmie (pozri časti 4.4 a 5.1).
Hypokaliemizujúca liečba
Súbežná hypokaliemizujúca liečba derivátmi metylxantínu, steroidmi alebo diuretikami nešetriacimi
draslík môže potenciovať možný hypokaliemizujúci účinok beta2-adrenergných agonistov (pozri
časť 4.4).
Beta-adrenergné blokátory
Beta-adrenergné blokátory môžu oslabiť alebo antagonizovať účinok beta2-adrenergných agonistov. Preto sa tento liek nemá podávať súbežne s beta-adrenergnými blokátormi, pokiaľ na ich používanie
nie sú závažné dôvody. Ak je to potrebné, majú sa uprednostniť kardioselektívne beta-adrenergné
blokátory, avšak musia sa podávať s opatrnosťou.
Interakcia s inhibítormi CYP3A4 a glykoproteínu P
Inhibícia CYP3A4 a glykoproteínu P (P-gp) nemá vplyv na bezpečnosť terapeutických dávok lieku
Bemrist Breezhaler.
Inhibícia kľúčových látok podieľajúcich sa na klírense indakaterolu (CYP3A4 a P-gp) alebo klírense mometazónfuroátu (CYP3A4) zvyšuje systémovú expozíciu indakaterolu alebo mometazónfuroátu až na dvojnásobok.
Vzhľadom na veľmi nízku koncentráciu v plazme, ktorá sa dosiahne po inhalačnom podaní, klinicky významné interakcie s mometazónfuroátom sú nepravdepodobné. Je však možnosť zvýšenej systémovej expozície mometazónfuroátu pri súbežnom podávaní so silnými inhibítormi CYP3A4 (napr. ketokonazolom, itrakonazolom, nelfinavirom, ritonavirom, kobicistatom).
I
né dlhodobo pôsobiace beta
2
-
adrenergné agonisty
Súbežné podávanie tohto lieku s inými liekmi obsahujúcimi dlhodobo pôsobiace beta2-adrenergné agonisty sa neskúmalo a neodporúča sa, keďže môže potenciovať nežiaduce reakcie (pozri časti 4.8 a
4.9).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití lieku Bemrist Breezhaler alebo jeho jednotlivých zložiek
(indakaterolu a mometazónfuroátu) u gravidných žien, aby sa stanovilo, či pri nich existuje riziko.
Indakaterol nebol teratogénny u potkanov a králikov po subkutánnom podaní (pozri
časť 5.3).V štúdiách reprodukcie na zvieratách s gravidnými myšami, potkanmi a králikmi spôsobil mometazónfuroát zvýšenie malformácií u plodov a znížené prežívanie a rast plodov.
Tak ako iné lieky obsahujúce beta2-adrenergné agonisty, indakaterol môže inhibovať pôrodné
kontrakcie relaxačným účinkom na hladké svalstvo maternice.
Tento liek sa má používať v gravidite len vtedy, ak očakávaný prínos pre pacientku prevýši
potenciálne riziko pre plod.
Dojčenie
Nie sú k dispozícii informácie o prítomnosti indakaterolu alebo mometazónfuroátu v ľudskom mlieku,
o účinkoch na dojčené dieťa alebo o účinkoch na tvorbu mlieka. Iné inhalačné kortikosteroidy podobné mometazónfuroátu prestupujú do ľudského mlieka. Indakaterol (vrátane jeho metabolitov) a
mometazónfuroát sa zistili v mlieku dojčiacich potkanov.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Reprodukčné štúdie a iné údaje u zvierat nenaznačili problémy týkajúce sa fertility ani u samcov, ani
u samíc.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Tento liek nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Najčastejšie nežiaduce reakcie počas 52 týždňov boli astma (exacerbácia) (26,9 %), nazofaryngitída
(12,9 %), infekcia horných dýchacích ciest (5,9 %) a bolesť hlavy (5,8 %).
T
abuľkový zoznam nežiaducichreakciíNežiaduce reakcie na liek (
adverse drug reactions, ADR) sú zoradené podľa tried orgánových
systémov MedDRA (tabuľka 1). Frekvencia ADR sa zakladá na štúdii PALLADIUM. V rámci každej triedy orgánových systémov sú nežiaduce reakcie zoradené podľa frekvencie, pričom najčastejšie reakcie sú uvedené ako prvé. V rámci každej skupiny frekvencie sú nežiaduce reakcie zoradené
v poradí klesajúcej závažnosti. Okrem toho sú zodpovedajúce kategórie frekvencie pre každú nežiaducu reakciu určené podľa nasledujúcej konvencie (CIOMS III): veľmi časté (≥1/10); časté
(≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi
zriedkavé (<1/10 000).
Tabuľka 1 Nežiaduce reakcieTrieda orgánových systémov
| Nežiaduce reakcie
| Kategória frekvencie
|
Infekcie a nákazy
| Nazofaryngitída
| Veľmi časté
|
Infekcia horných dýchacích
ciest
| Časté
|
Kandidóza*1
| Menej časté
|
Poruchy imunitného systému
| Precitlivenosť*2
| Časté
|
Angioedém*3
| Menej časté
|
Poruchy metabolizmu a výživy
| Hyperglykémia*4
| Menej časté
|
Poruchy nervového systému
| Bolesť hlavy*5
| Časté
|
Poruchy oka
| Rozmazané videnie
| Menej časté
|
Katarakta*6
| Menej časté
|
Poruchy srdca a srdcovej činnosti
| Tachykardia*7
| Menej časté
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Astma (exacerbácia)
| Veľmi časté
|
Orofaryngálna bolesť*8
| Časté
|
Dysfónia
| Časté
|
Poruchy kože a podkožného tkaniva
| Exantém*9
| Menej časté
|
Pruritus*10
| Menej časté
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Bolesť svalov a kostí*11
| Časté
|
Svalové kŕče
| Menej časté
|
* Označuje zoskupenie preferovaných termínov (PT):
1 Orálna kandidóza, orofaryngálna kandidóza.
2 Liekový exantém, precitlivenosť na liek, precitlivenosť, exantém, erytematózny exantém, svrbivý exantém, urtikária.
3 Alergický edém, angioedém, periorbitálny opuch, opuch očného viečka.
4 Zvýšená glukóza v krvi, hyperglykémia.
5 Bolesť hlavy, tenzná bolesť hlavy.
6 Katarakta, kortikálna katarakta.
7 Zvýšená srdcová frekvencia, tachykardia, sínusová tachykardia, supraventrikulárna tachykardia.
8 Bolesť úst, nepríjemné pocity v ústach a hrtane, orofaryngálna bolesť, podráždenie hrdla, odynofágia.
9 Liekový exantém, exantém, erytematózny exantém, svrbivý exantém.
10 Svrbenie konečníka, svrbenie očí, svrbenie nosa, pruritus, svrbenie genitálií.
11 Bolesť chrbta, bolesť svalov a kostí, myalgia, bolesť šije, bolesť svalov a kostí hrudníka.
|
Hlásenie podozrení na nežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Pri podozrení na predávkovanie sa majú začať celkové podporné opatrenia a symptomatická liečba. Predávkovanie pravdepodobne vyvolá prejavy, príznaky alebo nežiaduce účinky spojené
s farmakologickým pôsobením jednotlivých zložiek (napr. tachykardiu, tremor, palpitácie, bolesť
hlavy, nauzeu, vracanie, ospalosť, komorové arytmie, metabolickú acidózu, hypokaliémiu,
hyperglykémiu, útlm funkcie hypotalamo-hypofýzo-adrenálnej osi).
Je možné zvážiť podanie kardioselektívnych beta-blokátorov na liečbu beta2-adrenergných účinkov, avšak iba pod dohľadom lekára a s mimoriadnou opatrnosťou, pretože použitie beta2-adrenergných blokátorov môže vyvolať bronchospazmus. V závažných prípadoch majú byť pacienti hospitalizovaní.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá na obštrukčné choroby dýchacích ciest, adrenergiká
v kombinácii s kortikosteroidmi alebo inými liekmi okrem anticholinergík, ATC kód: R03AK14
Mechanizmus účinku
Tento liek je kombináciou indakaterolu, dlhodobo pôsobiaceho beta2-adrenergného agonistu (LABA), a mometazónfuroátu, inhalačného syntetického kortikosteroidu (ICS).
Indakaterol
Farmakologické účinky agonistov beta2-adrenergných receptorov vrátane indakaterolu možno aspoň čiastočne pripísať zvýšeným koncentráciám cyklického 3’, 5’-adenozínmonofosfátu (cyklického AMP), ktoré vyvolávajú uvoľnenie hladkého svalstva priedušiek.
Po inhalácii pôsobí indakaterol lokálne v pľúcach ako bronchodilatancium. Indakaterol je čiastočný agonista ľudského beta2-adrenergného receptoru účinkujúci v nanomolárnom množstve. V izolovanej ľudskej prieduške má indakaterol rýchly nástup účinku a dlhodobý účinok.
Hoci sú beta2-adrenergné receptory prevládajúcimi adrenergnými receptormi v hladkom svalstve priedušiek a beta1-receptory prevládajúcimi receptormi v ľudskom srdci, nachádzajú sa v ľudskom srdci aj beta2-adrenergné receptory, ktoré tvoria 10 % až 50 % z celkového počtu adrenergných receptorov.
Mometazónfuroát
Mometazónfuroát je syntetický kortikosteroid s vysokou afinitou ku glukokortikoidovým receptorom a s lokálnymi protizápalovými vlastnosťami. Mometazónfuroát in vitro inhibuje uvoľňovanie
leukotriénov z leukocytov alergických pacientov. V bunkovej kultúre mometazónfuroát preukázal
vysokú účinnosť pri inhibícii syntézy a uvoľňovania IL-1, IL-5, IL-6 a TNF-alfa. Je tiež účinným
inhibítorom tvorby leukotriénov a tvorby Th2 cytokínov IL-4 a IL-5 z ľudských CD4+ T-buniek.
Farmakodynamické účinky
Pre profil farmakodynamickej odpovede na tento liek je charakteristický rýchly nástup účinku
do 5 minút po podaní a pretrvávanie účinku počas 24-hodinového intervalu medzi podaniami, ako sa preukázalo zlepšením najnižšieho úsilného výdychového objemu v prvej sekunde (FEV1) oproti komparátorom 24 hodín po podaní.
Nepozorovala sa tachyfylaxia prínosu tohto lieku pre pľúcne funkcie v priebehu času.
Interval QTc
Účinok tohto lieku na interval QTc sa nevyhodnotil v detailnej štúdii QT (TQT). Nie je známe, že by mometazónfuroát predlžoval QTc.
Klinická účinnosťabezpečnosť
V dvoch randomizovaných, dvojito zaslepených štúdiách fázy III (PALLADIUM a QUARTZ)
s rôznym trvaním sa vyhodnotila bezpečnosť a účinnosť lieku Bemrist Breezhaler u dospelých a dospievajúcich pacientov s pretrvávajúcou astmou.
Štúdia PALLADIUM bola 52 týždňov trvajúca pivotná štúdia, v ktorej sa vyhodnotilo podávanie lieku
Bemrist Breezhaler 125 μg/127,5 μg raz denne (N=439) a 125 μg/260 μg raz denne (N=445)
v porovnaní s mometazónfuroátom 400 μg raz denne (N=444) a 800 μg denne (podávané ako 400 μg
dvakrát denne) (N=442). V tretej skupine aktívnej kontroly boli účastníci liečení
salmeterolom/flutikazónpropionátom 50 μg/500 μg dvakrát denne (N=446). Všetci účastnící museli mať symptómy astmy (skóre ACQ-7 ≥1,5) a dostávali udržiavaciu liečbu astmy zahŕňajúcu inhalačný syntetický kortikosteroid (ICS) s LABA alebo bez neho počas najmenej 3 mesiacov pred zaradením do štúdie. Pri skríningu malo 31 % pacientov v anamnéze exacerbáciu počas predchádzajúceho roka. Pri zaradení do štúdie boli najčastejšie hlásenými liekmi na astmu stredné dávky ICS (20 %), vysoké dávky ICS (7 %) alebo nízke dávky ICS v kombinácii s LABA (69 %).
Primárnym cieľom štúdie bolo preukázať superioritu buď lieku Bemrist Breezhaler 125 μg/127,5 μg raz denne oproti mometazónfuroátu 400 μg raz denne, alebo Bemrist Breezhaler 125 μg/260 μg raz denne oproti mometazónfuroátu 400 μg dvakrát denne na základe najnižšej hodnoty FEV1
po 26. týždni.
Po 26. týždni sa pri oboch liekoch Bemrist Breezhaler 125 μg/127,5 μg a 125 μg/260 μg raz denne preukázalo štatisticky významné zlepšenie najnižšieho FEV1 a skóre Asthma Control Questionnaire (ACQ-7) v porovnaní s mometazónfuroátom 400 μg raz alebo dvakrát denne (pozri tabuľku 2). Nálezy po 52. týždni a 26. týždni sa zhodovali.
Pri liekoch Bemrist Breezhaler 125 μg/127,5 μg aj 125 μg/260 μg raz denne sa preukázalo klinicky významné zníženie ročného výskytu stredne ťažkých až ťažkých exacerbácií (sekundárny koncový ukazovateľ) v porovnaní s mometazónfuroátom 400 μg raz a dvakrát denne (pozri tabuľku 2).
Výsledky klinicky najvýznamnejších koncových ukazovateľov sú uvedené v tabuľke 2.
Pľ
úcne funkcie, symptómy a exacerbácie
T
abuľka 2 Výsledky primárnych a sekundárnych koncových ukazovateľov v štúdii
P
ALLAD
IUM v 26. a 52. týždni
Ko
ncový ukazovateľ
|
Čas/ Trvanie
|
B
e
m
rist Breezhaler
1
o
proti MF
2
|
B
e
m
rist Breezhaler
1
o
proti SAL/FP
3
|
|
|
Stredná dávka
oproti strednej dávke
|
Vysoká dávka
oproti vysokej dávke
|
Vysoká dávka
oproti vysokej dávke
|
P
ľúcne funkcie
|
N
a
jnižší FEV
14
|
Rozdiel medzi
liečbami
p-hodnota
(95% IS)
|
26. týždeň
(primárny koncový
ukazovateľ)
|
211 ml
<0,001 (167, 255)
|
132 ml
<0,001 (88, 176)
|
36 ml
0,101
(-7, 80)
|
52. týždeň
|
209 ml
<0,001 (163, 255)
|
136 ml
<0,001 (90, 183)
|
48 ml
0,040 (2, 94)
|
Priemerný ranný vrcholový výdychový prietok (PEF)*
|
Rozdiel medzi
liečbami
(95% IS)
|
52. týždeň
|
30,2 l/min
(24,2; 36,3)
|
28,7 l/min
(22,7; 34,8)
|
13,8 l/min
(7,7; 19,8)
|
Priemerný večerný vrcholový výdychový prietok (PEF)*
|
Rozdiel medzi
liečbami
(95% IS)
|
52. týždeň
|
29,1 l/min
(23,3; 34,8)
|
23,7 l/min
(18,0; 29,5)
|
9,1 l/min
(3,3; 14,9)
|
Symptómy
|
ACQ-7
|
Rozdiel medzi
liečbami
p-hodnota
(95% IS)
|
26. týždeň
(kľúčový sekundárny koncový ukazovateľ)
|
-0,248
<0,001
(-0,334; -0,162)
|
-0,171
<0,001
(-0,257; -0,086)
|
-0,054
0,214
(-0,140; 0,031)
|
52. týždeň
|
-0,266
(-0,354; -0,177)
|
-0,141
(-0,229; -0,053)
|
0,010
(-0,078; 0,098)
|
Pacienti s odpoveďou pri ACQ (percentuálny podiel pacientov, u ktorých sa dosiahol oproti východiskovej
hod
n
o
te minimálny klinicky významný rozdiel (MCID) ACQ ≥0,5)
|
Percentuálny podiel
|
26. týždeň
|
76 % oproti
67 %
|
76 % oproti
72 %
|
76 % oproti 76 %
|
Pomer
pravdepodobností
(95% IS)
|
26. týždeň
|
1,73
(1,26; 2,37)
|
1,31
(0,95; 1,81)
|
1,06
(0,76; 1,46)
|
Percentuálny podiel
|
52. týždeň
|
82 % oproti
69 %
|
78 % oproti
74 %
|
78 % oproti 77 %
|
Pomer
pravdepodobností
(95% IS)
|
52. týždeň
|
2,24
(1,58; 3,17)
|
1,34
(0,96; 1,87)
|
1,05
(0,75; 1,49)
|
Percentuálny podiel dní bez záchranného lieku*
|
Rozdiel medzi
liečbami
(95% IS)
|
52. týždeň
|
8,6
(4,7; 12,6)
|
9,6
(5,7; 13,6)
|
4,3
(0,3; 8,3)
|
Percentuálny podiel dní bez symptómov*
|
Rozdiel medzi
liečbami
(95% IS)
|
52. týždeň
|
9,1
(4,6; 13,6)
|
5,8
(1,3; 10,2)
|
3,4
(-1,1; 7,9)
|
Ročný výskyt exacerbácií astmy**
|
S
tredne ťažké alebo ťažké exacerbácie
|
AR
|
52. týždeň
|
0,27 oproti 0,56
|
0,25 oproti 0,39
|
0,25 oproti 0,27
|
RR
(95% IS)
|
52. týždeň
|
0,47
(0,35; 0,64)
|
0,65
(0,48; 0,89)
|
0,93
(0,67; 1,29)
|
Ťažké exacerbácie
|
AR
|
52. týždeň
|
0,13 oproti 0,29
|
0,13 oproti 0,18
|
0,13 oproti 0,14
|
RR
(95% IS)
|
52. týždeň
|
0,46
(0,31; 0,67)
|
0,71
(0,47; 1,08)
|
0,89
(0,58; 1,37)
|
* Priemerná hodnota pre trvanie liečby
** RR <1,00 zvýhodňuje indakaterol/mometazónfuroát
1 Stredná dávka lieku Bemrist Breezhaler: 125 μg/127,5 μg raz denne; vysoká dávka: 125 μg/260 μg raz denne.
2 MF: stredná dávka mometazónfuroátu: 400 μg raz denne; vysoká dávka: 400 μg dvakrát denne
(jednotkové dávky).
Mometazónfuroát 127,5 μg raz denne a 260 μg raz denne v lieku Bemrist Breezhaler je porovnateľný
s mometazónfuroátom 400 μg raz denne a 800 μg denne (podávané ako 400 μg dvakrát denne).
3 SAL/FP: salmeterol/flutikazónpropionát vysoká dávka: 50 μg/500 μg dvakrát denne (jednotková dávka).
4 Najnižší FEV1: priemer dvoch hodnôt FEV1 meraných 23 hodín 15 minút a 23 hodín 45 minút po večernej dávke.
Primárny koncový ukazovateľ (najnižší FEV1 po 26. týždni) a kľúčový sekundárny koncový ukazovateľ (skóre ACQ-7 po 26. týždni) boli súčasťou stratégie testovania na potvrdenie výsledku, a preto boli kontrolované na multiplicitu. Všetky ďalšie koncové ukazovatele neboli súčasťou stratégie testovania na potvrdenie výsledku.
RR = pomer výskytu, AR = ročný výskyt
|
V
opred špecifikovanázdruženáanalýza
Bemrist Breezhaler 125 μg/260 μg raz denne sa skúmal aj ako aktívny komparátor v ďalšej štúdii
fázy III (IRIDIUM), v ktorej všetci účastníci mali v anamnéze počas predchádzajúceho roka exacerbáciu astmy, ktorá si vyžiadala systémové kortikosteroidy. Vopred špecifikovaná združená analýza štúdií IRIDIUM a PALLADIUM sa vykonala na porovnanie lieku Bemrist Breezhaler
125 μg/260 μg raz denne so salmeterolom/flutikazónom 50 μg/500 μg dvakrát denne pre koncové ukazovatele najnižší FEV1 a ACQ-7 po 26. týždni a ročný výskyt exacerbácií. Združená analýza ukázala, že Bemrist Breezhaler zlepšil najnižší FEV1 o 43 ml (95% IS: 17, 69) a skóre ACQ-7 o -0,091 (95% IS: -0,153, -0,030) po 26. týždni a znížil ročný výskyt stredne ťažkých alebo ťažkých
exacerbácií astmy o 22 % (RR: 0,78; 95% IS: 0,66, 0,93) a ťažkých exacerbácií o 26 % (RR: 0,74;
95% IS: 0,61, 0,91) oproti salmeterolu/flutikazónu.
Štúdia QUARTZ bola 12 týždňov trvajúca štúdia, v ktorej sa hodnotil Bemrist Breezhaler
125 μg/62,5 μg raz denne (N=398) v porovnaní s mometazónfuroátom 200 μg raz denne (N=404).
U všetkých účastníkov sa vyžadovalo, aby mali symptómy a dostávali udržiavaciu liečbu astmy
zahŕňajúcu nízke dávky ICS (s LABA alebo bez neho) počas najmenej 1 mesiaca pred zaradením
do štúdie. Pri vstupe do štúdie boli najčastejšie hlásenými liekmi proti astme nízke dávky ICS (43 %) a
LABA/nízke dávky ICS (56 %). Primárnym koncovým ukazovateľom štúdie bolo preukázanie superiority lieku Bemrist Breezhaler 125 μg/62,5 μg raz denne oproti mometazónfuroátu 200 μg raz denne vzhľadom na najnižšiu hodnotu FEV1 po 12. týždni.
Pri lieku Bemrist Breezhaler 125 μg/62,5 μg raz denne sa po 12. týždni preukázalo štatisticky významné zlepšenie najnižšieho FEV1 oproti východiskovému stavu a skóre Asthma Control Questionnaire (ACQ-7) v porovnaní s mometazónfuroátom 200 μg raz denne.
Výsledky klinicky najvýznamnejších koncových ukazovateľov sú uvedené v tabuľke 3.
T
abuľka 3 Výsledky primárnych a sekundárnych koncových ukazovateľov v štúdii
Q
UART
Z po 12. týždni
K
oncové ukazovatele
|
B
e
m
r
i
st Breezhaler nízka dávka*
oproti MF nízka dávka**
|
P
ľúcne funkcie
|
N
ajnižší FEV
1
(
primárny ukazovateľ)***
|
|
Rozdiel medzi liečbami
p-hodnota
(95% IS)
|
182 ml
<0,001 (148, 217)
|
Priemerný ranný vrcholový výdychový prietok (PEF)
|
Rozdiel medzi liečbami
(95% IS)
|
27,2 l/min
(22,1; 324)
|
Priemerný večerný vrcholový výdychový prietok (PEF)
|
Rozdiel medzi liečbami
(95% IS)
|
26,1 l/min
(21,0; 31,2)
|
Symptómy
|
ACQ-7 (kľúčový sekundárny koncový ukazovateľ)
|
|
Rozdiel medzi liečbami
p-hodnota
(95% IS)
|
-0,218
<0,001
(-0,293; -0,143)
|
Percentuálny podiel pacientov, ktorí dosiahli oproti východiskovej hodnote MCID ACQ ≥0,5
|
Percentuálny podiel
Pomer pravdepodobností
(95% IS)
|
75 % oproti 65 %
1,69 (1,23; 2,33)
|
Percentuálny podiel dní bez záchranného lieku
|
Rozdiel medzi liečbami
(95% IS)
|
8,1
(4,3; 11,8)
|
Percentuálny podiel dní bez symptómov
|
Rozdiel medzi liečbami
(95% IS)
|
2,7
(-1,0; 6,4)
|
* Bemrist Breezhaler nízka dávka: 125/62,5 μg raz denne.
** MF: mometazónfuroát nízka dávka: 200 μg raz denne (jednotková dávka).
Mometazónfuroát 62,5 μg v lieku Bemrist Breezhaler raz denne je porovnateľný
s mometazónfuroátom 200 μg raz denne (jednotková dávka).
*** Najnižší FEV1: priemer dvoch hodnôt FEV1 meraných 23 hodín 15 minút a 23 hodín 45 minút po večernej dávke.
|
Pediatrická populácia
V štúdii PALLADIUM, do ktorej bolo zaradených 106 dospievajúcich účastníkov (vo veku
12-17 rokov), bolo zlepšenie najnižšieho FEV1 po 26. týždni 0,173 litrov (95% IS: -0,021; 0,368)
pri lieku Bemrist Breezhaler 125 μg/260 μg raz denne v porovnaní s mometazónfuroátom 800 μg (t.j.
vysokými dávkami) a 0,397 litrov (95% IS: 0,195; 0,599) pri lieku Bemrist Breezhaler
125 μg/127,5 μg raz denne v porovnaní s mometazónfuroátom 400 μg raz denne (t.j. strednými
dávkami).
V štúdii QUARTZ, do ktorej bolo zaradených 63 dospievajúcich účastníkov (vo veku 12-17 rokov),
rozdiel medzi liečbami stanovený metódou najmenších štvorcov pre najnižší FEV1 na 85. deň
(12. týždeň) bol 0,251 litrov (95% IS: 0,130; 0,371).
V podskupinách dospievajúcich účastníkov sa zlepšenie pľúcnych funkcií, symptómov a zníženie
exacerbácií zhodovalo s celkovou populáciou.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií
s indakaterolom/mometazónfuroátom v jednej alebo vo viacerých podskupinách pediatrickej populácie pre astmu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po inhalácii lieku Bemrist Breezhaler bol medián času do dosiahnutia maximálnych plazmatických
koncentrácií indakaterolu približne 15 minút a mometazónfuroátu 1 hodina.
Na základe údajov o účinnosti in vitro sa predpokladá, že dávka každej zložky v monoterapii, ktorá sa dostane do pľúc, je podobná pri kombinácii indakaterol/mometazónfuroát a pri liekoch, ktoré ich obsahujú ako monoterapiu. Expozícia indakaterolu a mometazónfuroátu v plazme v rovnovážnom stave po inhalácii kombinácie bola podobná systémovej expozícii po inhalácii indakaterolmaleátu alebo mometazónfuroátu v liekoch, ktoré ich obsahujú ako monoterapiu.
Po inhalácii kombinácie bol odhad absolútnej biologickej dostupnosti indakaterolu asi 45 % a mometazónfuroátu menej ako 10 %.
Indakaterol
Koncentrácie indakaterolu sa zvyšovali pri opakovanom podávaní raz denne. Rovnovážny stav sa dosiahol za 12 až 14 dní. Priemerný pomer akumulácie indakaterolu, t.j. AUC počas 24-hodinového intervalu medzi dávkami na 14. deň v porovnaní s 1. dňom, bol v rozmedzí od 2,9 do 3,8 pri dávkach medzi 60 μg a 480 μg inhalovaných raz denne (podaná dávka). Systémová expozícia je daná súčtom pľúcnej a gastrointestinálnej absorpcie; asi 75 % systémovej expozície pochádza z pľúcnej absorpcie a asi 24 % z gastrointestinálnej absorpcie.
Mometazónfuroát
Koncentrácie mometazónfuroátu sa zvyšovali pri opakovanom podávaní raz denne pomocou inhalátora Breezhaler. Rovnovážny stav sa dosiahol po 12 dňoch. Priemerný pomer akumulácie mometazónfuroátu, t.j. AUC počas 24-hodinového intervalu medzi dávkami na 14. deň v porovnaní s 1. dňom, bol v rozmedzí od 1,61 do 1,71 pri dávkach medzi 62,5 μg a 260 μg inhalovaných raz denne ako súčasť kombinácie indakaterol/mometazónfuroát.
Po perorálnom podaní mometazónfuroátu sa odhadlo, že absolútna perorálna systémová biologická dostupnosť mometazónfuroátu je veľmi nízka (<2 %).
D
i
stribúcia
I
ndakaterol
Po intravenóznej infúzii bol distribučný objem (Vz) indakaterolu 2 361 až 2 557 litrov, čo naznačuje rozsiahlu distribúciu. Väzba in vitro na bielkoviny ľudského séra bola 94,1 až 95,3 % a na bielkoviny plazmy 95,1 až 96,2 %.
Mometazónfuroát
Po intravenóznom podaní ako bolus je Vd 332 litrov. Väzba mometazónfuroátu na bielkoviny in vitro
je vysoká, 98 % až 99 % v rozmedzí koncentrácií 5 až 500 ng/ml.
Biotransformácia
Indakaterol
Po perorálnom podaní rádioaktívne značeného indakaterolu v štúdii ADME (absorpcia, distribúcia,
metabolizmus, vylučovanie) u ľudí bol hlavnou zložkou v sére nezmenený indakaterol, na ktorý pripadala približne jedna tretina celkovej AUC súvisiacej s liečivom počas 24 hodín. Najvýznamnejším metabolitom v sére bol hydroxylovaný derivát. Ďalšími významnými metabolitmi boli fenolové O-glukuronidy indakaterolu a hydroxylovaný indakaterol. Diastereoizomér hydroxylovaného derivátu, N-glukuronid indakaterolu, a C- a N-dealkylované produkty boli ďalšími identifikovanými metabolitmi.
Sledovania in vitro ukázali, že UGT1A1 bola jediná izoforma UGT, ktorá metabolizovala indakaterol na fenolový O-glukuronid. Oxidačné metabolity sa našli pri inkubáciách s rekombinantnými CYP1A1, CYP2D6 a CYP3A4. Usudzuje sa, že CYP3A4 je hlavným izoenzýmom zodpovedným
za hydroxyláciu indakaterolu. Skúmania in vitro ďalej naznačili, že indakaterol je substrát s nízkou afinitou k efluxnej pumpe P-gp.
Izoforma UGT1A1 sa in vitro najviac podieľa na metabolickom klírense indakaterolu. Ako sa však ukázalo v klinickej štúdii u populácií s rôznymi genotypmi UGT1A1, systémovú expozíciu indakaterolu genotyp UGT1A1 významne neovplyvňuje.
Mometazónfuroát
Časť dávky inhalovaného mometazónfuroátu, ktorá sa prehltne a absorbuje v gastrointestinálnom trakte, podlieha rozsiahlemu metabolizmu na početné metabolity. V plazme nie sú detekovateľné
prevažujúce metabolity. V mikrozómoch ľudskej pečene sa mometazónfuroát metabolizuje'
prostredníctvom CYP3A4.
Eliminácia
Indakaterol
V klinických štúdiách, ktorých súčasťou bol zber moču, bolo množstvo nezmeneného indakaterolu vylúčeného močom spravidla nižšie ako 2 % dávky. Obličkový klírens indakaterolu bol v priemere
medzi 0,46 a 1,20 litrov/hodinu. V porovnaní so sérovým klírensom indakaterolu 18,8 až
23,3 litrov/hodinu je zjavné, že obličkový klírens zohráva pri eliminácii systémovo dostupného
indakaterolu malú úlohu (približne 2 až 6 % systémového klírensu).
V štúdii ADME u ľudí, v ktorej sa indakaterol podával perorálne, vylučovanie stolicou prevládalo na vylučovaním močom. Indakaterol sa vylučoval do ľudskej stolice predovšetkým ako nezmenená pôvodná látka (54 % dávky) a v menšej miere ako hydroxylované metabolity indakaterolu (23 % dávky). Hmotnostná rovnováha bola úplná pri ≥90 % dávky nájdených vo výlučkoch.
Koncentrácie indakaterolu v sére klesali viacfázovo, s priemerným konečným polčasom v rozmedzí
od 45,5 do 126 hodín. Efektívny polčas vyrátaný z akumulácie indakaterolu po opakovanom podávaní bol v rozmedzí od 40 do 52 hodín, čo je v súlade s pozorovaným časom do dosiahnutia rovnovážneho
stavu približne 12 až 14 dní.
M
ometazónfuroát
Po intravenóznom podaní ako bolus má mometazónfuroát terminálny eliminačný polčas T½ približne
4,5 hodiny. Rádioaktívne značená perorálne inhalovaná dávka sa vylučuje hlavne stolicou (74 %) a
v menšej miere močom (8 %).
Interakcie
Súbežné podávanie perorálne inhalovaného indakaterolu a mometazónfuroátu pri rovnovážnom stave
neovplyvnilo farmakokinetiku ani jedného liečiva.
Linearita/nelinearita
Systémová expozícia mometazónfuroátu sa zvyšovala úmerne dávke po jednorazovom a opakovanom
podávaní lieku Bemrist Breezhaler 125 μg/62,5 μg a 125 μg/260 μg zdravým osobám. Nižšie ako dávke úmerné zvýšenie systémovej expozície v rovnovážnom stave sa zaznamenalo u pacientov
s astmou v rozmedzí dávok od 125 μg/62,5 μg do 125 μg/260 μg. Stanovenie úmernosti dávke sa
nevykonalo pri indakaterole, keďže vo všetkých liekových silách sa použila len jedna dávka.
Pediatrická populácia
Bemrist Breezhaler sa môže používať u dospievajúcich pacientov (vo veku 12 rokov a starších)
s rovnakým dávkovaním ako u dospelých.
Osobitné populácie
Analýza populačnej farmakokinetiky u pacientov s astmou po inhalácii
indakaterolu/mometazónfuroátu neukázala významný vplyv veku, pohlavia, telesnej hmotnosti,
fajčenia, odhadovanej východiskovej rýchlosti glomerulárnej filtrácie (eGFR) a východiskového FEV1
na systémovú expozíciu indakaterolu a mometazónfuroátu.
Pacienti s poruc hou f unkcie obli či ek
Vzhľadom na veľmi nízky podiel vylučovania močom na celkovej eliminácii z tela pri indakaterole a
mometazónfuroáte sa účinky poruchy funkcie obličiek na ich systémovú expozíciu neskúmali (pozri
časť 4.2).
Pacienti s poruc hou f unkcie pe čene
Účinok indakaterolu/mometazónfuroátu sa nehodnotil u osôb s poruchou funkcie pečene. Štúdie sa však vykonali so zložkami v monoterapii (pozri časť 4.2).
Indakaterol
Pacienti s ľahkou a stredne ťažkou poruchou funkcie pečene nevykazovali významné zmeny Cmax alebo AUC indakaterolu, rovnako sa nelíšila väzba na bielkoviny medzi osobami s ľahkou a stredne ťažkou poruchou funkcie pečene a zdravými osobami v kontrolnej skupine. Nie sú dostupné údaje
u osôb s ťažkou poruchou funkcie pečene.
Mometazónfuroát
V štúdii hodnotiacej podanie jednorazovej inhalovanej dávky 400 μg mometazónfuroátu pomocou inhalátora suchého prášku osobám s ľahkou (n=4), stredne ťažkou (n=4) a ťažkou (n=4) poruchou
funkcie pečene sa v každej skupine našli len 1 alebo 2 osoby, ktoré mali v plazme detekovateľné
maximálne koncentrácie mometazónfuroátu (v rozmedzí od 50 do 105 pcg/ml). Pozorované maximálne koncentrácie v plazme sa zjavne zvyšujú so závažnosťou poruchy funkcie pečene; avšak
počet detekovateľných koncentrácií (dolná hranica stanovenia bola 50 pcg/ml) bol malý.
Iné osobitné populácie
Významné rozdiely v celkovej systémovej expozícii (AUC) obom látkam neboli medzi Japoncami a belochmi. Pre ostatné etniká alebo rasy nie sú dostupné postačujúce farmakokinetické údaje.
5.3 Predklinické údaje o bezpečnosti
Predklinické hodnotenia každej z monoterapií a kombinovaného lieku sú uvedené nižšie.
Kombinácia indakaterolu a mometazónfuroátu
Výsledky zo štúdií inhalačnej toxicity trvajúcich 13 týždňov boli prevažne priraditeľné zložke
mometazónfuroát a boli to typické farmakologické účinky glukokortikoidov. Zvýšené srdcové
frekvencie spájané s indakaterolom sa zaznamenali u psov po podaní indakaterolu/mometazónfuroátu alebo samotného indakaterolu.
Indakaterol
Účinky na kardiovaskulárny systém, ktoré možno pripísať vlastnostiam indakaterolu ako beta2-
agonistu, zahŕňali tachykardiu, arytmie a lézie myokardu u psov. U hlodavcov sa pozorovalo mierne
podráždenie nosovej dutiny a hrtanu.
V štúdiách genotoxicity sa nezistil žiadny mutagénny ani klastogénny potenciál.
Karcinogenita sa hodnotila v dvojročnej štúdii na potkanoch a šesťmesačnej štúdii na transgénnych myšiach. Zvýšená incidencia benígneho leiomyómu vaječníkov a fokálna hyperplázia hladkého svalstva vaječníkov u potkanov sa zhodovala s podobnými nálezmi hlásenými pri iných beta2- adrenergných agonistoch. U myší sa nepozoroval žiadny dôkaz karcinogenity.
Všetky tieto nálezy sa vyskytli pri expozíciách dostatočne vyšších, ako sú expozície predpokladané
u ľudí.
Po subkutánnom podaní v štúdii na králikoch sa nežiaduce účinky indakaterolu na graviditu a embryonálny/fetálny vývin dali preukázať len pri viac ako 500-násobných dávkach oproti tým, ktoré sa dosiahli po každodennej inhalácii 150 μg u ľudí (na základe AUC0-24 h).
Hoci indakaterol nemal vplyv na celkový reprodukčný výkon v štúdii fertility u potkanov, pokles počtu gravidných samíc v potomstve F1 sa pozoroval v štúdii peri- a postnatálneho vývinu u potkanov pri 14-násobne vyššej expozícii ako u ľudí, ktorým sa podával indakaterol. Indakaterol nebol embryotoxický ani teratogénny u potkanov alebo králikov.
Mometazónfuroát
Všetky pozorované účinky sú typické pre triedu glukokortikoidových zlúčenín a súvisia
s vystupňovanými farmakologickými účinkami glukokortikoidov.
Mometazónfuroát nevykazoval genotoxickú aktivitu v štandardnom súbore testov in vitro a in vivo.
V štúdiách karcinogenity na myšiach a potkanoch sa pri inhalovanom mometazónfuroáte nepreukázalo
významné zvýšenie incidencie nádorov.
Tak ako iné glukokortikoidy, aj mometazónfuroát je teratogénny u hlodavcov a králikov. Zaznamenali sa umbilikálna hernia u potkanov, rázštep podnebia u myší a agenéza žlčníka, umbilikálna hernia a ohnuté predné labky u králikov. Vyskytli sa tiež znížené prírastky telesnej hmotnosti u matiek, účinky na rast fétov (nižšia telesná hmotnosť a/alebo spomalenie osifikácie u fétov) u potkanov, králikov a myší a znížené prežívanie potomstva u myší. V štúdiách reprodukčnej funkcie subkutánne podávaný mometazónfuroát v dávke 15 μg/kg predlžoval gestáciu a vyskytli sa sťažené pôrody so zníženým prežívaním a telesnou hmotnosťou potomstva.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
O
bsah kapsuly
Laktóza, monohydrát
Telo kapsuly
Želatína
Atrament na potlač
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom a vlhkosťou.
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Spodná časť a viečko inhalátora sú vyrobené z akrylonitryl-butadién-styrénu, tlačidlá sú vyrobené
z metylmetakrylát-akrylonitryl-butadién-styrénu. Ihly a pružiny sú vyrobené s nehrdzavejúcej ocele.
Perforovaný blister z PA/Al/PVC – Al s jednotlivými dávkami. Každý blister obsahuje 10 tvrdých kapsúl.
Bemrist Breezhaler 125 mikrogramov/62,5 mikrogramov inhalačný prášok v tvrdých kapsulách
Jednotlivé balenie obsahujúce 10 x 1 alebo 30 x 1 tvrdých kapsúl spolu s 1 inhalátorom.
Multibalenia obsahujúce 90 (3 balenia po 30 x 1) tvrdých kapsúl a 3 inhalátory. Multibalenia obsahujúce 150 (15 balení po 10 x 1) tvrdých kapsúl a 15 inhalátorov.
Bemrist Breezhaler 125 mikrogramov/127,5 mikrogramov inhalačný prášok v tvrdých kapsulách
Jednotlivé balenie obsahujúce 10 x 1 alebo 30 x 1 tvrdých kapsúl spolu s 1 inhalátorom.
Multibalenia obsahujúce 90 (3 balenia po 30 x 1) tvrdých kapsúl a 3 inhalátory. Multibalenia obsahujúce 150 (15 balení po 10 x 1) tvrdých kapsúl a 15 inhalátorov.
Bemrist Breezhaler 125 mikrogramov/260 mikrogramov inhalačný prášok v tvrdých kapsulách
Jednotlivé balenie obsahujúce 10 x 1 alebo 30 x 1 tvrdých kapsúl spolu s 1 inhalátorom.
Multibalenia obsahujúce 90 (3 balenia po 30 x 1) tvrdých kapsúl a 3 inhalátory. Multibalenia obsahujúce 150 (15 balení po 10 x 1) tvrdých kapsúl a 15 inhalátorov.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Má sa používať inhalátor dodaný pri každom novom predpísaní lieku. Inhalátor z každého balenia sa má zlikvidovať po použití všetkých kapsúl v balení.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
Pokyny na zaobchádzanie a použitiePred použitím lieku Bemrist Breezhaler si prečítajte celé
Pokyny na použitie.

V
l
ožte Prepichnite
a uvoľnite
Inhalujte hlboko Skontrolujte, či je
kapsula prázdna
S
k
on
- trolujte

Krok 1a:
Odstráňte viečkoKrok 2a:
Prepichnite kapsulu raz Inhalátor držte zvislo. Prepichnite kapsulu silným stlačením obidvoch bočných tlačidiel súčasne.
Krok 3a:
Úplne vydýchniteNevydychujtedoinhalátora.Skontrolujte, či jekapsula prázdnaOtvorte inhalátor
a skontrolujte, či v kapsule
neostal zvyšok prášku.

Pri prepichnutí kapsuly by ste mali počuť zvuk.
Prepichnite kapsulu ibaraz.Ak je ešte v kapsule
zvyšok prášku:
· Uzavrite inhalátor.
· Zopakujte kroky 3a až
3d.


Krok 1b:
Otvorte inhalátor
Krok 1c:
Vyberte kapsulu Oddeľte jeden blister z blistrovej karty.
Stiahnutím otvorte blister a vyberte kapsulu.
Nepretláčajtekapsulucez fóliu.Kapsulu neprehltnite.Krok 2b:
Uvoľnite bočné tlačidláKrok 3b:
Inhalujte liek hlboko Inhalátor držte tak, ako je to znázornené
na obrázku.
Vložte náustok do úst a pevne ho obopnite perami.
Nestláčajtebočnétlačidlá.
Vdýchnite rýchlo a čo najhlbšie.
Počas inhalácie budete počuť vírivý zvuk. Môžete cítiť chuť lieku počas inhalácie.
Krok 3c:
Zadržte dych Zadržte dych až na 5 sekúnd.

Krok 3d:
Vypláchnite si ústa Vypláchnite si ústa vodou po každej dávke a vodu vypľujte.
Zostatok PrázdnapráškuOdstráňte prázdnukapsuluPrázdnu kapsulu zahoďte
medzi domový odpad.
Zatvorte inhalátor a nasaďte viečko.

Krok 1d:
Vložte kapsulu Kapsulunikdynevložtepriamo do náustka.Krok 1e:
Uzavrite inhalátorDôležité informácie· Kapsuly Bemrist Breezhaler sa musia vždy uchovávať v blistri a vybrať sa majú len
bezprostredne
pred použitím.
· Nepretláčajte kapsulu cez fóliu pri vyberaní z blistra.
· Kapsulu neprehltnite.
· Nepoužívajte kapsuly
Bemrist Breezhaler so žiadnym iným
inhalátorom.
· Nepoužívajte inhalátor
Bemrist Breezhaler
na podanie žiadneho
iného lieku v kapsulách.
· Kapsulu nikdy nevložte do úst alebo náustka inhalátora.
· Nestláčajte bočné tlačidlá viac ako raz.
· Nevydychujte do náustka.
· Nestláčajte bočné tlačidlá počas inhalácie
cez náustok.
· Nechytajte kapsuly mokrými rukami.
· Nikdy neumývajte inhalátor vodou.
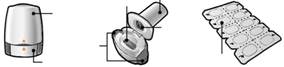
Balenie inhalátora Bemrist Breezhaler obsahuje:
· Jeden inhalátor Bemrist Breezhaler
· Jednu alebo viac blistrových kariet obsahujúcich
10 kapsúl lieku Bemrist Breezhaler, ktoré sa
používajú pomocou inhalátora
Lôžko Náustok na kapsuly
Viečko
Ochranná Bočné mriežka tlačidlá
Blister
Spodná časť
Spodná časť Blistrová karta inhalátora
|
Často kladené otázky
Prečo inhalátor nevydáva zvuk, keď inhalujem? Kapsula môže byť zaseknutá v lôžku
na kapsulu. Ak sa to stane, opatrne uvoľnite kapsulu poklopaním na spodnú
časť inhalátora. Inhalujte liek znovu opakovaním krokov 3a až 3d.
Čo mám urobiť, ak ostal
v kapsule zvyšok prášku? Nepoužili ste dostatok lieku. Zatvorte inhalátor
a zopakujte kroky 3a
až 3d.
Kašľal som po inhalácii –
znamená to niečo?
Môže sa to stať. Pokiaľ je
kapsula prázdna, použili
ste dostatok lieku.
Cítil som malé kúsky kapsuly na jazyku – znamená to niečo?
Môže sa to stať. Nie je to
škodlivé. Možnosť rozpadu kapsuly na malé kúsky sa zvýši, ak sa kapsula prepichne viac ako raz.
|
Čistenie inhalátora Zotretím odstráňte zvyšky prášku z vnútornej
a vonkajšej strany náustka čistou, suchou tkaninou,
z ktorej sa neuvoľňujú vlákna. Udržiavajte inhalátor suchý. Inhalátor nikdy neumývajte vodou.
|
L
i
k
v
idácia inhalátora
po použití
Každý inhalátor zlikvidujte
po použití všetkých kapsúl. Opýtajte sa svojho lekárnika, ako máte zlikvidovať lieky
a inhalátory, ktoré už
nepotrebujete.
|
|
|
I
nhalátor
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Írsko
8. REGISTRAČNÉ ČÍSLABemrist Breezhaler 125 mikrogramov/62,5 mikrogramov inhalačný prášok v tvrdých kapsuláchEU/1/20/1441/001-004
Bemrist Breezhaler 125 mikrogramov/127,5 mikrogramov inhalačný prášok v tvrdých kapsuláchEU/1/20/1441/005-008
Bemrist Breezhaler 125 mikrogramov/260 mikrogramov inhalačný prášok v tvrdých kapsuláchEU/1/20/1441/009-012
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.