
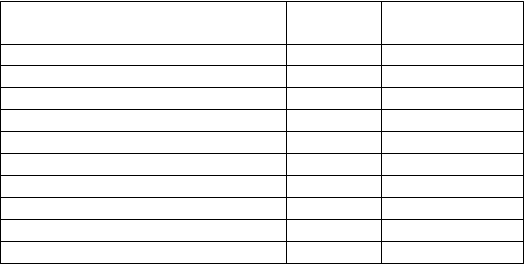
utánnej injekcie. Podaná dávka sa zvolí na základe výšky a hmotnosti pacienta (tabuľka 1).
Tabuľka 1. Dávka AMGEVITY v miligramoch (mg) podľa výšky a hmotnosti pacientov pri polyartikulárnej juvenilnej idiopatickej artritíde a artritíde spojenej s entezitídou
V
ýška
(
cm)
Celková telesná hmotnosť (kg)
10 15 20 25 30 35 40 45 50 55 60 65 70
 80
80 – – – –
90 – – – 20 20 20
100 – – – 20 20 20 – –
110 – – 20 20 20 – – – – – –
120 – 20 20 20 – – – – – – – – –
130 20 20 – – – – – – – – – –
140 20 20 – – – – – – – – – 40*
150 – – – – – – – – – 40* 40*
160 – – – – – – – 40* 40* 40* 40*
170 – – – – – 40* 40* 40* 40* 40*
180 – – – 40* 40* 40* 40* 40* 40*
* Maximálna jednotlivá dávka je 40 mg (0,8 ml)
– Nevzťahuje sa, AMGEVITA je dostupná iba vo forme 20 mg a 40 mg naplnenej injekčnej striekačky a 40 mg
naplneného injekčného pera
Polyartikulárna juvenilná idiopatická artritída vo veku od 13 rokovPacientom vo veku od 13 rokov sa podáva dávka 40 mg každý druhý týždeň bez ohľadu na plochu povrchu tela.
Klinická odpoveď sa zvyčajne dosiahne v priebehu 12 týždňov liečby. Ak pacient v tomto období neodpovedá na liečbu, pokračovanie v liečbe sa má starostlivo zvážiť.
Neexistuje žiadne relevantné použitie adalimumabu u pacientov mladších ako 2 roky pre túto indikáciu.
Artritída spojená s entezitídouOdporúčaná dávka AMGEVITY u pacientov s artritídou spojenou s entezitídou vo veku 6 rokov a starších je 24 mg/m2 plochy telesného povrchu až do maximálnej jednotlivej dávky 40 mg adalimumabu podávaného každé dva týždne subkutánnou injekciou. Objem injekcie sa zvolí na základe výšky a hmotnosti pacienta (tabuľka 1).
Adalimumab sa neskúmal u pacientov s artritídou spojenou s entezitídou vo veku menej ako 6 rokov.
Ložisková psoriáza u pediatrických pacientovOdporúčaná dávka AMGEVITY je 0,8 mg na 1 kg telesnej hmotnosti (až do maximálnej výšky 40 mg na jednu dávku), prvé dve dávky sa podávajú subkutánne jedenkrát týždenne a ďalšie dávky každý druhý týždeň. Pokračovanie liečby po 16 týždňoch sa má starostlivo zvážiť u pacienta, ktorý v tomto časovom intervale na liečbu neodpovedal.
Ak je indikovaná opätovná liečba AMGEVITOU, je potrebné dodržiavať vyššie uvedené pokyny týkajúce sa dávkovania a dĺžky liečby.
Bezpečnosť adalimumabu u pediatrických pacientov s ložiskovou psoriázou bola hodnotená v priemere
počas 13 mesiacov.
Pacientom starším ako 4 roky, ale s hmotnosťou nižšou ako 23 kg alebo medzi 29 a 46 kg, nie je možné podávať dávky tohto lieku. Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 4 roky pre túto indikáciu.
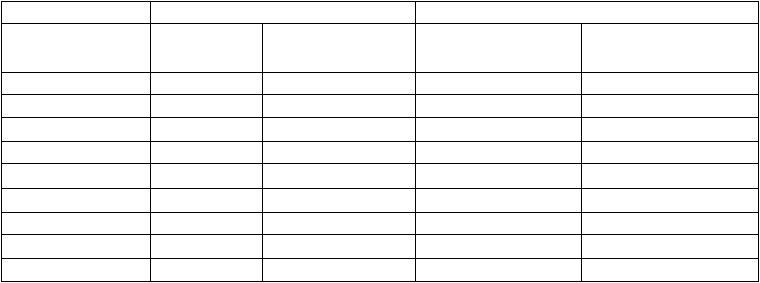
Podaná dávka sa zvolí na základe hmotnosti pacienta (tabuľka 2).
Tabuľka 2 Dávka AMGEVITY v miligramoch (mg) podľa hmotnosti pediatrických pacientov sopsoriázouTelesná hmotnosť (kg) Dávka pri psoriáze u detí13 – 16 –
17 – 22 –
23 – 28 20 mg

29 – 34 –
35 – 40 –
41 – 46 –
47+ 40 mg
– Nevzťahuje sa, AMGEVITA je dostupná iba vo forme 20 mg a 40 mg naplnenej injekčnej striekačky
a 40 mg naplneného injekčného pera.
Crohnova choroba u pediatrických pacientovCrohnova choroba u pediatrických pacientov < 40 kg:Odporúčaný úvodný dávkovací režim AMGEVITY u pediatrických pacientov s ťažkou Crohnovou
chorobou je 40 mg v týždni 0, potom 20 mg v týždni 2. V prípade, že je potrebná rýchlejšia odpoveď na liečbu, môže sa sa použiť režim 80 mg v týždni 0 (dávka sa môže podať v dvoch injekciách v jeden deň), 40 mg v týždni 2 s vedomím možnosti vyššieho rizika nežiaducich udalostí pri vyššej úvodnej dávke.
Po úvode liečby je odporúčaná dávka 20 mg každý druhý týždeň podávaná subkutánnou injekciou. Niektorí pacienti s neadekvátnou odpoveďou môžu mať prínos z frekvencie podávania zvýšenej na
20 mg AMGEVITY každý týždeň.
Crohnova choroba u pediatrických pacientov ≥ 40 kg:Odporúčaný úvodný dávkovací režim AMGEVITY u pediatrických pacientov s ťažkou Crohnovou
chorobou je 80 mg v týždni 0 nasledovaný dávkou 40 mg v týždni 2. V prípade, že je potrebná rýchlejšia odpoveď na liečbu, môže sa použiť režim 160 mg v týždni 0 (dávka sa môže podať ako štyri injekcie v jeden deň alebo ako dve injekcie denne počas dvoch po sebe nasledujúcich dní), 80 mg
v týždni 2 s vedomím možnosti vyššieho rizika nežiaducich udalostí pri vyššej úvodnej dávke.
Po úvode liečby je odporúčaná dávka 40 mg každý druhý týždeň podávaná subkutánnou injekciou. Niektorí pacienti s neadekvátnou odpoveďou môžu mať prínos z frekvencie podávania zvýšenej na
40 mg AMGEVITY každý týždeň.
U pacientov, ktorí neodpovedali na liečbu do týždňa 12, sa má starostlivo zvážiť pokračovanie v liečbe.
Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 6 rokov pre túto indikáciu.
Hidradenitis suppurativa u pediatrických pacientov
Bezpečnosť a účinnosť adalimumabu u detí vo veku 12 – 17 rokov sa ešte nestanovili pre hidradenitis suppurativa. K dispozícii nie sú žiadne údaje. Neexistuje žiadne relevantné použitie adalimumabu
u detí mladších ako 12 rokov pre túto indikáciu.
Ulcerózna kolitída u pediatrických pacientov
Bezpečnosť a účinnosť adalimumabu u detí vo veku 4 – 17 rokov sa ešte nestanovili. Nie sú dostupné žiadne údaje. Neexistuje žiadne relevantné použitie adalimumabu u detí mladších ako 4 roky pre túto indikáciu.
Psoriatická artritída a axiálna spondylartritída vrátane ankylozujúcej spondylitídy
Neexistuje žiadne relevantné použitie adalimumabu u detí pre indikácie ankylozujúca spondylitída a psoriatická artritída.
Uveitída u pediatrických pacientov
Bezpečnosť a účinnosť adalimumabu u detí vo veku 2 – 17 rokov sa ešte nestanovili. Nie sú dostupné
žiadne údaje.
Spôsob podávania
AMGEVITA sa podáva subkutánnou injekciou. Úplný návod na použitie je uvedený v písomnej
informácii pre používateľa.
40 mg naplnené injekčné pero a 20 mg a 40 mg naplnené injekčné striekačky sú dostupné pre pacientov
na podanie plnej 20 mg alebo 40 mg dávky.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Aktívna tuberkulóza alebo iné závažné infekcie, ako je sepsa a oportúnne infekcie (pozri časť 4.4). Stredne ťažké až ťažké srdcové zlyhanie (trieda III/IV podľa NYHA) (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Za účelom zlepšenia sledovateľnosti biologických liekov je potrebné presne zaznamenať názov a číslo
šarže podávaného lieku.
Infekcie
Pacienti používajúci antagonisty TNF sú náchylnejší na vznik závažných infekcií. Porucha funkcie
pľúc môže zvýšiť riziko vzniku infekcií. Pacienti musia byť preto dôkladne sledovaní z hľadiska
výskytu infekcií vrátane tuberkulózy, a to pred liečbou, počas nej a po ukončení liečby AMGEVITOU. Vzhľadom na to, že vylučovanie adalimumabu môže trvať až štyri mesiace, sledovanie má pokračovať počas celého tohto obdobia.
Liečba AMGEVITOU sa nemá začať u pacientov s aktívnymi infekciami vrátane chronických alebo lokalizovaných infekcií, až kým nie sú tieto infekcie zvládnuté. U pacientov, ktorí boli exponovaní tuberkulóze, a u pacientov, ktorí cestovali do oblastí s vysokým rizikom tuberkulózy alebo endemických mykóz, ako sú histoplazmóza, kokcidioidomykóza alebo blastomykóza, je potrebné pred začiatkom liečby zvážiť riziko a benefit liečby AMGEVITOU (pozri Iné oportúnne infekcie).
Pacienti, u ktorých sa počas liečby AMGEVITOU objaví nová infekcia, majú byť dôkladne sledovaní a podstúpiť kompletné diagnostické vyšetrenie. Ak sa u pacienta rozvinie nová závažná infekcia alebo sepsa, má sa začať vhodná antimikrobiálna alebo antimykotická liečba a podávanie AMGEVITY sa má prerušiť dovtedy, kým sa infekcia nezvládne. Lekári majú byť opatrní pri zvažovaní použitia AMGEVITY u pacientov s anamnézou rekurentnej infekcie alebo za podmienok, ktoré predisponujú
k vzniku infekcie vrátane použitia súčasnej imunosupresívnej liečby.
Ťažké infekcie
Ťažké infekcie vrátane sepsy, spôsobené bakteriálnymi, mykobakteriálnymi, invazívnymi mykotickými, parazitárnymi, vírusovými alebo ďalšími oportúnnymi infekciami, ako sú listerióza, legionelóza a pneumocystóza, boli hlásené u pacientov používajúcich adalimumab.
Ďalšie ťažké infekcie zaznamenané v klinických skúšaniach zahŕňajú zápal pľúc, pyelonefritídu, septickú artritídu a septikémiu. V súvislosti s infekciami boli hlásené prípady hospitalizácie alebo úmrtia.
Tuberkulóza
Tuberkulóza vrátane reaktivácie a nového nástupu tuberkulózy bola hlásená u pacientov, liečených adalimumabom. Hlásenia zahŕňali prípady pľúcnej a mimopľúcnej (t. j. diseminovanej) tuberkulózy.
Pred začatím liečby AMGEVITOU musia byť všetci pacienti vyšetrení na aktívnu aj neaktívnu („latentnú“) tuberkulóznu infekciu. Toto vyšetrenie má obsahovať podrobné lekárske posúdenie anamnézy pacienta, zamerané na výskyt tuberkulózy alebo na možný predchádzajúci kontakt s osobami s aktívnou tuberkulózou a na predchádzajúcu a/alebo súčasnú imunosupresívnu liečbu. U všetkých pacientov sa majú urobiť príslušné skríningové vyšetrenia (t. j. kožný tuberkulínový test a röntgen hrudníka (môžu sa použiť lokálne odporúčania). Odporúča sa, aby sa do informačnej kartičky pacienta zaznamenalo vykonanie týchto testov a ich výsledky. Predpisujúcim lekárom je potrebné pripomenúť riziko falošne negatívnych výsledkov kožného tuberkulínového testu, zvlášť u ťažko chorých alebo imunokompromitovaných pacientov.
Liečba AMGEVITOU sa nesmie začať u pacientov s diagnostikovanou aktívnou tuberkulózou (pozri
časť 4.3).
Vo všetkých nižšie opísaných situáciách sa má veľmi starostlivo zvážiť pomer prínosu a rizika liečby. Ak je podozrenie na latentnú tuberkulózu, má sa konzultovať s lekárom so skúsenosťami v liečbe
tuberkulózy.
V prípade diagnózy latentnej tuberkulózy sa musí ešte pred začatím liečby AMGEVITOU začať
vhodná antituberkulózna preventívna liečba v súlade s lokálnymi odporúčaniami.
Použitie antituberkulóznej liečby pre začatím podávania AMGEVITY sa má zvážiť aj u pacientov, ktorí majú viaceré alebo významné rizikové faktory pre tuberkulózu a majú negatívny test na tuberkulózu, a u pacientov s latentnou alebo aktívnou tuberkulózou v anamnéze, u ktorých nie je možné overiť adekvátny priebeh liečby.
Napriek preventívnej antituberkulóznej liečbe sa u pacientov, liečených adalimumabom, vyskytli prípady reaktivácie tuberkulózy. U niektorých pacientov, ktorí boli úspešne liečení na aktívnu tuberkulózu, sa počas liečby adalimumabom znova rozvinula tuberkulóza.
Pacientov je potrebné poučiť o tom, aby vyhľadali lekára, ak sa počas liečby AMGEVITOU alebo po jej ukončení objavia prejavy/príznaky, ktoré poukazujú na tuberkulózu (napr. pretrvávajúci kašeľ, chradnutie/úbytok telesnej hmotnosti, mierna horúčka, ochabnutosť).
Iné oportúnne infekcie
U pacientov používajúcich adalimumab sa pozoroval výskyt oportúnnych infekcií vrátane invazívnych mykotických infekcií. Tieto infekcie neboli presne identifkované u pacientov používajúcich antagonisty TNF, čo malo za následok oneskorenie vhodnej liečby, niekedy až s fatálnym dôsledkom.
U pacientov, u ktorých sa rozvinú prejavy a príznaky ako horúčka, nevoľnosť, chudnutie, potenie, kašeľ, dušnosť a/alebo pľúcne infiltráty alebo iné závažné systémové ochorenia so súčasným šokom alebo bez neho, sa má myslieť na invazívnu mykotickú infekciu a podávanie AMGEVITY sa má okamžite prerušiť. Diagnostika a podávanie empirickej antimykotickej liečby týmto pacientom sa má konzultovať s lekárom, špecializujúcim sa na starostlivosť o pacientov s invazívnymi mykotickými infekciami.
Reaktivácia hepatitídy typu B
U pacientov používajúcich antagonisty TNF vrátane adalimumabu, ktorí sú chronickí nosiči vírusu
hepatitídy typu B (HBV; t. j. majú pozitívny povrchový antigén), sa vyskytla reaktivácia hepatitídy typu B. Niektoré prípady sa skončili smrteľne. Pred začiatkom liečby AMGEVITOU by pacienti mali byť vyšetrení na prítomnosť infekcie HBV. U pacientov s pozitívnym testom na hepatitídu typu B sa odporúča konzultácia s odborníkom na liečbu hepatitídy typu B.
U nosičov HBV, u ktorých je potrebná liečba AMGEVITOU, sa majú podrobne sledovať prejavy a príznaky aktívnej infekcie HBV počas liečby a počas niekoľkých mesiacov po ukončení liečby. K dispozícii nie sú dostatočné údaje od pacientov, ktorí sú nosičmi HBV, liečených antivirotikami spolu s antagonistami TNF na zabránenie reaktivácie HBV. U pacientov s reaktiváciou HBV sa má ukončiť podávanie AMGEVITY a má sa začať účinná antivírusová liečba s primeranou podpornou liečbou.
Neurologické príhody
Podávanie antagonistov TNF vrátane adalimumabu bolo v zriedkavých prípadoch spojené s novým
objavením sa alebo exacerbáciou klinických príznakov a/alebo rádiografickým nálezom demyelinizačného ochorenia centrálneho nervového systému vrátane sklerózy multiplex a optickej
neuritídy a periférneho demyelinizačného ochorenia vrátane Guillain-Barrého syndrómu. Predpisujúci
lekári majú opatrne postupovať pri zvažovaní použitia AMGEVITY u pacientov s už existujúcimi alebo novovzniknutými demyelinizačnými poruchami centrálneho alebo periférneho nervového systému. Ak sa vyskytne niektorá z uvedených porúch, má sa uvažovať o ukončení liečby AMGEVITOU. Existuje známe spojenie medzi intermediárnou uveitídou a centrálnymi demyelinizačnými poruchami. U pacientov s neinfekčnou intermediárnou uveitídou sa má pred začatím liečby AMGEVITOU a pravidelne počas nej vykonávať neurologické vyšetrenie na posúdenie existujúcich alebo rozvíjajúcich sa centrálnych demyelinizačných porúch.
Alergické reakcie
Závažné alergické reakcie v súvislosti s adalimumabom boli počas klinických štúdií zriedkavé.
V klinických štúdiách s adalimumabom sa menej často vyskytli nezávažné alergické reakcie. Boli prijaté hlásenia o závažných alergických reakciách vrátane anafylaxie po podaní adalimumabu. Ak sa
vyskytne anafylaktická reakcia alebo iná závažná alergická reakcia, treba okamžite prerušiť liečbu
AMGEVITOU a začať príslušnú liečbu.

 Suchý prírodný kaučuk
Suchý prírodný kaučukKryt ihly naplnenej injekčnej striekačky alebo naplneného injekčného pera je zhotovený zo suchého
prírodného kaučuku (derivát latexu), ktorý môže vyvolať alergické reakcie.
ImunosupresiaV štúdii u 64 pacientov s reumatoidnou artritídou, ktorí boli liečení adalimumabom, nebolo dokázané
potlačenie oneskoreného typu precitlivenosti, zníženie hladín imunoglobulínov alebo zmena v počte efektorových T, B, NK buniek, monocytov/makrofágov a neutrofilov.
Malignity a lymfoproliferatívne poruchyV kontrolovaných častiach klinických skúšaní s antagonistami TNF zameraných na adalimumab bolo
medzi pacientmi používajúcimi antagonisty TNF pozorovaných viac prípadov malignít vrátane lymfómov v porovnaní s kontrolnou skupinou. Napriek tomu bol tento výskyt zriedkavý.
V postmarketingových skúšaniach boli hlásené prípady leukémie u pacientov liečených antagonistami
TNF. Existuje zvýšené riziko vzniku lymfómu a leukémie u pacientov s reumatoidnou artritídou s dlhodobým, vysoko aktívnym zápalovým ochorením, ktoré komplikuje odhad rizika. Podľa súčasných poznatkov nemôže byť eventuálne riziko vzniku lymfómov, leukémií a iných malignít u pacientov liečených antagonistami TNF vylúčené.
Malignity vrátane fatálnych boli hlásené v skupine detí, dospievajúcich a mladých dospelých (do 22
rokov) liečených v rámci postmarketingového skúšania antagonistami TNF (začiatok liečby vo veku ≤
18 rokov) vrátane adalimumabu. Približne v polovici prípadov sa jednalo o lymfómy. Ďalšie prípady zahŕňali rôzne iné malignity vrátane zriedkavých malignít, zvyčajne spojených s imunosupresiou. Nie je možné vylúčiť riziko vzniku malignít u detí a dospievajúcich liečených antagonistami TNF.
U pacientov liečených adalimumabom boli v postmarketingovej praxi zaznamenané zriedkavé prípady hepatosplenického T-lymfómu. Tento zriedkavý typ T-lymfómu má veľmi agresívny priebeh a je zvyčajne smrteľný. Niektoré z týchto hepatosplenických T-lymfómov sa pri liečbe adalimumabom vyskytli u mladých dospelých pacientov liečených pri zápalovom ochorení čreva súčasne azatioprinom alebo 6-merkaptopurínom. Je potrebné starostlivo zvážiť možné riziko kombinovanej liečby azatioprinom alebo 6-merkaptopurínom a AMGEVITOU. Riziko vzniku hepatosplenického T- lymfómu u pacientov liečených AMGEVITOU nie je možné vylúčiť (pozri časť 4.8).
Neboli vykonané žiadne štúdie, zahŕňujúce pacientov s malignitou v anamnéze alebo pacientov,
u ktorých sa pokračovalo liečbou s adalimumabom po rozvinutí malignity. Preto sa má pri zvažovaní liečby AMGEVITOU u týchto pacientov postupovať s mimoriadnou opatrnosťou (pozri časť 4.8).
Všetci pacienti, a najmä pacienti s anamnézou extenzívnej imunosupresívnej liečby alebo pacienti so psoriázou s liečbou PUVA v anamnéze, sa majú vyšetriť na prítomnosť nemelanómovej kožnej rakoviny pred a počas liečby AMGEVITOU. U pacientov liečených antagonistami TNF vrátane adalimumabu bol hlásený aj melanóm a karcinóm z Merkelových buniek (pozri časť 4.8).
Vo výskumnom klinickom skúšaní hodnotiacom používanie iného antagonistu TNF, infliximabu, sa hlásilo u pacientov so stredne ťažkou až ťažkou chronickou obštrukčnou chorobou pľúc (CHOCHP) viac malignít, predovšetkým v pľúcach alebo hlave a hrdle, u pacientov liečených infliximabom v porovnaní s pacientmi v kontrolnej skupine. U všetkých pacientov sa v anamnéze uvádzalo silné fajčenie. Preto je potrebná obozretnosť pri používaní akéhokoľvek antagonistu TNF u pacientov
s CHOCHP, ako aj u pacientov so zvýšeným rizikom malignity kvôli silnému fajčeni.
Podľa súčasných údajov nie je známe, či liečba adalimumabom ovplyvňuje riziko vzniku dysplázie alebo kolorektálneho karcinómu. Všetci pacienti s ulceróznou kolitídou, u ktorých existuje riziko vzniku dysplázie alebo kolorektálneho karcinómu (napr. pacienti s dlhotrvajúcou ulceróznou kolitídou alebo primárnou sklerotizujúcou cholangitídou) a u ktorých sa v minulosti vyskytla dysplázia alebo
kolorektálny karcinóm, by mali byť vyšetrení na možný rozvoj dysplázie alebo kolorektálneho karcinómu ešte pred začatím liečby a ďalej v pravidelných intervaloch v jej priebehu. Toto vyšetrenie má, v súlade s miestnymi požiadavkami, zahŕňať kolonoskopiu a biopsiu.
Hematologické reakcie
S antagonistami TNF sa zriedkavo hlásila pancytopénia vrátane aplastickej anémie. Pri podávaní
adalimumabu boli hlásené nežiaduce účinky hematologického systému vrátane liečebne signifikantnej cytopénie (napr. trombocytopénie, leukopénie). Všetci pacienti používajúci AMGEVITU musia byť
upozornení na nutnosť ihneď vyhľadať lekársku pomoc, ak spozorujú prejavy a príznaky naznačujúce
krvnú dyskráziu (napr. pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť). U pacientov s potvrdenými signifikantnými hematologickými abnormalitami sa má zvážiť ukončenie liečby AMGEVITOU.
Očkovanie
Podobné protilátkové odpovede po očkovaní štandardnou 23-zložkovou pneumokokovou vakcínou
a trojzložkovou chrípkovou vakcínou sa pozorovali v štúdii u 226 dospelých jedincov s reumatoidnou artritídou, ktorí boli liečení adalimumabom alebo placebom. Nie sú dostupné žiadne údaje
o sekundárnom prenose infekcie živými vakcínami u pacientov, liečených adalimumabom.
Odporúča sa, aby sa, pokiaľ sa dá, aktualizovali všetky imunizácie pediatrických pacientov v súlade so súčasnými smernicami pre imunizáciu ešte pred začatím liečby AMGEVITOU.
Pacientov používajúcich AMGEVITU je možné súčasne očkovať s výnimkou živých vakcín. Podávanie živých vakcín dojčatám, ktoré boli in utero vystavené účinku AMGEVITY, sa neodporúča počas 5 mesiacov po poslednej injekcii AMGEVITY, podanej matke počas gravidity.
Kongestívne srdcové zlyhanie
V klinickej štúdii s ďalším antagonistom TNF sa pozorovalo zhoršenie kongestívneho srdcového
zlyhania a zvýšenie úmrtnosti na srdcové zlyhanie. U pacientov používajúcich adalimumab boli hlásené tiež prípady zhoršenia kongestívneho srdcového zlyhania. U pacientov s miernym srdcovým
zlyhaním (trieda I/II podľa NYHA) sa má AMGEVITA použiť s opatrnosťou. AMGEVITA je
kontraindikovaná pri stredne ťažkom alebo ťažkom srdcovom zlyhaní (pozri časť 4.3). U pacientov, u ktorých sa rozvinuli nové alebo sa zhoršili príznaky kongestívneho srdcového zlyhania, sa musí
liečba AMGEVITOU prerušiť.
Autoimunitné procesy
Liečba AMGEVITOU môže viesť k tvorbe autoimunitných protilátok. Účinok dlhodobej liečby
AMGEVITOU na rozvoj autoimunitných ochorení nie je známy. Ak sa u pacienta po liečbe
AMGEVITOU rozvinú príznaky naznačujúce syndróm podobný lupusu a má pozitívne protilátky proti dvojreťazcovej DNA, AMGEVITA sa nemá ďalej podávať (pozri časť 4.8).
Súbežné podávanie biologických DMARD alebo antagonistov TNF
V klinických štúdiách sa pri súčasnom použití anakinry a etanerceptu, ďalšieho antagonistu TNF,
vyskytli závažné infekcie bez dosiahnutia ďalšieho klinického prínosu v porovnaní so samotným etanerceptom. Vzhľadom na povahu nežiaducich účinkov pozorovaných pri kombinovanej terapii
etanerceptom a anakinrou sa podobné toxicity môžu vyskytnúť aj pri kombinácii anakinry a iného antagonistu TNF. Preto sa neodporúča kombinácia AMGEVITY a anakinry. (Pozri časť 4.5).
Súbežné podávanie AMGEVITY a iných biologických DMARD (napr. anakinry a abataceptu) alebo iných antagonistov TNF sa neodporúča na základe možného zvýšeného rizika infekcií vrátane závažnych infekcií a iných potenciálnych farmakologických interakcií. (Pozri časť 4.5).
C
hirurgické zákroky
Je k dispozícii len limitované množstvo údajov o bezpečnosti pri chirurgických zákrokoch u pacientov
liečených adalimumabom. Ak je naplánovaný chirurgický zákrok, treba vziať do úvahy dlhý biologický polčas adalimumabu. Pacient, ktorý používa AMGEVITU a vyžaduje chirurgický zákrok, sa musí kvôli infekciám dôkladne monitorovať a prípadne sa majú vykonať vhodné opatrenia. U pacientov používajúcich adalimumab a podstupujúcich artroplastiku je k dispozícii minimálne množstvo údajov o bezpečnosti.
Obštrukcia tenkého čreva
Nedostatočná odpoveď pri liečbe Crohnovej choroby môže naznačovať výskyt fixovanej fibrotickej
striktúry, ktorá môže vyžadovať chirurgickú liečbu. Údaje, ktoré sú k dispozícii, naznačujú, že adalimumab nezhoršuje alebo nespôsobuje striktúry.
Starší pacienti
Frekvencia výskytu závažných infekcií v skupine pacientov starších ako 65 rokov (3,7 %), ktorí boli
liečení adalimumabom, bola vyššia ako u pacientov mladších ako 65 rokov (1,5 %). Niektoré z nich sa skončili fatálne. Pri liečbe starších pacientov treba venovať osobitnú pozornosť riziku vzniku infekcií.
Pediatrická populácia
Pozri vyššie časť „Očkovanie“.
4.5 Liekové a iné interakcie
Adalimumab sa skúmal u pacientov s reumatoidnou artritídou, polyartikulárnou juvenilnou idiopatickou artritídou a psoriatickou artritídou, liečených v monoterapii a v kombinácii
s metotrexátom. Pri podávaní adalimumabu spolu s metotrexátom bola tvorba protilátok nižšia
v porovnaní s monoterapiou. Podávanie adalimumabu bez metotrexátu viedlo k zvýšenej tvorbe protilátok, zvýšenému klírensu a zníženej účinnosti adalimumabu (pozri časť 5.1).
Kombinácia AMGEVITY a anakinry sa neodporúča (pozri časť 4.4 „Súbežné podávanie biologických
DMARD alebo antagonistov TNF“).
Kombinácia AMGEVITY a abataceptu sa neodporúča (pozri časť 4.4 „Súbežné podávanie biologických DMARD alebo antagonistov TNF“).
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku/antikoncepcia u mužov a žien
Ženám vo fertilnom veku sa striktne odporúča používať primeranú antikoncepciu, aby sa predišlo
gravidite a pokračovať v jej používaní aspoň päť mesiacov po poslednom podaní AMGEVITY.
Gravidita
Sú k dispozícii len obmedzené klinické údaje o gravidných ženách vystavených účinku adalimumabu.
V štúdiách vývojovej toxicity, uskutočnených na opiciach, neboli zistené náznaky toxicity matky, embryotoxicity alebo teratogenity. Predklinické údaje o účinku adalimumabu na postnatálnu toxicitu nie sú dostupné (pozri časť 5.3).
Adalimumab, podávaný v gravidite, môže vzhľadom na inhibíciu TNFα ovplyvniť normálne imunitné odpovede novorodenca. Podávanie AMGEVITY počas gravidity sa neodporúča.
Adalimumab môže prechádzať placentou do séra detí narodených ženám, ktoré boli počas gravidity liečené adalimumabom. Následkom toho môžu mať tieto deti zvýšené riziko vzniku infekcie. Podávanie živých vakcín dojčatám, ktoré boli in utero vystavené účinku adalimumabu, sa neodporúča počas 5 mesiacov po poslednej injekcii adalimumabu, podanej matke počas gravidity.
Dojčenie
Nie je známe, či sa adalimumab vylučuje do materského mlieka alebo či sa po podaní systémovo
absorbuje.
Pretože sa však ľudské imunoglobulíny vylučujú do mlieka, ženy nesmú dojčiť aspoň päť mesiacov po poslednom podaní AMGEVITY.
Fertilita
Nie sú dostupné údaje o vplyve adalimumabu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
AMGEVITA môže mať mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní
AMGEVITY sa môže vyskytnúť závrat a porucha zraku (pozri časť 4.8).
4.8 Nežiaduce účinky
Zhrnutie profilu bezpečnosti
Adalimumab sa skúmal u 9 506 pacientov v kľúčových kontrolovaných a otvorených štúdiách počas
60 mesiacov alebo dlhšie. Tieto štúdie zahŕňali pacientov s krátkodobou a dlhodobou reumatoidnou artritídou, juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou a artritídou spojenou s entezitídou), ako aj pacientov s axiálnou spondylartitídou (ankylozujúcou spondylitídou a axiálnou spondylartitídou bez rádiologického dôkazu AS), psoriatickou artritídou, Crohnovou chorobou, ulceróznou kolitídou, so psoriázou, s hidradenitis suppurativa a s uveitídou. Kľúčové kontrolované štúdie zahŕňali 6 089 pacientov používajúcich adalimumab a 3 801 pacientov používajúcich placebo alebo účinný komparátor počas kontrolovanej fázy.
Podiel pacientov, ktorí prerušili liečbu v dôsledku vedľajších účinkov počas dvojito zaslepených, kontrolovaných častí kľúčových štúdií, bol 5,9 % u pacientov liečených adalimumabom a 5,4 %
u pacientov, ktorým sa podávala kontrola.
Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (napr. zápal nosohltana, infekcia horných dýchacích ciest a zápal prinosových dutín), reakcie v mieste vpichu injekcie (erytém, svrbenie, krvácanie, bolesť alebo opuch), bolesť hlavy a muskuloskeletálna bolesť.
Pri adalimumabe boli hlásené závažné nežiaduce reakcie. Antagonisty TNF, ako je napr. AMGEVITA, pôsobia na imunitný systém a ich používanie môže ovplyvniť obranyschopnosť organizmu voči infekciám a nádorovým ochoreniam.
Pri použití adalimumabu boli hlásené aj fatálne a život ohrozujúce infekcie (vrátane sepsy, oportúnnych infekcií a TBC), reaktivácia HBV a rôzne malignity (vrátane leukémie, lymfómu a HSTCL).
Boli hlásené aj závažné hematologické, neurologické a autoimunitné reakcie. Patria k nim zriedkavé hlásenia pancytopénie, aplastickej anémie, centrálne a periférne prípady demyelinizácie a hlásenia lupusu, lupusu podobných stavov a Stevensovho-Johnsonovho syndrómu.
Pediatrická populácia
N
ežiaduce účinky u pediatrických pacientov
Vo všeobecnosti boli nežiaduce účinky u pediatrických pacientov podobné vo frekvencii a type tým, ktoré sa pozorovali u dospelých pacientov.
Tabuľkový zoznam nežiaducich reakcií
Nasledujúci zoznam nežiaducich účinkov je založený na výsledkoch z klinických skúšaní a
postmarketingových skúsenostiach a je zoradený podľa triedy orgánových systémov a frekvencie v tabuľke 3: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Uvedená je najvyššia frekvencia pozorovaná pri rôznych indikáciách. V stĺpci „trieda orgánových systémov“ je vyznačená hviezdička (*), ak sa ďalšie informácie vyskytujú aj na inom mieste v častiach 4.3, 4.4 a 4.8.
Tabuľka 3 Nežiaduce účinky
Trieda orgánových systémov Frekvencia Nežiaduci účinok
Infekcie a nákazy* Veľmi časté
Časté
Menej časté
infekcie dýchacej sústavy (vrátane infekcií
dolných a horných dýchacích ciest, pneumónie, sinusitídy, faryngitídy, nazofaryngitídy a
pneumónie spôsobenej vírusom herpesu)
systémové infekcie (vrátane sepsy, kandidózy a chrípky),
črevné infekcie (vrátane vírusovej
gastroenteritídy),
infekcie kože a mäkkých tkanív (vrátane paronychie, celulitídy, impetiga, nekrotizujúcej fasciitídy a herpes zoster),
infekcie ucha,
infekcie ústnej dutiny (vrátane herpesu simplex, orálneho herpesu a infekcií zubov),
infekcie reprodukčného systému (vrátane
vulvovaginálnej mykotickej infekcie),
infekcie močovej sústavy (vrátane
pyelonefritídy), hubové infekcie,
infekcie kĺbov
neurologické infekcie (vrátane vírusovej meningitídy),
oportúnne infekcie a tuberkulóza (vrátane kokcidioidomykózy, histoplazmózy a systémovej infekcie Mycobacterium avium),
bakteriálne infekcie, infekcie oka, divertikulitída1)
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)*
Časté karcinóm kože okrem melanómu (vrátane bazocelulárneho karcinómu a skvamocelulárneho karcinómu),
benígne novotvary
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Menej časté
Zriedkavé
lymfóm**,
solídne orgánové tumory (vrátane karcinómu
prsníka, pľúc a štítnej žľazy),
melanóm**
leukémia1)
Poruchy krvi a lymfatického systému*
Neznáme
Veľmi časté
Časté
Menej časté
hepatosplenický T-bunkový lymfóm1),
karcinóm z Merkelových buniek (neuroendokrinný karcinóm kože)1) leukopénia (vrátane neutropénie
a agranulocytózy),
anémia
leukocytóza, trombocytopénia
idiopatická trombocytopenická purpura
Zriedkavé
Poruchy imunitného systému* Časté
Menej časté
Zriedkavé
pancytopénia
hypersenzitivita,
alergie (vrátane sezónnej alergie)
sarkoidóza1), vaskulitída
anafylaxia1)
Poruchy metabolizmu a výživy Veľmi časté
Časté
zvýšenie hladiny lipidov
hypokaliémia, hyperurikémia,
abnormálne hladiny nátria v krvi,
hypokalciémia, hyperglykémia, hypofosfatémia, dehydratácia
Psychické poruchy Časté poruchy nálady (vrátane depresie),
úzkosť, nespavosť
Poruchy nervového systému* Veľmi časté
Časté
Menej časté
Zriedkavé
bolesť hlavy
parestézie (vrátane hypestézie), migréna,
kompresia nervového koreňa
cerebrovaskulárna príhoda1), tremor,
neuropatia
sclerosis multiplex,
demyelinizačné ochorenie (napr. optická neuritída, Guillainov-Barrého syndróm)1)
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Poruchy oka Časté
Menej časté
Poruchy ucha a labyrintu Časté
poruchy videnia,
zápal spojiviek, blefaritída,
opuch oka
dvojité videnie závraty
Poruchy srdca a srdcovej
činnosti*
Menej časté
Časté
Menej časté
strata sluchu,
tinitus tachykardia
infarkt myokardu1), arytmia,
kongestívne srdcové zlyhanie
Zriedkavé
Poruchy ciev Časté
zastavenie srdca
hypertenzia, návaly horúčavy, hematóm
Poruchy dýchacej sústavy, hrudníka a mediastína*
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových
ciest*
Menej časté
Časté
Menej časté
Zriedkavé
Veľmi časté
Časté
Menej časté
Zriedkavé
Veľmi časté
Menej časté
aneuryzma aorty,
vaskulárna arteriálna oklúzia, tromboflebitída
astma, dyspnoe, kašeľ
pľúcna embólia1), intersticiálna pľúcna choroba, chronická obštrukčná choroba pľúc, pneumonitída,
pleurálny výpotok1)
pľúcna fibróza1)
bolesť brucha,
nauzea a vracanie
gastrointestinálna hemorágia, dyspepsia,
gastroezofageálna refluxná choroba, Sjögrenov syndróm
pankreatitída, dysfágia, opuch tváre
intestinálna perforácia1)
zvýšenie hladín pečeňových enzýmov
zápal žlčníka a žlčové kamene, steatóza pečene,
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
zvýšenie hladiny bilirubínu v krvi
Zriedkavé
hepatitída,
reaktivácia hepatidídy B1), autoimunitná hepatitída1)
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových
ciest
Neznáme
Veľmi časté
Časté
Menej časté
Zriedkavé
Neznáme
Veľmi časté
Časté
Menej časté
Zriedkavé
Časté
Menej časté
zlyhanie pečene1)
exantém (vrátane exfoliatívneho exantému)
zhoršenie alebo novovzplanutie psoriázy
(vrátane palmoplantárnej pustulárnej psoriázy)1),
žihľavka,
tvorba modrín (vrátane purpury),
dermatitída (vrátane ekzému), onychoklázia, hyperhidróza,
alopécia1),
svrbenie
nočné potenie,
jazvy
multiformný erytém1),
Stevensov-Johnsonov syndróm1), angioedém1),
kutánna vaskulitída1)
zhoršenie príznakov dermatomyozitídy1)
bolesť kostrových svalov
svalové spazmy (vrátane zvýšenej hladiny
kreatínfosfokinázy v krvi)
rabdomyolýza,
systémový lupus erythematosus
syndróm podobný lupusu1)
poškodenie obličiek,
hematuria
noktúria
Poruchy reprodukčného
systému a prsníkov
Menej časté erektilná dysfunkcia
Celkové poruchy a reakcie v mieste podania*
Veľmi časté
Časté
Menej časté
reakcia v mieste vpichu (vrátane erytému v mieste vpichu)
bolesť na hrudníku,
opuch,
horúčka1)
zápal

Laboratórne a funkčné vyšetrenia*
Časté poruchy koagulácie a krvácania (vrátane
predĺženia aktivovaného parciálného
T
rieda orgánových systémov Frekvencia Nežiaduci účinok
Úrazy, otravy a komplikácie
liečebného postupu
tromboplastínového času), pozitívny test na
autoprotilátky (vrátane protilátok proti dvojvláknovej DNA),
zvýšená hladina laktátdehydrogenázy v krvi
Časté zhoršené hojenie

* ďalšie informácie sa nachádzajú v častiach 4.3, 4.4 a 4.8
** vrátane otvorených rozšírených klinických skúšaní
1) vrátane údajov zo spontánneho hlásenia
Hidradenitis suppurativaProfil bezpečnosti u pacientov s HS liečených adalimumabom jedenkrát za týždeň bol v súlade so
známym profilom bezpečnosti adalimumabu.
UveitídaProfil bezpečnosti u pacientov s uveitídou liečených adalimumabom každý druhý týždeň bol v súlade
so známym profilom bezpečnosti adalimumabu.
Opis vybraných nežiaducich reakciíReakcie v mieste podania injekcieV kľúčových kontrolovaných štúdiach u dospelých a u detí sa u 12,9 % pacientov liečených adalimumabom objavili reakcie v mieste podania injekcie (erytém a/alebo svrbenie, krvácanie, bolesť alebo opuch) v porovnaní so 7,2 % pacientov, ktorým sa podávalo placebo alebo účinná kontrola. Reakcie v mieste vpichu všeobecne nevyžadovali prerušenie podávania lieku.
InfekcieV kľúčových kontrolovaných štúdiach sa u dospelých a detí liečených adalimumabom vyskytla infekcia vo frekvencii 1,51 prípadu na pacienta za rok a u pacientov, ktorým sa podávalo placebo
a účinná kontrola, vo frekvencii 1,46 prípadu na pacienta za rok. Infekcie predstavovali najmä zápal sliznice nosohltana, infekciu horných dýchacích ciest a sinusitídu. Po odznení infekcie väčšina
pacientov pokračovala v liečbe adalimumabom.
Incidencia závažných infekcií bola 0,04 prípadu na pacienta za rok u pacientov liečených adalimumabom a 0,03 prípadu na pacienta za rok u pacientov, ktorým sa podávalo placebo a účinná kontrola.
V kontrolovaných a otvorených štúdiách s adalimumabom u dospelých a detí sa hlásili závažné infekcie (vrátane zriedkavo sa vyskytujúcich fatálnych infekcií), ktoré zahŕňali hlásenia o výskyte tuberkulózy (vrátane miliárnych a extrapulmonálnych lokácií) a invazívnych oportúnnych infekcií (napr. diseminovaná alebo extrapulmonárna histoplazmóza, blastomykóza, kokcidioidomykóza, pneumocystóza, kandidóza, aspergilóza a listerióza). Väčšina prípadov tuberkulózy sa vyskytla v priebehu prvých ôsmich mesiacov od začiatku liečby a môže odrážať opätovné vzplanutie latentného ochorenia.
Malignity a lymfoproliferatívne poruchyV štúdii s adalimumabom v liečbe pacientov s juvenilnou idiopatickou artritídou (polyartikulárnou juvenilnou idiopatickou artritídou a artritídou spojenou s entezitídou) neboli u 249 pediatrických pacientov pri expozícii 655,6 pacientorokov pozorované žiadne malignity. Navyše u 192 pediatrických pacientov pri expozícii 498,1 pacientorokov v štúdiách s adalimumabom na liečbu pediatrických
pacientov s Crohnovou chorobou sa nezaznamenali žiadne malignity. V klinickom skúšaní
s adalimumabom na liečbu pediatrických pacientov s chronickou ložiskovou psoriázou neboli pozorované u 77 pediatrických pacientov pri expozícii 80,0 pacientorokov žiadne malignity.
Počas kontrolovaných častí kľúčových skúšaní adalimumabu trvajúcich minimálne 12 týždňov u dospelých pacientov so strednou až ťažkou aktívnou reumatoidnou artritídou, ankylozujúcou spondylitídou, axiálnou spondylartritídou bez rádiografického dôkazu AS, psoriatickou artritídou, psoriázou, hidradenitis suppurativa, Crohnovou chorobou, ulceróznou kolitídou a uveitídou sa malignity iné ako lymfóm a nemelanómová rakovina kože zistili s frekvenciou (95 % interval spoľahlivosti) 6,8 (4,4; 10,5) na 1 000 pacientorokov medzi 5 291 pacientmi liečenými adalimumabom v porovnaní so 6,3 (3,4; 11,8) na 1 000 pacientorokov medzi 3 444 kontrolnými pacientmi (stredná dĺžka trvania liečby adalimumabom bola 4,0 mesiaca a v kontrolnej skupine pacientov 3,8 mesiaca). Frekvencia (95 % interval spoľahlivosti) nemelanómového druhu rakoviny kože bola 8,8 (6,0; 13,0) na
1 000 pacientorokov medzi pacientmi liečenými adalimumabom a 3,2 (1,3; 7,6) na 1 000 pacientorokov medzi kontrolnými pacientmi. Z karcinómov kože sa skvamózne bunkové karcinómy vyskytli s frekvenciou (95 % interval spoľahlivosti) 2,7 (1,4; 5,4) na 1 000 pacientorokov medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na 1 000 pacientorokov medzi kontrolnými pacientmi. Frekvencia (95 % interval spoľahlivosti) lymfómov bola 0,7 (0,2; 2,7) na 1 000 pacientorokov medzi pacientmi liečenými adalimumabom a 0,6 (0,1; 4,5) na 1 000 pacientorokov medzi kontrolnými pacientmi.
Ak sa skombinujú kontrolované časti týchto skúšaní a prebiehajúce a ukončené otvorené rozšírené štúdie adalimumabu so strednou dobou trvania približne 3,3 roka zahŕňajúce 6 427 pacientov a viac ako 26 439 pacientorokov liečby, pozorovaná frekvencia malignít iných ako lymfóm a nemelanómový druh rakoviny kože je približne 8,5 na 1 000 pacientorokov. Pozorovaná frekvencia nemelanómovej rakoviny kože je približne 9,6 na 1 000 pacientorokov a pozorovaná frekvencia lymfómov je približne
1,3 na 1 000 pacientorokov.
V postmarketingovej praxi od januára 2003 do decembra 2010 je prevažne u pacientov s reumatoidnou artritídou hlásená frekvencia malignít iných ako lymfómy a nemelanómový druh rakoviny kože približne 2,7 na 1 000 pacientorokov liečby. Hlásené frekvencie nemelanómového druhu rakoviny kože a lymfómov sú približne 0,2 a 0,3 na 1 000 pacientorokov liečby (pozri časť 4.4).
U pacientov liečených adalimumabom boli v postmarketingovej praxi hlásené zriedkavé prípady hepatosplenického T-lymfómu (pozri časť 4.4).
Autoprotilátky
U pacientov sa robilo vyšetrenie vzoriek séra na autoprotilátky v rôznych časových intervaloch v štúdiách I-V s reumatoidnou artritídou. V týchto štúdiách sa u pacientov, ktorí mali negatívne východiskové titre antinukleových protilátok, zistili pozitívne titre v 24. týždni liečby u 11,9 % pacientov liečených adalimumabom a u 8,1 % pacientov, ktorým sa podávalo placebo a aktívna kontrola. Vo všetkých štúdiách s reumatoidnou artritídou a psoriatickou artritídou sa vyvinuli u dvoch z 3 441 pacientov liečených adalimumabom klinické príznaky poukazujúce na novovzniknutý lupusu podobný syndróm. Po prerušení liečby sa stav pacientov zlepšil. U žiadneho pacienta sa nerozvinula lupózna glomerulonefritída ani symptómy postihnutia centrálneho nervového systému.
Porucha funkcie pečene a žlčových ciest
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s reumatoidnou artritídou a psoriatickou artritídou s kontrolným obdobím v rozmedzí 4 až 104 týždňov prišlo k zvýšeniu ALT ≥ 3 x horná hranica normálnej hodnoty (upper limit of normal – ULN) u 3,7 % pacientov liečených adalimumabom a u 1,6 % pacientov, ktorým sa podávala kontrola.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 4 až 17 rokov, a u pacientov s artritídou spojenou s entezitídou, ktorí boli vo veku 6 až 17 rokov, prišlo k zvýšeniu hladiny ALT ≥ 3 x ULN u 6,1 %
pacientov liečených adalimumabom a u 1,3 % pacientov, ktorým sa podávala kontrola. Väčšina prípadov zvýšenia hladiny ALT sa vyskytla pri súbežnom používaní metotrexátu. Žiadne zvýšenie hladiny ALT ≥ 3 x ULN sa nevyskytlo v skúšaní fázy 3 s adalimumabom u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, ktorí boli vo veku 2 až < 4 roky.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s Crohnovou chorobou a ulceróznou kolitídou s kontrolným obdobím v rozmedzí 4 až 52 týždňov prišlo k zvýšeniu ALT ≥ 3 x ULN u 0,9 % pacientov liečených adalimumabom a u 0,9 % pacientov, ktorým sa podávala kontrola.
V štúdii fázy 3 s adalimumabom u pediatrických pacientov s Crohnovou chorobou, ktorá hodnotila účinnosť a bezpečnosť dvoch udržiavacích dávkovacích režimov po dobu až 52 týždňov liečby, ktoré boli upravené podľa telesnej hmotnosti a ktoré nasledovali po úvodnej liečbe, upravenej podľa telesnej hmotnosti, prišlo k zvýšeniu ALT ≥ 3 x ULN u 2,6 % (5/192) pacientov, z ktorých 4 dostávali súbežne imunosupresíva na začiatku liečby.
V kontrolovaných klinických skúšaniach fázy 3 s adalimumabom u pacientov s ložiskovou psoriázou s kontrolným obdobím v rozmedzí 12 až 14 týždňov prišlo k zvýšeniu ALT ≥ 3 x ULN u 1,8 % pacientov liečených adalimumabom a u 1,8 % pacientov, ktorým sa podávala kontrola.
V klinickom skúšaní fázy 3 s adalimumabom u pediatrických pacientov s ložiskovou psoriázou sa nevyskytli žiadne zvýšenia ALT ≥ 3 x ULN.
V kontrolovaných klinických skúšaniach s adalimumabom (úvodné dávky 160 mg v týždni 0 a 80 mg v týždni 2, potom 40 mg každý týždeň od 4. týždňa) u pacientov s hidradenitis suppurativa
s kontrolným obdobím, ktoré trvalo 12 až 16 týždňov, nastalo zvýšenie ALT ≥ 3 x ULN u 0,3 %
pacientov liečených adalimumabom a u 0,6 % pacientov, ktorým sa podávala kontrola.
V kontrolovaných klinických skúšaniach s adalimumabom (úvodné dávky 80 mg v týždni 0, potom
40 mg každé dva týždne od 1. týždňa) u pacientov s uveitídou, ktoré trvali až 80 týždňov s mediánom expozície 166,5 dňa u pacientov liečených adalimumabom a 105,0 dňa u pacientov, ktorým sa
podávala kontrola, nastalo zvýšenie ALT ≥ 3 x ULN u 2,4 % pacientov liečených adalimumabom a u 2,4 % pacientov, ktorým sa podávala kontrola.
U všetkých indikácií v klinických štúdiách boli pacienti so zvýšenou ALT asymptomatickí a zvýšenia boli vo väčšine prípadov prechodné a upravili sa v priebehu liečby. Avšak aj po uvedení na trh boli u pacientov, liečených adalimumabom, hlásené prípady zlyhania pečene, ako aj menej závažné poruchy pečene, ktoré môžu predchádzať zlyhaniu pečene, ako je hepatitída vrátane autoimunitnej hepatitídy.
Súbežná liečba s azatioprínom/6-merkaptopurínomV štúdiách s Crohnovou chorobou u dospelých bol vyšší výskyt malignít a nežiaducich udalostí
súvisiacich s vážnymi infekciami pri kombinácii adalimumabu a azatioprínu/6-merkaptopurínu v porovnaní s adalimumabom samotným.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických štúdiách nebola pozorovaná žiadna toxicita obmedzujúca dávku. Najvyššou hodnotenou dávkou bola opakovaná intravenózna dávka 10 mg/kg, čo je približne 15-násobok odporúčanej dávky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: imunosupresíva, inhibítory tumor nekrotizujúceho faktora alfa (TNFα). ATC kód: L04AB04
AMGEVITA je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke

Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuAdalimumab sa špecificky viaže na TNF a neutralizuje biologickú funkciu TNF blokovaním jeho
interakcie s p55 a p75 receptormi TNF na povrchu bunky.
Adalimumab tiež moduluje biologické odpovede, ktoré sú navodené alebo regulované TNF, vrátane zmien hladín adhezívnych molekúl, ktoré zodpovedajú za migráciu leukocytov (ELAM-1, VCAM-1 a ICAM-1 pri IC50 0,1-0,2 nM).
Farmakodynamické účinkyU pacientov s reumatoidnou artritídou sa po liečbe adalimumabom pozoroval rýchly pokles hladín
reaktantov akútnej fázy zápalu (C-reaktívny proteín (CRP) a sedimentácia erytrocytov (FW))
a sérových cytokínov (IL-6) oproti východiskovému stavu. Po podaní adalimumabu sa znížili aj sérové koncentrácie matrixových metaloproteináz (MMP-1 a MMP-3), ktoré vyvolávajú remodeláciu tkaniva, zodpovednú za deštrukciu chrupky. U pacientov liečených adalimumabom zvyčajne došlo k zlepšeniu hematologických príznakov chronického zápalu.
Rýchly pokles hladín CRP sa pozoroval počas liečby adalimumabom aj u pacientov s polyartikulárnou juvenilnou idiopatickou artritídou, Crohnovou chorobou, ulceróznou kolitidou a hidradenitis suppurativa. U pacientov s Crohnovou chorobou sa pozorovalo zníženie počtu buniek, exprimujúcich zápalové markery v čreve, vrátane signifikantnej redukcie expresie TNFα. Endoskopické vyšetrenia intestinálnej mukóze preukázali dôkaz hojenia sliznice u pacientov liečených adalimumabom.
Klinická účinnosťabezpečnosťReumatoidná artritídaAdalimumab bol hodnotený u viac ako 3 000 pacientov vo všetkých klinických štúdiách zameraných na reumatoidnú artritídu. Účinnosť a bezpečnosť adalimumabu bola hodnotená v piatich randomizovaných, dvojito zaslepených a dobre kontrolovaných štúdiách. Niektorí pacienti boli liečení až 120 mesiacov.
V RA štúdii I bolo hodnotených 271 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, vo veku ≥ 18 rokov, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom a liečba metotrexátom v dávkach od 12,5 do 25 mg (10 mg v prípade neznášanlivosti metotrexátu) každý týždeň pri konštantnej dávke 10 až 25 mg každý týždeň mala nedostatočnú účinnosť. Pacienti dostávali dávky 20, 40 alebo 80 mg adalimumabu alebo placebo každý druhý týždeň počas 24 týždňov.
V RA štúdii II sa hodnotilo 544 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, u ktorých zlyhala terapia aspoň jedným chorobu modifikujúcim antireumatickým liekom. Pacientom boli každý druhý týždeň po dobu 26 týždňov podávané subkutánne dávky 20 alebo 40 mg adalimumabu a placebo v týždňoch bez podania aktívnej liečby alebo bolo rovnakú dobu podávané každý týždeň placebo. Nebolo povolené podávanie žiadneho iného chorobu modifikujúceho antireumatického lieku.
V RA štúdii III sa hodnotilo 619 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac, a ktorí mali nedostatočnú odpoveď na metotrexát v dávkach od 12,5 do 25 mg alebo netolerovali dávku 10 mg metotrexátu každý týždeň. V tejto štúdii boli tri skupiny. Prvá skupina dostávala injekcie placeba raz týždenne počas 52 týždňov. Druhá skupina dostávala 20 mg adalimumabu každý týždeň počas 52 týždňov. Tretia skupina dostávala
40 mg adalimumabu každý druhý týždeň a placebo v týždňoch bez podania aktívnej liečby. Po uplynutí prvých 52 týždňov bolo 457 pacientov zaradených do otvorenej predĺženej fázy štúdie, v ktorej sa podávalo 40 mg adalimumabu/MTX každý druhý týždeň až po dobu 10 rokov.
V RA štúdii IV sa primárne hodnotila bezpečnosť u 636 pacientov so stredne ťažkou až ťažkou aktívnou reumatoidnou artritídou, ktorí boli vo veku 18 rokov a viac. Štúdie sa zúčastnili pacienti, ktorí ešte neboli liečení chorobu modifikujúcim antireumatickým liekom alebo pacienti s predchádzajúcou reumatoidnou liečbou, v ktorej naďalej pokračovali pod podmienkou, že liečba bola stabilná minimálne
28 dní. Tieto terapie zahŕňajú metotrexát, leflunomid, hydroxylchlorochín, sulfasalazín a/alebo soli zlata. Pacienti boli randomizovaní na 40 mg adalimumabu alebo placebo, ktoré dostávali každý druhý týždeň počas 24 týždňov.
V RA štúdii V sa hodnotilo 799 dospelých pacientov so stredne ťažkou až ťažkou aktívnou včasnou reumatoidnou artritídou doposiaľ neliečených metotrexátom (priemerné trvanie ochorenia menej ako 9 mesiacov). Táto štúdia hodnotila účinnosť 40 mg adalimumabu každý druhý týždeň v monoterapii a metotrexátu v monoterapii na zníženie prejavov a príznakov a rýchlosti progresie poškodenia kĺbov u reumatoidnej artritídy počas 104 týždňov. Po dokončení prvých 104 týždňov bolo 497 pacientov zaradených do otvorenej predĺženej fázy štúdie, v ktorej sa podávalo 40 mg adalimumabu každý druhý týždeň po dobu až 10 rokov.
Primárnym koncovým ukazovateľom v RA štúdiách I, II a III a sekundárnym koncovým ukazovateľom v RA štúdii IV bolo percento pacientov, u ktorých sa dosiahla odpoveď ACR 20 v 24. alebo 26. týždni. Primárnym koncovým ukazovateľom v RA štúdii V bolo percento pacientov, ktorí dosiahli odpoveď ACR 50 v 52. týždni. RA štúdie III a V mali ďalší primárny koncový ukazovateľ po 52 týždňoch, a to spomalenie progresie ochorenia (hodnotené pomocou výsledkov röntgenu). RA štúdia III mala ako primárny koncový ukazovateľ aj zmenu v kvalite života.
ACR odpove ď
Percento pacientov liečených adalimumabom, u ktorých sa dosiahla odpoveď ACR 20, 50 a 70, bolo
konzistentné v RA štúdiách I, II a III. Výsledky pre dávku 40 mg každý druhý týždeň sú zhrnuté v tabuľke 4.
Tabuľka 4 ACR odpovede v placebom kontrolovaných štúdiách (percento pacientov) Odpoveď RA štúdia Ia** RA štúdia IIa** RA štúdia IIIa**
ACR 20
Placebo/
MTXc
n = 60
Adalimuma bb/MTXc
n = 63
Placebo
n = 110
Adalimumabb
n = 113
Placebo/
MTXc
n = 200
Adalimumabb
/MTXc
n = 207
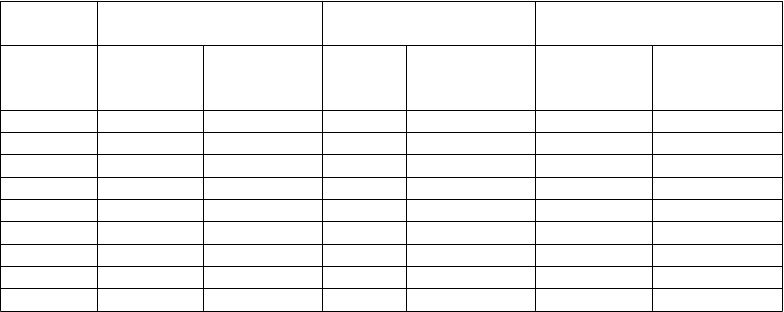
6 mesiacov 13,3 % 65,1 % 19,1 % 46,0 % 29,5 % 63,3 %
12 mesiacov NA NA NA NA 24,0 % 58,9 %
ACR 50
6 mesiacov 6,7 % 52,4 % 8,2 % 22,1 % 9,5 % 39,1 %
12 mesiacov NA NA NA NA 9,5 % 41,5 %
ACR 70
6 mesiacov 3,3 % 23,8 % 1,8 % 12,4 % 2,5 % 20,8 %
12 mesiacov NA NA NA NA 4,5 % 23,2 %
a RA štúdia I po 24 týždňoch, RA štúdia II po 26 týždňoch a RA štúdia III po 24 a 52 týždňoch
b 40 mg adalimumabu podávaného každý druhý týždeň
c MTX = metotrexát
**p < 0,01; adalimumab verzus placebo
V RA študiách I – IV sa po 24 alebo po 26 týždňoch v porovnaní s placebom zlepšili všetky jednotlivé zložky kritérií odpovede ACR (počet bolestivých a opuchnutých kĺbov, hodnotenie aktivity ochorenia
a bolesti lekárom a pacientom, skóre indexu postihnutia (HAQ) a hodnoty CRP (mg/dl)). V RA štúdii
III tieto zlepšenia pretrvávali počas 52 týždňov.
V otvorenej predĺženej fáze RA štúdie III si väčšina pacientov s ACR odozvou udržala odozvu pri sledovaní až po dobu 10 rokov. Z 207 pacientov, ktorí boli randomizovaní na adalimumab 40 mg každý druhý týždeň, pokračovalo 114 pacientov s adalimumabom 40 mg každý druhý týždeň po dobu
5 rokov. Medzi týmito pacientmi malo 86 pacientov (75,4 %) odpoveď ACR 20, 72 pacientov (63,2 %)
odpoveď ACR 50 a 41 pacientov (36 %) odpoveď ACR 70. 81 pacientov z 207 pokračovalo
s adalimumabom 40 mg každý druhý týždeň po dobu 10 rokov. Medzi týmito pacientmi malo 64
pacientov (79,0 %) odpoveď ACR 20, 56 pacientov (69,1 %) odpoveď ACR 50 a 43 pacientov
(53,1 %) odpoveď ACR 70.
V RA štúdii IV bola odpoveď ACR 20 u pacientov liečených adalimumabom spolu so štandardnou liečbou štatisticky signifikantne lepšia ako u pacientov, ktorým sa podávalo placebo spolu so štandardnou liečbou (p < 0,001).
V RA štúdiách I – IV dosiahli pacienti liečení adalimumabom štatisticky významné odpovede ACR 20
a 50 v porovnaní s placebom, a to už o jeden až dva týždne od začiatku liečby.
V RA štúdii V u pacientov s včasnou reumatoidnou artritídou, ktorí doposiaľ neboli liečení metotrexátom, viedla kombinovaná terapia adalimumabom a metotrexátom k rýchlejšej a významne väčšej odpovedi ACR ako monoterapia metotrexátom a monoterapia adalimumabom v 52. týždni
a odpoveď pretrvávala aj v 104. týždni (pozri tabuľku 5).
Tabuľka 5 ACR odpoveď v RA štúdii V (percento pacientov)
O
dpoveď
M
T
X
n =
257ACR 20
Adalimumabn =
274Adalimumab /MTXn
/MTXn =
268Hodnota paHodnota pbHodnota pc
Týždeň 52 62,6 % 54,4 % 72,8 % 0,013 < 0,001 0,043
Týždeň 104 56,0 % 49,3 % 69,4 % 0,002 < 0,001 0,140
ACR 50
Týždeň 52 45,9 % 41,2% 61,6 % < 0,001 < 0,001 0,317
Týždeň 104 42,8 % 36,9 % 59,0 % < 0,001 < 0,001 0,162
ACR 70
Týždeň 52 27,2 % 25,9 % 45,5 % < 0,001 < 0,001 0,656
Týždeň 104 28,4 % 28,1 % 46,6 % < 0,001 < 0,001 0,864 a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
c hodnota p pochádza z párového porovnania monoterapie adalimumabom a monoterapie metotrexátom pomocou Mannovho-Whitneyho U testu
V predĺženej otvorenej RA štúdii V sa odpovede ACR udržali počas obdobia sledovania až 10 rokov. Z 542 pacientov, ktorí boli randomizovaní na liečbu adalimumabom 40 mg každý druhý týždeň, 170 pacientov pokračovalo v liečbe adalimumabom 40 mg každý druhý týždeň po dobu 10 rokov. Spomedzi týchto pacientov malo 154 pacientov (90,6 %) odpoveď ACR 20, 127 pacientov (74,7 %) malo odpoveď ACR 50 a 102 pacientov (60,0 %) malo odpoveď ACR 70.
V 52. týždni dosiahlo 42,9 % pacientov liečených kombináciou adalimumab/metotrexát klinickú remisiu (DAS28 < 2,6) v porovnaní s 20,6 % pacientov liečených metotrexátom v monoterapii a 23,4
% pacientov liečených adalimumabom v monoterapii. Kombinovaná terapia adalimumab/metotrexát bola klinicky a štatisticky lepšia ako monoterapia metotrexátom (p < 0,001) a adalimumabom (p <
0,001) z hľadiska dosiahnutia stavu nízkej aktivity ochorenia u pacientov so stredne ťažkou až ťažkou formou reumatoidnej artritídy diagnostikovanou v nedávnom období. Odpoveď v dvoch
monoterapeutických ramenách štúdie bola podobná (p = 0,447).
Rádiografická odpoveď
V RA štúdii III, kde priemerná dĺžka trvania reumatoidnej artritídy u pacientov liečených
adalimumabom bola približne 11 rokov, bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky
a vyjadrené ako zmena modifikovaného celkového Sharpovho skóre (TSS) a jeho komponentov, skóre erózie a skóre zúženia kĺbovej štrbiny. U pacientov liečených adalimumabom/metotrexátom sa zistila významne menšia rádiografická progresia v 6. a 12. mesiaci liečby ako u pacientov liečených metotrexátom v monoterapii (pozri tabuľku 6).
V otvorenom predĺžení RA štúdie III zníženie stupňa progresie štrukturálneho poškodenia v
v podskupinách pacientov pretrvávalo 8 a 10 rokov. Po 8 rokoch bolo rádiograficky vyhodnotených 81
z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich u 48
nedošlo k progresii štrukturálneho poškodenia, čo sa definovalo ako zmena modifikovaného TSS (mTSS) z východiskovej hodnoty o 0,5 alebo menej. Po 10 rokoch bolo rádiograficky vyhodnotených
79 z 207 pacientov pôvodne liečených dávkou 40 mg adalimumabu každý druhý týždeň. Z nich u 40 nedošlo k progresii štrukturálneho poškodenia, definovaného ako zmena modifikovaného TSS (mTSS) z východiskovej hodnoty o 0,5 alebo menej.
Tabuľka 6 Priemerné rádiografické zmeny po 12 mesiacoch v RA štúdii III
P
lacebo/MTX
a
Adalimumab/
 M
T
X 40 mg každý druhý týždeň
Placebo/MT X- adalimumab/
M
T
X (95 % interval spoľahlivosti
b
Ho
dnota p
M
T
X 40 mg každý druhý týždeň
Placebo/MT X- adalimumab/
M
T
X (95 % interval spoľahlivosti
b
Ho
dnota p
Celkové 2,7 0,1 2,6 (1,4; 3,8) < 0,001c
Skóre erózie 1,6 0,0 1,6 (0,9; 2,2) < 0,001
Skóre JSNd 1,0 0,1 0,9 (0,3; 1,4) 0,002
a metotrexát
b 95 % intervaly spoľahlivosti pre rozdiely zmeny skóre medzi metotrexátom a adalimumabom
c na základe analýzy poradia
d zúženie kĺbovej štrbiny
V RA štúdii V bolo štrukturálne poškodenie kĺbov hodnotené rádiograficky a vyjadrené ako zmena modifikovaného celkového Sharpovho skóre (pozri tabuľku 7).
Tabuľka 7 Priemerné rádiografické zmeny v týždni 52 v RA štúdii V
M
T
X
n = 257
(9
5 % interval
s
poľahlivosti)
Adalimumab
n = 274
(9
5 % interval spoľahlivosti)
Adalimumab/ MTX
n = 268
(9
5 % interval spoľahlivosti)
Ho
dnota p
a
Ho
dnota p
b
Ho
dnota p
c
Celkové Sharpovo skóre
Skóre erózie
5,7 (4,2 – 7,3) 3,0 (1,7 – 4,3) 1,3 (0,5 – 2,1) < 0,001 0,0020 < 0,001
3,7 (2,7 – 4,7) 1,7 (1,0 – 2,4) 0,8 (0,4 – 1,2) < 0,001 0,0082 < 0,001
M
T
X
n = 257
(9
5 % interval
s
poľahlivosti)
Adalimumab
n = 274
(9
5 % interval spoľahlivosti)
Adalimumab/ MTX
n = 268
(9
5 % interval spoľahlivosti)
Ho
dnota p
a
Ho
dnota p
b
Ho
dnota p
c
JSN
skóre
2,0 (1,2 – 2,8) 1,3 (0,5 – 2,1) 0,5 (0 – 1,0) < 0,001 0,0037 0,151

a hodnota p pochádza z párového porovnania monoterapie metotrexátom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
b hodnota p pochádza z párového porovnania monoterapie adalimumabom a kombinovanej terapie adalimumab/metotrexát pomocou Mannovho-Whitneyho U testu
c hodnota p pochádza z párového porovnania monoterapie adalimumabom a monoterapie metotrexátom pomocou Mannovho-Whitneyho U testu
Po 52 a 104 týždňoch terapie bolo percento pacientov bez progresie (zmena modifikovaného Sharpovho skóre oproti východiskovej hodnote ≤ 0,5) významne vyššie pri kombinovanej terapii adalimumab/metotrexát (63,8 %, resp. 61,2 %) v porovnaní s monoterapiou metotrexátom (37,4 %, resp. 33,5 %, p < 0,001) a monoterapiou adalimumabom (50,7 %, p < 0,002, resp. 44,5 %, p < 0,001).
V otvorenej predĺženej štúdii RA V bola priemerná zmena modifikovaného Sharpovho skóre oproti východiskovým hodnotám na konci 10. roka 10,8; 9,2 a 3,9 u pacientov pôvodne randomizovaných na liečbu metotrexátom v monoterapii, adalimumabom v monoterapii a na kombinovanú liečbu adalimumabom/metotrexátom, v uvedenom poradí. Zodpovedajúci percentuálny podiel pacientov bez progresie bol 31,3 %, 23,7 % a 36,7 %, v uvedenom poradí.
Kvalita života a telesné funkcieKvalita života súvisiaca so zdravím a telesné funkcie boli hodnotené v štyroch pôvodných adekvátnych
a dobre kontrolovaných štúdiách indexom nespôsobilosti pomocou Dotazníka na posudzovanie zdravotného stavu (Health Assessment Questionnaire - HAQ). Tento parameter bol v RA štúdii III primárnym koncovým ukazovateľom v 52. týždni. U všetkých dávok/schém podávania adalimumabu vo všetkých štyroch štúdiách sa preukázalo štatisticky významné zlepšenie indexu nespôsobilosti HAQ medzi východiskovými hodnotami a hodnotami v 6. mesiaci v porovnaní s placebom. Rovnaké výsledky boli pozorované v RA štúdii III v 52 týždni. Výsledky z dotazníka Krátka forma prieskumu zdravotného stavu (Short Form Health Survey – SF 36) pre všetky dávky/schémy adalimumabu vo všetkých štyroch štúdiách podporujú tieto nálezy, so štatisticky významným zlepšením skóre súhrnu telesnej zložky (physical component summary – PCS) a rovnako aj štatisticky významným zlepšením skóre súhrnu zložiek bolesti a vitality pre dávku 40 mg každý druhý týždeň. Vo všetkých troch štúdiách, v ktorých bola posudzovaná únavnosť (RA štúdie I, III, IV), bolo pozorované štatisticky významné zníženie jej skóre, stanovené Funkčným hodnotením liečby chronickej choroby (Functional Assessment of Chronic Illness Therapy – FACIT).
Väčšina jedincov, ktorá dosiahla zlepšenie fyzických funkcií v RA štúdii III a ktorá pokračovala v liečbe v otvorenej fáze štúdie, si udržala zlepšenie až do týždňa 520 (120 mesiacov). Zlepšenie kvality života sa hodnotilo až do týždňa 156 (36 mesiacov) a pretrvávalo počas tejto doby.
V RA štúdii V zlepšenie indexu nespôsobilosti HAQ a skóre súhrnu telesných komponentov v SF 36 preukázalo výraznejšie zlepšenie (p < 0,001) pri kombinovanej liečbe adalimumab/metotrexát ako pri monoterapii metotrexátom a monoterapii adalimumabom v týždni 52 a zostalo väčšie až do týždňa 104.
250 pacientov, ktorí dokončili otvorenú rozšírenú štúdiu, si počas 10 rokov liečby zachovalo zlepšenie telesných funkcií.
Juvenilná idiopatická artritída (JIA)
P
olyartikulárna juvenilná idiopatická artritída (pJIA)
Bezpečnosť a účinnosť adalimumabu bola hodnotená v dvoch štúdiách (pJIA I a II) u detí s aktívnou
polyartikulárnou artritídou alebo s polyartikulárnym priebehom artritídy, ktoré mali rôzne typy vzplanutia JIA (najčastejšie polyartritída s negatívnym alebo pozitívnym reumatoidným faktorom alebo rozšírená oligoartritída).
pJIA I
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito zaslepenej štúdii s paralelnými skupinami u 171 detí (vo veku 4 – 17 rokov) s polyartikulárnou JIA. V otvorenej úvodnej fáze (OL LI) boli pacienti rozdelení do dvoch skupín, liečení MTX (metotrexátom) alebo neliečení MTX. Pacienti, ktorí boli v skupine neliečených MTX, neboli nikdy MTX liečení alebo bola liečba MTX u nich prerušená najmenej dva týždne pred podaním lieku v štúdii. Pacienti ostávali na stálych dávkach NSAID a/alebo prednizónu (≤ 0,2 mg/kg/deň alebo
maximálne 10 mg/deň). Vo fáze OL LI dostávali všetci pacienti adalimumab v dávke 24 mg/m2 až do maxima 40 mg každý druhý týždeň počas 16 týždňov. V tabuľke 8 je rozdelenie pacientov podľa veku
a minimálnej, strednej a maximálnej dávky, ktorú dostávali vo fáze OL LI.
Tabuľka 8 Rozdelenie pacientov podľa veku a dávky adalimumabu, ktorú dostávali vo fáze OL LI
V
eková
s
k
upina
P
očet pacientov na vstupe
 n (%)
Minimálna, stredná a maximálna
dávka
n (%)
Minimálna, stredná a maximálna
dávka
4 až 7 rokov 31 (18,1) 10, 20 a 25 mg
8 až 12 rokov 71 (41,5) 20, 25 a 40 mg
13 až 17 rokov 69 (40,4) 25, 40 a 40 mg
Pacienti, ktorí v 16. týždni vykázali pediatrickú odpoveď ACR 30, boli vhodní na randomizáciu do
dvojito zaslepenej (DB) fázy a dostávali každý druhý týždeň počas ďalších 32 týždňov alebo do vzplanutia ochorenia buď adalimumab v dávke 24 mg/m2 až do maxima 40 mg, alebo placebo. Kritériá vzplanutia ochorenia boli definované ako zhoršenie ≥ 3 zo 6 hlavných kritérií pediatrickej odpovede ACR o ≥ 30 % oproti vstupnej úrovni, ≥ 2 aktívnych kĺbov a zlepšenie nie viac ako 1 zo 6 kritérií o
>30 %. Po 32 týždňoch alebo po vzplanutí ochorenia boli pacienti vhodní na zaradenie do predĺženej otvorenej fázy.
Tabuľka 9 Pediatrické ACR 30 odpovede v JIA štúdii Skupina MTX bez MTX Fáza
Skupina MTX bez MTX FázaOL LI 16 týždeň
Pediatrická ACR 30 odpoveď (n/N) Hodnotenie účinnosti
94,1 % (80/85) 74,4 % (64/86)
Dvojito zaslepená,
32 týždňov
Vzplanutie ochorenia na konci 32. týždňaa (n/N)
Adalimumab/ MTX
(N = 38)
36,8 % (14/38)
Placebo/MTX (N = 37)
64,9 % (24/37)b
Adalimumab
(N = 30)
43,3 % (13/30)
Placebo
(N = 28)
71,4 % (20/28)c
Priemerný čas do
vzplanutia ochorenia
> 32 týždňov 20 týždňov > 32 týždňov 14 týždňov
a Pediatrické odpovede ACR 30/50/70 boli v 48. týždni významne vyššie ako u pacientov liečených placebom
b p = 0,015
c p = 0,031
U pacientov, ktorí boli počas celej štúdie liečení adalimumabom a odpovedali v 16. týždni (n = 144), pretrvávali pediatrické odpovede ACR 30/50/70/90 počas šiestich rokov fázy OLE. Všetkých 19 pacientov, z ktorých 11 bolo na začiatku štúdie vo veku 4 až 12 rokov a 8 vo veku 13 až 17 rokov, bolo liečených počas 6 rokov alebo dlhšie.
Celkové odpovede boli všeobecne lepšie a protilátky sa vyvinuli u menšieho počtu pacientov, ak boli liečení kombináciou adalimumab a MTX v porovnaní s adalimumabom samotným. Berúc do úvahy tieto údaje, adalimumab sa odporúča na používanie v kombinácii s MTX a na používanie ako monoterapia iba u pacientov, u ktorých je podávanie MTX nevhodné (pozri časť 4.2).
pJIA II
Bezpečnosť a účinnosť adalimumabu bola hodnotená v otvorenej multicentrickej štúdii u 32 detí (vo veku 2 – < 4 roky alebo vo veku 4 roky a viac, s hmotnosťou < 15 kg) so stredne ťažkou až ťažkou aktívnou polyartikulárnou JIA. Pacienti dostávali 24 mg adalimumabu/m2 telesného povrchu (Body Surface Area, BSA) až maximálne 20 mg každý druhý týždeň v jednej dávke subkutánnou injekciou aspoň po dobu 24 týždňov. V priebehu štúdie väčšina subjektov používala súbežne MTX, menej bolo hlásené používanie kortikosteroidov alebo NSAID.
Z pozorovaných údajov vyplýva, že v 12. týždni a 24. týždni bola pediatrická odpoveď ACR 30
93,5 %, resp. 90,0 %. Pomer subjektov s pediatrickou odpoveďou ACR 50/70/90 v 12. týždni a v 24. týždni bol 90,3 %/61,3 %/38,7 % a 83,3 %/73,3 %/36,7 %, v príslušnom poradí. Medzi tými, ktorí
odpovedali (pediatrická odpoveď ACR 30) v 24. týždni (n = 27 z 30 pacientov), sa pediatrická ACR
odpoveď 30 zachovala po dobu až 60 týždňov vo fáze OLE u pacientov, ktorí dostávali adalimumab po celé toto obdobie. Celkovo bolo 20 subjektov liečených po dobu 60 týždňov alebo dlhšie.
Artritída spojená s entezitídou
Bezpečnosť a účinnosť adalimumabu bola hodnotená v multicentrickej, randomizovanej, dvojito
zaslepenej štúdii u 46 pediatrických pacientoch (vo veku 6 až 17 rokov) so stredne ťažkou artritídou spojenou s entezitídou. Pacienti boli randomizovaní buď na podávanie adalimumabu v dávke
24 mg/m2 BSA až do maximálnej dávky 40 mg, alebo na podávanie placeba každý druhý týždeň po dobu 12 týždňov. Po dvojito zaslepenej fáze nasledovala otvorená (open-label – OL) fáza, počas ktorej pacienti dostávali 24 mg/m2 BSA adalimumabu až do maximálnej dávky 40 mg každý druhý týždeň
subkutánne po dobu ďalších až 192 týždňov. Primárnym koncovým ukazovateľom bola percentuálna zmena od východiskovej hodnoty do 12. týždňa v počte aktívnych kĺbov s artritídou (opuch nie pre
deformáciu alebo kĺby so stratou pohyblivosti plus bolesť a/alebo citlivosť), ktorá bolo dosiahnutá s priemerným percentuálnym poklesom o - 62,6 % (medián percentuálnej zmeny - 88,9 %)
u pacientov v skupine liečenej adalimumabom v porovnaní s - 11,6 % (medián percentuálnej zmeny -
50,0 %) u pacientov v skupine, ktorá dostávala placebo. Zlepšenie v počte aktívnych kĺbov s artritídou sa udržalo v priebehu otvorenej fázy až do 52. týždňa štúdie. Aj keď to nie je štatisticky významné,
u väčšiny pacientov sa prejavilo klinické zlepšenie sekundárnych koncových ukazovateľov, ako je počet miest entezitídy, počet bolestivých kĺbov (TJC), počet opuchnutých kĺbov (SJC), pediatrická
odpoveď ACR 50 a pediatrická odpoveď ACR 70.
Axiálna spondylartritída
Ankylozujúca spondylitída (AS)
V dvoch randomizovaných 24-týždňových, dvojito zaslepených, placebom kontrolovaných štúdiách u
pacientov s aktívnou ankylozujúcou spondylitídou (priemerné skóre pred začiatkom liečby [Bath
Ankylosing Spondylitis Disease Activity Index (BASDAI)] vo všetkých skupinách bolo 6,3) sa hodnotilo podávanie adalimumabu v dávke 40 mg každý druhý týždeň u 393 pacientov, ktorí neodpovedali adekvátne na konvenčnú liečbu. 79 (20,1 %) pacientov sa liečilo súčasne chorobu modifikujúcimi antireumatickými liekmi a 37 (9,4 %) pacientov glukokortikoidmi. Po zaslepenej časti štúdie nasledovala otvorená fáza štúdie, počas ktorej sa pacientom podával adalimumab 40 mg
subkutánne každý druhý týždeň ďalších 28 týždňov. Pacienti (n = 215; 54,7 %), ktorí nedosiahli ASAS
20 v týždňoch 12 alebo 16 alebo 20, prešli do otvorenej fázy skôr a podával sa im subkutánne adalimumab 40 mg každý druhý týždeň. Následne boli v dvojito zaslepených štatistických analýzach pokladaní za non-respondérov.
Vo väčšej AS štúdii I s 315 pacientmi výsledky ukázali štatisticky významné zlepšenie prejavov
a príznakov ankylozujúcej spondylitídy u pacientov liečených adalimumabom v porovnaní s tými, ktorým sa podávalo placebo. Signifikantná odpoveď sa prvýkrát pozorovala v týždni 2 a pretrvávala
počas 24 týždňov (tabuľka 10).
Tabuľka 10 Účinnosť v placebom kontrolovanej AS Štúdii – Štúdia I Redukcia prejavov a príznakov
O
dpoveď Placebo
 N = 107
A
dalimumab
N = 208
N = 107
A
dalimumab
N = 208
ASASa 20
Týždeň 2 16 % 42 %*** Týždeň 12 21 % 58 %*** Týždeň 24 19 % 51 %***
ASAS 50
Týždeň 2 3 % 16 %*** Týždeň 12 10 % 38 %*** Týždeň 24 11 % 35 %***
ASAS 70
Týždeň 2 0 % 7 %** Týždeň 12 5 % 23 %*** Týždeň 24 8 % 24 %***
BASDAIb 50
Týždeň 2 4 % 20 %*** Týždeň 12 16 % 45 %*** Týždeň 24 15 % 42 %***
***,** Štatisticky signifikanné v rozsahu p < 0,001; < 0,01 pre všetky porovnania medzi adalimumabom a placebom v týždňoch 2, 12 a 24
a Assessments in Ankylosing Spondylitis
b Bath Ankylosing Spondylitis Disease Activity Index
Pacienti liečení adalimumabom vykazovali signifikantne významnejšie zlepšenie v týždni 12
a pretrvávalo do týždňa 24 ako u SF36 tak aj v dotazníku Ankylosing Spondylitis Quality of Life
Questionnaire (ASQoL).
Podobné trendy (ale nie štatisticky signifikantné) sa zistili v menšej randomizovanej, dvojito zaslepenej, placebom kontrolovanej AS štúdii II u 82 dospelých pacientov s aktívnou ankylozujúcou spondylitídou.
Axiálna spondylartritída bez rádiografického dôkazu AS
Adalimumab 40 mg, podávaný každý druhý týždeň, sa hodnotil u 185 pacientov v jednej
randomizovanej, 12-týždňovej dvojito zaslepenej, placebom kontrolovanej štúdii u pacientov
s aktívnou nerádiografickou axiálnou spondylartritídou (priemerné východiskové skóre aktivity ochorenia [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), Bathov index aktivity ankylozujúcej spondylitídy] bolo 6,4 u pacientov liečených adalimumabom a 6,5 pre pacientov
s placebom), ktorí mali nedostatočnú odpoveď na ≥ 1 NSAID alebo ich netolerovali alebo boli u nich kontraindikované.
Tridsaťtri (18 %) pacientov bolo súbežne liečených chorobu modifikujúcimu antireumatickými liekmi a 146 (79 %) pacientov s NSAID na začiatku. Po dvojito zaslepenej fáze nasledovala otvorená fáza,
v ktorej dostávali pacienti adalimumab 40 mg každý druhý týždeň subkutánne počas ďalších 144
týždňov. Výsledky v týždni 12 ukázali štatisticky významné zlepšenie prejavov a príznakov aktívnej nerádiografickej axiálnej spondylartritídy u pacientov liečených adalimumabom v porovnaní
s placebom (tabuľka 11).
Tabuľka 11 Účinnosť v placebom kontrolovanej axiálnej SpA štúdii
D
vojito
z
aslepená
P
l
a
cebo
 N = 94
A
dalimumab
N = 91
N = 94
A
dalimumab
N = 91
ASASa 40 15 % 36 %*** ASAS 20 31 % 52 %** ASAS 5/6 6 % 31 %*** ASAS čiastočná remisia 5 % 16 %* BASDAIb 50 15 % 35 %** ASDASc,d,e −0,3 −1,0*** ASDAS neaktívna choroba 4 % 24 %*** hs-CRPd,f,g −0,3 −4,7*** SPARCCh MRI krížovodriekovéd,i −0,6 −3,2** SPARCC MRI Chrbticad,j −0,2 −1,8**
a Hodnotenie podľa Medzinárodnej spoločnosti pre spondylartritídu
b Bath Ankylosing Spondylitis Disease Activity Index
c Ankylosing Spondylitis Disease Activity Score
d priemerna zmena od východiskovej hodnoty
e n = 91 placebo a n = 87 adalimumab
f CRP test s vysokou citlivosťou (mg/l)
g n = 73 placebo a n = 70 adalimumab
h Spondyloarthritis Research Consortium of Canada
i n = 84 placebo a adalimumab
j n = 82 placebo a n = 85 adalimumab
***,**,* štatisticky signifikantné v rozsahu p < 0,001, < 0,01 a < 0,05, v uvedenom poradí, pre všetky porovnania medzi adalimumabom a placebom.
V otvorenom predĺžení skúšania sa zlepšenie prejavov a príznakov udržalo pri liečbe adalimumabom do 156. týždňa.
Inhibícia zápalu
Významné zlepšenie príznakov zápalu meraného testom hs-CRP a MRI u krížovodriekových kĺbov aj
u chrbtice sa u pacientov liečených adalimumabom udržalo do 156., resp. 104. týždňa.
Kvalita života a telesné funkcie
Kvalita života súvisiaca so zdravím a telesné funkcie boli hodnotené pomocou dotazníkov HAQ-S
a SF-36. Adalimumab preukázal štatisticky významne výraznejšie zlepšenie v celkovom skóre v HAQ- S a v skóre fyzickej zložky (Physical Component Score, PCS) v SF-36 od začiatku do 12. týždňa
v porovnaní s placebom. Zlepšenie kvality života súvisiacej so zdravím a fyzickými funkciami sa
udržalo v priebehu otvoreného predĺženia štúdie až do 156. týždňa.
Psoriatická artritída
Adalimumab 40 mg, podávaný každý druhý týždeň, bol študovaný u pacientov so stredne ťažkou
a ťažkou aktívnou psoriatickou artritídou v dvoch placebom kontrolovaných štúdiách, PsA štúdiách
I a II. V PsA štúdii I, trvajúcej 24 týždňov, bolo liečených 313 dospelých pacientov s nedostatočnou odpoveďou na nesteroidové antireumatiká a z nich približne 50 % užívalo metotrexát. V PsA štúdii II,
trvajúcej 12 týždňov, bolo liečených 100 pacientov s nedostatočnou odpoveďou na liečbu DMARD. Po
ukončení oboch štúdií bolo 383 pacientov vybraných do otvorenej rozšírenej štúdie, v ktorej sa pacientom podávalo 40 mg adalimumabu každý druhý týždeň (eow, every other week).
V dôsledku nízkeho počtu pacientov so psoriatickou artropatiou podobnou ankylozujúcej spondylitíde v štúdii nie sú k dispozícii dostatočné dôkazy účinnosti adalimumabu u týchto pacientov.
Tabuľka 12 ACR odpoveď v placebom kontrolovaných štúdiách u pacientov so psoriatickou artritídou (percento pacientov)
PsA štúdia I PsA štúdia II
O
dpoveď Placebo
N = 162
A
dalimumab
 N = 151
Placebo
N = 49
A
dalimumab
N = 51
N = 151
Placebo
N = 49
A
dalimumab
N = 51
ACR 20
Týždeň 12 14 % 58 %*** 16 % 39 %* Týždeň 24 15 % 57 %*** N/A N/A ACR 50
Týždeň 12 4 % 36 %*** 2 % 25 %***
Týždeň 24 6 % 39 %*** N/A N/A ACR 70
Týždeň 12 1 % 20 %*** 0 % 14 %*
Týždeň 24 1 % 23 %*** N/A N/A
***p < 0,001 pre všetky porovnania medzi adalimumabom a placebom
*p < 0,05 pre všetky porovnania medzi adalimumabom a placebom
N/A nevzťahuje sa
ACR odpovede v PsA štúdii I boli podobné pri súbežnom podávaní metotrexátu aj bez neho. V otvorenej rozšírenej štúdii pretrvávali odpovede ACR až 136 týždňov.
V štúdiách so psoriatickou artritídou boli hodnotené rádiografické zmeny. Röntgenové snímky rúk, zápästí a nôh sa urobili na začiatku a v týždni 24 počas dvojito zaslepenej fázy, keď sa pacientom podával adalimumab alebo placebo, a v týždni 48, keď sa všetkým pacientom v otvorenej fáze podával adalimumab. Použilo sa modifikované celkové Sharpovo skóre (modified Total Sharp Score, mTSS), ktoré hodnotí aj distálne interfalangeálne kĺby (t. j. nie je identické s TSS používaným pre reumatoidnú artritídu).
V porovnaní s liečbou placebom znížila liečba adalimumabom rýchlosť progresie poškodenia periférnych kĺbov, keď sa to hodnotilo zmenou medzi východiskovými hodnotami mTSS (priemer
±SD) a hodnotami 0,8 ±2,5 v skupine s placebom (v týždni 24) v porovnaní s hodnotami 0,0 ±1,9;
(p < 0,001) v skupine s adalimumabom (v týždni 48).
Z pacientov liečených adalimumabom, ktorí boli bez rádiografickej progresie od východiskového stavu po týždeň 48 (n = 102), 84 % nepreukázalo žiadnu rádiografickú progresiu počas 144 týždňov liečby. Hodnotenie pomocou HAQ a Stručného formulára prieskumu zdravia (SF 36) preukázalo v týždni 24
u pacientov liečených adalimumabom štatisticky významné zlepšenie fyzickej funkcie v porovnaní
s liečbou placebom. Zlepšená fyzická funkcia pokračovala počas otvorenej rozšírenej fázy až do týždňa
136.
Psoriáza
Bezpečnosť a účinnosť adalimumabu bola študovaná v randomizovaných, dvojito zaslepených štúdiách u dospelých pacientov s chronickou ložiskovou psoriázou (postihnutie ≥ 10 % BSA a index plochy postihnutia a závažnosti psoriázy (Psoriasis Area and Severity Index, PASI) ≥ 12 alebo ≥ 10), ktorí boli kandidátmi na systémovú liečbu alebo fotoliečbu. 73 % pacientov zahrnutých do štúdií I a II so psoriázou bolo predtým liečených systémovou liečbou alebo fotoliečbou. Bezpečnosť a účinnosť adalimumabu sa študovala aj u dospelých pacientov so stredne ťažkou až ťažkou chronickou
ložiskovou psoriázou so súčasnou psoriázou na rukách a/alebo chodidlách, ktorí boli kandidátmi na systémovú liečbu, v randomizovanej dvojito zaslepenej štúdii (štúdia III so psoriázou).
V štúdii I (REVEAL) so psoriázou bolo počas troch liečebných intervalov hodnotených 1 212 pacientov. V intervale A dostali pacienti placebo alebo adalimumab v úvodnej dávke 80 mg a po uplynutí jedného týždňa od úvodnej dávky 40 mg každý druhý týždeň. Pacienti, ktorí dosiahli aspoň odpoveď PASI 75 (skóre zlepšenia PASI aspoň 75 % v porovnaní s počiatočným stavom), pokračovali po 16 týždňoch liečby v intervale B a v otvorenej fáze dostávali 40 mg adalimumabu každý druhý týždeň. Pacienti, ktorí si aj v týždni 33 udržali odpoveď ≥ PASI 75 a v intervale A boli randomizovaní na aktívnu liečbu, boli v intervale C znovu randomizovaní na podanie 40 mg adalimumabu každý
druhý týždeň alebo placeba počas ďalších 19 týždňov. Vo všetkých liečebných skupinách bolo na začiatku liečby priemerné skóre PASI 18,9 a skóre celkového hodnotenia lekárom (Physician’s Global Assessment, PGA) sa pohybovalo od „stredne ťažkého“ (53 % hodnotených pacientov) po „ťažké“ (41
%) až „veľmi ťažké“ (6 %).
V štúdii II (CHAMPION) so psoriázou sa porovnávala účinnosť a bezpečnosť adalimumabu
v porovnaní s metotrexátom a placebom u 271 pacientov. Pacienti dostávali počas 16 týždňov placebo, úvodnú dávku MTX 7,5 mg, ktorá sa potom zvyšovala do 12. týždňa na maximálnu dávku 25 mg,
alebo dostali úvodnú dávku adalimumabu 80 mg a potom 40 mg adalimumabu každý druhý týždeň (po
1. týždni od úvodnej dávky). K dispozícii nie sú údaje porovnávajúce adalimumab a MTX po liečbe trvajúcej viac ako 16 týždňov. Pacientom, ktorým sa podával MTX a ktorí v týždni 8 a/alebo 12 mali
odpoveď ≥ PASI 50, sa nepodali ďalšie zvýšené dávky. Vo všetkých liečebných skupinách bolo na
začiatku liečby priemerné skóre PASI 19,7 a skóre PGA sa pohybovalo od „mierneho“ (< 1 %) po
„stredne ťažké“ (48 %), „ťažké “ (46 %) až „veľmi ťažké“ (6 %).
Pacienti, ktorí sa zúčastnili klinických skúšaní fázy 2 aj fázy 3 zameraných na psoriázu, boli vhodní na zaradenie do otvoreného rozšíreného klinického skúšania s podávaním adalimumabu najmenej ďalších
108 týždňov.
V štúdiách I a II so psoriázou bol primárnym koncovým ukazovateľom pomer pacientov, ktorí
v porovnaní so stavom na začiatku liečby dosiahli v týždni 16 odpoveď PASI 75 (pozri tabuľky 13
a 14).
Tabuľka 13 Štúdia I so psoriázou (REVEAL) – účinnosť v týždni 16
P
l
a
cebo
N = 398
 n (%)
A
dalimumab 40 mg každý
druhý týždeň N = 814
n (%)
n (%)
A
dalimumab 40 mg každý
druhý týždeň N = 814
n (%)
≥ PASI 75a 26 (6,5) 578 (70,9)b
PASI 100 3 (0,8) 163 (20,0)b
P
G
A:
č
i
sté
/
m
i
nimálne
17 (4,3) 506 (62,2)b
a percento pacientov, ktorí dosiahli odpoveď PASI 75, bolo vypočítané ako priemerná hodnota
b p < 0,001; adalimumab verzus placebo
Tabuľka 14 Štúdia II so psoriázou (CHAMPION) – účinnosť v týždni 16
P
l
a
cebo
N = 53
n (%)
MTX
N = 110
 n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 108
n (%)
n (%)
A
dalimumab 40 mg
každý druhý týždeň
N = 108
n (%)
≥ PASI 75 10 (18,9) 39 (35,5) 86 (79,6)a,b
PASI 100 1 (1,9) 8 (7,3) 18 (16,7)c,d
P
G
A:
čisté/minimálne
6 (11,3) 33 (30,0) 79 (73,1)a,b
a p < 0,001 adalimumab verzus placebo
b p < 0,001 adalimumab verzus metotrexát
c p < 0,01 adalimumab verzus placebo
d p < 0,05 adalimumab verzus metotrexát
V štúdii I so psoriázou u pacientov, ktorí mali odpoveď PASI 75 a v týždni 33 boli znovu randomizovaní na placebo, stratilo adekvátnu odpoveď 28 % v porovnaní s 5 %, ktorým sa ďalej podával adalimumab, p < 0,001 (skóre PASI po týždni 33 a v týždni 52 alebo pred ním vyústilo do odpovede < PASI 50 v porovnaní s počiatočným stavom s minimálne 6-bodovým zvýšením skóre PASI v porovnaní s týždňom 33). Z pacientov, ktorí po opätovnej randomizácii na placebo stratili schopnosť adekvátne odpovedať a ktorí boli potom zaradení do otvorenej rozšírenej štúdie, 38 % (25/66) znova získalo odpoveď PASI 75 po 12 týždňoch liečby a 55 % (36/66) po 24 týždňoch liečby.
Celkovo 233 pacientov, ktorí dosiahli skóre PASI 75 v 16. a 33. týždni, dostávalo kontinuálnu liečbu adalimumabom v trvaní 52 týždňov v štúdii I so psoriázou a v liečbe adalimumabom pokračovalo v otvorenom rozšírenom skúšaní. Po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní 160 týždňov) dosiahlo skóre PASI 75 74,7 % týchto pacientov a skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke 59,0 % pacientov. V analýze sa všetci pacienti vylúčení zo skúšania kvôli nežiaducim udalostiam alebo nedostatočnej účinnosti a tí, ktorým sa zvýšila dávka, považovali za pacientov bez odpovede, a po ďalších 108 týždňoch otvorenej liečby (v celkovom trvaní'
160 týždňov) skóre PASI 75 dosiahlo 69,6 % pacientov a skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke 55,7 %.
V otvorenom rozšírenom skúšaní sa hodnotilo pri vysadení liečby a pri pokračovaní v liečbe celkovo
347 pacientov so stálou odpoveďou na liečbu. V období vysadenia liečby sa príznaky psoriázy časom vrátili, s mediánom času po relaps (pokles skóre PGA na „stredne ťažká psoriáza“ alebo horšie skóre) približne 5 mesiacov. Žiadny z týchto pacientov nezaznamenal zhoršenie po náhlom vysadení liečby. Celkovo 76,5 % (218/285) pacientov, ktorí sa zúčastnili pokračujúcej liečby, malo po 16 týždňoch pokračujúcej liečby skóre PGA zodpovedajúce čistej pokožke alebo minimálne postihnutej pokožke bez ohľadu na to, či u nich počas vysadenia liečby došlo k relapsu (k relapsu došlo u 69,1 % [123/178] pacientov a bez relapsu bolo 88,8 % [95/107] pacientov). Profil bezpečnosti počas pokračujúcej liečby bol podobný ako pred vysadením.
Pri hodnotení indexu DLQI (Dermatology Life Quality Index, Dermatologický index kvality života) sa preukázali významné zlepšenia v týždni 16 v porovnaní so stavom na začiatku liečby a s placebom (štúdie I a II) a MTX (štúdia II). Zlepšenia vo fyzickej a mentálnej zložke súhrnných skór SF-36
v porovnaní s placebom v štúdii I boli tiež významné.
V otvorenej rozšírenej štúdii u pacientov, ktorých dávka bola kvôli odpovedi PASI pod 50 % stupňovaná zo 40 mg každý druhý týždeň na 40 mg týždenne, dosiahlo v 12. týždni 26,4 % (92/349) a v 24. týždni 37,8 % (132/349) pacientov odpoveď PASI 75.
Štúdia III so psoriázou (REACH) porovnávala účinnosť a bezpečnosť adalimumabu v porovnaní
s placebom u 72 pacientov so stredne ťažkou až ťažkou chronickou ložiskovou psoriázou a psoriázou na rukách a/alebo chodidlách. Pacienti dostali úvodnú dávku 80 mg adalimumabu, po ktorej nasledovala dávka 40 mg každý druhý týždeň (počínajúc prvým týždňom po úvodnej dávke) alebo placebo po dobu 16 týždňov. V týždni 16 dosiahol PGA „čisté“ alebo „takmer čisté“ pre ruky a/alebo chodidlá štatisticky signifikantne vyšší podiel pacientov, ktorí dostávali adalimumab, v porovnaní s pacientmi, ktorí dostávali placebo (30,6 % verzus 4,3 %, v uvedenom poradí [P = 0,014]).
Ložisková psoriáza u pediatrických pacientov
Účinnosť adalimumabu bola hodnotená v randomizovanej, dvojito zaslepenej, kontrolovanej štúdii zahŕňajúcej 114 pediatrických pacientov vo veku od 4 rokov s ťažkou chronickou ložiskovou psoriázou (definovanou hodnotami PGA ≥ 4 alebo postihnutím > 20 % BSA alebo postihnutím > 10 % BSA
s veľmi hrubými léziami alebo PASI ≥ 20 alebo ≥ 10 s klinicky relevantným postihnutím tváre, pohlavných orgánov alebo rúk/nôh), ktorí boli nedostatočne kontrolovaní lokálnou liečbou
a helioterapiou alebo fototerapiou.
Pacienti dostávali adalimumab 0,8 mg/kg každý druhý týždeň (maximálne 40 mg); 0,4 mg/kg každý druhý týždeň (maximálne 20 mg) alebo metotrexát 0,1 – 0,4 mg/kg jedenkrát týždenne (maximálne
25 mg). V týždni 16 malo viac pacientov randomizovaných do skupiny liečenej adalimumabom
0,8 mg/kg pozitívnu reakciu, pokiaľ ide o účinnosť (napr. PASI 75), v porovnaní s pacientmi, ktorí boli randomizovaní do skupiny liečenej 0,4 mg/kg každý druhý týždeň (eow) alebo MTX.
Tabuľka 15: Výsledky účinnosti liečby ložiskovej psoriázy u pediatrických pacientov v týždni 16
 MTX
a
N = 37
A
dalimumab 0,8 mg/kg eow
N = 38
MTX
a
N = 37
A
dalimumab 0,8 mg/kg eow
N = 38
PASI 75b 12 (32,4 %) 22 (57,9 %) PGA: čisté/minimálnec 15 (40,5 %) 23 (60,5 %)
a MTX = metotrexát
b P = 0,027; adalimumab 0,8 mg/kg verzus MTX
c P = 0,083; adalimumab 0,8 mg/kg verzus MTX
Pacienti, ktorí dosiahli PASI 75 a PGA čisté alebo minimálne, boli vysadení z liečby po dobu najviac
36 týždňov a sledovaní z hľadiska straty kontroly nad ochorením (t. j. zhoršenie PGA aspoň o 2 stupne). Pacienti boli potom znova liečení adalimumabom 0,8 mg/kg každý druhý týždeň počas ďalších 16 týždňov a miera odpovede pozorovaná pri opakovanej liečbe bola podobná ako v predchádzajúcom dvojito zaslepenom období: PASI 75 odpoveď 78,9 % (15 z 19 subjektov) a PGA čisté alebo minimálne 52,6 % (10 z 19 subjektov).
V otvorenom období štúdie boli odpovede PASI 75 a PGA čisté alebo minimálne zachované až počas
ďalších 52 týždňov bez nových bezpečnostných zistení.
Hidradenitis suppurativa
Bezpečnosť a účinnosť adalimumabu boli hodnotené v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách a v otvorenej predĺženej štúdii u dospelých pacientov so stredne ťažkou až ťažkou formou hidradenitis suppurativa (HS), ktorí netolerovali, mali kontraindikáciu alebo nedostatočnú odpoveď na aspoň 3-mesačnú skúšobnú systémovú antibiotickú terapiu. Pacienti v HS-I a HS-II mali štádium ochorenia II alebo III podľa Hurleyho a mali aspoň 3 abscesy alebo zápalové uzlíky.
V štúdii HS-I (PIONEER I) bolo hodnotených 307 pacientov počas 2 liečebných fáz. Vo fáze A dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0; 80 mg v 2. týždni a 40 mg jedenkrát za týždeň počínajúc 4. týždňom a končiac 11. týždňom. Súčasné používanie antibiotík v priebehu štúdie nebolo dovolené. Po 12. týždni liečby pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do 1 z 3 liečebných skupín (adalimumab 40 mg jedenkrát za týždeň, adalimumab 40 mg každý druhý týždeň alebo placebo od 12. týždňa do 35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny s placebom, dostávali vo fáze B adalimumab 40 mg jedenkrát za týždeň.
V štúdii HS-II (PIONEER II) bolo hodnotených 326 pacientov počas 2 liečebných fáz. Vo fáze A dostávali pacienti placebo alebo adalimumab v počiatočnej dávke 160 mg v týždni 0 a 80 mg v 2. týždni a 40 mg jedenkrát za týždeň počínajúc 4. týždňom a končiac 11. týždňom. 19,3 % pacientov pokračovalo v priebehu štúdie v základnej perorálnej liečbe antibiotikami. Po 12. týždňoch liečby pacienti, ktorí dostávali adalimumab vo fáze A, boli znova randomizovaní vo fáze B do 1 z 3 liečebných skupín (adalimumab 40 mg jedenkrát za týždeň, adalimumab 40 mg každý druhý týždeň alebo placebo od 12. týždňa do 35. týždňa). Pacienti, ktorí boli randomizovaní vo fáze A do skupiny s placebom, dostávali vo fáze B placebo.
Pacienti, ktorí sa zúčastnili štúdií HS-I a HS-II, boli vhodní na zaradenie do otvorenej predĺženej štúdie, v ktorej sa adalimumab 40 mg podával jedenkrát za týždeň. Počas všetkých 3 štúdií pacienti používali lokálny antiseptický prípravok na každodenné umývanie.
Klinická odpoveď
Zníženie zápalových lézií a prevencia zhoršenia abscesov a vytekajúcich fistúl boli hodnotené
pomocou klinickej odpovede pri hidradenitis suppurativa (Hidradenitis Suppurativa Clinical Response- HiSCR, najmenej 50 % zníženie celkového počtu abscesov a zápalových uzlíkov bez nárastu počtu
abscesov a bez nárastu počtu vytekajúcich fistúl v porovnaní s východiskovým stavom). Zníženie
bolesti kože súvisiacej s HS bolo hodnotené pomocou číselnej hodnotiacej stupnice u pacientov, ktorí vstúpili do štúdie s počiatočným východiskovým skóre 3 alebo viac na 11-bodovej stupnici.
V 12. týždni významne vyšší podiel pacientov liečených adalimumabom v porovnaní s pacientmi liečenými placebom dosiahol HiSCR. V 12. týždni významne vyšší podiel pacientov v štúdii HS-II dosiahol klinicky relevantné zníženie bolesti kože súvisiacej s HS (pozri tabuľku 16). U pacientov liečených adalimumabom sa významne znížilo riziko vzplanutia ochorenia v priebehu prvých 12 týždňov liečby.
Tabuľka 16 Výsledky hodnotenia účinnosti po 12 týždňoch, štúdie HS I a II
Štúdia HS I Štúdia HS II
Klinická odpoveď pri hidradenitis
suppurativa
a
Placebo
N = 154
40 (26,0 %)
Adalimumab
40 mg týždenné
N = 153
64 (41,8 %)*
Placebo
N = 163
45 (27,6 %)
Adalimumab
40 mg týždenne
N = 163
96 (58,9 %)***
(HiSCR)
≥ 30 % zníženie bolesti kožeb
N = 109
27 (24,8 %)
N = 122
34 (27,9 %)
N = 111
23 (20,7 %)
N = 105
48 (45,7 %)***
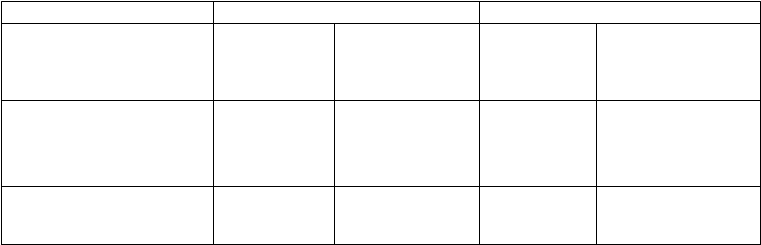
* < 0,05, ***P < 0,001, adalimumab verzus placebo
a U všetkých randomizovaných pacientov
b U pacientov s východiskovou hodnotou bolesti kože súvisiacej s HS ≥ 3, založené na číselnej hodnotiacej stupnici 0 – 10; 0 = žiadna bolesť kože, 10 = najhoršia bolesť kože, akú si dokážete predstaviť.
Liečba adalimumabom 40 mg každý týždeň výrazne znížila riziko zhoršenia abscesov a vytekajúcich fistúl. V prvých 12 týždňoch štúdií HS-I a HS-II približne dvakrát vyšší podiel pacientov v skupine
s placebom v porovnaní s tými, ktorí boli v skupine liečenej adalimumabom, zaznamenal zhoršenie abscesov (23,0 % verzus 11,4 %) a vytekajúcich fistúl (30,0 % verzus 13,9 %).
Výraznejšie zlepšenie v 12. týždni oproti východiskovému stavu v porovnaní s placebom bolo preukázané v kvalite života súvisiacej so zdravím kože, ktorá bola meraná Dermatologickým indexom kvality života (Dermatology Life Quality Index - DLQI; štúdie HS-I a HS-II), v celkovej spokojnosti pacienta s medikamentóznou liečbou, ktorá bola meraná Dotazníkom na zisťovanie spokojnosti
s liečbou – medikamentózna liečba (Treatment Satisfaction Questionnaire-medication, TSQM; štúdie HS-I a HS-II), a vo fyzickom zdraví, ktoré bolo merané pomocou skóre súhrnnej hodnoty fyzických komponentov SF-36 (štúdia HS-I).
Spomedzi pacientov, u ktorých bola v 12. týždni zaznamenaná aspoň čiastočná odpoveď na adalimumab 40 mg jedenkrát za týždeň, bola hodnota HiSCR v 36. týždni vyššia u pacientov, ktorí pokračovali v liečbe adalimumabom jedenkrát za týždeň, ako u pacientov, u ktorých bola frekvencia dávkovania zredukovaná na každý druhý týždeň alebo u ktorých bola liečba vysadená (pozri tabuľku
17).
T
abuľka 17 Podiel pacientov
a
, ktorí dosiahli HiSCR
b
v 24. a 36. týždni po zmene liečby
a
d
a
li
m
u
ma
bo
m jedenkrát za týždeň v 12. týždni
P
l
acebo (liečba vysadená) N = 73
A
dalimumab
 40 mg každý druhý týždeň
A
dalimumab
40 mg jedenkrát za týždeň N = 70
40 mg každý druhý týždeň
A
dalimumab
40 mg jedenkrát za týždeň N = 70
24. týždeň 24 (32,9 %) 36 (51,4 %) 40 (57,1 %)
36. týždeň 22 (30,1 %) 28 (40,0 %) 39 (55,7 %)
a Pacienti, u ktorých bola po 12 týždňoch liečby zaznamenaná aspoň čiastočná odpoveď na adalimumab
40 mg jedenkrát za týždeň.
b Pacienti spĺňajúci kritériá protokolu týkajúce sa straty odpovede alebo žiadneho zlepšenia boli požiadaní, aby ukončili účasť na štúdiách a boli počítaní medzi pacientov bez odpovede.
U pacientov, u ktorých bola zaznamenaná aspoň čiastočná odpoveď v 12. týždni a ktorí dostávali aj naďalej týždennú liečbu adalimumabom, bola hodnota HiSCR v 48. týždni 64,3 %.
U pacientov, ktorým bola liečba adalimumabom vysadená v 12. týždni v štúdiách HS-I a HS-II, sa hodnota HiSCR 12 týždňov po opätovnom zavedení adalimumabu 40 mg jedenkrát za týždeň vrátila na úrovne podobné tým, ktoré boli pozorované pred vysadením (56,0 %).
Crohnova choroba
Bezpečnosť a účinnosť adalimumabu sa hodnotila u viac ako 1 500 pacientov s miernou až ťažkou aktívnou Crohnovou chorobou (index aktivity Crohnovej choroby (Crohn’s Disease Activity Index, CDAI) ≥ 220 a ≤ 450) v randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách. Boli povolené súbežné stabilné dávky aminosalicylátov, kortikosteroidov a/alebo imunomodulačných liekov a 80 % pacientov pokračovalo v užívaní najmenej jedného z týchto liekov.
Indukcia klinickej remisie (definovaná ako CDAI < 150) sa hodnotila v dvoch štúdiách, CD štúdii I (CLASSIC I) a v CD štúdii II (GAIN). V CD štúdii I boli 299 pacienti bez predchádzajúcej liečby antagonistami TNF randomizovaní do jednej zo štyroch liečebných skupín; placebo v týždňoch 0 a 2,
160 mg adalimumabu v týždni 0 a 80 mg v týždni 2, 80 mg v týždni 0 a 40 mg v týždni 2, 40 mg v týždni 0 a 20 mg v týždni 2. V CD štúdii II bolo 325 pacientov, ktorí stratili schopnosť odpovedať
alebo mali neznášanlivosť infliximabu, randomizovaných tak, že dostávali buď 160 mg adalimumabu v týždni 0 a 80 mg v týždni 2, alebo placebo v týždňoch 0 a 2. Primárne na liečbu neodpovedajúci
pacienti boli zo štúdií vylúčení, a preto neboli ďalej hodnotení.
Pretrvávanie klinickej remisie sa hodnotilo v CD štúdii III (CHARM).V otvorenej fáze CD štúdie III dostalo 854 pacientov 80 mg v týždni 0 a 40 mg v týždni 2. V týždni 4 boli pacienti v štúdii s celkovým trvaním 56 týždňov randomizovaní do skupín so 40 mg každý druhý týždeň, 40 mg každý týždeň alebo placebo. Pacienti s klinickou odpoveďou na liečbu v týždni 4 (pokles v CDAI ≥ 70) boli stratifikovaní a analyzovaní oddelene od tých, ktorí boli do týždňa 4 bez klinickej odpovede. Znižovanie kortikosteroidov bolo povolené po týždni 8.
Indukcia remisie a percentuálny podiel odpovedí v CD štúdii I a CD štúdii II sú uvedené v tabuľke 18.
T
abuľka 18 Indukcia klinickej remisie a odpovede (percento pacientov)
C
D štúdia I: Pacienti doteraz neliečení
C
D štúdia II: Pacienti
i
n
f
l
i
x
i
m
abom
s predchádzajúcou liečbou
i
n
f
li
x
i
m
abom
Týždeň 4
Placebo
N = 74
Adalimumab
80/40 mg
N = 75
Adalimumab
160/80 mg
N = 76
Placebo
N = 166
Adalimumab
160/80 mg
N = 159
Klinická remisia 12 % 24 % 36 %* 7 % 21 %*
Klinická
odpoveď
(CR-100)
24 % 37 % 49 %** 25 % 38 %**
Všetky hodnoty p sú párové porovnania adalimumab verzus placebo
* p < 0,001
** p < 0,01
V oboch úvodných dávkovacích režimoch, 160/80 mg a 80/40 mg, sa do týždňa 8 pozorovali podobné
počty remisií a nežiaduce účinky boli častejšie pozorované v skupine so 160/80 mg.
V CD štúdii III malo 58 % (499/854) pacientov v týždni 4 klinickú odpoveď a boli hodnotení v primárnej analýze. Z tých s klinickou odpoveďou na liečbu v týždni 4 bolo 48 % predtým vystavených liečbe iným antagonistom TNF. Doba trvania remisie a počty pacientov s odpoveďou na liečbu sú uvedené v tabuľke 19. Výsledky klinickej remisie zostali pomerne nemenné bez ohľadu na predchádzajúcu expozíciu antagonistovi TNF.
Počet hospitalizácií a chirurgických zákrokov súvisiacich s ochorením bol v 56. týždni štatisticky signifikantne znížený pri používaní adalimumabu v porovnaní s placebom.
Tabuľka 19 Pretrvávanie klinickej remisie a odpovede (percento pacientov)
 P
l
a
cebo Adalimumab
40 mg každý druhý týždeň
A
dalimumab
40 mg každý týždeň
P
l
a
cebo Adalimumab
40 mg každý druhý týždeň
A
dalimumab
40 mg každý týždeň
T
ýždeň 26 N = 170 N = 172 N = 157
Klinická remisia 17 % 40 %* 47 %* Klinická odpoveď (CR-100) 27 % 52 %* 52 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
3 % (2/66) 19 % (11/58) ** 15 % (11/74) **
T
ýždeň 56 N = 170 N = 172 N = 157
Klinická remisia 12 % 36 %* 41 %* Klinická odpoveď (CR-100) 17 % 41 %* 48 %*
Pacienti v remisii bez steroidov
počas > = 90 dnía
5 % (3/66) 29 % (17/58) * 20 % (15/74) **
* p < 0,001 pre adalimumab verzus placebo, porovnania párových hodnôt
** p < 0,02 pre adalimumab verzus placebo, porovnania párových hodnôt
a Z tých, ktorí užívali kortikosteroidy na začiatku liečby
Z pacientov, ktorí boli v týždni 4 bez odpovede, do týždňa 12 odpovedalo 43 % pacientov liečených adalimumabom v porovnaní s 30 % pacientov, ktorým sa podávalo placebo. Tieto výsledky naznačujú, že niektorí pacienti, ktorí neodpovedajú na liečbu do týždňa 4, majú prínos z pokračujúcej udržiavacej
liečby do týždňa 12. Liečba, pokračujúca po 12. týždni, neviedla k signifikantne vyššiemu počtu odpovedí (pozri časť 4.2).
117 z 276 pacientov zo štúdie CD I a 272 zo 777 pacientov zo štúdií CD II a III bolo sledovaných počas otvorenej liečby adalimumabom minimálne 3 roky. 88 pacientov z CD I a 189 pacientov z CD II a III pokračovalo v liečbe až do klinickej remisie. Klinická odpoveď (CR-100) sa udržala u 102 pacientov z CD I a 233 pacientov z CD II a III.
Kvalita života
V CD štúdii I a CD štúdii II sa v týždni 4 dosiahlo štatisticky signifikantné zlepšenie celkového skóre
v dotazníku pre zápalového ochorenia čreva (Inflammatory Bowel Disease Questionnaire, IBDQ)
u pacientov randomizovaných do skupín adalimumab 80/40 mg a adalimumab 160/80 mg v porovnaní s placebom a v týždňoch 26 a 56 sa pozorovalo v CD štúdii III vo všetkých skupinách liečených
adalimumabom v porovnaní so skupinou s placebom.
Crohnova choroba u detí
Adalimumab sa hodnotil v multicentrickom, randomizovanom, dvojito zaslepenom klinickom skúšaní zameranom na hodnotenie účinnosti a bezpečnosti úvodnej a udržiavacej liečby dávkami závislými od telesnej hmotnosti (< 40 kg alebo ≥ 40 kg) u 192 pediatrických jedincov vo veku od 6 do 17 rokov (vrátane) s mierne ťažkou až ťažkou Crohnovou chorobou (CD), definovanou indexom aktivity Crohnovej choroby u detí (PCDAI) so skóre > 30. U týchto jedincov musela zlyhať konvenčná liečba CD (vrátane kortikosteroidov a/alebo imunomodulátorov). Jedinci mohli tiež predtým stratiť odpoveď na infliximab alebo ho netolerovať.
Všetci jedinci dostávali v otvorenej fáze úvodnú liečbu dávkou založenou na ich východiskovej telesnej hmotnosti: 160 mg v týždni 0 a 80 mg v týždni 2 jedinci ≥ 40 kg, prípadne 80 mg a 40 mg, jedinci < 40 kg.
V týždni 4 boli jedinci randomizovaní 1 : 1 na základe ich telesnej hmotnosti v tom čase buď na
dávkovací režim s nízkou dávkou, alebo štandardnou udržiavacou dávkou, ako je uvedené v tabuľke
20.
Tabuľka 20 Udržiavací režim
Hm
o
t
nosť
pacienta
N
í
z
ka dávka Štandardná
dávka
< 40 kg 10 mg každý druhý týždeň
≥ 40 kg 20 mg každý druhý týždeň
20 mg každý druhý týždeň
40 mg každý druhý týždeň
 Výsledky úč innosti
Výsledky úč innosti
Primárny koncový ukazovateľ v štúdii bola klinická remisia v týždni 26, definovaná ako skóre PCDAI
≤ 10.
Klinická remisia a klinická odpoveď na liečbu (definovaná ako zníženie skóre PCDAI najmenej o 15 bodov v porovnaní s východiskovou hodnotou) sú uvedené v tabuľke 21. Percentá vysadenia kortikosteroidov alebo imunomodulátorov sú uvedené v tabuľke 22.
T
abuľka 21 Pediatrická CD štúdia Klinická remisia PCDAI a odpoveď
Štandardná dávka
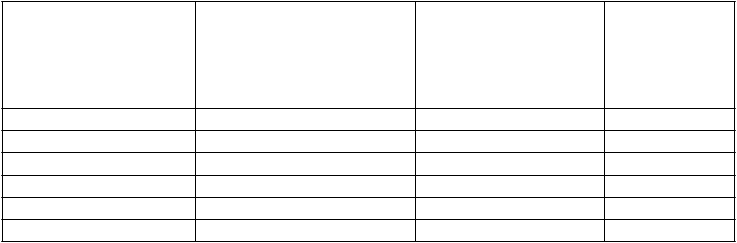 40/20 mg každý
druhý týždeň N = 93
N
í
z
ka dávka 20/10 mg každý druhý týždeň N = 95
H
odnota p
40/20 mg každý
druhý týždeň N = 93
N
í
z
ka dávka 20/10 mg každý druhý týždeň N = 95
H
odnota p*
T
ýždeň 26
Klinická remisia 38,7 % 28,4 % 0,075
Klinická odpoveď 59,1 % 48,4 % 0,073
Týždeň 52
Klinická remisia 33,3 % 23,2 % 0,100
Klinická odpoveď 41,9 % 28,4 % 0,038
* porovnanie hodnoty p štandardná dávka verzus nízka dávka
Tabuľka 22 Pediatrická CD štúdi Vysadenie kortikosteroidov alebo imunomodulátorov a remisia fistúl
Štandardná dávka
 40/20 mg každý druhý týždeň
N
í
z
ka dávka 20/10 mg
každý druhý týždeň
H
odnota p
1
40/20 mg každý druhý týždeň
N
í
z
ka dávka 20/10 mg
každý druhý týždeň
H
odnota p
1
 V
ysadenie kortikosteroidov N = 33 N = 38
V
ysadenie kortikosteroidov N = 33 N = 38
Týždeň 26 84,8 % 65,8 % 0,066
Týždeň 52 69,7 % 60,5 % 0,420
Vysadenie imunomodulátorov2 N = 60 N = 57Týždeň 52 30,0 % 29,8 % 0,983
Remisia fistúl3 N = 15 N = 21Týždeň 26 46,7 % 38,1 % 0,608
Týždeň 52 40,0 % 23,8 % 0,303
1 porovnanie hodnoty p štandardná dávka verzus nízka dávka
2 imunosupresívna liečba mohla byť zastavená len v týždni 26 alebo neskôr na základe uváženia skúšajúceho lekára o tom, či jedinec spĺňa kritéria klinickej odpovede
3 definované ako uzavretie všetkých fistúl, ktoré secernovali na začiatku liečby, prinajmenšom pri 2 po sebe nasledujúcich návštevách po východiskovej návšteve
Štatisticky významné zvýšenia (zlepšenie) indexu telesnej hmotnosti a rýchlosti rastu
z východiskového stavu do týždňa 26 a 52 boli pozorované u oboch liečebných skupín.
Štatisticky a klinicky významné zlepšenia v porovnaní s východiskovým stavom boli pozorované v oboch liečebných skupín aj pre parametre kvality života (vrátane IMPACT III).
Sto pediatrických pacientov (n = 100) zo štúdie s Crohnovou chorobou pokračovalo v otvorenej dlhodobej predĺženej štúdii. Po 5 rokoch liečby adalimumabom pretrvala klinická remisia u 74,0 % (37/50) z 50 pacientov, ktorí zotrvali v štúdii, a u 92,0 % (46/50) pacientov pretrvala klinická odpoveď podľa PCDAI.
Ulcerózna kolitídaBezpečnosť a účinnosť viacnásobného podania adalimumabu sa hodnotili u dospelých pacientov so stredne ťažkou až ťažkou aktívnou ulceróznou kolitídou (Mayo skóre 6 až 12 vrátane endoskopického podskóre 2 až 3) v randomizovaných dvojito zaslepených placebom kontrolovaných štúdiách.
V štúdii UC-I bolo zaradených 390 pacientov v minulosti neliečených antagonistami TNF, ktorí boli randomizovaní do skupín, v ktorých im bolo podávané buď placebo v týždni 0 a 2 a 160 mg adalimumabu v týždni 0 a následne 80 mg v týždni 2, alebo 80 mg adalimumabu v týždni 0 a následne
40 mg v týždni 2. Po týždni 2 dostávali pacienti v oboch ramenách s adalimumabom dávku 40 mg každý druhý týždeň. Klinická remisia (definovaná ako Mayo skóre ≤ 2 bez podskóre > 1) sa hodnotila v týždni 8.
V štúdii UC-II dostávalo 248 pacientov dávku 160 mg adalimumabu v týždni 0, 80 mg v týždni 2
a následne 40 mg každý druhý týždeň a 246 pacientov dostávalo placebo. U klinických výsledkov sa hodnotila indukcia remisie v týždni 8 a udržanie remisie v týždni 52.
Pacienti, u ktorých sa liečba začala dávkou 160/80 mg adalimumabu, dosiahli klinickú remisiu v týždni
8 v signifikantne vyššom percente v porovnaní s placebom v štúdii UC-I (18 % verzus 9 %, p = 0,031)
a v štúdii UC-II (17 % verzus 9 %, p = 0,019). U 21 zo 41 subjektov (51 %), ktorým sa v štúdii UC-II
podával adalimumab a ktorí dosiahli remisiu v týždni 8, bola dosiahnutá remisia aj v týždni 52.
Výsledky z celej populácie štúdie UC-II sú zobrazené v tabuľke 23.
 Tabuľka 23 Odpoveď, remisia a hojenie sliznice v štúdii UC-II (percento pacientov) Placebo Adalimumab 40 mgkaždý druhý týždeňTýždeň 52 N = 246 N = 248
Tabuľka 23 Odpoveď, remisia a hojenie sliznice v štúdii UC-II (percento pacientov) Placebo Adalimumab 40 mgkaždý druhý týždeňTýždeň 52 N = 246 N = 248Klinická odpoveď 18 % 30 %* Klinická remisia 9 % 17 %*
Hojenie sliznice 15 % 25 %*
Remisia bez steroidov
po ≥ 90 dnía
Týždeň 8 a 52
6 %
(N = 140)
13 %*
(N = 150)
Udržanie odpovede 12 % 24 %** Udržanie remisie 4 % 8 %*
Udržanie hojenia sliznice 11 % 19 %*
Klinická remisia je definovaná ako Mayo skóre ≤ 2 bez podskóre > 1;
Klinická odpoveď je definovaná ako zníženie Mayo skóre o ≥ 3 body a ≥ 30 % v porovnaní
s východiskovým stavom plus pokles podskóre rektálneho krvácania [rectal bleeding subscore, RBS] o ≥ 1
alebo absolútny RBS 0 alebo 1;
* p < 0,05 párové porovnanie hodnôt pri adalimumabe v porovnaní s placebom
** p < 0,001 párové porovnanie hodnôt pri adalimumabe v porovnaní s placebom
a Z tých, ktorí pôvodne dostávali kortikosteroidy
Z tých pacientov, ktorí mali odpoveď v týždni 8, malo v 52. týždni 47 % odozvu, 29 % bolo v remisii, u 41 % sa hojila sliznica a 20 % bolo v remisii bez steroidov počas ≥ 90 dní.
Približne u 40 % pacientov v štúdii UC-II zlyhala predtým liečba antagonistom TNF infliximabom. Účinnosť adalimumabu u týchto pacientov bola znížená v porovnaní s pacientmi, ktorí neboli liečení antagonistom TNF. Medzi pacientmi, u ktorých zlyhala predchádzajúca liečba antagonistom TNF, dosiahli v týždni 52 remisiu 3 % pacientov na placebe a 10 % pacientov na adalimumabe.
Pacienti zo štúdie UC-I a UC-II mali možnosť prejsť do otvorenej dlohodobej rozšírenej štúdie (UC- III). Po 3 rokoch liečby adalimumabom 75 % pacientov (301/402) zotrvalo v klinickej remisii podľa parciálneho Mayo skóre.
Frekvencia hospitalizácií
Počas 52-týždňového sledovania v štúdiách UC-I a UC-II sa v ramene s adalimumabom pozorovala
nižšia frekvencia hospitalizácií z akejkoľvek príčiny a hospitalizácií súvisiacich s UC v porovnaní
s ramenom s placebom. Počet hospitalizácií z akejkoľvej príčiny v skupine liečenej adalimumabom bol
0,18 pacientoroka v porovnaní s 0,26 pacientoroka v skupine s placebom a zodpovedajúce údaje pre hospitalizácie súvisiace s UC boli 0,12 pacientoroka v porovnaní s 0,22 pacientoroka.
K
valita života
V štúdii UC-II viedla liečba adalimumabom k zlepšeniu skóre v dotazníku pre zápalového ochorenia
čreva (IBDQ).
Uveitída
Bezpečnosť a účinnosť adalimumabu sa hodnotili u dospelých pacientov s neinfekčnou intermediárnou a posteriórnou uveitídou a panuveitídou v dvoch randomizovaných, dvojito maskovaných, placebom kontrolovaných štúdiách (UV I a II), pričom pacienti s izolovanou anteriórnou uveitídou boli vylúčení. Pacienti dostávali placebo alebo adalimumab v úvodnej dávke 80 mg, potom nasledovala dávka 40 mg každý druhý týždeň po uplynutí jedného týždňa od úvodnej dávky. Povolené bolo súčasné podávanie stabilných dávok jedného nebiologického imunosupresíva.
V štúdii UV I sa hodnotilo 217 pacientov s aktívnou uveitídou napriek liečbe kortikosteroidmi (perorálny prednizón v dávke 10 až 60 mg/deň). Na začiatku štúdie dostávali všetci pacienti 2- týždňovú štandardizovanú dávku prednizónu 60 mg/deň, potom nasledoval harmonogram povinného znižovania dávky s úplným vysadením kortikosteroidov do 15. týždňa.
V štúdii UV II sa hodnotilo 226 pacientov s neaktívnou uveitídou vyžadujúcich chronickú liečbu kortikosteroidmi (perorálny prednizón v dávke 10 až 35 mg/deň) na začiatku liečby na kontrolu ich ochorenia. Pacienti následne absolvovali povinný harmonogram znižovania dávky s úplným vysadením kortikosteroidov do 19. týždňa.
Primárnym koncovým ukazovateľom v oboch štúdiách bol „čas do zlyhania liečby“. Zlyhanie liečby bolo definované ako viaczložkový výsledok založený na zápalových chorioretinálnych a/alebo zápalových retinálnych vaskulárnych léziách, hodnotení buniek prednej komory (AC), hodnotení zákalu sklovca (VH) a najlepšej korigovanej ostrosti videnia (BCVA).
Klinická odpoveď
Výsledky oboch štúdií preukázali štatisticky významné zníženie rizika zlyhania liečby u pacientov
liečených adalimumabom oproti pacientom, ktorí dostávali placebo (pozri tabuľku 24). V oboch štúdiách sa preukázal skorý a pretrvávajúci účinok adalimumabu na mieru zlyhania liečby v porovnaní s placebom (pozri obrázok 1).
Tabuľka 24 Čas do zlyhania liečby v štúdiách UV I a UV II
A
nalýzy
L
i
ečba
N Zlyhanie
N (%)
Medián času
do zlyhania (mesiace)
H
R
a
IS 95%
pre HR
a
H
odnota
P
b
 Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Č
as do zlyhania liečby v 6. týždni alebo neskôr v štúdii UV I
Primárna analýza
(ITT)
Placebo 107 84 (78,5) 3.0
-- -- --Adalimumab 110 60 (54,5) 5,6 0,50 0,36, 0,70 < 0,001
Čas do zlyhania liečby v 2. týždni alebo neskôr v štúdii UV IIPrimárna analýza
(ITT)
Placebo 111 61 (55,0) 8,3
-- -- --Adalimumab 115 45 (39,1) NOc 0,57 0,39; 0,84 0,004
Poznámka: Ako udalosť sa započítavalo zlyhanie liečby v 6. týždni alebo neskôr (štúdia UV I), alebo v 2. týždni
alebo neskôr (štúdia UV II). Prípady ukončenia liečby z iných dôvodov ako zlyhanie liečby sa vyradili v čase ukončenia.
a HR adalimumabu oproti placebu z regresného modelu relatívneho rizika s liečbou ako faktorom.
b 2-stranná hodnota
P z logaritmického testu poradí.
c NO = nemožno odhadnúť. Udalosť sa vyskytla u menej než polovice rizikových účastníkov.
Obrázok 1: Kaplanove-Meierove krivky znázorňujúce čas do zlyhania liečby v 6. týždni alebo neskôr (štúdia UV I), alebo v 2. týždni alebo neskôr (štúdia UV II)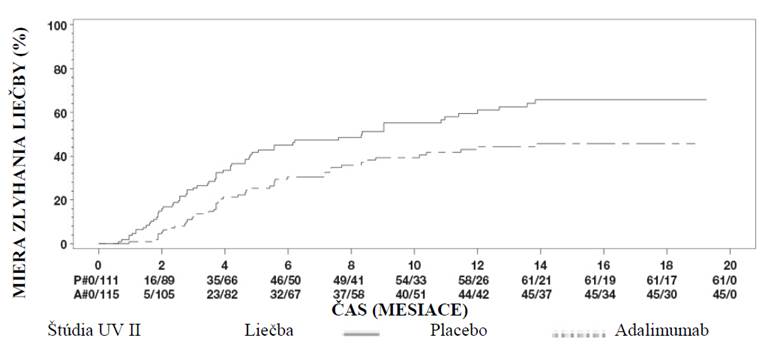
Poznámka: P# = placebo (počet udalostí/počet rizikových účastníkov); A# = Adalimumab (počet udalostí/počet
rizikových účastníkov).
V štúdii UV I sa pozorovali štatisticky významné rozdiely v prospech adalimumabu v porovnaní s placebom pre každú zložku zlyhania liečby. V štúdii UV II sa pozorovali štatisticky významné rozdiely len v prípade ostrosti videnia, ale aj ostatné zložky boli číselne v prospech adalimumabu.
Kvalita životaV oboch klinických štúdiách sa merali výsledky súvisiace s funkciou videnia hlásené pacientmi s
použitím dotazníka NEI VFQ-25. Výsledky adalimumabu boli číselne priaznivejšie pre väčšinu vedľajších skóre so štatisticky významnými priemernými rozdielmi pre celkové videnie, bolesť oka, videnie na blízko, duševné zdravie a celkové skóre v štúdii UV I a pre celkové videnie a duševné zdravie v štúdii UV II. Účinky súvisiace s videním neboli číselne priaznivejšie pre adalimumab v prípade farebného videnia v štúdii UV I a farebného videnia, periférneho videnia a videnia na blízko v štúdii UV II.
Im
unogenicita
Počas liečby adalimumabom môžu vzniknúť protilátky proti adalimumabu. Tvorba protilátok proti
adalimumabu je spojená so zvýšeným klírensom a zníženou účinnosťou adalimumabu. Nie je zrejmý vzťah medzi prítomnosťou protilátok proti adalimumabu a výskytom nežiaducich účinkov.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s adalimumabom
vo všetkých podskupinách pediatrickej populácie v liečbe reumatoidnej artritídy, psoriatickej artritídy a ankylozujúcej spondylitídy (informácie o pediatrickom použití, pozri časť 4.2).
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s adalimumabom v jednej alebo vo viacerých podskupinách pediatrickej populácie v liečbe ulceróznej kolitídy, hidradenitis suppurativa a neinfekčnej uveitídy (informácie o pediatrickom použití, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia a distribúcia
Po subkutánnom podaní jednorazovej dávky 40 mg bola absorpcia a distribúcia adalimumabu pomalá.
Maximálne sérové koncentrácie sa dosiahli asi 5 dní po podaní. Priemerná absolútna biologická dostupnosť adalimumabu, na základe troch štúdií, bola 64 % po podaní jednorazovej subkutánnej
dávky 40 mg. Po jednorazových intravenóznych dávkach v rozpätí od 0,25 do 10 mg/kg boli
koncentrácie lieku úmerné dávke. Po dávkach 0,5 mg/kg (~ 40 mg) bol klírens v rozsahu od 11 do
15 ml/hodinu, distribučný objem (Vss) v rozsahu od 5 do 6 litrov a priemerný polčas terminálnej fázy bol približne dva týždne. Koncentrácie adalimumabu v synoviálnej tekutine, stanovené u niekoľkých
pacientov s ťažkou reumatoidnou artritídou, boli v rozsahu od 31 do 96 % sérových koncentrácií.
Po subkutánnom podávaní 40 mg adalimumabu každý druhý týždeň u dospelých pacientov s reumatoidnou artritídou (RA) boli najnižšie priemerné sérové koncentrácie v rovnovážnom stave približne 5 µg/ml (bez súbežnej liečby metotrexátom) a 8 až 9 µg/ml (pri súbežnej liečbe metotrexátom). Najnižšie sérové koncentrácie adalimumabu v rovnovážnom stave sa zvyšovali približne úmerne s dávkou pri subkutánnom podávaní 20, 40 a 80 mg každý druhý týždeň aj každý týždeň.
Po podávaní dávky 24 mg/m2 (až do maxima 40 mg) subkutánne každý druhý týždeň pacientom s polyartikulárnou juvenilnou idiopatickou artritídou (JIA), ktorí mali 4 až 17 rokov, bola najnižšia priemerná sérová koncentrácia adalimumabu v rovnovážnom stave (hodnoty merané v týždňoch 20 až
48) 5,6 ±5,6 μg/ml (102 % CV) pri adalimumabe bez súbežného metotrexátu a 10,9 ±5,2 μg/ml
(47,7 % CV) so súbežným metotrexátom.
U pacientov s polyartikulárnou JIA, ktorí boli vo veku 2 až < 4 roky alebo 4 roky a viac a mali hmotnosť < 15 kg, ktorým bol podávané dávky adalimumabu 24 mg/m2, boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 6,0 ±6,1 µg/ml (101 % CV) pri adalimumabe bez súbežného metotrexátu a 7,9 ±5,6 µg/ml (71,2 % CV) so súbežným metotrexátom.
Po podávaní dávky 24 mg/m2 (až do maxima 40 mg) subkutánne každý druhý týždeň pacientom s artritídou spojenou s entezitídou, ktorí mali 6 až 17 rokov, boli najnižšie priemerné sérové koncentrácie adalimumabu v rovnovážnom stave 8,8 ± 6,6 μg/ml pri adalimumabe bez súbežného metotrexátu a
11,8 ± 4,3 μg/ml so súbežným metotrexátom (hodnoty merané v 24. týždni).
U dospelých pacientov so psoriázou bola priemerná najnižšia rovnovážna koncentrácia 5 µg/ml počas
liečby adalimumabom v monoterapii v dávke 40 mg každý druhý týždeň.
Po podávaní dávky 0,8 mg/kg (až do maxima 40 mg) subkutánne každý druhý týždeň pediatrickým pacientom s chronickou ložiskovou psoriázou bola priemerná najnižšia (±SD) sérová koncentrácia adalimumabu v rovnovážnom stave približne 7,4 ±5,8 µg/ml (79 % CV).
U pacientov s hidradenitis suppurativa sa pri dávke 160 mg adalimumabu v týždni 0 nasledovanej dávkou 80 mg v 2. týždni dosiahla počas indukčného obdobia najnižšia hodnota sérových koncentrácií adalimumabu približne od 7 do 8 μg/ml v 2. a 4. týždni. U pacientov, ktorí dostávali udržiavaciu dávku
40 mg adalimumabu každý týždeň, sa pozorovali od 12. do 36. týždňa priemerné minimálne rovnovážne hladiny približne od 8 do 10 μg/ml.
U pacientov s Crohnovou chorobou úvodná dávka 80 mg adalimumabu v týždni 0 nasledovaná dávkou
40 mg adalimumabu v týždni 2 dosahuje počas indukčného obdobia najnižšiu hodnotu sérových koncentrácií adalimumabu približne 5,5 µg/ml. Úvodná dávka 160 mg adalimumabu v týždni 0
nasledovaná 80 mg adalimumabu v týždni 2 dosahuje počas indukčného obdobia najnižšiu hodnotu sérových koncentrácií adalimumabu približne 12 µg/ml. U tých pacientov s Crohnovou chorobou, ktorí
dostávali udržiavaciu dávku 40 mg adalimumabu každý druhý týždeň, sa pozorovali priemerné rovnovážne najnižšie hladiny približne 7 µg/ml.
V otvorenej liečbe detských pacientov so stredne ťažkou až ťažkou CD bola úvodná dávka adalimumabu 160/80 alebo 80/40 mg v týždni 0 a 2, a to v závislosti od hranice telesnej hmotnosti
40 kg. V týždni 4 boli pacienti randomizovaní 1 : 1 do skupín s udržiavacou liečbou buď so štandardnou dávkou (40/20 mg eow), alebo nízkou dávkou (20/10 mg eow) v závislosti od telesnej
hmotnosti. Priemerné najnižšie (±SD) sérové koncentrácie adalimumabu dosiahnuté v týždni 4 boli
15,7 ±6,6 µg/ml u pacientov ≥ 40 kg (160/80 mg) a 10,6 ±6,1 µg/ml u pacientov < 40 kg (80/40 mg).
U pacientov, ktorí ostali na randomizovanej liečbe, boli v týždni 52 priemerné najnižšie (±SD) koncentrácie adalimumabu 9,5 ±5,6 µg/ml pre skupinu so štandardnou dávkou a 3,5 ±2,2 µg/ml pre skupinu s nízkou dávkou. Priemerné najnižšie koncentrácie sa udržali u pacientov, ktorí pokračovali v liečbe adalimumabom každý druhý týždeň počas 52 týždňov. U pacientov, u ktorých sa dávka zvýšila z režimu každý druhý týždeň na raz týždenne, boli v týždni 52 priemerné (±SD) sérové koncentrácie adalimumabu 15,3 ±11,4 μg/ml (40/20 mg, raz týždenne) a 6,7 ±3,5 μg/ml (20/10 mg, raz týždenne).
U pacientov s ulceróznou kolitídou, ktorým sa podávala úvodná dávka 160 mg adalimumabu v týždni
0, po ktorej nasledovala dávka 80 mg adalimumabu v týždni 2, sa dosiahli najnižšie sérové koncentrácie adalimumabu 12 μg/ml počas obdobia indukcie. Priemerne najnižšie hladiny
v rovnovážnom stave s hodnotou približne 8 μg/ml sa pozorovali u pacientov s ulceróznou kolitídou,
ktorým sa podávala udržiavacia dávka 40 mg adalimumabu každý druhý týždeň.
U pacientov s uveitídou, ktorým sa podávala úvodná dávka 80 mg adalimumabu v týždni 0, po ktorej nasledovala dávka 40 mg adalimumabu každý druhý týždeň od 1. týždňa, sa zistili priemerné koncentrácie v rovnovážnom stave približne 8 až 10 µg/ml.
Eliminácia
Populačná farmakokinetická analýza údajov od viac ako 1 300 pacientov s RA odhalila tendenciu
k vyššiemu zdanlivému klírensu adalimumabu so zvyšujúcou sa telesnou hmotnosťou. Po úprave vzhľadom na hmotnostné rozdiely, pohlavie a vek sa preukázal minimálny vplyv na klírens
adalimumabu. Sérové hladiny voľného adalimumabu (neviazaného na protilátky proti adalimumabu,
AAA) boli nižšie u pacientov s merateľným AAA.
Porucha funkcie pečene alebo obličiek
Adalimumab sa neskúmal u pacientov s poruchou funkcie pečene alebo obličiek.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe štúdií toxicity po jednorazovej dávke, toxicity po opakovanom podávaní a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
V štúdii embryofetálnej toxicity/perinatálneho vývoja, uskutočnenej u opíc rodu Cynomolgus, ktorým sa podávali dávky 0, 30 a 100 mg/kg (9-17 opíc/skupina), sa nezistil žiadny dôkaz poškodenia plodov, spôsobený adalimumabom. Ani štúdie karcinogenity ani štandardné hodnotenie fertility a postnatálnej toxicity adalimumabu sa neuskutočnili pre nedostatok vhodných modelov pre protilátku s obmedzenou skríženou reaktivitou na TNF hlodavcov a na rozvoj neutralizačných protilátok u hlodavcov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
ľadová kyselina octová sacharóza
polysorbát 80
hydroxid sodný (na úpravu pH)
voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote 2 °C – 8 °C. Neuchovávajte v mrazničke.
AMGEVITU uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Naplnená injekčná striekačka alebo naplnené injekčné pero sa môžu skladovať pri teplote do
maximálne 25 °C po dobu až 14 dní. Naplnená injekčná striekačka alebo naplnené injekčné pero musia byť chránené pred svetlom a zlikvidované, ak sa nepoužijú v priebehu tohto 14-dňového obdobia.
6.5 Druh obalu a obsah balenia
AMGEVITA 20 mg injekčnýroztok naplnený v injekčnej striekačke
0,4 ml roztoku naplneného v injekčnej striekačke (sklo typu I) s piestovou zátkou (brómbutylová guma)
a ihlou z nehrdzavejúcej ocele s krytom ihly (termoplastický elastomér). Kryt ihly naplnenej injekčnej striekačky je zhotovený zo suchého prírodného kaučuku (derivát latexu) (pozri časť 4.4).
Balenie obsahuje jednu naplnenú injekčnú striekačku.
AMGEVITA 40 mginjekčnýroztok naplnený v injekčnej striekačke
0,8 ml injekčného roztoku naplneného v injekčnej striekačke (sklo typu I) s piestovou zátkou
(brómbutylová guma) a ihlou z nehrdzavejúcej ocele s krytom ihly (termoplastický elastomér). Kryt
ihly naplnenej injekčnej striekačky je zhotovený zo suchého prírodného kaučuku (derivát latexu)
(pozri časť 4.4).
Balenia po jednom, dvoch, štyroch a šiestich naplnených injekčných striekačkách.
Na trh nemusia byť uvedené všetky veľkosti balenia.
A
MGEVITA 40 mg
i
n
j
ekčný
r
oztok
naplnený v injekčnom
pere
0,8 ml injekčného roztoku naplneného v injekčnom pere na použitie pacientom, ktoré obsahuje
naplnenú injekčnú striekačku (sklo typu I). Pero je jednorazová, ručná, mechanická injekčná pomôcka. Kryt ihly naplneného injekčného pera je zhotovený zo suchého prírodného kaučuku (derivát latexu) (pozri časť 4.4).
Balenia po jednom, dvoch, štyroch a šiestich naplnených injekčných perách.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPodrobné informácie o použití sú uvedené v písomnej informácii pre používateľa.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAmgen Europe B.V. Minervum 7061
NL-4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLAAMGEVITA 20 mg injekčnýroztok naplnený v injekčnej striekačkeEU/1/16/1164/001 – 1-balenie
AMGEVITA 40 mg injekčnýroztok naplnený v injekčnej striekačkeEU/1/16/1164/002 – 1-balenie
EU/1/16/1164/003 – 2-balenie EU/1/16/1164/004 – 4-balenie EU/1/16/1164/005 – 6-balenie

AMGEVITA 40 mg injekčný roztok naplnený v injekčnom pere
EU/1/16/1164/006 – 1-balenie
EU/1/16/1164/007 – 2-balenie EU/1/16/1164/008 – 4-balenie EU/1/16/1164/009 – 6-balenie
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu