lu v tejto skupine pacientov neboli stanovené.
Spôsob podávania Viacpočetné aktinické keratózy možno liečiť súbežne. Existujú skúsenosti s liečbou až desiatich lézií v rovnakom čase. Celková plocha kože liečená Actikerallom v danom čase, nemá presiahnuť 25 cm
2(5 cm x 5 cm).
Actikerall sa má dostať do kontaktu iba s aktinickou keratózou a s maximálne 0,5 cm okrajom zdravej kože v okolí lézie.
Actikerall sa pri aknitickej keratóze aplikuje pomocou štetca aplikátora, ktorý je spojený s uzatváracím viečkom. Aby sa predišlo aplikácii nadmerného množstva roztoku, štetec sa má pred aplikáciou otrieť o hrdlo fľaše.
Ošetrená plocha sa nemá po aplikácii zakrývať a roztok sa má nechať zaschnúť, aby sa nad plochou aplikácie vytvoril film.
Vždy pred ďalšou aplikáciou Actikerallu sa má existujúci filmový povlak najprv odstrániť tak, že sa jednoducho odlúpne. Teplá voda môže napomôcť odstráneniu filmového povlaku.
4.3 Kontraindikácie Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Actikerall sa nesmie používať počas obdobia laktácie, gravidity alebo u žien, u ktorých s istotou nemožno vylúčiť graviditu.
Actikerall sa nesmie používať na liečbu pacientov s insuficienciou obličiek.
Actikerall sa nesmie používať v kombinácii s brivudínom, sorivudínom a ich analógmi. Brivudín, sorivudín a ich analógy sú silnými inhibítormi enzýmu dihydropyrimidíndehydrogenázy (DPD), ktorý rozkladá fluóruracil (pozri aj časti 4.4 a 4.5).
Actikerall sa nesmie dostať do kontaktu s očami alebo sliznicami.
4.4 Osobitné upozornenia a opatrenia pri používaníActikerall obsahuje cytostatikum 5-fluóruracil.
Enzým dihydropyrimidíndehydrogenáza (DPD) hrá dôležitú úlohu v degradácii fluóruracilu. Inhibícia, deficit alebo znížená aktivita tohto enzýmu môže mať za následok kumuláciu fluóruracilu.
Ak je to relevantné, pred začiatkom liečby fluóruracilom alebo inými fluórpyrimidínmi je indikované stanoviť aktivitu enzýmu DPD.
Pacientov, ktorí užívajú fenytoín súbežne s fluóruracilom, treba pravidelne kontrolovať, či sa im nezvýšili plazmatické hladiny fenytoínu.
U pacientov so senzorickými poruchami (napr. u tých, ktorí majú diabetes mellitus) sa vyžaduje dôkladné sledovanie liečenej plochy.
Aktinická keratóza sa v dôsledku chronického poškodenia UV žiarením a lokálneho podráždenia v mieste aplikácie Actikerallu môže expozíciou slnku ešte zhoršiť. Pacienti majú byť poučení, aby si chránili kožu pred ďalšou nadmernou alebo kumulatívnou expozíciou, najmä pokiaľ ide o aktívne ošetrovanú oblasť.
Neexistujú žiadne skúsenosti s liečbou bazálneho bunkového karcinómu a Bowenovej choroby, preto sa tieto ochorenia nemajú liečiť týmto liekom.
Actikerall sa nemá používať na krvácajúce rany.
Neexistujú žiadne skúsenosti s liečbou aktinickej keratózy v oblastiach kože postihnutej iným kožným ochorením, a preto musí lekár vziať do úvahy, že výsledok liečby sa môže líšiť.
V súčasnosti nie sú dostupné údaje o liečbe Actikerallom iných častí tela okrem tváre, čela a lysín.
Ak sa liečia plochy kože s tenkou epidermou, roztok sa má nanášať menej často a priebeh liečby sa má častejšie sledovať.
Tento liek obsahuje dimetylsulfoxid. Môže vyvolať podráždenie pokožky.
Po použití sa má fľaška pevne uzatvoriť, pretože roztok rýchlo vyschne a už nebude možné ho správne používať.
Ak sa vytvoria kryštáliky, roztok sa nesmie používať.
Roztok Actikerallu nemá prísť do kontaktu s textilom alebo akrylátmi (napr. akrylátovými vaňami), pretože môže spôsobiť vznik trvalých škvŕn.
Pozor, horľavina: chráňte pred ohňom alebo plameňmi.
4.5 Liekové a iné interakcieEnzým dihydropyrimidíndehydrogenáza (DPD) hrá dôležitú úlohu v degradácii fluóruracilu. Analógy nukleozidov, ako brivudín a sorivudín, môžu viesť ku drastickému zvýšeniu plazmatických koncentrácií fluóruracilu alebo iných fluórpyrimidínov, čo môže súvisieť so zvýšenou toxicitou. Z tohto dôvodu sa má medzi použitím fluóruracilu a brivudínu, sorivudínu a ich analógov dodržať odstup minimálne 4 týždne.
V prípade náhodného podania nukleozidových analógov, ako brivudín a sorivudín pacientom, ktorí sa liečia fluóruracilom, sa majú zaviesť účinné opatrenia na zníženie toxicity fluóruracilu. Môže byť indikovaná hospitalizácia. Majú sa zaviesť všetky nevyhnutné opatrenia na ochranu pred systémovými infekciami a dehydratáciou.
Pri súbežnom podávaní fenytoínu a fluóruracilu sa hlásili zvýšené plazmatické hladiny fenytoínu, ktoré viedli k symptómom intoxikácie fenytoínom (pozri 4.4).
Nie sú žiadne dôkazy o významnej systémovej absorpcii kyseliny salicylovej, absorbovaná kyselina salicylová však môže interagovať s metotrexátom a derivátmi sulfonylmočoviny.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii údaje o lokálnom použití fluóruracilu u gravidných žien. U zvierat sa pri systémovo podávanom fluóruracile pozoroval teratogénny účinok. Kyselina salicylová môže mať nežiaduci vplyv na výsledok gravidity u hlodavcov.
DojčenieNie je známe, či sa fluóruracil alebo jeho metabolity po lokálnom podaní vylučujú do ľudského mlieka. Riziko pre dojčené dieťa sa nedá vylúčiť.
FertilitaŠtúdie fertility so systémovým fluóruracilom mali za následok prechodnú neplodnosť u samcov a zníženie počtu gravidít u samíc hlodavcov. Avšak vzhľadom na veľmi obmedzenú absorpciu účinných látok po dermálnom podaní Actikerallu je nepravdepodobné, že by toto zistenie bolo u ľudí relevantné.
Actikerall je kontraindikovaný počas gravidity a laktácie (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeActikerall nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNežiaduce účinky podľa triedy orgánových systémov a klesajúcej frekvencie výskytu podľa klasifikácie MedDRA sú uvedené nižšie.
Frekvencie výskytu sú definované ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥ 1/1000 až <1/100), zriedkavé (≥ 1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000) a neznáme (častosť sa nedá odhadnúť z dostupných údajov).
Celkové poruchy a reakcie v mieste podaniaVeľmi časté: v mieste aplikácie: erytém, zápal, podráždenie (vrátane pálenia), bolesť, pruritus.
Časté: v mieste aplikácie: krvácanie, erózia, chrasta.
Menej časté: v mieste aplikácie: dermatitída, edém, vred.
Poruchy kože a podkožného tkanivaČasté: exfoliácia kože.
Poruchy nervového systémuČasté: bolesť hlavy.
Poruchy okaMenej časté: suché oči, svrbenie očí, zvýšené slzenie.
U väčšiny pacientov liečených roztokom na aktinickú keratózu sa v mieste aplikácie vyskytlo mierne až stredne závažné podráždenie a zápal. V prípade závažných reakcií sa frekvencia liečby môže znížiť.
Keďže liek má veľmi silný zmäkčujúci účinok na stratum corneum, môže dôjsť ku belavému sfarbeniu a odlupovaniu kože, najmä v okolí miesta aktinickej keratózy.
Kvôli obsahu kyseliny salicylovej môže použitie tohto lieku u pacientov so zodpovedajúcou dispozíciou vyvolať mierne prejavy podráždenia, ako je dermatitída a kontaktné alergické reakcie. Takéto kontaktné alergické reakcie sa môžu prejavovať svrbením, sčervenaním a malými pľuzgierikmi, dokonca aj mimo miesta aplikácie.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieAk sa nanáša na kožu podľa odporúčaní, systémová intoxikácia ktorýmkoľvek z liečiv nie je pravdepodobná. Významne viac aplikácií, než sa odporúča, môže viesť ku zvýšenej frekvencii a závažnosti reakcií v mieste podania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antineoplastiká; antimetaboliká; analógy pyrimidínu, ATC kód: L01BC52
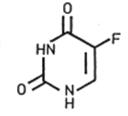
Fluóruracil:
Liečivo fluóruracil (FU) je cytostatikum, ktoré má antimetabolický účinok. Vzhľadom na jeho štrukturálnu podobnosť s tymínom (5-metyluracil), ktorý sa vyskytuje v nukleových kyselinách, FU zabraňuje tvorbe a využitiu tymínu, a týmto spôsobom inhibuje syntézu DNA aj RNA. Výsledkom je inhibícia rastu tých buniek, ktoré sú predovšetkým – ako v prípade aktinickej keratózy – vo fáze zrýchleného rastu, a preto vo zvýšených množstvách absorbujú FU. Následkom je aj inhibícia rastu vírusov, ktoré sa môžu podieľať na vývoji aktinickej keratózy.

| 
|
Tymín
| Fluóruracil
|
Kyselina salicylová:
Lokálne aplikovaná kyselina salicylová má keratolytický účinok a znižuje hyperkeratózu súvisiacu s aktinickou keratózou. Kyselina salicylová sa považuje za fenolovú aromatickú kyselinu a je rozpustná v tukoch. Predpokladá sa, že jej mechanizmus účinku ako keratolytika a látky s lytickým účinkom na rohovú vrstvu súvisí s narušením adhézie korneocytov, so solubilizačným účinkom na medzibunkovú hmotu (tzv. cement) a uvoľňovaním a oddeľovaním korneocytov. Keďže sa kyselina salicylová správa ako organické rozpúšťadlo, môže odbúrať intercelulárne lipidy kovalentne spojené s obalom okolitých korneocytov.
V pivotnom randomizovanom, placebom kontrolovanom, dvojito zaslepenom, multicentrickom klinickom skúšaní fázy III s 3 paralelnými skupinami sa 470 pacientov s AK I. až II. stupňa liečilo buď roztokom fluóruracilu (5 mg/g) a kyseliny salicylovej (100 mg/g) (5-FU-SA) alebo placebom alebo gélom s obsahom diklofenaku (30 mg/g) (DG). 187 pacientov bolo počas 12 týždňov vystavených účinku fixnej kombinácie 5-FU-SA. Primárnym koncovým ukazovateľom bolo histologické odstránenie lézie 8 týždňov po ukončení liečby. Lokálna liečba 5-FU-SA sa v porovnaní s liečbou placebom a DG ukázala ako lepšia. Sekundárne koncové ukazovatele účinnosti, ako celkový počet lézií, celková veľkosť lézií AK, odpoveď lézií, celkové hodnotenie účinnosti lekárom a celkové hodnotenie účinnosti pacientom potvrdili výsledky primárneho koncového ukazovateľa. U 72,0 % pacientov v skupine s 5-FU-SA už nebolo možné AK v odobratých biopsiách zistiť, zatiaľ čo stupeň odstránenia lézie v skupine s DG bol 59,1 % a s placebom 44,8 % (podľa analýzy protokolu). Najčastejšími nežiaducimi reakciami na 5-FU-SA bolo podráždenie v mieste aplikácie (vrátane pálenia) (86,1 %) a zápal v mieste aplikácie (73,3 %). S vysokou frekvenciou sa vyskytlo aj svrbenie v mieste aplikácie (44,9 %) a bolesť v mieste aplikácie (25,1 %). Ďalšie nežiaduce reakcie boli erytém a erózia v mieste aplikácie. Prerušenie liečby z dôvodu reakcií kože a reakcií v mieste aplikácie bolo nízke (0,5 %).
Sú dostupné iba klinické skúsenosti s používaním Actikerallu na tvári, čele a lysinách. Ak sa rozhodne o liečbe iných častí tela, je potrebné zohľadniť hrúbku epidermy na rozdielnych miestach:
Priemerná hrúbka epidermy rozdielnych častí tela
|
Časť tela
| Priemerná hrúbka (mikrometer)
|
Tvár
| 49,4
|
Čelo
| 50,3
|
Horná časť trupu (dekolt)
| 42,2
|
Ruky/nohy
| 60,1
|
Zdroj: Koehler a kol.. 2010 (Skin Res Technol 2010; 16:259 – 264);
Sandby-Moller a kol. 2003 (Acta Derm Venereol 2003; 83(6):410 – 3);
Whitton a Everall 1973 (Br J Dermatol 1973; 89(5):467 – 76)
|
Intenzita lézie AK bola odstupňovaná podľa 4-bodovej škály vychádzajúcej z Olsen a kol.,1991 (J Am Acad Dermatol 1991; 24: 738-743):
Stupeň'
| Klinický popis stupňujúcej sa intenzity
|
0
| žiadna
| bez prítomnosti lézie AK, ako viditeľnej tak hmatateľnej
|
I
| mierna
| plochá, ružová makula bez prejavov hyperkeratózy a erytému, jemne hmatateľná, s AK viac hmatateľnou, než viditeľnou
|
II
| stredne závažná
| ružové až červenkasté papuly a erytematózne plaky s hyperkeratotickým povrchom, mierne hrubé AK, ktoré sú viac viditeľné, než hmatateľné
|
III
| závažná
| veľmi hrubé a/alebo jasne viditeľné AK
|
5.2 Farmakokinetické vlastnostiV štúdii absorpcie vykonanej na ošípaných sa fluóruracil po dermálnej aplikácii v sére nezistil, ani keď sa aplikoval vo veľkých množstvách, t. j. liečivo sa neabsorbovalo v množstvách, ktoré možno zistiť štandardnými analytickými metódami (HPLC).
U pacientov s aktinickou keratózou (n = 12) sa nezistila koncentrácia fluóruracilu vyššia ako 0,05 µg/ml.
Podľa farmakokinetickej štúdie je stupeň absorpcie fluóruracilu u ľudí po nanesení roztoku s rovnakým zložením na bradavice výrazne nižší ako 0,1 %.
Po aplikácii Actikerallu na kožu sa vytvorí pevný film, ktorý po vyparení rozpúšťadla vyzerá biely. Tento film pôsobí okluzívne, čím podporuje penetráciu liečiv do epidermy, kde je aktinická keratóza lokalizovaná.
Kyselina salicylová bola pridaná kvôli svojim keratolytickým vlastnostiam s cieľom zlepšiť penetráciu liečiva, ktorá je v prípade hyperkeratotickej aktinickej keratóze mimoriadne ťažká. Rovnaký účinok sa dosiahne pomocnou látkou dimetylsulfoxidom, ktorá pôsobí ako solubilizér pre liečivo fluóruracil.
Keratolytický účinok kyseliny salicylovej je založený na jej priamom pôsobení na zložky medzibunkovej hmoty alebo dezmozómy, ktoré podporujú proces rohovatenia buniek.
Pokusy na zvieratách a farmakokinetické skúšania na ľuďoch ukázali, že kyselina salicylová z povrchu preniká rýchlo, v závislosti od podkladu a iných faktorov ovplyvňujúcich penetráciu, ako je stav kože.
Kyselina salicylová sa metabolizuje konjugáciou s glycínom za vzniku kyseliny salicylmočovej, s kyselinou glukurónovou na fenolovej skupine OH za vzniku éteru glukuronidu alebo na skupine COOH za vzniku esteru glukuronidu alebo hydroxyláciou na kyselinu gentisovú a kyselinu dihydroxybenzoovú. V normálnom rozmedzí dávok je polčas kyseliny salicylovej medzi 2 až 3 hodinami, no v prípade vysokých dávok sa v dôsledku obmedzenej kapacity pečene konjugovať kyselinu salicylovú môže zvýšiť na 15 až 30 hodín.
Po lokálnej aplikácii kyseliny salicylovej sa vo všeobecnosti neočakávajú žiadne toxické vedľajšie účinky (pozri však kontraindikácie), pretože sérové hladiny vyššie ako 5 mg/dl sa takmer nikdy nedosiahnu. Prvé symptómy intoxikácie salicylátmi sa môžu vyskytnúť iba pri hodnotách v sére vyšších než 30 mg/dl.
5.3 Predklinické údaje o bezpečnostiNie sú k dispozícii žiadne experimentálne údaje o akútnej a subchronickej toxicite fluóruracilu (FU) po lokálnej aplikácii. U potkanov sa vyskytuje systémová biologická dostupnosť FU závislá od dávky, ktorá má za následok závažné lokálne reakcie a fatálne systémové účinky z dôvodu pôsobenia fluóruracilu ako antimetabolitu v takých vysokých dávkach (až 10 000-násobne vyšších ako ľudská dávka), aké sa nedosiahnu, ak sa Actikerall používa podľa odporúčania.
FU bol u niektorých testovaných kmeňov
in vitro mutagénny. Množstvo štúdií skúmalo karcinogenitu FU u hlodavcov a nepreukázalo žiadny účinok. V jednej štúdii na myšiach však existuje dôkaz karcinogenity FU po i.p. podaní. Niekoľko štúdií po systémovom podaní FU naznačuje potenciálne teratogénne alebo embryotoxické účinky pri vysokých dávkach, ale menej alebo žiadne účinky na fertilitu alebo celkovú reprodukčnú schopnosť. Štúdie fertility so systémovým FU mali za následok prechodnú neplodnosť samcov a zníženie počtu gravidít u samíc hlodavcov. Vzhľadom na veľmi obmedzenú absorpciu po dermálnom podaní je však veľmi nepravdepodobné, že by akýkoľvek z týchto účinkov bol u ľudí významný.
Kyselina salicylová má nízku akútnu toxicitu, no pri vyšších koncentráciách po lokálnom podaní môže vyvolať kožné reakcie. Nie je známe, či má kyselina salicylová nejaké mutagénne, genotoxické, karcinogénne alebo teratogénne účinky.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokdimetylsulfoxid
etanol
etylacetát
pyroxylín
poly(butylmetakrylát, metylmetakrylát)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
Čas použiteľnosti po otvorení: 3 mesiace.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 25 °C.
Neuchovávajte v chladničke ani v mrazničke.
Fľašku udržiavajte dôkladne uzatvorenú.
6.5 Druh obalu a obsah baleniaTento liek je naplnený do fľašky z hnedého skla s bielym propylénovým uzáverom s detskou poistkou, fľaška je zabalená v papierovej škatuľke. Uzáver fľašky je spojený so štetcom na aplikáciu roztoku. Štetcový aplikátor (značka CE) pozostáva z polyetylénu (HDPE a LDPE 1:1) a štetca z nylonových vláken upevneného v násade pomocou nehrdzavejúcej ocele (V2A).
Veľkosť balenia: 25 ml roztoku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAlmirall Hermal GmbH
Scholtzstrasse 3
21465 Reinbek
Nemecko
8. REGISTRAČNÉ ČÍSLO 46/0515/11-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26.augusta 2011
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTU05/2016