
ečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie. Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanou nádorovým ochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu
autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho
darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri
časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria
trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné
chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od
indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek)
Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
1 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/003
EU/1/07/412/004
EU/1/07/412/029
EU/1/07/412/030
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 3 000 IU/0,3 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,3 ml obsahuje 3 000 medzinárodných jednotiek (IU), čo zodpovedá
25,2 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientov s chronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
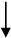
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
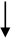
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň
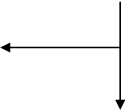
4 týždne
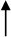
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta
jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou
samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Mechanizmus účinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu
rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov).
Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,3 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/005
EU/1/07/412/006
EU/1/07/412/031
EU/1/07/412/032
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 4 000 IU/0,4 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,4 ml obsahuje 4 000 medzinárodných jednotiek (IU), čo zodpovedá
33,6 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený
iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu
autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito
zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného
dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,4 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/007
EU/1/07/412/008
EU/1/07/412/033
EU/1/07/412/034
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 5 000 IU/0,5 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,5 ml obsahuje 5 000 medzinárodných jednotiek (IU), čo zodpovedá
42,0 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou
ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie
pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie. Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcich pacientov s chronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho
darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,5 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/009
EU/1/07/412/010
EU/1/07/412/035
EU/1/07/412/036
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 6 000 IU/0,6 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,6 ml obsahuje 6 000 medzinárodných jednotiek (IU), čo zodpovedá
50,4 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémie u dospelých a pediatrických pacientov s chronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo
znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky
než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta
jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne. Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito
zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Mechanizmus účinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu
rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov).
Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,6 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/011
EU/1/07/412/012
EU/1/07/412/037
EU/1/07/412/038
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 7 000 IU/0,7 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,7 ml obsahuje 7 000 medzinárodných jednotiek (IU), čo zodpovedá
58,8 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený
iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu
autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito
zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného
dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,7 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/017
EU/1/07/412/018
EU/1/07/412/039
EU/1/07/412/040
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 8 000 IU/0,8 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,8 ml obsahuje 8 000 medzinárodných jednotiek (IU), čo zodpovedá
67,2 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený
iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu
autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami
(221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,8 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/013
EU/1/07/412/014
EU/1/07/412/041
EU/1/07/412/042
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 9 000 IU/0,9 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,9 ml obsahuje 9 000 medzinárodných jednotiek (IU), čo zodpovedá
75,6 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia)
Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých
hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri
časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne
liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak, liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta
jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémie u dospelých, detských a dospievajúcich pacientov s chronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým
zlyhaním obličiek)

Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu
rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov).
Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,9 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/019
EU/1/07/412/020
EU/1/07/412/043
EU/1/07/412/044
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 10 000 IU/1 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 10 000 IU epoetínu alfa*, čo zodpovedá 84,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 1 ml obsahuje 10 000 medzinárodných jednotiek (IU), čo zodpovedá
84,0 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.'
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky
než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek (PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito
zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
1 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/015
EU/1/07/412/016
EU/1/07/412/045
EU/1/07/412/046
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 20 000 IU/0,5 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 40 000 IU epoetínu alfa*, čo zodpovedá 336,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,5 ml obsahuje 20 000 medzinárodných jednotiek (IU), čo zodpovedá 168,0 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých
hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou
ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie
pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie. Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne.
Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcich pacientov s chronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho
darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,5 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1, 4 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/021
EU/1/07/412/022
EU/1/07/412/047
EU/1/07/412/048
EU/1/07/412/053
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 30 000 IU/0,75 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 40 000 IU epoetínu alfa*, čo zodpovedá 336,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 0,75 ml obsahuje 30 000 medzinárodných jednotiek (IU), čo zodpovedá 252,0 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickej anémie u dospelých a pediatrických pacientov s chronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky
než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však
hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie.
Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne. Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcichpacientovschronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u
pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanounádorovýmochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito
zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.MechanizmusúčinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených
epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
0,75 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1, 4 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/023
EU/1/07/412/024
EU/1/07/412/049
EU/1/07/412/050
EU/1/07/412/054
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Abseamed 40 000 IU/1 ml injekčný roztok v naplnenej injekčnej striekačke
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml roztoku obsahuje 40 000 IU epoetínu alfa*, čo zodpovedá 336,0 mikrogramu na ml.
1 naplnená injekčná striekačka s 1 ml obsahuje 40 000 medzinárodných jednotiek (IU), čo zodpovedá
336,0 mikrogramu epoetínu alfa. * Vyrába sa technológiou rekombinantnej DNA v ovariálnych
bunkách čínskeho škrečka (CHO).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v naplnenej injekčnej striekačke (injekcia) Číry, bezfarebný roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba symptomatickej anémie súvisiacej s chronickým zlyhaním činnosti obličiek (CRF) u dospelých
a pediatrických pacientov:
- Liečba anémie spojenej s chronickým zlyhaním obličiek u pediatrických a dospelých
hemodialyzovaných pacientov a dospelých pacientov na peritoneálnej dialýze (pozri časť 4.4).
- Liečba ťažkej anémie obličkového pôvodu sprevádzanej klinickými symptómami u dospelých
pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu (pozri časť 4.4).
Liečba anémie a zníženie požiadaviek na transfúziu u dospelých pacientov liečených chemoterapiou kvôli pevným nádorom, malígnemu lymfómu alebo mnohopočetnému myelómu a u pacientov, pre ktorých je transfúzia rizikom vzhľadom na celkový zdravotný stav (napr. kardiovaskulárne ochorenie, anémia na začiatku chemoterapie).
Abseamed sa môže používať na zvýšenie výťažnosti autológnej krvi od pacientov v programe autológneho darcovstva. Jeho použitie pri tejto indikácii musí byť vyvážené vzhľadom na hlásené riziko vzniku tromboembolických udalostí. Tento liek sa má podávať iba pacientom so stredne závažnou anémiou (hemoglobín (Hb) 10 až 13 g/dl (6,2 až 8,1 mmol/l), bez deficitu železa), ak nie sú k dispozícii postupy na úsporu krvi, alebo ak sú nedostatočné, keď naplánovaný rozsiahly elektívny chirurgický zákrok vyžaduje veľký objem krvi (najmenej 4 jednotky krvi pre ženy alebo najmenej 5 jednotiek pre mužov).
Abseamed sa môže používať na zníženie rizika pri alogénnych transfúziách krvi u dospelých
pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou, u ktorých je vysoké riziko komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť na pacientov so stredne ťažkou
anémiou (napr. hodnota hemoglobínu Hb 10–13 g/dl alebo 6,2-8,1 mmol/l), pre ktorých nie je dostupný program autológneho darcovstva a predpokladané mierne straty krvi sú 900 až 1 800 ml.
Pred operáciou treba vždy používať štandardné praktiky v liečbe krvných porúch.
4.2 Dávkovanie a spôsob podávania
Liečba Abseamedom sa musí začať pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov
s vyššie uvedenými indikáciami.
Dávkovanie
Liečbasymptomatickejanémieudospelýchapediatrickýchpacientovschronickýmzlyhanímobličiek:
Pacientom s chronickým zlyhaním obličiek sa musí tento liek podávať intravenózne (pozri časť 4.4).
Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a súbežnými patologickými medicínskymi stavmi. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Abseamed sa má podávať na zvýšenie hladín hemoglobínu na hodnotu maximálne 12 g/dl
(7,5 mmol/l).
Zvýšeniu hladín hemoglobínu nad 2 g/dl (1,25 mmol/l) počas štvortýždenného intervalu sa má zabrániť. Ak k nemu dôjde, treba vykonať príslušnú úpravu dávky podľa odporúčaní.Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl (7,5 mmol/l). U pediatrických pacientov je odporúčaný cieľový rozsah hladín hemoglobínu v rozmedzí 9,5 až 11 g/dl (5,9 - 6,8 mmol/l).
Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa má zabrániť. Ak sa hodnota hemoglobínu zvýšila o viac ako 2 g/dl (1,25 mmol/l) za mesiac alebo ak trvalá hladina hemoglobínu prekračuje 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o 25 %. Ak hodnota hemoglobínu prekročí
13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne pod 12 g/dl (7,5 mmol/l)
a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu
alfa poskytujúcej dostatočnú kontrolu anémie a symptómov anémie.
Pred začatím liečby a v priebehu liečby sa má skontrolovať hladina železa a v prípade potreby sa má podávať železo ako doplnok stravy. Okrem toho je pred začatím liečby epoetínom alfa potrebné vylúčiť iné príčiny anémie, ako napríklad deficit vitamínu B12 alebo kyseliny listovej. Ak sa nedosiahne odpoveď na liečbu epoetínom alfa, môže ísť o nasledujúce príčiny: deficit železa, kyseliny listovej alebo vitamínu B12, intoxikácia hliníkom, interkurentné infekcie, zápalové alebo traumatické stavy, okultná strata krvi, hemolýza a fibróza kostnej drene akéhokoľvek pôvodu.
Dospelí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenóznou cestou. Ak je potrebná úprava dávky, má sa uskutočňovať
postupne v priebehu minimálne štyroch týždňov. V každom kroku sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2 – 7,5 mmol/l).
Odporúčaná celková týždenná dávka je 75 až 300 IU/kg podávaná intravenóznou cestou.
Dostupné klinické údaje naznačujú, že pacienti, u ktorých je počiatočná hladina hemoglobínu veľmi nízka (< 6 g/dl alebo < 3,75 mmol/l), môžu potrebovať vyššie udržiavacie dávky než tí, u ktorých sa vyskytla menej závažná anémia na začiatku liečby (Hb > 8 g/dl alebo > 5 mmol/l).
Pediatrickí hemodialyzovaní pacienti:
Liečba je rozdelená na dve etapy:
Korekčná fáza:
50 IU/kg 3-krát týždenne intravenózne. Ak je potrebná úprava dávky, má sa uskutočňovať postupne
po 25 IU/kg 3-krát týždenne v minimálne 4-týždňových intervaloch, až kým sa nedosiahne
požadovaný výsledok.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 9,5 až
11 g/dl (5,9 – 6,8 mmol/l).
Všeobecne platí, že deti s telesnou hmotnosťou do 30 kg potrebujú vyššie udržiavacie dávky než deti s telesnou hmotnosťou nad 30 kg a dospelí.
V klinických skúšaniach sa po 6 mesiacoch liečby zaznamenali nasledujúce udržiavacie dávky:
| Dávka (IU/kg podávaná 3-krát/týždeň)
|
Telesná
hmotnosť (kg)
|
Medián
|
Zvyčajná udržiavacia dávka
|
< 10
| 100
| 75-150
|
10-30
| 75
| 60-150
|
> 30
| 33
| 30-100
|
Dostupné klinické údaje naznačujú, že pediatrickí pacienti, u ktorých je počiatočná hladina
hemoglobínu veľmi nízka (< 6,8 g/dl alebo < 4,25 mmol/l), môžu potrebovať vyššie udržiavacie dávky
než tí, ktorí majú na začiatku liečby vyššiu hladinu hemoglobínu (> 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 2-krát týždenne intravenóznou cestou.
Udržiavacia fáza:
Úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až
12 g/dl (6,2-7,5 mmol/l). Udržiavacia dávka 25 až 50 IU/kg 2-krát týždenne v dvoch rovnakých injekciách.
Dospelí pacienti so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu:Liečba je rozdelená na dve etapy:
Korekčná fáza:
Počiatočná dávka 50 IU/kg 3-krát týždenne intravenóznou cestou nasledovaná v prípade potreby zvyšovaním dávkovania o 25 IU/kg (3-krát týždenne), až kým sa nedosiahne požadovaný výsledok
(dávka sa má zvyšovať postupne v priebehu minimálne štyroch týždňov).
Udržiavacia fáza:
Má sa vykonať vhodná úprava dávkovania za účelom udržania hladín hemoglobínu na požadovanej hodnote: Hb 10 až 12 g/dl (6,2-7,5 mmol/l). Predĺženie dávkovacích intervalov môže vyžadovať zvýšenie dávky.
Maximálne dávkovanie nesmie presiahnuť 150 IU/kg 3-krát týždenne.
Pacienti s anémiou vyvolanou chemoterapiou:Pacientom s anémiou (napr. hladina hemoglobínu ≤ 10 g/dl (6,2 mmol/l)) sa má podávať epoetín alfa
podkožnou cestou. Symptómy a následky anémie sa môžu líšiť s vekom, pohlavím a celkovou záťažou
ochorením. Je potrebné lekárske vyhodnotenie individuálnej klinickej liečby a stavu pacienta.
Z dôvodu variability u každého pacienta sa príležitostne môžu u pacienta pozorovať individuálne hladiny hemoglobínu vyššie a nižšie než požadovaná hladina hemoglobínu. Variabilita hemoglobínu sa má regulovať úpravou dávky so zvážením cieľového rozsahu hladín hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l). Trvalej hladine hemoglobínu vyššej než 12 g/dl (7,5 mmol/l) sa
má zabrániť. Pokyny pre príslušnú úpravu dávky, ak hladiny hemoglobínu prekročia hodnotu 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Liečba epoetínom alfa má pokračovať ešte jeden mesiac po skončení chemoterapie.
Počiatočná dávka je 150 IU/kg a podáva sa subkutánne 3-krát týždenne. Prípadne sa môže podávať počiatočná dávka epoetínu alfa 450 IU/kg subkutánne jedenkrát týždenne.
- Ak sa po štyroch týždňoch liečby zvýši hodnota hemoglobínu aspoň o 1 g/dl (0,62 mmol/l),
alebo ak sa zvýši počet retikulocytov o ≥ 40 000 buniek/µl oproti východiskovej hodnote, dávka
150 IU/kg 3-krát týždenne alebo 450 IU/kg jedenkrát týždenne má zostať nezmenená.
- Ak sa zvýšila hodnota hemoglobínu o < 1 g/dl (< 0,62 mmol/l) a zvýšil sa počet retikulocytov o
< 40 000 buniek/µl oproti východiskovej hodnote, dávka sa má zvýšiť na 300 IU/kg 3-krát
týždenne. Ak sa po ďalších štyroch týždňoch liečby s 300 IU/kg 3-krát týždenne zvýšila
hodnota hemoglobínu o ≥ 1 g/dl (≥ 0,62 mmol/l), alebo ak sa zvýšil počet retikulocytov o
≥ 40 000 buniek/µl, dávka 300 IU/kg 3-krát týždenne má zostať nezmenená. Ak sa však hodnota hemoglobínu zvýšila o < 1 g/dl (< 0,62 mmol/l) a počet retikulocytov sa zvýšil o
< 40 000 buniek/µl oproti východiskovej hodnote, odpoveď na liečbu epoetínom alfa je
nepravdepodobná a liečba sa má ukončiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne


4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl Zvýšenie počtu retikulocytov o
< 40 000/µl
alebo zvýšenie hodnoty Hb o ≥ 1 g/d a zvýšenie hodnoty Hb o < 1 g/dl
Požadovaná hodnota Hb 300 IU/kg
(≤ 12 g/dl) 3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/µl alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o
< 40 000/µl
a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Pacientov treba dôkladne monitorovať, aby sa zaručilo použitie najnižšej schválenej dávky epoetínu alfa poskytujúcej dostatočnú kontrolu symptómov anémie.
Úprava dávkovania na udržanie hladín hemoglobínu v rozsahu od 10 g/dl do 12 g/dl (6,2-7,5 mmol/l): Ak sa hladina hemoglobínu zvýši o viac než 2 g/dl (1,25 mmol/l) za mesiac, alebo ak hladiny hemoglobínu prekročia 12 g/dl (7,5 mmol/l), znížte dávku epoetínu alfa o približne 25 až 50 %. Ak hodnota hemoglobínu prekročí 13 g/dl (8,1 mmol/l), prerušte liečbu, až kým táto hodnota neklesne
pod 12 g/dl (7,5 mmol/l) a následne pokračujte v liečbe epoetínom alfa s dávkou nižšou o 25 % oproti predchádzajúcej dávke.
Dospelí pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva:Abseamed sa má podávať intravenóznou cestou.
V čase darovania krvi sa má Abseamed podávať po dokončení postupu darovania krvi.
Mierne anemickí pacienti (hematokrit 33 až 39 %) vyžadujúci predbežné uloženie ≥ 4 jednotiek krvi sa majú liečiť Abseamedom s dávkami 600 IU/kg telesnej hmotnosti 2-krát týždenne počas 3 týždňov pred chirurgickým zákrokom. Použitím tohto liečebného režimu bolo možné odobrať ≥ 4 jednotky krvi 81 % pacientov liečených epoetínom alfa v porovnaní s 37 % pacientov liečených placebom. Liečba epoetínom alfa znižovala riziko expozície homológnej krvi o 50 % v porovnaní s pacientmi nedostávajúcimi epoetín alfa.
Všetkým pacientom liečeným Abseamedom sa má adekvátne dopĺňať železo (napr. 200 mg elementárneho železa perorálne denne) počas celej liečby. Dopĺňanie železa sa má začať hneď, ako je to možné, aj niekoľko týždňov pred začatím autológneho odberu, aby sa dosiahli vysoké zásoby železa pred začatím liečby Abseamedom.
Dospelí pacienti pred plánovanou rozsiahlou ortopedickou operáciou:
Liek sa má podávať subkutánne.
Odporúčaný dávkovací režim epoetínu alfa je 600 IU/kg týždenne podávaný počas 3 týždňov (dni
- 21, - 14 a - 7) pred operáciou a v deň operácie (deň 0). V prípade, že je z lekárskeho hľadiska potrebné skrátiť čas pred operáciou na menej ako tri týždne, má sa podávať 300 IU/kg epoetínu alfa
denne počas desiatich po sebe nasledujúcich dní pred operáciou, v deň operácie a v priebehu štyroch
dní hneď po operácii. Ak sa hematologické vyšetrenia vykonávajú počas predoperačného obdobia, a ak je hodnota hemoglobínu 15 g/dl (9,38 mmol/l) alebo viac, podávanie epoetínu alfa sa má ukončiť a ďalšie dávky sa už nemajú podávať.
Na začiatku liečby je potrebné sa starostlivo uistiť, že pacienti netrpia deficitom železa.
Všetkým pacientom liečeným epoetínom alfa sa má adekvátne dopĺňať železo (napr. náhrada železa
200 mg Fe2+ perorálne denne) počas celej liečby epoetínom alfa. Železo je potrebné podľa možnosti doplniť pred začiatkom liečby epoetínom alfa, aby sa zabezpečili adekvátne zásoby železa.
Spôsob podávania
Skontrolujte, či nie sú v roztoku žiadne častice alebo či nedošlo k zmene farby, rovnako ako v prípade
akéhokoľvek iného injekčného lieku. Abseamed je sterilný, ale nekonzervovaný produkt a je určený iba na jednorazové použitie. Podávať potrebné množstvo.
Nepodávajte formou intravenóznej infúzie, ani nemiešajte s inými liekmi (ďalšie informácie, pozri časť 6.6).
Intravenózna injekcia: počas minimálne 1 až 5 minút v závislosti od celkovej dávky. Hemodialyzovaným pacientom sa môže podať bolusová injekcia počas dialýzy priamo do príslušného venózneho portu v dialyzačnom systéme. Prípadne sa môže podať injekcia na konci dialýzy cez ihlu fistuly s následným podaním 10 ml izotonického fyziologického roztoku na prepláchnutie hadičky
a zabezpečenie dostatočného prieniku lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu symptómami podobnými chrípke, je vhodnejšie aplikovať
injekciu pomalšie.
Subkutánna injekcia: všeobecne sa nesmie presiahnuť maximálny objem 1 ml podaný injekčne do jedného miesta. V prípade väčších objemov sa majú injekcie aplikovať do viacerých miest. Injekcie sa podávajú do končatín alebo prednej brušnej steny.
V situáciách, keď lekár určí, že pacient alebo ošetrovateľ môže bezpečne a účinne podať Abseamed
subkutánne, sa majú poskytnúť pokyny o správnej dávke a podaní.
„Pokyny, ako si môžete sami injekčne podať Abseamed“, môžete nájsť na konci písomnej informácie
pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacienti, u ktorých sa po liečbe akýmikoľvek erytropoetínmi vyvinie čistá aplázia červených krviniek (Pure Red Cell Aplasia – PRCA), nemajú dostávať Abseamed ani žiaden iný erytropoetín (pozri časť 4.4, Čistá aplázia červených krviniek).
- Nekontrolovaná hypertenzia.
- Pacienti podstupujúci chirurgický zákrok, ktorí z akéhokoľvek dôvodu nemôžu dostávať
adekvátnu antitrombotickú profylaxiu.
- U pacientov, ktorým sa podáva epoetín alfa, sa majú dodržiavať všetky kontraindikácie
súvisiace s programami autológneho darcovstva.
Použitie epoetínu alfa u pacientov pred plánovanou rozsiahlou ortopedickou operáciou, ktorí nie sú zaradení do programu autológneho darcovstva, je kontraindikované pri závažnom ochorení koronárnych, periférnych artérií, karotickom alebo cerebrovaskulárnom ochorení vrátane pacientov s nedávno prekonaným infarktom myokardu alebo cerebrovaskulárnou príhodou.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
U všetkých pacientov dostávajúcich epoetín alfa sa má pozorne monitorovať a v prípade potreby aj
regulovať krvný tlak. Epoetín alfa sa má používať s opatrnosťou v prípade neliečenej, nesprávne liečenej alebo nedostatočne kontrolovateľnej hypertenzie. Môže byť nevyhnutné pridať
antihypertenzívnu liečbu alebo zvýšiť dávku antihypertenzív. Ak nie je možné regulovať krvný tlak,
liečba epoetínom alfa sa má ukončiť.
Epoetín alfa sa má používať s opatrnosťou aj v prípade epilepsie a chronického zlyhania pečene.
Pacienti s chronickým zlyhaním obličiek a nádorovým ochorením užívajúci epoetín alfa majú mať pravidelne merané hladiny hemoglobínu, pokiaľ sa nedosiahne stabilná hladina a v pravidelných intervaloch aj potom.
U všetkých pacientov sa hladiny hemoglobínu majú dôkladne monitorovať z dôvodu potenciálne zvýšeného rizika vzniku tromboembolických udalostí a možného úmrtia pri liečbe pacientov
s hladinami hemoglobínu vyššími ako cieľ pre indikáciu použitia.
Počas liečby epoetínom alfa sa môže v závislosti od dávky vyskytnúť mierne zvýšenie počtu trombocytov v rámci normálneho rozpätia hodnôt. V priebehu ďalšej liečby sa tieto hodnoty upravia. Okrem toho bola hlásená trombocytémia nad normálnym rozsahom. Počas prvých 8 týždňov liečby sa odporúča pravidelne monitorovať počet trombocytov.
Pred začatím liečby epoetínom alfa sa majú zvážiť a liečiť všetky ďalšie príčiny anémie (deficit železa, hemolýza, strata krvi, deficit vitamínu B12 alebo kyseliny listovej). Vo väčšine prípadov hodnoty feritínu v sére klesajú súčasne so zväčšujúcim sa celkovým objemom cirkulujúcej krvi. Aby
sa dosiahla optimálna odpoveď na liečbu epoetínom alfa, majú sa zabezpečiť adekvátne zásoby železa:
- doplnenie železa, napr. 200-300 mg Fe2+/deň perorálne (100-200 mg Fe2+/deň u pediatrických
pacientov) sa odporúča u pacientov s chronickým zlyhaním činnosti obličiek s hodnotami feritínu v sére menej ako 100 ng/ml
- perorálne doplnenie železa 200-300 mg Fe2+/deň sa odporúča u všetkých pacientov s nádorovým ochorením, u ktorých je saturácia transferínu nižšia ako 20 %.
Všetky tieto aditívne faktory výskytu anémie majú byť taktiež starostlivo zvážené pri rozhodovaní o
zvýšení dávky epoetínu alfa u pacientov s nádorovým ochorením.
Veľmi zriedkavo sa u pacientov liečených epoetínom alfa pozoroval rozvoj alebo zhoršenie porfýrie. Epoetín alfa sa má u pacientov s porfýriou používať opatrne.
Na zlepšenie sledovateľnosti látok stimulujúcich erytropoézu (ESA) sa má do dokumentácie pacienta jasne zaznamenať (alebo uviesť) názov podávanej ESA.
U pacientov sa má prejsť z jednej ESA na inú iba pod príslušným dohľadom.
Č
i
stá aplázia červených krviniek(PRCA)
PRCA sprostredkovaná protilátkami bola hlásená po mesiacoch až rokoch subkutánnej liečby
erytropoetínmi, hlavne u pacientov s chronickým zlyhaním obličiek. U pacientov s hepatitídou C
liečených interferónom a ribavirínom boli tiež hlásené prípady, keď sa epoetíny užívali súbežne. Abseamed nie je schválený na liečbu anémie spojenej s hepatitídou C.
U pacientov s náhlym poklesom účinku definovaným znížením hodnôt hemoglobínu (1 až 2 g/dl alebo
0,62 až 1,25 mmol/l za mesiac) so zvýšenou potrebou transfúzií sa má zistiť počet retikulocytov
a majú sa vylúčiť typické príčiny nedostatočnej odpovede na liečbu (napr. deficit železa, kyseliny
listovej alebo vitamínu B12, intoxikácia hliníkom, infekcie alebo zápaly, strata krvi a hemolýza).
V prípade paradoxného poklesu hladiny hemoglobínu a rozvoja závažnej anémie spojenej s nízkymi počtami retikulocytov sa má ihneď ukončiť liečba Abseamedom a vykonať testovanie na antierytropoetínové protilátky. Pri diagnostike PRCA sa má zvážiť aj vyšetrenie kostnej drene.
Nemá sa začínať žiadna ďalšia liečba s ESA z dôvodu rizika krížovej reakcie.
Liečbasymptomatickejanémieudospelých,detskýchadospievajúcich pacientov s chronickým
zlyhaním obličiek
Nie sú k dispozícii dostatočné informácie o imunogénnosti pri subkutánnom použití Abseamedu u
pacientov s rizikom PRCA sprostredkované protilátkami, t.j. u pacientov s renálnou anémiou. Preto u pacientov s renálnou anémiou sa tento liek musí podávať intravenózne.
U pacientov s chronickým zlyhaním obličiek má byť rýchlosť zvyšovania hladiny hemoglobínu približne 1 g/dl (0,62 mmol/l) za mesiac a nemá presiahnuť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko zhoršenia hypertenzie.
Hladina hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia hladina hemoglobínu prekročiť horný
limit cieľovej hladiny hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali žiadne významné výhody, ktoré by sa dali pripísať podávaniu epoetínov, pri zvýšení hladiny hemoglobínu nad úroveň potrebnú na kontrolu symptómov anémie a na zabránenie nutnosti transfúzie krvi.
Niektorí pacienti s dlhšími dávkovacími intervalmi (dlhšími než jedenkrát týždenne) epoetínu alfa si nemusia udržať dostatočné hladiny hemoglobínu (pozri časť 5.1) a môžu vyžadovať zvýšenie dávky epoetínu alfa. Hladiny hemoglobínu sa majú pravidelne sledovať.
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia, aj keď príčinná súvislosť nebola stanovená. U pacientov s chronickým zlyhaním obličiek majú byť monitorované elektrolyty v sére. Ak sa zistí zvýšená alebo rastúca hladina draslíka v sére, okrem vhodnej liečby hyperkaliémie sa má zvážiť prerušenie liečby epoetínom alfa, až kým sa neupraví hladina draslíka v sére.
V priebehu liečby epoetínom alfa sa často vyžaduje počas hemodialýzy zvýšenie dávky heparínu v dôsledku zvýšeného hematokritu. Ak nie je heparinizácia optimálna, môže dôjsť k oklúzii dialyzačného systému.
Na základe doposiaľ dostupných údajov sa zistilo, že úprava anémie s epoetínom alfa u dospelých pacientov so zlyhaním činnosti obličiek, ktorí zatiaľ nepodstúpili dialýzu, neurýchľuje progresiu zlyhania činnosti obličiek.
Liečba pacientov s anémiou vyvolanou nádorovým ochorením
Erytropoetíny sú rastové faktory, ktoré primárne stimulujú tvorbu erytrocytov. Na povrchu rôznych
nádorových buniek sa môžu nachádzať receptory pre erytropoetín. Tak ako pri všetkých rastových faktoroch je potrebné vziať do úvahy, že epoetíny môžu stimulovať rast nádorov. V niekoľkých kontrolovaných štúdiách vykonávaných u pacientov s anémiou súvisiacou s rakovinou sa u epoetínov nepreukázalo žiadne zlepšenie celkového prežívania ani zníženie rizika progresie nádorových ochorení.
V kontrolovaných klinických štúdiách používanie epoetínu alfa a iných ESA preukázalo:
- zníženú lokoregionálnu kontrolu u pacientov s pokročilým karcinómom hlavy a krku podstupujúcich liečbu ožarovaním pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu vyššej než 14 g/dl (8,7 mmol/l),
- skrátený celkový čas prežívania a zvýšenú mieru úmrtí, ktorú bolo možné pripísať progresii ochorenia, po 4 mesiacoch u pacientov s metastatickým karcinómom prsníka podstupujúcich chemoterapiu pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12-14 g/dl
(7,5-8,7 mmol/l),
- zvýšené riziko úmrtia pri podávaní na dosiahnutie cieľovej hladiny hemoglobínu 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením nepodstupujúcim chemoterapiu ani
liečbu ožarovaním. Látky stimulujúce erytropoézu (ESA) nie sú indikované na použitie u tejto
populácie pacientov.
S ohľadom na vyššie uvedené informácie sa má v niektorých klinických situáciách uprednostniť liečba
krvnou transfúziou na zvládnutie anémie u pacientov s nádorovým ochorením. Rozhodnutie
o podávaní rekombinantných erytropoetínov má byť založené na vyhodnotení rizík a výhod s účasťou samotného pacienta, pričom sa má zohľadniť aj špecifická klinická súvislosť. Faktory, ktoré treba
zvážiť pri tomto vyhodnotení, majú zahŕňať typ nádoru a jeho fázu, stupeň anémie, očakávanú dĺžku
života, prostredie, v ktorom sa pacient lieči, a právo voľby pacienta (pozri časť 5.1).
Pri hodnotení vhodnosti liečby epoetínom alfa u pacientov s nádorovým ochorením liečených chemoterapiou (rizikoví pacienti pre transfúziu) je nutné zvážiť 2-3-týždňové oneskorenie medzi podaním epoetínu alfa a objavením sa erytropoetínom indukovaných erytrocytov.
Keďže u pacientov s nádorovým ochorením liečených látkami stimulujúcimi erytropoézu bol pozorovaný zvýšený výskyt trombovaskulárnych príhod (TVE) (pozri časť 4.8), toto riziko sa má starostlivo zvážiť oproti prínosom liečby (s epoetínom alfa), najmä u pacientov s nádorovým ochorením so zvýšeným rizikom trombovaskulárnych príhod, ako sú obézni pacienti a pacienti s TVE v anamnéze (napr. trombóza hlbokých žíl alebo pľúcna embólia). Výskumná štúdia (štúdia BEST)
u žien s metastatickým karcinómom prsníka bola navrhnutá na zistenie, či liečba epoetínom alfa nad rámec korekcie anémie môže zlepšiť liečebné výsledky. V tejto štúdii bol výskyt fatálnych tromboembolických udalostí vyšší u pacientov dostávajúcich epoetín alfa než u pacientov dostávajúcich placebo (pozri časť 5.1).
Pacienti podstupujúci chirurgický zákrok v programe autológneho darcovstva
Majú sa dodržiavať všetky špeciálne upozornenia a preventívne opatrenia súvisiace s programami
autológneho darcovstva, najmä rutinná náhrada objemu.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa musí zistiť príčina anémie a musí
sa liečiť pokiaľ možno pred začatím liečby epoetínom alfa. U tejto populácie môžu byť rizikom
trombotické príhody a možnosť trombotických príhod sa má starostlivo zvážiť oproti prínosom liečby
u tejto skupiny pacientov.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou majú dostávať adekvátnu antitrombotickú profylaxiu, nakoľko sa u pacientov podstupujúcich chirurgický výkon môžu vyskytnúť trombotické a vaskulárne príhody, obzvlášť u pacientov so skrytým kardiovaskulárnym ochorením. Okrem toho je potrebná zvláštna opatrnosť u pacientov s predispozíciou na rozvoj trombózy hlbokých žíl. Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl
(> 8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod. Z tohto dôvodu sa nemá použiť u pacientov s
východiskovou hodnotou hemoglobínu > 13 g/dl (> 8,1 mmol/l).
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neexistuje žiadny dôkaz o tom, či liečba epoetínom alfa ovplyvňuje metabolizmus iných liekov. Keďže sa cyklosporín viaže na erytrocyty, interakcia s inými látkami je možná. Ak sa epoetín alfa podáva súbežne s cyklosporínom, majú sa monitorovať hladiny cyklosporínu v krvi a podľa zvýšenia hodnoty hematokritu sa má upraviť dávka cyklosporínu.
Neexistuje žiadny dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G-CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití epoetínu alfa u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Takže:
- U pacientok s chronickým zlyhaním činnosti obličiek sa nesmie Abseamed používať počas
gravidity, okrem prípadov, kedy potenciálny prínos liečby preváži možné riziká pre plod.
- U gravidných pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho darcovstva krvi sa používanie epoetínu alfa neodporúča.
Laktácia
Nie je známe, či sa epoetín alfa vylučuje do ľudského mlieka.
Epoetín alfa sa má u dojčiacich žien používať opatrne. Rozhodnutie, či pokračovať/prerušiť dojčenie alebo pokračovať/prerušiť liečbu epoetínom alfa sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby epoetínom alfa pre ženu.
U dojčiacich pacientok podstupujúcich chirurgický zákrok a zúčastňujúcich sa programu autológneho
darcovstva krvi sa používanie epoetínu alfa neodporúča.
Fertilita
Nie sú k dispozícii žiadne údaje o plodnosti.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abseamed nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov s nádorovým ochorením a chronickým zlyhaním obličiek je najčastejšou nežiaducou
reakciou počas liečby epoetínom alfa zvýšenie krvného tlaku v závislosti od dávky alebo zhoršenie
existujúcej hypertenzie. Odporúča sa monitorovanie krvného tlaku, obzvlášť na začiatku liečby (pozri časť 4.4). Medzi ďalšie časté nežiaduce reakcie pozorované v klinických štúdiách epoetínu alfa patria trombóza hlbokých žíl, pľúcna embólia, kŕče, hnačka, nevoľnosť, bolesť hlavy, ochorenie podobné chrípke, pyrexia, vyrážky a vracanie. Najmä na začiatku liečby sa môže vyskytnúť ochorenie podobné chrípke vrátane bolestí hlavy, artralgie, myalgie a pyrexie. Frekvencie sa môžu líšiť v závislosti od indikácie (pozri tabuľku nižšie).
V štúdiách s predĺženým intervalom dávkovania u dospelých pacientov s renálnou insuficienciou, ktorí ešte nepodstupujú dialýzu, bolo hlásené upchatie dýchacích ciest, čo zahŕňa výskyt upchatia horných dýchacích ciest, upchatý nos a nazofaryngitídu.
Závažné nežiaduce liekové reakcie zahŕňajú venóznu a arteriálnu trombózu a embóliu (vrátane niektorých končiacich úmrtím), ako napríklad trombóza hlbokých žíl, pľúcna embólia, arteriálna trombóza (vrátane infarktu myokardu a ischémie myokardu), trombóza sietnice a trombóza cievnej spojky (vrátane dialyzačného zariadenia). Okrem toho boli hlásené v klinických štúdiách epoetínu alfa mozgovocievne príhody (vrátane mozgového infarktu a mozgového krvácania) a prechodné ischemické ataky.
Bola hlásená aneuryzma.
Boli hlásené reakcie z precitlivenosti vrátane výskytu vyrážok, žihľavky, anafylaktickej reakcie
a angioneurotického edému.
Počas liečby epoetínom alfa u pacientov s predchádzajúcim normálnym alebo nízkym krvným tlakom sa vyskytovala aj hypertenzívna kríza s encefalopatiou a kŕčmi vyžadujúca okamžitú liečbu
a hospitalizáciu na jednotke intenzívnej starostlivosti. Zvláštna pozornosť sa má venovať náhlym
bolestiam hlavy podobným záchvatom migrény, nakoľko môže ísť o možný varovný signál.
Čistá aplázia červených krviniek sprostredkovaná protilátkami bola pozorovaná veľmi zriedkavo
(v < 1/10 000 prípadov za pacient-rok) po mesiacoch až rokoch liečby epoetínom alfa (pozri časť 4.4).
Celkový bezpečnostný profil epoetínu alfa bol vyhodnocovaný u 142 pacientov s chronickým
zlyhaním obličiek a u 765 pacientov s rakovinou, ktorí sa zúčastnili placebom kontrolovaných, dvojito zaslepených klinických registračných štúdií. Nežiaduce liekové reakcie hlásené u ≥ 0,2 % pacientov
liečených epoetínom alfa v týchto štúdiách, ďalších klinických štúdiách a z postmarketingových
skúseností sú uvedené nižšie podľa tried orgánových systémov a frekvencie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej
časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Čistá aplázia červených krviniek sprostredkovaná erytropoetínovými protilátkami1
Trombocytémia (pacienti s chronickým zlyhaním obličiek)
 Poruchy imunitného systému
Poruchy imunitného systému Frekvencia nie je známa Anafylaktická reakcia
Precitlivenosť
 Poruchy nervového systému
Poruchy nervového systému Veľmi časté Bolesť hlavy (pacienti
s nádorovým ochorením)
Časté Kŕče (pacienti s chronickým
zlyhaním obličiek) Bolesť hlavy (pacienti
s chronickým zlyhaním
obličiek) Mŕtvica
Menej časté Mozgové krvácanie2
Kŕče (pacienti s nádorovým ochorením)
Frekvencia nie je známa Mozgovocievna príhoda2
Hypertenzívna encefalopatia
Prechodné ischemické ataky
 Poruchy oka
Poruchy oka Frekvencia nie je známa Trombóza sietnice
 P
oruchy srdca a srdcovej
činnosti
P
oruchy srdca a srdcovej
činnosti
Frekvencia nie je známa Infarkt myokardu
 P
oruchy ciev
P
oruchy ciev Časté Trombóza hlbokých
žíl2 (pacienti s nádorovým ochorením)
Hypertenzia
Frekvencia nie je známa Trombóza hlbokých
žíl2 (pacienti s chronickým
zlyhaním obličiek)
Arteriálna trombóza
Hypertenzívna kríza
 P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Pľúcna embólia2 (pacienti s nádorovým ochorením)
Frekvencia nie je známa Pľúcna embólia2 (pacienti s chronickým zlyhaním
obličiek)

Veľmi časté Nevoľnosť
Časté Hnačka (pacienti s nádorovým ochorením)
Vracanie
Menej časté Hnačka (pacienti s chronickým

zlyhaním obličiek) Časté Vyrážky
Frekvencia nie je známa Angioneurotický edém
Urtikária

Veľmi časté Artralgia (pacienti s chronickým
zlyhaním obličiek)
Časté Artralgia (pacienti s nádorovým ochorením)

Menej časté Myalgia (pacienti s nádorovým ochorením)

 T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Frekvencia nie je známa Myalgia (pacienti s chronickým
zlyhaním obličiek)
 V
rodené, familiárne
V
rodené, familiárne
Frekvencia nie je známa Porfýria
a genetické poruchy
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné
Veľmi časté Pyrexia (pacienti s nádorovým ochorením)
Ochorenie podobné chrípke
(pacienti s chronickým
zlyhaním obličiek)
Časté Ochorenie podobné chrípke (pacienti s nádorovým ochorením)
Frekvencia nie je známa Neúčinnosť látky
Periférny edém
Pyrexia (pacienti s chronickým
zlyhaním obličiek)
Reakcia v mieste injekcie

Frekvencia nie je známa Pozitívny test na
vyšetrenia
antierytropoetínovú protilátku
1
Ú
razy, otravy a komplikácie
li
e
čebného postupu
Časté Trombóza cievnej spojky vrátane dialyzačného zariadenia (pacienti s chronickým
zlyhaním obličiek)

1Frekvencia sa nedá stanoviť z klinických štúdií
2 Vrátane prípadov končiacich smrťou.
Opis niektorých nežiaducich reakciíPacienti s chronickýmzlyhanímobličiekU pacientov s chronickým zlyhaním obličiek môžu hladiny hemoglobínu vyššie než 12 g/dl
(7,5 mmol/l) súvisieť s vyšším rizikom kardiovaskulárnych udalostí vrátane úmrtia (pozri časť 4.4).
U hemodialyzovaných pacientov sa vyskytovala trombóza cievnej spojky, najmä u tých so sklonom k hypotenzii alebo s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.) (pozri časť 4.4).
Pacienti s nádorovým ochorenímU pacientov s nádorovým ochorením dostávajúcich ESA vrátane epoetínu alfa bol pozorovaný
zvýšený výskyt tromboembolických udalostí (pozri časť 4.4).
Pacienti po chirurgických zákrokochU pacientov pred plánovanou rozsiahlou ortopedickou operáciou s východiskovou hodnotou
hemoglobínu 10 až 13 g/dl (6,2 až 8,1 mmol/l) bol výskyt trombovaskulárnych príhod (väčšina z nich bola trombóza hlbokých žíl) v celkovej populácii pacientov v klinickom skúšaní, ktorým sa podávali rôzne dávky epoetínu alfa, podobný ako v skupine s placebom, i keď klinické skúsenosti sú obmedzené.
Navyše u pacientov s východiskovou hodnotou hemoglobínu > 13 g/dl (8,1 mmol/l) nemožno vylúčiť možnosť, že liečba epoetínom alfa môže byť spojená so zvýšeným rizikom pooperačných trombovaskulárnych príhod.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieTerapeutické rozpätie dávok epoetínu alfa je veľmi široké. Predávkovanie epoetínom alfa môže zvýrazniť farmakologické účinky hormónu. Ak sa zistia príliš vysoké hladiny hemoglobínu alebo hematokritu, môže sa vykonať flebotómia. V prípade potreby sa majú vykonať ďalšie podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné antianemiká, ATC kód: B03XA01
Abseamed je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Mechanizmus účinkuErytropoetín je glykoproteín, ktorý ako faktor stimulujúci mitózu a hormonálnu diferenciáciu
stimuluje tvorbu erytrocytov z prekurzorov časti kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 až 40 000 daltonov. Proteínová frakcia tvorí okolo 58 % a skladá sa zo 165 aminokyselín. K proteínovej časti sú pripojené štyri sacharidové reťazce pomocou troch N-glykozidových väzieb a jednej O-glykozidovej väzby. Epoetín alfa získaný génovou technológiou je glykozylovaný a svojím zložením aminokyselín a uhľohydrátov je identický s endogénnym ľudským erytropoetínom, ktorý bol izolovaný z moču anemických pacientov.
Abseamed sa vyznačuje najvyššou čistotou, akú je možné v súčasnosti dosiahnuť. Obzvlášť pri koncentráciách liečiva používaných u ľudí nie sú detekovateľné žiadne rezíduá bunkovej línie použitej pri výrobe.
Farmakodynamické účinkyBiologická účinnosť epoetínu alfa bola dokázaná na rôznych zvieracích modeloch v
in vivopodmienkach (normálne a anemické potkany, myši s polycytémiou). Po podaní epoetínu alfa stúpa
počet erytrocytov, hodnota hemoglobínu a počet retikulocytov, rovnako ako rýchlosť inkorporácie
59Fe.
Zvýšenie inkorporácie 3H-tymidínu do erytroidných buniek sleziny obsahujúcich jadrá bolo zistené
in vitro (bunková kultúra sleziny myší) po inkubácii s epoetínom alfa.
Klinická účinnosť abezpečnosťS pomocou kultúry buniek ľudskej kostnej drene sa preukázalo, že epoetín alfa špecificky stimuluje
erytropoézu a neovplyvňuje leukopoézu. Cytotoxické účinky epoetínu alfa na bunky sa nezistili.
Do troch placebom kontrolovaných štúdií bolo zaradených 721 pacientov s nádorovým ochorením,
ktorí boli liečení chemoterapiou bez platiny, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s non-Hodgkinovým lymfómom a 24 s inými hematologickými malignitami) a 332 s pevnými nádormi (172 s nádormi prsníka, 64 s
gynekologickými nádormi, 23 s nádormi pľúc, 22 s nádormi prostaty, 21 s gastrointestinálnymi
nádormi a 30 s inými typmi nádorov). Do dvoch veľkých, otvorených štúdií bolo zaradených
2 697 pacientov s nádorovým ochorením, ktorí boli liečení chemoterapiou bez platiny, z toho
1 895 pacientov s pevnými nádormi (683 s nádormi prsníka, 260 s nádormi pľúc, 174 s gynekologickými nádormi, 300 s gastrointestinálnymi nádormi a 478 s inými typmi nádorov)
a 802 s hematologickými malignitami.
V prospektívnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní uskutočnenom s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami, ktorí boli liečení chemoterapiou bez platiny, sa pozorovalo významné zníženie následkov spojených s anémiou (napr. únava, zníženie výkonnosti, znížená aktivita), čo sa stanovilo s použitím nasledujúcich dotazníkov a stupníc: všeobecná stupnica pre funkčné vyhodnotenie anémie pri protirakovinovej liečbe (Functional Assessment of Cancer Therapy-Anaemia – FACT-An), stupnica únavy FACT-An a rakovinová lineárna analógová stupnica (Cancer Linear Analogue Scale – CLAS). V dvoch iných menších, randomizovaných, placebom kontrolovaných klinických skúšaniach sa nepreukázalo významné zlepšenie parametrov kvality života podľa stupnice EORTC-QLQ-C30 resp. CLAS.
Erytropoetín je rastový faktor, ktorý v prvom rade stimuluje tvorbu červených krviniek. Na povrchu rôznych nádorových buniek sa môžu nachádzať receptory pre erytropoetín.
Prežívanie a progresia nádorových ochorení sa skúmali v piatich veľkých kontrolovaných štúdiách zahŕňajúcich spolu 2 833 pacientov, z ktorých štyri boli dvojito zaslepené, placebom kontrolované štúdie a jedna štúdia bola s odkrytým označením. Štúdií sa zúčastňovali buď pacienti, ktorí boli liečení pomocou chemoterapie (dve štúdie) alebo populácie pacientov, u ktorých nie sú indikované látky stimulujúce erytropoézu: anémia u pacientov s nádorovým ochorením, ktorí nie sú liečení chemoterapiou a pacienti s nádorovým ochorením hlavy a krku, ktorí sú liečení ožarovaním. Cieľová hladina hemoglobínu v dvoch štúdiách bola > 13 g/dl (8,1 mmol/l), v zostávajúcich troch štúdiách bola
12-14 g/dl (7,5-8,7 mmol/l). V štúdii s odkrytým označením nebol žiadny rozdiel v celkovom prežívaní medzi pacientmi liečenými pomocou rekombinantného ľudského erytropoetínu a kontrolnými látkami. V štyroch placebom kontrolovaných štúdiách dosahovali miery rizika pre celkové prežívanie hodnoty 1,25 až 2,47 v prospech kontrolnej skupiny. Tieto štúdie preukázali konzistentnú nevysvetlenú štatisticky významnú nadmernú úmrtnosť u pacientov, ktorí mali anémiu súvisiacu s rôznymi bežnými druhmi karcinómov a dostávali rekombinantný ľudský erytropoetín, v porovnaní s kontrolnou skupinou. Celkový výsledok prežívania v štúdiách sa nepodarilo uspokojivo vysvetliť na základe rozdielov vo výskyte trombózy a súvisiacich komplikácií medzi pacientmi, ktorým sa podával rekombinantný ľudský erytropoetín, a pacientmi v kontrolnej skupine.
Bola vykonaná aj analýza údajov na úrovni pacientov u viac než 13 900 pacientov s rakovinou
(chemoterapia, rádioterapia, chemorádioterapia alebo žiadna terapia) zúčastňujúcich sa
53 kontrolovaných klinických štúdií zahŕňajúcich viacero epoetínov. Metaanalýza celkových údajov o
prežívaní poskytla odhadovanú mieru rizika na úrovni 1,06 v prospech kontrolnej skupiny (95 % IS:
1,00, 1,12; 53 štúdií a 13 933 pacientov) a pre pacientov s rakovinou dostávajúcich chemoterapiu bola miera rizika pre celkové prežívanie 1,04 (95 % IS: 0,97, 1,11; 38 štúdií a 10 441 pacientov). Metaanalýzy tiež naznačujú konzistentne významne zvýšené relatívne riziko tromboembolických udalostí u pacientov s rakovinou dostávajúcich rekombinantný ľudský erytropoetín (pozri časť 4.4).
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a hladinou hemoglobínu ≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová hladina hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,89 (0,74; 1,08), infarkt myokardu (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
5.2 Farmakokinetické vlastnosti
A
bsorpcia
Biologická dostupnosť subkutánne podaného epoetínu alfa je oveľa nižšia ako po intravenóznom
podaní lieku: približne 20 %.
Eliminácia
Intravenózne podávanie
Zistilo sa, že po opakovanom intravenóznom podávaní epoetínu alfa bol polčas rozpadu približne
4 hodiny u zdravých dobrovoľníkov a u pacientov so zlyhaním činnosti obličiek bol polčas rozpadu
o niečo dlhší, približne 5 hodín. U detí bol zaznamenaný polčas rozpadu približne 6 hodín.
Subkutánne podávanie
Po subkutánnej injekcii sú hladiny epoetínu alfa v sére oveľa nižšie ako hladiny dosiahnuté po
intravenóznej injekcii, hladiny stúpajú pomaly a maximálne hodnoty sa dosahujú po 12 až
18 hodinách po podaní dávky. Maximálna hladina po subkutánnej injekcii je vždy výrazne nižšia ako maximálna hladina po intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii, hladiny zostávajú nezmenené, či už 24 hodín po podaní prvej injekcie alebo 24 hodín po podaní poslednej injekcie.
Polčas rozpadu sa určuje ťažšie pri subkutánnom podaní a odhaduje sa približne na 24 hodín.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách vykonávaných na psoch a potkanoch, ale nie na opiciach, bola liečba epoetínom alfa spojená so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známou komplikáciou pri chronickom zlyhaní činnosti obličiek u ľudí a môže súvisieť so sekundárnym hyperparatyreoidizmom alebo s neznámymi faktormi. Výsledky štúdie
nepotvrdili zvýšený výskyt fibrózy kostnej drene u hemodialyzovaných pacientov liečených epoetínom alfa počas 3 rokov v porovnaní so zodpovedajúcou kontrolnou skupinou dialyzovaných
pacientov liečených epoetínom alfa).
V štúdiách vykonávaných na zvieratách sa preukázalo, že epoetín alfa znižuje telesnú hmotnosť plodu, oneskoruje osifikáciu a zvyšuje mortalitu plodov, keď sa podáva v týždenných dávkach približne 20- krát vyšších, než je odporúčaná týždenná dávka u ľudí. Tieto zmeny sa považujú za sekundárne z dôvodu úbytku telesnej hmotnosti matky.
Epoetín alfa nepreukázal žiadne zmeny v testoch mutagénnosti na bunkových kultúrach baktérií a cicavcov a v in vivo mikronukleovom teste u myší.
Dlhodobé štúdie karcinogénnosti sa doposiaľ nevykonali. V literatúre sa vyskytujú sporné údaje
o tom, či môžu erytropoetíny zohrávať dôležitú úlohu pri proliferácii nádorov. Tieto údaje sú založené
na in vitro zisteniach zo vzoriek ľudských nádorov, ale ich klinický význam je nejednoznačný.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát dihydrogénfosforečnanu sodného dihydrát fosforečnanu disodného
chlorid sodný glycín polysorbát 80
voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2°C – 8°C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre účely ambulantného použitia môže pacient vybrať Abseamed z chladničky a uchovávať ho pri
teplote neprevyšujúcej 25°C maximálne 3 dni bez prerušenia.
6.5 Druh obalu a obsah balenia
1 ml roztoku v naplnených injekčných striekačkách (sklenené typu I), s ochranným krytom ihly alebo bez neho, s piestovou zátkou (teflónová guma) zatavené v pretlačovacom balení.
Balenia po 1, 4 alebo 6 kusoch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Abseamed sa nemá používať a má sa zlikvidovať
- ak je tekutina sfarbená alebo vidno v nej plávať častice,
- ak je tesnenie porušené,
- ak viete, alebo si myslíte, že roztok bol nechtiac zmrazený, alebo
- ak došlo k poruche chladničky.
Naplnené injekčné striekačky sú pripravené k použitiu (pozri časť 4.2). Naplnenú injekčnú striekačku nepretrepávajte. Injekčné striekačky sú opatrené vytlačenou odmerkou, aby bolo možné čiastočné použitie, ak treba. Každá odmerka zodpovedá objemu 0,1 ml. Tento liek je určený iba na jedno použitie. Z každej injekčnej striekačky odoberte iba jednu dávku Abseamedu a nepotrebný roztok pred injekciou zlikvidujte.
Použitie naplnenej injekčnej striekačky s ochranným krytom ihly
Ochranný kryt chráni ihlu po injekcii, aby sa zabránilo poraneniu ihlou. Normálna funkcia injekčnej
ihly tým nie je ovplyvnená. Pomaly a rovnomerne stláčajte piest, až kým sa nepodá celá dávka a piest
sa už nebude dať zatlačiť ďalej. Ďalej tlačte na piest a zároveň vytiahnite ihlu injekčnej striekačky
z pacienta. Ochranný kryt ihly chráni ihlu pri uvoľňovaní piesta.
Použitie naplnenej injekčnej striekačky bez ochranného krytuihly
Podajte dávku štandardným spôsobom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37
D-58638 Iserlohn
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/07/412/025
EU/1/07/412/026
EU/1/07/412/051
EU/1/07/412/052
EU/1/07/412/055
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. august 2007
Dátum posledného predĺženia registrácie: 15. júna 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.