
ať pacientom, u ktorých
sa po podaní kyseliny acetylsalicylovej alebo iných NSAID vyvinuli prejavy astmy, nosové polypy, angioneurotický edém alebo urtikária.
• Tretí trimester tehotenstva (pozri časť 4.6).
• Zákrok aortokoronárneho premostenia (CABG) (pozri časť 4.4).
• Závažné zlyhanie srdca (pozri časť 4.4).
• Závažná porucha funkcie pečene (pozri časť 4.4).
• Závažné zlyhanie obličiek bez dialýzy (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Bezpečnosť a účinnosť neboli stanovené pri veľkých chirurgických zákrokoch vrátane abdominálnych, vaskulárnych a torakálnych chirurgických zákrokov (pozri časť 5.1). Neodporúča sa používať tento
liek pri veľkých chirurgických zákrokoch.
Systémová toxicita lokálnych anestetík(LocalAnaestheticSystemicToxicity, LAST)
Keďže existuje potenciálne riziko vzniku závažných, život ohrozujúcich nežiaducich reakcií
súvisiacich s podaním bupivakaínu, všetky lieky obsahujúce bupivakaín sa majú podávať v prostredí, v ktorom je dostupný vyškolený personál a vybavenie na rýchlu liečbu pacientov, u ktorých sa
prejavia príznaky neurologickej alebo srdcovej toxicity.
Bupivakaín môže, ak je použitý pri lokálnych anestetických výkonoch, vedúcich k vysokým koncentráciám liečiva v krvi, spôsobiť akútne toxické účinky na centrálny nervový a kardiovaskulárny systém. Je to hlavne v prípade neúmyselného intravaskulárneho podania alebo injekcie do vysoko prekrvených oblastí. Pri vysokých systémových koncentráciách bupivakaínu sa hlásili komorová arytmia, komorová fibrilácia, náhly kardiovaskulárny kolaps a smrť. Zodpovedný lekár má prijať potrebné opatrenia na zabránenie systémovej toxicite lokálnych anestetík (pozri časť 4.2).
Pacienti vyžadujúci špeciálnu pozornosť na zníženie rizika vzniku nebezpečných nežiaducich reakcií zahŕňajú nasledujúcich pacientov:
• starší pacienti a pacienti vo všeobecne zlom zdravotnom stave, ktorým sa má podať znížená dávka zodpovedajúca ich fyzickému stavu,
• pacienti s čiastočnou alebo úplnou srdcovou blokádou - kvôli skutočnosti, že lokálne anestetiká môžu potlačiť vedenie vzruchu myokardu,
• pacienti s pokročilým ochorením pečene alebo závažnou renálnou dysfunkciou.
Toxické účinky lokálnych anestetík sú aditívne a majú sa podávať s opatrnosťou, vrátane sledovania neurologických a kardiovaskulárnych účinkov súvisiacich s LAST.
Kardiovaskulárny systém
Klinické skúšania a epidemiologické údaje naznačujú, že používanie niektorých NSAID (hlavne vo
vysokých dávkach a pri dlhodobej liečbe) môže súvisieť s mierne zvýšeným rizikom arteriálnych trombotických príhod (napríklad infarktu myokardu alebo cievnou mozgovou príhodou). Nie je
k dispozícii dostatočné množstvo údajov na vylúčenie tohto rizika pre liek Zynrelef. U pacientov
s nedávnym infarktom myokardu sa treba vyhnúť použitiu Zynrelefu, ak sa neočakáva, že prínosy budú prevyšovať riziko vzniku opätovných kardiovaskulárnych trombotických príhod.
Pacienti s nekontrolovanou hypertenziou, kongestívnym zlyhaním srdca, stanoveným ischemickým ochorením srdca, ochorením periférnych artérií a/alebo cerebrovaskulárnym ochorením majú byť liečení Zynrelefom len po starostlivom zvážení.
Gastrointestinálny systém
Gastrointestinálne (GI) krvácanie, ulcerácia alebo perforácia, ktoré môžu byť fatálne, sa hlásili pre
všetky NSAID a kedykoľvek počas liečby, s varovnými príznakmi alebo bez nich alebo so závažnými
GI príhodami v anamnéze. Keďže Zynrelef obsahuje meloxikam, ktorý je NSAID, zdravotnícki
pracovníci majú pozorne sledovať prejavy a príznaky GI ulcerácie a krvácania. Ak existuje podozrenie na závažnú GI nežiaducu reakciu, má sa urýchlene zahájiť vyšetrenie a liečba.
Riziko GI krvácania, ulcerácie alebo perforácie sa zvyšuje so zvyšujúcou sa dávkou NSAID
u pacientov s vredom v anamnéze a u starších pacientov. U týchto pacientov ako aj u pacientov vyžadujúcich súbežnú liečbu nízkymi dávkami kyseliny acetylsalicylovej alebo iných liečiv, ktoré
môžu zvýšiť GI riziko, sa má zvážiť kombinovaná liečba ochrannými liekmi (napr. mizoprostol alebo
inhibítory protónovej pumpy) (pozri nižšie a časť 4.5).
Pacienti s GI toxicitou v anamnéze, predovšetkým starší pacienti, majú byť poučení, aby hlásili akékoľvek neobvyklé abdominálne príznaky (hlavne GI krvácanie).
Opatrnosť sa odporúča u pacientov súbežne liečených liekmi, ktoré by mohli zvýšiť riziko ulcerácie alebo krvácania, ako sú heparín, antikoagulanciá ako je warfarín alebo iné NSAID, vrátane kyseliny acetylsalicylovej podávanej v protizápalových dávkach (≥ 1 g ako jednorazová dávka alebo ≥ 3 g ako celkové denné množstvo) (pozri časť 4.5).
Závažné kožné reakcie
V súvislosti s používaním meloxikamu boli hlásené život ohrozujúce kožné reakcie (Stevensov-
Johnsonov syndróm [SJS] a toxická epidermálna nekrolýza [TEN]). Pacientov treba upozorniť na prejavy a príznaky a pozorne u nich sledovať kožné reakcie. Najvyššie riziko výskytu SJS alebo TEN je v prvých týždňoch liečby. Ak sa u pacienta v súvislosti s používaním meloxikamu vyvinuli SJS alebo TEN, Zynrelef sa u tohto pacienta nesmie nikdy podávať.
Sledovanie funkcie pečene a obličiek
V súvislosti s používaním meloxikamu sa hlásili príležitostné zvýšenia hladiny transaminázy v sére,
zvýšenia hladiny bilirubínu v sére alebo zvýšenia iných parametrov funkcie pečene, ako aj zvýšenia hladiny kreatinínu v sére a hladiny močovinového dusíka v krvi a ďalšie laboratórne poruchy. Vo
väčšine týchto prípadov to boli prechodné a mierne abnormality. Pacientov je potrebné sledovať ohľadne prejavov zhoršenia funkcie pečene alebo obličiek.
Renálna toxicita a porucha funkcie obličiek
Renálna toxicita sa pozorovala u pacientov, u ktorých mali renálne prostaglandíny kompenzačnú
úlohu pri udržiavaní renálnej perfúzie. U týchto pacientov môže podávanie NSAID spôsobiť zníženie tvorby prostaglandínov závislé od dávky a sekundárne renálny prietok krvi, čo môže urýchliť zjavnú
renálnu dekompenzáciu. Pacienti s najvyšším rizikom tejto reakcie sú pacienti s poruchou funkcie
obličiek, nefrotickým syndrómom, lupusovou nefropatiou, dehydratovaní pacienti, pacienti
s hypovolémiou, srdcovým zlyhaním, závažnou dysfunkciou pečene, pacienti užívajúci diuretiká, inhibítory angiotenzín konvertujúceho enzýmu (ACE) alebo antagonisty angiotenzínu-II a starší pacienti.
U pacientov s poruchou funkcie obličiek alebo pečene, srdcovým zlyhaním, u dehydratovaných pacientov alebo u pacientov s hypovolémiou sa má po podaní Zynrelefu sledovať funkcia obličiek.
Renálne účinky meloxikamu môžu urýchliť progresiu renálnej dysfunkcie u pacientov s existujúcim ochorením obličiek.
Nie sú k dispozícii žiadne informácie z kontrolovaných klinických štúdií týkajúce sa používania meloxikamu u pacientov s pokročilým ochorením obličiek. Keďže niektoré metabolity meloxikamu sa vylučujú obličkami, používanie Zynrelefu sa neodporúča u pacientov so závažnou poruchou funkcie obličiek na dialýze, okrem prípadov, pri ktorých sa očakáva, že prínosy budú prevyšovať riziko zhoršenia funkcie obličiek. Zynrelef je kontraindikovaný u pacientov so závažnou poruchou funkcie obličiek, ktorí nie sú na dialýze (pozri časť 4.3).
Porucha funkcie pečene
Keďže bupivakaín sa metabolizuje v pečeni, u pacientov s ochorením pečene sa majú vysoké dávky
podávať opatrne. Pacienti so závažným ochorením pečene majú kvôli neschopnosti normálne metabolizovať lokálne anestetiká vyššie riziko rozvoja toxických plazmatických koncentrácií. Používanie Zynrelefu u pacientov so závažnou poruchou funkcie pečene je kontraindikované (pozri časť 4.3).
Hyperkaliémia
Pri liečbe meloxikamom sa hlásili zvýšené koncentrácie draslíka v sére u pacientov s diabetom alebo
u pacientov dostávajúcich súbežnú liečbu, o ktorej je známe, že zvyšuje koncentrácie draslíka.
Zynrelef sa má u pacientov s hyperkaliémiou používať len ak prínosy prevyšujú riziká.
Chondrolýza
U pacientov dostávajúcich pooperačné intraartikulárne nepretržité infúzie lokálnych anestetík sa po
uvedení liekov na trh sa hlásil výskyt chondrolýzy. Väčšina hlásených prípadov chondrolýzy sa týkala
ramenného kĺbu. Z dôvodu mnohých prispievajúcich faktorov a sporných informácií týkajúcich sa mechanizmu účinku vo vedeckej literatúre sa súvislosť nestanovila. Intraartikulárnej nepretržitej infúzii Zynrelefu je potrebné sa vyhnúť.
Zhoršené hojenie rán
U pacientov po bunionektómii sa pozorovalo zhoršené hojenie rán (pozri časť 4.8). Pri malých,
uzavretých miestach chirurgického zákroku sa vyhnite podaniu nadmerného objemu (pozri časť 4.2).
4.5 Liekové a iné interakcie
Bupivakaín
Bupivakaín sa má používať opatrne u pacientov dostávajúcich iné lokálne anestetiká alebo liečivá
štrukturálne podobné lokálnym anestetikám amidového typu, napr. niektoré antiarytmiká ako je lidokaín a mexiletín, pretože systémové toxické účinky sa sčítajú (pozri časť 4.4).
Meloxikam
Inhibítory ACE, antagonisti angiotenzínu II
NSAID môžu znižovať antihypertenzný účinok inhibítorov ACE, antagonistov angiotenzínu II alebo betablokátorov (vrátane propanololu).
U starších pacientov, pacientov s hypovolémiou (vrátane pacientov s diuretickou liečbou) alebo poruchou funkcie obličiek môže súbežné podávanie NSAID s inhibítormi ACE alebo antagonistami angiotenzínu II viesť k zhoršeniu funkcie obličiek vrátane možného akútneho zlyhania obličiek, ktoré je zvyčajne reverzibilné.
Pacientov liečených inhibítormi ACE, antagonistami angiotenzínu II alebo betablokátormi je potrebné po liečbe Zynrelefom sledovať, aby sa zaistilo dosiahnutie želaného krvného tlaku. Starších pacientov, pacientov s hypovolémiou alebo poruchou funkcie obličiek je potrebné sledovať ohľadne prejavov zhoršenia funkcie obličiek. (pozri časť 4.4).
Diuretiká
U pacientov liečených diuretikami je okrem zaistenia účinnosti diuretika, vrátane antihypertenzného účinku, potrebné po liečbe Zynrelefom aj sledovanie prejavov zhoršenia funkcie obličiek.
Lítium
Pre NSAID sa hlásilo zvýšenie hladín lítia v krvi (prostredníctvom zníženého vylučovania lítia obličkami), ktoré môže dosiahnuť toxické hodnoty. Súbežné používanie lítia a NSAID sa neodporúča. Ak je používanie Zynrelefu spolu s lítiom nevyhnutné, pacientov je po liečbe Zynrelefom potrebné sledovať ohľadne prejavov toxicity spôsobenej lítiom.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii ľudské údaje o použití Zynrelefu u gravidných žien.
Bupivakaín
Je iba obmedzené množstvo údajov o použití bupivakaínu u gravidných žien. Štúdie na zvieratách preukázali znížené prežívanie mláďat a embryotoxické účinky (pozri časť 5.3).
Meloxikam
Inhibícia syntézy prostaglandínu môže nepriaznivo ovplyvniť tehotenstvo a/alebo embryofetálny vývoj. Údaje z epidemiologických štúdií naznačujú zvýšené riziko potratu a srdcových malformácií
a gastroschízy po použití inhibítora syntézy prostaglandínu v skorom štádiu tehotenstva. Absolútne riziko vzniku kardiovaskulárnych malformácií sa zvýšilo z menej ako 1 % až na približne 1,5 %.
Predpokladá sa zvyšovanie rizika s dávkou a trvaním liečby. U zvierat sa preukázalo, že podávanie inhibítorov syntézy prostaglandínu má za následok zvýšený výskyt pred- a poimplantačných potratov a zvýšenú embyrofetálnu úmrtnosť. Okrem toho sa u zvierat, ktorým sa podával inhibítor syntézy
prostaglandínov počas organogenetického štádia, hlásil zvýšený výskyt rôznych malformácií, vrátane kardiovaskulárnych.
Počas tretieho trimestra gravidity môžu všetky inhibítory syntézy protaglandínov vystaviť plod nasledujúcemu:
• kardioplumonárnej toxicite (s predčasným uzavretím ductus arteriosus a pulmonálnou hypertenziou),
• renálnej dysfunkcii, ktorá môže pokročiť do zlyhania obličiek s oligohydroamniózou.
Na konci gravidity môžu všetky inhibítory syntézy prostaglandínov vystaviť matku a plod
nasledujúcemu:
• možnému predĺženiu času krvácania, antiagregačnému účinku, ktorý sa môže vyskytnúť aj po veľmi nízkych dávkach,
• inhibícii kontrakcií maternice vedúcich k oneskorenému alebo predĺženému pôrodu.
Ak sa Zynrelef používa u žien, ktoré sa snažia otehotnieť, alebo počas prvého alebo druhého trimestra gravidity, má sa použiť čo najnižšia možná dávka a čo najkratší čas liečby.
Kvôli obsahu meloxikamu je Zynrelef kontraindikovaný počas tretieho trimestra gravidity (pozri časť 4.3). Počas prvého a druhého trimestra gravidity sa meloxikam má podávať len ak to je úplne nevyhnutné.
Dojčenie
K dispozícii nie sú žiadne ľudské údaje o použití Zynrelefu u dojčiacich žien.
Bupivakaín prechádza do ľudského mlieka a o NSAID je tiež známe, že prechádzajú do ľudského mlieka. Rozhodnutie, či začať alebo ukončiť dojčenie sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby Zynrelefom pre matku.
Fertilita
Nevykonali sa štúdie hodnotiace účinky Zynrelefu na mužskú a ženskú fertilitu.
Používanie meloxikamu môže zhoršiť fertilitu u žien, ktoré sa snažia otehotnieť. U žien, ktoré majú ťažkosti s otehotnením alebo ktoré podstupujú vyšetrenie fertility sa má Zynrelef použiť, len ak prínosy prevyšujú riziká.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeBupivakaín má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Zynrelef môže mať veľmi slabý účinok na mentálnu funkciu a koordináciu, a to aj v neprítomnosti zjavnej toxicity na centrálny nervový systém (CNS) a môže dočasne zhoršiť pohybovú funkciu a znížiť ostražitosť.
4.8 Nežiaduce účinkyZhrnutie bezpečnostného profiluNajčastejšou nežiaducou reakciou bol závrat (15,1 %).
Tabuľkový zoznamnežiaducichreakciíNasledujúce nežiaduce reakcie sa zakladajú na skúsenostiach z klinických skúšaní a sú uvedené podľa
triedy orgánových systémov a frekvencie v tabuľke 1 nižšie. V rámci každej kategórie frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti. Frekvencia nežiaducich reakcií je vyjadrená
podľa nasledujúcich kategórií: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10).
Tabuľka 1: Nežiaduce reakcie hlásené pre ZynrelefTrieda orgánových systémov
| Veľmi časté
| Časté
|
Poruchy nervového systému
| závraty
| dysgeúzia
|
Poruchy srdca a srdcovej činnosti
|
| bradykardia
|
Poruchy ciev
|
| hypotenzia
|
Poruchy kože a podkožného tkaniva
|
| abnormálny pach kože
|
Celkové poruchy a reakcie v mieste podania
|
| celulitída,
zhoršené hojenie rán*,
reakcia v mieste aplikácie, opuch miesta aplikácie, erytém v mieste aplikácie, periférny opuch
|
* U pacientov po bunionektómii sa pozorovalo zhoršené hojenie rán vrátane dehiscencie rany (model
chirurgického zákroku s malým, ukrytým miestom dostupným na instiláciu lieku).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieBupivakaínNáhodné intravaskulárne injekcie bupivakaínu môžu spôsobiť okamžité (do niekoľkých sekúnd až
minút) systémové toxické reakcie. V prípade predávkovania sa systémová toxicita objaví neskôr
(15-60 minút po injekcii) z dôvodu pomalého zvyšovania koncentrácie lokálneho anestetika v krvi.
Akútna systémová toxicitaReakcie systémovej toxicity primárne zahŕňajú CNS a kardiovaskulárny systém.
Toxické účinky na centrálny nervový systému Toxické účinky na CNS sú stupňujúcou sa odpoveďou s príznakmi a prejavmi zvyšujúcej sa závažnosti. Prvými príznakmi sú zvyčajne obvodová parestézia, stŕpnutie jazyka, závrat, hyperakúzia, tinitus a poruchy videnia. Dyzartria, svalové zášklby alebo tras sú závažnejšie a predchádzajú vzniku generalizovaných kŕčov. Tieto prejavy na nesmú pomýliť s neurotickým správaním. Môže nasledovať bezvedomie a rozsiahle kŕče, ktoré môžu trvať od niekoľkých sekúnd do viacerých minút. Po kŕčoch rýchlo dochádza k hypoxii a hyperkarbii spôsobených zvýšenou svalovou aktivitou spojenou
s poruchou dýchania a možnou stratou funkčnosti dýchacích ciest. V ťažkých prípadoch sa môže
vyskytnúť apnoe. Acidóza, hyperkaliémia a hypoxia zvyšujú a rozširujú toxický účinok lokálneho anestetika.
K zotaveniu dochádza redistribúciou lokálneho anestetika z centrálneho nervového systému
a následným metabolizovaním a vylúčením. Zotavenie môže byť rýchle okrem prípadov, keď sa injekčne podali veľké množstvá bupivakaínu.
Toxické účinky na kardiovaskulárny systém
V ťažkých prípadoch sa môžu pozorovať toxické účinky na kardiovaskulárny systém a vo všeobecnosti im predchádzajú prejavy toxických účinkov na centrálny nervový systém. U pacientov pod silnou sedáciou alebo u pacientov, ktorí dostali celkové anestetikum, nemusia byť prítomné predchádzajúce príznaky CNS. Ako výsledok vysokých systémových koncentrácií lokálneho anestetika sa môže vyskytnúť hypotenzia, bradykardia, arytmia a dokonca aj srdcová zástava, avšak v zriedkavých prípadoch sa srdcová zástava vyskytla bez predchádzajúcich účinkov na CNS.
Liečba akútnej toxicity
Ak sa objavia prejavy akútnej systémovej toxicity, podávanie Zynrelefu sa má okamžite zastaviť. Pri prvom prejave toxicity sa má podať kyslík.
Prvý krok liečby kŕčov, ako aj nedostatočného okysličovania a apnoe pozostáva z okamžitej pozornosti na udržanie fungujúcich dýchacích ciest a asistovaného alebo kontrolovaného okysličovania so systémom umelého dýchania umožňujúcim vznik okamžitého pozitívneho tlaku v dýchacích cestách, a to použitím masky. Hneď po podaní týchto dýchacích opatrení sa má vyhodnotiť dostatočná obehová funkcia, pričom treba myslieť na to, že lieky používané na liečbu kŕčov niekedy pri intravenóznom podávaní potláčajú cirkuláciu. Ak napriek dostatočnej podpore
dýchania kŕče pretrvávajú, a ak to povoľuje stav obehovej funkcie, môžu sa intravenózne podať nízke dávky veľmi krátko pôsobiaceho barbiturátu (ako je tiopental alebo tiamylal) alebo benzodiezepínu
(ako je diazepam). Lekár má mať pred použitím anestetika skúsenosti s používaním týchto
antikonvulzív. Podporná liečba cirkulačnej depresie si môže vyžadovať podanie intravenóznych tekutín, a ak je to vhodné, podanie vazopresora podľa klinickej situácie (ako je efedrín na posilnenie
sily kontrakcie myokardu).
Ak sa neliečia okamžite, môžu viesť kŕče a kardiovaskulárna depresia k hypoxii, acidóze, bradykardii, arytmiám a srdcovej zástave. Ak dôjde k srdcovej zástave, má sa podať štandardná kardiopulmonálna resuscitačná liečba.
Ak sa vyskytnú ťažkosti s udržiavaním funkčnosti dýchacích ciest alebo ak je indikovaná dlhšia podpora dýchania (asistovaná alebo kontrolovaná), môže byť po začiatočnom podaní kyslíka prostredníctvom masky indikovaná endotracheálna intubácia, podanie liekov a použitie techník, s ktorými má lekár skúsenosti.
Meloxikam
K dispozícii sú len obmedzené skúsenosti s predávkovaním meloxikamom.
Príznaky po akútnom predávkovaní NSAID sú zvyčajne obmedzené na letargiu, ospalosť, nevoľnosť, zvracanie a epigastrickú bolesť, ktoré sú zvyčajne reverzibilné pomocou podpornej liečby. Môže sa vyskytnúť gastrointestinálne krvácanie. Po predávkovaní sa môžu objaviť anafylaktoidné reakcie.
Po predávkovaní Zynrelefom sa má pacientom podať symptomatická a podporná liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Anestetiká, lokálne anestetiká (amidy), ATC kód: zatiaľ nepridelený
Mechanizmus účinku
Zynrelef je fixnou kombináciou dávky bupivakaínu a meloxikamu s predĺženým uvoľňovaním. Po
aplikácii Zynrelefu na miesto chirurgického zákroku sa približne 72 hodín uvoľňuje bupivakaín
a meloxikam, ktoré sa potom absorbujú do okolitých tkanív. Predpokladá sa, že meloxikam kontroluje zápal tkaniva a tým normalizuje hodnotu pH a posilňuje účinok bupivakaínu, čo vedie k zvýšenej analgézii.
Bupivakaín je lokálne anestetikum amidového typu a anestetickým a analgetickým účinkom. Vo vysokých dávkach vedie k chirurgickej anestézii, zatiaľ čo v nízkych dávkach vytvára senzorickú blokádu (analgéziu) s menej výrazným motorickou blokádou.
Meloxikam je nesteroidný protizápalový liek (NSAID) patriaci do triedy oxikamov s protizápalovými, analgetickými a antipyretickými vlastnosťami. Presný mechanizmus jeho účinku nie je známy. Meloxikam inhibuje biosyntézu prostaglandínov, známych mediátorov zápalu.
Farmakodynamické účinky
Bupivakaín
Bupivakaín spôsobuje reverzibilnú blokádu šírenia impulzov pozdĺž nervových vlákien zabraňovaním toku sodíkových iónov smerom dovnútra cez bunkovú membránu nervových vlákien. Sodíkové kanály
membrány nervových buniek sa považujú za receptory molekúl lokálneho anestetika.
Lokálne anestetiká môžu mať podobné účinky na iné vzrušivé membrány, napr. v mozgu a myokarde. Ak sa do systémového obehu dostane nadmerné množstvo liečiva, môžu sa objaviť príznaky a prejavy toxicity šíriace sa z centrálneho nervového systému a kardiovaskulárneho systému.
Toxické účinky na centrálny nervový systém (pozri časť 4.9) zvyčajne predchádzajú kardiovaskulárnym účinkom, keďže k toxickým účinkom na centrálny nervový systém dochádza pri nižších plazmatických koncentráciách. Priame účinky lokálneho anestetika na srdce zahŕňajú pomalé vedenie vzruchu, negatívny inotropizmus a nakoniec srdcovú zástavu.
Klinická účinnosť abezpečnosť
Účinnosť Zynrelefu sa vyhodnocovala v 2 multicentrických, dvojito zaslepených, aktívne a placebom
kontrolovaných klinických skúšaniach s paralelnými skupinami.
Štúdia 301 (bunionektómia)
Celkom 412 pacientov podstupujúcich unilaterálnu bunionektómiu s osteotómiou a fixáciou
a s lidokaínovou tzv. „Mayo“ blokádou bolo randomizovaných do 1 z nasledujúcich 3 liečebných skupín v pomere 3:3:2 (v uvedenom poradí): Zynrelef 60 mg/1,8 mg, bupivakaín hydrochlorid 50 mg
alebo placebo vo forme fyziologického roztoku. Priemerný vek pacientov bol 47 rokov (rozsah 18 až
77 rokov) a pacienti boli prevažne ženy (86 %). Zynrelef sa aplikoval priamo na miesto chirurgického zákroku na konci zákroku, po záverečnom vypláchnutí a odsatí, avšak pred uzavretím rany.
Bupivakaín hydrochlorid sa podal injekčne a placebo vo forme fyziologického roztoku sa podalo ako
instilácia. Pacienti hodnotili intenzitu bolesti na číselnej hodnotiacej stupnici (Numeric Rating Scale, NRS) od 0 do 10 do 72 hodín po podaní dávky. Pooperačne nebol naplánovaný žiadny režim liekov proti bolesti, avšak pacientom bolo povolené použiť núdzové lieky podľa potreby (10 mg oxykodónu
perorálne každé 4 hodiny, 10 mg morfínu i.v. každé 2 hodiny a/alebo 1 000 mg paracetamolu perorálne každých 6 hodín).
Výsledky primárneho koncového ukazovateľa a všetkých 4 kľúčových sekundárnych koncových ukazovateľov boli pozitívne. Zynrelef významne znížil priemernú hodnotu AUC skóre intenzity bolesti pri aktivite na NRS-A počas 72 hodín po chirurgickom zákroku v porovnaní s placebom vo forme fyziologického roztoku (primárny koncový ukazovateľ) aj bupivakaínom HCl (obrázok 1). Zynrelef tiež významne znížil spotrebu opioidov a významne zvýšil podiel pacientov, ktorí nevyžadovali žiadne pooperačné núdzové lieky vo forme opioidov (boli „bez opioidov“) (tabuľka 2).
Obrázok 1: Priemerná intenzita bolesti počas 72 hodín v štúdii 301 (bunionektómia)
Zynrelef 60 mg/1,8 mg
(N = 157)
Bupivakaín HCl 50 mg
(N = 155)
Placebo vo forme
fyziologického roztoku
(N = 100)


AUC0-72
Zynrelef oproti placebu: p < 0,0001
Zynrelef oproti bupivakaínu HCl: p = 0,0002
Hodiny po aplikácii v štúdii
Tabuľka 2: Používanie opioidov počas 72 hodín v štúdii 301 (bunionektómia)
|
Zynrelef
60 mg/1,8 mg
(N = 157)
|
Bupivakaín
hydrochlorid
50 mg
(N = 155)
| Placebo vo forme fyziologického roztoku
(N = 100)
|
Celková spotreba opioidova
0-72 hodín
| Medián
| 13
| 18
| 25
|
Hodnota p oproti placebu vo forme fyziologického roztoku
|
< 0,0001
|
|
|
Hodnota p oproti bupivakaín hydrochloridu
|
0,0022
|
|
|
Bez opioidov
0-72 hodín
| n (%)
| 45 (29%)
| 17 (11%)
| 2 (2%)
|
Hodnota p oproti placebu vo forme fyziologického roztoku
|
< 0,0001
|
|
|
Hodnota p oproti bupivakaín hydrochloridu
|
0,0001
|
|
|
a Ekvivalenty v miligramoch intravenózne podávaného morfínu (i.v. MME).
Štúdia 302 (inguinálna herniorafia)Celkom 418 pacientov podstupujúcich otvorenú inguinálnu herniorafiu so sieťkou pod celkovou anestéziou bolo randomizovaných do 1 z nasledujúcich 3 liečebných skupín v pomere 2:2:1
(v uvedenom poradí): Zynrelef 300 mg/9 mg, bupivakaín hydrochlorid 75 mg alebo placebo vo forme
fyziologického roztoku. Priemerný vek pacientov bol 49 rokov (rozsah 18 až 83 rokov) a pacienti boli prevažne muži (94 %). Zynrelef sa aplikoval priamo na miesto chirurgického zákroku na konci zákroku, po vypláchnutí a odsatí každej vrstvy fascie, avšak pred uzavretím rany. Bupivakaín hydrochlorid sa podal injekčne a placebo vo forme fyziologického roztoku sa podalo ako instilácia. Pacienti hodnotili intenzitu bolesti na NRS od 0 do 10 do 72 hodín po podaní dávky. Pooperačne nebol naplánovaný žiadny režim liekov proti bolesti, avšak pacientom bolo povolené použiť núdzový liek podľa potreby (10 mg oxykodónu perorálne každé 4 hodiny, 10 mg morfínu i.v. každé 2 hodiny
a/alebo 1 000 mg paracetamolu perorálne každých 6 hodín).
Výsledky primárneho koncového ukazovateľa a všetkých 4 kľúčových sekundárnych koncových ukazovateľov boli pozitívne. Zynrelef významne znížil priemernú hodnotu AUC skóre intenzity bolesti pri aktivite na NRS-A počas 72 hodín po chirurgickom zákroku v porovnaní s placebom vo forme fyziologického roztoku (primárny koncový ukazovateľ) aj bupivakaínom HCl (obrázok 2). Zynrelef tiež významne znížil spotrebu opioidov a významne zvýšil podiel pacientov, ktorí boli „bez opioidov“ (tabuľka 3).
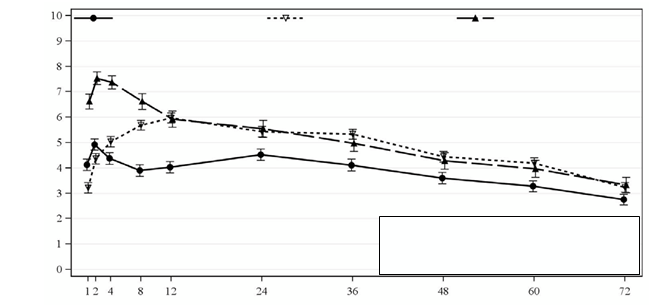
Obrázok 2: Priemerná intenzita bolesti ( NRS) počas 72 hodín v štúdii 302 (herniorafia)
Zynrelef 300 mg/9 mg
(N = 164)
Bupivakaín HCl 75 mg
(N = 172)
Placebo vo forme
fyziologického roztoku
(N = 82)
'
AUC0-72
Zynrelef oproti placebu: p = 0,0004
Zynrelef oproti bupivakaínu HCl: p < 0,0001
Hodiny po aplikácii v štúdii
Tabuľka 3: Používanie opioidov počas 72 hodín v štúdii 302 (herniorafia)
|
Zynrelef
300 mg/9 mg
(N = 164)
|
Bupivakaín
hydrochlorid
75 mg
(N = 172)
| Placebo vo forme fyziologického roztoku
(N = 82)
|
Celková spotreba opioidova
0-72 hodín
| Medián
| 0
| 7
| 11
|
Hodnota p oproti placebu vo forme fyziologického roztoku
|
0,0001
|
|
|
Hodnota p oproti bupivakaín hydrochloridu
|
0,0240
|
|
|
Bez opioidov
0-72 hodín
| n (%)
| 84 (51%)
| 69 (40%)
| 18 (22%)
|
Hodnota p oproti placebu vo forme fyziologického roztoku
|
< 0,0001
|
|
|
Hodnota p oproti bupivakaín hydrochloridu
|
0,0486
|
|
|
a Ekvivalenty v miligramoch intravenózne podávaného morfínu (i.v. MME).
C
hirurgické zákroky nevyhodnocované so Zynrelefom
Účinnosť a bezpečnosť neboli stanovené pre veľké chirurgické zákroky vrátane abdominálnych, vaskulárnych a torakálnych chirurgických zákrokov (pozri časť 4.4).
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií so Zynrelefom
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe akútnej pooperačnej bolesti
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiLokálna aplikácia Zynrelefu na miesto chirurgického zákroku vedie k merateľným systémovým hladinám bupivakaínu počas 72 hodín a meloxikamu počas 120 hodín. Systémové plazmatické hladiny bupivakaín po aplikácii Zynrelefu korelujú s účinnosťou.
AbsorpciaZynrelef je formulácia bupivakaínu a meloxikamu s predĺženým uvoľňovaním, pri ktorej sa používa
systém uvoľňovania lieku na základe polyméru. Po aplikácii jednorazovej dávky Zynrelefu sa
bupivakaín a meloxikam naraz uvoľňujú z polyméru približne po dobu 3 dní.
Farmakokinetické parametre bupivakaínu a meloxikamu v Zynrelefe sa hodnotili po niekoľkých chirurgických zákrokoch.
Deskriptívne štatistické údaje farmakokinetických parametrov reprezentačných dávok Zynrelefu v každej štúdii sú uvedené v tabuľke 4.
Tabuľka 4: Súhrn farmakokinetických parametrov pre bupivakaín a meloxikam po podaní jednorazových dávok Zynrelefu
Liečivo
|
Parameter
|
Bunionektómia: Zynrelef
60 mg/1,8 mg
(N = 17)
|
Herniorafia: Zynrelef
300 mg/9 mg
(N = 16)
|
Bupivakaín
| Cmax (ng/ml)
| 53,6 (32,6)
| 271 (147)
|
tmax (h)
| 3,00 (1,55-24,08)
| 18,22 (3,10-30,28)
|
AUC(0-t) (h×ng/ml)
| 1 650 (1 130)
| 14 900 (8 470)
|
AUC(inf) (h×ng/ml)
| 1 680 (1 190)
| 15 300 (8 780)
|
Meloxikam
| Cmax (ng/ml)
| 25,6 (13,8)
| 225 (96,3)
|
tmax (h)
| 18,02 (8,13-60)
| 53,72 (24,2-96,02)
|
AUC(0-t) (h×ng/ml)
| 1 600 (915)
| 18 600 (7 860)
|
AUC(inf) (h×ng/ml)
| 1 660 (1 050)
| 15 500 (NKa)
|
AUC = plocha pod krivkou, NK = nekalkulované.
Poznámka: Aritmetický priemer (štandardná odchýlka) okrem tmax, kde je to medián (rozsah). Dávky Zynrelefu sú uvedené ako dávka bupivakaínu (mg)/dávka meloxikamu (mg).
a Terminálna fáza eliminácie nebola zachytená u dostatočného počtu pacientov, SD sa nekalkulovala.
DistribúciaPo uvoľnení bupivakaínu a meloxikamu zo Zynrelefu a ich systémovej absorpcii sa očakáva, že
distribúcia bupivakaínu a meloxikamu bude rovnaká, ako pre akýkoľvek roztok bupivakaín hydrochloridu alebo perorálnu formuláciu meloxikamu.
B
upivakaín
Celkový plazmatický klírens bupivakaínu je 0,58 l/min., jeho distribučný objem v ustálenom stave je
73 l a stredný pomer pečeňovej extrakcie po i.v. podaní je 0,38. Viaže sa hlavne na alfa-1-kyslý glykoproteín s plazmatickou väzbou 96 %.
Meloxikam
Meloxikam sa veľmi silno viaže na plazmatické proteíny, v podstate na albumín (99 %). Meloxikam prechádza do synoviálnej tekutiny s približne polovičnými plazmatickými koncentráciami.
Distribučný objem je nízky, v priemere 11 l. Variácia medzi jednotlivcami je v rozmedzí 30-40 %.
Biotransformácia
Bupivakaín
Bupivakaín sa rozsiahlo metabolizuje v pečeni, prevažne aromatickou hydroxyláciou na 4-hydroxy- bupivakaín a N-dealkyláciou na pipekoloxylidid (PPX), pričom obe sú sprostredkované cytochrómom P450 (CYP) 3A4. Plazmatické koncentrácie PPX a 4-hydroxy-bupivakaínu po podaní bupivakaín sú
v porovnaní s pôvodným liekom nízke. Farmakologická aktivita metabolitov je nižšia ako farmakologická aktivita bupivakaínu.
Meloxikam
Meloxikam prechádza rozsiahlou pečeňovou biotransformáciou. V moči sa identifikovali štyri rôzne metabolity meloxikamu, pričom všetky sú farmakodynamicky neaktívne. Hlavný metabolit
5'-karboxymeloxikam (60 % dávky) sa tvorí oxidáciou prechodného metabolitu
5'-hydroxymetylmeloxikamu, ktorý sa tiež vylučuje v menšom rozsahu (9 % dávky). In vitro štúdie naznačujú, že CYP2C9 hrá dôležitú úlohu v tejto metabolickej ceste, s menším podielom izoenzýmu CYP3A4. Za ďalšie dva metabolity, ktoré tvoria 16 % a 4 % podanej dávky, je pravdepodobne zodpovedná aktivita peroxidázy pacienta.
Eliminácia
Po uvoľnení bupivakaínu a meloxikamu zo Zynrelefu a ich systémovej absorpcii sa očakáva, že ich
vylučovanie bude rovnaké, ako pre iné roztoky bupivakaín hydrochloridu alebo perorálne formulácie meloxikamu.
Bupivakaín
Približne 1 % bupivakaínu sa vylučuje močom ako nezmenený liek do 24 hodín a približne 5 % sa vylučuje ako PPX. Priemerný zjavný terminálny polčas (t1/2) bupivakaínu zo Zynrelefu je približne 14 až 15 hodín.
Meloxikam
Meloxikam sa vylučuje prevažne vo forme metabolitov a vyskytuje sa v rovnakých množstvách
v moči a stolici. Menej ako 5 % dennej dávky sa vylučuje nezmenenej stolicou zatiaľ čo len stopy pôvodnej zlúčeniny sa vylučujú močom. Priemerný zjavný terminálny polčas (t1/2) meloxikamu zo Zynrelefu je približne 22 až 25 hodín. Celkový plazmatický klírens je v priemere 8 ml/min.
Osobitné skupiny pacientov
Po uvoľnení bupivakaínu a meloxikamu zo Zynrelefu a ich systémovej absorpcii sa očakáva, že vplyv
poruchy funkcie pečene a obličiek bude rovnaký, ako pre iné liekové formy bupivakaínu alebo meloxikamu.
Porucha funkcie obličiek/pečene
Klírens bupivakaínu je sprostredkovaný skoro úplne pečeňovým metabolizmom a je citlivejší na zmeny prirodzenej funkcie pečeňových enzýmov ako na zmeny pečeňovej perfúzie.
Pečeňová ani mierna alebo stredne závažná porucha funkcie obličiek nemajú podstatný vplyv na farmakokinetické vlastnosti meloxikamu. Pri závažnom zlyhaní obličiek môže zvýšenie distribučného objemu viesť k vyššej koncentrácii voľného meloxikamu (pozri časti 4.3 a 4.4).
Starší pacienti
Po perorálnom podaní meloxikamu bol priemerný plazmatický klírens v ustálenom stave u starších osôb mierne nižší ako hodnota hlásená u mladších osôb.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje o Zynrelefe, bupivakaíne alebo meloxikame získané na základe obvyklých štúdií celkovej toxicity a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Nenašiel sa žiadny dôkaz mutagénneho účinku meloxikamu in vitro ani in vivo. U potkanov a myší v dávkach oveľa vyšších, ako sú dávky používané v klinickej praxi, sa nenašlo žiadne karcinogénne riziko meloxikamu. Nevykonali sa dlhodobé štúdie na zvieratách na vyhodnotenie mutagénneho
a karcinogénneho potenciálu Zynrelefu a bupivakaínu.
Bupivakaín prechádza placentou. V štúdiách reprodukčnej toxicity sa zaznamenala znížená miera prežívania mláďat potkanov a zvýšená mortalita embryí u králikov pri dávkach bupivakaínu
1,9 - alebo 2,1 - násobne vyšších ako je maximálna odporúčaná dávka Zynrelefu u ľudí (na základe
plochy povrchu tela s použitím maximálnej dennej expozície u 60 kg osoby). Štúdia bupivakaínu
u makakov rhesus naznačila zmeny postnatálneho správania po expozícii bupivakaínu pri narodení.
Reprodukčné štúdie perorálneho podávania meloxikamu potkanom preukázali zníženie ovulácií
a inhibíciu implantácií a embryotoxické účinky (zvýšenie vstrebávania) pri hladinách dávok toxických pre matku 1 mg/kg a vyšších. Štúdie reprodukčnej toxicity u potkanov a králikov neodhalili žiadne
teratogénne účinky až do perorálnej dávky 4 mg/kg u potkanov a 80 mg/kg u králikov. Hladiny, pri
ktorých sa nepozoroval žiadny účinok, prevyšovali maximálnu dennú expozíciu meloxikamu
v Zynrelefe 7,4 - a 295 - násobne (na základe plochy povrchu tela s použitím maximálnej dennej expozície u 60 kg osoby). Boli opísané fetotoxické účinky na konci gravidity, ktoré sa týkajú všetkých
inhibítorov syntézy prostaglandínov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
kopolymér DETOSU/trietylénglykol/ trietylénglykol-polyglykolid
triacetín
dimetylsulfoxid
kyselina maleínová
6.2 Inkompatibility
Tento liek sa nesmie miešať s vodou, roztokom chloridu sodného ani inými liekmi, pretože sa môže veľmi zahustiť a jeho aplikácia môže byť obtiažna.
Zynrelef nesmie prísť do kontaktu s roztokom jódovaného povidónu.
6.3 Čas použiteľnosti
2 roky
Čas použiteľnosti po prvom otvorení: použite okamžite.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25°C.
Uchovávajte v pôvodnom obale na ochranu pred svetlom a vlhkosťou. Tento liek sa má pripraviť len tesne pred použitím.
6.5 Druh obalu a obsah balenia
60 mg bupivakaínu/1,8 mg meloxikamu
Jedna 10 ml injekčná liekovka zo skla typu I, 1 hrot s ventilom na injekčnú liekovku, jedna 3 ml
striekačka typu Luer lock a 1 aplikátor typu Luer lock.
200 mg bupivakaínu/6 mg meloxikamu
Jedna 10 ml injekčná liekovka zo skla typu I, 1 hrot s ventilom na injekčnú liekovku, jedna 12 ml
striekačka typu Luer lock a 1 aplikátor typu Luer lock.
400 mg bupivakaínu/12 mg meloxikamu
Jedna 20 ml injekčná liekovka zo skla typu I, 1 hrot s ventilom na injekčnú liekovku, dve 12 ml
striekačky typu Luer lock a 2 aplikátory typu Luer lock.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Použiť sa má len číry roztok bez akýchkoľvek častíc.
Roztok je určený len na jednorazové použitie. Všetok nepoužitý roztok sa musí zlikvidovať. Vonkajší povrch injekčnej liekovky Zynrelef nie je sterilný. Počas manipulácie s liekom sa musia
dodržiavať prísne sterilné techniky, aby sa zabránilo jeho mikrobiálnej kontaminácii. Pri príprave v operačnej sále sa odporúča, aby tento liek pripravoval 2-členný tím.
Zynrelef je viskózny roztok, ktorá sa má pripraviť a podať len so sterilnými komponentmi dodávanými v aplikačnom balení Zynrelef.
Prečítajte si návod na použitie určený pre zdravotníckych pracovníkov uvedený v písomnej informácii.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Heron Therapeutics, B.V. Herengracht 500
1017 CB Amsterdam
Holandsko
8. REGISTRAČNÉ ČÍSLO
EU/1/20/1478/001
EU/1/20/1478/002
EU/1/20/1478/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.