
d>
Liečba sa neodporúča.
|
Zvýšenie QTc spĺňa obe hodnoty > 500 ms a
> 60 ms v porovnaní s hodnotami pred liečbou
|
Natrvalo vysadiť.
|
1. výskyt QTc > 500 ms počas liečby a zmena
z hodnoty pred liečbou zostáva < 60 ms
|
Dočasne prerušiť liečbu až do zníženia QTc
pod 500 ms.
Pozri sledovacie opatrenia v časti 4.4. Znova začnite dávkovanie dávkou 720 mg dvakrát denne (alebo 480 mg dvakrát denne, ak bola už dávka znížená).
|
2. výskyt QTc > 500 ms počas liečby a zmena
z hodnoty pred liečbou zostáva < 60 ms
|
Dočasne prerušiť liečbu až do zníženia QTc
pod 500 ms.
Pozri sledovacie opatrenia v časti 4.4. Znova začnite dávkovanie dávkou 480 mg dvakrát denne (alebo natrvalo vysaďte, ak už bola dávka znížená na 480 mg dvakrát denne).
|
3. výskyt QTc > 500 ms počas liečby a zmena z hodnoty pred liečbou zostáva < 60 ms
|
Natrvalo vysadiť.
|
Osobitné skupiny pacientov
Starší pacienti
U pacientov vo veku > 65 rokov nie je potrebná špeciálna úprava dávky.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sú k dispozícii obmedzené údaje. Riziko zvýšenej expozície u pacientov so závažnou poruchou funkcie obličiek nie je možné vylúčiť. Pacienti so závažnou poruchou funkcie obličiek sa majú starostlivo sledovať (pozri časti 4.4 a 5.2).
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene sú k dispozícii obmedzené údaje. Keďže sa vemurafenib vylučuje pečeňou, pacienti so stredne závažnou až závažnou poruchou funkcie pečene môžu mať zvýšenú expozíciu a majú sa starostlivo sledovať (pozri časti 4.4 a 5.2).
Deti a dospievajúci
Bezpečnosť a účinnosť vemurafenibu u detí a dospievajúcich (vo veku < 18 rokov) neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Pacienti inej ako bielej rasy
Bezpečnosť a účinnosť vemurafenibu u pacientov inej ako bielej rasy neboli doteraz stanovené. K
dispozícii nie sú žiadne údaje.
Spôsob podania
Tablety vemurafenibu sa majú prehltnúť celé a zapiť vodou. Tablety vemurafenibu sa nemajú rozhrýzť
ani drviť.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pred užívaním vemurafenibu sa musí u pacientov validovaným testom potvrdiť prítomnosť mutácie
BRAF V600 v nádore. Bezpečnosť a účinnosť vemurafenibu u pacientov s nádormi exprimujúcimi
non-E mutácie génu BRAF V600 sa presvedčivo nestanovili (pozri časť 5.1). Vemurafenib sa nemá používať u pacientov s malígnym melanómom bez prítomnosti BRAF mutácie (wilde type BRAF).
Hypersenzitívna reakcia
V súvislosti s vemurafenibom sa zaznamenali závažné hypersenzitívne reakcie, vrátane anafylaxie (pozri časti 4.3 a 4.8). Závažné hypersenzitívne reakcie môžu zahŕňať Stevensov-Johnsonov syndróm, generalizovanú vyrážku, erytém alebo hypotenziu. U pacientov, u ktorých sa vyskytli závažné hypersenzitívne reakcie, sa má liečba vemurafenibom trvale ukončiť.
Dermatologické reakcie
U pacientov užívajúcich vemurafenib sa zaznamenali závažné dermatologické reakcie, vrátane zriedkavých prípadov Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy
v pivotnom klinickou skúšaní. U pacientov, u ktorých sa vyskytla závažná dermatologická reakcia, sa má liečba vemurafenibom trvalo vysadiť.
Predĺženie QT intervalu
Predĺženie QT závislé od expozície sa pozorovalo v nekontrolovanej, nezaslepenej štúdii fázy II
u predliečených pacientov s metastatickým melanómom (pozri časť 4.8). Predĺženie QT môže viesť k zvýšenému riziku ventrikulárnych arytmií, vrátane torsade de pointes. Liečba vemurafenibom sa neodporúča u pacientov s nekorigovateľnými abnormalitami elektrolytov (vrátane horčíka), so syndrómom dlhého QT alebo u tých, ktorí užívajú lieky, o ktorých je známe, že predlžujú QT interval. Pred liečbou vemurafenibom, po mesiaci liečby a po úprave dávky sa u všetkých pacientov musí monitorovať elektrokardiogram (EKG) a elektrolyty (vrátane horčíka).
Ďalšie sledovanie sa odporúča predovšetkým u pacientov so stredne závažnou až závažnou poruchou funkcie pečene každý mesiac v priebehu prvých 3 mesiacov liečby, a potom každé 3 mesiace alebo častejšie podľa klinickej indikácie. Začatie liečby vemurafenibom sa neodporúča u pacientov
s QTc > 500 millisekúnd (ms). Ak v priebehu liečby QTc presiahne 500 ms, liečba vemurafenibom sa má dočasne prerušiť, abnormality elektrolytov (vrátane horčíka) sa majú korigovať a je potrebné skontrolovať kardiálne rizikové faktory pre predĺženie QT (napr. kongestívne srdcové zlyhanie, bradyarytmie). Liečba sa môže opätovne začať vtedy, keď QTc klesne pod 500 ms a s nižšou dávkou, tak ako je popísané v tabuľke 1. Trvalé ukončenie liečby vemurafenibom sa odporúča, ak sa QTc zvýši na hodnotu > 500 ms a zároveň rozdiel v porovnaní s hodnotami pred liečbou je > 60 ms.
Oftalmologické reakcie
Zaznamenali sa závažné oftalmologické reakcie, vrátane uveitídy, iritídy a venóznej retinálnej oklúzie. U pacientov pravidelne sledujte oftalmologické reakcie.
Spinocelulárny karcinóm kože (cuSCC)
U pacientov liečených vemurafenibom sa zaznamenali prípady cuSCC (ktoré zahŕňajú prípady klasifikované ako keratoakantóm alebo zmiešaný podtyp keratoakantómu) (pozri časť 4.8). Odporúča sa, aby boli všetci pacienti dermatologicky vyšetrení pred začiatkom liečby a počas liečby pravidelne sledovaní. Akékoľvek podozrivé kožné lézie sa majú odstrániť, poslať na dermatopatologické vyšetrenie a liečiť v súlade s miestnymi štandardmi starostlivosti. Predpisujúci lekár má vyšetriť pacienta pre cuSCC raz mesačne počas liečby a ešte počas šiestich mesiacov po
liečbe. U pacientov, u ktorých sa vyvinul cuSCC, sa odporúča pokračovať v liečbe bez úpravy dávky. Sledovanie má pokračovať počas 6 mesiacov po vysadení vemurafenibu alebo do začatia inej antineoplastickej liečby. Pacientov treba poučiť, aby informovali svojich lekárov v prípade výskytu akýchkoľvek kožných zmien.
Nekožný spinocelulárny karcinóm (non-cuSCC)
V klinických skúšaniach s vemurafenibom v liečbe melanómu sa nezaznamenali žiadne prípady non- cuSCC. Pred začatím liečby a každé 3 mesiace počas liečby majú pacienti podstúpiť vyšetrenie hlavy a krku, ktoré pozostáva minimálne z vizuálnej kontroly ústnej sliznice a palpácie lymfatických uzlín. Okrem toho majú pacienti pred liečbou a každých 6 mesiacov počas liečby podstúpiť vyšetrenie hrudníka počítačovou tomografiou (Computerised Tomography – CT).
Pred liečbou a na konci liečby alebo keď sa to považuje za klinicky indikované, sa odporúča vyšetrenie konečníka a panvy (u žien).
Po vysadení vemurafenibu má sledovanie pre non-cuSCC pokračovať počas 6 mesiacov alebo do začatia inej antineoplastickej liečby. Neobvyklé nálezy sa majú riešiť podľa klinickej praxe.
Nový primárny melanóm
V klinických skúškach sa zaznamenali nové primárne melanómy. Prípady sa liečili excíziou a pacienti pokračovali v liečbe bez úpravy dávky. Sledovanie pre kožné lézie sa má vykonávať tak, ako je to uvedené vyššie pre spinocelulárny karcinóm kože.
Poškodenie pečene
Pri liečbe vemurafenibom sa môžu vyskytnúť laboratórne abnormality pečene(pozri časť 4.8). Pečeňové enzýmy (transaminázy a alkalická fosfatáza) a bilirubín sa majú sledovať pred začatím liečby a každý mesiac počas liečby alebo podľa klinickej indikácie. Laboratórne abnormality sa majú zvládnuť znížením dávky, prerušením liečby alebo vysadením liečby (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene nie je potrebná žiadna úprava úvodnej dávky. Pacienti
s miernou poruchou funkcie pečene kvôli pečeňovým metastázam bez hyperbilirubinémie sa môžu sledovať podľa všeobecných odporúčaní. K dispozícii sú len veľmi obmedzené údaje u pacientov so stredne závažnou až závažnou poruchou funkcie pečene. U pacientov so stredne závažnou až závažnou poruchou funkcie pečene môže byť zvýšená expozícia (pozri časť 5.2). Preto je predovšetkým po prvých niekoľkých týždňoch liečby potrebné starostlivé sledovanie, pretože sa môže objaviť
kumulácia v priebehu dlhšej doby (niekoľko týždňov). Okrem toho sa odporúča sledovanie EKG
každý mesiac počas prvých troch mesiacov.
Porucha funkcie obličiek
U pacientov s miernou alebo stredne závažnou poruchou funkcie obličiek nie je potrebná žiadna úprava úvodnej dávky. K dispozícii sú len veľmi obmedzené údaje u pacientov so závažnou poruchou funkcie obličiek. Vemurafenib sa má používať s opatrnosťou u pacientov so závažnou poruchou funkcie obličiek a pacienti sa majú dôkladne sledovať.
Fotosenzitivita
U pacientov, ktorí dostávali vemurafenib v klinických štúdiách, sa zaznamenala mierna až závažná fotosenzitivita (pozri časť 4.8). Všetkým pacientom sa má odporučiť, aby sa počas užívania vemurafenibu vyhýbali expozícii slnka. Počas užívania lieku sa pacientom odporúča, aby nosili ochranný odev a používali širokospektrálny Ultraviolet A (UVA)/Ultraviolet B (UVB) ochranný krém a balzam na pery (Sun Protection Factor ≥ 30) počas pobytu vonku ako ochranu proti spáleniu
pokožky slnkom.
V prípade fotosenzitivity 2. stupňa (netolerovateľnej) alebo vyššieho stupňa sa odporúčajú úpravy dávky (pozri časť 4.2).
Účinky vemurafenibu na iné lieky
Vemurafenib môže zvýšiť plazmatickú expozíciu liekov, ktoré sú metabolizované predovšetkým CYP1A2 a znížiť plazmatickú expozíciu liekov, ktoré sú metabolizované predovšetkým CYP3A4, vrátane perorálnych kontraceptív. V prípade liekov metabolizovaných predovšetkým CYP1A2 alebo CYP3A4 sa majú pred súbežnou liečbou s vemurafenibom zvážiť úpravy dávky na základe ich terapeutických rozmedzí (pozri časti 4.5 a 4.6).
Keď sa vemurafenib používa súčasne s warfarínom, je potrebná opatrnosť a zváženie ďalšieho sledovania INR (International Normalized Ratio).
Účinky iných liekov na vemurafenib
Lieky, ktoré inhibujú alebo ovplyvňujú P-gp (napr. verapamil, klaritromycín, cyklosporín, ritonavir, chinidín, dronedaron, amiodaron, itrakonazol, ranolazín), by mohli ovplyvňovať farmakokinetiku vemurafenibu (pozri časť 4.5).
Ak je to možné, je potrebné vyhýbať sa súbežnému podávaniu silných induktorov P-gp, glukuronidácii, CYP3A4 (napr. rifampicín, rifabutín, karbamazepín, fenytoín alebo ľubovník
bodkovaný [hypericín]). Na udržanie účinnosti vemurafenibu sa má zvážiť alternatívna liečba s menej indukujúcim potenciálom.
4.5 Liekové a iné interakcie
Účinky vemurafenibu na substráty CYP
Inhibícia CYP1A2 sa pozorovala pri súbežnom podaní jednorazovej dávky kofeínu po opakovanom
podávaní vemurafenibu po dobu 15 dní. Výsledkom toho bolo priemerné 2,5-násobné zvýšenie (maximálne do 10-násobku) plazmatickej expozície kofeínu po liečbe vemurafenibom. Vemurafenib môže zvyšovať plazmatickú expozíciu látok, ktoré sú metabolizované predovšetkým CYP1A2 a má sa zvážiť úprava dávky.
Indukcia CYP3A4 sa pozorovala pri súbežnom podaní jednorazovej dávky midazolamu po opakovanom podávaní vemurafenibu po dobu 15 dní. Výsledkom toho bolo priemerné zníženie o 32 % (maximálne do 80 %) plazmatickej expozície midazolamu po liečbe vemurafenibom.
Vemurafenib môže znižovať plazmatickú expozíciu látok, ktoré sú metabolizované predovšetkým CYP3A4. Na základe toho môže byť znížená účinnosť antikoncepčných tabliet metabolizovaných CYP3A4 používaných súčasne s vemurafenibom. Je potrebné zvážiť úpravu dávky substrátov CYP3A4 s úzkym terapeutickým oknom (pozri časti 4.4 a 4.6).
Mierna indukcia CYP2B6 spôsobená vemurafenibom sa zaznamenala in vitro pri koncentrácii vemurafenibu 10 μM. V súčasnosti nie je známe, či vemurafenib pri plazmatickej hladine 100 μM pozorovanej u pacientov v rovnovážnom stave (približne 50 μg/ml) môže znížiť plazmatické koncentrácie súbežne podávaných substrátov CYP2B6, ako je bupropión.
Ak sa jednorazová dávka warfarínu podala spoločne po opakovanom dávkovaní vemurafenibu po dobu 15 dní, došlo u niektorých pacientov ku zvýšeniu expozície warfarínu (priemerne o 20 %) (pozri časť 4.4). Pri súbežnom podaní vemurafenibu s warfarínom (CYP2C9) u pacientov s melanómom je potrebné postupovať s opatrnosťou.
Z dôvodu dlhého polčasu vemurafenibu sa môže úplný inhibičný účinok vemurafenibu na súbežne podávaný liek pozorovať až na 8. deň liečby vemurafenibom.
Po skončení liečby vemurafenibom môže byť nevyhnutné obdobie bez liečby trvajúce 8 dní, aby sa zabránilo interakcii s následnou liečbou.
Účinky vemurafenibu na transportné systémy látky
Štúdie in vitro preukázali, že vemurafenib je inhibítorom efluxného transportéra (P-gp). Klinický význam tohto nálezu nie je známy. Nie je možné vylúčiť, že vemurafenib môže zvyšovať expozíciu iných liekov transportovaných P-gp.
Možný vplyv vemurafenibu na iné transportéry (napr. BCRP) nie je v súčasnosti známy.
Účinky súbežne podávaných liekov na vemurafenib
Štúdie in vitro naznačujú, že metabolizmus CYP3A4 a glukuronidácia sú zodpovedné za metabolizmus vemurafenibu. Zdá sa, že biliárna exkrécia je ďalšou dôležitou eliminačnou cestou. Nie sú k dispozícii žiadne klinické údaje preukazujúce vplyv aktivity silných induktorov alebo inhibítorov CYP3A4 a/alebo transportných proteínov na expozíciu vemurafenibu. Vemurafenib sa má používať opatrne v kombinácii so silnými inhibítormi CYP3A4, glukuronidácie a/alebo transportných proteínov (napr. ritonavir, sachinavir, telitromycín, ketokonazol, itrakonazol, vorikonazol, posakonazol, nefazodon, atazanavir).
Súbežné podávanie silných induktorov P-gp, glukuronidácie a/alebo CYP3A4 (napr. rifampicín, rifabutín, karbamazepín, fenytoín alebo ľubovník bodkovaný [hypericum perforatum]) môže viesť k suboptimálnej expozícii vemurafenibu a je potrebné tomu zabrániť.
Štúdie in vitro preukázali, že vemurafenib je substrátom efluxného transportéra, P-gp. Vplyv induktorov a inhibítorov P-gp na expozíciu vemurafenibu nie je známy. Nie je možné vylúčiť, že lieky, ktoré inhibujú alebo ovplyvňujú P-gp (napr. verapamil, klaritromycín, cyklosporín, ritonavir,
chinidín, dronedaron, amiodaron, itrakonazol, ranolazín), môžu ovplyvňovať farmakokinetiku vemurafenibu.
Nie je v súčasnosti známe, či je vemurafenib substrátom aj iných transportných proteínov.
4.6 Fertilita, gravidita a laktácia
Ženy v reprodukčnom veku / Antikoncepcia u žien
Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby a minimálne 6 mesiacov po liečbe.
Vemurafenib môže znižovať účinnosť hormonálnych kontraceptív (pozri časť 4.5).
Gravidita
Nie sú k dispozícii žiadne údaje týkajúce sa používania vemurafenibu u gravidných žien.
Vemurafenib nejavil žiadny dôkaz teratogenity u embrya/plodu potkana alebo králika (pozri časť 5.3). V štúdiách na zvieratách sa zistilo, že vemurafenib môže prechádzať placentou. Vemurafenib sa nemá podávať gravidným ženám, pokiaľ možný prínos pre matku neprevýši možné riziko pre plod.
Laktácia
Nie je známe, či sa vemurafenib vylučuje do ľudského mlieka. Riziko pre novorodencov/dojčatá nemožno vylúčiť. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť liečbu vemurafenibom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Neuskutočnili sa žiadne špecifické štúdie s vemurafenibom u zvierat na zhodnotenie vplyvu na fertilitu. V toxikologických štúdiách po opakovanom podaní dávky u potkanov a psov sa však nezistili žiadne histopatologické nálezy na reprodukčných orgánoch (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Vplyv vemurafenibu na schopnosť viesť vozidlá a obsluhovať stroje sa neskúmal. Pacientov je potrebné upozorniť na potenciálnu únavu alebo očné problémy, ktoré môžu byť dôvodom na to, aby neviedli vozidlo.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie nežiaduce liekové reakcie (adverse drug reactions – ADR) (> 30 %) zaznamenané pri vemurafenibe zahŕňajú artralgiu, únavu, vyrážky, fotosenzitívnu reakciu, nauzeu, alopéciu a pruritus. CuSCC sa zaznamenal veľmi často a bol najčastejšie liečený lokálnou excíziou.
Súhrn nežiaducich reakcií uvedených v tabuľke
ADR, ktoré sa zaznamenali u pacientov s melanómom, sú vymenované nižšie podľa triedy
orgánových systémov MedDRA, frekvencie a stupňa závažnosti. Na klasifikáciu frekvencie bola použitá nasledovná konvencia:
Veľmi časté ≥ 1/10
Časté ≥ 1/100 až < 1/10
Menej časté ≥ 1/1 000 až < 1/100
Zriedkavé ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé < 1/10 000
V tejto časti vychádzajú ADR z výsledkov od 500 pacientov z randomizovanej, nezaslepenej štúdie fázy III u dospelých pacientov neresekovateľným melanómom alebo melanómom v IV štádiu
s pozitivitou mutácie BRAF V600, rovnako ako z výsledkov štúdie fázy II s jedným ramenom
u pacientov s melanómom v IV štádiu s pozitivitou mutácie BRAF V600, u ktorých v minulosti zlyhala minimálne jedna predchádzajúca systémová liečba (pozri časť 5.1). Všetky zahrnuté výrazy
vychádzajú z najvyšších podielov pozorovaných počas klinických skúšaní fázy II a fázy III. V rámci jednotlivých frekvencií sú ADR usporiadané v poradí klesajúcej závažnosti a zaznamenali sa pomocou NCI-CTCAE v 4.0 (všeobecné kritériá toxicity) pre posúdenie toxicity.
Tabuľka 3: Nežiaduce účinky vyskytujúce sa u pacientov liečených vemurafenibom v štúdii fázyII alebo IIITrieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie a nákazy
|
| Folikulitída
|
|
Benígne a malígne nádory,
nešpecifikované novotvary
(vrátane cysty a polypy)
| SCC kože(c),
seboroická keratóza, kožný papilóm
| Bazocelulárny
karcinóm
|
|
Poruchy metabolizmu a
výživy
| Znížená chuť do
jedla
|
|
|
Poruchy nervového systému
| Bolesť hlavy,
dysgeúzia
| Paralýza VII. nervu
| Periférna neuropatia
|
Poruchy oka
|
| Uveitída
| Oklúzia retinálnej vény
|
Porucha ciev
|
|
| Vaskulitída
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Kašeľ
|
|
|
Poruchy gastrointestinálneho
traktu
| Hnačka, vracanie,
nauzea, zápcha
|
|
|
Poruchy kože a podkožného
tkaniva
| Fotosenzitívna
reakcia, aktinická keratóza, vyrážka, makulopapulózna vyrážka, papulózna vyrážka, svrbenie, hyperkeratóza, erytém, alopécia, suchá koža, spálenie od slnka
| Syndróm palmárno-
plantárnej erytrodyzestézie nodózny erytém, keratosis pilaris
| Toxická epidermálna nekrolýza(d), Stevensov-Johnsonov syndróm(e)
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Artralgia, myalgia,
bolesť končatín, bolesť svalov a kostí, bolesť chrbta
| Artritída
|
|
Celkové poruchy a reakcie v
mieste podania
| Únava, pyrexia,
periférny edém, asténia
|
|
|
Laboratórne a funkčné
vyšetrenia
| Zvýšenie GGT (b)
| Zvýšenie ALT(b),
zvýšenie alkalickej fosfatázy(b), zvýšenie bilirubínu(b), zníženie hmotnosti
| Zvýšenie AST(b)
|
Popis vybraných nežiaducich reakcií
Zvýšenie pečeňových enzýmov
(b)
Abnormality pečeňových enzýmov zaznamenané v klinickej štúdii fázy III sú uvedené nižšie ako podiel pacientov, ktorí prekonali zmenu pečeňových enzýmov z východiskovej hodnoty na poruchu 3. alebo 4. stupňa.
• Veľmi časté: GGT
• Časté: ALT, alkalická fosfatáza, bilirubín
• Menej časté: AST
Nevyskytli sa žiadne zvýšenia ALT, alkalickej fosfatázy alebo bilirubínu na 4. stupeň.
Spinocelulárny karcinóm kože(c) (cuSCC)
U pacientov liečených vemurafenibom sa zaznamenali prípady cuSCC. Incidencia cuSCC u pacientov liečených vemurafenibom v štúdiách bola približne 20 %. Väčšina excidovaných lézií preskúmaných nezávislým centrálnym dermatopatologickým laboratóriom bola klasifikovaná ako SCC keratoakantómový podtyp alebo so zmiešanými črtami keratoakantómu (52 %). Väčšina lézií klasifikovaných ako „iné“ (43 %) boli benígne kožné lézie (napr. obyčajná bradavica, aktinická keratóza, benígna keratóza, cysta/benígna cysta). CuSCC sa zvyčajne vyskytoval na začiatku liečby
s mediánom času do prvého objavenia 7 až 8 týždňov. Z pacientov, ktorí prekonali cuSCC, približne
33 % prekonalo > 1 výskyt s mediánom času medzi výskytmi 6 týždňov. Prípady cuSCC boli zvyčajne zvládnuté jednoduchou excíziou a pacienti obvykle pokračovali v liečbe bez úpravy dávky (pozri časti
4.2 a 4.4).
Nový primárny melanóm
V klinických skúškach sa zaznamenali nové primárne melanómy. Tieto prípady sa liečili excíziou
a pacienti pokračovali v liečbe bez úpravy dávky. Je potrebné sledovať kožné lézie tak, ako je uvedené v časti 4.4.
Hypersenzitívne reakcie(d)
V súvislosti s vemurafenibom sa zaznamenali závažné hypersenzitívne reakcie, vrátane anafylaxie. Závažné hypersenzitívne reakcie môžu zahŕňať Stevensov-Johnsonov syndróm, generalizovanú vyrážku, erytém alebo hypotenziu. U pacientov, u ktorých sa vyskytli závažné hypersenzitívne reakcie, sa má liečba vemurafenibom trvale ukončiť (pozri časť 4.4).
Dermatologické reakcie(e)
U pacientov užívajúcich vemurafenib sa zaznamenali závažné dermatologické reakcie, vrátane zriedkavých prípadov Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy
v pivotnom klinickom skúšaní. U pacientov, u ktorých sa vyskytla závažná dermatologická reakcia, sa má liečba vemurafenibom trvalo vysadiť.
Predĺženie QT intervalu
Analýza centralizovaných EKG údajov z nezaslepenej, nekontrolovanej QT podštúdie fázy II u 132
pacientov, ktorí dostávali dávku 960 mg vemurafenibu dvakrát denne (NP22657), preukázala predĺženie QTc závislé od expozície. Priemerný účinok na QTc stabilne pretrvával v rozmedzí 12-
15 ms dlhšom po prvom mesiaci liečby s najväčším priemerným predĺžením QTc (15,1 ms; horných
95 % IS: 17,7 ms) pozorovaným v priebehu prvých 6 mesiacov (n = 90 pacientov). U dvoch pacientov (1,5 %) sa vyvinuli pri liečbe absolútne hodnoty QTc > 500 ms (CTC 3. stupňa) a len u jedného pacienta (0,8 %) sa preukázala zmena QTc z východiskovej hodnoty > 60 ms (pozri časť 4.4).
Osobitné populácie
Staršie osoby
V štúdii fázy III bolo deväťdesiatštyri (28 %) z 336 pacientov s neresekovateľným alebo metastatickým melanómom liečených vemurafenibom vo veku ≥ 65 rokov. Starší pacienti (vo veku
≥ 65 rokov) môžu byť náchylnejší na výskyt nežiaducich reakcií, vrátane cuSCC, zníženej chuti do jedla a kardiálnych porúch.
Pohlavie
Počas klinických skúšaní s vemurafenibom boli vyrážka, artralgia a fotosenzitivita nežiaducimi reakciami 3. stupňa zaznamenanými častejšie u žien ako u mužov.
4.9 PredávkovanieNeexistuje žiadne špecifické antidotum pri predávkovaní vemurafenibom. Pacienti, u ktorých sa vyvinuli nežiaduce reakcie, majú dostať zodpovedajúcu symptomatickú liečbu. V klinických skúškach sa nepozorovali žiadne prípady predávkovania vemurafenibom. V prípade podozrenia na predávkovanie sa má pozastaviť liečba vemurafenibom a zahájiť podporná starostlivosť.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antineoplastiká, inhibítor proteínkinázy, ATC kód: L01XE15
Spôsob účinku a farmakodynamické účinkyVemurafenib je perorálne dostupný inhibítor BRAF serín-treonínkinázy s nízkou molekulovou
hmotnosťou. Mutácie v géne BRAF, ktoré nahradzujú valín na pozícii aminokyseliny 600, vedú ku konštitutívnej aktivácii BRAF proteínov, ktorá môže spôsobovať bunkovú proliferáciu bez rastových faktorov, ktoré by boli normálne pre proliferáciu potrebné.
Predklinické údaje získané z biochemických hodnotení preukázali, že vemurafenib môže potentne inhibovať BRAF kinázy s aktivujúcimi mutáciami kodónu 600 (tabuľka 4).
Tabuľka 4: Inhibičná kinázová aktivita vemurafenibu proti rôznym BRAF kinázam Kináza
| Očakávaná frekvencia melanómu pozitívneho na V600 mutáciu(f)
| Inhibičná koncentrácia
50 (nM)
| BRAFV600E
| 93,2 %
| 10
| BRAFV600K
| 5,6 %
| 7
| BRAFV600R
| 1 %
| 9
| BRAFV600D
| < 0,1 %
| 7
| BRAFV600G
| < 0,1 %
| 8
| BRAFV600M
| < 0,1 %
| 7
| BRAFV600A
| 0
| 14
| BRAFWT
| NA
| 39
|
|
|
(f) Odhadované z 2 099 melanómov s anotovanými mutáciami BRAF kodónu 600 vo verejnej databáze
COSMIC, vydanie 54 (júl 2011).
Tento inhibičný účinok bol potvrdený v hodnotení ERK fosforylácie a bunkovej anti-proliferácie v dostupných melanómových bunkových líniách exprimujúcich V600-mutantný BRAF.
V hodnoteniach bunkovej anti-proliferácie sa IC50 oproti V600 mutovaným bunkovým líniám (V600E, V600R, V600D a V600K mutované bunkové línie) pohybuje od 0,016 až 1,13 μM, zatiaľ čo inhibičná koncentrácia 50 oproti bunkovým líniám bez prítomnosti BRAF mutácie (wild type BRAF) bola 12,06 a 14,32 μM v uvedenom poradí.
Stanovenie BRAF mutačného statusuPred užívaním vemurafenibu sa musí u pacientov validovaným testom potvrdiť prítomnosť mutácie BRAF V600 v nádore. V klinickom skúšaní fázy II a fázy III boli vhodní pacienti identifikovaní pomocou testu real-time PCR (polymerázovej reťazovej reakcie v reálnom čase) (cobas 4800 BRAF V600 Mutation Test). Tento test má označenie CE a používa sa na posudzovanie BRAF mutačného statusu DNA izolovanej z nádorového tkaniva fixovaného formalínom a zakonzervovaného v parafíne (FFPE – formalin fixed, paraffin embeded). Bol navrhnutý na stanovenie prevládajúcej mutácie BRAF
V600E s vysokou citlivosťou do 5 % V600E sekvencií spomedzi wild-type (nemutovaných) sekvencií DNA získanej z FFPE). Predklinické a klinické štúdie s retrospektívnymi sekvenčnými analýzami preukázali, že test tiež stanovuje, s nižšou citlivosťou, menej časté mutácie BRAF V600D
a V600K. Zo vzoriek dostupných z predklinických a klinických štúdií, ktoré boli pozitívne na mutáciu v teste cobas a okrem toho sekvenčne analyzované, žiadna vzorka nebola identifikovaná ako vzorka bez prítomnosti mutácie (wild type) ani Sangerovým sekvenovaním ani sekvenovaním 454.
Klinická účinnosť a bezpečnosťÚčinnosť vemurafenibu sa hodnotila u 336 pacientov z klinického skúšania fázy III (NO25026) a
u 132 pacientov z klinického skúšania fázy II (NP 22657). Všetci pacienti museli mať pokročilý melanóm s mutáciami BRAF V600 podľa mutačného testu cobas 4800 BRAF V600.
Výsledky štúdie fázy III (NO25026) u nepredliečených pacientovNezaslepená, multicentrická, medzinárodná, randomizovaná štúdia fázy III podporila používanie vemurafenibu u nepredliečených pacientov s neresekovateľným alebo metastatickým melanómom
s pozitivitou mutácie BRAF V600E. Pacienti boli randomizovaní na liečbu vemurafenibom (960 mg dvakrát denne) alebo dakarbazínom (1 000 mg/m2 1. deň každé 3 týždne).
Celkovo 675 pacientov bolo randomizovaných na vemurafenib (n = 337) alebo dakarbazín (n = 338). Väčšina pacientov bola mužského pohlavia (56 %) a belosi (99 %), medián veku bol 54 rokov (24 % bolo vo veku ≥ 65 rokov), všetci pacienti mali výkonnostný stav ECOG 0 alebo 1 a väčšina pacientov mala štádium ochorenia M1c (65 %). Koprimárne koncové ukazovatele účinnosti štúdie boli celkové prežívanie (overall survival - OS) a prežívanie bez progresie (progression-free survival - PFS).
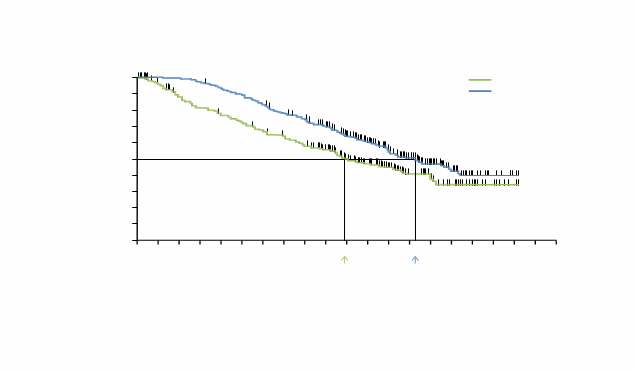
Vo vopred špecifikovanej analýze s dátumom uzávierky údajov 30. decembra 2010 sa pozorovalo významné zlepšenie v koprimárnych koncových ukazovateľoch OS (p < 0,0001) a PFS (p < 0,0001) (nestratifikovaný log-rank test). Podľa odporúčania Data Safety Monitoring Board (DSMB) boli tieto výsledky publikované v januári 2011 a štúdia bola upravená, aby umožňovala pacientov užívajúcim dakarbazín prejsť na užívanie vemurafenibu. Následne sa uskutočnili post-hoc analýzy prežívania podľa popisu v tabuľke 5.
Tabuľka 5: Celkové prežívanie u predtým neliečených pacientov s melanómom s pozitívnou mutáciou BRAF V600 do dátumu uzávierky štúdie (N = 338 dakarbazín, N = 337 vemurafenib) Dátumy uzávierky
| Liečba
| Počet úmrtí
(%)
| Pomer rizika
(95 % IS)
| Počet prestavených pacientov (%)
| 30. december 2010
| dakarbazín
| 75 (22)
| 0,37 (0,26, 0,55)
| 0 (neaplikovateľné)
| vemurafenib
| 43 (13)
| 31. marec 2011
| dakarbazín
| 122 (36)
| 0,44 (0,33, 0,59) (g)
| 50 (15 %)
| vemurafenib
| 78 (23)
| 3. október 2011
| dakarbazín
| 175 (52)
| 0,62 (0,49, 0,77) (g)
| 81 (24 %)
| vemurafenib
| 159 (47)
|
|
|
(g) Cenzurované výsledky v čase prestavenia
Necenzurované výsledky v čase prestavenia: 31. marec: HR (95 % IS) = 0,47 (0,35, 0,62); 3. október: HR (95 % IS) = 0,67 (0,54, 0,84)
Graf 1: Kaplanove-Meierove krivky celkového prežívania – predtým neliečení pacienti (dátum uzávierky 3. október 2011)
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
Dacarbazine
Vemurafenib
0 1 2 3 4 5
6 7 8
9 10
11 12 13
14 15
16 17
18 19 20
Počet ohrozených pacientov
8.9
Čas (mesiace)
13.2
(median)
Dacarbazine'
|
338 305 275 253 238 224 207 194 176 160 128 99 74
|
49 36
|
24 12 7
|
2
|
0
|
0
|
Vemurafenib
|
337 336 335 326 313 299 280 259 245 223 181 147 112
|
86 54
|
35 17 10
|
3
|
0
|
0
|
Tabuľka 6 uvádza účinok liečby pre vopred špecifikované premenné stratifikácie, ktoré sú stanovené
ako prognostické faktory.
Tabuľka 6: Celkové prežívanie u predtým neliečených pacientov s melanómom s pozitívnou mutáciou BRAF V600 podľa LDH, štádia tumoru a stavu ECOG (dátum uzávierky 3. október2011, cenzurované výsledky v čase prestavenia) Premenná stratifikácie
| N
| Pomer rizika
| 95 % interval spoľahlivosti
|
LDH normálne
| 391
| 0,65
| 0,46; 0,91
|
LDH >ULN
| 284
| 0,50
| 0,37; 0,67
|
Štádium IIIc/M1A/M1B
| 234
| 0,87
| 0,56; 1,34
|
Štádium MIC
| 441
| 0,52
| 0,40; 0,67
|
ECOG PS=0
| 459
| 0,64
| 0,47; 0,86
|
ECOG PS=1
| 216
| 0,52
| 0,37; 0,73
|

LDH: Laktát Dehydrogenázy, ECOG PS: Eastern Cooperative Oncology Group Performance Status
Tabuľka 7 uvádza celkovú mieru odpovede bez progresie u predtým neliečených pacientov s melanómom s pozitívnou mutáciou BRAF V600
Tabuľka 7: Celková miera odpovede a prežívanie bez progresie u predtým neliečených pacientov s melanómom s pozitívnou mutáciou BRAF V600 (dátum uzávierky 30. december
2010)
vemurafenib
dakarbazín
p-hodnota (h)
|
(N = 336)
|
|
(N = 336)
|
|
Prežívanie bez progresie
|
|
|
|
|
Pomer rizika
|
|
0,26
|
|
|
(95 % IS)
|
|
(0,20, 0,33)
|
|
< 0,0001
|
Medián PFS (mesiace)
|
5,32
|
|
1,61
|
|
(95 % IS)
|
(4,86, 6,57)
|
|
(1,58, 1,74)
|
-
|
Celková miera odpovede
|
48,4 %
|
5,5 %
|
|
|
(41,6 %, 55,2 %)
|
(2,8 %, 9,3 %)
|
< 0,0001
|
|
|
(h) Nestratifikovaný log-rank test pre PFS a Chi-squared test pre celkovú mieru odpovede.
Celkovo 549 pacientov bolo hodnotiteľných pre PFS a 439 pacientov bolo hodnotiteľných pre celkovú mieru odpovede.
U celkovo 19 pacientov z 220 v NO25026, ktorých nádory boli retrospektívne analyzované sekvenovaním, sa zaznamenal melanóm s pozitívnou mutáciou BRAF V600K. Aj keď obmedzené nízkym počtom pacientov, analýzy účinnosti u týchto pacientov s nádormi s pozitívnou V600K naznačujú prínos liečby vemurafenibom čo sa týka OS, PFS a potvrdenej celkovej odpovede. Nie sú dostupné žiadne údaje u pacientov s melanómom s mutáciami BRAF V600 inými ako V600E a V600K.
Výsledky štúdie fázy II (NP22657) u pacientov, u ktorých zlyhala minimálne jedna predchádzajúca liečbaMedzinárodná, multicentrická štúdia fázy II s jedným ramenom sa uskutočnila u 132 pacientov, ktorí mali metastázujúci melanóm s pozitívnou mutáciou BRAF V600 podľa mutačného testu cobas 4800
BRAF V600 a ktorí dostávali minimálne jednu predchádzajúcu liečbu. Medián veku bol 52 rokov, pričom 19 % pacientov bolo starších ako 65 rokov. Väčšina pacientov bola mužského pohlavia
(61 %), belosi (99 %) a mala štádium ochorenia M1c (61 %). U štyridsiatich deviatich percent pacientov zlyhali ≥ 2 predchádzajúce liečby.
S mediánom sledovania 12,9 mesiacov (rozmedzie 0,6 až 20,1) bol primárny koncový ukazovateľ potvrdenej miery najlepšej celkovej odpovede (CR + PR) hodnotený nezávislou revíznou komisiou (IRC) 53 % (95 % IS: 44 %; 62 %). Medián celkového prežívania bol 15,9 mesiacov (95 % IS: 11,6;
18,3). Miera celkového prežívania po 6 mesiacoch bola 77 % (95 % IS: 70 %; 85 %) a po 12
mesiacoch bola 58 % (95 % IS: 49 %; 67 %).
Deväť zo 132 pacientov zaradených do štúdie NP22657 malo nádory s pozitívnou mutáciou V600K podľa retrospektívneho Sangerovho sekvenovania. Z týchto pacientov mali 3 pacienti PR, 3 pacienti SD, 2 pacienti PD a jeden nebol hodnotiteľný.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre vemurafenib u všetkých podskupín detí a dospievajúcich s melanómom (informácie o pediatrickom použití, pozri
časť 4.2).
5.2 Farmakokinetické vlastnostiVemurafenib je látka triedy IV (nízka solubilita a permeabilita), podľa kritérií popísaných
v klasifikačnom systéme biofarmaceutík. Farmakokinetické parametre vemurafenibu sa stanovili pomocou nekompartmentovej analýzy v štúdiách fázy I a fázy III (20 pacientov po 15 dňoch dávkovania 960 mg dvakrát denne a 204 pacientov v rovnovážnom stave v deň 22) rovnako ako populačnou FK analýzou s použitím združených údajov od 458 pacientov. Z týchto pacientov 457 bolo belochov.
Absorpcia
Absolútna biologická dostupnosť 240 mg tabliet vemurafenibu nie je známa.
960 mg vemurafenibu dvakrát denne sa absorbuje s mediánom Tmax približne 4 hodiny. Vemurafenib vykazuje vysokú interindividuálnu variabilitu. V štúdii fázy II bolo AUC0-8h a Cmax v deň 1 22,1 ± 12,7
µg⋅h/ml a 4,1 ± 2,3 µg/ml. Po viacnásobnom dávkovaní vemurafenibu dvakrát denne sa objavila kumulácia. V nekompartmentovej analýze sa po podaní 960 mg vemurafenibu dvakrát denne pomer
deň 15/ deň 1 pohyboval v rozmedzí 15- až 17-násobku AUC a 13- až 14 násobku Cmax, čo za rovnovážnych podmienok znamená AUC0-8h a Cmax 380,2 ± 143,6 µg⋅h/ml a 56,7 ± 21,8 µg/ml v uvedenom poradí.
Vplyv jedla na absorpciu vemurafenibu nie je v súčasnosti známy. Môže sa vyskytnúť variabilita expozície vzhľadom na rozdiely v obsahu, objemoch, pH gastrointestinálnych tekutín, motility a doby prechodu a zloženia žlče.
V rovnovážnom stave je priemerná expozícia vemurafenibu v plazme stabilná počas 24-hodinového intervalu, čo naznačuje priemerný pomer 1,13 medzi plazmatickými koncentráciami pred rannou dávkou a 2-4 hodiny po nej.
Pri perorálnom podaní dávky sa miera absorpcie konštantná pre populáciu pacientov s metastatickým melanómom odhaduje na 0,19 h-1 (s variabilitou medzi pacientmi 101 %).
Distribúcia
Populačný zdanlivý distribučný objem vemurafenibu u pacientov s metastatickým melanómom sa odhaduje na 91 l (s variabilitou medzi pacientmi 64,8 %). In vitro sa vo vysokej miere viaže na proteíny ľudskej plazmy (> 99 %).
Biotransformácia
Relatívne podiely vemurafenibu a jeho metabolitov boli charakterizované v bilančnej štúdii u veľkého počtu ľudí s jednorazovou dávkou 14C-značeného vemurafenibu podávaného perorálne. CYP3A4 je hlavným enzýmom zodpovedným za metabolizmus vemurafenibu in vitro. U ľudí boli identifikované aj konjugačné metabolity (glukuronidácia a glykozylácia). Východisková látka bola však prevládajúcou zložkou (95 %) v plazme. Hoci sa nezdá, že by v dôsledku metabolizmu bolo v plazme významné množstvo metabolitov, dôležitosť metabolizmu pre vylučovanie nie je možné vylúčiť.
Eliminácia
Populačný zjavný klírens vemurafenibu u pacientov s metastatickým melanómom sa odhaduje na
29,3 l/deň (s variabilitou medzi pacientmi 31,9 %). Populačný eliminačný polčas odhadovaný populačnou FK analýzou pre vemurafenib je 51,6 hodín (5. a 95. percentilový rozsah individuálnych odhadov polčasu je 29,8 – 119,5 hodín).
V bilančnej štúdii s veľkým počtom ľudí s perorálne podávaným vemurafenibom sa v priemere 95 % dávky vylúčilo v priebehu 18 dní. Väčšina látok príbuzných vemurafenibu (94 %) sa vylúčila v stolici a < 1 % v moči. Vylučovanie nezmeneného liečiva žlčou môže byť dôležitou cestou eliminácie.
Z dôvodu neznámej absolútnej biologickej dostupnosti však význam hepatálnej a renálnej exkrécie pre klírens východiskového vemurafenibu nie je jasný. Vemurafenib je substrátom a inhibítorom P-gp in vitro.
Osobitné skupiny pacientov
Starší pacienti
Na základe populačnej FK analýzy vek nemá štatisticky významný vplyv na farmakokinetiku vemurafenibu.
Pohlavie
Populačná farmakokinetická analýza naznačila o 17 % väčší zdanlivý klírens (Cl/F) a o 48 % väčší zdanlivý distribučný objem (V/F) u mužov ako u žien. Nie je jasné, či to je spôsobené pohlavím alebo vplyvom veľkosti tela. Rozdiely v expozícii však nie sú dostatočne veľké na to, aby bola potrebná úprava dávky na základe veľkosti tela alebo pohlavia.
Porucha funkcie obličiek
V populačnej farmakokinetickej analýze použitím údajov z klinických skúšaní u pacientov
s metastázujúcim melanómom neovplyvňovala mierna a stredne závažná porucha funkcie obličiek zdanlivý klírens vemurafenibu (klírens kreatinínu > 40 ml/min). Nie sú k dispozícii údaje u pacientov so závažnou poruchou funkcie obličiek (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
Na základe predklinických údajov a metabolickej bilančnej štúdie u veľkého počtu ľudí je väčšina vemurafenibu eliminovaná pečeňou. V populačnej farmakokinetickej analýze použitím údajov
z klinických skúšaní u pacientov s metastatickým melanómom zvýšenia AST a ALT až do trojnásobku
horného limitu normálu neovplyvňovali zdanlivý klírens vemurafenibu. Údaje nie sú dostatočné na určenie vplyvu poruchy metabolickej alebo vylučovacej funkcie pečene na farmakokinetiku vemurafenibu (pozri časti 4.2 a 4.4).
Deti a dospievajúci
Štúdie na preskúmanie farmakokinetiky vemurafenibu u detí a dospievajúcich sa neuskutočnili.
5.3 Predklinické údaje o bezpečnosti
Predklinický bezpečnostný profil vemurafenibu sa hodnotil u potkanov, psov a králikov. Toxikologické štúdie s opakovanou dávkou identifikovali pečeň a kostnú dreň ako cieľové orgány
u psov. Reverzibilné toxické účinky (hepatocelulárna nekróza a degenerácia) v pečeni pri expozíciách
nižších ako je predpokladaná klinická expozícia (na základe porovnaní AUC) sa zaznamenali v 13-týždňovej štúdii uskutočnenej u psov. V predčasne ukončenej 39-týždňovej štúdii u psov
s podávaním dvakrát denne bola zaznamená ložisková nekróza kostnej drene u jedného psa pri expozícii zhodnej s predpokladanou klinickou expozíciou (na základe porovnania AUC). V in vitro štúdii cytotoxicity v kostnej dreni sa pozorovala mierna cytotoxicita v niektorých lymfo- hematopoetických bunkových populáciách potkanov, psov a ľudí pri klinicky významných koncentráciách.
Preukázalo sa, že vemurafenib je fototoxický in vitro, na kultivovaných myších fibroblastoch po ožiarení UVA, nie však v in vivo štúdii uskutočnenej u potkanov s dávkami až do 450 mg/kg/deň (pri expozíciách nižších ako je predpokladaná klinická expozícia (na základe porovnania AUC)). Neuskutočnili sa žiadne špecifické štúdie s vemurafenibom u zvierat na hodnotenie účinku na fertilitu. V toxikologických štúdiách s opakovanou dávkou sa však nezistili žiadne histopatologické nálezy na reprodukčných orgánoch u samcov a samičiek potkanov a psov pri dávkach až do 450 mg/kg/deň (pri expozíciách nižších ako je predpokladaná klinická expozícia na základe porovnania AUC). V štúdiách embryofetálneho vývoja u potkanov a králikov sa nepozorovala teratogenita pri dávkach až do
250 mg/kg/deň a 450 mg/kg/deň (v uvedenom poradí), čo vedie k expozíciám nižším ako je predpokladaná klinická expozícia (na základe porovnania AUC). Expozície v štúdiách embryofetálneho vývoja boli však nižšie ako je klinická expozícia na základe porovnania AUC, preto je ťažké definovať, do akej miery je možné tieto výsledky extrapolovať na ľudí. Preto vplyv vemurafenibu na plod nie je možné vylúčiť. Štúdie týkajúce sa prenatálneho a postnatálneho vývoja sa neuskutočnili.
V in vitro hodnoteniach (bakteriálna mutácia [AMES test], chromozómová aberácia ľudských lymfocytov) ani v in vivo mikronukleovom teste kostnej drene potkanov uskutočnených
s vemurafenibom sa nezistili známky genotoxicity.
Štúdie karcinogenity s vemurafenibom sa neuskutočnili.
6
. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro
Sodná soľ kroskarmelózy Koloidný oxid kremičitý bezvodý Magnéziumstearát Hydroxypropylcelulóza
Filmový obal
Polyvinylalkohol
Oxid titaničitý (E171) Makrogol 3350
Mastenec
Červený oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Al/Al blistre s perforáciou umožňujúcou oddelenie jednotlivej dávky
Veľkosť balenia: 56 x 1 filmom obalených tabliet (7 blistrov po 8 tabliet)
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLO
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.