
pacient fľaštičku s kvapkadlom opakovane aktivovať (stláčať) mimo
oka, kým sa neuvoľní stlačením jedna kvapka.
- Ak sa pacient uistí, že sa z kvapkadla uvoľňuje samostatne jedna kvapka, má si zvoliť polohu,
ktorá mu najviac vyhovuje pri aplikácii kvapiek (môže si sadnúť, ležať na chrbte alebo stáť pred
zrkadlom).
P ouži ti e do oka :1. Pacient má držať fľašku priamo pod uzáverom, otočiť uzáverom aby otvoril fľašku. Nemá sa
ničoho dotýkať hrotom fľašky, aby sa zabránilo kontaminácii roztoku.
2. Pacient má zakloniť hlavu dozadu a fľašku držať priamo nad okom.
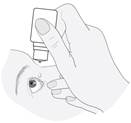
3. Pacient má jemne stiahnuť spodné viečko (vytvoriť tak malý vačok medzi okom a očným viečkom) a pozrieť sa nahor. Pacient má fľašku jemne stlačiť v strede a nechať kvapku spadnúť do oka.
Upozornenie: môže dôjsť k niekoľkosekundovému oneskoreniu medzi stlačením fľašky a vkvapnutím. Fľaška sa nesmie stláčať veľmi silno.
4. Pacient má aplikovať jednu kvapku do postihnutého oka (očí) podľa pokynov lekára. Pacient
má opakovane žmurknúť, aby sa kvapka rozšírila cez jeho oko a má byť poučený, aby vyhľadal radu od svojho lekára, lekárnika alebo zdravotnej sestry, ak si nie je istý, ako podať liek.
5. Kroky 2.-4.sa majú zopakovať aj pri aplikácii do druhého oka. Nie vždy je potrebné liečiť obe oči. Lekár má pacientovi presne určiť, ktoré oko je potrebné liečiť.
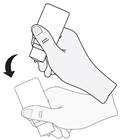
6. Po použití a pred opätovným nasadením uzáveru je potrebné fľašku raz pretrepať smerom nadol
bez toho, aby sa pacient dotýkal špičky kvapkadla, odstráni sa tak zvyšková tekutina na špičke.
Tento postup je potrebné dodržať na zabezpečenie následných aplikácií očných kvapiek
7. Po použití všetkých dávok zostane vo fľaške malé množstvo Vizidoru. Nie je potrebné sa znepokojovať, pretože tam bolo pridané určité množstvo Vizidoru navyše a pacient dostane celé množstvo Vizidoru, tak ako ho predpísal lekár. Užívanie prebytočného lieku zostávajúceho vo fľaške po ukončení lekárom stanovenej liečby sa pacientom neodporúča a nemajú sa o to pokúšať.
Pacienti nesmú používať očné roztokové kvapky dlhšie ako 28 dní po prvom otvorení obalu.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Dorzolamid sa nesledoval u pacientov so závažným poškodením obličiek (klírens
kreatinínu < 30 ml/min) alebo u pacientov s hyperchloremickou acidózou. Vzhľadom na to, že
dorzolamid a jeho metabolity sa vylučujú prevažne obličkami, dorzolamid je u týchto pacientov kontraindikovaný.
4.4 Osobitné upozornenia a opatrenia pri používaníDorzolamid sa nesledoval u pacientov s poškodením pečene, a preto sa má u týchto pacientov používať s opatrnosťou.
Liečba pacientov s akútnym glaukómom s uzavretým uhlom si vyžaduje okrem podávania látok
znižujúcich vnútroočný tlak aj ďalšie terapeutické zákroky. U pacientov s akútnym glaukómom
s uzavretým uhlom sa dorzolamid nesledoval.
Dorzolamid obsahuje sulfónamidovú skupinu, ktorá sa vyskytuje pri sulfónamidoch, a hoci sa podáva lokálne, vstrebáva sa systémovo. Pri lokálnom podávaní sa teda môžu vyskytnúť rovnaké typy
nežiaducich reakcií, aké spôsobujú sulfónamidy vrátane ťažkých reakcií, ako je Stevensov-Johnsonov
syndróm a toxická epidermálna nekrolýza. Ak sa vyskytnú prejavy závažných alergických reakcií
alebo precitlivenosti, prerušte používanie tohto lieku.
Liečba perorálnymi inhibítormi karboanhydrázy je spojená s urolitiázou ako následkom poruchy acidobázy, hlavne u pacientov s obličkovými kameňmi v anamnéze. Hoci sa pri dorzolamide nepozorovali žiadne poruchy acidobázy, zriedkavo bola hlásená urolitiáza. Pretože dorzolamid je lokálny inhibítor karboanhydrázy, ktorý sa absorbuje systémovo, pacienti s obličkovými kameňmi v anamnéze môžu mať pri používaní dorzolamidu zvýšené riziko urolitiázy.
Ak sa spozorujú alergické reakcie (napr. konjunktivitída a reakcie na očnom viečku), má sa zvážiť ukončenie liečby.
Existuje možnosť aditívneho účinku so známymi systémovými účinkami inhibície karboanhydrázy
u pacientov dostávajúcich perorálny inhibítor karboanhydrázy a dorzolamid. Súčasné podávanie
dorzolamidu a perorálneho inhibítora karboanhydrázy sa neodporúča.
Pri používaní dorzolamidu v liekovej forme s obsahom konzervačných látok sa hlásil edém rohovky
a ireverzibilná dekompenzácia rohovky u pacientov s už existujúcim chronickým poškodením rohovky
a/alebo s vnútroočnou operáciou v anamnéze. Lokálny dorzolamid sa má u týchto pacientov používať
s opatrnosťou.
Pri podávaní liečby potláčajúcej sekréciu komorového moku sa po filtračných výkonoch vyskytlo odchlípenie chorioidey spolu s očnou hypotóniou.
Pacienti s precitlivenosťou na striebro v anamnéze, nemajú tento liek používať. Očné kvapky môžu
obsahovať stopy striebra.
Vizidor nebol sledovaný u pacientov, ktorí používajú kontaktné šošovky.
Pediatrickápopulácia
Dorzolamid sa neštudoval u pacientov mladších ako 36 týždňov gestačného veku a mladších ako 1 týždeň veku. Pacienti s významnou renálnou tubulárnou nezrelosťou majú dostať dorzolamid až po starostlivom zvážení pomeru rizika a prínosu z dôvodu možného rizika metabolickej acidózy.
4.5 Liekové a iné interakcie
Špecifické interakčné štúdie s dorzolamidom sa neuskutočnili.
V klinických štúdiách sa súčasne s dorzolamidom podávali tieto liečivá, pričom sa nepozorovali nežiaduce interakcie: očný roztok timololu, očný roztok betaxololu a systémové lieky vrátane ACE inhibítorov, blokátorov kalciového kanála, diuretík, nesteroidných protizápalových liekov vrátane kyseliny acetylsalicylovej a hormónov (napr. estrogén, inzulín, tyroxín).
Počas liečby glaukómu nebola úplne zhodnotená spojitosť medzi dorzolamidom a miotikami a adrenergnými agonistami.
4.6 Fertilita, gravidita a laktácia
Gravidita
Dorzolamid sa nesmie používať počas gravidity. Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití dorzolamidu u gravidných žien. U králikov mal dorzolamid teratogénne účinky
v dávkach toxických pre matku (pozri časť 5.3).
Dojčenie
Nie je známe, či sa metabolity dorzolamidu vylučujú do materského mlieka u ľudí. Dostupné farmakodynamické/ toxikologické údaje u zvierat preukázali vylučovanie dorzolamidu/ metabolitov
do mlieka. Musí sa rozhodnúť, či prerušiť dojčenie alebo prerušiť/ zdržať sa liečby Vizidorom, berúc
do úvahy prínos dojčenie pre dieťa a prínos liečby pre ženu. Riziko pre novorodencov/ dojčatá nemožno vylúčiť.
Fertilita
Údaje na zvieratách nenaznačujú vplyv liečby dorzolamidom na fertilitu mužov a žien. Ľudské údaje chýbajú.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
O účinkoch na schopnosť viesť vozidlá alebo obsluhovať stroje sa nevykonali žiadne štúdie. Možné nežiaduce účinky, ako napr. rozmazané videnie, môžu ovplyvňovať schopnosť niektorých pacientov viesť motorové vozidlá a/alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Vo viacdávkovej, dvojito-zaslepenej, prekríženej, kontrolovanej multicentrickej štúdii s aktívnym komparátorom a dvoma periódami sa preukázalo, že bezpečnostný profil dorzolamidu v liekovej forme bez konzervačných látok je podobný viacdávkovému dorzolamidu.
Dorzolamid (s obsahom konzervačných látok) vo viacdávkovom obale sa hodnotil u viac ako 1 400 jedincov v kontrolovaných a nekontrolovaných klinických štúdiách. V dlhodobých štúdiách s 1 108 pacientmi liečenými viacdávkovým dorzolamidom ako monoterapiou alebo ako prídavnou terapiou s očným betablokátorom boli najčastejšou príčinou prerušenia (približne 3 %) liečby dorzolamidom s liekom súvisiace očné nežiaduce reakcie, prednostne konjunktivitída a reakcie na očnom viečku.
Počas klinických štúdií alebo po uvedení lieku na trh boli hlásené nasledujúce nežiaduce reakcie pre
dorzolamid : veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100)
a zriedkavé (≥ 1/10 000 až < 1/1 000), neznáme (nedá sa odhadnúť z dostupných údajov)
Trieda orgánových systémov (MedDRA)
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
| Neznáme*
*
|
Poruchy nervového systému:
|
| bolesť hlavy
|
| závrat, parestézia.
|
|
Poruchy oka
| pálenie a pichanie
| keratitis punctata superficialis, slzenie, konjunktivitída, zápal očného viečka, svrbenie v oku, podráždenie očného viečka, rozmazané videnie
| iridocyklitída
| iritácia vrátane začervenania, bolesť, krusty očného viečka, prechodná myopia (ktorá sa upravila po prerušení liečby), edém rohovky, očná hypotónia, odchlípenie chorioidey po filtračných výkonoch
| pocit cudzieho telesa v oku
|
Poruchy dýchacej sústavy, hrudníka a mediastína:
|
|
|
| epistaxa
| dyspnoe
|
Poruchy gastrointesti nálneho traktu:
|
| nauzea, horká chuť
|
| podráždenie hrdla, sucho v ústach
|
|
Poruchy kože a podkožného tkaniva:
|
|
|
| kontaktná dermatitída, Stevensov- Johnsonov syndróm, toxická epidermálna nekrolýza
|
|
Poruchy obličiek a močových ciest:
|
|
|
| urolitiáza
|
|
C
elkové poruchy a reakcie v mieste podania:
|
|
malátnosť/únava
|
|
hypersenzitivita:
prejavy
a príznaky lokálnych reakcií
(reakcií na
očnom viečku)
a systémových alergických reakcií vrátane angioedému, urtikárie
a pruritu, vyrážky, dýchavičnosti, zriedkavo bronchospazmus
|
|
P
oruchy srdca
a srdcovej
činnosti
|
|
|
|
|
palpitácie
|
Laboratórne a funkčné vyšetrenia:
Dorzolamid nebol spojený s klinicky významnými poruchami elektrolytov.
PediatrickápopuláciaPozri časť 5.1.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSú dostupné len obmedzené údaje o predávkovaní dorzolamídium-chloridom po jeho náhodnom alebo úmyselnom užití u ľudí.
PríznakyPo perorálnom užití bola hlásená: somnolencia; po lokálnej aplikácii boli hlásené: nauzea, závrat, bolesť hlavy, únava, abnormálne sny a dysfágia.
LiečbaLiečba predávkovania má byť symptomatická a podporná. Môže dôjsť k elektrolytovej nerovnováhe, rozvoju acidózy a možným účinkom na centrálnu nervovú sústavu. Treba monitorovať hladiny
elektrolytov v sére (predovšetkým draslík) a hladiny pH krvi.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1
Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiglaukomatiká a miotiká, inhibítory karboanhydrázy, dorzolamid,,
ATC kód: S01EC03
Mechanizmus účinku
Karboanhydráza (KA) je enzým vyskytujúci sa v mnohých tkanivách tela vrátane oka. U ľudí existuje
mnoho izoenzýmov karboanhydrázy, pričom najaktívnejšia je karboanhydráza II (KA-II) nachádzajúca sa predovšetkým v červených krvinkách, ale aj v iných tkanivách. Inhibícia karboanhydrázy v ciliárnych výbežkoch oka znižuje sekréciu komorového moku. Výsledkom je zníženie vnútroočného tlaku (VOT).
Vizidor obsahuje dorzolamídium-chlorid, účinný inhibítor ľudskej karboanhydrázy II. Po lokálnom očnom podaní dorzolamid znižuje zvýšený vnútroočný tlak, či už súvisí alebo nesúvisí s glaukómom. Zvýšený vnútroočný tlak je hlavný rizikový faktor v patogenéze poškodenia zrakového nervu a straty zorného poľa.
Dorzolamid nespôsobuje zúženie zrenice a znižuje vnútroočný tlak bez vedľajších účinkov, ako je šeroslepota, akomodačný kŕč. Dorzolamid má minimálny alebo žiadny účinok na frekvenciu pulzu
alebo krvný tlak.
Lokálne aplikované beta-adrenergické blokátory tiež znižujú VOT znížením sekrécie komorového moku, ale rozdielnym mechanizmom účinku. Štúdie ukázali, že keď sa dorzolamid pridá k lokálnemu betablokátoru, pozoruje sa ďalšie zníženie VOT; tento nález je v súlade s pozorovanými aditívnymi účinkami betablokátorov a perorálnych inhibítorov karboanhydrázy.
Klinická účinnosťabezpečnosť
Dospelí pacienti
V rozsiahlych klinických štúdiách s dĺžkou trvania až do jedného roka sa u pacientov s glaukómom alebo očnou hypertenziou preukázala účinnosť dorzolamidu podávaného 3-krát denne ako monoterapia (základný VOT ≥ 23 mmHg) alebo 2-krát denne ako adjuvantná terapia pri súbežnom podávaní očných betablokátorov (základný VOT ≥ 22 mmHg). Zníženie VOT po dorzolamide ako monoterapii a ako adjuvantnej terapii sa preukázalo počas celého dňa a účinok sa udržiaval počas dlhodobého podávania. Účinnosť počas dlhodobej monoterapie bola podobná účinnosti betaxololu
a mierne slabšia ako u timololu. Ak sa dorzolamid použil ako adjuvantná terapia k očným betablokátorom, preukázal podobné dodatočné zníženie VOT ako 2 % pilokarpín podávaný štyrikrát
denne.
Vo viacdávkovej, dvojito-zaslepenej, prekríženej, kontrolovanej multicentrickej štúdii s aktívnym komparátorom a dvoma periódami u 152 pacientov so zvýšeným vnútroočným tlakom (základný VOT'
≥ 22 mmHg) v jednom alebo v obidvoch očiach, mal dorzolamid v liekovej forme bez konzervačných látok rovnaký účinok na zníženie zvýšeného vnútroočného tlaku (VOT) ako viacdávkový dorzolamid. Bezpečnostný profil dorzolamidu v liekovej forme bez obsahu konzervačných látok bol podobný
viacdávkovému dorzolamidu.
Pediatrická populácia
U 184 pediatrických pacientov (122 s dorzolamidom) vo veku od 1 týždňa do < 6 rokov s glaukómom
alebo zvýšeným vnútroočným tlakom (základný VOT ≥ 22 mmHg) sa vykonala 3-mesačná, dvojito zaslepená, multicentrická štúdia s aktívnym komparátorom na zhodnotenie bezpečnosti dorzolamidu (s
obsahom konzervantov) podávaného lokálne trikrát denne. Približne polovica pacientov v oboch
liečebných skupinách mala diagnostikovaný kongenitálny galukóm, ďalšími bežnými príčinami boli
Sturgeov-Weberov syndróm, iridokorneálna mezenchymálna dysgenéza, pacienti s afakiou.
Distribúcia podľa veku a liečby bola vo fáze monoterapie nasledovná:
|
dorzolamid 2 %
|
timolol
|
veková kohorta < 2 roky
|
N=56
vekový interval: 1 až 23
mesiacov
|
timolol 0,25 % gélový roztok
N=27
vekový interval: 0,25 až 22
mesiacov
|
veková kohorta ≥ 2-< 6
rokov
|
N=66
vekový interval: 2 až 6 rokov
|
timolol 0,50 % N=35
vekový interval: 2 až 6 rokov
|
V rámci oboch vekových kohort bolo približne 70 pacientov liečených najmenej 61 dní a približne 50
pacientov 81-100 dní.
Ak sa VOT nedostatočne liečil gélovými roztokmi dorzolamidu alebo timololu v monoterapii, prešlo sa na otvorený dizajn liečby podľa nasledovného: 30 pacientov < 2 ročných bolo prestavených na súčasnú liečbu gélotvorným 0,25 % roztokom timololu denne a 2 % roztokom dorzolamidu trikrát denne; 30 pacientov vo veku ≥ 2 roky bolo prestavených na fixnú kombináciu 2 % dorzolamid/0,5 % timolol dvakrát denne.
Celkovo táto štúdia neodhalila u pediatrických pacientov ďalšie riziká čo sa týka bezpečnosti: približne u 26 % (20 % v monoterapii dorzolamidom) pediatrických pacientov boli pozorované nežiaduce účinky lieku, z ktorých väčšina boli lokálne, nezávažné účinky na oko ako napr. pálenie a pichanie v očiach, prekrvenie a bolesť oka. U malého percenta < 4 % bol pozorovaný korneálny edém alebo zákal. Miestne reakcie sa objavili v podobnej frekvencii ako u porovnávacej látky. Z
údajov po uvedení lieku na trh bola hlásená metabolická acidóza u veľmi mladých pacientov, najmä
pri nedovyvinutých/poškodených obličkách.
Výsledky účinnosti u pediatrických pacientov naznačujú, že stredné zníženie VOT pozorované v skupine dorzolamidu bolo porovnateľné so stredným znížením VOT pozorovaným v skupine timololu, hoci u timololu boli pozorované mierne lepšie číselné výsledky.
Dlhodobejšie (> 12 týždňov) štúdie účinnosti nie sú dostupné.
5.2 Farmakokinetické vlastnostiNa rozdiel od perorálnych inhibítorov karboanhydrázy, lokálne podanie dorzolamídium-chloridu umožňuje liečivu pôsobiť priamo v oku pri podstatne nižších dávkach a teda pri menšej systémovej expozícii. V klinických štúdiách to viedlo k zníženiu vnútroočného tlaku bez porúch acidobázickej rovnováhy či zmien elektrolytov, ktoré sú typické pre perorálne inhibítory karboanhydrázy.
Pri lokálnom podaní sa dorzolamid dostáva do systémového obehu. Aby sa určil potenciál inhibície systémovej karboanhydrázy po lokálnom podaní, merali sa koncentrácie liečiva a jeho metabolitu
v erytrocytoch a plazme a inhibícia karboanhydrázy v erytrocytoch. Dorzolamid sa pri chronickom
podávaní kumuluje v erytrocytoch v dôsledku selektívnej väzby na KA-II, pričom v plazme sa udržiava extrémne nízka koncentrácia voľného liečiva. Z materského liečiva sa tvorí jediný N- dezetylovaný metabolit, ktorý inhibuje KA-II menej účinne ako materské liečivo, ale inhibuje aj menej aktívny izoenzým (KA-I). Metabolit sa tiež hromadí v erytrocytoch, kde sa viaže predovšetkým na
KA-I. Dorzolamid sa stredne silno viaže na plazmatické bielkoviny (približne 33 %). Dorzolamid sa vylučuje predovšetkým nezmenený močom; metabolit sa tiež vylučuje močom. Po skončení podávania
sa dorzolamid vyplavuje z erytrocytov nelineárne, čo má za následok počiatočný rýchly pokles
koncentrácie liečiva, po ktorom nasleduje pomalšia eliminačná fáza s polčasom približne štyri
mesiace.
Ak sa dorzolamid podával perorálne, aby sa simulovala maximálna systémová expozícia po dlhodobom lokálnom očnom podávaní, rovnovážny stav sa dosiahol do 13 týždňov. V rovnovážnom stave sa v plazme prakticky nenachádzalo žiadne voľné liečivo alebo jeho metabolit. Inhibícia KA
v erytrocytoch bola slabšia, než je predpokladaná inhibícia potrebná na farmakologické ovplyvnenie renálnej funkcie alebo dýchania. Podobné farmakokinetické výsledky sa pozorovali po chronickom
lokálnom podávaní dorzolamídium-chloridu.
Avšak, niektorí starší pacienti s poruchou funkcie obličiek (odhadovaný klírens kreatinínu 30-
60 ml/min) mali vyššie koncentrácie metabolitu v erytrocytoch, tomuto nálezu však nebolo možné priamo pripísať žiadne významné rozdiely v inhibícii karboanhydrázy a žiadne klinicky významné
systémové nežiaduce účinky.
5.3 Predklinické údaje o bezpečnosti
Hlavné nálezy v štúdiách na zvieratách s perorálne podávaným dorzolamídium-chloridom súviseli
s farmakologickými účinkami systémovej inhibície karboanhydrázy. Niektoré z týchto nálezov boli druhovo špecifické a/alebo boli výsledkom metabolickej acidózy. U králikov sa po podaní dávok dorzolamidu toxických pre matku spojených s metabolickou acidózou pozorovali malformácie tiel stavcov.
U laktujúcich potkanov sa pozoroval pokles prírastku telesnej hmotnosti potomstva. U samcov a samíc potkanov, ktorým bol dorzolamid podávaný pred a počas párenia, neboli pozorované žiadne
nepriaznivé účinky na fertilitu.
V klinických štúdiách u pacientov nevznikli prejavy metabolickej acidózy alebo zmeny elektrolytov v sére, ktoré by poukazovali na systémovú inhibíciu KA. Preto sa neočakáva, že by sa účinky zaznamenané v štúdiách na zvieratách pozorovali u pacientov dostávajúcich terapeutické dávky dorzolamidu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hydroxyetylcelulóza
manitol ( E421)
citrónan sodný, dihydrát
hydroxid sodný (E524) (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov
Po prvom otvorení liek skladujte maximálne po dobu 28 dní.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
Podmienky na uchovávanie lieku po prvom otvorení pozri časť 6.3.
6.5 Druh obalu a obsah balenia
5 ml roztoku v bielej nepriehľadnej 11 ml LDPE fľaške s bielym Novelia kvapkadlom (HDPE a silikón) zapečatené bielym HDPE uzáverom.
Veľkosti balenia: 1 ,3 alebo 4 fľaštičky v papierovej škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
PharmaSwiss Česká republika, s.r.o.
Jankovcova 1569/2c
170 00 Praha 7
Česká republika
8. REGISTRAČNÉ ČÍSLO
64/0161/18-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 18. mája 2018
10. DÁTUM REVÍZIE TEXTU
09/2021