
ovanie
sildenafilu s
inými
PDE5
inhibítormi
alebo
inými
liečebnými
postupmi
na
liečbu
erektilnej
dysfunkcie
Bezpečnosť a účinnosť kombinácií sildenafilu s inými PDE5 inhibítormi alebo inými liečebnými
postupmi na liečbu pľúcnej artériovej hypertenzie (PAH) obsahujúcimi sildenafil (REVATIO) alebo inými liečebnými postupmi na liečbu erektilnej dysfunkcie nebola študovaná. Preto sa použitie
takýchto kombinácií neodporúča.
Účinky nazrak
V súvislosti s užitím sildenafilu a ostatných inhibítorov PDE5 boli spontánne hlásené prípady porúch
zraku (pozri časť 4.8). V súvislosti s užitím sildenafilu a ostatných inhibítorov PDE5 boli spontánne a z observačných štúdií hlásené prípady zriedkavého ochorenia, nearterickej prednej ischemickej
neuropatie zrakového nervu (pozri časť 4.8). Pacienti majú byť poučení, aby v akomkoľvek prípade náhlej poruchy videnia prestali užívať VIAGRU a ihneď sa poradili s lekárom (pozri časť 4.3).
Súčasné podávaniesildenafilu aritonaviru
Súčasné podávanie sildenafilu a ritonaviru sa neodporúča (pozri časť 4.5).
Súčasné podávaniesalfablokátormi
Opatrnosť sa odporúča, keď sa sildenafil podáva pacientom užívajúcim alfablokátory vzhľadom na to,
že súčasné podávanie môže viesť u niektorých citlivých jedincov k symptomatickej hypotenzii (pozri časť 4.5). Najpravdepodobnejší čas jej výskytu je do 4 hodín po podaní sildenafilu. Pacienti liečení alfablokátormi musia byť pred začatím liečby sildenafilom hemodynamicky stabilizovaní, aby sa minimalizovala možnosť vzniku posturálnej hypotenzie. Má sa zvážiť úvodná dávka sildenafilu 25 mg (pozri časť 4.2). Lekári majú okrem toho poradiť pacientom čo robiť v prípade príznakov posturálnej hypotenzie.
Účinky nakrvácanie
Štúdie in vitro s humánnymi krvnými doštičkami naznačujú, že sildenafil potenciuje antiagregačný
účinok nitroprusidu sodného. Nie sú žiadne údaje o bezpečnosti podania sildenafilu pacientom
s poruchami krvácania alebo s aktívnym peptickým vredom. Preto sa má sildenafil u týchto pacientov podávať iba po dôslednom zvážení prínosu a rizika liečby.
Filmový obal tablety VIAGRA obsahuje laktózu. VIAGRA sa nemá podávať mužom so zriedkavou vrodenou intoleranciou galaktózy, laponským deficitom laktázy alebo glukózo-galaktózovou malabsorpciou.
Ženy
VIAGRA nie je indikovaná na použitie u žien.
4.5 Liekové a iné interakcie
Účinky inýchliekovnasildenafil
Štúdie in vitro
Sildenafil je v rozhodujúcej miere metabolizovaný (CYP) izoenzýmami 3A4 (hlavná metabolická cesta) a 2C9 (vedľajšia metabolická cesta) cytochrómu P450. Inhibítory týchto izoenzýmov môžu preto znížiť klírens sildenafilu a induktory týchto izoenzýmov môžu zvýšiť klírens sildenafilu.
Štúdie in vivo
Analýzy farmakokinetických údajov rôznych skupín pacientov, ktorí boli sledovaní v klinických štúdiách, naznačujú, že dochádza k zníženiu klírensu sildenafilu, ak sa podáva súčasne s inhibítormi izoenzýmu CYP3A4 (ako sú ketokonazol, erytromycín, cimetidín).
Hoci sa u týchto pacientov nezaznamenalo žiadne zvýšenie výskytu nežiaducich účinkov, aj napriek tomu, ak sa sildenafil podáva súčasne s inhibítormi CYP3A4, má sa zvážiť úvodná dávka 25 mg.
Súčasné podávanie inhibítora HIV proteázy ritonaviru, ktorý je veľmi silný inhibítor cytochrómu P450, v rovnovážnom stave (500 mg dvakrát denne) a sildenafilu (100 mg jednorazová dávka) viedlo k 300 % (4-násobnému) vzostupu Cmax sildenafilu a k 1 000 % (11-násobnému) vzostupu AUC sildenafilu v plazme. Po uplynutí 24 hodín boli plazmatické koncentrácie sildenafilu ešte stále približne 200 ng/ml, v porovnaní s približne 5 ng/ml, ak bol sildenafil podaný samostatne. Tieto údaje sú v súlade s výraznými účinkami ritonaviru na široké spektrum substrátov P450. Sildenafil neovplyvňuje farmakokinetiku ritonaviru. Vzhľadom na tieto farmakokinetické výsledky, súčasné podávanie sildenafilu a ritonaviru sa neodporúča (pozri časť 4.4) a v žiadnom prípade maximálna dávka sildenafilu nesmie za žiadnych okolností prekročiť 25 mg za 48 hodín.
Súčasné podávanie inhibítora HIV proteázy sakvinaviru, inhibítora CYP3A4 v rovnovážnom stave (1 200 mg trikrát denne) a sildenafilu (100 mg jednorazová dávka) viedlo k 140 % vzostupu Cmax sildenafilu a k 210 % vzostupu AUC sildenafilu. Sildenafil neovplyvňuje farmakokinetiku sakvinaviru (pozri časť 4.2). Predpokladá sa, že silnejšie inhibítory CYP3A4, ako sú ketonazol a itrakonazol, by mali výraznejšie účinky.
Ak sa sildenafil podával jednorazovo v dávke 100 mg spolu s erytromycínom, stredne silným inhibítorom CYP3A4 v rovnovážnom stave (500 mg dvakrát denne 5 dní), zaznamenal sa 182 % vzostup systémovej expozície sildenafilom (AUC). U zdravých dobrovoľníkov mužského pohlavia sa nedokázal vplyv azitromicínu (500 mg denne počas 3 dní) na AUC, Cmax, tmax, eliminačnú rýchlostnú konštantu alebo následne na polčas sildenafilu alebo jeho hlavný cirkulujúci metabolit. Pri súčasnom podávaní sildenafilu (50 mg) a cimetidínu (800 mg), ktorý je inhibítorom cytochrómu P450
a nešpecifickým inhibítorom CYP3A4, zdravým dobrovoľníkom sa zaznamenal 56 % vzostup plazmatickej koncentrácie sildenafilu.
Grapefruitová šťava je slabým inhibítorom CYP3A4 metabolizmu v črevnej stene a môže vyvolať mierny vzostup plazmatických hladín sildenafilu.
Biologická dostupnosť sildenafilu nebola ovplyvnená podaním jednorazových dávok antacíd
(hydroxidu horečnatého/hydroxidu hlinitého).
Aj keď sa špecifické interakčné štúdie nerobili so všetkými liekmi, analýzy farmakokinetických údajov rôznych skupín pacientov nepreukázali žiadny vplyv inhibítorov CYP2C9 (ako sú tolbutamid, warfarín, fenytoín), inhibítorov CYP2D6 (ako sú selektívne inhibítory spätného vychytávania serotonínu, tricyklické antidepresíva), tiazidov a príbuzných diuretík, slučkových diuretík a draslík šetriacich diuretík, inhibítorov angiotenzín konvertujúceho enzýmu, blokátorov vápnikových kanálov, betablokátorov alebo induktorov metabolizmu CYP450 (ako sú rifampicín, barbituráty) na farmakokinetiku sildenafilu pri ich súčasnom podaní. V štúdii so zdravými dobrovoľníkmi mužského pohlavia viedlo súčasné podávanie antagonistu endotelínu, bosentanu (stredne silný induktor CYP3A4,induktor CYP2C9 a pravdepodobne CYP2C19) v rovnovážnom stave (125 mg dvakrát denne) so sildenafilom v rovnovážnom stave (80 mg trikrát denne) k 62,6 % zníženiu AUC a k 55,4 % zníženiu Cmax sildenafilu. Preto súčasné podávanie silných CYP3A4 induktorov ako rifampicín môže spôsobiť väčší pokles plazmatickej koncentrácie sildenafilu.
Nikorandil je hybrid aktivátora draslíkových kanálov a nitrátu. Vzhľadom na nitrátovú zložku má potenciál viesť k závažným interakciám so sildenafilom.
Účinky sildenafilu nainélieky
Štúdie in vitro:
Sildenafil je slabým inhibítorom (IC50 > 150 μmol/l) izoforiem 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4 cytochrómu P450. Je však nepravdepodobné, že by VIAGRA ovplyvňovala klírens substrátov týchto izoenzýmov, keďže vrcholová koncentrácia sildenafilu pri podávaní v odporúčaných dávkach je približne 1 μmol/l.
Nie sú žiadne údaje o interakcii sildenafilu s nešpecifickými inhibítormi fosfodiesterázy, ako sú teofylín alebo dipyridamol.
Štúdie in vivo:
V súlade so známym účinkom sildenafilu na metabolickú cestu oxid dusnatý/cGMP (pozri časť 5.1) sa preukázalo, že sildenafil potencuje hypotenzívny účinok nitrátov, a preto je jeho súčasné podanie
s donormi oxidu dusnatého alebo nitrátmi v akejkoľvek forme kontraindikované (pozri časť 4.3).
Riociguát
Predklinické štúdie ukázali aditívny systémový účinok znižujúci krvný tlak, keď sa inhibítory PDE5
podávali súčasne s riociguátom. Klinické štúdie preukázali, že riociguát zosilňuje hypotenzívne účinky inhibítorov PDE5. V skúšanej populácii nebol nájdený žiadny dôkaz o priaznivom klinickom účinku spomínanej kombinácie. Súčasné užívanie riociguátu s PDE5 inhibítormi, vrátane sildenafilu, je kontraindikované (pozri časť 4.3).
Súbežné podávanie sildenafilu pacientom užívajúcim alfablokátory môže viesť u niektorých citlivých jedincov k symptomatickej hypotenzii. Najpravdepodobnejší čas jej výskytu je do 4 hodín po podaní sildenafilu (pozri časti 4.2 a 4.4). V troch špecifických liekových interakčných štúdiách sa pacientom s benígnou hyperpláziou prostaty (BPH), stabilizovaným na liečbe doxazosínom, súčasne podával alfablokátor doxazosín (4 mg a 8 mg) a sildenafil (25 mg, 50 mg alebo 100 mg). V týchto štúdiách sa u sledovanej populácie pozorovalo priemerné dodatočné zníženie tlaku krvi v ľahu o 7/7 mmHg,
9/5 mmHg a 8/4 mmHg a priemerné dodatočné zníženie tlaku krvi v stoji o 6/6 mmHg, 11/4 mmHg a 4/5 mmHg. Keď sa sildenafil a doxazosín podávali súčasne pacientom stabilizovaným na liečbe
doxazosínom, hlásenia o výskyte symptomatickej posturálnej hypotenzie u pacientov boli ojedinelé.
Tieto hlásenia zahŕňali závraty a stratu rovnováhy, ale nie synkopu.
Nezaznamenali sa žiadne signifikantné interakcie sildenafilu (50 mg) ani s tolbutamidom (250 mg), ani s warfarínom (40 mg), liekmi, ktoré sú metabolizované CYP2C9.
Sildenafil (50 mg) nepotencoval predĺženie času krvácania zapríčineného kyselinou acetylsalicylovou
(150 mg).
Sildenafil (50 mg) nepotencoval hypotenzívny účinok alkoholu u zdravých dobrovoľníkov, ktorí mali priemernú maximálnu koncentráciu alkoholu v krvi 80 mg/dl.
Analýza výsledkov o podávaní s antihypertenzívami, ako sú diuretiká, betablokátory, ACE inhibítory, antagonisti angiotenzínu II, iné antihypertenzíva (vazodilatátory a centrálne pôsobiace), blokátory adrenergných neurónov, blokátory vápnikových kanálov a alfablokátory, nepreukázala žiadny rozdiel v profile nežiaducich účinkov medzi pacientami, ktorí užívali sildenafil, a pacientami, ktorí užívali placebo. V špecifickej interakčnej štúdii u pacientov s hypertenziou, ktorí súčasne užívali amplodipín so sildenafilom (100 mg), sa zaznamenalo ďalšie zníženie systolického tlaku krvi v ľahu o 8 mmHg. Zodpovedajúce ďalšie zníženie diastolického tlaku krvi v ľahu bolo o 7 mmHg. Toto ďalšie zníženie tlaku krvi malo podobný rozsah, ako keď sa sildenafil podával zdravým dobrovoľníkom samostatne (pozri časť 5.1).
Sildenafil (100 mg) neovplyvnil farmakokinetiku inhibítorov HIV proteáz v rovnovážnom stave, sakvinaviru a ritonaviru, ktoré sú oba substrátmi CYP3A4.
U zdravých dobrovoľníkov mužského pohlavia viedol sildenafil v rovnovážnom stave (80 mg trikrát denne) k 49,8 % zvýšeniu AUC bosentanu a k 42 % zvýšeniu Cmax bosentanu (125 mg dvakrát denne).
4.6 Fertilita, gravidita a laktácia
VIAGRA nie je indikovaná na použitie u žien.
Nie sú k dispozícii adekvátne a kontrolované štúdie u gravidných alebo dojčiacich žien.
V reprodukčných štúdiách u potkanov a zajacov sa po perorálnom podávaní sildenafilu nepozoroval žiaden relevantný nežiaduci účinok.
Nebol prítomný žiaden efekt na mobilitu spermií alebo ich morfológiu po podaní jednotlivej perorálnej dávky 100 mg sildenafilu u zdravých dobrovoľníkov (pozri časť 5.1).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Keďže závrat a zmenené videnie boli hlásené v klinických štúdiách so sildenafilom, pacienti predtým, ako budú viesť vozidlá a obsluhovať stroje, majú poznať, ako reagujú na podanie VIAGRY.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Bezpečnostný profil VIAGRY je založený na 9 570 pacientoch, ktorí sa zúčastnili 74 dvojito
zaslepených placebom kontrolovaných klinických štúdií. Najčastejšie hlásené nežiaduce reakcie
v klinických štúdiách u pacientov liečených sildenafilom boli bolesť hlavy, návaly, dyspepsia, nazálna kongescia, závraty, nevoľnosť, návaly horúčavy, poruchy zraku, cyanopsia a rozmazané videnie.
Nežiaduce reakcie v rámci sledovania po uvedení lieku na trh boli zhromaždené počas obdobia približne > 10 rokov. Vzhľadom na to, že nie všetky nežiaduce reakcie sú hlásené držiteľovi rozhodnutia o registrácii, a tým zahrnuté do bezpečnostnej databázy, frekvencie týchto reakcií sa nedajú spoľahlivo určiť.
Zoznam nežiaducichreakciízostavenýdotabuľky
V tabuľke nižšie sú všetky klinicky dôležité nežiaduce reakcie, ktoré sa vyskytli v rámci klinických
štúdií s incidenciou väčšou ako pri placebe, uvedené podľa triedy orgánových systémov a frekvencie
(veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Tabuľka 1: Klinicky dôležité nežiaduce reakcie hlásené v kontrolovaných klinických štúdiách s incidenciou väčšou ako pri placebe a klinicky dôležité nežiaduce reakcie hlásené v rámci sledovania po uvedení lieku na trh
 Trieda
orgánových systémov
Trieda
orgánových systémov Infekcie a nákazy
Veľmičasté(³
1/10)Časté(³
1/100 až< 1/10)Menej časté(³
1/1 000 až<1/100)rinitída
Zriedkavé(³
1/10 000 až < 1/1 000)
Trieda orgánových systémov Poruchy imunitného systému
Veľmi časté
(³ 1/10)
Časté
(³ 1/100 až
< 1/10)
Menej časté
(³ 1/1 000 až
<1/100)
precitlivenosť
Zriedkavé
(³ 1/10 000 až < 1/1 000)
Poruchy
nervového systému
bolesť
hlavy
závrat spavosť,
hypoestézia
cerebrovaskulárna príhoda,
tranzitórny ischemický atak, záchvat*, opätovný výskyt záchvatov*, synkopa
Poruchy oka poruchy
farebného videnia**, porucha zraku, rozmazané videnie,
poruchy
slzenia***,boles ť oka, fotofóbia, fotopsia, hyperémia oka, porucha jasného videnia, konjunktivitída,
nearteritická predná
ischemická neuropatia zrakového nervu (NAION)*, oklúzia ciev sietnice* , krvácanie sietnice, artériosklerotická
retinopatia, porucha sietnice, glaukóm, porucha v zornom poli, diplopia, znížená
ostrosť zraku,myopia, astenopia, opacity sklovca,
porucha dúhovky, mydriáza, videnie žiary, edém oka,
opuch oka, porucha oka, hyperémia spojoviek, podráždenie oka,
abnormálny pocit v oku, edém očného viečka, zmena
zafarbenia bielka
Poruchy ucha a
labyrintu
vertigo, tinitus hluchota
Poruchy srdca a srdcovej
činnosti
tachykardia, palpitácie
náhla srdcová smrť*, infarkt myokardu, komorová
arytmia*, fibrilácia predsiení, nestabilná angina pectoris
Poruchy ciev sčervenanie,
návaly horúčavy
hypertenzia,
hypotenzia

Poruchy
dýchacej sústavy,
hrudníka a mediastína
nazálna
kongescia
epistaxa,
sínusová kongescia
zvieranie hrdla, opuch nosa,
sucho v nose
Trieda orgánových systémov Poruchy gastrointestinál- neho traktu
Veľmi časté
(³ 1/10)
Časté
(³ 1/100 až
< 1/10)
nevoľnosť, dyspepsia
Menej časté
(³ 1/1 000 až
<1/100)
gastro- ezofageálna refluxná choroba, vracanie, bolesť v hornej časti brucha, sucho v ústach
Zriedkavé
(³ 1/10 000 až < 1/1 000)
hypoestézia úst
Poruchy kože a
podkožného tkaniva
vyrážka Stevensov-John-sonov syndróm (SJS)*, toxická
epidermálna nekrolýza
(TEN)*
Poruchy
kostrovej
a svalovej sústavy
a spojivového
tkaniva
myalgia, bolesť
v končatine
Poruchy
obličiek a močových ciest
hematúria
Poruchy
reprodukčného systému a prsníkov
hemorágie v penise, priapizmus*, hematospermia,
zvýšená erekcia
Celkové
poruchy a reakcie v mieste podania
bolesť hrudníka,
únava, pocit horúčavy
podráždenosť
Laboratórne a
funkčné vyšetrenia
zvýšená
frekvencia srdca
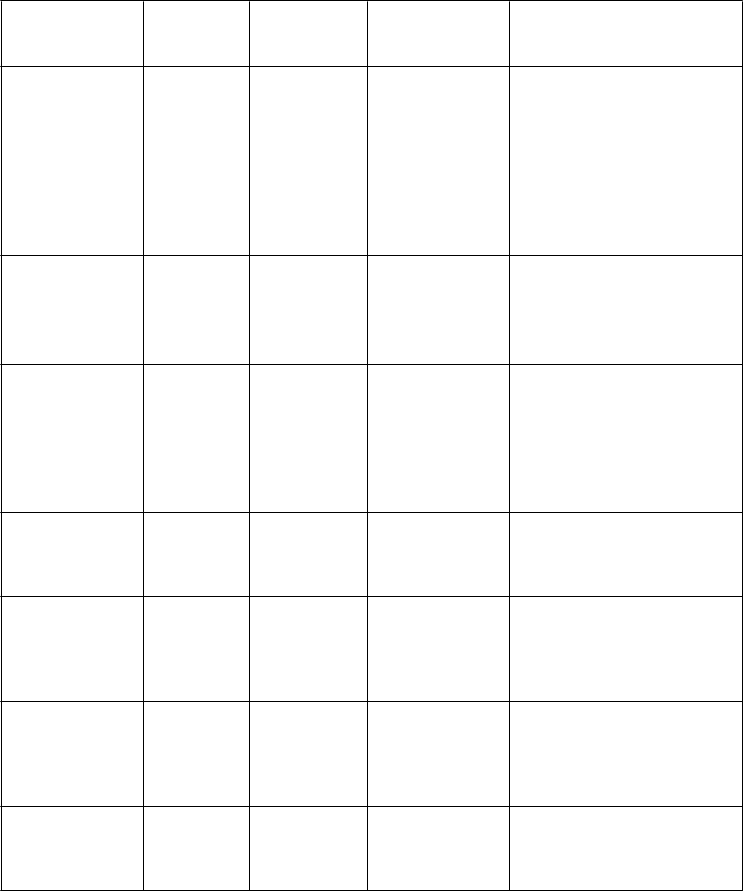
* Hlásené len počas dohľadu po uvedení lieku na trh
** Porucha farebného videnia: chloropsia, chromatopsia, cyanopsia, erytropsia a xantopsia
*** Poruchy slzenia: suché oko, porucha slzenia a zvýšené slzenie
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovanieV štúdiách so zdravými dobrovoľníkmi boli po podaní jednorazovej dávky do 800 mg nežiaduce účinky podobné ako pri podaní nižších dávok, ale vyskytovali sa častejšie a boli závažnejšie. Dávky
200 mg neviedli k väčšej účinnosti, ale viedli k vyššiemu výskytu nežiaducich účinkov (bolesť hlavy, návaly, závrat, dyspepsia, nazálna kongescia, zmena videnia).
V prípade predávkovania sa majú podľa potreby zaviesť štandardné podporné opatrenia. Keďže sildenafil je pevne viazaný na bielkoviny plazmy a neeliminuje sa močom, nie je pravdepodobné, že by renálna dialýza mala urýchliť klírens sildenafilu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Urologiká, lieky určené na liečbu erektilnej dysfunkcie, ATC kód: G04B E03
Mechanizmus účinku
Sildenafil je perorálna forma liečby erektilnej dysfunkcie. Za prirodzených podmienok, t.j. po
sexuálnej stimulácii, obnovuje narušenú erektilnú funkciu zvýšením prítoku krvi do penisu.
Fyziologický mechanizmus, ktorý je zodpovedný za erekciu penisu, zahrňuje uvoľňovanie oxidu dusnatého (NO) v kavernóznom telese penisu počas sexuálnej stimulácie. Oxid dusnatý potom aktivuje enzým guanylátcyklázu, čo nakoniec vedie ku zvýšeniu koncentrácie cyklického guanozínmonofosfátu (cGMP) a relaxácii hladkých svalov v kavernóznom telese, čo umožní prítok krvi.
Sildenafil je silný a selektívny inhibítor cGMP špecifickej fosfodiesterázy typu 5 (PDE5)
v kavernóznom telese, kde je PDE5 zodpovedná za degradáciu cGMP. Účinok sildenafilu na erekciu je založený na periférnom pôsobení. Sildenafil nemá priamy relaxačný účinok na izolované humánne kavernózne teleso, ale účinne zvyšuje relaxačný účinok oxidu dusnatého (NO) na toto tkanivo. Ak je aktivovaná metabolická cesta NO/cGMP, ako je to v prípade sexuálnej stimulácie, tak inhibícia PDE5 účinkom sildenafilu vedie k zvýšeniu koncentrácie cGMP v kavernóznom telese. Preto dochádza
k očakávanému priaznivému farmakologickému účinku sildenafilu iba v prípade sexuálnej stimulácie.
Farmakodynamické účinky
Štúdie in vitro preukázali, že sildenafil je selektívny pre PDE5, ktorá sa podieľa na procese erekcie.
Jeho účinok je výraznejší na PDE5 ako na ostatné známe fosfodiesterázy. Sildenafil je 10-krát selektívnejší pre PDE5 ako pre PDE6, ktorá sa podieľa na fototransdukcii v retine. Pri maximálnych odporučených dávkach má 80-krát vyššiu selektivitu pre PDE5 než pre PDE1 a viac ako 700-krát vyššiu selektivitu pre PDE5 než pre PDE2, 3, 4, 7, 8, 9, 10 a 11. Obzvlášť, sildenafil má 4 000-krát vyššiu selektivitu pre PDE5 ako pre PDE3, cAMP špecifickú izoformu fosfodiesterázy, ktorá sa podieľa na kontrole kontraktility srdcového svalu.
Klinická účinnosťabezpečnosť
Dve klinické štúdie sa špeciálne zaoberali tým, aby sa určil časový úsek po podaní dávky sildenafilu,
počas ktorého dochádza k erekcii ako odpovedi na sexuálnu stimuláciu. V štúdii s falopletyzmografiou
(RigiScan) u pacientov pri podávaní sildenafilu nalačno bol priemerný čas po dosiahnutie erekcie
u tých, ktorí dosiahli erekciu so 60 % rigiditou (dostačujúci stupeň rigidity na vykonanie pohlavného styku) 25 minút (rozsah 12 – 37 minút). V druhej štúdii, v ktorej sa tiež používal RigiScan, bol
sildenafil schopný vyvolať erekciu ako odpoveď na sexuálnu stimuláciu ešte 4 – 5 hodín po podaní
dávky.
Sildenafil spôsobuje mierny a prechodný pokles tlaku krvi, vo väčšine prípadov bez klinického významu. Priemerné maximálne zníženie systolického tlaku krvi v ľahu po podaní 100 mg sildenafilu perorálne bolo 8,4 mmHg. Korešpondujúca zmena diastolického tlaku krvi v ľahu bola 5,5 mmHg.
Toto zníženie hodnôt tlaku krvi je v súlade s vazodilatačným účinkom sildenafilu, pravdepodobne
v dôsledku zvýšenia cGMP v hladkých svaloch ciev. Podávanie jednorazových dávok až do 100 mg u zdravých dobrovoľníkov neviedlo k žiadnemu klinicky relevantnému účinku na EKG.
V štúdii zameranej na hemodynamické účinky jednorazovej perorálnej dávky 100 mg sildenafilu u 14 pacientov s ťažkou koronárnou artériovou chorobou (CAD) (> 70 % stenóza aspoň jednej koronárnej artérie) poklesol stredný kľudový systolický a diastolický krvný tlak o 7 % resp. o 6 % v porovnaní s východiskovými hodnotami. Stredný pľúcny systolický tlak krvi poklesol o 9 %. Sildenafil nemal vplyv na srdcový výdaj a neviedol ku zhoršeniu krvného prietoku cez stenózne koronárne artérie.
Dvojito zaslepená, placebom kontrolovaná záťažová štúdia hodnotila 144 pacientov s erektilnou dysfunkciou a chronickou stabilnou angínou, ktorí pravidelne dostávali anti-anginózne lieky (s výnimkou nitrátov). Výsledky nepreukázali žiaden klinicky relevantný rozdiel medzi sildenafilom a placebom v čase do vzniku limitujúcej anginy.
U niektorých pacientov sa jednu hodinu po podaní dávky 100 mg sildenafilu pri použití Farnsworthovho-Munsellovho testu so 100 farebnými odtieňmi pozorovali mierne a prechodné rozdiely v rozlišovaní farieb (modrá/zelená). Dve hodiny po podaní sa nezaznamenali už žiadne účinky. Možný mechanizmus tejto zmeny v rozlišovaní farieb súvisí s inhibíciou PDE6, ktorý hrá úlohu vo fototransdukčnej kaskáde retiny. Sildenafil neovplyvňuje ani ostrosť, ani kontrast videnia. V placebom kontrolovanej štúdii s malým počtom pacientov s dokumentovaným včasným štádiom vekom podmienenej makulárnej degenerácie (n = 9) neboli vo vykonaných testoch videnia (ostrosť videnia, Amslerova mriežka, rozlíšenie farieb pri simulovanom dopravnom osvetlení, Humpreyho perimeter a fotostres) dokázané žiadne významné zmeny vplyvom sildenafilu (jednorazová dávka
100 mg).
Po podaní jednorazovej perorálnej dávky 100 mg sildenafilu zdravým dobrovoľníkom sa nezaznamenal žiaden vplyv na motilitu alebo na morfológiu spermií (pozri časť 4.6).
Ďalšie informácie o klinických skúškach
V klinických skúškach sa sildenafil podával viac ako 8 000 pacientom vo veku 19 – 87 rokov. Zastúpené boli nasledovné skupiny pacientov: starší pacienti (19,9 %), pacienti s hypertenziou
(30,9 %), diabetom mellitus (20,3 %), ischemickou chorobou srdca (5,8 %), hyperlipidémiou
(19,8 %), poranením miechy (0,6 %), depresiou (5,2 %), transuretrálnou resekciou prostaty (3,7 %), pacienti po radikálnej prostatektómii (3,3 %). Nasledovné skupiny neboli dostatočne zastúpené alebo
boli vyradené z klinických skúšok: pacienti po chirurgickom výkone v oblasti panvy, pacienti po
rádioterapii, pacienti s ťažkým poškodením funkcie obličiek alebo pečene a pacienti s niektorými kardiovaskulárnymi poruchami (pozri časť 4.3).
Podiel pacientov, ktorí v štúdiách s fixnými dávkami udávali, že liečba viedla k zlepšeniu erekcie, bol
62 % (25 mg), 74 % (50 mg) a 82 % (100 mg) v porovnaní s 25 % u pacientov, ktorí užívali placebo. V kontrolovaných klinických skúškach bolo prerušenie liečby sildenafilom zriedkavé a v podobnej
miere ako u pacientov, ktorí užívali placebo.
Zhrnutie údajov zo všetkých skúšok ukazuje, že podiel pacientov, ktorí udávali zlepšenie po podaní sildenafilu bol nasledujúci: psychogénna erektilná dysfunkcia (84 %), zmiešaná erektilná dysfunkcia (77 %), organická erektilná dysfunkcia (68 %), staršie osoby (67 %), diabetes mellitus (59 %), ischemická choroba srdca (69 %), hypertenzia (68 %), TURP (61 %), radikálna prostatektómia (43 %), poranenie miechy (83 %), depresia (75 %). Bezpečnosť a účinnosť sildenafilu bola preukázaná
v dlhodobých štúdiách.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
VIAGRA vo všetkých podskupinách pediatrickej populácie na liečbu erektilnej dysfunkcie (pozri časť
4.2 ).
5.2 Farmakokinetické vlastnosti
Absorpcia
Sildenafil sa rýchlo vstrebáva. Maximálne plazmatické koncentrácie sa dosahujú 30 – 120 minút
(v priemere 60 minút) po perorálnom užití lieku nalačno. Priemerná absolútna perorálna biologická dostupnosť je 41 % (rozsah 25 – 63 %). AUC a Cmax sa po perorálnom podaní odporučených dávok sildenafilu (25 – 100 mg) zvyšujú proporcionálne s dávkou.
Ak sa sildenafil užije súčasne s jedlom, tak sa rýchlosť absorpcie zníži, pričom priemerné oneskorenie tmax je 60 minút a priemerné zníženie Cmax o 29 %.
Distribúcia
Priemerný stabilizovaný distribučný objem (Vd) sildenafilu je 105 l, čo naznačuje distribúciu do
tkanív. Po jednorazovom perorálnom podaní dávky 100 mg dosahuje priemerná maximálna celková
plazmatická koncentrácia sildenafilu približne 440 ng/ml (CV 40 %). Keďže sildenafil (a jeho hlavný cirkulujúci N-desmetyl metabolit) sa viaže v 96 % na plazmatické bielkoviny, dosahuje priemerná
maximálna plazmatická koncentrácia voľného sildenafilu 18 ng/ml (38 nmol). Väzba na bielkoviny nie je závislá od celkových koncentrácií lieku.
U zdravých dobrovoľníkov, ktorí užili sildenafil (100 mg jednorazovú dávku), bolo po 90 minútach v ejakuláte menej ako 0,0002 % užitej dávky (priemerne 188 ng).
Biotransformácia
Sildenafil je metabolizovaný predovšetkým hepatálnymi mikrozomálnymi izoenzýmami CYP3A4
(hlavná metabolická cesta) a CYP2C9 (vedľajšia metabolická cesta). Hlavný cirkulujúci metabolit sildenafilu je výsledkom N-demetylácie sildenafilu. Tento metabolit má profil selektivity na fosfodiesterázu podobný sildenafilu a účinnosť in vitro na PDE5 približne 50 % v porovnaní
s materským liečivom. Plazmatické koncentrácie tohto metabolitu zodpovedajú približne 40 %
koncentrácie sildenafilu. N-desmetyl metabolit je ďalej metabolizovaný a terminálny polčas je približne 4 h.
Eliminácia
Celkový telový klírens sildenafilu je 41 l/h a terminálny fázový polčas 3 – 5 h. Tak po perorálnom,
ako aj po intravenóznom podaní sa sildenafil vylučuje vo forme metabolitov predovšetkým do stolice (približne 80 % podanej perorálnej dávky) a v menšej miere do moču (približne 13 % podanej perorálnej dávky).
Farmakokinetika všpeciálnychskupináchpacientov
Starší ľudia
U zdravých starších dobrovoľníkov (65-ročných a starších) bol znížený klírens sildenafilu, čo viedlo k zvýšeniu plazmatických koncentrácií sildenafilu a aktívneho N-desmetyl metabolitu o približne
90 % v porovnaní s hodnotami u mladších zdravých dobrovoľníkov (18 – 45-ročných). Vzhľadom na
rozdiely vo väzbe na plazmatické bielkoviny, ktoré sú podmienené vekom, bolo zodpovedajúce zvýšenie plazmatických koncentrácií voľného sildenafilu približne 40 %.
Renálna insuficiencia
U dobrovoľníkov s miernym a stredne ťažkým poškodením funkcie obličiek (klírens
kreatinínu = 30 - 80 ml/min) nebola zmenená farmakokinetika sildenafilu po podaní jednorazovej perorálnej dávky 50 mg. Priemerná AUC a Cmax N-desmetyl metabolitu sa zvýšila na 126 %, resp. na 73 % v porovnaní s dobrovoľníkmi zodpovedajúceho veku bez poškodenia funkcie obličiek.
Vzhľadom na vysokú interindividuálnu variabilitu však tieto rozdiely neboli štatisticky signifikantné. U dobrovoľníkov s ťažkým poškodením funkcie obličiek (klírens kreatinínu < 30 ml/min) bol klírens
sildenafilu znížený a v porovnaní s dobrovoľníkmi rovnakého veku, ale bez poškodenia funkcie obličiek, sa AUC zvýšila o 100 % a Cmax o 88 %. Okrem toho hodnoty AUC a Cmax N-desmetyl metabolitu sa signifikantne zvýšili o 200 % a o 79 %.
Hepatálna insuficiencia
U dobrovoľníkov s miernou a stredne ťažkou cirhózou pečene (A a B podľa Childa-Pugha) bol klírens sildenafilu znížený a v porovnaní s dobrovoľníkmi rovnakého veku, ale bez poškodenia funkcie pečene, sa AUC zvýšila o 84 % a Cmax o 47 %. Farmakokinetika sildenafilu u pacientov s ťažkým poškodením funkcie pečene nebola študovaná.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývoja neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety: mikrokryštalická celulóza hydrogénfosforečnan vápenatý (bezvodý) sodná soľ kroskarmelózy magnéziumstearát
Filmovávrstva:
hypromelóza
oxid titaničitý (E171)
monohydrát laktózy triacetín
hliníkový lak indigokarmínu (E132).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
5 rokov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30 C.
Uchovávajte v pôvodnom balení na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
V
I
AGR
A
25 mg
filmom
obalené
tablety
PVC/hliníkové blistre v škatuľke s 2, 4, 8 alebo 12 tabletami.
VIAGRA50 mgfilmomobalenétabletyPVC/hliníkové blistre v škatuľke alebo vonkajšej teplom zatavenej skladacej karte s 2, 4, 8, 12 alebo
24 tabletami.
VIAGRA100 mgfilmomobalenétabletyPVC/hliníkové blistre v škatuľke s 2, 4, 8, 12 alebo 24 tabletami. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Limited, Sandwich, Kent CT13 9NJ, Veľká Británia
8. REGISTRAČNÉ ČÍSLOVIAGRA25 mgfilmomobalenétabletyEU/1/98/077/002–004
EU/1/98/077/013
VIAGRA50 mgfilmomobalenétabletyEU/1/98/077/006-008
EU/1/98/077/014
EU/1/98/077/016-019
EU/1/98/077/024
VIAGRA100 mgfilmomobalenétabletyEU/1/98/077/010-012
EU/1/98/077/015
EU/1/98/077/025
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. septembra 1998
Dátum posledného predĺženia registrácie: 14. septembra 2008
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
VIAGRA 50 mg orodispergovateľné tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje sildenafiliumcitrát zodpovedajúci 50 mg sildenafilu. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta.
Modré tablety v tvare zaoblených kosoštvorcov, označené nápisom “V50“ na jednej strane a ploché na strane druhej.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
VIAGRA je indikovaná u dospelých u mužov s erektilnou dysfunkciou, čo je neschopnosť dosiahnuť alebo udržať dostatočnú erekciu penisu na vykonanie uspokojivého pohlavného styku.
Aby bola VIAGRA účinná, je potrebná sexuálna stimulácia.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Použitie u dospelých:
Viagra sa má užívať podľa potreby, približne jednu hodinu pred sexuálnou aktivitou. Odporúčaná dávka je 50 mg užitá nalačno, nakoľko súčasné užitie s jedlom oneskoruje absorpciu a oneskoruje
účinok orodisergovateľnej tablety (pozri časť5.2).
Podľa účinnosti a tolerancie sa môže dávka zvýšiť na 100 mg. Maximálna odporúčaná dávka je 100 mg. Pacienti, ktorí vyžadujú zvýšenie dávky na 100 mg, majú užiť dve 50 mg orodisergovateľné tablety následne po sebe. Maximálna odporúčaná frekvencia dávkovania je jedenkrát denne. Ak sa požaduje dávka 25 mg, tak sa odporúča užiť 25 mg filmom obalenú tabletu.
Osobitné skupinypacientov
Starší pacienti
U starších ľudí sa nevyžaduje úprava dávkovania (≥ 65 rokov).
Pacienti s poškodením funkcie obličiek
U pacientov s miernym a stredným poškodením funkcie obličiek (klírens kreatinínu = 30 – 80 ml/min)
sa odporúča rovnaké dávkovanie, ako je opísané v odseku ‘Použitie u dospelých‘.
Keďže klírens sildenafilu je u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu
< 30 ml/min) znížený, má sa zvážiť dávka 25 mg. Podľa účinnosti a tolerancie je možné dávku postupne zvýšiť na 50 mg až 100 mg.
Pacienti s poškodením funkcie pečene
Keďže klírens sildenafilu je u pacientov s poškodením funkcie pečene (napr. s cirhózou) znížený, má sa zvážiť dávka 25 mg. Podľa účinnosti a tolerancie je možné dávku postupne zvýšiť na 50 mg až
100 mg.
Pediatrická populácia
VIAGRA nie je indikovaná u osôb mladších ako 18 rokov.
Použitie u pacientov, ktorí užívajú iné lieky
S výnimkou ritonaviru, kedy sa súčasné podávanie so sildenafilom neodporúča (pozri časť 4.4), má sa u pacientov súčasne užívajúcich inhibítory CYP3A4 zvážiť úvodná dávka 25 mg (pozri časť 4.5).
Pacienti liečení alfablokátormi musia byť pred začatím liečby sildenafilom stabilizovaní, aby sa minimalizovala možnosť vzniku posturálnej hypotenzie. Navyše sa má zvážiť úvodná dávka sildenafilu 25 mg (pozri časti 4.4 a 4.5).
Spôsob podávania
Na perorálne použitie.
Orodispergovateľná tableta sa má dať do úst, na jazyk a nechať rozpustiť skôr ako sa prehltne s alebo bez vody. Má sa užiť ihneď po vybratí z blistra. Pacienti, ktorí potrebujú ďalšiu 50 mg orodispergovateľnú tabletu, aby mohli užiť 100 mg, majú druhú tabletu užiť až po úplnom rozpustení prvej tablety.
Je prítomné signifikantné oneskorenie absorpcie, ak sa orodispergovateľná tableta užije s jedlom s vysokým obsahom tukov v porovnaní s užitím nalačno (pozri časť 5.2). Odporúča sa užívať tablety rozpustné v ústach nalačno. Tablety rozpustné v ústach sa môžu užívať s alebo bez vody.
4.3 Kontraindikácie
Precitlivenosť na sildenafil alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. V súlade so známym účinkom na metabolickú cestu oxidu dusnatého/cyklického
guanozínmonofosfátu (cGMP) (pozri časť 5.1) sa preukázalo, že sildenafil potencuje hypotenzívny
účinok nitrátov, a preto jeho podanie spolu s donormi oxidu dusnatého (ako je amylnitrit) alebo nitrátmi v akejkoľvek forme je kontraindikované.
Súbežné podanie PDE5 inhibítorov, vrátane sildenafilu, so stimulátormi guanylátcyklázy, akým je napr. riociguát, je kontraindikované, pretože môže viesť k symptomatickej hypotenzii (pozri časť 4.5).
Látky určené na liečbu erektilnej dysfunkcie vrátane sildenafilu nemajú používať muži, u ktorých sa sexuálna aktivita neodporúča (napr. pacienti s ťažkými kardiovaskulárnymi poruchami, ako nestabilná angina pectoris alebo ťažké srdcové zlyhávanie).
VIAGRA je kontraindikovaná u pacientov, ktorí majú stratu videnia v jednom oku v dôsledku nearteritickej prednej ischemickej neuropatie zrakového nervu (non-arteritic anterior ischaemic optic neuropathy, NAION) bez ohľadu na to, či táto príhoda súvisela alebo nesúvisela s predchádzajúcou expozíciou inhibítoru PDE5 (pozri časť 4.4).
Bezpečnosť sildenafilu sa neštudovala u nasledujúcich podskupín pacientov, a preto jeho použitie je u týchto pacientov kontraindikované: ťažké poškodenie funkcie pečene, hypotenzia (krvný
tlak < 90/50 mmHg), nedávno prekonaný infarkt myokardu alebo náhla cievna mozgová príhoda, hereditárne degeneratívne ochorenia retiny, ako sú retinitis pigmentosa (menšina z týchto pacientov
má genetickú poruchu retinálnej fosfodiesterázy).
4.4 Osobitné upozornenia a opatrenia pri používaní
Na stanovenie diagnózy erektilnej dysfunkcie a určenie jej možných príčin má sa pred rozhodnutím o farmakologickej liečbe zistiť anamnéza a urobiť fyzikálne vyšetrenie.
Kardiovaskulárne rizikovéfaktory
Pred začatím akejkoľvek liečby erektilnej dysfunkcie má lekár zohľadniť kardiovaskulárny status
pacienta, lebo sexuálna aktivita je spojená s istým stupňom kardiálneho rizika. Sildenafil má vazodilatačné vlastnosti, ktoré vedú k miernemu a prechodnému zníženiu tlaku krvi (pozri časť 5.1). Pred predpísaním sildenafilu má lekár dôkladne zvážiť, či pacient netrpí takým ochorením, ktorého priebeh by mohli uvedené vazodilatačné účinky nepriaznivo ovplyvniť, najmä v kombinácii so sexuálnou aktivitou. Medzi pacientov so zvýšenou citlivosťou pri podaní vazodilatátorov patria najmä pacienti s obštrukciou výtoku z ľavej komory (napr. aortálna stenóza, hypertrofická obštrukčná kardiomyopatia) alebo pacienti so zriedkavým syndrómom multisystémovej atrofie, ktorý sa manifestuje ako ťažké poškodenie autonómnej kontroly krvného tlaku.
VIAGRA potencuje hypotenzívny účinok nitrátov (pozri časť 4.3).
Po uvedení lieku na trh boli v časovej súvislosti s užitím VIAGRY hlásené závažné kardiovaskulárne príhody vrátane infarktu myokardu, nestabilnej angina pectoris, náhlej srdcovej smrti, komorovej arytmie, cerebrovaskulárnej hemorágie, tranzitórneho ischemického ataku, hypertenzie a hypotenzie. U väčšiny týchto pacientov, ale nie u všetkých, boli prítomné preexistujúce kardiovaskulárne rizikové faktory. Mnohé z týchto hlásených príhod vznikli počas alebo krátko po sexuálnom styku a niekoľko
z nich sa vyskytlo krátko po užití VIAGRY, ale bez sexuálnej aktivity. Nie je možné určiť, či tieto príhody priamo súvisia s uvedenými alebo inými faktormi.
Priapizmus
Látky na liečbu erektilnej dysfunkcie, vrátane sildenafilu, sa majú používať s opatrnosťou u pacientov
s anatomickou deformáciou penisu (ako angulácia, kavernózna fibróza alebo Peyronieho choroba) alebo u pacientov s ochoreniami, ktoré predisponujú k priapizmu (ako kosáčiková anémia, mnohonásobný myelóm alebo leukémia).
Z post-marketingových skúseností so sildenafilom boli hlásené predĺžené erekcie a priapizmus. V prípade erekcie, ktorá pretrváva dlhšie než 4 hodiny má pacient vyhľadať okamžitú zdravotnú pomoc. Ak priapizmus nie je liečený okamžite, môže to mať za následok poškodenie tkaniva penisu a trvalú stratu potencie.
Kombinovaniesildenafilu sinýmiPDE5inhibítormialeboinými liečebnýmipostupminaliečbuerektilnejdysfunkcie
Bezpečnosť a účinnosť kombinácii sildenafilu s inými PDE5 inhibítormi alebo inými liečebnými
postupmi na liečbu pľúcnej artériovej hypertenzie (PAH) obsahujúcimi sildenafil (REVATIO) alebo inými liečebnými postupmi na liečbu erektilnej dysfunkcie nebola študovaná. Preto sa použitie
takýchto kombinácií neodporúča.
Účinky nazrak
V súvislosti s užitím sildenafilu a ostatných inhibítorov PDE5 boli spontánne hlásené prípady porúch
zraku (pozri časť 4.8). V súvislosti s užitím sildenafilu a ostatných inhibítorov PDE5 boli spontánne a z observačných štúdií hlásené prípady zriedkavého ochorenia, nearterickej prednej ischemickej neuropatie zrakového nervu (pozri časť 4.8). Pacienti majú byť poučení, aby v akomkoľvek prípade náhlej poruchy videnia prestali užívať VIAGRU a ihneď sa poradili s lekárom (pozri časť 4.3).
Súčasné podávaniesildenafilu aritonaviru
Súčasné podávanie sildenafilu a ritonaviru sa neodporúča (pozri časť 4.5).
Súčasné podávaniesalfablokátormi
Opatrnosť sa odporúča, keď sa sildenafil podáva pacientom užívajúcim alfablokátory vzhľadom na to,
že súčasné podávanie môže viesť u niektorých citlivých jedincov k symptomatickej hypotenzii (pozri časť 4.5). Najpravdepodobnejší čas jej výskytu je do 4 hodín po podaní sildenafilu. Pacienti liečení
alfablokátormi musia byť pred začatím liečby sildenafilom hemodynamicky stabilizovaní, aby sa
minimalizovala možnosť vzniku posturálnej hypotenzie. Má sa zvážiť úvodná dávka sildenafilu 25 mg (pozri časť 4.2). Lekári majú okrem toho poradiť pacientom čo robiť v prípade príznakov posturálnej hypotenzie.
Účinky nakrvácanie
Štúdie in vitro s humánnymi krvnými doštičkami naznačujú, že sildenafil potenciuje antiagregačný
účinok nitroprusidu sodného. Nie sú žiadne údaje o bezpečnosti podania sildenafilu pacientom
s poruchami krvácania alebo s aktívnym peptickým vredom. Preto sa má sildenafil u týchto pacientov podávať iba po dôslednom zvážení prínosu a rizika liečby.
Ženy
VIAGRA nie je indikovaná na použitie u žien.
4.5 Liekové a iné interakcie
Účinky inýchliekovnasildenafil
Štúdie in vitro
Sildenafil je v rozhodujúcej miere metabolizovaný (CYP) izoenzýmami 3A4 (hlavná metabolická cesta) a 2C9 (vedľajšia metabolická cesta) cytochrómu P450. Inhibítory týchto izoenzýmov môžu preto znížiť klírens sildenafilu a induktory týchto izoenzýmov môžu zvýšiť klírens sildenafilu.
Štúdie in vivo
Analýzy farmakokinetických údajov rôznych skupín pacientov, ktorí boli sledovaní v klinických štúdiách, naznačujú, že dochádza k zníženiu klírensu sildenafilu, ak sa podáva súčasne s inhibítormi izoenzýmu CYP3A4 (ako sú ketokonazol, erytromycín, cimetidín).
Hoci sa u týchto pacientov nezaznamenalo žiadne zvýšenie výskytu nežiaducich účinkov, aj napriek tomu, ak sa sildenafil podáva súčasne s inhibítormi CYP3A4, má sa zvážiť úvodná dávka 25 mg.
Súčasné podávanie inhibítora HIV proteázy ritonaviru, ktorý je veľmi silný inhibítor cytochrómu P450, v rovnovážnom stave (500 mg dvakrát denne) a sildenafilu (100 mg jednorazová dávka) viedlo k 300 % (4-násobnému) vzostupu Cmax sildenafilu a k 1 000 % (11-násobnému) vzostupu AUC sildenafilu v plazme. Po uplynutí 24 hodín boli plazmatické koncentrácie sildenafilu ešte stále približne 200 ng/ml, v porovnaní s približne 5 ng/ml, ak bol sildenafil podaný samostatne. Tieto údaje sú v súlade s výraznými účinkami ritonaviru na široké spektrum substrátov P450. Sildenafil neovplyvňuje farmakokinetiku ritonaviru. Vzhľadom na tieto farmakokinetické výsledky, súčasné podávanie sildenafilu a ritonaviru sa neodporúča (pozri časť 4.4) a v žiadnom prípade maximálna dávka sildenafilu nesmie za žiadnych okolností prekročiť 25 mg za 48 hodín.
Súčasné podávanie inhibítora HIV proteázy sakvinaviru, inhibítora CYP3A4 v rovnovážnom stave (1 200 mg trikrát denne) a sildenafilu (100 mg jednorazová dávka) viedlo k 140 % vzostupu Cmax sildenafilu a k 210 % vzostupu AUC sildenafilu. Sildenafil neovplyvňuje farmakokinetiku sakvinaviru (pozri časť 4.2). Predpokladá sa, že silnejšie inhibítory CYP3A4, ako sú ketonazol a itrakonazol, by mali výraznejšie účinky.
Ak sa sildenafil podával jednorazovo v dávke 100 mg spolu s erytromycínom, stredne silným inhibítorom CYP3A4 v rovnovážnom stave (500 mg dvakrát denne 5 dní), zaznamenal sa 182 % vzostup systémovej expozície sildenafilom (AUC). U zdravých dobrovoľníkov mužského pohlavia sa nedokázal vplyv azitromicínu (500 mg denne počas 3 dní) na AUC, Cmax, tmax, eliminačnú rýchlostnú konštantu alebo následne na polčas sildenafilu alebo jeho hlavný cirkulujúci metabolit. Pri súčasnom podávaní sildenafilu (50 mg) a cimetidínu (800 mg), ktorý je inhibítorom cytochrómu P450
a nešpecifickým inhibítorom CYP3A4, zdravým dobrovoľníkom sa zaznamenal 56 % vzostup plazmatickej koncentrácie sildenafilu.
Grapefruitová šťava je slabým inhibítorom CYP3A4 metabolizmu v črevnej stene a môže vyvolať mierny vzostup plazmatických hladín sildenafilu.
Biologická dostupnosť sildenafilu nebola ovplyvnená podaním jednorazových dávok antacíd
(hydroxidu horečnatého/hydroxidu hlinitého).
Aj keď sa špecifické interakčné štúdie nerobili so všetkými liekmi, analýzy farmakokinetických údajov rôznych skupín pacientov nepreukázali žiadny vplyv inhibítorov CYP2C9 (ako sú tolbutamid, warfarín, fenytoín), inhibítorov CYP2D6 (ako sú selektívne inhibítory spätného vychytávania serotonínu, tricyklické antidepresíva), tiazidov a príbuzných diuretík, slučkových diuretík a draslík šetriacich diuretík, inhibítorov angiotenzín konvertujúceho enzýmu, blokátorov vápnikových kanálov, betablokátorov alebo induktorov metabolizmu CYP450 (ako sú rifampicín, barbituráty) na farmakokinetiku sildenafilu pri ich súčasnom podaní. V štúdii so zdravými dobrovoľníkmi mužského pohlavia viedlo súčasné podávanie antagonistu endotelínu, bosentanu (stredne silný induktor CYP3A4,induktor CYP2C9 a pravdepodobne CYP2C19) v rovnovážnom stave (125 mg dvakrát denne) so sildenafilom v rovnovážnom stave (80 mg trikrát denne) k 62,6 % zníženiu AUC a k 55,4 % zníženiu Cmax sildenafilu. Preto súčasné podávanie silných CYP3A4 induktorov ako rifampicín môže spôsobiť väčší pokles plazmatickej koncentrácie sildenafilu.
Nikorandil je hybrid aktivátora draslíkových kanálov a nitrátu. Vzhľadom na nitrátovú zložku má potenciál viesť k závažným interakciám so sildenafilom.
Účinky sildenafilu nainélieky
Štúdie in vitro:
Sildenafil je slabým inhibítorom (IC50 > 150 μmol/l) izoforiem 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4 cytochrómu P450. Je však nepravdepodobné, že by VIAGRA ovplyvňovala klírens substrátov týchto izoenzýmov, keďže vrcholová koncentrácia sildenafilu pri podávaní v odporúčaných dávkach je približne 1 μmol/l.
Nie sú žiadne údaje o interakcii sildenafilu s nešpecifickými inhibítormi fosfodiesterázy, ako sú teofylín alebo dipyridamol.
Štúdie in vivo:
V súlade so známym účinkom sildenafilu na metabolickú cestu oxid dusnatý/cGMP (pozri časť 5.1) sa preukázalo, že sildenafil potencuje hypotenzívny účinok nitrátov, a preto je jeho súčasné podanie
s donormi oxidu dusnatého alebo nitrátmi v akejkoľvek forme kontraindikované (pozri časť 4.3).
Riociguát
Predklinické štúdie ukázali aditívny systémový účinok znižujúci krvný tlak, keď sa inhibítory PDE5
podávali súčasne s riociguátom. Klinické štúdie preukázali, že riociguát zosilňuje hypotenzívne účinky inhibítorov PDE5. V skúšanej populácii nebol nájdený žiadny dôkaz o priaznivom klinickom účinku
spomínanej kombinácie. Súčasné užívanie riociguátu s PDE5 inhibítormi, vrátane sildenafilu, je
kontraindikované (pozri časť 4.3).
Súbežné podávanie sildenafilu pacientom užívajúcim alfablokátory môže viesť u niektorých citlivých jedincov k symptomatickej hypotenzii. Najpravdepodobnejší čas jej výskytu je do 4 hodín po podaní sildenafilu (pozri časti 4.2 a 4.4). V troch špecifických liekových interakčných štúdiách sa pacientom
s benígnou hyperpláziou prostaty (BPH), stabilizovaným na liečbe doxazosínom, súčasne podával alfablokátor doxazosín (4 mg a 8 mg) a sildenafil (25 mg, 50 mg alebo 100 mg). V týchto štúdiách sa u sledovanej populácie pozorovalo priemerné dodatočné zníženie tlaku krvi v ľahu o 7/7 mmHg,'
9/5 mmHg a 8/4 mmHg a priemerné dodatočné zníženie tlaku krvi v stoji o 6/6 mmHg, 11/4 mmHg a 4/5 mmHg. Keď sa sildenafil a doxazosín podávali súčasne pacientom stabilizovaným na liečbe doxazosínom, hlásenia o výskyte symptomatickej posturálnej hypotenzie u pacientov boli ojedinelé. Tieto hlásenia zahŕňali závraty a stratu rovnováhy, ale nie synkopu.
Nezaznamenali sa žiadne signifikantné interakcie sildenafilu (50 mg) ani s tolbutamidom (250 mg), ani s warfarínom (40 mg), liekmi, ktoré sú metabolizované CYP2C9.
Sildenafil (50 mg) nepotencoval predĺženie času krvácania zapríčineného kyselinou acetylsalicylovou
(150 mg).
Sildenafil (50 mg) nepotencoval hypotenzívny účinok alkoholu u zdravých dobrovoľníkov, ktorí mali priemernú maximálnu koncentráciu alkoholu v krvi 80 mg/dl.
Analýza výsledkov o podávaní s antihypertenzívami, ako sú diuretiká, betablokátory, ACE inhibítory, antagonisti angiotenzínu II, iné antihypertenzíva (vazodilatátory a centrálne pôsobiace), blokátory adrenergných neurónov, blokátory vápnikových kanálov a alfablokátory, nepreukázala žiadny rozdiel v profile nežiaducich účinkov medzi pacientami, ktorí užívali sildenafil, a pacientami, ktorí užívali placebo. V špecifickej interakčnej štúdii u pacientov s hypertenziou, ktorí súčasne užívali amplodipín so sildenafilom (100 mg), sa zaznamenalo ďalšie zníženie systolického tlaku krvi v ľahu o 8 mmHg. Zodpovedajúce ďalšie zníženie diastolického tlaku krvi v ľahu bolo o 7 mmHg. Toto ďalšie zníženie tlaku krvi malo podobný rozsah, ako keď sa sildenafil podával zdravým dobrovoľníkom samostatne (pozri časť 5.1).
Sildenafil (100 mg) neovplyvnil farmakokinetiku inhibítorov HIV proteáz v rovnovážnom stave, sakvinaviru a ritonaviru, ktoré sú oba substrátmi CYP3A4.
U zdravých dobrovoľníkov mužského pohlavia viedol sildenafil v rovnovážnom stave (80 mg trikrát denne) k 49,8 % zvýšeniu AUC bosentanu a k 42 % zvýšeniu Cmax bosentanu (125 mg dvakrát denne).
4.6 Fertilita, gravidita a laktácia
VIAGRA nie je indikovaná na použitie u žien.
Nie sú k dispozícii adekvátne a kontrolované štúdie u gravidných alebo dojčiacich žien.
V reprodukčných štúdiách u potkanov a zajacov sa po perorálnom podávaní sildenafilu nepozoroval žiaden relevantný nežiaduci účinok.
Nebol prítomný žiaden efekt na mobilitu spermií alebo ich morfológiu po podaní jednotlivej perorálnej dávky 100 mg sildenafilu u zdravých dobrovoľníkov (pozri časť 5.1).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Keďže závrat a zmenené videnie boli hlásené v klinických štúdiách so sildenafilom, pacienti predtým, ako budú viesť vozidlá a obsluhovať stroje, majú poznať, ako reagujú na podanie VIAGRY.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Bezpečnostný profil VIAGRY je založený na 9 570 pacientoch, ktorí sa zúčastnili 74 dvojito
zaslepených placebom kontrolovaných klinických štúdií. Najčastejšie hlásené nežiaduce reakcie
v klinických štúdiách u pacientov liečených sildenafilom boli bolesť hlavy, návaly, dyspepsia, nazálna kongescia, závraty, nevoľnosť, návaly horúčavy, poruchy zraku, cyanopsia a rozmazané videnie.
Nežiaduce reakcie v rámci sledovania po uvedení lieku na trh boli zhromaždené počas obdobia približne > 10 rokov. Vzhľadom na to, že nie všetky nežiaduce reakcie sú hlásené držiteľovi rozhodnutia o registrácii, a tým zahrnuté do bezpečnostnej databázy, frekvencie týchto reakcií sa nedajú spoľahlivo určiť.
Zoznam nežiaducichreakciízostavenýdotabuľky
V tabuľke nižšie sú všetky klinicky dôležité nežiaduce reakcie, ktoré sa vyskytli v rámci klinických
štúdií s incidenciou väčšou ako pri placebe, uvedené podľa triedy orgánových systémov a frekvencie
(veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Tabuľka 1: Klinicky dôležité nežiaduce reakcie hlásené v kontrolovaných klinických štúdiách s incidenciou väčšou ako pri placebe a klinicky dôležité nežiaduce reakcie hlásené v rámci sledovania po uvedení lieku na trh
Trieda
orgánových systémov
Infekcie a nákazy
Veľmi
časté
(³ 1/10)
Časté
(³ 1/100 až
< 1/10)
Menej časté
(³ 1/1 000 až
<1/100)
rinitída
Zriedkavé
(³ 1/10 000 až < 1/1 000)
Poruchy
imunitného systému
precitlivenosť
Poruchy
nervového systému
bolesť
hlavy
závrat spavosť,
hypoestézia
cerebrovaskulárna príhoda,
tranzitórny ischemický atak, záchvat*, opätovný výskyt záchvatov*, synkopa
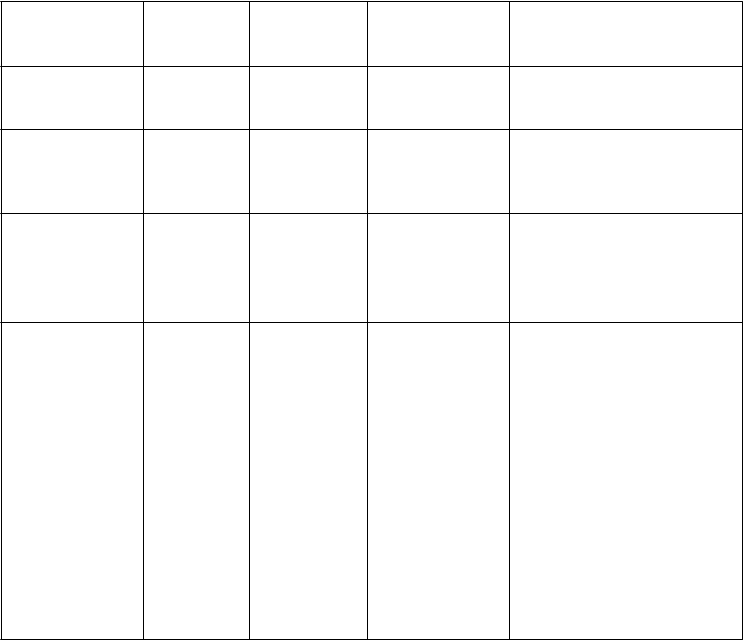
Poruchy oka poruchy
farebného videnia**, porucha zraku, rozmazané videnie
poruchy
slzenia***, bolesť oka, fotofóbia, fotopsia, hyperémia oka, porucha jasného videnia, konjunktivitída
nearteritická predná
ischemická neuropatia zrakového nervu (NAION)*, oklúzia ciev sietnice*, krvácanie sietnice, artériosklerotická
retinopatia, porucha sietnice, glaukóm, porucha v zornom poli, diplopia, znížená
ostrosť zraku, myopia, astenopia, opacitysklovca,
porucha dúhovky, mydriáza, videnie žiary, edém oka,
opuch oka, porucha oka, hyperémia spojoviek,
Trieda orgánových systémov
Veľmi časté
(
³ 1/10)
Časté
(³ 1/100 až
< 1/10)
Menej časté
(³ 1/1 000 až
<1/100)
Zriedkavé
(³ 1/10 000 až < 1/1 000)
podráždenie oka, abnormálny pocit v oku, edém očného viečka, zmena zafarbenia bielka
Poruchy ucha a
labyrintu
vertigo, tinitus hluchota
Poruchy srdca a srdcovej
činnosti
tachykardia, palpitácie
náhla srdcová smrť*, infarkt myokardu, komorová
arytmia*, fibrilácia predsiení, nestabilná angina pectoris
Poruchy ciev sčervenanie,
návaly horúčavy
hypertenzia,
hypotenzia
Poruchy
dýchacej sústavy,
hrudníka a
mediastína
nazálna
kongescia
epistaxa,
sínusová kongescia
zvieranie hrdla, opuch nosa,
sucho v nose
Poruchy
gastrointestinál- neho traktu
nevoľnosť,
dyspepsia
gastro-
ezofageálna refluxná choroba, vracanie, bolesť v hornej časti brucha, sucho v ústach
hypoestézia úst
Poruchy kože a
podkožného tkaniva
vyrážka Stevensov-John-sonov syndróm (SJS)*, toxická
epidermálna nekrolýza
(TEN)*
Poruchy
kostrovej
a svalovej sústavy
a spojivového
tkaniva
myalgia, bolesť
v končatine
Poruchy
obličiek a močových ciest
hematúria

Poruchy
reprodukčného systému a
prsníkov
hemorágie v penise, priapizmus*, hematospermia,
zvýšená erekcia
Trieda orgánových systémov Celkové poruchy a
reakcie v mieste podania
Veľmi časté
(³ 1/10)
Časté
(³ 1/100 až
< 1/10)
Menej časté
(³ 1/1 000 až
<1/100)
bolesť hrudníka, únava, pocit horúčavy
Zriedkavé
(³ 1/10 000 až < 1/1 000)
podráždenosť
Laboratórne a
funkčné vyšetrenia
zvýšená
frekvencia srdca
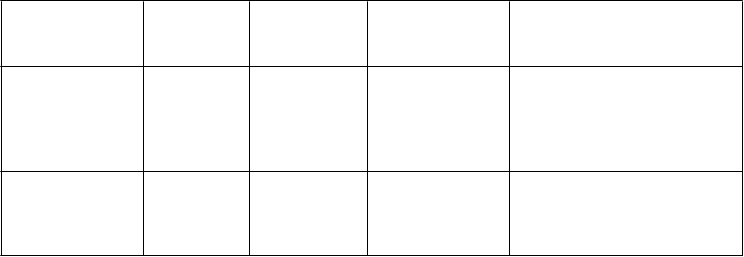
* Hlásené len počas dohľadu po uvedení lieku na trh
** Porucha farebného videnia: chloropsia, chromatopsia, cyanopsia, erytropsia a xantopsia
*** Poruchy slzenia: suché oko, porucha slzenia a zvýšené slzenie
Hlásenie podozrení nanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovanieV štúdiách so zdravými dobrovoľníkmi boli po podaní jednorazovej dávky do 800 mg nežiaduce účinky podobné ako pri podaní nižších dávok, ale vyskytovali sa častejšie a boli závažnejšie. Dávky
200 mg neviedli k väčšej účinnosti, ale viedli k vyššiemu výskytu nežiaducich účinkov (bolesť hlavy,
návaly, závrat, dyspepsia, nazálna kongescia, zmena videnia).
V prípade predávkovania sa majú podľa potreby zaviesť štandardné podporné opatrenia. Keďže sildenafil je pevne viazaný na bielkoviny plazmy a neeliminuje sa močom, nie je pravdepodobné, že by renálna dialýza mala urýchliť klírens sildenafilu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: urologiká, lieky určené na liečbu erektilnej dysfunkcie, ATC kód: G04B E03
Mechanizmus účinkuSildenafil je perorálna forma liečby erektilnej dysfunkcie. Za prirodzených podmienok, t.j. po
sexuálnej stimulácii, obnovuje narušenú erektilnú funkciu zvýšením prítoku krvi do penisu.
Fyziologický mechanizmus, ktorý je zodpovedný za erekciu penisu, zahrňuje uvoľňovanie oxidu dusnatého (NO) v kavernóznom telese penisu počas sexuálnej stimulácie. Oxid dusnatý potom aktivuje enzým guanylátcyklázu, čo nakoniec vedie ku zvýšeniu koncentrácie cyklického guanozínmonofosfátu (cGMP) a relaxácii hladkých svalov v kavernóznom telese, čo umožní prítok krvi.
Sildenafil je silný a selektívny inhibítor cGMP špecifickej fosfodiesterázy typu 5 (PDE5)
v kavernóznom telese, kde je PDE5 zodpovedná za degradáciu cGMP. Účinok sildenafilu na erekciu je založený na periférnom pôsobení. Sildenafil nemá priamy relaxačný účinok na izolované humánne
kavernózne teleso, ale účinne zvyšuje relaxačný účinok oxidu dusnatého (NO) na toto tkanivo. Ak je
aktivovaná metabolická cesta NO/cGMP, ako je to v prípade sexuálnej stimulácie, tak inhibícia PDE5
účinkom sildenafilu vedie k zvýšeniu koncentrácie cGMP v kavernóznom telese. Preto dochádza
k očakávanému priaznivému farmakologickému účinku sildenafilu iba v prípade sexuálnej stimulácie.
Farmakodynamické účinky
Štúdie in vitro preukázali, že sildenafil je selektívny pre PDE5, ktorá sa podieľa na procese erekcie.
Jeho účinok je výraznejší na PDE5 ako na ostatné známe fosfodiesterázy. Sildenafil je 10-krát selektívnejší pre PDE5 ako pre PDE6, ktorá sa podieľa na fototransdukcii v retine. Pri maximálnych
odporučených dávkach má 80-krát vyššiu selektivitu pre PDE5 než pre PDE1 a viac ako 700-krát
vyššiu selektivitu pre PDE5 než pre PDE2, 3, 4, 7, 8, 9, 10 a 11. Obzvlášť, sildenafil má 4 000-krát vyššiu selektivitu pre PDE5 ako pre PDE3, cAMP špecifickú izoformu fosfodiesterázy, ktorá sa podieľa na kontrole kontraktility srdcového svalu.
Klinická účinnosťabezpečnosť
Dve klinické štúdie sa špeciálne zaoberali tým, aby sa určil časový úsek po podaní dávky sildenafilu,
počas ktorého dochádza k erekcii ako odpovedi na sexuálnu stimuláciu. V štúdii s falopletyzmografiou
(RigiScan) u pacientov pri podávaní sildenafilu nalačno bol priemerný čas po dosiahnutie erekcie
u tých, ktorí dosiahli erekciu so 60 % rigiditou (dostačujúci stupeň rigidity na vykonanie pohlavného styku) 25 minút (rozsah 12 – 37 minút). V druhej štúdii, v ktorej sa tiež používal RigiScan, bol
sildenafil schopný vyvolať erekciu ako odpoveď na sexuálnu stimuláciu ešte 4 – 5 hodín po podaní
dávky.
Sildenafil spôsobuje mierny a prechodný pokles tlaku krvi, vo väčšine prípadov bez klinického významu. Priemerné maximálne zníženie systolického tlaku krvi v ľahu po podaní 100 mg sildenafilu perorálne bolo 8,4 mmHg. Korešpondujúca zmena diastolického tlaku krvi v ľahu bola 5,5 mmHg. Toto zníženie hodnôt tlaku krvi je v súlade s vazodilatačným účinkom sildenafilu, pravdepodobne
v dôsledku zvýšenia cGMP v hladkých svaloch ciev. Podávanie jednorazových dávok až do 100 mg u zdravých dobrovoľníkov neviedlo k žiadnemu klinicky relevantnému účinku na EKG.
V štúdii zameranej na hemodynamické účinky jednorazovej perorálnej dávky 100 mg sildenafilu u 14 pacientov s ťažkou koronárnou artériovou chorobou (CAD) (> 70 % stenóza aspoň jednej koronárnej artérie) poklesol stredný kľudový systolický a diastolický krvný tlak o 7 % resp. o 6 % v porovnaní s východiskovými hodnotami. Stredný pľúcny systolický tlak krvi poklesol o 9 %. Sildenafil nemal vplyv na srdcový výdaj a neviedol ku zhoršeniu krvného prietoku cez stenózne koronárne artérie.
Dvojito zaslepená, placebom kontrolovaná záťažová štúdia hodnotila 144 pacientov s erektilnou dysfunkciou a chronickou stabilnou angínou, ktorí pravidelne dostávali anti-anginózne lieky (s výnimkou nitrátov). Výsledky nepreukázali žiaden klinicky relevantný rozdiel medzi sildenafilom a placebom v čase do vzniku limitujúcej anginy.
U niektorých pacientov sa jednu hodinu po podaní dávky 100 mg sildenafilu pri použití Farnsworthovho-Munsellovho testu so 100 farebnými odtieňmi pozorovali mierne a prechodné rozdiely v rozlišovaní farieb (modrá/zelená). Dve hodiny po podaní sa nezaznamenali už žiadne účinky. Možný mechanizmus tejto zmeny v rozlišovaní farieb súvisí s inhibíciou PDE6, ktorý hrá úlohu vo fototransdukčnej kaskáde retiny. Sildenafil neovplyvňuje ani ostrosť, ani kontrast videnia. V placebom kontrolovanej štúdii s malým počtom pacientov s dokumentovaným včasným štádiom vekom podmienenej makulárnej degenerácie (n = 9) neboli vo vykonaných testoch videnia (ostrosť videnia, Amslerova mriežka, rozlíšenie farieb pri simulovanom dopravnom osvetlení, Humpreyho perimeter a fotostres) dokázané žiadne významné zmeny vplyvom sildenafilu (jednorazová dávka
100 mg).
Po podaní jednorazovej perorálnej dávky 100 mg sildenafilu zdravým dobrovoľníkom sa nezaznamenal žiaden vplyv na motilitu alebo na morfológiu spermií (pozri časť 4.6).
Ďalšie informácie o klinických skúškach
V klinických skúškach sa sildenafil podával viac ako 8 000 pacientom vo veku 19 – 87 rokov. Zastúpené boli nasledovné skupiny pacientov: starší pacienti (19,9 %), pacienti s hypertenziou (30,9 %), diabetom mellitus (20,3 %), ischemickou chorobou srdca (5,8 %), hyperlipidémiou
(19,8 %), poranením miechy (0,6 %), depresiou (5,2 %), transuretrálnou resekciou prostaty (3,7 %), pacienti po radikálnej prostatektómii (3,3 %). Nasledovné skupiny neboli dostatočne zastúpené alebo
boli vyradené z klinických skúšok: pacienti po chirurgickom výkone v oblasti panvy, pacienti po
rádioterapii, pacienti s ťažkým poškodením funkcie obličiek alebo pečene a pacienti s niektorými kardiovaskulárnymi poruchami (pozri časť 4.3).
Podiel pacientov, ktorí v štúdiách s fixnými dávkami udávali, že liečba viedla k zlepšeniu erekcie, bol
62 % (25 mg), 74 % (50 mg) a 82 % (100 mg) v porovnaní s 25 % u pacientov, ktorí užívali placebo. V kontrolovaných klinických skúškach bolo prerušenie liečby sildenafilom zriedkavé a v podobnej
miere ako u pacientov, ktorí užívali placebo.
Zhrnutie údajov zo všetkých skúšok ukazuje, že podiel pacientov, ktorí udávali zlepšenie po podaní sildenafilu bol nasledujúci: psychogénna erektilná dysfunkcia (84 %), zmiešaná erektilná dysfunkcia (77 %), organická erektilná dysfunkcia (68 %), staršie osoby (67 %), diabetes mellitus (59 %), ischemická choroba srdca (69 %), hypertenzia (68 %), TURP (61 %), radikálna prostatektómia (43 %), poranenie miechy (83 %), depresia (75 %). Bezpečnosť a účinnosť sildenafilu bola preukázaná
v dlhodobých štúdiách.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
VIAGRA vo všetkých podskupinách pediatrickej populácie na liečbu erektilnej dysfunkcie (pozri časť
4.2 ).
5.2 Farmakokinetické vlastnosti
Absorpcia
Sildenafil sa rýchlo vstrebáva. Maximálne plazmatické koncentrácie sa dosahujú 30 – 120 minút
(v priemere 60 minút) po perorálnom užití lieku nalačno. Priemerná absolútna perorálna biologická dostupnosť je 41 % (rozsah 25 – 63 %). AUC a Cmax sa po perorálnom podaní odporučených dávok sildenafilu (25 – 100 mg) zvyšujú proporcionálne s dávkou.
Ak sa filmom obalené tablety sildenafilu užijú súčasne s jedlom, tak sa rýchlosť absorpcie zníži, pričom priemerné oneskorenie tmax je 60 minút a priemerné zníženie Cmax o 29 %.
V klinickej štúdii na 36 zdravých mužoch vo veku 45 a viac rokov. bola pozorovaná bioekvivalencia
50 mg orodispergovateľných tabliet užitých s alebo bez vody s 50 mg filmom obalenými tabletami. V
rovnakej štúdii zostala AUC nezmenená, ale priemerná Cmax bola o 14% nižšia ak boli 50 mg orodispergovateľné tablety podávané s vodou v porovnaní s 50 mg filmom obalenými tabletami.,
Ak sa tablety rozpustné v ústach užijú s jedlom, ktoré má vysoký obsah tuku, je miera absorpcie sildenafilu redukovaná Medián Tmax je oneskorený o približne 3,4 hodiny a medián Cmax a AUC sú redukované o približne 59% a 12% v porovnaní s podaním tabliet rozpustných v ústach nalačno (pozri časť 4.2).
Distribúcia
Priemerný stabilizovaný distribučný objem (Vd) sildenafilu je 105 l, čo naznačuje distribúciu do
tkanív. Po jednorazovom perorálnom podaní dávky 100 mg dosahuje priemerná maximálna celková
plazmatická koncentrácia sildenafilu približne 440 ng/ml (CV 40 %). Keďže sildenafil (a jeho hlavný cirkulujúci N-desmetyl metabolit) sa viaže v 96 % na plazmatické bielkoviny, dosahuje priemerná
maximálna plazmatická koncentrácia voľného sildenafilu 18 ng/ml (38 nmol). Väzba na bielkoviny nie je závislá od celkových koncentrácií lieku.
U zdravých dobrovoľníkov, ktorí užili sildenafil (100 mg jednorazovú dávku), bolo po 90 minútach v ejakuláte menej ako 0,0002 % užitej dávky (priemerne 188 ng).
Biotransformácia
Sildenafil je metabolizovaný predovšetkým hepatálnymi mikrozomálnymi izoenzýmami CYP3A4
(hlavná metabolická cesta) a CYP2C9 (vedľajšia metabolická cesta). Hlavný cirkulujúci metabolit sildenafilu je výsledkom N-demetylácie sildenafilu. Tento metabolit má profil selektivity na
fosfodiesterázu podobný sildenafilu a účinnosť in vitro na PDE5 približne 50 % v porovnaní
s materským liečivom. Plazmatické koncentrácie tohto metabolitu zodpovedajú približne 40 %
koncentrácie sildenafilu. N-desmetyl metabolit je ďalej metabolizovaný a terminálny polčas je približne 4 h.
Eliminácia
Celkový telový klírens sildenafilu je 41 l/h a terminálny fázový polčas 3 – 5 h. Tak po perorálnom,
ako aj po intravenóznom podaní sa sildenafil vylučuje vo forme metabolitov predovšetkým do stolice
(približne 80 % podanej perorálnej dávky) a v menšej miere do moču (približne 13 % podanej perorálnej dávky).
Farmakokinetika všpeciálnychskupináchpacientov
Starší ľudia
U zdravých starších dobrovoľníkov (65-ročných a starších) bol znížený klírens sildenafilu, čo viedlo k zvýšeniu plazmatických koncentrácií sildenafilu a aktívneho N-desmetyl metabolitu o približne
90 % v porovnaní s hodnotami u mladších zdravých dobrovoľníkov (18 – 45-ročných). Vzhľadom na
rozdiely vo väzbe na plazmatické bielkoviny, ktoré sú podmienené vekom, bolo zodpovedajúce zvýšenie plazmatických koncentrácií voľného sildenafilu približne 40 %.
Renálna insuficiencia
U dobrovoľníkov s miernym a stredne ťažkým poškodením funkcie obličiek (klírens
kreatinínu = 30 - 80 ml/min) nebola zmenená farmakokinetika sildenafilu po podaní jednorazovej perorálnej dávky 50 mg. Priemerná AUC a Cmax N-desmetyl metabolitu sa zvýšila na 126 %, resp. na 73 % v porovnaní s dobrovoľníkmi zodpovedajúceho veku bez poškodenia funkcie obličiek.
Vzhľadom na vysokú interindividuálnu variabilitu však tieto rozdiely neboli štatisticky signifikantné. U dobrovoľníkov s ťažkým poškodením funkcie obličiek (klírens kreatinínu < 30 ml/min) bol klírens sildenafilu znížený a v porovnaní s dobrovoľníkmi rovnakého veku, ale bez poškodenia funkcie obličiek, sa AUC zvýšila o 100 % a Cmax o 88 %. Okrem toho hodnoty AUC a Cmax N-desmetyl metabolitu sa signifikantne zvýšili o 200 % a o 79 %.
Hepatálna insuficiencia
U dobrovoľníkov s miernou a stredne ťažkou cirhózou pečene (A a B podľa Childa-Pugha) bol klírens sildenafilu znížený a v porovnaní s dobrovoľníkmi rovnakého veku, ale bez poškodenia funkcie
pečene, sa AUC zvýšila o 84 % a Cmax o 47 %. Farmakokinetika sildenafilu u pacientov s ťažkým poškodením funkcie pečene nebola študovaná.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývoja neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Mikrokryštalická celulóza
Koloidný oxid kremičitý, hydrofóbny Sodná soľ kroskarmelózy Magnéziumstearát
Indigokarmím, hlinitý lak (E132) Sukralóza
Manitol Krospovidón Polyvinylacetát
Povidón
Príchuť obsahuje: Maltodextrín Dextrín
Prírodná príchute obsahuje: Maltodextrín
Glycerol (E422) Propylénglykol (E1520)
Citrónová príchuť obsahuje: Maltodextrin
Alfa-tokoferol (E307)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie. Uchovávajte v pôvodnom balení na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Hliníkové blistre v škatuľke s 2, 4, 8 alebo 12 tabletami. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Pfizer Limited, Sandwich, Kent CT13 9NJ, Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/98/077/020
EU/1/98/077/021
EU/1/98/077/022
EU/1/98/077/023
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. septembra 1998
Dátum posledného predĺženia registrácie: 14. septembra 2008
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.