
> a/alebomäkkýše
Ikosapentetyl sa získava z rybieho oleja. Nie je známe, či je u pacientov s alergiami na ryby a/alebo
mäkkýše zvýšené riziko výskytu alergickej reakcie na ikosapentetyl. Ikosapentetyl sa má podávať s opatrnosťou u pacientov so známou precitlivenosťou na ryby a/alebo mäkkýše.
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene sa majú podľa klinickej indkácie pred začatím liečby a vo
vhodných intervaloch počas liečby sledovať koncentrácie alanínaminotransferázy (ALT)
a aspartátaminotransferázy (AST).
Atriálna fibrilácia aleboflutter
Ikosapentetyl sa v dvojito zaslepenom, placebom kontrolovanom skúšaní spájala so zvýšeným rizikom
výskytu atriálnej fibrilácie alebo flutteru vyžadujúcich hospitalizáciu. Miera výskytu atriálnej fibrilácie bola vyššia u pacientov s atriálnou fibriláciou alebo chvením v anamnéze (pozri časť 4.8).
U pacientov, hlavne tých s relevantnou anamnézou, sa majú sledovať klinické dôkazy atriálnej fibrilácie alebo atriálneho flutteru (napr. dýchavičnosť, palpitácie, synkopa/závraty, diskomfort
v hrudi, zmena krvného tlaku alebo nepravidelný tep). Pri klinickej indikácii sa má vykonať elektrokardiografické vyhodnotenie.
Krvácanie
Liečba ikosapentetylom sa spájala so zvýšenou mierou výskytu krvácania. Pacienti užívajúci
ikosapentetyl spolu s antitrombotikami, t. j. látkami pôsobiacimi proti tromocytom, vrátane kyseliny acetylsalicylovej a/alebo antikoagulanciami môžu mať zvýšené riziko výskytu krvácania a majú byť
pravidelne sledovaní (pozri časť 4.8).
Obsah pomocnýchlátok
Sorbitol (E420 ii)
Tento liek obsahuje 83 mg sorbitolu v každej kapsule. Musí sa vziať do úvahy aditívny účinok súbežne podávaných liekov obsahujúcich sorbitol (alebo fruktózu) a príjem sorbitolu (alebo fruktózy) v strave.
Obsah sorbitolu v liekoch na perorálne použitie môže ovplyvniť biologickú dostupnosť iných liekov na perorálne použitie podávaných súbežne.
Pacienti s hereditárnou intoleranciou fruktózy (HFI, hereditary fructose intolerance) nesmú užívať tento liek.
Maltitol (E965 ii)
Tento liek obsahuje 30 mg maltitolu v každej kapsule.
Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy nesmú užívať tento liek.
Sójový lecitín
Tento liek obsahuje sójový lecitín. Pacienti, ktorí sú alergickí na sóju alebo arašidy, nemajú používať tento liek.
4.5 Liekové a iné interakcie
Ikosapentetyl sa skúmal v hladine dávky štyroch 998 mg kapsúl/deň s nasledujúcimi liekmi, ktoré sú typickými substrátmi enzýmov cytochrómu P450: omeprazol, rosiglitazón, warfarín a atorvastatín. Nepozorovali sa žiadne interakcie.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii je iba obmedzené množstvo údajov o použití ikosapentetylu u gravidných žien. Štúdie na
zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu ikosapentetylu počas gravidity, pokiaľ možný prínos pre matku neprevyšuje možné riziko pre plod.
Dojčenie
Nie je známe, či sa ikosapentetyl vylučuje do ľudského mlieka. Štúdie z literatúry ukázali, že aktívny
metabolit kyseliny eikosapentaénovej (EPA) sa vylučuje do ľudského mlieka v hladinách, ktoré korelujú s výživou matky. Dostupné toxikologické údaje u potkanov preukázali vylučovanie
ikosapentetylu do mlieka (pozri časť 5.3).
Riziko u dojčaťa nemôže byť vylúčené.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť/vynechať liečbu ikosapentetylom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú dostupné žiadne údaje týkajúce sa fertility pri používaní ikosapentetylu u ľudí. Štúdie na
zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Na základe farmakodynamického profilu a údajov z klinickej štúdie týkajúcich sa nežiaducich reakcií sa pre ikosapentetyl neočakáva žiadny alebo sa očakáva len zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluNajčastejšie hlásené nežiaduce reakcie spojené s ikosapentetylom boli krvácanie (11,8 %), periférny
edém (7,8 %), atriálna fibrilácia (5,8 %), zápcha (5,4 %), muskuloskeletálna bolesť (4,3 %), dna
(4,3 %) a vyrážka (3,0 %).
Tabuľkový zoznamnežiaducichreakciíNežiaduce reakcie sú klasifikované podľa frekvencie výskytu a triedy orgánových systémov.
Frekvencie hlásení nežiaducich reakcií sa odhadli z dlhodobej štúdie kardiovaskulárnych výsledkov, v ktorej sa osoby sledovali počas mediánu trvania sledovania 4,9 rokov. Kategórie frekvencie sú
definované podľa nasledujúcich konvencií: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej
časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000) a veľmi zriedkavé (< 1/10 000). Tabuľka 1 uvádza zoznam nežiaducich reakcií.
Tabuľka 1 Nežiaduce reakcieTrieda orgánových systémov podľa MedDRA
| Nežiaduca reakcia
| Frekvencia
|
Poruchy imunitného systému
| precitlivenosť
| menej časté
|
Poruchy metabolizmu a výživy
| dna
| časté
|
Poruchy nervového systému
| dysgeúzia1
| menej časté
|
Poruchy srdca a srdcovej činnosti
| atriálna fibrilácia alebo flutter2
| časté
|
Poruchy ciev
| krvácanie2
| veľmi časté
|
Poruchy gastrointestinálneho traktu
| zápcha2
| časté
|
grganie
| časté
|
Poruchy kože a podkožného tkaniva
| vyrážka
| časté
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| muskuloskeletálna
bolesť
| časté
|
Celkové poruchy a reakcie v mieste podania
| periférny edém
| časté
|
1 Dysgeúzia doslovne popisuje termín: rybia pachuť v ústach
2 Pozri časť Popis vybraných nežiaducich reakcií
Popis vybraných nežiaducich reakciíKrvácanieV placebom kontrolovanom skúšaní kardiovaskulárnych výsledkov sa krvácanie vyskytlo u 11,8 % osôb dostávajúcich ikosapentetyl v porovnaní s 9,9 % osôb dostávajúcich placebo. Závažné príhody krvácania boli hlásené častejšie u osôb dostávajúcich ikosapentetyl v porovnaní s osobami dostávajúcicmi placebo pri súbežnom podávaní v kombinácii s antitrombotikom (3,4 % oproti 2,6 %), ale vyskytlo sa v rovnakej miere (0,2 %) u osôb, ktoré súbežne neužívali antikoagulačné/antitrombotické lieky (pozri časť 4.4).
Príhody krvácania, ktoré boli pri požití ikosapentetylu najčastejšie pozorované, boli gastrointestinálne krácanie (3,1 %), pomliaždenina (2,5 %), hematúria (1,9 %) a epistaxa (1,5 %).
Atriálna fibrilácia/flutterV placebom kontrolovanom skúšaní kardiovaskulárnych výsledkov sa atriálna fibrilácia alebo atriálny flutter vyskytli u 5,8 % osôb dostávajúcich ikosapentetyl v porovnaní so 4,5 % osôb dostávajúcich placebo. Atriálna fibrilácia alebo atriálny flutter vyžadujúce hospitalizáciu na 24 hodín alebo dlhšie sa vyskytli u 3 % osôb liečených ikosapentetylom v porovnaní s 2 % osôb dostávajúcich placebo. Atriálna fibrilácia a atriálny flutter sa častejšie hlásili u osôb s atriálnou fibriláciou alebo atriálnym
chvením v anamnéze dostávajúcich ikosapentetyl v porovnaní s osobami dostávajúcimi placebo
(12,5 % oproti 6,3 %) (pozri časť 4.4).
ZápchaV placebom kontrolovanom skúšaní kardiovaskulárnych výsledkov sa zápcha vyskytla u 5,4 % osôb dostávajúcich ikosapentetyl v porovnaní s 3,6 % osôb dostávajúcich placebo. Závažná zápcha bola menej častá pre ikosapentetyl (0,1 %) a placebo (0,2 %). Relatívna miera výskytu zápchy v tejto štúdii mohla byť rušená reziduálnym laxatívnym účinkom placeba, ktoré obsahovalo subterapeutické dávky minerálneho oleja (4 ml).
Pri globálnom používaní ikosapentetylu po uvedení lieku na trh sa identifikovali nasledujúce nežiaduce reakcie. Keďže tieto reakcie sú hlásené dobrovoľne z populácie s neistou veľkosťou, nie je vo všeobecnosti možné spoľahlivo odhadnúť ich frekvenciu výskytu ani stanoviť kauzálny vzťah
k expozícii lieku: zvýšená hladina triglyceridov v krvi, artralgia, hnačka, abdominálny diskomfort a bolesť končatín.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie je k dispozícii žiadna špecifická liečba pri predávkovaní ikosapentetylom. V prípade predávkovania sa má pacient liečiť symptomaticky a podľa potreby sa má podať podporná liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Hypolipidemiká, iné látky upravujúce lipidy, ATC kód: C10AX06
Mechanizmus účinkuIkosapentetyl je stabilný etylový ester omega-3 mastnej kyseliny, kyseliny eikosapentaénovej (EPA).
Mechanizmus účinku ikosapentetylu prispievajúceho k zníženiu rizika výskytu kardiovaskulárnych príhod nie je úplne jasný. Je pravdepodobné, že mechanizmy sú multifaktoriálne, vrátane zlepšeného
lipoproteínového profilu so znížením hladiny lipoproteínov bohatých na triglyceridy, protizápalového účinku a antioxidačného účinku, zníženia akumulácie makrofágov, zlepšenia endotelovej funkcie,
zvýšenia hrúbky/stability fibrózneho spojivového tkaniva a účinku proti trombocytom. Každý z týchto mechanizmov môže pozitívne ovplyvniť vývoj, progresiu a stabilizáciu aterosklerotického plátu ako aj dôsledky jeho ruptúry a predklinické a klinické štúdie podporujú takéto prínosy EPA. Systémové
a lokálne protizápalové účinky EPA môžu byť dôsledkom vytlačenia prozápalovej kyseliny arachidónovej (AA), pričom sa katabolizmus nasmeruje od eikosanoidov (2-sériové prostaglandíny
a tromboxány a 4-sériové leukotriény) k nezápalovým alebo protizápalovým mediátorom. Priamy klinický význam jednotlivých zistení však nie je jasný.
Farmakodynamické účinkyIkosapentetyl zlepšuje lipoproteínový profil potláčaním enzýmov syntetizujúcich cholesterol, mastné
kyseliny a triglyceridy (TG), zvyšovaním β-oxidácie mastných kyselín a znižovaním syntézy
a uvoľňovania transferového proteínu mikrozomálnych triglyceridov (MTP) vedúcim k syntéze a uvoľňovaniu lipoproteínov s veľmi nízkou hustotou (
Very Low-Density Lipoprotein, VLDL). Ikosapentetyl tiež zvyšuje expresiu lipoproteínovej lipázy vedúcu k zvýšenému odstraňovaniu TG
z cirkulujúcich VLDL a chylomikrónových častíc. U pacientov so zvýšenými hladinami TG znižuje ikosapentetyl hladiny TG, VLDL, prebytočný lipoproteínový cholesterol a hladiny zápalových markerov ako je C-reaktívny proteín. Zdá sa však, že znižovanie hladín TG prispieva len v malej miere k znižovaniu rizika výskytu kardiovaskulárnych príhod pri ikosapentetyle.
Klinická účinnosť abezpečnosť
REDUCE-IT bolo medzinárodné, dvojito zaslepené, randomizované, placebom kontrolované skúšanie
s posudzovaním výskytu príhod, do ktorého bolo zaradených 8 179 (4 089 ikosapentetyl,
4 090 placebo) dospelých pacientov liečených statínmi s hladinami lipoproteínového cholesterolu s nízkou hustotou (LDL-C) > 1,03 mmol/l (40 mg/dl) a ≤ 2,59 mmol/l (100 mg/dl) a stredne
zvýšenými hladinami triglyceridov (TG) (≥ 1,53 mmol/l a < 5,64 mmol/l [≥ 135 mg/dl a < 500 mg/dl]
meraných počas skríningu pacientov, t. j. kvalifikačných návštev pred zaradením do skúšania) a buď so stanoveným kardiovaskulárnym ochorením (70,7 %) alebo diabetom a inými rizikovými faktormi
pre kardiovaskulárne ochorenie (29,3 %). Pacienti so stanoveným kardiovaskulárnym ochorením boli
definovaní ako pacienti vo veku aspoň 45 rokov a dokumentovaným ochorením koronárnych artérií, cerebrovaskulárnym ochorením alebo ochorením karotidových artérií alebo ochorením periférnych artérií v anamnéze. Pacienti v druhej rizikovej skupine boli definovaní ako pacienti vo veku aspoň
50 rokov s diabetom vyžadujúcim liečbu a najmenej jedným ďalším rizikovým faktorom t. j. hypertenzia alebo liečba antihypertenzívom, vek aspoň 55 rokov (muži) alebo aspoň 65 rokov (ženy),
hladiny lipoproteínového cholesterolu s nízkou hustotou, fajčenie, zvýšené vysokosenzitívne hladiny C-reaktívneho proteínu, porucha funkcie obličiek, mikro- alebo makroalbuminúria, retinopatia alebo znížený index členok-rameno. Pacienti boli náhodne priradení v pomere 1:1 buď na ikosapentetyl
alebo placebo (ako 4 kapsuly denne). Medián trvania sledovania bol 4,9 rokov. Celkovo bol zdravotný stav sledovaný u 99,8 % pacientov až do konca skúšania alebo úmrtia.
Východiskové charakteristiky boli medzi skupinami vyrovnané, medián veku na začiatku štúdie bol
64 rokov (rozsah: 44 rokov až 92 rokov), so 46 % vo veku aspoň 65 rokov, 28,8 % boli ženy. Populáciu skúšania tvorilo 90,2 % belochov, 5,5 % Ázijčanov, 4,2 % bolo identifikovaných ako hispánske etnikum a 1,9 % boli černosi. Čo sa týka predchádzajúcich diagnóz kardiovaskulárnych ochorení, 46,7 % malo infarkt myokardu, 9,2 % malo symptomatické ochorenie periférnych artérií a 6,1 % malo predtým neznámu mŕtvicu alebo prechodný ischemický záchvat (Transient Ischemic Attack, TIA) v anamnéze. Vybrané dodatočné východiskové rizikové faktory zahŕňali hypertenziu (86,6 %), diabetes mellitus (0,7 % typ 1; 57,8 % typ 2), eGFR < 60 ml/min. na 1,73 m2 (22,2 %), kongestívne zlyhanie srdca (17,7 %) a aktuálne každodenné fajčenie cigariet (15,2 %). Väčšina
pacientov užívala na začiatku skúšania liečbu statínmi strednej (63 %) alebo silnej (31 %) intenzity. Väčšina pacientov užívala na začiatku skúšania aspoň jeden kardiovaskulárny liek vrátane liekov pôsobiacich proti trombocytom a/alebo antitrombotík (85,5 %), betablokátorov (70,7 %), antihypertenzív (95,2 %), inhibítorov enzýmu konvertujúceho angiotenzín (ACE) (51,9 %) alebo blokátorov angiotenzínového receptora (ARB; 26,9 %). 77,5 % užívalo ACE alebo ARB. Protokol vylučoval pacientov užívajúcich inhibítory PCSK9. Na stabilnej základnej liečbe znižujúcej hladinu lipidov bol medián [Q1, Q3] východiskovej hladiny LDL-C 1,9 [1,6; 2,3] mmol/l (75,0 [62,0;
89,0] mg/dl); priemer (SD)bol 2,0 (0,5) mmol/l (76,2 [20,3] mg/dl). Na stabilnej základnej liečbe znižujúcej hladinu lipidov bol medián [Q1, Q3] hladiny TG nalačno 2,4 [2,0; 3,1] mmol/l
(216,0 [176,0; 272,5] mg/dl); priemer (SD) bol 2,6 (0,9) mmol/l (233,2 [80,1] mg/dl).
Ikosapentetyl významne znížil riziko výskytu primárneho kompozitného koncového ukazovateľa (čas do prvého výskytu kardiovaskulárneho úmrtia, infarktu myokardu, mŕtvice, koronárnej revaskularizácie alebo hospitalizácie z dôvodu nestabilnej angíny, p < 0,0001) a kľúčového sekundárneho kompozitného koncového ukazovateľa (čas do prvého výskytu kardiovaskulárneho úmrtia, infarktu myokardu alebo mŕtvice, p < 0,0001). Výsledky primárnych a sekundárnych koncových ukazovateľov účinnosti sú uvedené v tabuľke 2. Kaplanove-Meierove odhady kumulatívnej miery výskytu kľúčového sekundárneho kompozitného koncového ukazovateľa
v priebehu času sú zobrazené na obrázku 1.
T
abuľka 2 Účinok ikosapentetylu na čas do prvého výskytu kardiovaskulárnych príhod
|
I
kosapentetyl
|
Placebo
|
I
kosapentetyl oproti placebu
|
N = 4 089
n (%)
|
N = 4 090
n (%)
|
P
omer rizík
(
95 % IS)
|
Primárny kompozitný koncový ukazovateľ
|
Kardiovaskulárne úmrtie, infarkt
myokardu, mŕtvica, koronárna revaskularizácia, hospitalizácia z dôvodu nestabilnej angíny
(5-bodové veľké nežiaduce kardiovaskulárne príhody (Major
Adverse Cardiovascular Events,
MACE))
|
705 (17,2)
|
901 (22,0)
|
0,75 (0,68; 0,83)
|
K
ľúčový sekundárny kompozitný koncový ukazovateľ
|
Kardiovaskulárne úmrtie, infarkt
myokardu, mŕtvica (3-bodové
MACE)
|
459 (11,2)
|
606 (14,8)
|
0,74 (0,65; 0,83)
|
Ď
alšie sekundárne koncové ukazovatele
|
Kardiovaskulárne úmrtie[1]
|
174
(4,3)
|
213
(5,2)
|
0,80
(0,66; 0,98)
|
Úmrtie z akéhokoľvek dôvodu[2]
|
274
(6,7)
|
310
(7,6)
|
0,87
(0,74; 1,02)
|
Fatálny alebo nefatálny infarkt
myokardu
|
250
(6,1)
|
355'
(8,7)
|
0,69
(0,59; 0,81)
|
Fatálna alebo nefatálna mŕtvica
|
98
(2,4)
|
134
(3,3)
|
0,72
(0,55; 0,93)
|
Núdzová alebo naliehavá koronárna
revaskularizácia
|
216
(5,3)
|
321
(7,8)
|
0,65
(0,55; 0,78)
|
Koronárna revaskularizácia[3]
|
376 (9,2)
|
544 (13,3)
|
0,66 (0,58; 0,76)
|
Hospitalizácia z dôvodu nestabilnej angíny[4]
|
108 (2,6)
|
157 (3,8)
|
0,68 (0,53; 0,87)
|
[1] Kardiovaskulárne úmrtie zahŕňa stanovené kardiovaskulárne úmrtia a úmrtia s nestanovenou kauzalitou.
[2] Úmrtie z akéhokoľvek dôvodu alebo celková mortalita nie je komponentom žiadneho primárneho kompozitného koncového ukazovateľa ani kľúčového sekundárneho kompozitného koncového
ukazovateľa.
[3] Preddefinovaný kompozitný sekundárny koncový ukazovateľ zahŕňal núdzovú alebo naliehavú koronárnu revaskularizáciu (p < 0,0001). Koronárna revaskularizácia je kompozitom všetkých udalostí revaskularizácie a bola preddefinovaná ako terciárny koncový ukazovateľ.
[4] Stanovená, čo znamená, že je spôsobená ischémiou myokardu invazívnym/neinvazívnym testovaním a vyžaduje si okamžitú hospitalizáciu.
|
|
|
u pacientov so zvýšenými hladinami triglyceridov a kardiovaskulárnym ochorením alebo diabetom a ďalšími rizikovými faktormi v skúšaní REDUCE-IT
O
brázok
1
K
aplanov-Meierov odhad výskytu kľúčového sekundárneho kompozitného
 koncového ukazovateľa v skúšaní REDUCE
-
IT
koncového ukazovateľa v skúšaní REDUCE
-
IT
Pomer rizík 0,74
(95 % IS, 0,65-0,83) P < 0,0001
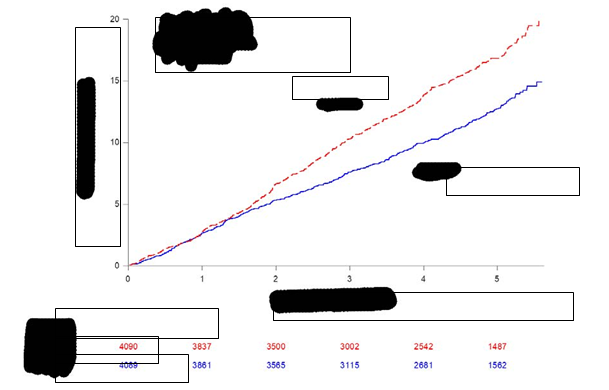 PlaceboVazkepa
PlaceboVazkepa
P
oč
e
t s rizikom
Roky od randomizácie
Placebo
Vazkepa
Kľúčový sekundárny kompozitný koncový ukazovateľ pozostával z kardiovaskulárneho úmrtia, infarktu
myokardu alebo mŕtvice (3-bodové MACE) Skratky: IS interval spoľahlivosti
Mediány východiskových hodnôt TG a LDL-C boli podobné medzi skupinou s ikosapentetylom a skupinou s placebom. Medián zmeny východiskovej hodnoty TG do 1. roku bol -0,4 mmol/l
(-39 mg/dl, -18 %) v skupine s ikosapentetylom a 0,1 mmol/l (5 mg/dl, 2 %) v skupine s placebom. Medián zmeny východiskovej hodnoty LDL-C do 1. roku bol 0,1 mmol/l (2 mg/dl, 3 %) v skupine
s ikosapentetylom a 0,2 mmol/l (7 mg/dl, 10 %) v skupine s placebom. Vopred špecifikované analýzy
účinku ikosapentetylu na kardiovaskulárne výsledky v skúšaní REDUCE-IT ukázali nízku až žiadnu koreláciu medzi odpoveďou TG alebo LDL-C a kardiovaskulárnym účinkom na základe východiskových hladín TG alebo LDL-C alebo hladín TG alebo LDL-C dosiahnutých v skúšaní. Viac informácií nájdete v časti 5.1 Mechanizmus účinku.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s ikosapentetylom
vo všetkých podskupinách pediatrickej populácie pre liečbu hypertriglyceridémie a na zníženie rizika výskytu kardiovaskulárnych príhod (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní sa ikosapentetyl deesterifikuje počas procesu absorpcie a aktívny metabolit
EPA sa absorbuje v tenkom čreve a vstupuje do systémového obehu hlavne cez torakálny systém lymfatických kanálikov. Maximálne plazmatické koncentrácie EPA sa dosiahli približne 5 hodín po
podaní perorálnych dávok ikosapentetylu.
Ikosapentetyl sa vo všetkých klinických štúdiách podávala s jedlom alebo po jedle. Nevykonali sa žiadne štúdie účinku jedla (pozri časť 4.2).
Distribúcia
Priemerný objem distribúcie v ustálenom stave EPA je približne 88 litrov. Väčšina EPA cirkulujúcej
v plazme je začlenená do fosfolipidov, triglyceridov a cholesterylových esterov a < 1 % je prítomné ako neesterifikovaná mastná kyselina. Viac ako 99 % neesterifikovanej EPA sa viaže na plazmatické
proteíny.
Biotransformácia a eliminácia
EPA sa metabolizuje hlavne pečeňou prostredníctvom beta-oxidácie, podobne ako mastné kyseliny
z potravy. Pri beta-oxidácii sa rozštiepi dlhý uhlíkový reťazec EPA na acetyl koenzým A, ktorý sa konvertuje na energiu prostredníctvom Krebsovho cyklu. Metabolizmus sprostredkovaný cytochrómom P450 je menej významnou cestou eliminácie EPA. Celkový plazmatický klírens EPA v ustálenom stave je 684 ml/h. Plazmatický polčas eliminácie (t1/2) EPA je približne 89 hodín. Ikosapentetyl nepodlieha renálnemu vylučovaniu.
Farmakokinetický/farmakodynamický vzťah
Hladina triglyceridov/zníženie hypertriglyceridémie
V dvoch štúdiách fázy III sa pozoroval lineárny vzťah medzi hladinami EPA v plazme alebo erytrocytoch a znížením hladín TG.
Zníženie kardiovaskulárneho rizika
Analýzy primárnych (5-bodových) a kľúčových sekundárnych (3-bodových) koncových ukazovateľov MACE naznačujú, že lipoproteínové zmeny mali pri liečbe obmedzený vplyv na zníženia kardiovaskulárneho rizika, zatiaľ čo sérové hladiny EPA v ustálenom stave pri liečbe zodpovedali za väčšinu zníženia relatívneho rizika pozorovaného v skúšaní REDUCE-IT. Východisková sérová hladina EPA bolo 26 μg/ml. V porovnaní s liečenými pacientmi so sérovou hladinou EPA v ustálenom stave pod 100 μg/ml mali liečení pacienti s hladinami EPA ≥ 175 μg/ml o > 50 % znížené riziko výskytu kardiovaskulárnej príhody.
Porucha funkcie obličiek apečene
Farmakokinetické vlastnosti ikosapentetylu sa neskúmali u pacientov s poruchou funkcie obličiek
alebo pečene. Vo výsledkoch dobre kontrolovanej štúdie s ikosapentetylom sa u pacientov nevyžadovala úprava rutinnej dávky z dôvodu poruchy funkcie pečene alebo obličiek.
Iné osobitné populácie
Starší pacienti (≥ 65 rokov)
Farmakokinetické vlastnosti ikosapentetylu sa neskúmali u starších pacientov. V dobre kontrolovaných klinických štúdiách s ikosapentetylom sa u starších pacientov nevyžadovala úprava rutinnej dávky.
Pediatrická populácia
Farmakokinetické vlastnosti ikosapentetylu sa neskúmali u pediatrických pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Pri najvyšších hladinách dávky v reprodukčných a vývojových štúdiách sa nepozorovali žiadne nežiaduce účinky u potkanov alebo králikov pri približne 6 až 8-násobnej dávke oproti zodpovedajúcej ľudskej dávke na základe porovnania telesného povrchu. V embryofetálnych štúdiách u potkanov sa nepozorovali žiadne nežiaduce účinky pri 6,9-násobne vyšších expozíciách ako je klinická expozícia (na základe hodnoty AUC).
Štúdie na zvieratách naznačujú, že ikosapentetyl prechádza cez placentu a nachádza sa v plazme plodu.
Štúdie na zvieratách naznačujú, že ikosapentetyl sa vylučuje do mlieka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Zoznam pomocných látok
Náplň kapsuly
all-rac-alfa-tokoferol
Obal kapsuly
želatína
glycerín
tekutý maltitol (E965 ii)
tekutý sorbitol (nekryštalizujúci) (E420 ii)
čistená voda sójový lecitín
Farba tlače
oxid titaničitý
propylénglykol hypromelóza
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
4 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
Fľaša: fľašu uchovávajte dobre uzavretú na ochranu pred vlhkosťou. Blister: uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Fľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým detským bezpečnostným uzáverom zataveným tepelnou indukciou obsahujúce 120 mäkkých kapsúl.
PVC/PCTFE/Al perforované blistre s jednotkovými dávkami obsahujúce 4 x 2 mäkkých kapsúl.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAmarin Pharmaceuticals Ireland Limited
88 Harcourt Street
Dublin 2, D02DK18
Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/20/1524/001
EU/1/20/1524/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. marec 2021
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.