
liekom Tysabri alebo do 6 mesiacov po zastavení liečby.
· Povedzte svojmu partnerovi alebo opatrovateľom o tom, čo si majú na vás všímať (pozri tiež časť 4 Možné vedľajšie účinky). Niektoré príznaky, ako sú zmeny nálady alebo správania, zmätenosť, ťažkosti s rečou a komunikáciou, si môžete ťažko sami všimnúť. Ak sa u vás vyskytne niečo z uvedeného, možno budete potrebovať ďalšie vyšetrenia. Naďalej si všímajte svoje príznaky až do 6 mesiacov od vysadenia lieku Tysabri.
· Majte pri sebe kartu pre pacienta, ktorú vám odovzdal váš lekár. Obsahuje tieto informácie.
Ukážte ju svojmu partnerovi alebo opatrovateľom.
Vaše riziko vzniku PML pri používaní lieku Tysabri môžu zvýšiť tri veci. Ak máte dva alebo viac týchto rizikových faktorov, riziko je ešte viac zvýšené:
· Ak máte protilátky proti JC vírusu v krvi. Je to príznak vírusu vo vašom tele. Pred liečbou a počas liečby liekom Tysabri budete vyšetrený.
· Ak ste liečený dlhý čas liekom Tysabri, najmä dlhšie ako dva roky.
· Ak ste užívali liek nazývaný imunosupresívum, ktorý znižuje aktivitu vášho imunitného systému.
Ďalšie ochorenie nazývané JCV GCN (JCV neuropatia granulárnych buniek) je tiež spôsobované JC vírusom a vyskytlo sa u niektorých pacientov používajúcich liek Tysabri. Príznaky JCV GCN sú podobné príznakom PML.
U pacientov s nižším rizikom PML môže lekár tento test opakovať pravidelne, aby zistil, či:
· aj naďalej nemáte v krvi protilátky proti JC vírusu,
· ak sa liečite dlhšie ako 2 roky, máte aj naďalej nižšiu hladinu protilátok proti JC vírusu v krvi.
Ak sa u niekoho vyskytne PML
PML možno liečiť a liečba liekom Tysabri sa zastaví. U niektorých osôb sa však vyskytne reakcia, keď sa liek Tysabri vylučuje z tela. Táto reakcia (známa ako IRIS alebo imunoreštitučný zápalový syndróm) môže spôsobiť zhoršenie vášho zdravotného stavu vrátane zhoršenia funkcie mozgu.
Všímajte si ďalšie infekcie
Niektoré infekcie iné ako PML môžu byť takisto závažné a môžu byť spôsobené vírusmi, baktériami a inými príčinami.
Okamžite povedzte lekárovi alebo zdravotnej sestre, ak si myslíte, že máte infekciu (pozri tiež časť
4 Možné vedľajšie účinky).
Zmeny v krvných doštičkách
Natalizumab môže v krvi znižovať počet krvných doštičiek, ktoré sú zodpovedné za zrážanie krvi. To môže mať za následok stav nazývaný trombocytopénia (pozri časť 4), pri ktorom sa krv nemusí zrážať dostatočne rýchlo na to, aby sa zastavilo krvácanie. Môže to spôsobiť tvorbu modrín, ako aj ďalšie závažné problémy, napríklad silné krvácanie. Ak sa u vás vyskytne nevysvetliteľná tvorba modrín, červené alebo fialové škvrny na koži (nazývané petechia), nezastaviteľné alebo presakujúce krvácanie po porezaní kože, dlhotrvajúce krvácanie z ďasien alebo nosa, krv v moči alebo stolici alebo krvácanie do očných bielok, ihneď to povedzte svojmu lekárovi.
Deti a dospievajúci
Nedávajte tento liek deťom ani dospievajúcim mladším ako 18 rokov.
Iné lieky a Tysabri
Ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to
svojmu lekárovi.
· Tento liek vám nesmie byť podaný, ak ste v súčasnosti liečený liekmi, ktoré ovplyvňujú váš
imunitný systém vrátane určitých iných liekov na liečbu SM.
· Je možné, že nebudete môcť používať tento liek, ak ste predtým dostávali nejaké lieky, ktoré
ovplyvňujú váš imunitný systém.
Tehotenstvo a dojčenie
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná, alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek.
· Ak ste tehotná, nepoužívajte tento liek bez toho, aby ste sa poradili so svojím lekárom. Ihneď oznámte vášmu lekárovi, ak ste otehotneli, ak si myslíte, že ste tehotná, alebo ak plánujete otehotnieť.
· Počas používania Tysabri nedojčite. Váš lekár vám pomôže rozhodnúť sa, či by ste mali prestať dojčiť alebo prestať používať liek.
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek. Váš lekár zváži riziko pre dieťa a prínos pre matku.
Vedenie vozidiel a obsluha strojov
Závraty sú veľmi častý vedľajší účinok. Ak sa u vás vyskytnú, neveďte vozidlá a neobsluhujte stroje.
Tysabri obsahuje sodík
Jedna injekčná liekovka tohto lieku obsahuje 2,3 mmol (alebo 52 mg) sodíka. Po zriedení na použitie obsahuje tento liek 17,7 mmol (alebo 406 mg) sodíka na 1 dávku. To sa má vziať do úvahy, ak máte diétu s nízkym obsahom sodíka.
3. Ako používať Tysabri
Vnútrožilovú infúziu Tysabri vám bude podávať lekár so skúsenosťami v liečbe SM. Váš lekár vás môže previesť priamo z inej terapie SM na Tysabri za predpokladu, že nie sú u vás prítomné žiadne problémy súvisiace s predchádzajúcou liečbou.
· Lekár nariadi krvné testy na zistenie protilátok proti JC vírusu a iných možných problémov.
· Lekár zariadi vyšetrenie MR, ktoré sa počas liečby zopakuje.
· Pri prechode z niektorých liekov na SM vám lekár môže odporučiť, aby ste určitý čas počkali
na uistenie, že sa väčšina predchádzajúceho lieku vylúčila z vášho tela.
· Pre dospelých je odporúčaná dávka 300 mg podaná každé 4 týždne.
· Tysabri musí byť zriedený predtým, ako vám bude podaný. Podáva sa do žily (intravenóznou infúziou), obyčajne do hornej končatiny. Trvá to asi 1 hodinu.
· Informácie pre lekárov a ostatných zdravotníckych pracovníkov o príprave a podaní lieku sa nachádzajú na konci tejto písomnej informácie.
Ak prestanete používať Tysabri
Pravidelné podávanie lieku Tysabri je dôležité najmä v prvých mesiacoch liečby. Je dôležité pokračovať v tejto liečbe tak dlho, pokým vy a váš lekár usudzujete, že vám pomáha. Pacienti, ktorí dostali jednu alebo dve dávky Tysabri a potom prerušili liečbu na tri a viac mesiacov, mali vyššiu pravdepodobnosť alergickej reakcie pri opätovnom začatí liečby.
Kontrola alergických reakcií
U niektorých pacientov sa vyskytla alergická reakcia na tento liek. Váš lekár bude kontrolovať alergické reakcie počas podávania infúzie a 1 hodinu po podaní. Pozri tiež časť 4 Možné vedľajšie účinky.
Ak vynecháte dávku Tysabri
Ak vynecháte vašu zvyčajnú dávku Tysabri, dohodnite sa so svojím lekárom, aby ste ju dostali čo najskôr. Potom môžete pokračovať v liečbe ďalšími dávkami Tysabri každé 4 týždne.
Bude TYSABRI vždy účinkovať?
U niektorých pacientov, ktorí používajú Tysabri, môže po nejakom čase prirodzená obranyschopnosť tela zastaviť riadne pôsobenie lieku, pretože telo si vytvorí protilátky proti lieku. Váš lekár sa môže rozhodnúť vyšetriť vám krv, aby zistil, či u vás liek riadne účinkuje, a ak je to potrebné, liečbu zastaví.
Ak máte akékoľvek ďalšie otázky týkajúce sa Tysabri, opýtajte sa svojho lekára. Vždy používajte tento liek presne tak, ako je to uvedené v tejto písomnej informácii, alebo ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to u svojho lekára.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Ak spozorujte ktorýkoľvek z nasledujúcich príznakov, okamžite to oznámte svojmu lekárovi alebo
zdravotnej sestre. Príznaky infekcie mozgu
· zmeny osobnosti a správania, ako zmätenosť, delírium alebo strata vedomia,
· epileptické záchvaty (kŕče),
· bolesť hlavy,
· nevoľnosť/vracanie,
· stuhnutosť šije,
· extrémna precitlivenosť na jasné svetlo,
· horúčka,
· vyrážky (kdekoľvek na tele).
Uvedené príznaky môžu byť spôsobené infekciou mozgu (encefalitída alebo PML) alebo mozgových blán (meningitída).
Prejavy iných závažných infekcií
· nevysvetliteľná horúčka,
· ťažká hnačka,
· dýchavičnosť,
· dlhodobé závraty,
· bolesť hlavy,
· úbytok hmotnosti,
· apatia,
· porucha zraku,
· bolesť alebo začervenanie oka (očí).
Prejavy alergickej reakcie
· svrbivá vyrážka (žihľavka),
· opuch tváre, pier alebo jazyka,
· ťažkosti s dýchaním,
· bolesti alebo ťažkosti na hrudníku,
· zvýšenie alebo zníženie tlaku krvi (zistí to váš lekár alebo zdravotná sestra, ak sledujú váš tlak krvi).
Tieto prejavy sa najpravdepodobnejšie vyskytnú počas podávania infúzie alebo krátko po podaní.
Prejavy možného problému s pečeňou
· zožltnutie pokožky alebo očných bielok,
· nezvyčajné stmavnutie moču,
· neobvyklé výsledky testu funkcie pečene.
Okamžite informujte lekára alebo zdravotnú sestru, ak sa u vás vyskytne niektorý z vyššie uvedených vedľajších účinkov, alebo ak si myslíte, že máte infekciu. Nielen svojmu neurológovi, ale každému lekárovi alebo zdravotnej sestre, ktorí vás ošetrujú, ukážte svoju kartu pre pacienta a túto písomnú informáciu pre používateľa.
Ďalšie vedľajšie účinky
Veľmi časté (môžu postihovať viac ako 1 z 10 osôb)
· infekcia močových ciest,
· bolesť hrdla a nádcha alebo upchaný nos,
· bolesť hlavy,
· závraty,
· pocit nutkania na vracanie (nauzea),
· bolesť kĺbov,
· únava,
· závraty, pocit nevoľnosti (nauzea), svrbenie a zimnica počas podávanie infúzie alebo krátko po
podaní.
Časté (môžu postihovať menej ako 1 z 10 osôb)
· anémia (pokles počtu červených krviniek, ktorý sa môže u vás prejaviť bledosťou kože a dýchavičnosťou alebo pocitom nedostatku energie),
· alergia (precitlivenosť),
· triaška,
· svrbivá vyrážka (žihľavka),
· nevoľnosť (vracanie),
· horúčka,
· problémy s dýchaním (dyspnoe),
· sčervenanie tváre alebo tela,
· herpetické infekcie,
· nepríjemný pocit v okolí miesta, kde vám bola podaná infúzia. Mohla by sa u vás vyskytnúť modrina, začervenanie, bolesť, svrbenie alebo opuch.
Menej časté (môžu postihovať menej ako 1 zo 100 osôb)
· závažná alergia (anafylaktická reakcia),
· progresívna multifokálna leukoencefalopatia (PML),
· zápalová porucha po vysadení lieku,
· opuch tváre,
· zvýšenie počtu bielych krviniek (eozinofília).
· zníženie počtu krvných doštičiek,
· ľahká tvorba modrín (purpura).
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
· herpetická infekcia v oku,
· závažná anémia (pokles počtu červených krviniek, ktorý môže spôsobiť zblednutie kože a dýchavičnosť alebo nedostatok energie),
· závažný opuch pod kožou,
· vysoká hladina bilirubínu v krvi (
hyperbilirubinémia), ktorá môže spôsobiť také príznaky ako zožltnutie očí alebo kože, horúčku a únavu.
N
eznáme (frekvenciu nemožno odhadnúť z dostupných údajov)
· nezvyčajné infekcie (takzvané
oportúnne infekcie),
· poškodenie pečene.
Čo najskôr informujte svojho lekára, ak si myslíte, že máte infekciu.
Tieto informácie nájdete aj v karte pre pacienta, ktorú ste dostali od vášho lekára.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára. To sa týka aj

akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky

môžete hlásiť aj priamo na
v Prílohe V. Hlásením vedľajších
účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať Tysabri
Tento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
Neotvorené injekčné liekovky: Uchovávajte v chladničke. Neuchovávajte v mrazničke.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Zriedený roztok:
Po zriedení sa odporúča okamžité použitie. Ak sa nepoužije okamžite, musí sa zriedený roztok uchovávať pri 2 ˚C až 8 ˚C a musí sa infúzne podať do 8 hodín po zriedení.
Nepoužívajte tento liek, ak spozorujete v kvapaline viditeľné častice a/alebo je kvapalina v injekčnej
liekovke sfarbená.
6. Obsah balenia a ďalšie informácie
Čo Tysabri obsahuje
Liečivo je natalizumab. Každá injekčná liekovka koncentrátu s objemom 15 ml obsahuje 300 mg
natalizumabu (20 mg na ml). Po zriedení infúzny roztok obsahuje približne 2,6 mg/ml natalizumabu.
Ďalšie zložky sú:
monohydrát dihydrogenfosforečnanu sodného, heptahydrát hydrogenfosforečnanu sodného,
chlorid sodný (pozri časť 2 Tysabri obsahuje sodík),
polysorbát 80 (E 433), voda na injekcie.
Ako vyzerá Tysabri a obsah balenia
Tysabri je číra, bezfarebná až mierne opaleskujúca kvapalina. Každá škatuľa obsahuje jednu sklenenú injekčnú liekovku.
Držiteľ rozhodnutia o registráciiBiogen Netherlands B.V. Prins Mauritslaan 13
1171 LP Badhoevedorp
Holandsko
VýrobcaFUJIFILM Diosynth Biotechnologies Denmark ApS Biotek Allé 1
DK-3400 Hillerød
Dánsko
Biogen Netherlands B.V.

Prins Mauritslaan 13
1171 LP Badhoevedorp
Holandsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii.
België/Belgique/Belgien
Biogen Belgium N.V./S.A. Tél/Tel: +32 2 219 12 18
Lietuva
Biogen Lithuania UAB Tel: +370 5 259 6176
България
ТП ЕВОФАРМА
Teл.: +359 2 962 12 00
Luxembourg/Luxemburg
Biogen Belgium N.V./S.A. Tél/Tel: +352 2 219 12 18
Česká republika
Biogen (Czech Republic) s.r.o. Tel: +420 255 706 200
Magyarország
Biogen Hungary Kft. Tel.: +36 (1) 899 9883
Danmark
Biogen (Denmark) A/S Tlf: +45 77 41 57 57
Malta
Pharma MT limited
Tel: +356 213 37008/9
Deutschland
Biogen GmbH
Tel: +49 (0) 89 99 6170
Nederland
Biogen Netherlands B.V. Tel: +31 20 542 2000
Eesti
Biogen Estonia OÜ Tel: +372 618 9551
Norge
Biogen Norway AS Tlf: +47 23 40 01 00
Ελλάδα
Genesis Pharma SA
Τηλ: +30 210 8771500
Österreich
Biogen Austria GmbH Tel: +43 1 484 46 13
España
Biogen Spain SL
Tel: +34 91 310 7110
Polska
Biogen Poland Sp. z o.o. Tel.: +48 22 351 51 00
France
Biogen France SAS
Tél: +33 (0)1 41 37 95 95
Portugal
Biogen Portugal Sociedade Farmacêutica
Unipessoal, Lda
Tel: +351 21 318 8450
Hrvatska
Biogen Pharma d.o.o.
Tel: +358 (0) 1 775 73 22
România
Johnson & Johnson Romania S.R.L. Tel: +40 21 207 18 00
Ireland
Biogen Idec (Ireland) Ltd. Tel: +353 (0)1 463 7799
Slovenija
Biogen Pharma d.o.o. Tel: +386 1 511 02 90
Ísland
Icepharma hf
Sími: +354 540 8000
Slovenská republika
Biogen Slovakia s.r.o. Tel: +421 2 323 340 08
Italia
Biogen Italia s.r.l.
Tel: +39 02 584 9901
Suomi/Finland
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Κύπρος
Genesis Pharma (Cyprus) Ltd
Τηλ: +357 22 76 57 40
Sverige
Biogen Sweden AB Tel: +46 8 594 113 60
Latvija
Biogen Latvia SIA Tel: +371 68 688 158
United Kingdom (Northern Ireland)
Biogen Idec (Ireland) Limited
Tel: +44 (0) 1628 50 1000
Táto písomná informácia bola naposledy aktualizovaná v .
Ďalšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
1. Pred zriedením a podaním skontrolujte, či injekčná liekovka Tysabri neobsahuje častice. Ak sú častice prítomné a/alebo nie je kvapalina v injekčnej liekovke bezfarebná, číra až slabo opaleskujúca, nesmie sa injekčná liekovka použiť.
2. Pri príprave lieku použite aseptickú techniku. Z injekčnej liekovky odstráňte snímateľnú čiapočku. Vložte ihlu injekčnej striekačky do injekčnej liekovky cez stred gumovej zátky a odoberte 15 ml infúzneho koncentrátu.
3. Pridajte 15 ml infúzneho koncentrátu k 100 ml injekčného roztoku chloridu sodného 9 mg/ml
(0,9 %). Opatrne injekčnú liekovku obráťte, aby sa roztok celkom premiešal. Netrepte.
4. Tysabri sa nesmie miešať s inými liekmi alebo rozpúšťadlami.
5. Pred podaním zriedený liek vizuálne skontrolujte, či neobsahuje častice alebo nezmenil farbu.
Nepoužívajte ho, ak zmenil farbu alebo ak sú v ňom viditeľné cudzie častice.
6. Zriedený liek sa má podať čo najskôr, ale najneskôr do 8 hodín po zriedení. Ak sa zriedený liek uchováva pri 2 ˚C až 8 ˚C (neuchovávajte v mrazničke), pred infúznym podaním nechajte roztok ohriať na izbovú teplotu.
7. Zriedený roztok sa musí podať intravenóznou infúziou počas 1 hodiny rýchlosťou približne 2 ml
za minútu.
8. Po ukončení infúzie premyte intravenózne trubice injekčným roztokom chloridu sodného
9 mg/ml (0,9 %).
9. Každá injekčná liekovka je určená len na jedno použitie.
10. Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov
(Tysabri) a číslo šarže podaného lieku.
11. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
Písomná informácia pre používateľa
Tysabri 150 mg injekčný roztok v naplnenej injekčnej striekačke
natalizumab
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.
Okrem tejto písomnej informácie pre používateľa dostanete aj kartu pre pacienta s dôležitými informáciami o bezpečnosti, ktoré musíte vedieť pred liečbou, ako aj počas liečby liekom Tysabri.
- Túto písomnú informáciu a kartu pre pacienta si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali. Písomnú informáciu a kartu pre pacienta majte vždy so sebou v priebehu liečby a počas 6 mesiacov po poslednej dávke tohto lieku, pretože vedľajšie účinky sa môžu objaviť aj po ukončení liečby.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Tysabri a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Tysabri
3. Ako používať Tysabri
4. Možné vedľajšie účinky
7. Ako uchovávať Tysabri
6. Obsah balenia a ďalšie informácie
1. Čo je Tysabri a na čo sa používa
Tysabri sa používa na liečbu roztrúsenej sklerózy (sclerosis multiplex, SM). Obsahuje liečivo
natalizumab. To sa nazýva monoklonálna protilátka.
SM spôsobuje zápal v mozgu, ktorý poškodzuje nervové bunky. K tomuto zápalu dochádza, keď sa do mozgu a do miechy dostanú biele krvinky. Tento liek zabraňuje, aby sa biele krvinky dostali do mozgu. Tým sa znižuje poškodenie nervov spôsobované SM.
Príznaky roztrúsenej sklerózy
Príznaky SM sa u jednotlivých pacientov líšia a u vás sa môžu objaviť len niektoré z nich alebo
žiadne.
Môžu zahŕňať: problémy s chôdzou, tŕpnutie tváre, horných alebo dolných končatín, problémy so zrakom, únavu, pocit nerovnováhy alebo závratov, problémy s močovým mechúrom a črevami, ťažkosti s myslením a sústredením sa, depresiu, akútnu (náhlu) alebo chronickú (opakovanú) bolesť, sexuálne problémy, stuhnutosť a svalové kŕče.
Prepuknutie týchto príznakov sa nazýva relaps (tiež známy ako vzplanutie alebo atak). Keď sa relaps objaví, môžete nástup príznakov zaznamenať náhle, počas niekoľkých hodín, alebo pomaly nastupujúc v priebehu niekoľkých dní. Príznaky zvyčajne postupne ustúpia (to sa nazýva remisia).
Ako môže Tysabri pomôcť
V skúšaniach tento liek spomaľoval zhoršovanie invalidity spôsobenej SM približne na polovicu a znižoval počet atakov SM asi o dve tretiny. Keď sa liečite týmto liekom, možno si nevšimnete žiadne zlepšenie, napriek tomu môže pôsobiť proti zhoršovaniu vašej SM.
2. Čo potrebujete vedieť predtým, ako použijete Tysabri
Pred začatím liečby týmto liekom je dôležité, aby ste sa s vaším lekárom porozprávali o prínosoch, ktoré by ste mohli od tejto liečby očakávať, ako aj o rizikách, ktoré s ňou súvisia.
Tysabri vám nesmie byť podaný
· ak ste alergický na natalizumab alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6).
· ak vám bola diagnostikovaná PML (progresívna multifokálna leukoencefalopatia). PML je
menej častá infekcia mozgu.
· ak máte vážny problém s imunitným systémom. Môže to byť spôsobené ochorením (ako je
HIV) alebo niektorými liekmi, ktoré užívate alebo ste v minulosti užívali (pozri ďalej).
· ak užívate lieky, ktoré ovplyvňujú váš imunitný systém vrátane určitých liekov na liečbu SM.
Tieto lieky nemôžu byť užívané súbežne s Tysabri.
· ak máte nádorové ochorenie (s výnimkou kožného nádorového ochorenia nazývaného
bazocelulárny karcinóm).
Upozornenia a opatrenia
Musíte sa porozprávať so svojím lekárom, či je Tysabri pre vás najvhodnejšou liečbou. Urobte to predtým, ako začnete používať Tysabri a keď používate Tysabri dlhšie ako dva roky.
Možná infekcia mozgu (PML)
U niektorých ľudí používajúcich tento liek (menej ako 1 zo 100) sa vyskytla menej častá infekcia mozgu nazývaná PML (progresívna multifokálna leukoencefalopatia). PML môže spôsobiť závažné postihnutie a môže byť smrteľná.
· Pred začatím liečby všetkým pacientom vykonajú krvné testy, na infekciu JC vírusu, ktoré zariadi lekár. JC vírus je bežný vírus, ktorý za normálnych okolností nespôsobuje ochorenie. PML je však spojená so zvýšením JC vírusu v mozgu. Dôvod tohto zvýšenia u niektorých pacientov liečených liekom Tysabri nie je známy. Pred liečbou a počas liečby vám bude lekár vyšetrovať krv, aby zistil, či máte protilátky proti JC vírusu, ktoré sú prejavom, že ste sa týmto vírusom infikovali.
· Váš lekár zariadi vyšetrenie magnetickou rezonanciou (MR), ktoré sa počas liečby zopakuje na vylúčenie PML.
· Príznaky PML sa môžu podobať relapsu SM (pozri časť 4.4 Možné vedľajšie účinky). PML
môžete dostať do 6 mesiacov po zastavení liečby liekom Tysabri.
Povedzte svojmu lekárovi čo najskôr, ak ste si všimli, že sa vaša SM zhoršuje, ak zaznamenáte
akékoľvek nové príznaky počas liečby liekom Tysabri alebo do 6 mesiacov po zastavení liečby.
· Povedzte svojmu partnerovi alebo opatrovateľom o tom, čo si majú na vás všímať (pozri tiež časť 4 Možné vedľajšie účinky). Niektoré príznaky, ako sú zmeny nálady alebo správania, zmätenosť, ťažkosti s rečou a komunikáciou, si môžete ťažko sami všimnúť. Ak sa u vás vyskytne niečo z uvedeného, možno budete potrebovať ďalšie vyšetrenia. Naďalej si všímajte svoje príznaky až do 6 mesiacov od vysadenia lieku Tysabri.
· Majte pri sebe kartu pre pacienta, ktorú vám odovzdal váš lekár. Obsahuje tieto informácie.
Ukážte ju svojmu partnerovi alebo opatrovateľom.
Vaše riziko vzniku PML pri používaní lieku Tysabri môžu zvýšiť tri veci. Ak máte dva alebo viac týchto rizikových faktorov, riziko je ešte viac zvýšené:
· Ak máte protilátky proti JC vírusu v krvi. Je to príznak vírusu vo vašom tele. Pred liečbou a počas liečby liekom Tysabri budete vyšetrený.
· Ak ste liečený dlhý čas liekom Tysabri, najmä dlhšie ako dva roky.
· Ak ste užívali liek nazývaný imunosupresívum, ktorý znižuje aktivitu vášho imunitného systému.
Ďalšie ochorenie nazývané JCV GCN (JCV neuropatia granulárnych buniek) je tiež spôsobované JC vírusom a vyskytlo sa u niektorých pacientov používajúcich tento liek. Príznaky JCV GCN sú podobné ako príznaky PML.
U pacientov s nižším rizikom PML môže lekár tento test opakovať pravidelne, aby zistil, či:
· aj naďalej nemáte v krvi protilátky proti JC vírusu,
· ak sa liečite dlhšie ako 2 roky, aj naďalej máte nižšiu hladinu protilátok proti JC vírusu v krvi.
Ak sa u niekoho vyskytne PML
PML možno liečiť a liečba liekom Tysabri sa zastaví. U niektorých osôb sa však vyskytne reakcia, keď sa liek Tysabri vylučuje z tela. Táto reakcia (známa ako IRIS alebo imunoreštitučný zápalový syndróm) môže spôsobiť zhoršenie vášho zdravotného stavu vrátane zhoršenia funkcie mozgu.
Všímajte si ďalšie infekcie
Niektoré infekcie iné ako PML môžu byť takisto závažné a môžu byť spôsobené vírusmi, baktériami a inými príčinami.
Okamžite povedzte lekárovi alebo zdravotnej sestre, ak si myslíte, že máte infekciu (pozri tiež časť
4 Možné vedľajšie účinky).
Deti a dospievajúci
Nedávajte tento liek deťom ani dospievajúcim mladším ako 18 rokov.
Iné lieky a Tysabri
Ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to
svojmu lekárovi.
· Tento liek vám nesmie byť podaný, ak ste v súčasnosti liečený liekmi, ktoré ovplyvňujú váš
imunitný systém vrátane určitých iných liekov na liečbu SM.
· Je možné, že nebudete môcť používať tento liek, ak ste predtým dostávali nejaké lieky, ktoré
ovplyvňujú váš imunitný systém.
Tehotenstvo a dojčenie
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná, alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek.
· Ak ste tehotná, nepoužívajte tento liek bez toho, aby ste sa poradili so svojím lekárom. Ihneď oznámte vášmu lekárovi, ak ste otehotneli, ak si myslíte, že ste tehotná, alebo ak plánujete otehotnieť.
· Počas používania Tysabri nedojčite. Váš lekár vám pomôže rozhodnúť sa, či by ste mali prestať dojčiť alebo prestať používať liek.
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek. Váš lekár zváži riziko pre dieťa a prínos pre matku.
Vedenie vozidiel a obsluha strojov
Závraty sú veľmi častý vedľajší účinok. Ak sa u vás vyskytnú, neveďte vozidlá a neobsluhujte stroje.
Tysabri obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v 300 mg dávke, t. j. v podstate zanedbateľné
množstvo sodíka.
3. Ako používať Tysabri
Injekcie lieku Tysabri vám bude podávať lekár so skúsenosťami v liečbe SM. Váš lekár vás môže previesť priamo z inej terapie SM na Tysabri za predpokladu, že nie sú u vás prítomné žiadne problémy súvisiace s predchádzajúcou liečbou.
· Lekár nariadi krvné testy na zistenie protilátok proti JC vírusu a iných možných problémov.
· Lekár zariadi vyšetrenie MR, ktoré sa počas liečby zopakuje.
· Pri prechode z niektorých liekov na SM vám lekár môže odporučiť, aby ste určitý čas počkali na uistenie, že sa väčšina predchádzajúceho lieku vylúčila z vášho tela.
· Pre dospelých je odporúčaná dávka 300 mg podaná každé 4 týždne.
· Každá dávka sa podáva ako dve injekcie pod kožu, do stehna, brucha alebo zadnej časti
ramena. Trvá to do 30 minút.
· Informácie pre lekárov a ostatných zdravotníckych pracovníkov o príprave a podaní lieku sa nachádzajú na konci tejto písomnej informácie.
Ak prestanete používať Tysabri
Pravidelné podávanie tohto lieku je dôležité, najmä v prvých mesiacoch liečby. Je dôležité pokračovať v tejto liečbe tak dlho, pokým vy a váš lekár usudzujete, že vám pomáha. Pacienti, ktorí dostali jednu alebo dve dávky Tysabri a potom prerušili liečbu na tri a viac mesiacov, mali vyššiu pravdepodobnosť alergickej reakcie pri opätovnom začatí liečby.
Kontrola alergických reakcií
U niektorých pacientov sa vyskytla alergická reakcia na tento liek. Váš lekár môže skontrolovať alergické reakcie počas podávania injekcií a 1 hodinu po podaní. Pozri tiež časť 4 Možné vedľajšie účinky.
Ak vynecháte dávku Tysabri
Ak vynecháte vašu zvyčajnú dávku Tysabri, dohodnite sa so svojím lekárom, aby ste ju dostali čo najskôr. Potom môžete pokračovať v liečbe ďalšími dávkami Tysabri každé 4 týždne.
Bude TYSABRI vždy účinkovať?
U niektorých pacientov, ktorí používajú Tysabri, môže po nejakom čase prirodzená obranyschopnosť tela zastaviť riadne pôsobenie lieku, pretože telo si vytvorí protilátky proti lieku. Váš lekár sa môže rozhodnúť vyšetriť vám krv, aby zistil, či u vás liek riadne účinkuje, a ak je to potrebné, liečbu zastaví.
Ak máte akékoľvek ďalšie otázky týkajúce sa Tysabri, opýtajte sa svojho lekára. Vždy používajte tento liek presne tak, ako je to uvedené v tejto písomnej informácii alebo ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to u svojho lekára.
Skratka pre subkutánny (podkožný) spôsob podávania na štítku injekčnej liekovky je s.c..
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Ak spozorujte ktorýkoľvek z nasledujúcich príznakov, okamžite to oznámte svojmu lekárovi alebo
zdravotnej sestre. Príznaky infekcie mozgu
· zmeny osobnosti a správania, ako zmätenosť, delírium alebo strata vedomia,
· epileptické záchvaty (kŕče),
· bolesť hlavy,
· nevoľnosť/vracanie,
· stuhnutosť šije,
· extrémna precitlivenosť na jasné svetlo,
· horúčka,
· vyrážky (kdekoľvek na tele).
Uvedené príznaky môžu byť spôsobené infekciou mozgu (encefalitída alebo PML) alebo mozgových blán (meningitída).
Prejavy iných závažných infekcií
· nevysvetliteľná horúčka,
· ťažká hnačka,
· dýchavičnosť,
· dlhodobé závraty,
· bolesť hlavy,
· úbytok hmotnosti,
· apatia,
· porucha zraku,'
· bolesť alebo začervenanie oka (očí).
Prejavy alergickej reakcie
· svrbivá vyrážka (žihľavka),
· opuch tváre, pier alebo jazyka,
· ťažkosti s dýchaním,
· bolesti alebo ťažkosti na hrudníku,
· zvýšenie alebo zníženie tlaku krvi (zistí to váš lekár alebo zdravotná sestra, ak sledujú váš tlak krvi).
Tieto prejavy sa najpravdepodobnejšie vyskytnú počas podávania injekcie alebo krátko po podaní.
Prejavy možného problému s pečeňou
· zožltnutie pokožky alebo očných bielok,
· nezvyčajné stmavnutie moču,
· neobvyklé výsledky testu funkcie pečene.
Okamžite informujte lekára alebo zdravotnú sestru, ak sa u vás vyskytne niektorý z vyššie
uvedených vedľajších účinkov, alebo ak si myslíte, že máte infekciu. Nielen svojmu neurológovi, ale
každému lekárovi alebo zdravotnej sestre, ktorí vás ošetrujú,
ukážte svoju kartu pre pacienta a túto
písomnú informáciu pre používateľa.
Ďalšie vedľajšie účinkyVeľmi časté (môžu postihovať viac ako 1 z 10 osôb)
· infekcia močových ciest,
· bolesť hrdla a nádcha alebo upchaný nos,
· bolesť hlavy,
· závraty,
· pocit nutkania na vracanie (
nauzea),
· bolesť kĺbov,
· únava.
Časté (môžu postihovať menej ako 1 z 10 osôb)
· anémia (pokles počtu červených krviniek, ktorý sa môže u vás prejaviť bledosťou kože a dýchavičnosťou alebo pocitom nedostatku energie),
· alergia (
precitlivenosť),
· triaška,
· svrbivá vyrážka (
žihľavka),
· nevoľnosť (
vracanie),
· horúčka,
· problémy s dýchaním (
dyspnoe),
· sčervenanie tváre alebo tela,
· herpetické infekcie,
· nepríjemný pocit v okolí miesta, kde vám bola podaná injekcia. Mohla by sa u vás vyskytnúť modrina, začervenanie, bolesť, svrbenie alebo opuch.
Menej časté (môžu postihovať menej ako 1 zo 100 osôb)
· závažná alergia (
anafylaktická reakcia),
· progresívna multifokálna leukoencefalopatia (PML),
· zápalová porucha po vysadení lieku,
· opuch tváre,
· zvýšenie počtu bielych krviniek (
eozinofília).
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
· herpetická infekcia v oku,
· závažná anémia (pokles počtu červených krviniek, ktorý môže spôsobiť zblednutie kože a dýchavičnosť alebo nedostatok energie),
· závažný opuch pod kožou,
· vysoká hladina bilirubínu v krvi (
hyperbilirubinémia), ktorá môže spôsobiť také príznaky ako zožltnutie očí alebo kože, horúčku a únavu.
Neznáme (frekvenciu nemožno odhadnúť z dostupných údajov)
· nezvyčajné infekcie (takzvané
oportúnne infekcie),
· poškodenie pečene.
Čo najskôr informujte svojho lekára, ak si myslíte, že máte infekciu.
Tieto informácie nájdete aj v karte pre pacienta, ktorú ste dostali od vášho lekára.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára. To sa týka aj
akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky

môžete hlásiť aj priamo na
v Prílohe V. Hlásením vedľajších
účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať Tysabri
Tento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke. Neuchovávajte v mrazničke.
Injekčné striekačky možno uchovávať v pôvodnom obale do 24 hodín pri izbovej teplote (do 25 °C).
Injekčné striekačky sa nesmú znova dať do chladničky.
Injekčné striekačky uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Nepoužívajte tento liek, ak spozorujete v kvapaline viditeľné častice a/alebo je kvapalina v injekčnej striekačke sfarbená.
6. Obsah balenia a ďalšie informácieČo Tysabri obsahujeLiečivo je natalizumab.
1 ml naplnenej injekčnej striekačky obsahuje 150 mg natalizumabu.
Ďalšie zložky sú:
monohydrát dihydrogenfosforečnanu sodného, heptahydrát hydrogenfosforečnanu sodného,
chlorid sodný (pozri časť 2 Tysabri obsahuje sodík),
polysorbát 80 (E 433), voda na injekcie.
Ako vyzerá Tysabri a obsah baleniaTysabri je bezfarebná až slabožltá, mierne opaleskujúca až opaleskujúca kvapalina.
Každá škatuľa obsahuje dve injekčné striekačky.
Tysabri je dostupný v baleniach obsahujúcich 2 naplnené injekčné striekačky.
Držiteľ rozhodnutia o registráciiBiogen Netherlands B.V. Prins Mauritslaan 13
1171 LP Badhoevedorp
Holandsko
VýrobcaFUJIFILM Diosynth Biotechnologies Denmark ApS Biotek Allé 1
DK-3400 Hillerød
Dánsko
Biogen Netherlands B.V.

Prins Mauritslaan 13
1171 LP Badhoevedorp
Holandsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii.
België/Belgique/Belgien Biogen Belgium N.V./S.A. Tél/Tel: +32 2 219 12 18
Lietuva
Biogen Lithuania UAB Tel: +370 5 259 6176
България
ТП ЕВОФАРМА
Teл.: +359 2 962 12 00
Luxembourg/Luxemburg
Biogen Belgium N.V./S.A. Tél/Tel: +352 2 219 12 18
Česká republika
Biogen (Czech Republic) s.r.o. Tel: +420 255 706 200
Magyarország
Biogen Hungary Kft. Tel.: +36 (1) 899 9883
Danmark
Biogen (Denmark) A/S Tlf: +45 77 41 57 57
Malta
Pharma MT limited
Tel: +356 213 37008/9
Deutschland
Biogen GmbH
Tel: +49 (0) 89 99 6170
Nederland
Biogen Netherlands B.V. Tel: +31 20 542 2000
Eesti
Biogen Estonia OÜ Tel: +372 618 9551
Norge
Biogen Norway AS Tlf: +47 23 40 01 00
Ελλάδα
Genesis Pharma SA
Τηλ: +30 210 8771500
Österreich
Biogen Austria GmbH Tel: +43 1 484 46 13
España
Biogen Spain SL
Tel: +34 91 310 7110
Polska
Biogen Poland Sp. z o.o. Tel.: +48 22 351 51 00
France
Biogen France SAS
Tél: +33 (0)1 41 37 95 95
Portugal
Biogen Portugal Sociedade Farmacêutica
Unipessoal, Lda
Tel: +351 21 318 8450
Hrvatska
Biogen Pharma d.o.o.
Tel: +385 (0) 1 775 73 22
România
Johnson & Johnson Romania S.R.L. Tel: +40 21 207 18 00
Ireland
Biogen Idec (Ireland) Ltd. Tel: +353 (0)1 463 7799
Slovenija
Biogen Pharma d.o.o. Tel: +386 1 511 02 90
Ísland
Icepharma hf
Sími: +354 540 8000
Slovenská republika
Biogen Slovakia s.r.o. Tel: +421 2 323 340 08
Italia
Biogen Italia s.r.l.
Tel: +39 02 584 9901
Suomi/Finland
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Κύπρος
Genesis Pharma (Cyprus) Ltd
Τηλ: +357 22 76 57 40
Sverige
Biogen Sweden AB Tel: +46 8 594 113 60
Latvija
Biogen Latvia SIA Tel: +371 68 688 158
United Kingdom (Northern Ireland)
Biogen Idec (Ireland) Limited
Tel: +44 (0) 1628 50 1000
Táto písomná informácia bola naposledy aktualizovaná v .
Ďalšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Odporúčaná dávka 300 mg sa má podať s použitím dvoch 150 mg naplnených injekčných striekačiek;
pozri časť 3 nižšie.
Pokyny na podanie
Naplnená injekčná striekačka má systém na ochranu ihly, ktorý sa automaticky aktivuje po úplnom zatlačení piestu. Keď piest pustíte, chránič ihly prikryje odhalenú ihlu.
Pred podaním
A
C Po podaní
C D
B
E F A. Piest
B. Obruba na prsty
C. Naplnená injekčná striekačka (sklenená)
D. Kryt ihly
E. Ihla
F. Chránič ihly

1. Vyberte z chladničky balenie s dávkami a pred podaním injekcií ho nechajte zohriať na izbovú
teplotu (do 25 oC). Odporúčaný čas ohrievania je 30 minút.
Na škatuľu sa musí zaznamenať dátum a čas vybratia balenia s dávkami z chladničky.○ Na ohriatie naplnených injekčných striekačiek
nepoužívajte vonkajšie zdroje tepla, ako je horúca voda.
o V žiadnej fáze sa
nedotýkajte ihly ani ju znova neuzatvárajte, aby ste zabránili náhodnému poraneniu ihlou.
2.
Vyberte z podnosu
obidve injekčné striekačky s liekom. Skontrolujte, či je liek v každej naplnenej injekčnej striekačke bezfarebný až slabožltý, mierne opaleskujúci roztok, ktorý v podstate
neobsahuje viditeľné častice. V zobrazovacích okienkach možno uvidíte vzduchové bubliny. To je
normálne a neovplyvní to dávku.
·
Skontrolujte obidve naplnené injekčné striekačky.
Nepoužívajte ich, ak:
·uplynul dátum exspirácie uvedený na štítku injekčnej striekačky (EXP),
alebo· boli uchovávané pri izbovej teplote (do 25 oC) dlhšie ako 24 hodín,
·sfarbenie a priehľadnosť kvapaliny nezodpovedá vyššie uvedenému opisu, alebo ak kvapalina obsahuje plávajúce častice,
·sú viditeľné nejaké príznaky poškodenia (praskliny, štrbiny atď.).
· Ak zbadáte niečo z vyššie uvedeného,
okamžite kontaktujte lekáreň.
3. Celá dávka zodpovedá dvom injekčným striekačkám podaným za sebou, a to do 30 minút.
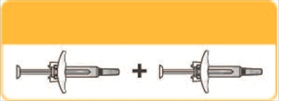
Použi dve 150 mg injekčné striekačky.
Celá dávka = 300 mg.
4. Počas postupu podávania injekcie použite aseptickú techniku (čistú, bez baktérií) a rovný pracovný
povrch.
5. Vyberte prvé miesto podania podkožnej injekcie na stehne, bruchu alebo zadnej časti ramena.
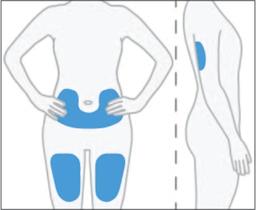
·
Nepodávajte injekciu do oblasti tela, kde je koža podráždená, začervenaná, obsahuje modriny,
je infikovaná alebo zjazvená.
6. Podajte prvú injekciu.
· Zvoľte miesto podania injekcie a utrite kožu alkoholovým tampónom.
·Pred podaním injekcie nechajte miesto injekcie vyschnúť.
·Nedotýkajte sa tejto oblasti ani na ňu pred podaním injekcie nefúkajte.
·Odstráňte kryt ihly.
·Jemne stlačte kožu okolo očisteného miesta podania injekcie palcom a ukazovákom tak,
aby sa vytvorila kožná riasa.
·Naplnenú injekčnú striekačku držte v uhle 45°- 90° k miestu podania injekcie. Ihlu rýchlo zasúvajte priamo do kožnej riasy, kým ihla nie je úplne pod kožou.
7. Pomaly zatláčajte piest jedným plynulým pohybom, kým injekčná striekačka nie je úplne prázdna. Piest neťahajte späť.
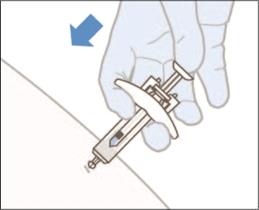
8. Pred vytiahnutím injekčnej striekačky skontrolujte, či je injekčná striekačka prázdna. Ak uvidíte krv, pritlačte na miesto bavlnený tampón alebo gázu. Kožu po podaní injekcie netrite. Po vytiahnutí injekčnej striekačky z miesta injekcie piest pustite A SÚČASNE vyťahujte ihlu. Keď piest pustíte, chránič ihly prikryje odhalenú ihlu.

9. Podajte injekcie ihneď jednu za druhou. V prípade, že druhú injekciu nie je možné podať okamžite po prvej injekcii, druhá injekcia sa má podať najneskôr 30 minút po prvej injekcii. Druhá injekcia sa má podať aspoň 3 cm od miesta podania prvej injekcie.
Pacientov je potrebné
pozorovať počas podávania subkutánnych injekcií a 1 hodinu po podaní pre prejavy a príznaky reakcií po podaní injekcie vrátane precitlivenosti.
Po prvých 6 dávkachlieku Tysabri, bez ohľadu na spôsob podávania, je potrebné pacientov pozorovať po subkutánnej injekcii podľa klinického uváženia.
Keď spozorujte akékoľvek prejavy alebo príznaky naznačujúce alergickú reakciu, okamžite ukončite podávanie injekcie (pozri súhrn charakteristických vlastností lieku, časť 4.4).
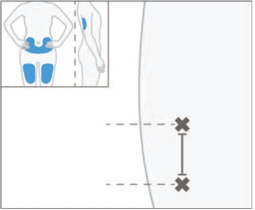
1. injekcia
2. injekcia
Aspoň3 cm
10. Použitú injekčnú striekačku zlikvidujte v súlade s národnými požiadavkami.
PRÍLOHA IV
VEDECKÉ ZÁVERY A DÔVODY ZMENY PODMIENOK ROZHODNUTIA O REGISTRÁCII
Vedecké závery
Vzhľadom na hodnotiacu správu Výboru pre hodnotenie rizík liekov (PRAC) o periodicky aktualizovaných správach o bezpečnosti lieku (PSUR) pre natalizumab dospel Výbor pre humánne lieky (CHMP) k týmto vedeckým záverom:
Po zvážení dostupných údajov o trombocytopénii (TCP) a imunitnej (alebo idiopatickej) trombocytopenickej purpure (ITP) z klinických a neklinických štúdií, literatúry, hlásení po uvedení lieku na trh a údajov o bezpečnosti z databáz tretích strán, PRAC považuje kauzálny vzťah medzi natalizumabom a trombocytopéniou (TCP) a imunitnou (alebo idiopatickou) trombocytopenickou purpurou za prinajmenšom odôvodnenú možnosť. PRAC dospel k záveru, že informácie o liekoch obsahujúcich natalizumab sa majú príslušným spôsobom upraviť.
Výbor pre humánne lieky (CHMP) súhlasí s vedeckými závermi PRAC.
Dôvody zmeny podmienok rozhodnutia o registrácii
Na základe vedeckých záverov pre natalizumab je CHMP toho názoru, že pomer prínosu a rizika lieku obsahujúceho natalizumab je nezmenený za predpokladu, že budú prijaté navrhované zmeny
v informáciách o lieku.
CHMP odporúča zmenu podmienok rozhodnutia o regisraci.