
th="121" valign="top"> < 80 mg/dl
-2 jednotky
| 4,4–6,1 mmol/l
| 80–110 mg/dl
| 0
|
6,2–7,8 mmol/l
| 111–
140 mg/dl
| +2 jednotky
|
7,9–10 mmol/l
| 141–
180 mg/dl
| +4 jednotky
|
> 10 mmol/l
| > 180 mg/dl
| +6 jednotiek
|
Majú sa použiť najnižšie hladiny glukózy v krvi pred jedlom z predchádzajúcich troch dní. Dávka sa
nemá zvýšiť, ak sa vyskytne hypoglykémia počas týchto dní. Úprava dávky sa môže uskutočniť raz
týždenne, až do dosiahnutia cieľovej hodnoty HbA1c. Hladiny glukózy v krvi pred jedlom sa majú
použiť na vyhodnotenie primeranosti predchádzajúcej dávky.
U pacientov s diabetom 2. typu, sa na minimalizáciu rizika hypoglykémie u pacientov s HbA1c nižším ako 8 % odporúča zníženie dávky o 20 %, ak sa k lieku Truvelog Mix 30 pridá agonista GLP-1 receptora. U pacientov s HbA1c vyšším ako 8 % sa má zvážiť zníženie dávky. Následne sa má dávkovanie upraviť individuálne.
U pacientov s diabetom 1. typu sa individuálna potreba inzulínu obvykle pohybuje medzi 0,5 a
1 jednotkou/kg/deň. Truvelog Mix 30 môže úplne alebo čiastočne spĺňať túto požiadavku.
Úprava dávky môže byť potrebná, ak pacienti majú zvýšenú fyzickú námahu, zmenili svoje obvyklé stravovanie alebo počas súbežného ochorenia.
Prechod z iných liekov s obsahom inzulínov
Pri prechode pacienta z liečebného režimu s inou premixovanou inzulínovou terapiou s rovnakým pomerom ako Truvelog Mix 30 sa má výmena inzulínu vykonať na jednotkovej úrovni (1:1) (nie je potrebná žiadna konverzia) pod prísnym lekárskym dohľadom s titráciou podľa individuálnych potrieb (pozri návod na titráciu v tabuľke vyššie).
Počas prechodu a v prvých týždňoch po ňom sa odporúča dôsledné monitorovanie glukózy (pozri časť 4.4).
Osobitné skupiny pacientov
Staršie osoby (≥ 65 rokov)
Truvelog Mix 30 môžu používať starší pacienti; u pacientov starších ako 75 rokov však nie sú
dostatočné skúsenosti s použitím lieku Truvelog Mix 30 v kombinácii s perorálnymi antidiabetikami. U starších pacientov sa má zintenzívniť monitorovanie glukózy a dávka inzulínu aspartátu sa má upraviť na individuálnom základe.
Porucha funkcie obličiek
Porucha funkcie obličiek môže u pacienta znižovať potreby inzulínu.
U pacientov s poruchou funkcie obličiek sa má zintenzívniť monitorovanie glukózy a dávka inzulínu aspartátu sa má upraviť na individuálnom základe.
Porucha funkcie pečene
Porucha funkcie pečene môže u pacienta znižovať potreby inzulínu.
U pacientov s poruchou funkcie pečene sa má zintenzívniť monitorovanie glukózy a dávka inzulínu aspartátu sa má upraviť na individuálnom základe.
Pediatrická populácia
Truvelog Mix 30 môžu používať dospievajúci a deti vo veku 10 rokov a staršie, keď má byť uprednostnený premixovaný inzulín. U detí vo veku 6–9 rokov sú obmedzené klinické skúsenosti s liekom Truvelog Mix 30 (pozri časť 5.1).
K dispozícii nie sú žiadne údaje pre Truvelog Mix 30 u detí mladších ako 6 rokov. Spôsobpodávania
Truvelog Mix 30 je dvojfázová suspenzia analógu inzulínu, inzulínu aspartátu. Suspenzia obsahuje
rýchlo pôsobiaci a strednodobo pôsobiaci inzulín aspartát v pomere 30/70.
Truvelog Mix 30 sa podáva len subkutánne.
Pred každým podaním injekcie lieku Truvelog Mix 30 sa musí inzulín premiešať prevrátením a pohybom pera, kým roztok nebude rovnomerne biely a zakalený.
Truvelog Mix 30 sa podáva subkutánne ako injekcia do stehna alebo do brušnej steny. Ak je to vhodné môže sa podávať do oblasti sedacej alebo deltovej. Miesta podania injekcie sa majú v tej istej oblasti striedať, aby sa znížilo riziko lipodystrofie a kožnej amyloidózy (pozri časti 4.4 a 4.8). Vplyv rôznych miest podávania injekcie na absorpciu lieku Truvelog Mix 30 sa neskúmal. Trvanie účinku sa bude meniť podľa dávky, miesta podávania, prietoku krvi, teploty a úrovne fyzickej aktivity.
Truvelog Mix 30 má rýchlejší nástup účinku ako dvojfázový ľudský inzulín, všeobecne sa má podávať bezprostredne pred jedlom. Ak je to potrebné, Truvelog Mix 30 sa môže podávať ihneď po jedle.
Truvelog Mix 30 sa nesmie podávať intravenózne, pretože to môže viesť k závažnej hypoglykémii. Treba sa vyhnúť intramuskulárnej aplikácii. Truvelog Mix 30 sa nemá používať v inzulínových infúznych pumpách.
Truvelog Mix 30 100 jednotiek/ml injekčná suspenzia v náplni
Truvelog Mix 30 v náplniach je vhodný len na subkutánne injekcie z opakovane použiteľného pera
(pozri časť 4.4). Náplne Truvelog Mix 30 sú určené na používanie s týmito perami (pozri časť 6.6):
- AllStar a AllStar PRO, ktorými sa dávkuje 1-80 jednotiek inzulínu aspartátu s pridávaním po
1 jednotke.
Truvelog Mix 30 100 jednotiek/ml injekčná suspenzia v naplnenom pere
Truvelog Mix 30 v naplnenom pere je vhodný len na subkutánne injekcie. Ak je potrebné podanie
injekčnou striekačkou, má sa použiť iný liek s obsahom inzulínu dodávaný v injekčnej liekovke (pozri časť 4.4). Truvelogom Mix 30 v naplnenom pere dávkuje 1-80 jednotiek inzulínu aspartátu s
pridávaním po 1 jednotke.
Pacienti si musia vizuálne overiť množstvo navolených jednotiek v dávkovacom okienku pera. Preto
je potrebné, aby pacienti, ktorí si sami podávajú injekciu, boli schopní prečítať hodnoty v dávkovacom okienku pera. Nevidiaci pacienti, alebo pacienti so slabým zrakom majú byť poučení, aby im pri dávkovaní vždy pomohla ďalšia osoba s dobrým znakom a vyškolená na používanie inzulínovej pomôcky.
Podrobné pokyny pre používateľa nájdete v písomnej informácii pre používateľa.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Hyperglykémia
Neprimerané dávky alebo prerušenie liečby, najmä pri diabete 1. typu, môže viesť k hyperglykémii a
diabetickej ketoacidóze. Zvyčajne sa prvé príznaky hyperglykémie objavujú postupne, počas niekoľkých hodín alebo dní. Patrí k nim smäd, zvýšená frekvencia močenie, nauzea, vracanie,
ospalosť, sčervenená suchá pokožka, sucho v ústach, nechutenstvo a acetónový dych. Neliečené
hyperglykemické udalosti u pacientov s diabetom 1. typu v konečnom dôsledku vedú ku vzniku diabetickej ketoacidózy, ktorá je potenciálne letálna.
Hypoglykémia
Vynechanie jedla alebo neplánované namáhavé telesné cvičenie môže viesť k hypoglykémii.
Hypoglykémia môže nastať, ak je dávka inzulínu veľmi vysoká v porovnaní s potrebou inzulínu.
V prípade hypoglykémie alebo podozrenia na hypoglykémiu, sa nesmie Truvelog Mix 30 podať. Po stabilizácii glykémie pacienta, sa má uvažovať o úprave dávky (pozri časti 4.2, 4.8 a 4.9).
V porovnaní s dvojfázovým ľudským inzulínom, Truvelog Mix 30 môže mať výraznejší glukózu znižujúci účinok do 6 hodín po podaní injekcie. Toto možno kompenzovať u jednotlivých pacientov upravením dávky inzulínu a/alebo príjmom jedla.
Pacienti, u ktorých nastalo významné zlepšenie kompenzácie glykémie, napr. po intenzifikovanej inzulínovej liečbe, môžu pocítiť zmenu obvyklých varovných príznakov hypoglykémie a majú byť o nich informovaní. Obvyklé varovné príznaky sa môžu stratiť u pacientov s dlhotrvajúcim diabetom.
Prísnejšia kontrola hladín glukózy v krvi môže zvýšiť možnosť vzniku hypoglykémií, a preto sa vyžaduje zvýšená pozornosť počas intenzifikácie dávky, ako je uvedené v časti 4.2.
Pretože Truvelog Mix 30 sa má podávať bezprostredne pred jedlom, u pacientov so súbežnými ochoreniami alebo pri liečbe, kde sa predpokladá spomalenie absorpcie jedla, má sa vziať do úvahy rýchly nástup účinku.
Súbežné ochorenia, najmä infekcie a horúčkovité stavy, si obvykle vyžadujú zvýšené požiadavky
pacienta na inzulín. Súbežné ochorenia obličiek, pečene, alebo ovplyvňujúce nadobličky, podmozgovú alebo štítnu žľazu si môžu vyžadovať zmeny v dávke inzulínu.
Keď pacienti prechádzajú z iných typov liekov s obsahom inzulínu, môžu sa včasné varovné príznaky hypoglykémie zmeniť alebo prichádzajú oneskorene, v porovnaní s predchádzajúcim inzulínom.
Prechod zinýchliekovsobsahominzulínu
Prechod pacienta na iný typ alebo značku inzulínu sa musí uskutočniť len pod prísnym dohľadom
lekára. Zmeny v sile, značke (výrobcovi), type, pôvode (zvierací inzulín, ľudský inzulín alebo inzulínový analóg) a/alebo v spôsobe výroby (rekombinantná DNA technológia oproti inzulínu zvieracieho pôvodu) si môžu vyžadovať zmenu dávky. Pacienti prechádzajúci na Truvelog Mix 30 z iného typu inzulínu si môžu vyžadovať zvýšenie počtu injekčných podávaní za deň alebo zmenu dávky oproti pôvodne používaným liekom s obsahom inzulínu. Ak je potrebná úprava dávky, môže sa vykonať už pri prvej dávke alebo počas prvých niekoľkých týždňov alebo mesiacov.
Reakcie v mieste podávania injekcie
Ako pri liečbe inými inzulínmi, môžu sa objaviť reakcie v mieste podávania injekcie, ktoré sa prejavia
bolesťou, sčervenením, žihľavkou, zápalom, podliatinou, opuchom a svrbením. Neustále striedanie miesta podávania v rámci danej oblasti znižuje riziko vzniku týchto reakcií. Reakcie zvyčajne vymiznú do niekoľkých dní až niekoľkých týždňov. V zriedkavých prípadoch si reakcie v mieste podávania injekcie môžu vyžiadať ukončenie liečby liekom Truvelog Mix 30.
Poruchy kože a podkožného tkaniva
Pacienti musia byť poučení o tom, aby miesto podania injekcie neustále menili, čím sa zníži riziko
vzniku lipodystrofie a kožnej amyloidózy. Na miestach s týmito reakciami existuje potenciálne riziko oneskorenej absorpcie inzulínu a zhoršenej kontroly glykémie po podaní inzulínových injekcií.
V prípade náhlej zmeny miesta podania injekcie na nepostihnutú oblasť bol hlásený vznik
hypoglykémie. Po zmene miesta podania injekcie z postihnutej oblasti na nepostihnutú oblasť sa odporúča monitorovanie hladiny glukózy v krvi a je možné zvážiť úpravu dávky antidiabetík.
Kombinácia lieku TruvelogMix30 spioglitazónom
Ak sa užíval pioglitazón v kombinácii s inzulínom, hlásili sa prípady kardiálneho zlyhávania,
predovšetkým u pacientov s rizikovými faktormi rozvoja kardiálneho zlyhávania srdca. Na toto sa má pamätať, ak sa uvažuje o liečbe kombináciou pioglitazónu a lieku Truvelog Mix 30. Ak sa používa táto kombinácia, majú sa u pacientov sledovať prejavy a symptómy zlyhávania srdca, zvýšenie telesnej hmotnosti a edémy. Užívanie pioglitazónu sa má ukončiť, ak sa objaví akékoľvek zhoršenie kardiálnych symptómov.
Zamedzenie náhodným zámenám/chybám vliečbe
Pacienti musia byť upozornení, aby vždy pred každým injekčným podaním skontrolovali obal
inzulínu, aby sa zamedzilo náhodnej zámene lieku Truvelog Mix 30 za iné lieky s obsahom inzulínu.
Protilátky proti inzulínu
Podávanie inzulínu môže spôsobiť tvorbu protilátok proti inzulínu. V zriedkavých prípadoch si
prítomnosť takýchto protilátok proti inzulínu, môže vyžadovať úpravu dávky inzulínu, aby sa korigovala náchylnosť na hyperglykémie alebo hypoglykémie.
Cestovanie
Pred cestou medzi rôznymi časovými pásmami sa má pacient poradiť s lekárom, pretože to môže
znamenať, že pacient bude musieť užívať inzulín a jedlo v iných časoch.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t. j. v podstate zanedbateľné
množstvo sodíka
4.5 Liekové a iné interakcie
O mnohých liekoch je známe, že ovplyvňujú metabolizmus glukózy. Látky, ktoré môžu znižovať pacientovu potrebu inzulínu sú nasledovné:
Perorálne antidiabetiká, agonisty GLP-1 receptora, inhibítory monoaminooxidázy (IMAO), betablokátory, inhibítory enzýmu konvertujúceho angiotenzín (ACE, angiotensin converting enzyme), salicyláty, anabolické steroidy a sulfónamidy.
Látky, ktoré môžu zvyšovať pacientovu potrebu inzulínu sú nasledovné:
Perorálne kontraceptíva, tiazidy, glukokortikoidy, tyroidné hormóny, sympatomimetiká, rastový hormón a danazol.
Betablokátory môžu maskovať príznaky hypoglykémie. Oktreotid/lanreotid môže zvyšovať alebo znižovať potrebu inzulínu. Alkohol môže zosilňovať alebo znižovať hypoglykemický účinok inzulínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Klinické skúsenosti s podávaním lieku Truvelog Mix 30 v gravidite sú obmedzené.
Reprodukčné štúdie na zvieratách týkajúce sa embryotoxicity alebo teratogenity, neodhalili žiadne rozdiely medzi inzulínom aspartátom a ľudským inzulínom.
Všeobecne sa odporúča intenzívna kontrola glykémie a jej sledovanie u gravidných žien s diabetom počas gravidity a pri plánovaní gravidity. Potreba inzulínu obvykle poklesne v prvom trimestri a následne sa zvyšuje počas druhého a tretieho trimestra. Po pôrode sa potreba inzulínu rýchlo vracia späť na hladiny pred graviditou.
Dojčenie
Nie sú žiadne obmedzenia na liečbu liekom Truvelog Mix 30 počas dojčenia. Liečba dojčiacich matiek
inzulínom nepreukazuje žiadne riziko pre dojča. Môže však byť potrebná úprava dávky lieku Truvelog
Mix 30.
Fertilita
Reprodukčné štúdie na zvieratách týkajúce sa fertility neodhalili žiadne rozdiely medzi inzulínom
aspartátom a ľudským inzulínom (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Schopnosť koncentrácie a reakčná schopnosť pacientov sa môže znížiť v dôsledku hypoglykémie.
Táto skutočnosť vytvára riziko v situáciách, ktoré si vyžadujú mimoriadnu pozornosť (napr. pri vedení vozidiel alebo pri obsluhe strojov).
Pacienti majú byť poučení o opatreniach, ako zabrániť vzniku hypoglykémie pri vedení vozidiel alebo obsluhe strojov. Zvlášť dôležité je to u pacientov, ktorí si nedostatočne uvedomujú, alebo si neuvedomujú varovné signály hypoglykémie, alebo ktorí mávajú časté hypoglykémie. V takýchto prípadoch sa má zvážiť vhodnosť vedenia vozidla.
4.8 Nežiaduce účinkyPrehľad bezpečnostnéhoprofiluNežiaduce reakcie pozorované u pacientov používajúcich Truvelog Mix 30 sú prevažne závislé od
farmakologického účinku inzulínu aspartátu.
Hypoglykémia je najčastejšie hlásená nežiaduca reakcie počas liečby. Frekvencie hypoglykémií sa menia s populáciou pacientov, dávkovacími schémami a úrovňou glykemickej kontroly (pozrite časť 4.8 Opis vybraných nežiaducich reakcií).
Na začiatku liečby inzulínom sa môžu objaviť refrakčné poruchy, edémy a reakcie v mieste podávania injekcie (bolesť, sčervenenie, žihľavka, zápal, podliatina, opuch a svrbenie v mieste podávania). Tieto reakcie majú obvykle prechodný charakter. Náhle zlepšenie glykémie sa môže spájať s akútnou bolestivou neuropatiou, ktorá má zvyčajne prechodný charakter. Intenzifikácia liečby inzulínom s prudkým zlepšením glykemickej kontroly sa môže spájať s prechodným zhoršením diabetickej retinopatie, kým dlhodobé zlepšenie kontroly glykémie znižuje riziko progresie diabetickej retinopatie.
Tabuľkový zoznamnežiaducichreakciíNežiaduce reakcie uvedené nižšie sú na základe údajov z klinickej štúdie a klasifikácie podľa triedy
orgánových systémov. Kategórie frekvencií sú definované podľa nasledovnej konvencie: Veľmi časté
(≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000); neznáme (z dostupných údajov).
MedDRA
trieda orgánových
systémov
| Veľmi časté
| Časté
| Zriedkavé
| Veľmi
zriedkavé
| Neznáme
|
Poruchy imunitného systému
|
| Žihľavka, vyrážka, výsev
|
| Anafylaktické reakcie*
|
|
Poruchy metabolizmu
a výživy
| Hypoglykémia*
|
|
|
|
|
Poruchy
nervového systému
|
|
| Periférna
neuropatia (bolestivá neuropatia)
|
|
|
Poruchy oka
|
| Refrakčné
poruchy, diabetická retinopatia
|
|
|
|
Poruchy kože a
podkožného
|
| Lipodystrofia*
|
|
| Kožná amyloidóza*†
|
tkaniva
|
|
|
|
|
|
Celkové poruchy a
reakcie v mieste
podania
|
|
Reakcie v mieste
podávania injekcie, edém
|
|
|
|
*pozri Opis vybraných nežiaducich reakcií
†nežiaduce reakcie zo zdrojov po uvedení lieku na trh
Opis vybraných nežiaducichreakciíAnafylaktické reakcieVýskyt generalizovaných hypersenzitívnych reakcií (vrátane generalizovanej kožnej vyrážky, svrbenia, potenia, gastrointestinálnych ťažkostí, angioneurotického edému, ťažkostí s dýchaním, palpitácií a poklesu krvného tlaku) sú veľmi zriedkavé, no môžu byť potenciálne život ohrozujúce.
HypoglykémiaHypoglykémia je najčastejšie hlásená nežiaduca reakcia. Môže sa objaviť vtedy, keď je dávka inzulínu príliš vysoká v porovnaní s potrebou inzulínu. Závažná hypoglykémia môže viesť k bezvedomiu a/alebo kŕčom, čoho výsledkom môže byť prechodné alebo trvalé poškodenie funkcií mozgu alebo až dokonca smrť. Príznaky hypoglykémie sa objavujú zvyčajne náhle. Môžu zahŕňať studený pot,
studenú bledú pokožku, vyčerpanosť, nervozitu alebo triašku, úzkosť, nezvyčajnú únavu alebo
slabosť, zmätenosť, problémy s koncentráciou, ospalosť, nadmerný hlad, zmeny videnia, bolesť hlavy, nauzeu a búšenie srdca.
V klinických skúšaniach sa frekvencia hypoglykémie mení s populáciou pacientov, dávkovacími schémami a úrovňou glykemickej kontroly. Počas klinických skúšaní celkový počet hypoglykémií nebol rozdielny v porovnaní medzi pacientmi liečenými inzulínom aspartátom a ľudským inzulínom.
Poruchy kože a podkožného tkanivaLipodystrofia (vrátane lipohypertrofie, lipoatrofie) a kožná amyloidóza sa môže vyskytnúť v mieste podávania injekcie, čím sa môže oneskoriť lokálna absorpcia inzulínu. Pravidelné striedanie miesta podania injekcie v danej oblasti môže pomôcť pri zmiernení týchto reakcií alebo môže týmto reakciám zabrániť (pozri časť 4.4).
Pediatrická populáciaNa základe zdrojov po uvedení lieku na trh a klinických skúšaní, frekvencia, typ a závažnosť
nežiaducich reakcií pozorovaných v pediatrickej populácii nenaznačujú žiadne rozdiely vo všeobecných skúsenostiach v porovnaní s bežnou populáciou.
Iné osobitné skupiny pacientovNa základe zdrojov po uvedení lieku na trh a klinických skúšaní, frekvencia, typ a závažnosť
nežiaducich reakcií pozorovaných u starších pacientov a pacientov s poruchou funkcie obličiek alebo pečene nenaznačujú žiadne rozdiely vo všeobecných skúsenostiach v porovnaní s bežnou populáciou.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9. Predávkovanie
Špecifiká predávkovania inzulínom nie je možné definovať, hoci sa hypoglykémia môže vyvinúť cez nasledujúce štádiá, ak sa pacientovi podajú veľmi vysoké dávky v porovnaní s jeho potrebou:
• V prípade miernej hypoglykémie možno podať perorálne pacientovi glukózu alebo potravu obsahujúcu cukor. Preto sa odporúča, aby diabetik mal vždy pri sebe potraviny obsahujúce cukor.
• Pri závažnej hypoglykémii, ak je pacient v bezvedomí, mu môže zaškolená osoba podať intramuskulárne alebo subkutánne glukagón (0,5 až 1 mg), alebo mu môže lekár alebo iný zdravotnícky pracovník podať intravenózne glukózu. Ak pacient do 10 až 15 minút nezareaguje na glukagón, musí sa podať intravenózne glukóza. Po obnovení vedomia sa odporúča podať pacientovi perorálne cukor, ako prevenciu proti recidíve.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, inzulíny a analógy na injekciu pôsobiace strednodobo alebo dlhodobo v kombinácii s rýchlo pôsobiacimi, ATC kód: A10AD05.
Truvelog Mix 30 je biologicky podobný liek. Podrobné informácie sú dostupné na webovom sídle
Európskej liekovej agentúr
y http://www.ema.europa.eu.Mechanizmus účinku a farmakodynamické účinkyTruvelog Mix 30 je dvojfázová suspenzia 30 % rozpustného inzulínu aspartátu (rýchlo pôsobiaci
analóg ľudského inzulínu) a 70 % inzulínu aspartátu kryštalizovaného protamínom (strednodobo pôsobiaci analóg ľudského inzulínu).
Vplyv inzulínu aspartátu na znižovanie cukru v krvi vzniká tým, že jeho molekuly uľahčujú vychytávanie glukózy následnou väzbou inzulínu na receptory vo svale a v tukových bunkách a súčasne prebieha inhibícia tvorby glukózy v pečeni.
Truvelog Mix 30 je dvojfázový inzulín, ktorý obsahuje 30 % rozpustného inzulínu aspartátu. Má rýchly nástup účinku, takže umožňuje jeho podávanie ihneď po jedle (v priebehu nula až 10 minút po jedle), čo je porovnateľné s rozpustným ľudským inzulínom. Kryštalická fáza (70 %) obsahuje protamínom kryštalizovaný inzulín aspartát, ktorého profil účinku je podobný ľudskému NPH inzulínu.'
Ak sa Truvelog Mix 30 podá subkutánne, začiatok účinku je do 10 až 20 minút po podaní. Maximálny účinok sa dosiahne medzi 1. až 4. hodinou po podaní. Celková dĺžka trvania účinku je do 24 hodín (obrázok 1).
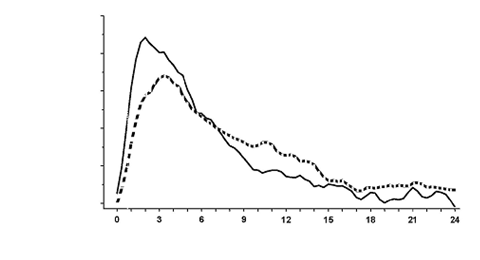
Rýchlosť podávania infúzie glukózy
Hodiny
Obrázok 1: Profil aktivity inzulínu aspartátu Mix 30 (-) a dvojfázového ľudského inzulínu 30 (---) u
zdravých jedincov.
Klinická účinnosť abezpečnosťPri trojmesačnom klinickom skúšaní s pacientmi s diabetom 1. a 2. typu preukázal inzulín aspartát
Mix 30 rovnakú kontrolu glykozylovaného hemoglobínu ako je pri dvojfázovom ľudskom inzulíne 30. Inzulín aspartát má molárny základ rovnocenný s ľudským inzulínom. V porovnaní s dvojfázovým ľudským inzulínom 30, podávanie inzulínu aspartátu Mix 30 pred raňajkami a pred večerou viedlo k nižšej hladine cukru v krvi po oboch jedlách (raňajky a večera).
Meta-analýza zahŕňajúca deväť klinických skúšaní s pacientmi s diabetom 1. a 2. typu ukázala, že hladina cukru v krvi nalačno bola vyššia u pacientov liečených inzulínom aspartátom Mix 30, ako u pacientov liečených dvojfázovým ľudským inzulínom 30.
V jednom skúšaní bolo 341 pacientov s diabetom 2. typu náhodne liečených buď samotným inzulínom aspartátom Mix 30 alebo v kombinácii s metformínom alebo metformínom spolu so sulfonylureou. Premenná primárnej účinnosti - HbA1c sa po 16 týždňoch liečby - nelíšila medzi pacientmi liečenými inzulínom aspartátom Mix 30 v kombinácii s metformínom a pacientmi liečenými metformínom a sulfonylureou. V tomto skúšaní 57 % pacientov malo východiskové hodnoty HbA1c nad 9 %; u týchto pacientov liečba inzulínom aspartátom Mix 30 v kombinácii s metfornínom viedla k významnejšiemu zníženiu HbA1c ako pri metformíne v kombinácii so sulfonylureou.
V jednom skúšaní, pacienti s diabetom 2. typu, nedostatočne kompenzovaní so samotnými perorálnymi antidiabetikami, boli randomizovaní na liečbu inzulínom aspartátom Mix 30 dvakrát denne
(117 pacientov) alebo jedenkrát denne s inzulínom glargínom (116 pacientov). Po 28. týždňoch liečby
podľa pravidiel na stanovenie dávky, ktoré sú naznačené v časti 4.2, priemerné zníženie HbA1c
inzulínom aspartátom Mix 30 bolo 2,8 % (priemerná začiatočná hodnota = 9,7 %). S inzulínom aspartátom Mix 30, 66 % a 42 % pacientov dosiahlo HbA1c hladiny pod 7 % a 6,5 %, v uvedenom poradí, a priemerná FPG sa znížila na hodnotu okolo 7 mmol/l (z východiskovej hodnoty 14 mmol/l na 7,1 mmol/l).
U pacientov s diabetom 2. typu liečených inzulínom aspartátom Mix 30, meta-analýza preukázala znížené riziko celkových nočných hypoglykémií a závažných hypoglykémií v porovnaní s dvojfázovým ľudským inzulínom 30. U pacientov liečených inzulínom aspartátom Mix 30 sa zvýšilo riziko celkových denných hypoglykémií.
Pediatrickápopulácia
16 týždňové klinické skúšanie porovnávajúce kontrolu postprandiálnej glykémie po podaní inzulínu aspartátu Mix 30 v čase jedla s humánnym inzulínom/dvojfázovým humánnym inzulínom 30 podaným v čase jedla a večer podaným NPH inzulínom sa vykonala so 167 pacientmi vo veku 10 až 18 rokov. Priemerná hodnota HbA1c zostala počas skúšania podobná východiskovej hodnote v obidvoch liečených skupinách a vo výskyte hypoglykémie sa nezistil rozdiel po inzulíne aspartáte Mix 30 alebo po dvojfázovom humánnom inzulíne 30.
V menšej (54 pacientov) a mladšej (vekové rozpätie 6 až 12 rokov) populácii, liečenej v dvojito zaslepenom skríženom skúšaní (12 týždňov každá liečba) bol výskyt hypoglykemií a postprandiálneho zvýšenia glukózy signifikantne nižší po inzulíne aspartáte Mix 30 v porovnaní s dvojfázovým humánnym inzulínom 30. Konečná hodnota HbA1c bola signifikantne nižšia v skupine liečenej dvojfázovým humánnym inzulínom 30 v porovnaní s inzulínom aspartátom Mix 30.
5.2 Farmakokinetické vlastnosti
Absorpcia, distribúcia a eliminácia
V inzulíne aspartáte výmena aminokyseliny prolínu za kyselinu asparágovú v polohe B28 znižuje
možnosť tvorby hexamérov, ako sa pozorovalo pri rozpustnom ľudskom inzulíne. Inzulín aspartát v rozpustnej fáze Truvelogu Mix 30 tvorí 30 % celkového inzulínu; rýchlejšie sa absorbuje z podkožnej vrstvy ako rozpustný inzulín, ktorý je zložkou dvojfázového ľudského inzulínu. Zostávajúcich 70 % tvorí kryštalická forma protamínom kryštalizovaného inzulínu aspartátu; ten má predĺžený absorpčný profil podobný ľudskému NPH inzulínu.
Maximálna koncentrácia inzulínu v sére je v priemere o 50 % vyššia po inzulíne aspartáte Mix 30 ako po dvojfázovom ľudskom inzulíne 30. Dĺžka trvania maximálnej koncentrácie je v priemere polovičná ako u dvojfázového ľudského inzulínu 30. U zdravých dobrovoľníkov bola priemerná maximálna koncentrácia v sére 140 ± 32 pmol/l a dosiahla sa za 60 minút po subkutánnej dávke 0,20 jednotiek/kg telesnej hmotnosti. Priemerný polčas (t1/2) inzulínu aspartátu Mix 30 vyjadruje absorpčnú rýchlosť frakcie s naviazaným protamínom, ktorá bola 8-9 hodín. Hladiny inzulínu v sére sa vrátia na základnú hodnotu za 15-18 hodín po subkutánnom podaní. U pacientov s diabetom 2. typu sa maximálna koncentrácia dosiahla za 95 minút po podaní, a merané koncentrácie dosiahli nulovú hodnotu nie neskôr ako za 14 hodín po podaní.
Osobitné skupiny pacientov
Farmakokinetika inzulínu aspartátu Mix 30 sa neskúmala u starších pacientov, alebo u pacientov s
poruchou funkcie obličiek alebo pečene.
Pediatrická populácia
Farmakokinetika inzulínu aspartátu Mix 30 nebola stanovená u detí alebo dospievajúcich. Farmakokinetické a farmakodynamické vlastnosti rozpustného inzulínu aspartátu sa však zisťovali u detí (vo veku 6–12 rokov) a dospievajúcich (vo veku 13–17 rokov) s diabetom 1. typu. Inzulín aspartát sa rýchlo absorboval v obidvoch skupinách s podobným tmax ako u dospelých. Cmax bolo odlišné medzi vekovými skupinami, čo podčiarklo dôležitosť individuálnej titrácie inzulínu aspartátu.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a reprodukčnej toxicity a vývoja, neodhalili žiadne osobitné riziko pre ľudí.
V in vitro testoch, zahrňujúcich väzby na inzulínové a IGF-1 receptorové miesta a pri sledovaní vplyvu na rast buniek sa inzulín aspartát správal podobne ako ľudský inzulín. Štúdie tiež dokázali, že disociácia väzieb medzi inzulínovými receptormi a inzulínom aspartátom je rovnaká ako pri ľudskom
inzulíne.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
glycerol fenol metakrezol
chlorid zinočnatý
heptahydrát hydrogenfosforečnanu sodného chlorid sodný
síran protamínu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Pred otvorenímnaprvépoužitie
2 roky
Po prvom použití
4 týždne.
Uchovávajte pri teplote do 30 °C. Neuchovávajte v chladničke. Neuchovávajte v mrazničke. Udržujte kryt pera na pere na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Truvelog Mix 30 100 jednotiek/mlinjekčnásuspenziavnáplni
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Náplň uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Truvelog Mix 30100jednotiek/mlinjekčnásuspenziavnaplnenompere
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnené pero uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po prvom použití lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Truvelog Mix 30 100 jednotiek/mlinjekčnásuspenziavnáplni
Bezfarebná sklenená náplň typu 1 so sivým piestom (bromobutylová guma) a tesniacim krytom
(hliník) so zátkou (izoprénový laminát a bromobutylová guma). Každá náplň obsahuje 3 ml suspenzie. Náplň obsahuje oceľové guľôčky na uľahčenie resuspendovania.
Veľkosti balenia: 5 alebo 10 náplní. Na trh nemusia byť uvedené všetky veľkosti balenia.
T
r
uvelog
Mi
x
30
100
jednotiek/ml
injekčná
s
uspenzia
v
naplnenom
pere
Bezfarebná sklenená náplň typu 1 so sivým piestom (bromobutylová guma) a tesniacim krytom
(hliník) so zátkou (izoprénový laminát a bromobutylová guma) zaplombovaná do jednorazového injekčného pera (SoloStar). Náplň obsahuje oceľové guľôčky na uľahčenie resuspendovania.
Každé naplnené pero obsahuje 3 ml suspenzie.
Veľkosti balenia: 1, 5 alebo 10 naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Po vybratí Truvelogu Mix 30 z chladničky sa odporúča nechať pred resuspendovaním inzulínu Truvelog Mix 30 dosiahnuť izbovú teplotu počas 1 až 2 hodín, ako je uvedené v časti na prvé použitie. Tento liek sa nesmie použiť, ak resuspendovaný roztok nie je homogénne biely a zakalený. Pacientovi treba zdôrazniť potrebu premiešania suspenzie Truvelog Mix 30 bezprostredne pred použitím. Truvelog Mix 30, ktorý bol zmrazený sa nesmie použiť.
Na každé podanie injekcie použite vždy novú ihlu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Truvelog Mix 30 100 jednotiek/mlinjekčnásuspenziavnáplni
Aby sa zabránilo možnému prenosu choroby, každú náplň smie používať len jeden pacient, a to aj
vtedy, ak sa vymieňa ihla na pomôcke na podávanie.
Truvelog Mix 30 náplne sa majú použiť s perami AllStar alebo AllStar PRO, podľa odporúčania (pozri časť 4.2 a 4.4).
Pri vkladaní náplne, nasadzovaní ihly a podávaní inzulínovej injekcie sa musia dodržiavať pokyny výrobcu pre každé jednotlivé pero.
Pero s vloženou náplňou sa nesmie uchovávať s nasadenou ihlou. Náplň sa nesmie znovu napĺňať.
Truvelog Mix 30100jednotiek/mlinjekčnásuspenziavnaplnenompere
Aby sa zabránilo možnému prenosu choroby, každé pero smie používať len jeden pacient, a to aj
vtedy, ak sa vymieňa ihla.
Naplnené pero sa nesmie uchovávať s nasadenou ihlou. Ihly nie sú súčasťou balenia.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
sanofi-aventis groupe
54, rue La Boétie F - 75008 Paríž Francúzsko
8. REGISTRAČNÉ ČÍSLA
EU/1/22/1639/001
EU/1/22/1639/002
EU/1/22/1639/003
EU/1/22/1639/004
EU/1/22/1639/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu