
/>• Pacienti bez žlčníka (napr. z dôvodu cholecystektómie alebo agenézy). Títo pacienti sú tiež vystavení
zvýšenému riziku spazmu Oddiho sfinktera (pozri časť 4.4).
• Pacienti liečení silnými inhibítormi OATP1B1 (napr. cyklosporín)
• Pankreatitída v anamnéze, alebo známe alebo suspektné štrukturálne ochorenia pankreasu, vrátane obštrukcie pankreatického vývodu. Títo pacienti sú vystavení zvýšenému riziku akútnej pankreatitídy (pozri časť 4.4).
• Poškodenie funkcie pečene (trieda A-C podľa Childa-Pugha). Títo pacienti sú vystavení riziku
významne zvýšenej plazmatickej koncentrácie eluxadolínu (pozri časti 4.4 a 5.2).
• Chronická alebo ťažká zápcha alebo následky zápchy v anamnéze, alebo známa mechanická obštrukcia gastrointestinálneho traktu alebo podozrenie na ňu. Títo pacienti môžu byť vystavení riziku závažných komplikácií črevnej obštrukcie.
4.4 Osobitné upozornenia a opatrenia pri používaní
Spazmus Oddiho sfinktera
Vzhľadom na to, že eluxadolín je agonistom mí opioidných receptorov, u pacientov užívajúcich eluxadolín, najmä u pacientov bez žlčníka (pozri časti 4.3 a 4.8), existuje potenciál zvýšeného rizika spazmu Oddiho sfinktera, ktorý vedie k pankreatitíde alebo zvýšeniu hladiny pečeňových enzýmov spojenému s akútnou bolesťou brucha (napr. bolesť podobná žlčníkovej). Pacienti so známym alebo suspektným ochorením alebo poruchou Oddiho sfinktera a/alebo so známou alebo suspektnou chorobou žlčovodov alebo pankreasu, vrátane pankreatitídy v anamnéze, a takí, ktorí mali cholecystektómiu alebo nemajú žlčník z iných dôvodov, nesmú užívať tento liek (pozri časť 4.3). Pacientov treba poučiť, aby prerušili liečbu a vyhľadali lekársku pomoc, ak sa u nich vyskytnú príznaky pripomínajúce spazmus Oddiho sfinktera, ako je akútne zosilnenie bolesti brucha (napr. akútna bolesť v epigastriu alebo žlčových cestách [t.j. v pravom hornom kvadrante]), ktoré môžu vyžarovať do chrbta alebo ramena, s nevoľnosťou a vracaním alebo bez nich. Liečbu eluxadolínom
netreba opätovne začínať u pacientov, u ktorých došlo k obštrukcii žlčovodu alebo k spazmu Oddiho sfinktera počas užívania eluxadolínu (pozri časť 4.3).
Pankreatitída
U pacientov užívajúcich eluxadolín existuje zvýšené riziko pankreatitídy so spazmom Oddiho sfinktera alebo bez neho (pozri časť 4.3). Najmä u pacientov bez žlčníka sa hlásili závažné prípady,
ktoré viedli k hospitalizácii a úmrtiu. Truberzi je kontraindikovaný pacientom bez žlčníka a pri iných stavoch, ktoré zvyšujú riziko rozvoja pankreatitídy (pozri časť 4.3). Väčšina hlásených prípadov závažnej pankreatitídy sa vyskytla v priebehu týždňa od začatia liečby eluxadolínom a u niektorých
pacientov sa rozvinuli symptómy dokonca už po jednej až dvoch dávkach, no hlásili sa aj prípady
pankreatitídy po dlhšej liečbe.
Pacienti majú byť informovaní a sledovaníz dôvoduprejavov a symptómov naznačujúcich pankreatitídu, napr. bolesť brucha, ktorá môže vyžarovať do chrbta alebo pleca, nevoľnosť a vracanie. Pacienti majú byť poučení o tom, aby prestali užívať liek a vyhľadali lekársku pomoc, ak sa počas užívania eluxadolínu vyvinú tieto symptómy (pozri časť 4.8).
Všetci pacienti majú byť poučení o tom, aby počas liečby eluxadolínom nepožívali alkohol. Zápcha
Pri užívaní eluxadolínu existuje potenciál zvýšeného rizika zápchy (pozri časť 4.8). Ak sa u pacientov
vyvinie ťažká zápcha pretrvávajúca dlhšie ako 4 dni, treba ich poučiť, aby prerušili liečbu a vyhľadali
lekársku pomoc.
Riziko zápchy s eluxadolínom u pacientov s inými podtypmi IBS nie je známe, ale môže byť zvýšené. U pacientov s IBS, u ktorých sa vyprázdňovanie stolice časom mení, treba pri podávaní eluxadolínu postupovať opatrne.
Ospa l osť a sedácia
Pri užívaní eluxadolínu existuje potenciál zvýšeného rizika ospalosti a sedácie (pozri časť 4.8)
u pacientov, u ktorých môže dochádzať k jeho zvýšeným hladinám v plazme, ako napr. u pacientov
s genetickou náchylnosťou na zhoršenú funkciu transportéra OATP1B1. Keďže genetická dispozícia pacienta nemusí byť známa, odporúča sa monitorovať pacientov, či u nich nedochádza k zhoršeniu duševných alebo fyzických schopností potrebných na výkon potenciálne nebezpečných činností, ako sú vedenie vozidiel alebo obsluha strojov (pozri časti 4.7 a 4.8).
Dr ogová zá vi sl osť a pot enci ál zneuží vania
Na základe fyzikálno-chemických a biofarmaceutických vlastností (veľmi nízka biologická dostupnosť pri perorálnom podaní) sa predpokladá, že eluxadolín má minimálny potenciál zneužitia alebo závislosti.
Osobitné populácie
Staršie osoby
Celkovo bola v klinických štúdiách hlásená zvýšená frekvencia nežiaducich udalostí u pacientov vo
veku 65 rokov alebo starších. Avšak, u pacientov vo veku 65 rokov a starších, ktorí dostávali dávku
75 mg dvakrát denne, bol znížený výskyt závažných nežiaducich udalostí ako aj nežiaducich udalostí, ktoré viedli k prerušeniu liečby v porovnaní s pacientmi, ktorí boli liečení dávkou 100 mg dvakrát denne (pozri časť 4.8). Preto možno zvážiť dávku 75 mg dvakrát denne pre túto populáciu, ale jej pomer prínosu a rizika sa má pravidelne vyhodnocovať v kontexte závažnosti príznakov (pozri
časť 4.2).
Pediatrická populácia
Eluxadolín sa nemá používať u detí a dospievajúcich, keďže nebol preskúmaný v tejto populácii (pozri
časť 4.2).
Porucha funkcie obličiek
Nie sú k dispozícii žiadne údaje o farmakokinetike eluxadolínu u pacientov s poškodením funkcie obličiek (pozri časť 5.2). Z dôvodu minimálnej absorpcie a zanedbateľnej úlohy eliminácie obličkami, nepredpokladá sa vplyv poškodenia funkcie obličiek na plazmatickú hladinu eluxadolínu.
Porucha funkcie pečene
Eluxadolín sa nesmie používať u pacientov s anamnézou poškodenia funkcie pečene (trieda A-C podľa Childa-Pugha) alebo v prípadoch, keď je takéto poškodenie prítomné alebo je naň podozrenie (pozri časť 4.3).
Účinok variability funkcie transportéra OATP1B1 na hladiny v plazme
U pacientov s genetickou náchylnosťou na zhoršenú funkciu transportéra OATP1B1 sú hladiny
v plazme zvýšené, a u týchto pacientov možno očakávať vyšší výskyt nežiaducich udalostí, najmä tých
gastrointestinálnych, ako aj účinkov na CNS (pozri časť 5.2).
Malabsorpcia žlčových kyselín
Významný podiel pacientov, u ktorých bol diagnostikovaný IBS-D, môžu byť postihnutí malabsorbciou žlčových kyselín ako možnou príčinou symptómov IBS-D. Bezpečnosť a účinnosť eluxadolínu v tejto podskupine pacientov s IBS-D sa nestanovila.
4.5 Liekové a iné interakcie
Lieky spôsobujúce zápchu
I keď neboli preukázané žiadne priame liekové interakcie, treba sa vyhnúť chronickému užívaniu loperamidu s eluxadolínom, keďže toto môže zvýšiť riziko zápchy. Tiež sa treba vyhnúť užívaniu eluxadolínu s inými liekmi, ktoré môžu spôsobiť zápchu (napríklad anticholinergiká, opioidy, atď.).
Inhibítory OATP1B1
Súbežné podávanie inhibítorov OATP1B1 (cyklosporín, gemfibrozil, antiretrovirotiká [atazanavir, lopinavir, ritonavir, sakvinavir, tipranavir], rifampicín) s eluxadolínom môže zvýšiť expozíciu eluxadolínu (pozri časť 5.2). Eluxadolín sa nemá podávať súbežne s takými liekmi (pozri časť 4.3).
Substráty pre OATP1B1
Eluxadolín môže zvýšiť expozíciu súbežne podaných substrátov OATP1B1 (napr. rosuvastatín) (pozri
časť 5.2) o až do 40 % celkovej expozície, čo sa zvyčajne nepovažuje za klinicky významné. Účinok na iné statíny, ktoré sú citlivejšími substrátmi OATP1B1 (napr. simvastatín a atorvastatín), môže byť však výraznejší. Preto treba postupovať opatrne u pacientov, ktorí dostávajú takéto lieky, najmä vo vysokých dávkach.
Medzi iné substráty, ktoré môžu byť ovplyvnené, patria napr. sartany (valsartan, olmesartan)
Substráty pre CYP3A
Eluxadolín môže zvýšiť expozíciu súbežne podávaných liekov metabolizovaných prostredníctvom cytochrómu CYP3A4. Pri podávaní takýchto liekov je potrebná opatrnosť (napr. midazolam, erytromycín, nifedipín), a to najmä pri tých s úzkym terapeutickým indexom (napr. alfentanil, dihydroergotamín, ergotamín, fentanyl, pimozid, chinidín, sirolimus, takrolimus). Koncentrácia týchto súbežne podávaných liekov s úzkym terapeutickým indexom alebo ich ďalších farmakodynamických markerov sa má sledovať na začiatku a na konci ich súbežného podávania s eluxadolínom.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii je iba obmedzené množstvo údajov o použití eluxadolínu u gravidných žien. Štúdie na zvieratách neukázali priame ani nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri
časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu Truberzi počas gravidity.
Doj če ni e
Nie je známe, či sa eluxadolín vylučuje do ľudského mlieka. Dostupné
farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie eluxadolínu do mlieka
(pre podrobné informácie pozri časť 5.3). Riziko u novorodencov/dojčiat nemôže byť vylúčené. Musí sa urobiť rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom Truberzi vzhľadom na prínos dojčenia pre dieťa a prínos liečby pre ženu.
Fertilita
Nie sú k dispozícii žiadne údaje o účinku eluxadolínu na fertilitu u ľudí. U potkanov nebol žiadny účinok na párenie, fertilitu a ukazovatele plodnosti (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Eluxadolín má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Z dôvodu príhod ospalosti a sedácie, pozorovaných v klinických štúdiách, je potrebná opatrnosť (pozri časti 4.4 a 4.5).
4.8 Nežiaduce účinky
Súhrn bezpeč nost ného pr ofi l u
Najčastejšie hlásenými nežiaducimi reakciami (incidencia >5 %) boli zápcha (7 % pacientov, ktorí dostávali 75 mg a 8 % pacientov, ktorí dostávali 100 mg), nauzea (8 % a 7 % pacientov, ktorí dostávali 75 mg a 100 mg v danom poradí) a bolesť brucha (6 % a 7 % pacientov, ktorí dostávali
75 mg a 100 mg v danom poradí). Tiež môže dôjsť k závažným nežiaducim reakciám ako sú
pankreatitída (0,2 % a 0,3 % pacientov, ktorí dostávali 75 mg a 100 mg v danom poradí) a spazmus
Oddiho sfinktera (0,2 % pacientov, ktorí dostávali 75 mg a 0,8 % pacientov, ktorí dostávali 100 mg).
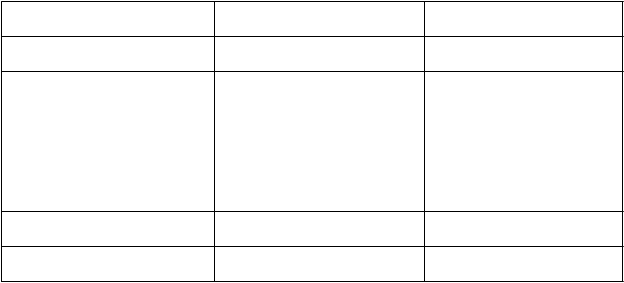
T abuľkový pr ehľad neži aduci ch r eakci í
Nežiaduce reakcie sú uvedené podľa klasifikácie orgánových systémov a konvencie frekvencií MedDRA: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), a neznáme (z dostupných údajov).
Trieda orgánových systémov Časté Menej časté
Poruchy nervového systému Závraty
Ospalosť1
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného
t
kaniva
Laboratórne a funkčné vyšetrenia
Zápcha Nevoľnosť Bolesť brucha2
Vracanie Plynatosť Distenzia brucha
Gastroezofágová refluxová choroba4
Vyrážka5
Zvýšená hladina ALT
Zvýšená hladina AST
Spazmus Oddiho sfinktera3
Pankreatitída
 1
Termín "ospalosť" zahrnuje: ospalosť a sedáciu.
2
Termín "bolesť brucha" zahrnuje: bolesť brucha, bolesť v dolnej časti brucha a bolesť v hornej časti
brucha.
3
Termín “spazmus Oddiho sfinktera” zahrnuje: prejav ako pankreatitída (termíny zahrnujú
alkoholickú pankreatitídu, pankreatitídu a akútnu pankreatitídu) a zvýšenia hladín pečeňových enzýmov s bolesťou brucha (termíny zahrnujú bolesť brucha, bolesť v hornej časti brucha, dyspepsiu a dysfunkciu Oddiho sfinktera).
1
Termín "ospalosť" zahrnuje: ospalosť a sedáciu.
2
Termín "bolesť brucha" zahrnuje: bolesť brucha, bolesť v dolnej časti brucha a bolesť v hornej časti
brucha.
3
Termín “spazmus Oddiho sfinktera” zahrnuje: prejav ako pankreatitída (termíny zahrnujú
alkoholickú pankreatitídu, pankreatitídu a akútnu pankreatitídu) a zvýšenia hladín pečeňových enzýmov s bolesťou brucha (termíny zahrnujú bolesť brucha, bolesť v hornej časti brucha, dyspepsiu a dysfunkciu Oddiho sfinktera).
4
Termín “gastroezofágová refluxová choroba” zahrnuje gastroezofágovú refluxovú chorobu,
dyspepsiu a gastritídu.
5
Termín “vyrážka" zahrnuje: dermatitídu, alergickú dermatitídu, vyrážku, vyrážky po celom tele, makulopapulárnu vyrážku, papulárnu vyrážku, svrbivú vyrážku, žihľavku a idiopatickú žihľavku.
O
pi s vybr aných ne ži aduci ch r ea kcií
Zápcha
K približne 50 % prípadov zápchy došlo v priebehu prvých 2 týždňov liečby.
Miera ťažkej zápchy bola menej ako 1 % u pacientov užívajúcich 75 mg a 100 mg eluxadolínu, a nevyskytli sa žiadne závažné komplikácie zápchy spojenej s používaním eluxadolínu v pivotných štúdiách. Pre zápchu liečbu prerušilo alebo dočasne pozastavilo užívanie 1 % pacientov užívajúcich
75 mg a 2 % pacientov užívajúcich 100 mg v danom poradí, v porovnaní s <1 % pacientov liečených
placebom. Pacientov treba poučiť, aby prerušili užívanie lieku a vyhľadali lekársku pomoc, ak sa u nich vyskytne ťažká zápcha trvajúca viac ako 4 dni (pozri časť 4.4).
Spazmus Oddiho sfinkteraV klinických štúdiách sa prípady spazmu Oddiho sfinktera prejavovali ako zvýšené hladiny pečeňových enzýmov spojené s bolesťou brucha u 8 pacientov, pankreatitída u 1 pacienta a bolesť brucha so zvýšením hladiny lipázy, nižším ako je trojnásobok hornej hranice normálneho rozsahu, u 1 pacienta. K 80 % (8/10) udalostí spazmu Oddiho sfinktera došlo v prvom týždni liečby. Všetky udalosti ustúpili po prerušení liečby s Truberzi, pričom príznaky sa zvyčajne zlepšili do nasledujúceho dňa. Ku všetkým udalostiam spazmu Oddiho sfinktera došlo u pacientov bez žlčníka. Preto je eluxadolín kontraindikovaný u tejto populácie, ako aj u tých, ktorí mali v minulosti problémy so žlčovými cestami (pozri časti 4.2, 4.3 a 4.4). Výskyt takýchto udalostí u pacientov s neporušenými žlčovými cestami sa nedá vylúčiť.
PankreatitídaV klinických štúdiách boli hlásené dodatočné prípady pankreatitídy, ktoré nesúviseli so spazmom Oddiho sfinktera. Z 5 hlásených prípadov boli 3 spojené s nadmerným užívaním alkoholu, 1 bol spojený so žlčovým kalom, a v jednom prípade pacient prerušil liečbu eluxadolínom 2 týždne pred nástupom príznakov.
Všetky pankreatické udalosti, či už spojené so spazmom Oddiho sfinktera alebo nie, boli spätne vyhodnotené ako udalosti miernej intenzity, poukazujúc tým na neprítomnosť orgánového zlyhania a miestnych alebo systémových komplikácií. Všetky pankreatické udalosti sa vyriešili normalizáciou lipázy po prerušení liečby eluxadolínom, pričom 80 % (4/5) sa vyriešilo do 1 týždňa po prerušení liečby (pozri časť 4.4).
Staršie osobyZ 1795 pacientov s IBS-D, ktorí boli zahrnutí do klinických štúdií s eluxadolínom a zaradení do skupín dostávajúcich 75 mg alebo 100 mg dvakrát denne, 139 (7,7 %) boli vo veku aspoň 65 rokov, pričom 15 (0,8 %) mali aspoň 75 rokov.
Bolo pozorované celkové zvýšenie frekvencie nežiaducich udalostí v staršej populácii v porovnaní
s pacientmi <65 rokov, ktoré bolo porovnateľné u všetkých liečebných skupín, vrátane placeba. Frekvencia závažných nežiaducich udalostí, gastrointestinálnych udalostí a udalostí vedúcich
k prerušeniu mala tendenciu byť nižšia v prípade dávky 75 mg v porovnaní s dávkou 100 mg. Preto
možno u tejto populácie používať dávku 75 mg dvakrát denne (pozri časti 4.2 a 4.4).
Hl ás eni e podozr ení na nežiaduc e r ea kcie 
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Príznaky
Jednorazové supraterapeutické perorálne dávky eluxadolínu do 1 000 mg a jednorazové intranazálne dávky do 200 mg boli spojené s väčším výskytom nežiaducich udalostí ako jednorazová dávka
100 mg, najmä gastrointestinálne udalosti a účinky centrálnej nervovej sústavy. Predávkovanie
eluxadolínom môže viesť k príznakom vyplývajúcim zo zosilnenia známych farmakodynamických účinkov lieku.
Lie čba V prípade akútneho predávkovania treba pacienta pozorne sledovať a treba mu poskytnúť štandardnú podpornú liečbu podľa potreby. Treba zvážiť výplach žalúdka alebo podanie aktívneho uhlia. Vzhľadom na účinok eluxadolínu na opioidné receptory, treba zvážiť podanie narkotického antagonistu mí opioidných receptorov, ako je naloxón. Vzhľadom na krátky polčas naloxónu môže byť potrebné jeho opakované podanie. V prípade podania naloxónu, jedincov treba pozorne sledovať, či sa u nich vracajú príznaky predávkovania, čo môže poukazovať na potrebu opakovanej injekcie naloxónu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnosti

Farmakoterapeutická skupina: {zatiaľ nepridelená}, ATC kód: {zatiaľ nepridelený}
Me chani zmus úč i nku Eluxadolín je miestne pôsobiaci zmiešaný agonista mí opioidných receptorov (μOR) a antagonista delta opioidných receptorov (δOR). Eluxadolín je tiež agonista kapa opioidných receptorov (κOR). Väzobné afinity (Ki) eluxadolínu k ľudským μOR a δOR sú 1,8 nM a 430 nM v danom poradí. Väzobná afinita (Ki) eluxadolínu k ľudským κOR nebola stanovená, avšak hodnota Ki pre κOR v cerebelle morčiat je 55 nM. U zvierat eluxadolín interaguje s opioidnými receptormi v čreve. Eluxadolín preukázal účinnosť v normalizácii prechodu potravy gastrointestinálnym traktom a defekácie v niekoľkých modeloch stresom indukovanej alebo gastrointestinálnym zápalom zmenenej funkcie gastrointestinálneho traktu u zvierat. Eluxadolín má veľmi nízku biologickú dostupnosť pri perorálnom podaní a nepreukazuje žiadne detegovateľné účinky sprostredkované centrálnou nervovou sústavou (CNS) pri perorálnom podaní účinných dávok zvieratám. Eluxadolín tiež mení
hyperalgetické odpovede v zvieracom modeli akútnej viscerálnej bolesti indukovanej kolitídou.
Farmakodynami cké úč i nky Keďže má obmedzenú biologickú dostupnosť, farmakodynamická aktivita eluxadolínu je založená prevažne na lokálnom účinku vnútri gastrointestinálneho traktu. Podporujúc nedostatok systémových farmakodynamických účinkov, výsledky štúdie skúmajúcej potenciál na perorálne zneužívanie u rekreačných užívateľov opioidov ukázali, že perorálne dávky vo výške až 1000 mg nevyvolali významné zúženie zreníc alebo významné zaujatie liečivom. Štúdia skúmajúca potenciál zneužitia intranazálnych dávok 100 mg a 200 mg eluxadolínu mala za výsledok vyššie systémové koncentrácie eluxadolínu, ktoré vyvolali zmeny priemeru zreníc, ale boli spojené s averziou voči liečivu. U pacientov s IBS-D nebol zistený žiadny signál pre nežiaduce udalosti sprostredkované centrálnou nervovou sústavou. Súhrnne tieto výsledky naznačujú, že keď sa tento liek používa v terapeutických dávkach podľa návodu, u pacientov sa nevyskytnú významné účinky na centrálnu nervovú sústavu, ani nežiaduce udalosti charakteristické pre drogy.
Klinická účinnosť a bezpečnosť Účinnosť a bezpečnosť eluxadolínu u pacientov s IBS-D boli stanovené vo dvoch randomizovaných, multicentrických, mnohonárodných, dvojito zaslepených štúdiách kontrolovaných placebom (Štúdie 1 a 2). Celkovo bolo zaradených 1282 pacientov do Štúdie 1 (IBS-3001) a 1146 pacientov do Štúdie 2 (IBS-3002), a boli liečení Truberzi 75 mg, Truberzi 100 mg alebo placebom dvakrát denne. Celkovo
mali pacienti priemerný vek 45 rokov (rozsah 18-80 rokov, pričom 10 % bolo vo veku minimálne 65 rokov alebo starších), 66 % ženského pohlavia, 86 % belochov, 12 % černochov a 27 % Hispáncov. Všetci pacienti spĺňali kritériá pre IBS Rím III a museli spĺňať nasledovné kritériá:
• počas týždňa pred randomizáciou bol priemer skóre najhoršej bolesti brucha (worst abdominal
pain, WAP) za posledných 24 hodín >3,0 na stupnici od 0 do 10.
• počas týždňa pred randomizáciou bol priemer denných skóre konzistencie stolice (Bristol Stool
Score, BSS) ≥5,5 a najmenej 5 dní BSS skóre bolo ≥5 na stupnici od 1 do 7.
• počas týždňa pred randomizáciou bol priemerné skóre globálnych príznakov >2,0 na stupnici 0-
4 (0 znamená žiadne príznaky, 1 znamená mierne príznaky, 2 znamená stredne ťažké príznaky, 3
znamená ťažké príznaky a 4 znamená veľmi ťažké príznaky).
Tieto štúdie boli identické svojím usporiadaním počas prvých 26 týždňov. Štúdia 1 (IBS-3001) pokračovala ako dvojito zaslepená ďalších 26 týždňov na preskúmanie dlhodobej bezpečnosti (celkovo 52 týždňov liečby), po čom nasledovali 2 týždne následného pozorovania. Štúdia 2 (IBS-
3002) po ukončení liečebného obdobia 26 týždňov zahrnovala jednoducho zaslepené 4-týždňové
obdobie s odobratím placeba.
Účinnosť eluxadolínu sa hodnotila pomocou celkovej analýzy odpovedí, definovanej ako súčasné zlepšenie denného WAP skóre o ≥30 % v porovnaní so základným týždenným priemerom A zníženie BSS na <5 počas aspoň 50 % dní v časovom období. Zlepšenia globálnych príznakov IBS boli hodnotené na základe ukazovateľa odpovede dostatočnej úľavy, ktorý bol definovaný ako dosiahnutie dostatočnej úľavy od príznakov IBS počas aspoň 50 % týždňov, a na základe ukazovateľa odpovede globálnych príznakov, ktorý bol definovaný denným hodnotením globálnych príznakov ako žiadne alebo mierne počas najmenej 50 % dní. Výsledky pre ukazovatele boli založené na denných elektronických záznamoch do denníka, zaznamenaných pacientmi.
Výsledky účinnosti pre ≥50 % dní s odpoveďou (primárny kombinovaný ukazovateľ) počas 6 mesiacov sú uvedené v Tabuľke 2. V oboch štúdiách bol podiel pacientov s kombinovanou odpoveďou na Truberzi 100 mg dvakrát denne štatisticky významne vyšší ako v prípade placeba. Počas obdobia 6 mesiacov v oboch štúdiách bol podiel pacientov s odpoveďou dostatočnej úľavy
v prípade Truberzi 100 mg dvakrát denne štatisticky významne vyšší ako v prípade placeba. Počas
obdobia 6 mesiacov v Štúdii 2 bol podiel pacientov s odpoveďou na globálne príznaky v prípade Truberzi 100 mg dvakrát denne štatisticky významne vyšší ako v prípade placeba, a číselne vyšší ako placebo v Štúdii 1. Neboli zistené žiadne rozdiely v účinnosti v závislosti od pohlavia.
Tabuľka 2: Výsledky účinnosti v randomizovaných klinických štúdiách
Štúdia 1 (IBS 3001) Štúdia 2 (IBS 3002)
Truberzi
T
ruberzi
100 mg n=426
T
ruberzi
75 mg n=427
Placebo n=427
T
ruberzi
100 mg n=382
75 mg
n=381
Placebo
n=382
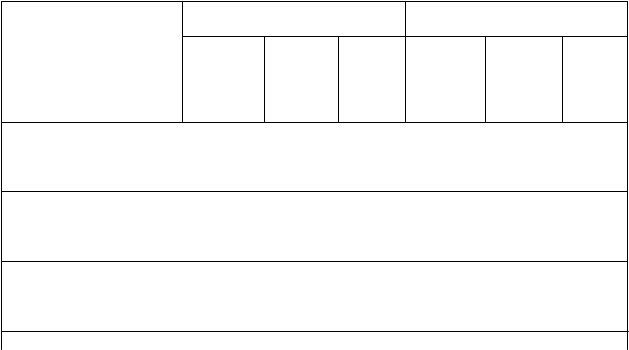 K
ombinovaná odpoveď
K
ombinovaná odpoveď
Miery odozvy 29 % 23 % 19 % 33 % 30 % 20 % Hodnoty P <0,001 0,112 <0,001 0,001'
Odpoveď bolesti bruchaMiery odozvy 47 % 45 % 43 % 50 % 48 % 45 % Hodnoty P 0,355 0,852 0,148 0,448
Odpoveď BSS <5Miery odozvy 34 % 28 % 24 % 40 % 34 % 24 % Hodnoty P 0,001 0,186 <0,001 <0,001
Odpoveď dostatočnej
 úľavy
úľavy
Miery odozvy 49,5 % 45,7 % 40,0 % 53,7 % 52,8 % 43,7 % Hodnoty P 0,005 0,097 0,006 0,013
Odpoveď globálnychpríznakovMiery odozvy 34,7 % 35,1 % 28,8 % 43,2 % 45,1 % 34,3 %
Hodnoty P 0,063 0,048 0,012 0,002
V prípade dennej kombinovanej odpovede, eluxadolín sa začal oddeľovať od placeba krátko po začatí
liečby, pričom maximálny účinok bolo vidieť po 4-6 týždňoch, a tento účinok sa udržal počas priebehu liečby. Okrem toho, podiel pacientov, ktorí mali kombinovanú odpoveď na eluxadolín v každom 4- týždňovom období v mesiacoch 1 až 6, bol vyšší ako placebo v prípade oboch dávok v oboch štúdiách fázy 3, čo ukazuje na to, že pri pokračovanej liečbe eluxadolínom je účinnosť zachovaná.
Liečba eluxadolínom tiež viedla k významným zlepšeniam u pacientov, ktorých príznaky IBS-D
neboli dostatočne kontrolované používaním loperamidu pred zaradením.
Keď sa prah pre odpoveď bolesti brucha zvýšil na ≥40 % alebo ≥50 % zlepšenie z východiskovej hodnoty v dennej najhoršej bolesti brucha, podiel pacientov, ktorí mali odpoveď bolesti brucha bol o
6 %-7 % vyšší v prípade eluxadolínu 100 mg dvakrát denne v porovnaní s placebom, čo bolo štatisticky významné (P ≤0,009) pre zhrnuté údaje (Štúdia 1 a Štúdia 2). Pacienti, ktorí dostávali eluxadolín tiež hlásili významné zníženie frekvencie vyprázdňovania a nadúvania v porovnaní s placebom, čo bolo preukázané zmenami východiskového skóre v dennom vyprázdňovaní a nadúvaní v týždňoch 12 a 26. Pacienti, ktorí dostávali eluxadolín hlásili významné zvýšenia v dňoch bez naliehavostí, ako pre ≥50 % dní bez naliehavostí, tak aj pre ≥75 % dní bez naliehavostí. Eluxadolín
tiež významne zlepšuje kvalitu života pacienta, čo je preukázané zmenou východiskového skóre
v dotazníku IBS-QOL v týždňoch 12 a 26.
Počas 4 týždňov jednoducho zaslepeného obdobia vysadenia v Štúdii 2 (IBS-3002) neboli preukázané
žiadne dôkazy opätovnej hnačky alebo bolesti brucha.
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky klinických štúdií s Truberzi v jednej alebo vo viacerých podskupinách pediatrickej populácie s IBS-D (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiSystémová expozícia eluxadolínu po perorálnom podaní je nízka a je v súlade s jeho miestnym účinkom v gastrointestinálnom trakte. Toto liečivo má lineárnu farmakokinetiku bez akumulácie po opakovanom dávkovaní dvakrát denne. Priemerný polčas eliminácie z plazmy je 5 hodín, s vysokou interindividuálnou variabilitou. Eluxadolín sa vylučuje predovšetkým nezmenený prostredníctvom biliárneho systému, pričom obličky majú minimálnu rolu v jeho eliminácii. Eluxadolín nie je induktorom/inhibítorom hlavných CYP enzýmov, eluxadolín však má určitý potenciál pre inaktiváciu CYP3A4 založenú na metabolizme. Je substrátom a inhibítorom pečeňového vychytávacieho transportéra OATP1B1 a substrátom pečeňového efluxného transportéra MRP2. Poškodenie funkcie pečene alebo súbežné podanie s cyklosporínom vedie k významnému zvýšeniu plazmatickej koncentrácie eluxadolínu.
AbsorpciaAbsolútna biologická dostupnosť eluxadolínu nebola stanovená, ale sa odhaduje, že je nízka, vzhľadom na obmedzenú absorpciu a efekt prvého prechodu pečeňou. Absorpcia eluxadolínu nalačno bola rýchla, pričom hodnota mediánu Tmax bola 2 hodiny. Podanie eluxadolínu s jedlom s vysokým obsahom tukov významne znížilo Cmax (50 %) aj AUC (60 %), a nemalo žiadny účinok na Tmax. Pri podaní viacnásobných perorálnych dávok dvakrát denne nedochádzalo k žiadnej akumulácii liečiva.
D
i
stribúcia
V populačnej farmakokinetickej analýze bol odhadovaný zdanlivý distribučný objem eluxadolínu
27 100 l. U zdravých osôb sa eluxadolín viazal stredne silno (81 %) na plazmatické bielkoviny.
Biotransformácia
Eluxadolín sa vylučuje predovšetkým stolicou, či už ako neabsorbované liečivo, alebo prostredníctvom biliárneho systému, pričom obličky majú minimálnu rolu v jeho eliminácii. Štúdie in vitro preukázali, že eluxadolín bol stabilný v ľudských hepatocytoch, pečeňových a
intestinálnych mikrozómoch, a že jediný zistený menej významný a neúčinný metabolit eluxadolínu
bol acylglukuronidový metabolit (M11), vytvorený glukuronidáciou skupiny kyseliny metoxybenzoovej. Po perorálnej dávke 1 000 mg zdravým dobrovoľníkom mužského pohlavia bol M11 zistený v moči, ale nie v systémovom obehu.
Eluxadolín existuje prevažne vo forme (S,S)-diastereoméru (>99 %) a in vivo iba jeho malý alebo
žiadny podiel podstupuje chirálnu premenu.
Eluxadolín má nízky potenciál liekových interakcií vyplývajúci z obmedzenej inhibície/indukcie CYP in vitro a vzhľadom na to, že v klinicky významných koncentráciách nie je substrátom pre CYP enzýmy.
Inhibítory OATP1B1
Eluxadolín je substrátom pre pečeňový vychytávací transportér OATP1B1. Súbežné podanie eluxadolínu s cyklosporínom (inhibítor OATP1B1) zvýšilo expozíciu eluxadolínu približne o 5- násobok (pozri časti 4.3 a 4.5).
Inhibítory MRP2
Eluxadolín je substrátom pre pečeňový efluxový transportér MRP2. Súbežné podanie eluxadolínu s probenecidom (inhibítor MRP2) malo za výsledok približne 1,4-násobné zvýšenie expozície eluxadolínu. Nie je potrebná žiadna úprava dávky.
Substráty pre OATP1B1
Eluxadolín je inhibítorom pečeňového vychytávacieho transportéru OATP1B1. Súbežné podanie eluxadolínu s rosuvastatínom (substrát pre OATP1B1) malo za výsledok až 1,4-násobné zvýšenie expozície rosuvastatínu a hlavného aktívneho metabolitu, N-demetyl rosuvastatínu, v porovnaní s rosuvastatínom podaným samostatne. Nie je potrebná žiadna úprava dávky v prípade súbežne podávaných substrátov pre OATP1B1. Je však potrebná opatrnosť u pacientov, ktorí dostávajú vysoké dávky substrátov pre OATP1B1 (pozri časť 4.5).
Posúdenie liekových interakcií metódami in vitro
Štúdie in vitro ukazujú, že eluxadolín v klinicky významných koncentráciách nie je ani induktorom CYP1A2, CYP2B6, CYP2C9, CYP2C19 alebo CYP3A4, ani inhibítorom CYP1A2, CYP2A6, CYP2B6, CYP2C9, CYP2C19, CYP2C8 alebo CYP2D6. CYP2E1 bol mierne inhibovaný (50 % inhibičná koncentrácia [IC50] bola približne 20 µM [11 µg/ml]), hoci sa nepredpokladá, že táto inhibícia bude mať za výsledok akékoľvek klinicky významné interakcie. Štúdie in vitro na pečeňových mikrozómoch ukázali, že eluxadolín nie je inhibítorom CYP3A4 v klinicky významných koncentráciách, ale v črevných mikrozómoch eluxadolín inhiboval CYP3A4 s hodnotou Ki vo výške
450 µM (256 µg/ml). Potenciálne vysoké koncentrácie (až 700 µM) eluxadolínu v čreve môžu
ovplyvniť farmakokinetiku súbežne podávaných substrátov pre CYP3A4 (pozri časť 4.5). Štúdie in vitro ukázali, že eluxadolín je substrátom a inhibítorom pečeňového vychytávacieho transportéra OATP1B1, substrátom pečeňového efluxového transportéra MRP2, a nie je substrátom ani inhibítorom transportérov P-gp a BCRP.
Eliminácia
Po jednej perorálnej dávke 300 mg [14C] eluxadolínu zdravým osobám mužského pohlavia, 82,2 % celkového množstva [14C] eluxadolínu bolo zachytené v stolici počas 336 hodín, a menej ako 1 % bolo zachytené v moči počas 192 hodín.
Špecif ické populáci e
Vek a pohlavie
Vzhľadom na miestny účinok eluxadolínu v gastrointestinálnom trakte, nízku biodostupnosť po perorálnom podaní a chýbajúcu biotransformáciu, prospektívne klinické štúdie, pokiaľ ide o rozdiely vo veku, indexe telesnej hmotnosti (BMI), etnicite a pohlaví, boli považované za zbytočné. Farmakokinetické údaje pre zdravých dobrovoľníkov, zhrnuté zo štúdií fázy I (v ktorých bola použitá jedna perorálna dávka 100 mg) a analyzované s cieľom stanoviť potenciálne rozdiely založené na pohlaví, veku, rase a BMI, nepreukázali žiadne významné rozdiely.
Porucha funkcie obličiek
Eluxadolín nebol špecificky skúmaný u pacientov s poškodením funkcie obličiek. Vzhľadom na nízku odhadovanú biodostupnosť eluxadolínu po perorálnom podaní (Foral 1,34 %) a obmedzenú elimináciu obličkami, neočakáva sa, že poškodenie funkcie obličiek ovplyvní klírens eluxadolínu.
Porucha funkcie pečene
Zdanlivý klírens eluxadolínu je výrazne znížený a jeho biologický polčas je predĺžený u pacientov s poškodením funkcie pečene (pozri časti 4.3 a 4.4). Po jednej perorálnej dávke 100 mg osobám s rozličnými stupňami poškodenia funkcie pečene a zdravým osobám, plazmatické hladiny eluxadolínu boli v priemere 6-krát, 4-krát a 16-krát vyššie u osôb s miernym, stredne ťažkým, a ťažkým poškodením funkcie pečene (trieda A, B, a C podľa Childa-Pugha) v danom poradí, kým biologický polčas bol predĺžený 3- až 5-násobne (pozri časti 4.3 a 4.4).
Haplotypy spojené so zhoršenou funkciou OATP1B1
Plazmatické hladiny u pacientov s genetickou náchylnosťou na zhoršenú funkciu transportéra OATP1B1 sú zvýšené a u týchto pacientov možno očakávať vyšší výskyt nežiaducich udalostí, najmä tých gastrointestinálnych, ako aj účinkov na CNS (pozri časť 4.4).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí. U potkanov sa eluxadolín vylučoval do mlieka približne dávkovo úmerne maximálnym koncentráciám, menej než plazmatickým koncentráciám.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
oxidom kremičitým impregnovaná mikrokryštalická celulóza (E460);
bezvodý koloidný oxid kremičitý (E551);
krospovidón, typ B (E1202);
manitol (E421);
stearan horečnatý (E572); polyvinylalkohol (E1203); oxid titaničitý (E171); makrogol 3350 (E1521); mastenec (E553b);
žltý oxid železitý (E172);
červený oxid železitý (E172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPCTFE/PVC/Al blister s obsahom 14 filmom obalených tabliet. Balenia s 28, 56 a skupinové balenie obsahujúce 168 (3 balenia po 56) filmom obalenými tabletami.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAllergan Pharmaceuticals International Limited
Clonshaugh Industrial Estate
Coolock
Dublin 17
Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1126/001-006
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 19. september 2016
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.