
soriázou, ako bolo preukázané analýzami mRNA získanými z biopsií kožných lézií pacientov s ložiskovou psoriázou v 12. týždni v porovnaní s východiskovým stavom.
V rovnakej štúdii fázy I viedla v 12. týždni liečba guselkumabom k zlepšeniu histologických meradiel psoriázy, vrátane zníženia hrúbky pokožky a hustoty T-buniek. Navyše boli v štúdiách fázy II a III
pozorované znížené hladiny IL-17A, IL-17F a IL-22 v sére pacientov liečených guselkumabom
v porovnaní s placebom. Tieto výsledky sú v súlade s klinickým prínosom pozorovaným pri liečbe ložiskovej psoriázy guselkumabom.
Klinickáúčinnosťabezpečnosť
Účinnosť a bezpečnosť guselkumabu bola hodnotená v troch randomizovaných, dvojito zaslepených, aktívne kontrolovaných štúdiách fázy III s dospelými pacientmi so stredne závažnou až závažnou ložiskovou psoriázou, ktorí boli kandidátmi na fototerapiu alebo systémovú liečbu.
VOYAGE 1 a VOYAGE 2
Dve štúdie (VOYAGE 1 a VOYAGE 2) hodnotili účinnosť a bezpečnosť guselkumabu v porovnaní s placebom a adalimumabom u 1829 dospelých pacientov. Pacienti randomizovaní na guselkumab (N=825) dostali 100 mg v 0. a 4. týždni, a potom každých 8 týždňov až do 48. týždňa (VOYAGE 1) a do 20. týždňa (VOYAGE 2). Pacienti randomizovaní na adalimumab (N=582) dostali 80 mg
v 0. týždeň a 40 mg v 1. týždeň, po čom nasledovalo 40 mg každý druhý týždeň až do 48. týždňa
(VOYAGE 1) a do 23. týždňa (VOYAGE 2). V oboch štúdiách, pacienti randomizovaní na placebo (N=422) dostali guselkumab 100 mg v 16. a 20. týždni, a potom každých 8 týždňov. V otvorenej štúdii VOYAGE 1 začali všetci pacienti vrátane pacientov randomizovaných na adalimumab v 0. týždni dostávať v 52. týždni guselkumab každých 8 týždňov (q8w). V štúdii VOYAGE 2 pacienti randomizovaní na guselkumab v 0. týždni, ktorí boli v 28. týždni respondérmi podľa Psoriasis Area
and Severity Index (PASI) s hodnotou 90, boli randomizovaní buď na pokračovanie v liečbe guselkumabom každých 8 týždňov (udržiavacia liečba) alebo dostali placebo (ukončenie liečby). Pacienti, ktorí ukončili liečbu, začali znovu používať guselkumab (s dávkou v čase opätovného začiatku liečby, o 4 týždne neskôr a potom každých 8 týždňov), keď zaznamenali aspoň 50 % stratu zlepšenia PASI, ktoré dosiahli v 28. týždni. Pacienti randomizovaní na adalimumab v 0. týždni, ktorí nedosiahli odpoveď PASI 90, dostali guselkumab v 28., 32. týždni a potom každých 8 týždňov.
V štúdii VOYAGE 2 začali všetci pacienti dostávať v 76. týždni odslepený guselkumab každých
8 týždňov.
Východiskové charakteristiky ochorenia boli zhodné v skúšaných populáciách vo VOYAGE 1 a 2
s mediánom plochy povrchu tela (BSA) 22 % a 24 %, mediánom východiskového PASI skóre 19
v oboch štúdiách, mediánom východiskového skóre dermatologického indexu kvality života (DLQI)
14 a 14,5, východiskovým skóre celkového hodnotenia skúšajúcim lekárom (IGA) s hodnotou závažné u 25 % a 23 % pacientov a anamnézou psoriatickej artritídy u 19 % a 18 % pacientov, v tomto poradí.
Spomedzi všetkých pacientov zaradených do VOYAGE 1 a 2, 32 % a 29 % nebolo doposiaľ liečených ani konvenčnou systémovou, ani biologickou liečbou, 54 % a 57 % bolo predtým liečených fototerapiou a 62 % a 64 % bolo predtým liečených konvenčnou systémovou liečbou, v tomto poradí. V oboch štúdiách bolo 21 % predtým liečených biologickou liečbou, vrátane 11 %, ktorí dostali najmenej jednu látku proti tumor nekrotizujúcemu faktoru alfa (TNFα), a približne 10 %, ktorí dostali látku proti IL-12/IL-23.
Účinnosť guselkumabu bola hodnotená s ohľadom na celkové postihnutie kože, lokalitu ochorenia (koža na temene, ruky a nohy a nechty), kvalitu života a výsledky hlásené pacientom. Koprimárne cieľové ukazovatele vo VOYAGE 1 a 2 boli podiel pacientov, ktorí v 16. týždni v porovnaní
s placebom dosiahli skóre IGA čisté alebo minimálne (IGA 0/1) a odpoveď PASI 90 (pozri
Tabuľku 2).
CelkovépostihnutiekožeLiečba guselkumabom viedla k významným zlepšeniam v meradlách aktivity ochorenia v porovnaní
s placebom a adalimumabom v 16. týždni a v porovnaní s adalimumabom v 24. a 48. týždni. Kľúčové výsledky účinnosti pre primárne a hlavné sekundárne cieľové ukazovatele sú uvedené nižšie
v Tabuľke 2.
Tabuľka 2: Súhrn klinických odpovedí vo VOYAGE 1 a VOYAGE 2
| Počet pacientov (%)
| VOYAGE 1
| VOYAGE 2
| Placebo
(N=174)
| Guselkumab
(N=329)
| Adalimumab
(N=334)
| Placebo
(N=248)
| Guselkumab
(N=496)
| Adalimumab
(N=248)
| 16. týždeň
PASI 75
PASI 90
PASI 100
IGA 0/1
IGA 0
|
10 (5,7)
5 (2,9)
1 (0,6)
12 (6,9)
2 (1,1)
|
300 (91,2)a
241 (73,3)c
123 (37,4)a
280 (85,1)c
157 (47,7)a
|
244 (73,1)b
166 (49,7)b
57 (17,1)d
220 (65,9)b
88 (26,3)d
|
20 (8,1)
6 (2,4)
2 (0,8)
21 (8,5)
2 (0,8)
|
428 (86,3)a
347 (70,0)c
169 (34,1)a
417 (84,1)c
215 (43,3)a
|
170 (68,5)b
116 (46,8)b
51 (20,6)d
168 (67,7)b
71 (28,6)d
| 24. týždeň
PASI 75
PASI 90
PASI 100
IGA 0/1
IGA 0
|
-
-
-
-
-
|
300 (91,2)
264 (80,2)
146 (44,4)
277 (84,2)
173 (52,6)
|
241 (72,2)e
177 (53,0)b
83 (24,9)e
206 (61,7)b
98 (29,3)b
|
-
-
-
-
-
|
442 (89,1)
373 (75,2)
219 (44,2)
414 (83,5)
257 (51,8)
|
176 (71,0)e
136 (54,8)b
66 (26,6)e
161 (64,9)b
78 (31,5)b
| 48. týždeň
PASI 75
PASI 90
PASI 100
IGA 0/1
IGA 0
|
-
-
-
-
-
|
289 (87,8)
251 (76,3)
156 (47,4)
265 (80,5)
166 (50,5)
|
209 (62,6)e
160 (47,9)b
78 (23,4)e
185 (55,4)b
86 (25,7)b
|
-
-
-
-
-
|
-
-
-
-
-
|
-
-
-
-
-
|
|
|
a p < 0,001 pre porovnanie guselkumabu a placeba.
b p < 0,001 pre porovnanie guselkumabu a adalimumabu s ohľadom na hlavné sekundárne cieľové ukazovatele.
c p < 0,001 pre porovnanie guselkumabu a placeba s ohľadom na koprimárne cieľové ukazovatele.
d porovnania guselkumabu a adalimumabu sa neurobili.
e p < 0,001 pre porovnanie guselkumabu a adalimumabu.
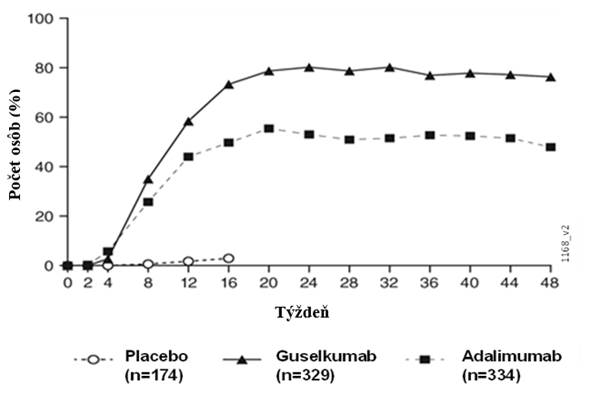
OdpoveďvčaseGuselkumab preukázal rýchly nástup účinnosti s významne vyšším percentom zlepšenia PASI
v porovnaní s placebom už v 2. týždni (p < 0,001). Percento pacientov, ktorí dosiahli odpoveď
PASI 90, bolo od 8. týždňa numericky vyššie pri guselkumabe ako pri adalimumabe, rozdiel dosiahol maximum okolo 20. týždňa (VOYAGE 1 a 2) a udržal sa do 48. týždňa (VOYAGE 1) (pozri
Obrázok 1).
Obrázok 1: Percento osôb, ktoré dosiahli podľa návštev odpoveď PASI 90 do 48. týždňa (osoby randomizované v 0. týždni) vo VOYAGE 1
V štúdii VOYAGE 1 bola u pacientov, ktorí dostávali kontinuálnu liečbu guselkumabom, miera odpovede PASI 90 udržaná od 52. týždňa do 156. týždňa. U pacientov randomizovaných na adalimumab v 0. týždni, ktorí boli prevedení na guselkumab v 52. týždni, sa miera odpovede PASI 90 zvýšila od 52. do 76. týždňa a potom bola udržaná do 156. týždňa (pozri Obrázok 2).
Obrázok 2: Percento osôb, ktoré dosiahli odpoveď PASI 90 podľa návštev v otvorenej fáze štúdie VOYAGE 1
Účinnosť a bezpečnosť guselkumabu bola preukázaná bez ohľadu na vek, pohlavie, rasu, telesnú hmotnosť, umiestnenie ložísk, závažnosť východiskového PASI, súbežnú psoriatickú artritídu
a predchádzajúcu biologickú liečbu. Guselkumab bol účinný u pacientov, ktorí neboli predtým liečení konvenčnou systémovou liečbou, biologickou liečbou a u pacientov, ktorí boli liečení biologickou
liečbou.
Vo VOYAGE 2, 88,6 % pacientov, ktorí dostali udržiavaciu liečbu guselkumabom, boli v 48. týždni respondérmi PASI 90 v porovnaní s 36,8 % pacientov, u ktorých bola liečba ukončená v 28. týždni
(p < 0,001). Strata odpovede PASI 90 bola zaznamenaná už 4 týždne po ukončení liečby
guselkumabom s mediánom doby do straty odpovede PASI 90 približne 15 týždňov. Spomedzi pacientov, ktorí ukončili liečbu a následne znovu začali liečbu guselkumabom, 80 % znovu získalo odpoveď PASI 90, keď boli hodnotení 20 týždňov po začiatku opätovnej liečby.
Vo VOYAGE 2, spomedzi 112 pacientov randomizovaných na adalimumab, ktorým sa nepodarilo dosiahnuť odpoveď PASI 90 v 28. týždni, 66 % dosiahlo odpoveď PASI 90 po 20 týždňoch a 76 % po
44 týždňoch liečby guselkumabom. Navyše spomedzi 95 pacientov randomizovaných na guselkumab, ktorým sa nepodarilo dosiahnuť odpoveď PASI 90 v 28. týždni, 36 % dosiahlo odpoveď PASI 90 pri
ďalších 20 týždňoch a 41 % pri ďalších 44 týždňoch kontinuálnej liečby guselkumabom. U pacientov, ktorí prešli z adalimumabu na guselkumab, neboli pozorované žiadne nové bezpečnostné zistenia.
LokalitaochoreniaVo VOYAGE 1 a 2 boli v 16. týždni pozorované významné zlepšenia psoriázy na koži na temene, rukách a nohách a na nechtoch (merané pomocou Scalp-specific Investigator Global Assessment [ss- IGA], Physician’s Global Assessment of Hands and/or Feet [hf-PGA], Fingernail Physician’s Global Assessment [f-PGA] a Nail Psoriasis Severity Index [NAPSI], v tomto poradí) u pacientov liečených guselkumabom v porovnaní s pacientmi, ktorí dostávali placebo (p < 0,001, Tabuľka 3). Guselkumab preukázal superioritu v porovnaní s adalimumabom pri psoriáze na temene a na rukách a nohách v
24. týždni (VOYAGE 1 a 2) a 48. týždni (VOYAGE 1) (p ≤ 0,001, okrem psoriázy na rukách a nohách v 24. týždni [VOYAGE 2] a 48. týždni [VOYAGE 1], p < 0,05).
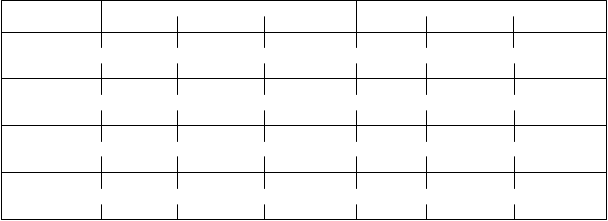 Tabuľka 3: Súhrn odpovedí lokality ochorenia vo VOYAGE 1 a VOYAGE 2
VOYAGE
1
VOYAGE
2
ss
-
IGA (N)
a
Tabuľka 3: Súhrn odpovedí lokality ochorenia vo VOYAGE 1 a VOYAGE 2
VOYAGE
1
VOYAGE
2
ss
-
IGA (N)
a
ss-IGA 0/1b, n (%)
16. týždeň
hf-PGA (N)a Placebo
| Guselkumab
| Adalimumab
| Placebo
| Guselkumab
| Adalimumab
| 145
| 277
| 286
| 202
| 408
| 194
|
21 (14,5)
|
231 (83,4)c
|
201 (70,3)d
|
22 (10,9)
|
329 (80,6)c
|
130 (67,0)d
| 43
| 90
| 95
| 63
| 114
| 56
|
6 (14,0)
|
66 (73,3)e
|
53 (55,8)d
|
9 (14,3)
|
88 (77,2)e
|
40 (71,4)d
| 88
| 174
| 173
| 123
| 246
| 124
|
14 (15,9)
|
68 (39,1)e
|
88 (50,9)d
|
18 (14,6)
|
128 (52,0)e
|
74 (59,7)d
| 99
| 194
| 191
| 140
| 280
| 140
|
|
|
hf-PGA 0/1b, n (%)
16. týždeň
f-PGA (N)af-PGA 0/1, n (%)
16. týždeň
NAPSI (N)aPercento zlepšenia, priemer (SD)
16. týždeň -0,9 (57,9) 34,4 (42,4)e 38,0 (53,9)d 1,8 (53,8) 39,6 (45,6)e 46,9 (48,1)d
a Zahŕňa len pacientov s východiskovými skóre ss-IGA, f-PGA, hf-PGA ≥ 2 alebo východiskovým skóre NAPSI > 0.
b Zahŕňa len pacientov, ktorí dosiahli zlepšenie oproti východiskovej hodnote ≥ 2 stupne ss-IGA a/alebo hf-PGA.
c p < 0,001 pre porovnanie guselkumabu a placeba s ohľadom na hlavný sekundárny cieľový ukazovateľ.
d porovnania guselkumabu a adalimumabu sa neurobili.
e p < 0,001 pre porovnanie guselkumabu a placeba.
Kvalitaživotasúvisiacasozdravím/VýsledkyhlásenépacientomVo VOYAGE 1 a 2 boli v 16. týždni u pacientov liečených guselkumabom v porovnaní s pacientmi dostávajúcimi placebo pozorované významne väčšie zlepšenia kvality života súvisiacej so zdravím
merané pomocou Dermatology Life Quality Index (DLQI) a zlepšenia pacientom hlásených príznakov psoriázy (svrbenie, bolesť, pálenie, pichanie a napnutie kože) a prejavov psoriázy (suchá, popraskaná,
šupinatá, opadávajúca alebo olupujúca sa, sčervenaná a krvácajúca koža) meraných pomocou Psoriasis Symptoms and Signs Diary (PSSD) (Tabuľka 4). Prejavy zlepšenia výsledkov hlásených pacientom sa udržali do 24. týždňa (VOYAGE 1 a 2) a 48. týždňa (VOYAGE 1). V štúdii VOYAGE 1 sa
u pacientov, ktorí dostávali kontinuálnu liečbu guselkumabom, tieto zlepšenia udržali v otvorenej fáze do 156. týždňa (Tabuľka 5).





 Tabuľka 4: Súhrn výsledkov hlásených pacientom v 16. týždni vo VOYAGE 1 a VOYAGE 2
Tabuľka 4: Súhrn výsledkov hlásených pacientom v 16. týždni vo VOYAGE 1 a VOYAGE 2
| VOYAGE 1
| VOYAGE 2
| Placebo
| Guselkumab
| Adalimumab
| Placebo
| Guselkumab
| Adalimumab
| DLQI, osoby
s východiskovým skóre
|
170
|
322
|
328
|
248
|
495
|
247
| Zmena oproti východiskovej hodnote, priemer (štandardná odchýlka)
| 16. týždeň
|
-0,6 (6,4)
| -11,2 (7,2)c
| -9,3 (7,8)b
| -2,6
(6,9)
| -11,3 (6,8)c
| -9,7 (6,8)b
| PSSD skóre príznakov, osoby s východiskovým skóre > 0
|
129
|
248
|
273
|
198
|
410
|
200
| Skóre príznakov = 0, n (%)
16. týždeň 1 (0,8) 67 (27,0)a 45 (16,5)b 0 112 (27,3)a 30 (15,0)b
PSSD skóre
prejavov, osoby 129 248 274 198 411 201
s východiskovým
skóre > 0
Skóre prejavov = 0, n (%)
| 16. týždeň
| 0
| 50 (20,2)a
| 32 (11,7)b
| 0
| 86 (20,9)a
| 21 (10,4)b
|
|
|
a p < 0,001 pre porovnanie guselkumabu a placeba.
b porovnania guselkumabu a adalimumabu sa neurobili.
c p < 0,001 pre porovnanie guselkumabu a placeba s ohľadom na hlavné sekundárne cieľové ukazovatele.
Tabuľka 5: Súhrn výsledkov hlásených pacientom v otvorenej fáze štúdie VOYAGE 1
|
Guselkumab
|
Adalimumab - Guselkumab
|
76. týždeň
|
156. týždeň
|
76. týždeň
|
156. týždeň
|
DLQI skóre > 1 v úvode, n
Osoby s DLQI 0/1
|
445
337 (75,7 %)
|
411
307 (74,7 %)
|
264
198 (75,0 %)
|
251
190 (75,7 %)
|
PSSD skóre príznakov,
pacienti s východiskovým skóre
> 0
Skóre príznakov = 0, n (%) PSSD skóre prejavov, pacienti s východiskovým skóre > 0
Skóre prejavov = 0, n (%)
|
347
136 (39,2 %)
347
102 (29,4 %)
|
319
129 (40,4 %)
319
93 (29,2 %)
|
227
99 (43,6 %)
228
71 (31,1 %)
|
214
96 (44,9 %)
215
69 (32,1 %)
|
Vo VOYAGE 2 zaznamenali v 16. týždni pacienti liečení guselkumabom v porovnaní s pacientmi
dostávajúcimi placebo významne väčšie zlepšenie oproti východiskovému stavu kvality života súvisiacej so zdravím, úzkosti a depresie a meradiel pracovného obmedzenia, meraných pomocou 36-
bodového zdravotného dotazníka (SF-36, z angl. Short Form), Hospital Anxiety and Depression Scale
(HADS) a Work Limitations Questionnaire (WLQ), v tomto poradí. U pacientov randomizovaných na udržiavaciu liečbu v 28. týždni sa zlepšenia SF-36, HADS a WLQ udržali do 48. týždňa a v otvorenej
fáze do 156. týždňa.
NAVIGATEŠtúdia NAVIGATE hodnotila účinnosť guselkumabu u pacientov, ktorí v 16. týždni neodpovedali dostatočne (t. j. pacienti, ktorí nedosiahli odpoveď „čisté“ alebo „minimálne“ definovanú ako IGA
≥ 2) na ustekinumab. Všetci pacienti (N = 871) dostali v 0. a 4. týždni v otvorenej fáze ustekinumab
(45 mg ≤ 100 kg a 90 mg > 100 kg). V 16. týždni boli 268 pacienti so skóre IGA ≥ 2 randomizovaní buď na pokračovanie liečby ustekinumabom (N = 133) každých 12 týždňov alebo na začatie liečby guselkumabom (N = 135) v 16., 20. týždni, a potom každých 8 týždňov. Východiskové charakteristiky boli u randomizovaných pacientov podobné ako charakteristiky pozorované vo VOYAGE 1 a 2.
Po randomizácii bol primárnym cieľovým ukazovateľom počet návštev po randomizácii medzi 12. a 24. týždňom, pri ktorých pacienti dosiahli skóre IGA 0/1 a zaznamenali zlepšenie ≥ 2 stupne. Pacienti boli vyšetrovaní v štvortýždňových intervaloch, celkovo pri štyroch návštevách. Spomedzi pacientov, ktorí neodpovedali dostatočne na ustekinumab v čase randomizácie, bolo významne väčšie zlepšenie účinnosti pozorované u pacientov, ktorí prešli na liečbu guselkumabom v porovnaní
s pacientmi, ktorí boli naďalej liečení ustekinumabom. V období medzi 12. a 24. týždňom po randomizácii dosiahli pacienti s guselkumabom skóre 0/1 so zlepšením ≥ 2 stupňa dvakrát častejšie ako pacienti s ustekinumabom (priemer 1,5 oproti 0,7 návštevy, v tomto poradí, p < 0,001). Navyše,
12 týždňov po randomizácii dosiahol väčší podiel pacientov s guselkumabom v porovnaní s pacientmi s ustekinumabom skóre IGA 0/1 a zlepšenie ≥ 2 stupňa (31,1 % oproti 14,3 %, v tomto poradí;
p = 0,001) a odpoveď PASI 90 (48 % oproti 23 %, v tomto poradí, p < 0,001). Rozdiely v mierach odpovede medzi pacientmi liečenými guselkumabom a ustekinumabom boli zaznamenané už 4 týždne po randomizácii (11,1 % a 9,0 %, v tomto poradí) a maximum dosiahli 24 týždňov po randomizácii
(pozri Obrázok 3). U pacientov, ktorí prešli z ustekinumabu na guselkumab neboli pozorované žiadne nové bezpečnostné zistenia.
Obrázok 3: Percento osôb, ktoré dosiahli skóre IGA čisté (0) alebo minimálne (1) a zlepšenie
IGA minimálne 2. stupňa od 0. do 24. týždňa, podľa návštevy po randomizácii v štúdii NAVIGATE
ECLIPSE
Účinnosť a bezpečnosť guselkumabu v porovnaní so sekukinumabom sa hodnotili tiež v dvojito zaslepenej štúdii. Pacienti boli randomizovaní na podávanie guselkumabu (N = 534; 100 mg v 0. a
4. týždni a potom q8w) alebo sekukinumabu (N = 514; 300 mg v 0., 1., 2., 3. a 4. týždni a potom
každé 4 týždne). V oboch liečebných skupinách bola posledná dávka podaná v 44. týždni.
Východiskové charakteristiky ochorenia zodpovedali populácii so stredne závažnou až závažnou ložiskovou psoriázou s mediánom BSA 20 %, mediánom PASI skóre 18 a skóre IGA s hodnotou závažné u 24 % pacientov.
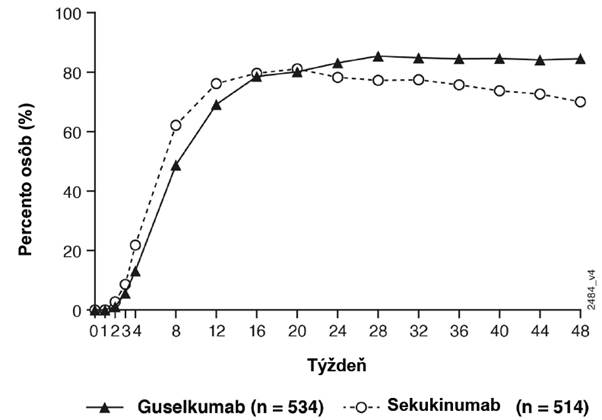
Guselkumab preukázal superioritu nad sekukinumabom pri meraní primárneho cieľového ukazovateľa odpoveď PASI 90 v 48. týždni (84,5 % oproti 70,0 %, p < 0,001). Porovnávacie miery odpovede PASI sú uvedené v Tabuľke 6.
Table 6: Miery odpovede PASI v ECLIPSE
| Počet pacientov (%)
| Guselkumab (N = 534)
| Sekukinumab (N = 514)
| Primárny cieľový ukazovateľ
odpoveď PASI 90 v 48. týždni
Významné sekundárne cieľové ukazovatele
odpoveď PASI 75 v oboch 12. aj
48. týždni
odpoveď PASI 75 v 12. týždni odpoveď PASI 90 v 12. týždni odpoveď PASI 100 v 48. týždni
|
451 (84,5 %) a
b
452 (84,6 %)
477 (89,3 %) c
369 (69,1 %) c
311 (58,2 %) c
|
360 (70,0 %)
412 (80,2 %)
471 (91,6 %)
391 (76,1 %)
249 (48,4 %)
|
|
|
a p < 0,001 pre superioritu
b p < 0,001 pre non-inferioritu, p = 0,062 pre superioritu
c formálne štatistické testovanie sa neuskutočnilo
Miery odpovede PASI 90 do 48. týždňa pre guselkumab a sekukinumab sú uvedené na Obrázku 4.
Obrázok 4: Percento osôb, ktoré dosiahli podľa návštev odpoveď PASI 90 do 48. týždňa (osoby randomizované v 0. týždni) v ECLIPSE
 Pediatrická
populácia
Pediatrická
populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Tremfyou pre ložiskovú psoriázu v jednej alebo vo viacerých podskupinách pediatrickej populácie (informácie
o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaPo podaní jednorazovej 100 mg subkutánnej injekcie zdravým osobám dosiahol guselkumab priemernú hodnotu (± SD) maximálnej koncentrácie v sére (Cmax) 8,09 ± 3,68 µg/ml za približne
5,5 dňa po podaní dávky.
Po subkutánnom podaní 100 mg guselkumabu v 0. a 4. týždni a následne každých 8 týždňov bola rovnovážna koncentrácia guselkumabu v sére dosiahnutá do 20. týždňa. Priemerné (± SD) rovnovážne minimálne koncentrácie guselkumabu v sére v dvoch štúdiách fázy III boli 1,15 ± 0,73 µg/ml a
1,23 ± 0,84 µg/ml.
Absolútna biologická dostupnosť guselkumabu po jednorazovej 100 mg subkutánnej injekcii zdravým osobám sa odhaduje na približne 49 %.
DistribúciaPriemerný distribučný objem počas terminálnej fázy (Vz) po jednorazovom intravenóznom podaní zdravým osobám sa pohyboval približne v rozsahu 7 až 10 l v rámci všetkých štúdií.
BiotransformáciaPresná dráha, prostredníctvom ktorej sa guselkumab metabolizuje, nebola charakterizovaná. Predpokladá sa, že ako humánna IgG mAb, sa guselkumab rozloží na malé peptidy a aminokyseliny prostredníctvom katabolických dráh rovnakým spôsobom ako endogénny IgG.
Eliminácia
V rámci všetkých štúdií sa priemerný systémový klírens (CL) po jednorazovom intravenóznom podaní zdravým osobám pohyboval v rozsahu od 0,288 do 0,479 l/deň. V rámci všetkých štúdií bol priemerný
polčas (T1/2) guselkumabu u zdravých osôb približne 17 dní a približne 15 až 18 dní u pacientov s ložiskovou psoriázou.
Linearita/nelinearita
Po jednorazovej subkutánnej injekcii v dávkach od 10 mg do 300 mg zdravým osobám alebo pacientom s ložiskovou psoriázou sa systémová expozícia guselkumabu (Cmax a AUC) zvyšovala spôsobom približne úmerným dávke.
Staršípacienti
Neuskutočnili sa žiadne špecifické štúdie so staršími pacientmi. Spomedzi 1384 pacientov s ložiskovou psoriázou vystavených guselkumabu a zaradených do analýzy populačnej farmakokinetiky bolo 70 pacientov vo veku 65 rokov alebo starších, vrátane 4 pacientov, ktorí mali
75 rokov alebo boli starší. Analýzy populačnej farmakokinetiky nepreukázali žiadne zjavné zmeny v odhadoch CL/F u pacientov vo veku ≥ 65 rokov v porovnaní s pacientmi vo veku < 65 rokov, čo
naznačuje, že u starších pacientov nie je potrebná úprava dávky.
Pacientisporuchoufunkcieobličiekalebopečene
Neuskutočnila sa žiadna špecifická štúdia za účelom stanovenia vplyvu poruchy funkcie obličiek alebo pečene na farmakokinetiku guselkumabu. Predpokladá sa, že renálna eliminácia intaktného
guselkumabu, t. j. IgG mAb, bude nízka a menej významná; podobne sa predpokladá, že porucha funkcie pečene neovplyvní klírens guselkumabu, keďže IgG mAb sa eliminujú hlavne
prostredníctvom intracelulárneho katabolizmu.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, toxicity na reprodukciu a vývin pred a po narodení neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách toxicity po opakovanom podávaní makakom dlhochvostým bol guselkumab dobre znášaný pri intravenóznom a subkutánnom podávaní. Subkutánna dávka 50 mg/kg podaná opiciam jedenkrát
za týždeň viedla k hodnotám expozície (AUC) a Cmax, ktoré boli minimálne 49-násobne a
>200-násobne vyššie, v tomto poradí, ako hodnoty namerané v klinickej FK štúdii u ľudí. Navyše
nebola zaznamenaná žiadna nežiaduca imunotoxicita ani farmakologické vplyvy na kardiovaskulárnu bezpečnosť počas trvania štúdií toxicity po opakovanom podávaní ani vo farmakologickej štúdii zameranej na kardiovaskulárnu bezpečnosť u makakov dlhochvostých.
V histopatologických vyšetreniach zvierat liečených až do 24 týždňov ani po 12-týždňovom období rekonvalescencie, počas ktorého bol liek detekovateľný v sére, neboli pozorované žiadne preneoplastické zmeny.
S guselkumabom sa neuskutočnili štúdie mutagenity alebo karcinogenity.
Guselkumab nebolo možné detegovať v materskom mlieku makakov, keď sa meranie uskutočnilo na
28. deň po pôrode.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Histidín
Monohydrát histidíniumchloridu
Polysorbát 80
Sacharóza
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Uchovávajte naplnenú injekčnú striekačku alebo naplnené injekčné pero vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Tremfya100mginjekčnýroztokvnaplnenejinjekčnej striekačke
1 ml roztok v naplnenej sklenenej injekčnej striekačke s pripevnenou ihlou a krytom ihly, zostavenými v automatickom ochrannom kryte ihly.
Tremfya je dostupná v balení obsahujúcom jednu naplnenú injekčnú striekačku a vo viacpočetnom balení obsahujúcom 2 (2 balenia po 1) naplnené injekčné striekačky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Tremfya100mginjekčnýroztokvnaplnenominjekčnompere
1 ml roztok v naplnenej sklenenej injekčnej striekačke zostavenej v naplnenom injekčnom pere s automatickým ochranným krytom ihly.
Tremfya je dostupná v balení obsahujúcom jedno naplnené injekčné pero a vo viacpočetnom balení
obsahujúcom 2 (2 balenia po 1) naplnené injekčné perá. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Po vybratí naplnenej injekčnej striekačky alebo naplneného injekčného pera z chladničky nechajte naplnenú injekčnú striekačku alebo naplnené injekčné pero v škatuli a nechajte ju dosiahnuť izbovú teplotu tým, že počkáte 30 minút pred injekčným podaním Tremfye. Naplnenou injekčnou striekačkou alebo naplneným injekčným perom sa nemá triasť.
Odporúča sa pred použitím vizuálne skontrolovať naplnenú injekčnú striekačku alebo naplnené injekčné pero. Roztok má byť číry, bezfarebný až svetložltý a môže obsahovať niekoľko malých bielych alebo priesvitných častíc. Tremfya sa nemá použiť, ak je roztok kalný alebo zafarbený alebo obsahuje veľké častice.
Každé balenie Tremfye sa dodáva s letákom obsahujúcim „Návod na použitie”, ktorý ucelene opisuje prípravu a podanie naplnenej injekčnej striekačky alebo naplneného injekčného pera.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
8. REGISTRAČNÉ ČÍSLOEU/1/17/1234/001 1 naplnená injekčná striekačka EU/1/17/1234/002 1 naplnené injekčné pero EU/1/17/1234/003 2 naplnené injekčné perá EU/1/17/1234/004 2 naplnené injekčné striekačky
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 10. novembra 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
PRÍLOHA II
A
. VÝROBCOVIA BIOLOGICKEJ AKTÍVNEJ LÁTKY A VÝROBCA ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
B
. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA VÝDAJA A POUŽITIA
C
. ĎALŠIE PODMIENKY A POŽIADAVKY REGISTRÁCIE D. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA
BEZPEČNÉHO A ÚČINNÉHO POUŽÍVANIA LIEKU
A
. VÝROBCOVIA BIOLOGICKEJ AKTÍVNEJ LÁTKY A VÝROBCA ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
Názo
v
aadresa
výrobcov
biologickej
aktívnej
látky
Biogen Inc. (BIIB)
5000 Davis Drive Research Triangle Park NC27709
USA
Janssen Sciences Ireland UC Barnahely
Ringaskiddy
Co. Cork
Írsko
Názovaadresavýrobcuzodpovednéhozauvoľneniešarže
Janssen Biologics B.V. Einsteinweg 101
2333CB Leiden
Holandsko
B. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA VÝDAJA A POUŽITIA
Výdaj lieku je viazaný na lekársky predpis s obmedzením predpisovania (pozri Prílohu I: Súhrn charakteristických vlastností lieku, časť 4.2).
C. ĎALŠIE PODMIENKY A POŽIADAVKY REGISTRÁCIE
· Periodicky aktualizované správy o bezpečnosti (Periodic safety update reports, PSUR)
Požiadavky na predloženie PSUR tohto lieku sú stanovené v zozname referenčných dátumov Únie (zoznam EURD) v súlade s článkom 107c ods. 7 smernice 2001/83/ES a všetkých následných aktualizácií uverejnených na európskom internetovom portáli pre lieky.
Držiteľ rozhodnutia o registrácii predloží prvú PSUR tohto lieku do 6 mesiacov od registrácie.
D. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA BEZPEČNÉHO A ÚČINNÉHO POUŽÍVANIA LIEKU
· Plán riadenia rizík (RMP)
Držiteľ rozhodnutia o registrácii vykoná požadované činnosti a zásahy v rámci dohľadu nad liekmi, ktoré sú podrobne opísané v odsúhlasenom RMP predloženom v module 1.8.2 registračnej dokumentácie a vo všetkých ďalších odsúhlasených aktualizáciách RMP.
Aktualizovaný RMP je potrebné predložiť:
· na žiadosť Európskej agentúry pre lieky;
· vždy v prípade zmeny systému riadenia rizík, predovšetkým v dôsledku získania nových informácií, ktoré môžu viesť k výraznej zmene pomeru prínosu a rizika, alebo v dôsledku
dosiahnutia dôležitého medzníka (v rámci dohľadu nad liekmi alebo minimalizácie rizika).
PRÍLOHA III
OZNAČENI
E OBALU A PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
A. OZNAČENIE OBALU









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA NAPLNENEJ INJEKČNEJ STRIEKAČKY (100 mg)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA NAPLNENEJ INJEKČNEJ STRIEKAČKY (100 mg)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenej injekčnej striekačke
guselkumab
2. LIEČIVO (LIEČIVÁ)Každá naplnená injekčná striekačka obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
1 naplnená injekčná striekačka
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.
Neuchovávajte v mrazničke.
Uchovávajte naplnenú injekčnú striekačku vo vonkajšej škatuli na ochranu pred svetlom.








 10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/001
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE 1 NAPLNENÚ INJEKČNÚ STRIEKAČKU (100 mg) AKO PROSTREDNÉ
BALENIE / SÚČASŤ VIACPOČETNÉHO BALENIA (BEZ BLUE BOXU)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE 1 NAPLNENÚ INJEKČNÚ STRIEKAČKU (100 mg) AKO PROSTREDNÉ
BALENIE / SÚČASŤ VIACPOČETNÉHO BALENIA (BEZ BLUE BOXU)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenej injekčnej striekačke
guselkumab
2. LIEČIVO (LIEČIVÁ)Každá naplnená injekčná striekačka obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
1 naplnená injekčná striekačka
Súčasť viacpočetného balenia, nesmie sa predávať samostatne.
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.
Neuchovávajte v mrazničke.









Uchovávajte naplnenú injekčnú striekačku vo vonkajšej škatuli na ochranu pred svetlom.
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/004
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓD18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOM









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE VIACPOČETNÉ BALENIE NAPLNENÝCH INJEKČNÝCH STRIEKAČIEK
OBSAHUJÚCE 2 BALENIA (VRÁTANE BLUE BOXU)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE VIACPOČETNÉ BALENIE NAPLNENÝCH INJEKČNÝCH STRIEKAČIEK
OBSAHUJÚCE 2 BALENIA (VRÁTANE BLUE BOXU)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenej injekčnej striekačke
guselkumab
2. LIEČIVO (LIEČIVÁ)Každá naplnená injekčná striekačka obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
Viacpočetné balenie: 2 (2 balenia po 1) naplnené injekčné striekačky
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.
Neuchovávajte v mrazničke.









Uchovávajte naplnenú injekčnú striekačku vo vonkajšej škatuli na ochranu pred svetlom.
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/004 (2 balenia, každé obsahuje 1 naplnenú injekčnú striekačku)
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
NÁLEPKA NA NAPLNENEJ INJEKČNEJ STRIEKAČKE (100 mg)
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
NÁLEPKA NA NAPLNENEJ INJEKČNEJ STRIEKAČKE (100 mg)
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIA
Tremfya 100 mg
injekcia guselkumab s.c.
2. SPÔSOB PODÁVANIA3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽELot
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO KUSOVÝCH JEDNOTKÁCH1 ml
6. INÉ









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽ
A NAPLNENÉHO INJEKČNÉHO PERA (100 mg)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽ
A NAPLNENÉHO INJEKČNÉHO PERA (100 mg)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenom injekčnom pere
guselkumab
2. LIEČIVO (LIEČIVÁ)Každé naplnené injekčné pero obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
1 naplnené injekčné pero
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.
Neuchovávajte v mrazničke.
Uchovávajte naplnené injekčné pero vo vonkajšej škatuli na ochranu pred svetlom.








 10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/002
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE 1 NAPLNENÉ INJEKČNÉ PERO (100 mg) AKO PROSTREDNÉ BALENIE /
SÚČASŤ VIACPOČETNÉHO BALENIA (BEZ BLUE BOXU)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE 1 NAPLNENÉ INJEKČNÉ PERO (100 mg) AKO PROSTREDNÉ BALENIE /
SÚČASŤ VIACPOČETNÉHO BALENIA (BEZ BLUE BOXU)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenom injekčnom pere
guselkumab
2. LIEČIVO (LIEČIVÁ)Každé naplnené injekčné pero obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
1 naplnené injekčné pero
Súčasť viacpočetného balenia, nesmie byť predávané samostatne.
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.









Neuchovávajte v mrazničke.
Uchovávajte naplnené injekčné pero vo vonkajšej škatuli na ochranu pred svetlom.
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/003
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓD18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOM









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE VIACPOČETNÉ BALENIE NAPLNENÝCH PIER OBSAHUJÚCE 2
BALENIA (VRÁTANE BLUE BOXU)
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA PRE VIACPOČETNÉ BALENIE NAPLNENÝCH PIER OBSAHUJÚCE 2
BALENIA (VRÁTANE BLUE BOXU)
1. NÁZOV LIEKU
Tremfya 100 mg injekčný roztok v naplnenom injekčnom pere
guselkumab
2. LIEČIVO (LIEČIVÁ)Každé naplnené injekčné pero obsahuje 100 mg guselkumabu v 1 ml.
3. ZOZNAM POMOCNÝCH LÁTOKPomocné látky: sacharóza, histidín, monohydrát histidíniumchloridu, polysorbát 80, voda na injekcie.
4. LIEKOVÁ FORMA A OBSAHInjekčný roztok
Viacpočetné balenie: 2 (2 balenia po 1) naplnené injekčné perá
5. SPÔSOB A CESTA (CESTY) PODÁVANIANetraste.
Subkutánne použitie
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADU A DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEUchovávajte v chladničke.
Neuchovávajte v mrazničke.









Uchovávajte naplnené injekčné pero vo vonkajšej škatuli na ochranu pred svetlom.
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgicko
12. REGISTRAČNÉ ČÍSLOEU/1/17/1234/003 (2 balenia, každé obsahuje 1 naplnené injekčné pero)
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMETremfya 100 mg
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN






 MINIMÁLN
E ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
NÁLEPKA NA NAPLNENOM INJEKČNOM PERE (100 mg)
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIA
MINIMÁLN
E ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
NÁLEPKA NA NAPLNENOM INJEKČNOM PERE (100 mg)
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIA
Tremfya 100 mg
injekcia guselkumab s.c.
2. SPÔSOB PODÁVANIA3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽELot
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO KUSOVÝCH JEDNOTKÁCH1 ml
6. INÉ
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
Písomná informácia pre používateľa
Tremfya 100 mg injekčný roztok v naplnenej injekčnej striekačke
guselkumab
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Tento liek bol predpísaný iba vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Tremfya a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Tremfyu
3. Ako používať Tremfyu
4. Možné vedľajšie účinky
5. Ako uchovávať Tremfyu
6. Obsah balenia a ďalšie informácie
1. Čo je Tremfya a na čo sa používaTremfya obsahuje liečivo guselkumab, typ proteínu nazývaný monoklonálna protilátka.
Tento liek blokuje činnosť proteínu nazývaného IL-23, ktorý je prítomný vo zvýšených hladinách u ľudí so psoriázou.
Tremfya sa používa na liečbu dospelých so stredne závažnou až závažnou „ložiskovou psoriázou“, zápalovým stavom postihujúcim kožu a nechty.
Tremfya môže zlepšiť stav kože a vzhľad nechtov a zmierniť príznaky, ako šupinatenie, opadávanie, odlupovanie, svrbenie, bolesť a pálenie.
2. Čo potrebujete vedieť predtým, ako použijete TremfyuNepoužívajte Tremfyu· ak ste alergický na guselkumab alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6). Ak si myslíte, že môžete byť alergický, poraďte sa so svojím lekárom predtým, ako
použijete Tremfyu
· ak máte aktívnu infekciu, vrátane aktívnej tuberkulózy
Upozornenia a opatreniaPredtým, ako začnete používať Tremfyu, obráťte sa na svojho lekára, lekárnika alebo zdravotnú
sestru:
· ak sa liečite z infekcie
· ak máte infekciu, ktorá pretrváva alebo sa opätovne vracia
· ak máte tuberkulózu alebo ste boli v úzkom kontakte s niekým s tuberkulózou
· ak si myslíte, že máte infekciu alebo máte príznaky infekcie (pozri nižšie pod „Dávajte si pozor na infekcie a alergické reakcie”)
· ak ste boli nedávno očkovaný alebo máte byť očkovaný počas liečby Tremfyou.
Ak si nie ste istý, či sa vás týka niečo z vyššie uvedeného, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru predtým, ako začnete používať Tremfyu.
Dávajte si pozor na infekcie a alergické reakcie
Tremfya môže potenciálne spôsobiť vážne vedľajšie účinky vrátane alergických reakcií a infekcií.
Počas používania Tremfye si musíte všímať prejavy týchto stavov. Prestaňte používať Tremfyu a okamžite informujte svojho lekára alebo vyhľadajte lekársku pomoc, ak spozorujete akékoľvek
prejavy svedčiace o možnej vážnej alergickej reakcii alebo infekcii.
Prejavy infekcií môžu zahŕňať horúčku alebo príznaky podobné chrípke; svalové bolesti, kašeľ; dýchavičnosť; pálenie pri močení alebo nutnosť močiť častejšie než obvykle; krv v hliene (slize); úbytok telesnej hmotnosti; hnačku alebo bolesť žalúdka; teplú, červenú alebo bolestivú pokožku alebo vriedky na tele, ktoré sa líšia od psoriázy.
Pri používaní Tremfye sa vyskytli vážne alergické reakcie, ktoré môžu zahŕňať príznaky žihľavky a dýchavičnosť (pozri „Vážne vedľajšie účinky“ v časti 4).
Deti a dospievajúci
Tremfya sa neodporúča deťom a dospievajúcim mladším ako 18 rokov, pretože nebola skúšaná v tejto vekovej skupine.
Iné lieky a Tremfya
Povedzte svojmu lekárovi alebo lekárnikovi:
· ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky.
· ak ste boli nedávno očkovaný alebo máte byť očkovaný. Nesmiete dostať istý druh vakcín (živé vakcíny), kým používate Tremfyu.
Tehotenstvo a dojčenie
· Tremfya sa nemá používať počas gravidity, pretože účinky tohto lieku na tehotnú ženu nie sú známe. Ak ste žena v plodnom veku, odporúča sa, aby ste sa vyhli otehotneniu a musíte
používať primeranú antikoncepciu, kým používate Tremfyu a minimálne 12 týždňov po
poslednej dávke Tremfye. Ak ste tehotná, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom.
· Ak dojčíte, alebo ak plánujete dojčiť, poraďte sa so svojím lekárom. Spolu so svojím lekárom sa rozhodnete, či budete dojčiť alebo používať Tremfyu.
Vedenie vozidiel a obsluha strojov
Je nepravdepodobné, že Tremfya ovplyvní vašu schopnosť viesť vozidlá a obsluhovať stroje.
3. Ako používať Tremfyu
Vždy používajte tento liek presne tak, ako vám povedal váš lekár alebo zdravotná sestra. Ak si nie ste niečím istý, overte si to u svojho lekára, zdravotnej sestry alebo lekárnika.
Koľko Tremfye sa podáva a ako dlho
Váš lekár rozhodne, ako dlho potrebujete používať Tremfyu.
· Dávka je 100 mg (obsah 1 naplnenej injekčnej striekačky), ktoré sa podávajú injekciou pod kožu (subkutánna injekcia). Môže byť podaná vaším lekárom alebo zdravotnou sestrou.
· Po prvej dávke dostanete ďalšiu dávku o 4 týždne neskôr, a potom každých 8 týždňov.
Na začiatku bude podávať injekčne Tremfyu váš lekár alebo zdravotná sestra. Môžete sa však spolu so svojím lekárom rozhodnúť, že si budete Tremfyu podávať sám. V tomto prípade dostanete príslušné školenie ako si podať injekčne Tremfyu. Obráťte sa na svojho lekára alebo zdravotnú sestru, ak máte akékoľvek otázky o podaní injekcie sebe samému. Je dôležité, aby ste sa nepokúšali podať si injekciu, kým nedostanete školenie od svojho lekára alebo zdravotnej sestry.
Podrobné informácie o tom, ako používať Tremfyu, si pred použitím pozorne prečítajte v „Návode na použitie“, ktorý je ako príloha v škatuli.
Ak použijete viac Tremfye, ako máte
Ak ste dostali viac Tremfye, ako ste mali, alebo bola dávka podaná skôr, ako bolo predpísané, oznámte to svojmu lekárovi.
Ak zabudnete použiť Tremfyu
Ak zabudnete na injekčné podanie dávky Tremfye, oznámte to svojmu lekárovi.
Ak prestanete používať Tremfyu
Nesmiete prestať používať Tremfyu, ak sa o tom najskôr neporozprávate so svojím lekárom. Ak
ukončíte liečbu, príznaky psoriázy sa môžu vrátiť späť.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Vážne vedľajšie účinky
Okamžite informujte svojho lekára alebo vyhľadajte lekársku pomoc, ak spozorujete niektorý
z nasledujúcich vedľajších účinkov:
Možná vážna alergická reakcia – prejavy môžu zahŕňať:
- ťažkosti s dýchaním alebo prehĺtaním
- opuch tváre, pier, jazyka alebo hrdla
- vážne svrbenie kože s červenou vyrážkou alebo vystúpenými hrčami.
Ďalšie vedľajšie účinky
Všetky nasledujúce vedľajšie účinky sú mierne alebo stredne závažné. Ak sa ktorýkoľvek z týchto vedľajších účinkov stane závažným, ihneď to oznámte svojmu lekárovi, lekárnikovi alebo zdravotnej
sestre.
Niektoré vedľajšie účinky sú veľmi časté (môžu postihovať viac ako 1 z 10 osôb):
- infekcie horných dýchacích ciest
Niektoré vedľajšie účinky sú časté (môžu postihovať menej ako 1 z 10 osôb):
- bolesť hlavy
- bolesť kĺbov (artralgia)
- hnačka
- zápal žalúdka a čriev (gastroenteritída)
- sčervenanie v mieste podania injekcie
- žihľavka
- hubová infekcia kože, napríklad medzi prstami na nohe (napr. atletická noha)
- infekcie herpes simplex
Niektoré vedľajšie účinky sú menej časté (môžu postihovať menej ako 1 zo 100 osôb):
- bolesť v mieste podania injekcie
- alergická reakcia
- kožná vyrážka
Hlásenie vedľajších účinkov

Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej

informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
PríloheV. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať TremfyuTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na nálepke injekčnej striekačky a na vonkajšej škatuli po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte naplnenú injekčnú striekačku vo vonkajšom obale na ochranu pred svetlom. Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Netraste.
Nepoužívajte tento liek, ak spozorujete, že je liek kalný alebo zafarbený, alebo obsahuje veľké častice. Pred použitím vyberte škatuľu z chladničky a naplnenú injekčnú striekačku nechajte vo vnútri škatule
a nechajte ju dosiahnuť izbovú teplotu tým, že počkáte 30 minút.
Tento liek je len na jednorazové použitie. Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Tremfya obsahuje- Liečivo je guselkumab. Každá naplnená injekčná striekačka obsahuje 100 mg guselkumabu v 1 ml roztoku.
- Ďalšie zložky sú histidín, monohydrát histidíniumchloridu, polysorbát 80, sacharóza a voda na
injekcie.
Ako vyzerá Tremfya a obsah baleniaInjekčný roztok (injekcia). Tremfya je číry, bezfarebný až svetložltý roztok. Dodáva sa v škatuli
obsahujúcej jednu sklenenú naplnenú injekčnú striekačku na jednorazové použitie a vo viacpočetnom balení obsahujúcom 2 (2 balenia po 1) naplnené injekčné striekačky na jednorazové použitie. Na trh
nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
VýrobcaJanssen Biologics B.V. Einsteinweg 101
2333CB Leiden
Holandsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien Janssen-Cilag NV Antwerpseweg 15-17
B-2340 Beerse
Tel/Tél: +32 14 64 94 11
Lietuva
UAB "JOHNSON & JOHNSON"
Konstitucijos pr. 21C LT-08130 Vilnius
Tel: +370 5 278 68 88
България
„Джонсън & Джонсън България” ЕООД
ж.к. Младост 4
Бизнес Парк София, сграда 4
София 1766
Тел.: +359 2 489 94 00
Luxembourg/Luxemburg
Janssen-Cilag NV Antwerpseweg 15-17
B-2340 Beerse Belgique/Belgien Tél/Tel: +32 14 64 94 11
Česká republika
Janssen-Cilag s.r.o. Walterovo náměstí 329/1
CZ-158 00 Praha 5 – Jinonice
Tel.: +420 227 012 227
Magyarország
Janssen-Cilag Kft. Nagyenyed u. 8-14
H-Budapest, 1123
Tel.: +36 1 884 2858
Danmark
Janssen-Cilag A/S
Bregnerødvej 133
DK-3460 Birkerød
Tlf: +45 45 94 82 82
Malta
AM MANGION LTD.
Mangion Building, Triq Ġdida fi Triq Valletta
MT-Ħal-Luqa LQA 6000
Tel: +356 2397 6000
Deutschland
Janssen-Cilag GmbH Johnson & Johnson Platz 1
D-41470 Neuss
Tel: +49 2137 955 955
Nederland
Janssen-Cilag B.V. Graaf Engelbertlaan 75
NL-4837 DS Breda
Tel: +31 76 711 1111
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal
Lõõtsa 2
EE-11415 Tallinn
Tel: +372 617 7410
Norge
Janssen-Cilag AS
Postboks 144
NO-1325-Lysaker
Tlf: +47 24 12 65 00
Ελλάδα
Janssen-Cilag Φαρμακευτική Α.Ε.Β.Ε. Λεωφόρος Ειρήνης 56
GR-151 21 Πεύκη, Αθήνα
Tηλ: +30 210 80 90 000
Österreich
Janssen-Cilag Pharma GmbH Vorgartenstraße 206B
A-1020 Wien
Tel: +43 1 610 300
España
'
Janssen-Cilag, S.A.
Paseo de las Doce Estrellas, 5-7
E-28042 Madrid
Tel: +34 91 722 81 00
Polska
Janssen-Cilag Polska Sp. z o.o.
ul. Iłżecka 24
PL-02-135 Warszawa
Tel.: +48 22 237 60 00
France
Janssen-Cilag
1, rue Camille Desmoulins, TSA 91003
F-92787 Issy Les Moulineaux, Cedex 9
Tél: 0 800 25 50 75 / +33 1 55 00 40 03
Portugal
Janssen-Cilag Farmacêutica, Lda.
Lagoas Park, Edifício 9
PT-2740-262 Porto Salvo
Tel: +351 21 43 68 600
Hrvatska
Johnson & Johnson S.E. d.o.o. Oreškovićeva 6h
10010 Zagreb
Tel: +385 1 6610 700
România
Johnson & Johnson România SRL Str. Tipografilor nr. 11-15
Clădirea S-Park, Corp B3-B4, Etaj 3
013714 Bucureşti, ROMÂNIA Tel: +40 21 207 1800
Ireland
Janssen Sciences Ireland UC Barnahely
Ringaskiddy
IRL – Co. Cork P43 FA46
Tel: +353 1 800 709 122
Slovenija
Johnson & Johnson d.o.o. Šmartinska cesta 53
SI-1000 Ljubljana
Tel: +386 1 401 18 00
Ísland
Janssen-Cilag AB c/o Vistor hf. Hörgatúni 2
IS-210 Garðabær
Sími: +354 535 7000
Slovenská republika
Johnson & Johnson, s.r.o. CBC III, Karadžičova 12
SK-821 08 Bratislava
Tel: +421 232 408 400
Italia
Janssen-Cilag SpA
Via M.Buonarroti, 23
I-20093 Cologno Monzese MI Tel: +39 02 2510 1
Suomi/Finland
Janssen-Cilag Oy
Vaisalantie/Vaisalavägen 2
FI-02130 Espoo/Esbo
Puh/Tel: +358 207 531 300
Κύπρος
Βαρνάβας Χατζηπαναγής Λτδ
Λεωφόρος Γιάννου Κρανιδιώτη 226
Λατσιά
CY-2234 Λευκωσία
Τηλ: +357 22 207 700
Sverige
Janssen-Cilag AB
Box 4042
SE-16904 Solna
Tel: +46 8 626 50 00
Latvija
UAB "JOHNSON & JOHNSON" filiāle Latvijā
Mūkusalas iela 101
Rīga, LV-1004
Tel: +371 678 93561
United Kingdom
Janssen-Cilag Ltd.
50-100 Holmers Farm Way
High Wycombe
Buckinghamshire HP12 4EG - UK Tel: +44 1 494 567 444
Táto písomná informácia bola naposledy aktualizovaná v
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
Návod na použitie
Tremfya
Naplnená injekčná striekačka
 ZARIADENIE NA JEDNORAZOVÉ POUŽITIE
Dôležité
ZARIADENIE NA JEDNORAZOVÉ POUŽITIE
Dôležité
Ak váš lekár rozhodne, že vy alebo váš opatrovateľ budete schopní podávať injekcie Tremfye doma, musíte dostať školenie o správnom spôsobe prípravy a podania injekcie Tremfye použitím naplnenej injekčnej striekačky predtým, ako sa pokúsite podať injekciu.
Prečítajte si, prosím, tento Návod na použitie pred použitím Tremfye naplnenej injekčnej striekačky a zakaždým, keď dostanete novú striekačku. Informácie môžu byť aktualizované. Tento návod nenahrádza rozhovor s vaším lekárom o vašom zdravotnom stave alebo vašej liečbe. Prečítajte si tiež, prosím, pozorne písomnú informáciu pre používateľa predtým, ako začnete s podávaním injekcie
a s lekárom alebo zdravotnou sestrou preberte akékoľvek otázky, ktoré máte.
Tremfya naplnená injekčná striekačka je určená na injekčné podanie pod kožu, nie do svalu ani do žily. Po injekcii sa ihla stiahne do tela zariadenia a uzamkne sa na mieste.
Informácie o uchovávaníUchovávajte v chladničke pri 2 ° až 8 °C.
Neuchovávajte v mrazničke.Uchovávajte Tremfyu a všetky lieky mimo dosahu detí.Naplnenou injekčnou striekačkou nikdy
netraste.
 Injekčná striekačka na prvý pohľad
Injekčná striekačka na prvý pohľad
Pred injekciou
Piest Nikdy
nedržte ani
neťahajtepiest.
Bezpečnostný krytLem pre prstyTeloTelo injekčnej striekačky držte
pod lemom na prsty.
Zobrazovacie oknoKryt ihlyNeodstraňujte, kým nie ste pripravený na
podanie injekcie Tremfye (pozri Krok 2).
Po injekcii
Piest sa uzamkne
Bezpečnostný kryt sa
aktivuje
Ihla sa stiahne do

tela
Budete potrebovať tieto pomôcky:• 1 alkoholový tampón • 1 vatový tampón
• 1 vatový tampón alebo
gázový vankúšik• 1 náplasť• 1 kontajner na ostré predmety (pozri Krok 3)
1
. Pripravte sa na injekciu
30
MIN
Skontrolujte škatuľu
Vyberte škatuľu s naplnenou injekčnou striekačkou z chladničky. Nechajte naplnenú injekčnú striekačku v škatuli a nechajte ju
postáť na rovnom povrchu pri izbovej teplote
najmenej 30 minút pred použitím.
Nezohrievajte iným spôsobom.
Skontrolujte dátum exspirácie („EXP“) na zadnej strane škatule.
Nepoužívajte, ak už uplynul dátum exspirácie.
Nepodávajte injekciu, ak sú perforácie na škatuli porušené. Požiadajte svojho lekára alebo lekárnika o novú injekčnú striekačku.
Vyberte miesto podania injekcieVyberte si z nasledujúcich miest na podanie injekcie:
·
Predná strana stehien (odporúčané)
· Dolná časť brucha
Nepoužívajte 5-centimetrovú oblasť okolo svojho pupka.
· Zadná strana nadlaktí (ak vám injekciu podáva opatrovateľ)
Nepodávajte injekciu do kože, ktorá je citlivá, pomliaždená, červená, šupinatá alebo stvrdnutá.
Nepodávajte injekciu do oblastí s jazvami alebo striami.
 Vyčistite miesto podania injekcie
Vyčistite miesto podania injekcie
Dôkladne si umyte ruky mydlom a teplou vodou. Očistite vybrané miesto pre podanie injekcie
alkoholovým tampónom a nechajte ho vyschnúť.
Po vyčistení miesta podania injekcie sa ho
nedotýkajte, neovievajte ho ani naň
nefúkajte.
 Skontrolujte tekutinu
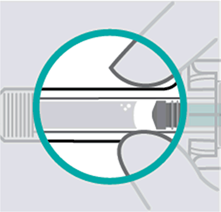
Skontrolujte tekutinuVyberte naplnenú injekčnú striekačku zo škatule. Skontrolujte tekutinu v zobrazovacom okne.
Má byť číra až svetložltá a môže obsahovať
malé biele alebo priesvitné častice. Môžete tiež vidieť jednu alebo viaceré vzduchové bubliny. Je to normálne.
Nepodávajte injekciu, ak je tekutina kalná alebo zafarbená alebo obsahuje veľké častice. Ak si nie ste istý, požiadajte svojho lekára alebo lekárnika o náhradu.
2. Podajte injekčne Tremfyu použitím naplnenej injekčnej striekačky
 Odstráňte kryt ihly
Odstráňte kryt ihly
Držte injekčnú striekačku za telo a kryt ihly rovno stiahnite. Je normálne, ak vidíte kvapku tekutiny.
Je dôležité podať injekciu do 5 minút od odstránenia krytu ihly.Kryt ihly
nenasadzujte naspäť, mohlo by to poškodiť ihlu.
Nedotýkajte sa ihly ani nedovoľte, aby sa dotkla akéhokoľvek povrchu.
Nepoužívajte Tremfyu naplnenú injekčnú striekačku, ak spadla. Požiadajte svojho lekára alebo lekárnika o náhradu.
Umiestnite prsty a zaveďte ihluUmiestnite palec, ukazovák a prostredník
rovno pod lem pre prsty, ako je zobrazené.
Nedotýkajte sa piestu ani oblasti nad lemom pre prsty,
pretože to môže spôsobiť aktiváciu bezpečnostného zariadenia.
Druhú ruku použite na stlačenie kože v mieste podania injekcie. Umiestnite injekčnú striekačku ku koži približne v 45 stupňovom uhle.
Je dôležité stlačiť dostatok kože, aby bola
injekcia podaná pod kožu a nie do svalu. Zaveďte ihlu rýchlym pohybom, podobným vrhaniu šípky.
 Uvoľnite stlačenie a presuňte ruku
Uvoľnite stlačenie a presuňte ruku
Použite voľnú ruku na uchopenie tela injekčnej striekačky.
Stlačte piestUmiestnite palec druhej ruky na piest a piest stlačte rovno dolu, kým sa nezastaví.
Uvoľnite tlak z piestuBezpečnostný kryt pokryje ihlu a uzamkne ju na mieste, keď vytiahnete ihlu z kože.
3. Po injekcii
Vyhoďte použitú injekčnú striekačku
Hneď po použití vložte použitú injekčnú striekačku do kontajnera na ostré predmety.
Uistite sa, že tento kontajner po jeho naplnení zlikvidujete v súlade s pokynmi svojho lekárnika.
Skontrolujte miesto podania injekcieV mieste podania injekcie sa môže nachádzať malé množstvo krvi alebo tekutiny. Pritlačte na kožu vatový tampón alebo gázový vankúšik, kým sa krvácanie nezastaví.
Nešúchajte miesto podania injekcie.
Ak je to potrebné, miesto podania injekcie prekryte náplasťou. Podanie injekcie je ukončené!
 Potrebujete pomoc?
Potrebujete pomoc?Zavolajte svojmu lekárovi a položte mu všetky otázky, ktoré máte. V prípade potreby ďalšej pomoci
alebo nahlásenia vašich skúseností si prečítajte kontaktné informácie miestneho zástupcu v písomnej informácii pre používateľa.
Písomná informácia pre používateľa
Tremfya 100 mg injekčný roztok v naplnenom injekčnom pere
guselkumab
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Tento liek bol predpísaný iba vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Tremfya a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Tremfyu
3. Ako používať Tremfyu
4. Možné vedľajšie účinky
5. Ako uchovávať Tremfyu
6. Obsah balenia a ďalšie informácie
1. Čo je Tremfya a na čo sa používaTremfya obsahuje liečivo guselkumab, typ proteínu nazývaný monoklonálna protilátka.
Tento liek blokuje činnosť proteínu nazývaného IL-23, ktorý je prítomný vo zvýšených hladinách u ľudí so psoriázou.
Tremfya sa používa na liečbu dospelých so stredne závažnou až závažnou „ložiskovou psoriázou“, zápalovým stavom postihujúcim kožu a nechty.
Tremfya môže zlepšiť stav kože a vzhľad nechtov a zmierniť príznaky, ako šupinatenie, opadávanie, odlupovanie, svrbenie, bolesť a pálenie.
2. Čo potrebujete vedieť predtým, ako použijete TremfyuNepoužívajte Tremfyu· ak ste alergický na guselkumab alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6). Ak si myslíte, že môžete byť alergický, poraďte sa so svojím lekárom predtým, ako
použijete Tremfyu
· ak máte aktívnu infekciu, vrátane aktívnej tuberkulózy
Upozornenia a opatreniaPredtým, ako začnete používať Tremfyu, obráťte sa na svojho lekára, lekárnika alebo zdravotnú
sestru:
· ak sa liečite z infekcie
· ak máte infekciu, ktorá pretrváva alebo sa opätovne vracia
· ak máte tuberkulózu alebo ste boli v úzkom kontakte s niekým s tuberkulózou
· ak si myslíte, že máte infekciu alebo máte príznaky infekcie (pozri nižšie pod „Dávajte si pozor na infekcie a alergické reakcie”)
· ak ste boli nedávno očkovaný alebo máte byť očkovaný počas liečby Tremfyou.
Ak si nie ste istý, či sa vás týka niečo z vyššie uvedeného, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru predtým, ako začnete používať Tremfyu.
Dávajte si pozor na infekcie a alergické reakcie
Tremfya môže potenciálne spôsobiť vážne vedľajšie účinky vrátane alergických reakcií a infekcií.
Počas používania Tremfye si musíte všímať prejavy týchto stavov. Prestaňte používať Tremfyu a okamžite informujte svojho lekára alebo vyhľadajte lekársku pomoc, ak spozorujete akékoľvek
prejavy svedčiace o možnej vážnej alergickej reakcii alebo infekcii.
Prejavy infekcií môžu zahŕňať horúčku alebo príznaky podobné chrípke; svalové bolesti, kašeľ; dýchavičnosť; pálenie pri močení alebo nutnosť močiť častejšie než obvykle; krv v hliene (slize); úbytok telesnej hmotnosti; hnačku alebo bolesť žalúdka; teplú, červenú alebo bolestivú pokožku alebo vriedky na tele, ktoré sa líšia od psoriázy.
Pri používaní Tremfye sa vyskytli vážne alergické reakcie, ktoré môžu zahŕňať príznaky žihľavky a dýchavičnosť (pozri „Vážne vedľajšie účinky“ v časti 4).
Deti a dospievajúci
Tremfya sa neodporúča deťom a dospievajúcim mladším ako 18 rokov, pretože nebola skúšaná v tejto vekovej skupine.
Iné lieky a Tremfya
Povedzte svojmu lekárovi alebo lekárnikovi:
· ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky.
· ak ste boli nedávno očkovaný alebo máte byť očkovaný. Nesmiete dostať istý druh vakcín (živé vakcíny), kým používate Tremfyu.
Tehotenstvo a dojčenie
· Tremfya sa nemá používať počas gravidity, pretože účinky tohto lieku na tehotnú ženu nie sú známe. Ak ste žena v plodnom veku, odporúča sa, aby ste sa vyhli otehotneniu a musíte
používať primeranú antikoncepciu, kým používate Tremfyu a minimálne 12 týždňov po
poslednej dávke Tremfye. Ak ste tehotná, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom.
· Ak dojčíte, alebo ak plánujete dojčiť, poraďte sa so svojím lekárom. Spolu so svojím lekárom sa rozhodnete, či budete dojčiť alebo používať Tremfyu.
Vedenie vozidiel a obsluha strojov
Je nepravdepodobné, že Tremfya ovplyvní vašu schopnosť viesť vozidlá a obsluhovať stroje.
3. Ako používať Tremfyu
Vždy používajte tento liek presne tak, ako vám povedal váš lekár alebo zdravotná sestra. Ak si nie ste niečím istý, overte si to u svojho lekára, zdravotnej sestry alebo lekárnika.
Koľko Tremfye sa podáva a ako dlho
Váš lekár rozhodne, ako dlho potrebujete používať Tremfyu.
· Dávka je 100 mg (obsah 1 naplneného injekčného pera), ktoré sa podávajú injekciou pod kožu
(subkutánna injekcia). Môže byť podaná vaším lekárom alebo zdravotnou sestrou.
· Po prvej dávke dostanete ďalšiu dávku o 4 týždne neskôr, a potom každých 8 týždňov.
Na začiatku bude podávať injekčne Tremfyu váš lekár alebo zdravotná sestra. Môžete sa však spolu so svojím lekárom rozhodnúť, že si budete Tremfyu podávať sám. V tomto prípade dostanete príslušné školenie ako si podať injekčne Tremfyu. Obráťte sa na svojho lekára alebo zdravotnú sestru, ak máte akékoľvek otázky o podaní injekcie sebe samému. Je dôležité, aby ste sa nepokúšali podať si injekciu, kým nedostanete školenie od svojho lekára alebo zdravotnej sestry.
Podrobné informácie o tom, ako používať Tremfyu, si pred použitím pozorne prečítajte v „Návode na použitie“, ktorý je ako príloha v škatuli.
Ak použijete viac Tremfye, ako máte
Ak ste dostali viac Tremfye, ako ste mali, alebo bola dávka podaná skôr, ako bolo predpísané, oznámte to svojmu lekárovi.
Ak zabudnete použiť Tremfyu
Ak zabudnete na injekčné podanie dávky Tremfye, oznámte to svojmu lekárovi.
Ak prestanete používať Tremfyu
Nesmiete prestať používať Tremfyu, ak sa o tom najskôr neporozprávate so svojím lekárom. Ak
ukončíte liečbu, príznaky psoriázy sa môžu vrátiť späť.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Vážne vedľajšie účinky
Okamžite informujte svojho lekára alebo vyhľadajte lekársku pomoc, ak spozorujete niektorý
z nasledujúcich vedľajších účinkov:
Možná vážna alergická reakcia – prejavy môžu zahŕňať:
- ťažkosti s dýchaním alebo prehĺtaním
- opuch tváre, pier, jazyka alebo hrdla
- vážne svrbenie kože s červenou vyrážkou alebo vystúpenými hrčami.
Ďalšie vedľajšie účinky
Všetky nasledujúce vedľajšie účinky sú mierne alebo stredne závažné. Ak sa ktorýkoľvek z týchto vedľajších účinkov stane závažným, ihneď to oznámte svojmu lekárovi, lekárnikovi alebo zdravotnej
sestre.
Niektoré vedľajšie účinky sú veľmi časté (môžu postihovať viac ako 1 z 10 osôb):
- infekcie horných dýchacích ciest
Niektoré vedľajšie účinky sú časté (môžu postihovať menej ako 1 z 10 osôb):
- bolesť hlavy
- bolesť kĺbov (artralgia)
- hnačka
- zápal žalúdka a čriev (gastroenteritída)
- sčervenanie v mieste podania injekcie
- žihľavka
- hubová infekcia kože, napríklad medzi prstami na nohe (napr. atletická noha)
- infekcie herpes simplex
Niektoré vedľajšie účinky sú menej časté (môžu postihovať menej ako 1 zo 100 osôb):
- bolesť v mieste podania injekcie
- alergická reakcia
- kožná vyrážka
Hlásenie vedľajších účinkov

Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej

informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
PríloheV. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať TremfyuTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na nálepke naplneného injekčného pera a na vonkajšej škatuli po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte naplnené injekčné pero vo vonkajšom obale na ochranu pred svetlom. Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Netraste.
Nepoužívajte tento liek, ak spozorujete, že je liek kalný alebo zafarbený, alebo obsahuje veľké častice. Pred použitím vyberte škatuľu z chladničky a naplnené injekčné pero nechajte vo vnútri škatule
a nechajte ho dosiahnuť izbovú teplotu tým, že počkáte 30 minút.
Tento liek je len na jednorazové použitie. Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Tremfya obsahuje- Liečivo je guselkumab. Každé naplnené injekčné pero obsahuje 100 mg guselkumabu v 1 ml
roztoku.
- Ďalšie zložky sú histidín, monohydrát histidíniumchloridu, polysorbát 80, sacharóza a voda na injekcie.
Ako vyzerá Tremfya a obsah baleniaInjekčný roztok (injekcia). Tremfya je číry, bezfarebný až svetložltý roztok. Dodáva sa v škatuli
obsahujúcej jedno naplnené injekčné pero na jednorazové použitie a vo viacpočetnom balení obsahujúcom 2 (2 balenia po 1) naplnené injekčné perá na jednorazové použitie. Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
VýrobcaJanssen Biologics B.V.
Einsteinweg 101
2333CB Leiden
Holandsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
Janssen-Cilag NV
Antwerpseweg 15-17
B-2340 Beerse
Tel/Tél: +32 14 64 94 11
Lietuva
UAB "JOHNSON & JOHNSON"
Konstitucijos pr. 21C LT-08130 Vilnius
Tel: +370 5 278 68 88
България
„Джонсън & Джонсън България” ЕООД
ж.к. Младост 4
Бизнес Парк София, сграда 4
София 1766
Тел.: +359 2 489 94 00
Luxembourg/Luxemburg
Janssen-Cilag NV Antwerpseweg 15-17
B-2340 Beerse
Belgique/Belgien
Tél/Tel: +32 14 64 94 11
Česká republika
Janssen-Cilag s.r.o.
Walterovo náměstí 329/1
CZ-158 00 Praha 5 – Jinonice
Tel.: +420 227 012 227
Magyarország
Janssen-Cilag Kft.
Nagyenyed u. 8-14
H-Budapest, 1123
Tel.: +36 1 884 2858
Danmark
Janssen-Cilag A/S
Bregnerødvej 133
DK-3460 Birkerød
Tlf: +45 45 94 82 82
Malta
AM MANGION LTD.
Mangion Building, Triq Ġdida fi Triq Valletta
MT-Ħal-Luqa LQA 6000
Tel: +356 2397 6000
Deutschland
Janssen-Cilag GmbH
Johnson & Johnson Platz 1
D-41470 Neuss
Tel: +49 2137 955 955
Nederland
Janssen-Cilag B.V.
Graaf Engelbertlaan 75
NL-4837 DS Breda
Tel: +31 76 711 1111
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal
Lõõtsa 2
EE-11415 Tallinn
Tel: +372 617 7410
Norge
Janssen-Cilag AS Postboks 144
NO-1325-Lysaker
Tlf: +47 24 12 65 00
Ελλάδα
Janssen-Cilag Φαρμακευτική Α.Ε.Β.Ε.
Λεωφόρος Ειρήνης 56
GR-151 21 Πεύκη, Αθήνα
Tηλ: +30 210 80 90 000
Österreich
Janssen-Cilag Pharma GmbH
Vorgartenstraße 206B A-1020 Wien
Tel: +43 1 610 300
España
Janssen-Cilag, S.A.
Paseo de las Doce Estrellas, 5-7
E-28042 Madrid
Tel: +34 91 722 81 00
Polska
Janssen-Cilag Polska Sp. z o.o. ul. Iłżecka 24
PL-02-135 Warszawa
Tel.: +48 22 237 60 00
France
Janssen-Cilag
1, rue Camille Desmoulins, TSA 91003
F-92787 Issy Les Moulineaux, Cedex 9
Tél: 0 800 25 50 75 / +33 1 55 00 40 03
Portugal
Janssen-Cilag Farmacêutica, Lda. Lagoas Park, Edifício 9
PT-2740-262 Porto Salvo
Tel: +351 21 43 68 600
Hrvatska
Johnson & Johnson S.E. d.o.o.
Oreškovićeva 6h
10010 Zagreb
Tel: +385 1 6610 700
România
Johnson & Johnson România SRL
Str. Tipografilor nr. 11-15
Clădirea S-Park, Corp B3-B4, Etaj 3
013714 Bucureşti, ROMÂNIA Tel: +40 21 207 1800
Ireland
Janssen Sciences Ireland UC
Barnahely
Ringaskiddy
IRL – Co. Cork P43 FA46
Tel: +353 1 800 709 122
Slovenija
Johnson & Johnson d.o.o.
Šmartinska cesta 53
SI-1000 Ljubljana
Tel: +386 1 401 18 00
Ísland
Janssen-Cilag AB
c/o Vistor hf. Hörgatúni 2
IS-210 Garðabær
Sími: +354 535 7000
Slovenská republika
Johnson & Johnson, s.r.o.
CBC III, Karadžičova 12
SK-821 08 Bratislava
Tel: +421 232 408 400
Italia
Janssen-Cilag SpA
Via M.Buonarroti, 23
I-20093 Cologno Monzese MI Tel: +39 02 2510 1
Suomi/Finland
Janssen-Cilag Oy
Vaisalantie/Vaisalavägen 2
FI-02130 Espoo/Esbo
Puh/Tel: +358 207 531 300
Κύπρος
Βαρνάβας Χατζηπαναγής Λτδ
Λεωφόρος Γιάννου Κρανιδιώτη 226
Λατσιά
CY-2234 Λευκωσία
Τηλ: +357 22 207 700
Sverige
Janssen-Cilag AB
Box 4042
SE-16904 Solna
Tel: +46 8 626 50 00
Latvija
UAB "JOHNSON & JOHNSON" filiāle Latvijā
Mūkusalas iela 101
Rīga, LV-1004
Tel: +371 678 93561
United Kingdom
Janssen-Cilag Ltd.
50-100 Holmers Farm Way
High Wycombe
Buckinghamshire HP12 4EG - UK Tel: +44 1 494 567 444
Táto písomná informácia bola naposledy aktualizovaná v
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
Návod na použitie
Tremfya
Naplnené injekčné pero

Dôležité
ZARIADENIE NA JEDNORAZOVÉ POUŽITIE
Ak váš lekár rozhodne, že vy alebo váš opatrovateľ budete schopní podávať injekcie Tremfye doma, musíte dostať školenie o správnom spôsobe prípravy a podania injekcie Tremfye použitím naplneného
injekčného pera.
Prečítajte si, prosím, tento Návod na použitie pred použitím Tremfye naplneného injekčného pera a zakaždým, keď dostanete nové naplnené injekčné pero. Informácie môžu byť aktualizované. Tento návod nenahrádza rozhovor s vaším lekárom o vašom zdravotnom stave alebo vašej liečbe.
Prečítajte si tiež, prosím, pozorne písomnú informáciu pre používateľa predtým, ako začnete
s podávaním injekcie a s lekárom alebo zdravotnou sestrou preberte akékoľvek otázky, ktoré máte.
Informácie o uchovávaníUchovávajte v chladničke pri 2 ° až 8 °C.
Neuchovávajte v mrazničke.Uchovávajte Tremfyu a všetky lieky mimo dosahu detí.Naplneným injekčným perom nikdy
netraste.
 Potrebujete pomoc?
Potrebujete pomoc?Zavolajte svojmu lekárovi a položte mu všetky otázky, ktoré máte. V prípade potreby ďalšej pomoci
alebo nahlásenia vašich skúseností si prečítajte kontaktné informácie miestneho zástupcu v písomnej informácii pre používateľa.
 Naplnené injekčné pero na prvý pohľad
Rukoväť
Naplnené injekčné pero na prvý pohľad
Rukoväť
 Zelené telo
Okienko
Chránič ihly
Spodný kryt
Budet
e potrebovať tieto pomôcky:
• 1 alkoholový tampón
• 1 vatový tampón
Zelené telo
Okienko
Chránič ihly
Spodný kryt
Budet
e potrebovať tieto pomôcky:
• 1 alkoholový tampón
• 1 vatový tampón alebo
gázový vankúšik• 1 náplasť• 1 kontajner na ostré predmety (pozri Krok 3)
1
. Pripravte sa na injekciu
 MIN
Skontrolujte škatuľu
MIN
Skontrolujte škatuľu
Vyberte škatuľu s naplneným injekčným perom z chladničky.
Nechajte naplnené injekčné pero v škatuli a nechajte ho postáť na rovnom povrchu pri izbovej teplote
najmenej 30 minút pred použitím.
Nezohrievajte iným spôsobom.
Skontrolujte dátum exspirácie („EXP“) na škatuli.
Nepoužívajte, ak už uplynul dátum exspirácie.
Nepodávajte injekciu, ak sú perforácie na škatuli porušené.
Požiadajte svojho lekára alebo lekárnika o nové naplnené injekčné pero.
Vyberte miesto podania injekcieVyberte si z nasledujúcich miest na podanie injekcie:
·
Predná strana stehien (odporúčané)
· Dolná časť brucha
Nepoužívajte 5-centimetrovú oblasť okolo svojho pupka.
· Zadná strana nadlaktí (ak vám injekciu podáva opatrovateľ)
Nepodávajte injekciu do kože, ktorá je citlivá, pomliaždená, červená, šupinatá, stvrdnutá alebo na ktorej sú jazvy či strie.
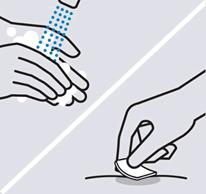 Umyte si ruky
Umyte si ruky
Dôkladne si umyte ruky mydlom a teplou vodou.
Vyčistite miesto podania injekcieOčistite vybrané miesto pre podanie injekcie alkoholovým tampónom a nechajte ho vyschnúť. Po vyčistení miesta podania injekcie sa ho
nedotýkajte, neovievajte ho ani naň
nefúkajte.
Skontrolujte tekutinu v okienkuVyberte naplnené injekčné pero zo škatule. Skontrolujte tekutinu v okienku.
Má byť číra až svetložltá a môže obsahovať malé biele alebo priesvitné častice. Môžete tiež vidieť
jednu alebo viaceré vzduchové bubliny. Je to normálne.
Nepodávajte injekciu, ak je tekutina kalná alebo zafarbená alebo obsahuje veľké častice. Ak si nie ste istý, požiadajte svojho lekára alebo lekárnika o nové naplnené injekčné pero.
2. Podajte injekčne Tremfyu použitím naplneného injekčného pera
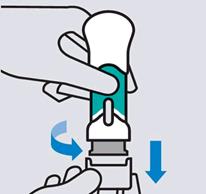 Pootočte a vytiahnite spodný kryt
Pootočte a vytiahnite spodný kryt
Po odstránení krytu majte ruky mimo chrániča ihly.
Je dôležité podať injekciu do 5 minút od odstránenia krytu.Kryt
nenasadzujte naspäť, mohlo by to poškodiť ihlu.
Nepoužívajte naplnené injekčné pero, ak spadne po odstránení krytu. Požiadajte svojho lekára alebo lekárnika o nové naplnené injekčné pero.
90°Priložte na kožuUmiestnite naplnené injekčné pero priamo na kožu (približne 90 stupňov k miestu vpichu).
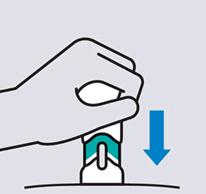 Zatlačte rukoväť priamo nadol
Zatlačte rukoväť priamo nadol
Liečivo sa vstrekuje, keď potlačíte. Robte to rýchlosťou, ktorá je pre vás prijateľná.
Počas vstrekovania
nevyťahujte naplnené injekčné pero. Chránič ihly sa uzamkne a nebude podaná celá dávka.
clickDokončite vstrekovanieVstrekovanie je ukončené, keď je rukoväť zatlačená úplne nadol, počujete kliknutie a zelené telo už nie je viditeľné.
Zodvihnite priamo nahorŽltý pásik znamená, že chránič ihly je uzamknutý.
3. Po injekcii
 Vyhoďte použité injekčné pero
Vyhoďte použité injekčné pero
Hneď po použití vložte použité injekčné pero do kontajnera na ostré predmety.
Uistite sa, že tento kontajner po jeho naplnení zlikvidujete v súlade s pokynmi svojho lekárnika.
Skontrolujte miesto podania injekcieV mieste podania injekcie sa môže nachádzať malé množstvo krvi alebo tekutiny. Pritlačte na kožu vatový tampón alebo gázový vankúšik, kým sa krvácanie nezastaví.
Nešúchajte miesto podania injekcie.
Ak je to potrebné, miesto podania injekcie prekryte náplasťou. Podanie injekcie je ukončené!