
u>
Nádor sa musí pred liečbou správne lokalizovať a potvrdiť ako unilaterálny pomocou biopsie
s vysokým rozlíšením podľa súčasných najlepších postupov, ako sú multiparametrické stratégie
založené na MRI alebo templátová biopsia (template-based biopsy procedures).
Simultánna liečba oboch lalokov prostaty bola v klinických skúšaniach spojená s horšími výsledkami, a preto sa nesmie vykonávať.
Opakovanú liečbu ipsilaterálneho laloka alebo sekvenčnú liečbu kontralaterálneho laloka podstúpil
nedostatočný počet pacientov na to, aby sa stanovila účinnosť a bezpečnosť druhého zákroku
TOOKAD-VTP.
Sledovanie po zákroku TOOKAD-VTP
Existuje len obmedzené množstvo údajov z biopsie po viac ako 2 rokoch od ukončenia liečby liekom
TOOKAD, preto sa dlhodobá účinnosť nestanovila. Počas sledovania po liečbe sa v 12. a 24. mesiaci biopsiou liečeného laloka zistil reziduálny nádor, zvyčajne mimo rozsahu liečeného objemu, ale niekedy v rámci oblasti nekrózy.
O dlhodobých výsledkoch a potenciálnych následkoch lokálneho zjazvenia po liečbe liekom
TOOKAD v prípade progresie ochorenia existujú len obmedzené údaje.
V súčasnosti sa ukazuje, že liečba TOOKAD-VTP odďaľuje potrebu radikálnej liečby a s ňou súvisiacu toxicitu. Na stanovenie toho, či bude mať TOOKAD-VTP u určitého podielu pacientov liečivý účinok, sa bude vyžadovať dlhodobejšie sledovanie.
Po liečbe TOOKAD-VTP majú pacienti absolvovať digitálne rektálne vyšetrenie (digital rectal examination, DRE) a treba u nich monitorovať PSA v sére vrátane posúdenia dynamiky PSA (čas potrebný na zdvojnásobenie PSA a velocita PSA). Na vyhodnotenie dynamiky PSA (času potrebného na zdvojnásobenie PSA, velocity PSA) sa testy na PSA majú počas prvých 2 rokov po VTP vykonávať každé 3 mesiace a po uplynutí tohto obdobia každých 6 mesiacov. Digitálne rektálne vyšetrenie (DRE) sa odporúča vykonávať najmenej raz ročne a v klinicky odôvodnených prípadoch aj častejšie. Rutinnú biopsiu sa po VTP odporúča vykonať po 2 – 4 rokoch a po 7 rokoch, pričom v závislosti od klinického hodnotenia/hodnotenia PSA sa môžu vykonať aj ďalšie biopsie. Na zlepšenie rozhodovacieho procesu sa môže použiť multiparametrická MRI, v súčasnosti však nie ako náhrada biopsie. V prípade pozitívnych biopsií sa má pacientom, ktorí prekročia prahovú hodnotu nízkeho rizika ochorenia (t. j. majú hodnotu GS > 6; > 3 pozitívne jadrá alebo dĺžku ktoréhokoľvek jadra > 5 mm), odporučiť radikálna liečba.
RadikálnaliečbapozákrokuVTP
Bezpečnosť a účinnosť následnej radikálnej liečby (chirurgického zákroku alebo rádioterapie)
je neistá. K dispozícii sú len obmedzené údaje o bezpečnosti a účinnosti radikálnej prostatektómie
po zákroku TOOKAD-VTP. V malých sériách chirurgických zákrokov boli hlásené nádory T3, pozitívne okraje a impotencia. V priebehu 24 mesiacov trvania pivotnej európskej štúdie fázy III nepodstúpil žiaden pacient radikálnu rádioterapiu po zákroku TOOKAD-VTP.
Fotosenzitivita
Existuje riziko, že po vystavení očí a pokožky svetlu po zákroku TOOKAD-VTP dôjde k fotosenzitivite.
Na zníženie rizika poškodenia pokožky a očí je preto dôležité, aby všetci pacienti počas 48 hodín
po zákroku dodržiavali nižšie uvedené bezpečnostné opatrenia týkajúce sa svetla.
Počas 48 hodín po zákroku VTP sa majú pacienti vyhýbať expozícii priamemu slnečnému žiareniu (vrátane toho, ktoré prechádza cez okno) a všetkým zdrojom jasného svetla, či už vonku alebo vnútri. Medzi ne patria soláriá, jasné obrazovky počítačových monitorov a svetlá používané lekárom
na vyšetrenie, napríklad oftalmoskopy, otoskopy a endoskopické vybavenie.
Opaľovacie krémy nechránia pred blízkym infračerveným svetlom, a preto neposkytujú adekvátnu
ochranu.
Ak pacient počas hospitalizácie pociťuje kožný alebo očný diskomfort, stlmte osvetlenie a venujte
zvýšenú pozornosť tomu, aby bol pacient chránený pred umelým aj prirodzeným svetlom.
Prvých 12 hodín po zákroku VTP
Pacient má najmenej 6 hodín nosiť ochranné okuliare a byť pod lekárskym dohľadom v miestnosti
s tlmeným svetlom.
Podľa uváženia lekára možno pacienta prepustiť v ten istý deň večer.
Pacient musí zostať v prostredí s tlmeným svetlom, pričom pokožka a oči sa nesmú priamo vystaviť dennému svetlu. Pacient smie používať len žiarovky s maximálnym výkonom 60 wattov alebo ekvivalentným výkonom (t. j. 6 wattov v prípade LED-žiariviek, 12 wattov v prípade úsporných fluorescenčných žiariviek).
Pacient môže sledovať televíziu zo vzdialenosti 2 metrov a po 6 hodinách od zákroku môže používať elektronické zariadenia, ako sú smartfóny, tablety a počítače. Ak musí pacient za denného svetla vyjsť von, má si obliecť ochranný odev a okuliare s vysokou ochranou, aby mu chránili pokožku a oči.
12 až 48 hodín po zákroku VTP
Pacient môže za denného svetla vyjsť von, ale len na zatienené miesta alebo len ak je zamračené. Má si obliecť tmavé oblečenie a dbať na ochranu rúk a tváre pred slnkom.
Po 48 hodinách od zákroku pacient toleruje priame slnečné svetlo a môže vrátiť k bežným činnostiam.
V rámci klinických štúdií sa liek TOOKAD nepodal žiadnemu pacientovi s fotosenzitívnou dermatitídou, ochoreniami kože, ako je porfýria, alebo s citlivosťou na slnečné žiarenie v anamnéze. V dôsledku krátkeho trvania účinku lieku TOOKAD sa však očakáva, že riziko zvýšenej fototoxicity bude nízke za predpokladu, že títo pacienti budú striktne dodržiavať opatrenia týkajúce sa ochrany pred svetlom.
Riziko fotosenzitivity očí môže hroziť aj u pacientov, ktorí absolvovali vnútroočnú liečbu anti-VEGF. Pacienti, ktorí v minulosti podstúpili liečbu VEGF, majú počas 48 hodín po injekčnom podaní lieku TOOKAD venovať osobitnú pozornosť ochrane očí pred svetlom. Súbežné podanie systémových inhibítorov VEGF a lieku TOOKAD sa neodporúča.
Interakcie s fotosenzibilizujúcimi liekmi, pozri časť 4.5.
Erektilná dysfunkcia
Erektilná dysfunkcia sa môže vyskytnúť aj vtedy, ak sa radikálna prostatektómia nevykoná. Určitý stupeň erektilnej dysfunkcie sa môže objaviť krátko po zákroku a môže trvať viac ako 6 mesiacov (pozri časť 4.8).
Extraprostatická nekróza
V periprostatickom tuku sa môže vyskytnúť extraprostatická nekróza, ktorá nie je sprevádzaná klinickými príznakmi.
K výskytu nadmernej extraprostatickej nekrózy došlo následkom nesprávnej kalibrácie lasera alebo nesprávneho umiestnenia svetelných vlákien (pozri časť 4.8). V dôsledku toho existuje potenciálne riziko poškodenia priľahlých štruktúr, napríklad močového mechúra a/alebo konečníka, a rozvoja rektouretrálnej alebo vonkajšej fistuly. V jednom prípade sa vyskytla jedna močová fistula z dôvodu nesprávneho umiestnenia vlákna.
Musí sa vykonať dôkladná kalibrácia vybavenia a musí sa použiť softvér na navádzanie liečby
s cieľom znížiť riziko klinicky významnej extraprostatickej nekrózy.
Retenciamoču/zúženiemočovej rúry
U pacientov, ktorí majú v anamnéze zúženie močovej rúry alebo ťažkosti s prietokom moču, môže byť
po zákroku TOOKAD-VTP vyššie riziko slabého prietoku a retencie moču. Retencia moču ihneď
po zákroku bola pripisovaná prechodnému edému prostaty a spravidla si vyžadovala len krátkodobú rekatetrizáciu.
Niekoľko mesiacov po zákroku sa v dôsledku zúženia močovej rúry objavil slabý prietok moču.
V niektorých prípadoch bulbárna poloha naznačila, že k stenóze mohlo dôjsť v dôsledku katetrizácie močových ciest. V iných prípadoch mohla byť stenóza močovej rúry oneskoreným dôsledkom nekrózy vyvolanej zákrokom TOOKAD-VTP.
Hoci boli pacienti s existujúcou stenózou vylúčení z klinických skúšaní, existuje u nich riziko
zhoršenia stenózy po zákroku TOOKAD-VTP (pozri časť 4.8).
Inkontinenciamoču
Riziko poškodenia zvierača možno minimalizovať dôkladným naplánovaním umiestnenia vlákna pomocou softvéru na navádzanie liečby. Závažná dlhodobá inkontinencia moču sa pozorovala
u pacienta, ktorý už absolvoval transuretrálnu prostatektómiu (TURP). Táto udalosť sa nepovažovala za udalosť súvisiacu s nesprávnym vykonaním zákroku, ale skôr za dôsledok poškodenia vnútorného zvierača močovej rúry zákrokom TURP. Zákrok TOOKAD-VTP je kontraindikovaný u pacientov,
ktorí už absolvovali akékoľvek zákroky na prostate, pri ktorých mohlo dôjsť k poškodeniu vnútorného zvierača močovej rúry, vrátane transuretrálnej resekcie prostaty (TURP) z dôvodu benígnej hypertrofie
prostaty (pozri časť 4.3).
Zápalovéochoreniečriev
U pacientov, ktorí majú v anamnéze aktívne zápalové ochorenie čriev postihujúce konečník alebo
akýkoľvek stav, ktorý by mohol zvýšiť riziko vzniku rektouretrálnej fistuly, sa má zákrok TOOKAD-
VTP vykonať až po dôkladnom klinickom posúdení (pozri časť 4.3).
Použitie u pacientov so zrážaním krvi mimo normy
U pacientov zrážaním krvi mimo normy môže dôjsť k nadmernému krvácaniu v dôsledku zavedenia
ihiel potrebných na umiestnenie svetelných vlákien, čo môže spôsobiť aj tvorbu podliatín, hematúriu a/alebo lokálnu bolesť. Nepredpokladá sa, že by oneskorenie zrážania krvi znížilo účinnosť liečby
TOOKAD-VTP. Pred zákrokom VTP a v období bezprostredne po ňom sa však odporúča vysadiť
lieky, ktoré ovplyvňujú zrážanie krvi (pozri časť 4.5).
Použitie u pacientov na diéte s kontrolovaným obsahom draslíka
Tento liek obsahuje draslík a dávka (3,66 mg/kg) bude spravidla obsahovať menej ako 1 mmol
(39 mg) draslíka, t. j. v podstate zanedbateľné množstvo draslíka. U pacientov s hmotnosťou vyššou ako 115 kg bude však táto dávka prekročená. Má sa to vziať do úvahy u pacientov so zníženou
funkciou obličiek alebo u pacientov na diéte s kontrolovaným obsahom draslíka, u ktorých by sa
zvýšenie hladiny draslíka v sére mohlo považovať za škodlivé (pozri časť 4.2).
4.5 Liekové a iné interakcie
Transportéry OATP1B1 a OATP1B3
Na základe štúdií in vitro sa predpokladá, že liek TOOKAD v terapeutických koncentráciách pravdepodobne neinhibuje enzýmy cytochrómu P450, ale mohol by inhibovať prenášače OATP1B1
a OATP1B3 (pozri časť 5.2).
Význam interakcie sa klinicky neskúmal, ale nemožno vylúčiť prechodné zvýšenie plazmatickej koncentrácie súbežne podávaných substrátov OATP1B1 a OATP1B3. V deň podania infúzie TOOKAD a najmenej 24 hodín po nej sa však treba vyhnúť použitiu liekov, ktoré sú substrátmi OATP1B1 alebo OATP1B3 (repaglinid, atorvastatín, pitavastatín, pravastatín, rosuvastatín,
simvastatín, bosentán, glyburid) a u ktorých sa pozorovali závažné nežiaduce udalosti závislé
od koncentrácie. Súbežné podávanie si vyžaduje obozretnosť a odporúča sa dôkladné sledovanie.
Fotosenzibilizátory
Lieky, ktoré majú potenciálne fotosenzibilizujúce účinky (ako sú tetracyklíny, sulfónamidy, chinolóny, fenotiazíny, hypoglykemizujúce deriváty sulfonylmočoviny, tiazidové diuretiká,
grizeofulvín alebo amiodarón), sa majú prestať podávať najmenej 10 dní pred zákrokom s liekom
TOOKAD a nemajú sa podávať najmenej 3 dni po ňom alebo sa majú tieto lieky nahradiť inými bez
fotosenzibilizujúcich vlastností. Ak nie je možné fotosenzibilizujúce lieky (napr. amiodarón) vysadiť, treba pacienta upozorniť na to, že môže dôjsť k zvýšeniu citlivosti na slnečné svetlo a že možno bude potrebné, aby sa počas dlhšieho obdobia chránil pred svetlom (pozri časť 4.2).
Antikoagulanciá a antiagreganciá trombocytov
Antikoagulanciá a antiagreganciá trombocytov (napr. kyselina acetylsalicylová) sa majú prestať podávať najmenej 10 dní pred zákrokom s liekom TOOKAD. Lieky, ktoré bránia agregácii trombocytov alebo ju znižujú, sa nemajú začať podávať skôr ako 3 dni po zákroku.
4.6 Fertilita, gravidita a laktácia
Antikoncepcia
V prípade pohlavného styku pacienta so ženami, ktoré môžu otehotnieť, má pacient a/alebo jeho
partnerka počas 90 dní po zákroku VTP používať účinnú formu antikoncepcie, aby nedošlo k otehotneniu.
Gravidita a dojčenie
Liek TOOKAD nie je indikovaný na liečbu žien.
Fertilita
Padeliporfín nebol testovaný na reprodukčnú toxicitu ani fertilitu.
U zvierat sa však pozorovali všetky fázy spermatogenézy. U jedného samca s vysokou dávkou
a s vakuolizáciou sa zaznamenala aj minimálna degenerácia semenotvorného epitelu. Všetky tieto zmeny sa považovali za náhodné a pravdepodobne súviseli s postupom intravenózneho podania.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek TOOKAD nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Avšak vzhľadom na to, že zákrok zahŕňa celkovú anestéziu, nemajú pacienti počas 24 hodín od navodenia celkovej anestézie vykonávať zložité úkony, napríklad viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce reakcie v klinických štúdiách fázy II a III boli poruchy močových ciest a reprodukčného systému: dyzúria (25,1 %), erektilná dysfunkcia (21,1 %), hematúria (19,6 %), perineálna bolesť/perineálny hematóm (15,3 %), retencia moču (13,3 %), nutkanie na močenie
(9,0 %), polakizúria (7,3 %), infekcia močových ciest (5,5 %), inkontinencia (5,3 %) a zlyhanie ejakulácie (5,0 %).
Takisto sa pozorovali nešpecifické nežiaduce udalosti pravdepodobne súvisiace s celkovou anestéziou: prechodná celková amnézia, bradykardia, sínusová arytmia, fibrilácia predsiení, hypotenzia, bronchospazmus, zápal hltana, kongescia dýchacej sústavy, nauzea, vracanie, zápcha, pyrexia, hypotenzia počas zákroku. Bolo hlásených aj niekoľko prípadov hepatotoxicity (1,5 %), napríklad zvýšená hladina transamináz. Všetky z nich mali miernu intenzitu.
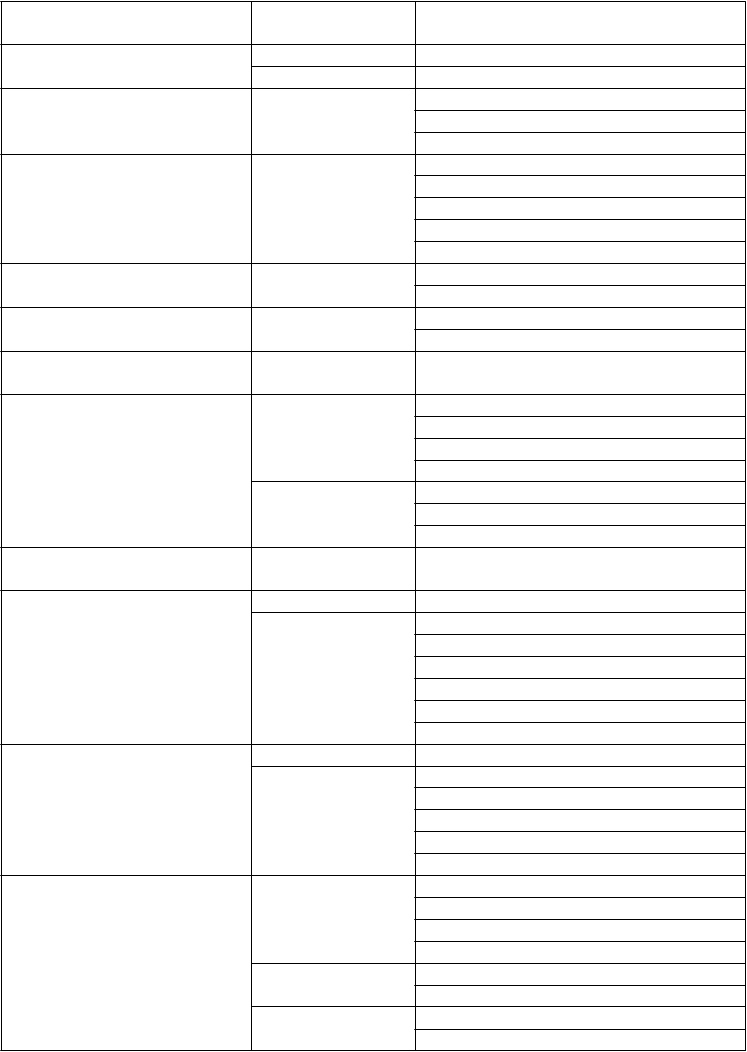
Tabuľkovýzoznamnežiaducichreakcií
V tabuľke 1 nižšie sú uvedené nežiaduce reakcie zoradené podľa tried orgánových systémov
a frekvencie. V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí podľa
klesajúcej závažnosti. Kategórie frekvencie výskytu sú vymedzené takto: veľmi časté (≥ 1/10), časté
(≥ 1/100 až < 1/10) a menej časté (≥ 1/1 000 až < 1/100).
Tabuľka 1: Zhrnutie nežiaducich reakcií, ktoré sa považujú za súvisiace s liekom TOOKAD a/alebo so zariadním použitým v štúdii a/alebo postupom použitým v štúdii v rámci súhrnnej analýzy bezpečnosti (n = 398)
T
rieda orgánových systémov Frekvencia
výskytu
N
ežiaduca reakcia
Infekcie a nákazy časté infekcia urogenitálneho traktu1
menej časté absces prostaty
Psychické poruchy menej časté znížené libido afektívna porucha enkopréza
Poruchy nervového systému menej časté bolesť hlavy
závrat ischias
smenzorická porucha
mravčenie
Poruchy oka menej časté podráždenie očí
fotofóbia
Poruchy ciev časté hematóm hypertenzia
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových
ciest
Poruchy kože a podkožného tkaniva
Poruchy svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových
ciest
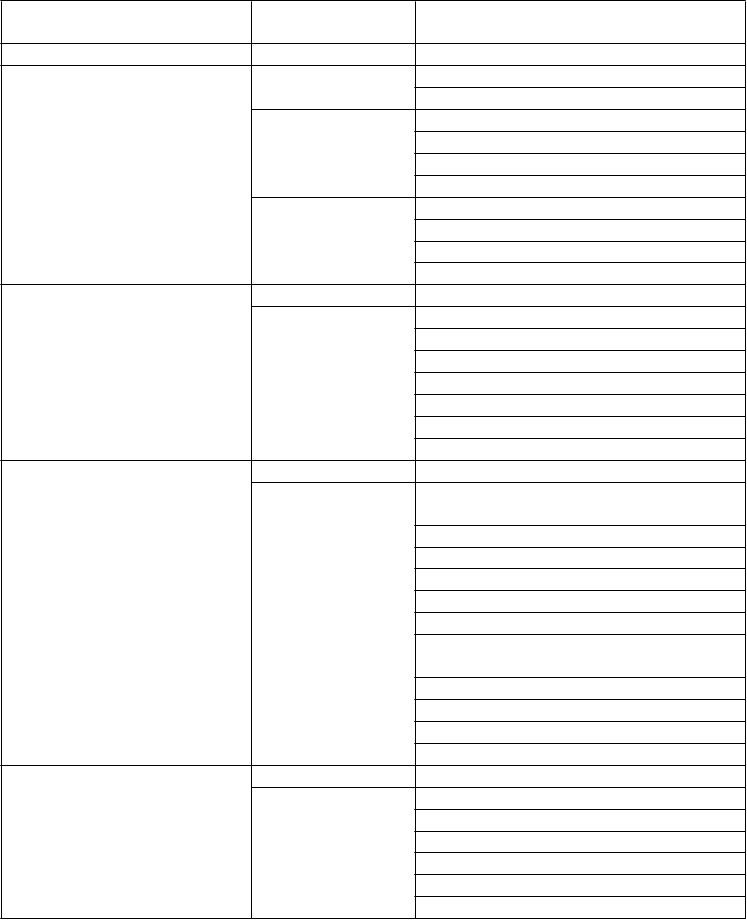
menej časté námahové dyspnoe
časté hemoroidy
anorektálny diskomfort2
abdominálna bolesť
krvácanie z konečníka3
menej časté abdominálny diskomfort stolica mimo normy hnačka
časté hepatotoxicita4
časté ekchymóza menej časté vyrážka
erytém suchá koža pruritus
depigmentácia kože
kožná reakcia časté bolesť chrbta5 menej časté bolesť v slabinách
krvácanie do svalu hemartróza
bolesť svalov a kostí
bolesť v končatine
veľmi časté retencia moču hematúria dyzúria6
poruchy močenia7
časté stenóza močovej rúry
inkontinencia moču8
menej časté krvácanie z močovodu
krvácanie z močovej rúry
T
rieda orgánových systémov Frekvencia výskytu
N
ežiaduca reakcia
poruchy močových ciest
Poruchy reprodukčného
systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné
vyšetrenia
Úrazy, otravy a komplikácie
liečebného postupu
veľmi časté perineálna bolesť9
sexuálna dysfunkcia u mužov10
časté prostatitída bolesť genitálií11 bolesť prostaty12 hematospermia
menej časté krvácanie z genitálií opuch penisu13 krvácanie z prostaty opuch semenníkov
časté únava menej časté asténia
bolesť v mieste zavedenia katétra
zlyhanie laserového zariadenia podliatina v mieste podania infúzie uzlík
bolesť
erytém v mieste podania
časté zrážanie krvi mimo normy14
menej časté zvýšená hladina laktátdehydrogenázy v krvi
zvýšená hladina triglyceridov v krvi zvýšená hladina gamaglutamyltransferázy zvýšená hladina cholesterolu v krvi zvýšená hladina kreatínfosfokinázy v krvi znížená hladina draslíka v krvi
zvýšená hladina lipoproteínov s nízkou hustotou
zvýšený počet neutrofilov zvýšenie hodnoty PSA zníženie hmotnosti
zvýšený počet bielych krviniek časté zranenie perinea15
menej časté opakovanie chirurgického zákroku kontúzia
únik moču po zákroku bolesť počas zákroku výtok po zákroku
pád
Nasledujúce pojmy predstavujú skupinu súvisiacich udalostí, ktoré opisujú skôr zdravotný stav ako
samostatnú udalosť.
1 Infekcia urogenitálneho traktu (infekcia močových ciest, orchitída, epididymitída, cystitída).
2 Anorektálny diskomfort (proktalgia, rektálny tenezmus).
3 Krvácanie z konečníka (krvácanie z análneho otvoru).
4 Hepatotoxicita (zvýšená hladina alanínaminotransferázy, zvýšená hladina aspartátaminotransferázy).
5 Bolesť chrbta (protrúzia medzistavcovej platničky).
6 Dyzúria (bolesť močového mechúra, spazmus močového mechúra, hypertonický močový mechúr,
spazmus močovej rúry, bolesť močových ciest).
7 Poruchy močenia (nutkanie na močenie, polakizúria, noktúria, znížený prietok moču, namáhavé
močenie).
8 Inkontinencia moču (urgentná inkontinencia, inkontinencia, stresová inkontinencia moču).
9 Perineálna bolesť (bolesť v panve).
10 Sexuálna dysfunkcia u mužov (erektilná dysfunkcia, zlyhanie ejakulácie, dyspareunia, porucha ejakulácie, hypospermia, bolestivá ejakulácia, retrográdna ejakulácia, sexuálna dysfunkcia, znížený objem ejakulátu).
11 Bolesť genitálií (bolesť penisu, bolesť semenníkov, bolesť mieška, neinfekčná orchitída, zápal
semenného povrazca, kontúzia genitálií).
12 Bolesť prostaty (prostatizmus, poruchy prostaty, fibróza prostaty).
13 Opuch penisu (balanopostitída).
14 Zrážanie krvi mimo normy (zvýšená hladina D-dimérov fibrínu, predĺžený aPTT, zvýšený INR).
15 Zranenie perinea (hematóm po zákroku, nekróza, perineálny hematóm, hematóm panvy).
Opis vybraných nežiaducich reakcií
Erektilná dysfunkcia
V rámci európskej štúdie fázy III došlo u 60 (30,5 %) pacientov v skupine TOOKAD-VTP k erektilnej dysfunkcii a u 16 (8,1 %) pacientov k zlyhaniu ejakulácie. U 53 (26,9 %) pacientov dochádzalo
k erektilnej dysfunkcii počas viac ako 6 mesiacov vrátane 34 (17,3 %) pacientov, u ktorých erektilná
dysfunkcia nevymizla do ukončenia štúdie. Keď sa analýza obmedzila na pacientov, ktorí podstúpili
unilaterálny zákrok VTP, u 33 (16,8 %) pacientov dochádzalo k erektilnej dysfunkcii počas viac ako
6 mesiacov vrátane 17 (8,6 %) pacientov, u ktorých erektilná dysfunkcia nevymizla do ukončenia
štúdie.
Retencia moču
V európskej štúdii fázy III došlo u 30 (15,2 %) pacientov k retencii moču. Medián času do nástupu retencie moču bol 3 dni (1 – 417). Medián trvania bol 10 dní (1 – 344).
Infekcie urogenitálneho traktu
Najčastejšie infekcie sú orchitída, epididymitída a infekcie močových ciest vrátane cystitídy.
V európskej štúdii fázy III došlo u 20 (10,2 %) pacientov v skupine TOOKAD-VTP k infekcii urogenitálneho traktu. U 5 (2,5 %) pacientov sa infekcia považovala za závažnú. Medián času
do nástupu infekcií urogenitálneho traktu bol 22,5 dňa (4 – 360). Medián trvania bol 21 dní (4 – 197).
Inkontinencia moču
V európskej štúdii fázy III došlo u 25 (12,7 %) pacientov k inkontinencii moču (vrátane inkontinencie, stresovej inkontinencie moču a urgentnej inkontinencie). Medián času do nástupu inkontinencie moču
bol 4 dni (1 – 142). U 18 pacientov nežiaduca udalosť ustúpila s mediánom trvania 63,5 dňa (1 – 360)
a u 7 pacientov pretrvávala aj na konci štúdie. Len u 1 (0,5 %) pacienta došlo k závažnej inkontinencii
moču (3. stupňa). Ani u jedného z týchto pacientov nebola potrebná operácia z dôvodu inkontinencie.
Zranenie perinea, perineálna bolesť a prostatitída
V kontrolovanej európskej štúdii fázy III došlo k zraneniu perinea a perineálnej bolesti u 46 (23,4 %)
pacientov. V niektorých prípadoch bolo potrebné tlmiť bolesť z dôvodu perineálnej bolesti alebo anorektálneho diskomfortu. U jedného pacienta sa vyskytla perineálna bolesť 3. stupňa, ktorá sa
objavila 35 týždňov po zákroku VTP, trvala približne 35 týždňov a potom odznela bez následkov.
V kontrolovanej európskej štúdii fázy III sa u 7 (3,6 %) pacientov vyskytla prostatitída. U jedného
pacienta sa vyskytla prostatitída 3. stupňa, ktorá sa považovala za závažnú. Objavila sa 4 dni
po zákroku VTP, trvala 31dní a potom odznela bez následkov.
Stenóza močovej rúry
V pivotnej európskej štúdii fázy III sa u 2 (1,0 %) pacientov po 5 až 6 mesiacoch od zákroku objavila stredne závažná až závažná stenóza močovej rúry. Tento stav si vyžadoval dilatáciu močovej rúry
(pozri časť 4.4).
ĎalšienežiaducereakcievštúdiáchfázyIIo karcinóme prostaty a osobitné povolenie
Extraprostatická nekróza
Z dôvodu nesprávnej kalibrácie lasera sa vyskytli sa dva prípady nadmernej extraprostatickej nekrózy bez klinických následkov. Z dôvodu nesprávneho umiestnenia vlákna sa vyskytol jeden prípad externej uretrálnej fistuly (pozri časť 4.4).
F
ototoxicita
U jedného pacienta liečeného liekom TOOKAD v dávke 2 mg/kg bol 33 dní po zákroku VTP hlásený jeden prípad ischemickej neuropatie zrakového nervu 3. stupňa. Tento stav odznel s malým defektom
zorného poľa.
Absces prostatyV štúdii realizovanej v Latinskej Amerike bol u jedného pacienta, ktorý podstúpil unilaterálny zákrok
VTP, hlásený výskyt jednej závažnej nežiaducej udalosti v podobe abscesu prostaty. Tento stav odznel do troch dní.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby

hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v prílohe V.
4.9 PredávkovanieExistujú len obmedzené klinické údaje o predávkovaní liekom TOOKAD. Zdraví účastníci boli
vystavení didraselnej soli padeliporfínu v dávkach do 15 mg/kg (čo zodpovedá padeliporfínu
13,73 mg/kg) bez svetelnej aktivácie a 23 pacientov sa liečilo didraselnou soľou padeliporfínu v dávke
6 mg/kg (čo zodpovedá padeliporfínu 5,49 mg/kg) bez výrazných bezpečnostných problémov. Napriek tomu však môže dôjsť k predĺženiu fotosenzitivity a bezpečnostné opatrenia týkajúce sa
expozície svetlu sa majú dodržiavať počas ďalších 24 hodín (pozri časť 4.4).
Predávkovanie laserovým svetlom môže zvýšiť riziko nežiaducej extraprostatickej nekrózy (pozri časť
4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: liečivá používané pri fotodynamickej/radiačnej terapii,
ATC kód: L01XD07
MechanizmusúčinkuPadeliporfín zostáva v cievnom systéme. Keď sa aktivuje pomocou laserového svetla s vlnovou dĺžkou 753 nm, dochádza k spusteniu série patofyziologických udalostí, ktoré v priebehu niekoľkých
dní vedú k fokálnej nekróze. Aktivácia v rámci osvetlenej nádorovej vaskulatúry vytvára kyslíkové
radikály (•OH, O•�
2
), čo spôsobuje lokálnu hypoxiu, ktorá vyvoláva uvoľnenie radikálov oxidu
dusnatého (•NO). Toto vedie k prechodnej arteriálnej vazodilatácii, ktorá spúšťa uvoľnenie
vazokonstriktora, endotelínu-1. Rýchla spotreba radikálov •NO kyslíkovými radikálmi vedie súčasne so zúžením artérie k tvorbe reaktívnych foriem dusíka (reactive nitrogen species, RNS) (napr. peroxynitritu). Okrem toho sa predpokladá, že narušená deformabilita zvyšuje agregačnú schopnosť erytrocytov a tvorbu krvných zrazenín na rozhraní artérií zásobujúcich nádor a v mikrocirkulácii nádoru, pričom spôsobuje oklúziu nádorových ciev. Tento účinok ešte posilňuje apoptóza endoteliálnych buniek spôsobená RNS a iniciácia samostatne sa šíriacej nekrózy nádorových buniek prostredníctvom peroxidácie ich membrán.
Farmakodynamickéúčinky
U pacientov s lokalizovaným karcinómom prostaty, ktorí absolvovali liečbu TOOKAD-VTP, sa pomocou magnetickej rezonancie (Magnetic Resonance Imaging, MRI) pozorovala nekróza na 7. deň. Celková dodaná energia korelovala s objemom nekrózy pozorovanej na 7. deň. LDI zodpovedá
pomeru kumulatívnej dĺžky hrotov osvetlených vlákien (cm) k objemu (ml) zacielenej oblasti, ktorá sa
má liečiť. Zacielená oblasť zodpovedá laloku s pozitívnymi biopsiami. Jej objem sa meria
po vymedzení prostaty pomocou softvéru na navádzanie liečby. V štúdiách fázy II boli podmienky liečby zodpovedajúce hodnote LDI ≥ 1 na 7. deň v prípade unilaterálnej liečby spojené s priemernou mierou nekrózy v zacielenej oblasti 89 % ±20,75. Zdá sa, že hodnota LDI ≥ 1 bola spojená s vyšším objemom nekrózy na základe vyšetrenia MRI na 7. deň a vyšším podielom pacientov s negatívnou biopsiou v 6. mesiaci v porovnaní s hodnotou LDI < 1 (pozri časť 4.2).
Sledovaním po zákroku sa nezistila signifikantná korelácia medzi percentuálnym podielom nekrózy prostaty na základe vyšetrenia MRI na 7. deň a pravdepodobnosťou negatívnej biopsie prostaty.
Klinickáúčinnosťabezpečnosť
Štúdia fázy III (PCM301)
V pivotnej otvorenej štúdii fázy III (PCM301) vykonanej v 10 európskych krajinách sa randomizovalo
413 pacientov do skupiny TOOKAD-VTP alebo skupiny AS.
Hlavnými kritériami na zaradenie do štúdie boli karcinóm prostaty s nízkym rizikom a s Gleasonovým skóre adenokarcinómu prostaty maximálne 3 + 3, dve až tri jadrá pozitívne na karcinóm a maximálna dĺžka jadra karcinómu 5 mm v ktoromkoľvek jadre (minimálne 3 mm u pacientov, ktorí mali len jedno pozitívne jadro), klinické štádium do T2a, PSA ≤ 10 ng/ml, objem prostaty rovný alebo väčší ako
25 ml a menší ako 70 ml.
Hlavnými kritériami na vyradenie zo štúdie boli akákoľvek liečba karcinómu prostaty v súčasnosti alebo v minulosti, akýkoľvek chirurgický zákrok z dôvodu benígnej hypertrofie prostaty, očakávaná dĺžka života kratšia ako 10 rokov, zdravotný stav, ktorý vylučuje použitie celkovej anestézie.
Zákrok VTP zahŕňal 10-minútovú intravenóznu injekcie lieku TOOKAD v dávke 4 mg/kg, po ktorej
nasledovalo osvetlenie laserovým svetlom s vlnovou dĺžkou 753 nm a energiou 200 J/cm vlákna počas
22 minút a 15 sekúnd pomocou intersticiálnych optických vlákien, ktoré boli transperineálne zavedené
do prostaty. V prípade unilaterálneho ochorenia sa mala aplikovať fokálna liečba jedného laloka.
V prípade bilaterálneho ochorenia (zisteného pri vstupe do štúdie alebo počas sledovania po zákroku)
sa mala aplikovať bilaterálna liečba, a to buď simultánne alebo postupne. Bola povolená opakovaná liečba lalokov, u ktorých sa po 12-mesačnom sledovaní zistil pozitívny nález karcinómu.
Liečba AS zahŕňala sériové merania absolútnych hodnôt PSA a ultrazvukom navádzanú biopsiu prostaty v 12. a 24. mesiaci.
Štúdia mala dva primárne sledované parametre pre liečbu TOOKAD-VTP v porovnaní s liečbou AS:
- A: miera absencie jednoznačného karcinómu na základe histológie v 24. mesiaci,
- B: rozdiel v miere zlyhania liečby spojeného s pozorovanou progresiou ochorenia od karcinómu prostaty s nízkym rizikom po karcinóm prostaty so stredným alebo vyšším rizikom. Karcinóm prostaty so stredným/vyšším rizikom bol definovaný ako ktorýkoľvek z nasledujúcich prípadov:
> 3 jadrá jednoznačne pozitívne na karcinóm, primárny alebo sekundárny Gleasonov vzor ≥ 4,
aspoň 1 jadro karcinómu s dĺžkou > 5 mm, PSA > 10 ng/ml v 3 po sebe idúcich meraniach,
karcinóm prostaty štádia T3, metastáza, smrť súvisiaca s karcinómom prostaty. Na začiatku mali všetci pacienti Gleasonovo skóre ≤ 3 + 3.
V každej tabuľke sa takisto nachádzajú výsledky pacientov spĺňajúcich indikačné kritériá (pacienti
s unilaterálnym, nízkorizikovým, lokalizovaným karcinómom prostaty nezahŕňali pacientov s veľmi
nízkym rizikom).
V tabuľke 2 sa uvádzajú východiskové charakteristiky podľa jednotlivých skupín.
T
abuľka 2: PCM301 – Východiskové charakteristiky podľa jednotlivých skupín v ITT-populácii a u pacientov spĺňajúcich indikačné kritériá
C
harakteristika ITT-populácia Pacienti spĺňajúci indikačné
kritériá
V
ek (roky)
Skupina TOOKAD- VTP
n = 206
Skupina
AS
n = 207
Skupina TOOKAD- VTP
n = 80
Skupina
AS
n = 78
Priemer (SD) 64,2 (6,70) 62,9 (6,68) 63,9 (6,27) 62,3 (6,32) Rozmedzie: min.; max. 45;85 44;79 48;74 46;73
Pacienti starší ako > 75 rokov,
n (%)
6 (2,9) 6 (2,9) 0 0
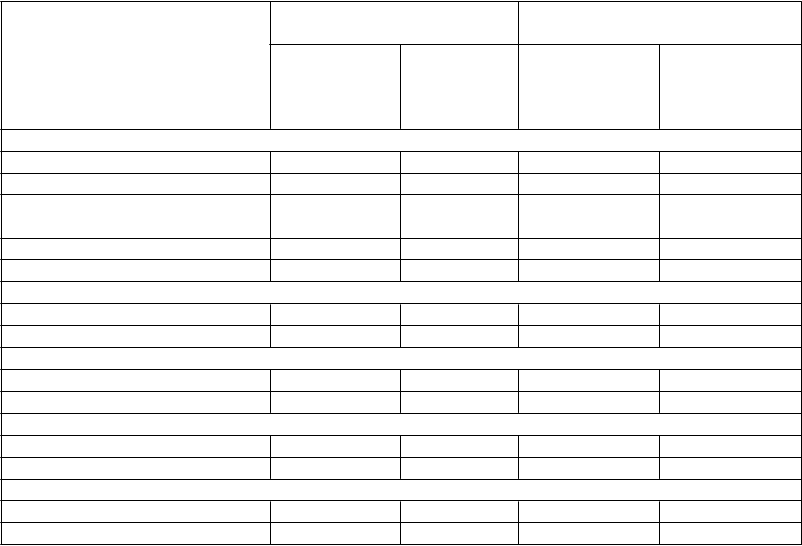 U
nilaterálne ochorenie, n (%)
U
nilaterálne ochorenie, n (%) 157 (76,2) 163 (78,7) 80 (100) 78 (100)
Bilaterálne ochorenie, n (%) 49 (23,8) 44 (21,3) neaplikovateľné neaplikovateľné
Klinické štádiáT1, n (%) 178 (86,4) 180 (87,0) 66 (82,5) 71 (91,0)
T2a, n (%) 28 (13,6) 27 (13,0) 14 (17,5) 7 (9,0)
Celkový počet pozitívnych jadierPriemer (SD) 2,1 (0,68) 2,0 (0,72) 2,2 (0,74) 2,1 (0,76) Rozmedzie: min.; max. 1;3 1;3 1;3 1;3
Odhadovaný objem prostaty (ml)Priemer (SD) 42,5 (12,49) 42,5 (11,76) 37,2 (9,67) 37,6 (9,63) Rozmedzie: min.; max. 25;70 25;70 25;68 25;66
PSA (ng/ml)Priemer (SD) 6,19 (2,114) 5,91 (2,049) 6,98 (1,796) 7,12 (1,704) Rozmedzie: min.; max. 0,1;10,0 0,5;10,0 1,0;10,0 3,1;10,0
10 z 206 účastníkov randomizovaných na liečbu TOOKAD-VTP nedostalo liečbu z rôznych dôvodov
vrátane odstúpenia zo štúdie, splnenia kritérií na vyradenie, nedodržiavania liečby a iných zdravotných
udalostí.
Tabuľka 3 popisuje primárne sledované parametre účinnosti v celej prostate a v liečenom laloku (ITT- populácia a pacienti spĺňajúci indikačné kritériá).
T
abuľka 3: PCM301 – Primárne sledované parametre účinnosti – celá prostata a liečené laloky*
– ITT-populácia a pacienti spĺňajúci indikačné kritéria
P
očet účastníkov ITT-populácia Pacienti spĺňajúci indikačné kritériá
Skupina TOOKAD- VTP
n = 206
'
Skupina
AS
n = 207
Skupina TOOKAD- VTP
n = 80
Skupina
AS
n = 78
A
: Miera absencie jednoznačného karcinómu na základe histológie v 24. mesiaci
N
egatívna biopsia, n (%) 101 (49,0)a 28 (13,5)a 36 (45,0)e 8 (10,3)e
N
egatívna biopsia liečeného laloku*, n (%) Žiadny výsledok biopsie, n (%)
Účastníci, ktorí podstúpili radikálnu liečbu,
v dôsledku čoho chýbala
biopsia, n (%)
129 (62,6)b 40 (19,3)b 52 (65,0)f 11 (14,1)f
38 (18,4) 86 (41,5) 11 (13,8) 34 (43,6)
12 (5,8) 55 (26,6)c 6 (7,5) 27 (34,6)
Iné dôvodyd, n (%) 26 (12,6) 31 (15,0) 5 (6,3) 7 (9,0)
Pozitívna biopsia, n (%) 67 (32,5) 93 (44,9) 33 (41,3) 36 (46,2)
P
ozitívna biopsia
li
e
čeného laloku*, n (%)
39 (18,9) 81 (39,1) 17 (21,3) 33 (42,3)
aRisk ratio (95 % IS) = 3,62 (2,50;5,26); hodnota p < 0,001
bRisk ratio (95 % IS) = 3,24 (2,41;4,36); hodnota p < 0,001
cSpomedzi 60 pacientov, ktorí podstúpili radikálnu liečbu, 5 pacientov podstúpilo biopsiu v 24.
mesiaci
dNapríklad: odstúpenie zo štúdie, zdravotný dôvod, odmietnutie zo strany účastníka
eRisk ratio (95 % IS) = 4,39 (2,18;8,83); hodnota p < 0,001
fRisk ratio (95 % IS) = 4,61 (2,60;8,16); hodnota p < 0,001
B: Rozdiel v miere zlyhania liečby spojeného s pozorovanou progresiou ochorenia
P
očet účastníkov
s progresiou v 24. mesiaci, n (%)
Progresia na Gleasonov vzor ≥ 4
Počet účastníkov
s progresiou v liečenom
laloku* v 24. mesiaci, n (%)
58 (28,2)g 121 (58,5)g 27 (33,8)h 53 (67,9)h
49 (23,8) 91 (44,0) 19 (23,8) 40 (51,3)
24 (11,7)i 90 (43,5)i 7 (8,8)j 39 (50,0)j
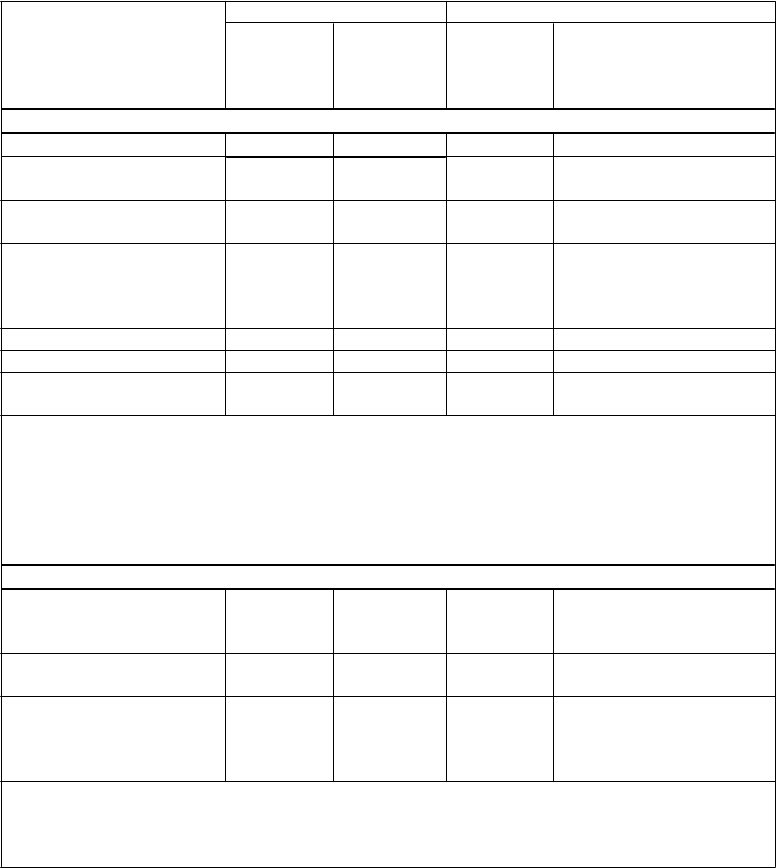
gUpravené hazard ratio (95 % IS) = 0,34 (0,24, 0,46), hodnota p ≤ 0,001
hUpravené hazard ratio (95 % IS) = 0,31 (0,20, 0,50), hodnota p ≤ 0,001
iUpravené hazard ratio (95 % IS) = 0,17 (0,12, 0,27), hodnota p ≤ 0,001
jUpravené hazard ratio (95 % IS) = 0,11 (0,05, 0,25), hodnota p ≤ 0,001
* Liečený lalok (liečené laloky) v skupine AS boli definované ako laloky s ochorením na začiatku
štúdie.
Sekundárnym cieľom bolo stanoviť rozdiel medzi týmito dvomi skupinami, pokiaľ ide o mieru následnej radikálnej liečby karcinómu prostaty. Z 58 pacientov s progresiou v skupine TOOKAD-VTP len 11 podstúpilo radikálnu liečbu, 18 pacientov podstúpilo druhý zákrok VTP a 29 nedostalo na konci štúdie žiadnu ďalšiu liečbu. Zo 121 pacientov s progresiou v skupine AS 54 podstúpilo radikálnu
liečbu a 67 nedostalo na konci štúdie žiadnu aktívnu liečbu. Pacientom v skupine AS nebola ponúknutá následná liečba VTP. V rámci hodnotenia celkovej znášanlivosti 24 mesiacov po zaradení do štúdie boli pacienti, ktorí podstúpili radikálnu liečbu, takisto započítaní do hodnotenia príznakov prostaty a erektilnej funkcie.
T
abuľka 4: PCM301 – Počet účastníkov s radikálnou liečbou v 24. mesiaci – ITT-populácia a pacienti spĺňajúcich indikačné kritériá
C
harakteristika ITT-populácia Pacienti spĺňajúci indikačné
kritériá
Skupina TOOKAD-VTP n = 206
Skupina AS
n = 207
Skupina TOOKAD-VTP n = 80
Skupina AS
n = 78
P
očet účastníkov, u ktorých sa začala radikálna liečba,
n (%)
P
očet účastníkov, u ktorých sa začala radikálna liečba po progresii, n (%)
12 (5,8) 62 (29,9) 6 (7,5) 28 (35,9)
11 (5,3) 54 (26,1) 5 (6,3) 25 (32,1)
Ú
činok na urologickú morbiditu (IPSS) a erektilnú funkciu (IIEF) po zákroku TOOKAD-VTP
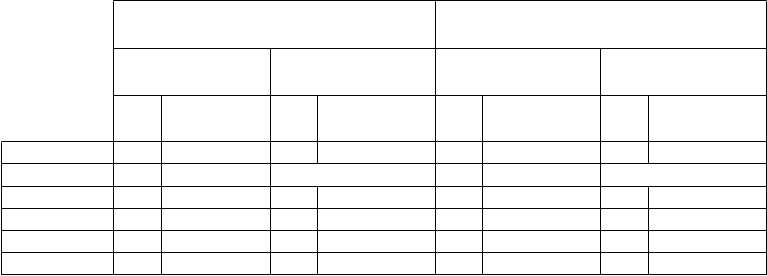
Ako je uvedené v tabuľke 5, medzinárodné skóre prostatických príznakov (International Prostate
Symptomes Score, IPSS) v štúdii PCM301 preukázalo mierny nárast 7 dní po zákroku VTP v ITT- populácii i u pacientov spĺňajúcich indikačné kritériá. Tieto výsledky sa zlepšili v 3. mesiaci a v 6. mesiaci sa vrátili na hodnoty zo začiatku štúdie a ďalej sa zlepšovali až do 24. mesiaca. V skupine
s aktívnym dohľadom (Active Surveillance, AS) sa skóre IPSS priebežne mierne zhoršovalo až do 24. mesiaca.
Tabuľka 5: PCM301 – Účinok na urologickú morbiditu (IPSS) – ITT-populácia a pacienti
spĺňajúci indikačné kritériá
ITT-populácia Pacienti spĺňajúci indikačné kritériá
Skupina
T
O
O
K
AD
-
V
TP
n Priemerné skóre (SD)
Skupina
AS
n Priemerné skóre (SD)
Skupina
T
O
O
K
AD
-
V
TP
n Priemerné skóre (SD)
Skupina
AS
n Priemerné skóre (SD)
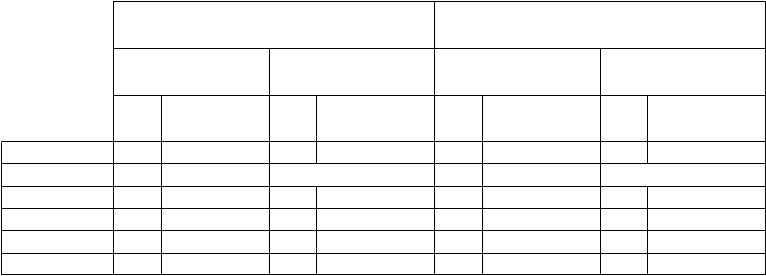
Začiatok 179 7,6 (6,09) 185 6,6 (5,30) 71 6,7 (5,69) 73 6,0 (4,34)
7. deň 180 14,8 (8,64) neaplikovateľné 72 14,2 (8,89) neaplikovateľné
3. mesiac 179 9,6 (6,86) 190 7,2 (5,75) 71 8,7 (5,72) 72 6,6 (5,11)
6. mesiac 182 7,5 (6,06) 189 6,8 (5,84) 74 6,4 (5,33) 73 6,3 (5,36)
12. mesiac 177 7,2 (5,85) 173 7,3 (5,95) 71 5,7 (5,01) 68 7,1 (5,75)
24. mesiac* 165 6,6 (5,47) 154 8,2 (6,47) 66 5,5 (5,34) 55 8,6 (6,56)
*Skóre v 24. mesiaci zahŕňajú pacientov, ktorí podstúpili radikálnu liečbu.
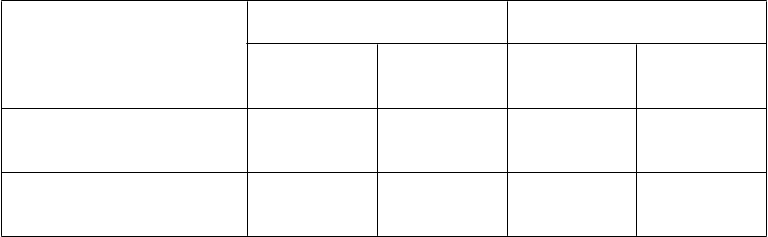
Ako je uvedené v tabuľke 6, v skupine VTP štúdie PCM301 došlo v ITT-populácii i u pacientov
spĺňajúcich indikačné kritériá 7 dní po zákroku VTP k značnému poklesu skóre týkajúceho sa
erektilnej funkcie podľa dotazníka Medzinárodného indexu erektilnej funkcie (IIEF-15) s 15 otázkami;
potom počas ďalších mesiacov nasledovalo zlepšenie až do 24. mesiaca.
T
abuľka 6: PCM301 – Účinok na erektilnú funkciu (IIEF) – ITT-populácia a pacienti spĺňajúci indikačné kritériá
I
TT
-
populácia Pacienti spĺňajúci indikačné kritériá
Skupina
T
O
O
K
AD
-
V
TP
n Priemerné skóre (SD)
Skupina
AS
n Priemerné skóre (SD)
Skupina
T
O
O
K
AD
-
V
TP
n Priemerné skóre (SD)
Skupina
AS
n Priemerné skóre (SD)
Začiatok 184 18,6 (10,22) 188 20,6 (9,92) 74 18,4 (10,31) 74 20,8 (10,02)
7. deň 165 11,5 (10,96) neaplikovateľné 68 10,1 (10,82) neaplikovateľné
3. mesiac 171 14,7 (10,48) 182 21,0 (9,84) 69 14,3 (10,81) 70 21,7 (9,95)
6. mesiac 176 16,1 (9,98) 185 20,4 (9,83) 68 16,9 (9,78) 72 20,6 (9,85)
12. mesiac 170 15,1 (10,28) 167 19,9 (10,29) 70 16,7 (10,18) 65 20,4 (10,44)
24. mesiac* 159 15,0 (10,70) 152 16,8 (11,17) 62 15,4 (11,11) 54 16,4 (11,10)
*Skóre v 24. mesiaci zahŕňajú pacientov, ktorí podstúpili radikálnu liečbu.
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti lieku TOOKAD sa skúmali u 42 zdravých účastníkov mužského pohlavia
(bez fotoaktivácie) a 70 pacientov s lokalizovaným karcinómom prostaty (po fotoaktivácii).
DistribúciaU zdravých účastníkov mužského pohlavia bol priemerný distribučný objem v rozmedzí
0,064 – 0,279 l/kg pri dávkovaní didraselnej soli padeliporfínu 1,25 – 15 mg/kg, čo naznačuje distribúciu do mimobunkovej tekutiny. Podobný priemerný distribučný objem sa pozoroval
u pacientov s lokalizovaným karcinómom prostaty liečených didraselnou soľou padeliporfínu v dávke
2 mg/kg a 4 mg/kg (0,09 – 0,10 l/kg v uvedenom poradí).
Didraselná soľ padeliporfínu sa vo veľkej miere viaže na proteíny ľudskej plazmy (99 %).
Štúdie
in vitro naznačujú, liek TOOKAD pravdepodobne nie je substrátom prenášačov OATP1B1, OATP1B3, OCT1, OATP2B1, P-gp, BCRP, MRP2 alebo BSEP zodpovedných za vychytávanie
v pečeni.
BiotransformáciaV štúdiách
in vitro zameraných na metabolizmus sa pozoroval minimálny metabolizmus padeliporfínu v ľudských pečeňových mikrozómoch a frakciách S9. V týchto štúdiách sa nepozorovali žiadne
metabolity padeliporfínu.
Nevykonali sa žiadne štúdie
in vitro ani
in vivo s rádioaktívne značeným padeliporfínom. Preto sa nedá úplne vylúčiť možnosť určitého metabolizmu padeliporfínu
in vivo.
Štúdie
in vitro naznačujú, že liek TOOKAD pravdepodobne nie je inhibítorom enzýmov CYP450. Štúdie
in vitro naznačujú, že liek TOOKAD neinhibuje P-gp, OAT1, OAT3, OCT2, OCT1, BCRP
a BSEP, ale mohol by inhibovať prenášače OATP1B1 a OATP1B3 (pozri časť 4.5).
ElimináciaU zdravých účastníkov mužského pohlavia, ktorí sa liečili didraselnou soľou padeliporfínom v dávke
1,25 – 15 mg/kg, sa klírens didraselnej soli padeliporfínu pohyboval v rozmedzí 0,0245 –
0,088 l/h/kg. Na základe populačnej farmakokinetickej analýzy sa pri dávke didraselnej soli padeliporfínu 4 mg/kg odhaduje polčas na 1,19 h ±0,08. Podobné rozmedzie priemerného klírensu sa
pozorovalo u pacientov s lokalizovaným karcinómom prostaty liečených didraselnou soľou
padeliporfínu v dávke 4 mg/kg a 2 mg/kg (0,04 – 0,06 l/h/kg v uvedenom poradí). U zdravých účastníkov bolo vylučovanie padeliporfínu močom veľmi nízke (< 0,2 % dávky). Vzhľadom na jeho molekulárnu hmotnosť a veľmi nízku mieru vylučovania molekuly močom je u ľudí najpravdepodobnejšou cestou eliminácie vylučovanie stolicou.
Populácia starších osôb
Do štúdií, v rámci ktorých sa hodnotila farmakokinetika, bolo zaradených veľmi málo pacientov starších ako 75 rokov, takže nie je známe, či je medzi týmito a mladšími pacientmi nejaký rozdiel (pozri časti 4.2 a 5.1).
Linearita/nelinearita
U zdravých účastníkov mužského pohlavia sa ukázalo, že hodnota Cmax je pri dávke didraselnej soli padeliporfínu 1,25 – 15 mg/kg lineárna, čo pokrýva terapeutické rozmedzie.
Vplyvy kovariantov na farmakokinetické vlastnosti
U zdravých dobrovoľníkov a pacientov sa skúmal vplyv veku, hmotnosti a rasy.
Výsledky populačnej farmakokinetickej štúdie ukázali, že vek, rasa, zdravotný stav a markery pečeňových funkcií pravdepodobne nemajú podstatný a biologicky významný vplyv
na farmakokinetiku lieku TOOKAD.
Telesná hmotnosť pacientov (v rozmedzí 60 – 120 kg) mala malý vplyv na farmakokinetické parametre lieku TOOKAD pri dávkach didraselnej soli padeliporfínu do 5 mg/kg .
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a toxicity
po opakovanom podávaní neodhalili žiadne osobitné riziko pre ľudí.
Testovanie genotoxicity in vitro odhalilo, že padeliporfín má pri osvetlení ultrafialovým (UV) svetlom slabý potenciál navodiť klastogenitu, čo zodpovedá mechanizmu účinku (tvorba reaktívnych foriem kyslíka).
Ukázalo sa, že padeliporfín je v prítomnosti UVA žiarenia (in vitro) cytotoxický a u morčiat (in vivo)
sa považuje za fototoxický.
Štúdie karcinogenity a reprodukčnej toxicity padeliporfínu sa nevykonali.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol (E 421)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka
5 rokov
Po rekonštitúcii
Chemická a fyzikálna stabilita lieku TOOKAD po rekonštitúcii v injekčnej liekovke pomocou 5 %
roztoku glukózy sa preukázala počas 8 hodín pri teplote 15 °C – 25 °C a 5 °C ±3 °C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, za čas
a podmienky uchovávania lieku pred použitím zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Injekčnú liekovku uchovávajte vo vonkajšej škatuli na ochranu pred svetlom. Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
TOOKAD 183 mgprášoknainjekčnýroztok
Injekčná liekovka jantárovej farby zo skla typu I, uzavretá gumovou zátkou s hliníkovou obrubou, zakrytá odklopiteľným modrým plastovým viečkom, obsahujúca 183 mg padeliporfínu.
Veľkosť balenia: 1 injekčná liekovka
TOOKAD 366 mgprášoknainjekčnýroztok
Injekčná liekovka jantárovej farby zo skla typu I, uzavretá gumovou zátkou s hliníkovou obrubou, zakrytá odklopiteľným bielym plastovým viečkom, obsahujúca 366 mg padeliporfínu.
Veľkosť balenia: 1 injekčná liekovka
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Príprava roztoku sa má vykonať v prostredí s tlmeným svetlom.
Liek TOOKAD sa pripravuje rekonštitúciou prášku na injekčný roztok:
- s 20 ml 5 % roztoku glukózy v prípade lieku TOOKAD 183 mg,
- so 40 ml 5 % roztoku glukózy v prípade lieku TOOKAD 366 mg.
Injekčná liekovka sa má následne ľahkým krúživým pohybom premiešavať 2 minúty. Každý ml výsledného roztoku bude obsahovať 9,15 mg padeliporfínu. Injekčnú liekovku treba 3 minúty nechať vo zvislej polohe bez ďalšieho pretrepávania alebo pohybu. Keďže liek TOOKAD má fotosenzibilizujúce vlastnosti, obsah injekčnej liekovky sa má potom preniesť do nepriehľadnej injekčnej striekačky, ktorá sa má nechať 3 minúty vo zvislej polohe, aby zmizla všetka pena.
Pri podaní lieku pacientovi sa má použiť injekčný filter s veľkosťou 0,22 µm a nepriehľadná hadička. Potom má nasledovať štandardný postup manipulácie s injekčnými striekačkami.
Rekonštituovaný roztok je tmavý. Ak sa nepoužije okamžite, za čas a podmienky uchovávania lieku pred použitím zodpovedá používateľ.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Steba Biotech S.A.
7 Place du Théâtre
L-2613 Luxembourg
Luxembursko
8. REGISTRAČNÉ ČÍSLA
EU/1/17/1228/001
EU/1/17/1228/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.