alebo
123I,
- poruchy prehĺtania, zúženie pažeráka, aktívny zápal žalúdka, žalúdočná erózia, vredová choroba,
- podozrenie na zníženie motility tráviaceho traktu.
NEŽIADUCE ÚČINKYVystavenie každého pacienta ionizujúcemu žiareniu musí byť opodstatnené na základe jeho pravdepodobného prínosu. Aplikovaná aktivita musí byť taká, aby výsledná dávka žiarenia bola čo najnižšia pri dosiahnutí požadovaného diagnostického alebo terapeutického výsledku.
Po podaní jodidu (
131I) sodného boli popísané niektoré prípady nežiaducich účinkov, zahrňujúcich nevoľnosť, vracanie a nešpecifikované prejavy alergie. Nevoľnosť a vracanie sú častejšie po perorálnom podaní predovšetkým terapeutických dávok a v prípade nevoľnosti je potrebné myslieť na riziko kontaminácie.
Včasné následkyTerapeutické množstvo jodidu (
131I) sodného môže zhoršiť existujúcu hypertyreózu.
Vysoké hladiny rádioaktivity môžu spôsobiť gastrointestinálne poruchy, obvykle v prvých hodinách alebo dňoch po podaní. K zhoršeniu stavu v gastrointestinálnej oblasti môže dochádzať až v 67 %. Tomu možno predísť symptomatickou liečbou.
Pri liečbe vysokou dávkou rádioaktívneho jódu, jeden až tri dni po aplikácii môže vzniknúť prechodný akútny zápal štítnej žľazy a trachey s možným prejavom ťažkej tracheálnej konstrikcie, najmä v prípadoch už existujúcej stenózy. Môže vzniknúť zápal slinných žliaz s ich zdurením a bolestivosťou, čiastočnou stratou chuti do jedla a suchosťou v ústach. Výskyt býva od 10 % (v prípade preventívnych opatrení) až do 60 % (bez preventívnych opatrení). Sialoadenitída sa obvykle spontánne upraví, niekedy je však potrebná protizápalová terapia. Ojedinele boli popísané pretrvávajúce prípady straty chute do jedla, sucha v ústach s následnou stratou zubov, v závislosti na dávke. Radiačné zaťaženie slinných žliaz má byť znižované stimuláciou vylučovania slín kyslými zlúčeninami. Zvýšené vychytávanie rádioaktívneho jódu v rôznych orgánoch môže spôsobiť ich bolestivosť, opuch tkanív a nevoľnosť.
Pri liečbe metastáz karcinómu štítnej žľazy v CNS môže vzniknúť edému mozgu alebo sa môže zvýšiť rozsah už existujúceho edému.
Neskoršie následkyAko neskorší následok liečby hypertyreózy rádioaktívnym jódom môže vzniknúť v závislosti na dávke hypotyreóza. Potrebná je preto pravidelná kontrola funkcie štítnej žľazy pre prípadné započatie substitučnej terapie. Hypothyreóza po liečbe rádioaktívnym jódom sa môže prejaviť za niekoľko týždňov ale i rokov (väčšinou to nebýva skôr ako za 6 - 12 týždňov). Incidencia hypotyreózy po aplikácii rádioaktívneho jódu sa uvádza v rozmedzí 2 - 70 %.
Príležitostne boli po podaní rádioaktívneho jódu pozorované prípady zníženej funkcie prištítnych teliesok; preto sa musia sledovať jej príznaky a pri ich zistení začať substitučná terapia. Ako neskoršie následky jednej aplikácie aktivity väčšej ako 5000 MBq alebo pri kratšom intervale ako 6 mesiacov sa môže vyskytnúť reverzibilný alebo vo veľmi vzácnych prípadoch ireverzibilný útlm kostnej drene, izolovanej trombocytopénie alebo erytrocytopénie s fatálnym priebehom. Často je pozorovaná prechodná leukocytóza.
Epidemiologické štúdie z obdobia rokov 1950 - 1970 informujú o zvýšenej incidencii karcinómu žalúdka u chorých po podaní jodidu (
131I) sodného.
Podľa epidemiologických štúdií pacientov po aplikácii väčších aktivít
131I, napríklad pri liečbe malígnych ochorení štítnej žľazy, bola pozorovaná zvýšená incidencia leukémií. Možný je tiež mierny vzostup incidencie karcinómu prsníka a močového mechúra.
Vystavenie ionizujúcemu žiareniu je spojené so vznikom rakoviny a s možným vývojom dedičných chýb. Radiačná dávka po terapeutickom ožiarení môže spôsobiť vyšší výskyt rakoviny a mutácií. Vo všetkých prípadoch je nevyhnutné, aby riziko z ožiarenia bolo menšie ako riziko spôsobené samotným ochorením. Radiačná dávka (EDE) po podaní terapeutickej dávky jodidu (
131I) sodného je väčšia ako 20 mSv.
V prípade nežiadúcich účinkov po podaní rádiofarmák je potrebné, aby v čase podania každého rádiofarmaka bola zabezpečená dostupnosť príslušnej liečby. Všetky nežiadúce účinky alebo podozrenie na ne je treba hlásiť.
INTERAKCIESú známe mnohé interakcie farmakologicky účinných látok s rádioaktívnym jódom. Mechanizmy interakcií, ktoré môžu ovplyvňovať väzbu jódu na proteíny, jeho farmakokinetiku a jeho pôsobenie sú rôzne. Preto je nevyhnutné poznať predchádzajúcu farmakoterapiu a zabezpečiť, ak je to potrebné, aby pred podaním jodidu (
131I) sodného niektoré lieky chorý neužíval. Napr. antityreoidálne látky, karbimazol (alebo iné deriváty imidazolu ako propyltiouracil), salicyláty, steroidy, nitroprusid sodný, brómsulfoftaleín sodný, chloristan, rôzne látky (antikoagulanciá, antihistaminiká, antiparazitiká, penicilíny, sulfónamidy, tolbutamid, tiopental) sa obvykle vysadzujú na 1 týždeň, benzylbutatión na 1 - 2 týždne, expektoranciá, vitamíny na 2 týždne, prírodné alebo syntetické lieky na liečbu štítnej žľazy (sodná soľ tyroxínu, liotyronínu, extrakt zo štítnej žľazy) na 2 - 3 týždne, amiodaron, benzodiazepíny, lítium na 4 týždne, topicky podávané jodidy na 1 - 9 mesiacov, intravenózne podávané kontrastné látky, perorálne podávané látky na cholecystografiu a kontrastné látky obsahujúce jód na obdobie do 1 roka.
DÁVKOVANIEAktivita sa podáva podľa klinického stavu chorého. Terapeutický účinok sa dosiahne až za niekoľko mesiacov.
Liečba hypertyreózy:Obvykle sa podáva aktivita v rozsahu 200 - 800 MBq, liečba sa však môže opakovať. Potrebná dávka závisí od diagnózy, veľkosti štítnej žľazy, akumulácie a klírensu jódu v štítnej žľaze. Pred liečbou hypertyreózy rádioaktívnym jódom je podľa možnosti vhodná medikamentózna liečba s cieľom dosiahnuť eutyreózu.
Odstránenie štítnej žľazy a liečba metastáz:Po celkovom alebo čiastočnom chirurgickom odstránení štítnej žľazy sa na odstránenie zbytkov tkaniva podávajú aktivity v rozsahu 1850 - 3700 MBq. Tieto aktivity závisia od objemu zbytkov a od akumulácie rádioaktívneho jódu. Pri ďalšej liečbe metastáz sa podáva aktivita v rozsahu 3700 - 11100 MBq.
Aktivitu pre deti a mladistvých je možné určiť ako podiel z dávky pre dospelých podľa telesnej hmotnosti alebo povrchu tela z nasledujúcich vzťahov:
Dávka pre deti (MBq) =
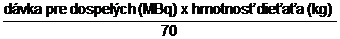
Dávka pre deti (MBq) =
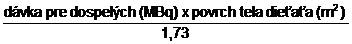
Aktivitu pre deti a mladistvých je možné určiť tiež ako podiel z dávky pre dospelých použitím koeficientov, odporúčaných Pediatric Task Group EANM:
3 kg = 0,10
| 4 kg = 0,14
| 6 kg = 0,19
| 8 kg = 0,23
| 10 kg = 0,27
|
12 kg = 0,32
| 14 kg = 0,36
| 16 kg = 0,40
| 18 kg = 0,44
| 20 kg = 0,46
|
22 kg = 0,50
| 24 kg = 0,53
| 26 kg = 0,56
| 28 kg = 0,58
| 30 kg = 0,62
|
32 kg = 0,65
| 34 kg = 0,68
| 36 kg = 0,71
| 38 kg = 0,73
| 40 kg = 0,76
|
42 kg = 0,78
| 44 kg = 0,80
| 46 kg = 0,82
| 48 kg = 0,85
| 50 kg = 0,88
|
52-54 kg = 0,90
| 56-58 kg = 0,92
| 60-62 kg = 0,96
| 64-66 kg = 0,98
| 68 kg = 0,99
|
SPÔSOB PODÁVANIA
Návod na použitie
Pri podávaní chorému sa dodržiava tento postup:
1. Skontroluje sa aktivita a referenčný dátum na olovenom tienení.
2. Bezprostredne pred meraním alebo podaním sa otočí viečko proti smeru hodinových ručičiek.
3. Viečko sa odstráni a jednotka sa uzavrie.
4. Aplikátor THERACAPu
131™ sa umiestni na vrch držiaka kapsuly. Otočí sa v smere hodinových ručičiek, až je cítiť ľahký odpor (asi 1,5 otáčky). Držiak kapsuly je teraz pripojený na aplikátor.
5. Aktivita kapsuly THERACAPu
131™ sa odmeria vložením aplikátora do ionizačnej komory.
6. Obráteným postupom sa kapsula vráti do oloveného kontajnera.
7. Ak je pripravené podanie chorému, postupuje sa podľa bodov 2, 3 a 4.
8. Chorý je požiadaný, aby jednoduchým stlačením odstránil plastové viečko na konci aplikátora.
9. Chorý môže kapsulu prehltnúť tak, že otvorený koniec aplikátora THERACAP
131™ si priloží na ústa k dolnej pere, aplikátor mierne nakloní do zvislej polohy a kapsula mu voľne vypadne do úst.
10. Pacient pred podaním kapsuly vypije malé množstvo vlažného nápoja. Kapsulu nerozhrýza. Po prehltnutí kapsuly vypije opäť malé množstvo vlažného nápoja.
Rádioaktivita
Aktivita kapsúl k 12:00 hod. SEČ každý deň pred (-) a po referenčnom dátume sa vypočíta vynásobením deklarovanej aktivity faktorom z tabuľky 1:
deň faktor
| deň faktor
|
- 6 1,677
| 5 0,650
|
- 5 1,539
| 6 0,596
|
- 4 1,412
| 7 0,547
|
- 3 1,295
| 8 0,502
|
- 2 1,188
| 9 0,460
|
- 1 1,090
| 10 0,422
|
0 1,000
| 11 0,387
|
1 0,971
| 12 0,355
|
2 0,842
| 13 0,326
|
3 0,772
| 14 0,299
|
4 0,708
|
|
DozimetriaÚdaje o absorbovanej radiačnej dávke po podaní jodidu (
131I) sodného sú prevzaté z ICRP 53, International Commision on Radiological Protection, Radiation Dose to Patients from Radiopharmaceuticals, Pergamon Press, 1988.
Model ICRP uvádza údaje pre intravenóznu aplikáciu. Tento model je použiteľný i pre perorálnu aplikáciu, pretože pri nej dochádza k rýchlej a úplnej absorpcii z tráviaceho traktu. Vzniká pri tom len väčšie radiačné zaťaženie steny žalúdka, ktoré je spôsobené vylučovaním v žalúdku a v slinných žľazách. Za predpokladu pôsobenia
131I v žalúdku v trvaní 0,5 hodiny sa absorbovaná dávka zvýši o 30 %.
Radiačná zaťaženie jednotlivých orgánov, ktoré nemusia byť cieľovými orgánmi terapie, môže byť ovplyvnené patofyziologickými zmenami, spôsobenými ich samotným ochorením.
Ako súčasť hodnotenia vzťahu riziko - úžitok sa odporúča urobiť výpočet efektívneho dávkového ekvivalentu (EDE) pre cieľový orgán pred aplikáciou
131I.
Aktivita sa potom môže upraviť podľa hmotnosti štítnej žľazy, biologického polčasu a „recyklačného“ faktora, ktorý berie do úvahy fyziologický stav chorého (vrátane deplécie jódu) a súvisiace patologické procesy.
JODIDBlokovaná štítna žľaza, vychytávanie 0 % 131I 8,04 dňa
Orgán Absorbovaná dávka na jednotku podanej aktivity (mGy/MBq)dospelý 15 rokov 10 rokov 5 rokov 1 rok
nadobličky 3,7.10
-2 4,2.10
-2 6,7.10
-2 1,1.10
-1 2,0.10
-1stena močového 6,1.10
-1 7,5.10
-1 1,1 1,8 3,4
mechúra
povrch kostí 3,2.10
-2 3,8.10
-2 6,1.10
-2 9,7.10
-2 1,9.10
-1prsná žľaza 3,3.10
-2 3,3.10
-2 5,2.10
-2 8,5.10
-2 1,7.10
-1GI trakt :
stena žalúdka 3,4.10
-2 4,0.10
-2 6,4.10
-2 1,0.10
-1 1,9.10
-1tenké črevo 3,8.10
-2 4,7.10
-2 7,5.10
-2 1,2.10
-1 2,2.10
-1hrubé črevo
-stena horná č. 3,7.10
-2 4,5.10
-2 7,0.10
-2 1,2.10
-1 2,1.10
-1-stena dolná č. 4,3.10
-2 5,2.10
-2 8,2.10
-2 1,3.10
-1 2,3.10
-1obličky 6,5.10
-2 8,0.10
-2 1,2.10
-1 1,7.10
-1 3,1.10
-1pečeň 3,3.10
-2 4,0.10
-2 6,5.10
-2 1,0.10
-1 2,0.10
-1pľúca 3,1.10
-2 3,8.10
-2 6,0.10
-2 9,6.10
-2 1,9.10
-1vaječníky 4,2.10
-2 5,4.10
-2 8,4.10
-2 1,3.10
-1 2,4.10
-1pankreas 3,5.10
-2 4,3.10
-2 6,9.10
-2 1,1.10
-1 2,1.10
-1červená kostná
dreň 3,5.10
-2 4,2.10
-2 6,5.10
-2 1,0.10
-1 1,9.10
-1slezina 3,4.10
-2 4,0.10
-2 6,5.10
-2 1,0.10
-1 2,0.10
-1semenníky 3,7.10
-2 4,5.10
-2 7,5.10
-2 1,2.10
-1 2,3.10
-1štítna žľaza 2,9.10
-2 3,8.10
-2 6,3.10
-2 1,0.10
-1 2,0.10
-1maternica 5,4.10
-2 6,7.10
-2 1,1.10
-1 1,7.10
-1 3,0.10
-1ostatné tkanivá 3,2.10
-2 3,9.10
-2 6,2.10
-2 1,0.10
-1 1,9.10
-1Efektívny dáv- 7,2.10-2 8,8.10-2 1,4.10-1 2,1.10-1 4,0.10-1kový ekvivalent(mSv/MBq)Stena močového mechúra prispieva k efektívnemu dávkovému ekvivalentu 50,8 %.
Efektívny dávkový ekvivalent je pri podaní 5,55 GBq dospelému človeku s vychytávaním štítnej žľazy 0% 399,6 mSv.
Neúplné blokovanie :Efektívny dávkový ekvivalent (mSv / MBq) s malým vychytávaním v štítnej žľaze.
vychytávanie 0,5 % 3,0.10-1 4,5.10-1 6,9.10-1 1,5 2,8
vychytávanie 1,0 % 5,2.10-1 8,1.10-1 1,2 2,7 5,3
vychytávanie 2,0 % 9,7.10-1 1,5 2,4 5,3 10,0
Vychytávanie štítnou žľazou 15 %Orgán Absorbovaná dávka na jednotku podanej aktivity (mGy/MBq)dospelý 15 rokov 10 rokov 5 rokov 1 rok
nadobličky 3,6.10
-2 4,3.10
-2 7,1.10
-2 1,1.10
-1 2,2.10
-1stena močového 5,2.10
-1 6,4.10
-1 9,8.10
-1 1,5 2,9
mechúra
povrch kostí 4,7.10
-2 6,7.10
-2 9,4.10
-2 1,4.10
-1 2,4.10
-1prsná žľaza 4,3.10
-2 4,3.10
-2 8,1.10
-2 1,3.10
-1 2,5.10
-1GI trakt :
stena žalúdka 4,6.10
-1 5,8.10
-1 8,4.10
-2 1,5 2,9
tenké črevo 2,8.10
-1 3,5.10
-1 6,2.10
-1 1,0 2,0
hrubé črevo
-stena horná č. 5,9.10
-2 6,5.10
-2 1,0.10
-1 1,6.10
-1 2,8.10
-1-stena dolná č. 4,2.10
-2 5,3.10
-2 8,2.10
-2 1,3.10
-1 2,3.10
-1obličky 6,0.10
-2 7,5.10
-2 1,1.10
-1 1,7.10
-1 2,9.10
-1pečeň 3,2.10
-2 4,1.10
-2 6,8.10
-2 1,1.10
-1 2,2.10
-1pľúca 5,3.10
-2 7,1.10
-2 1,2.10
-2 1,9.10
-1 3,3.10
-1vaječníky 4,3.10
-2 5,9.10
-2 9,2.10
-2 1,4.10
-1 2,6.10
-1pankreas 5,2.10
-2 6,2.10
-2 1,0.10
-1 1,5.10
-1 2,7.10
-1červená kostná
dreň 5,4.10
-2 7,4.10
-2 9,9.10
-2 1,4.10
-1 2,4.10
-1slezina 4,2.10
-2 5,1.10
-2 8,1.10
-2 1,2.10
-1 2,3.10
-1semenníky 2,8.10
-2 3,5.10
-2 5,8.10
-2 9,4.10
-2 1,8.10
-1štítna žľaza 2,1.10
-2 3,4.10
-2 5,1.10
-2 1,1.10
3 2,0.10
3maternica 5,4.10
-2 6,8.10
-2 1,1.10
-1 1,7.10
-1 3,1.10
-1ostatné tkanivá 6,5.10
-2 8,9.10
-2 1,4.10
-1 2,2.10
-1 4,0.10
-1Efektívny dáv- 6,6 1,0.10-1 1,5.10-1 3,4.10-1 6,2.10-1kový ekvivalent(mSv/MBq)Efektívny dávkový ekvivalent (EDE) pri podaní 5,55 GBq dospelým s 15 % vychytaním štítnou žľazou je 36,630 mSv.
Vychytávanie štítnou žľazou 35 %Orgán Absorbovaná dávka na jednotku podanej aktivity (mGy/MBq)dospelý 15 rokov 10 rokov 5 rokov 1 rok
nadobličky 4,2.10
-2 5,0.10
-2 8,7.10
-2 1,4.10
-1 2,8.10
-1stena močového 4,0.10
-1 5,0.10
-1 7,8.10
-1 1,2 2,3
mechúra
povrch kostí 7,6.10
-2 1,2.10
-1 1,6.10
-1 2,3 .10
-1 3,5.10
-1prsná žľaza 6,7.10
-2 6,6.10
-2 1,3.10
-1 2,2 .10
-1 4,0.10
-1GI trakt :
stena žalúdka 4,6.10
-1 5,9.10
-1 8,5.10
-2 1,5 3,0
tenké črevo 2,8.10
-1 3,5.10
-1 6,2.10
-1 1,0 2,0
hrubé črevo
-stena horná č. 5,8.10
-2 6,5.10
-2 1,0.10
-1 1,7.10
-1 3,0.10
-1-stena dolná č. 4,0.10
-2 5,1.10
-2 8,0.10
-2 1,3.10
-1 2,4.10
-1obličky 5,6.10
-2 7,2.10
-2 1,1.10
-1 1,7.10
-1 2,9.10
-1pečeň 3,7.10
-2 4,9.10
-2 8,2.10
-2 1,4.10
-1 2,7.10
-1pľúca 9,0.10
-2 1,2.10
-1 2,1.10
-1 3,3.10
-1 5,6.10
-1vaječníky 4,2.10
-2 5,7.10
-2 9,0.10
-2 1,4.10
-1 2,7.10
-1pankreas 5,4.10
-2 6,9.10
-2 1,1.10
-1 1,8.10
-1 3,2.10
-1červená kostná
dreň 8,6.10
-2 1,2.10
-1 1,6.10
-1 2,2.10
-1 3,5.10
-1slezina 4,6.10
-2 5,9.10
-2 9,6.10
-2 1,5.10
-1 2,8.10
-1semenníky 2,6.10
-2 3,2.10
-2 5,4.10
-2 8,9.10
-2 1,8.10
-1štítna žľaza 5,0.10
-2 7,9.10
-2 1,2.10
-3 2,6.10
3 4,7.10
3maternica 5,0.10
-2 6,3.10
-2 1,0.10
-1 1,6.10
-1 3,0.10
-1ostatné tkanivá 1,1.10
-1 1,6.10
-1 2,6.10
-1 4,1.10
-1 7,1.10
-1Efektívny dáv- 1,5.10 2,4.10 3,6.10 7,8.10 1,4.102kový ekvivalent(mSv/MBq)Efektívny dávkový ekvivalent (EDE) pri podaní 5,55 GBq dospelým s 35 % vychytaním štítnou žľazou je 83,250 mSv.
'
Vychytávanie štítnou žľazou 55 %Orgán Absorbovaná dávka na jednotku podanej aktivity (mGy/MBq)dospelý 15 rokov 10 rokov 5 rokov 1 rok
nadobličky 4,9.10
-2 5,8.10
-2 1,1.10
-1 1,7.10
-1 3,4.10
-1stena močového 2,9.10
-1 3,6.10
-1 5,4.10
-1 8,5.10 1,6
mechúra
povrch kostí 1,1.10
-1 1,7.10
-1 2,2.10
-1 3,2.10
-1 4,8.10
-1prsná žľaza 9,1.10
-2 8,9.10
-2 1,9.10
-1 3,1.10
-1 5,6.10
-1GI trakt :
stena žalúdka 4,6.10
-1 5,9.10
-1 8,6.10
-1 1,5 3,0
tenké črevo 2,8.10
-1 3,5.10
-1 6,2.10
-1 1,0 2,0
hrubé črevo
-stena horná č. 5,8.10
-2 6,7.10
-2 1,0.10
-1 1,8.10
-1 3,2.10
-1-stena dolná č. 3,9.10
-2 4,9.10
-2 7,8.10
-2 1,3.10
-1 2,4.10
-1obličky 5,1.10
-2 6,8.10
-2 1,0.10
-1 1,7.10
-1 2,9.10
-1pečeň 4,3.10
-2 5,8.10
-2 9,7.10
-2 1,7.10
-1 3,3.10
-1pľúca 1,3.10
-1 1,8.10
-1 3,0.10
-1 4,8.10
-1 8,0.10
-1vaječníky 4,1.10
-2 5,6.10
-2 9,0.10
-2 1,5.10
-1 2,7.10
-1pankreas 5,8.10
-2 7,6.10
-2 1,3.10
-1 2,1.10
-1 3,8.10
-1červená kostná
dreň 1,2.10
-1 1,8.10
-1 2,2.10
-1 2,9.10
-1 4,6.10
-1slezina 5,1.10
-2 6,8.10
-2 1,1.10
-1 1,7.10
-1 3,3.10
-1semenníky 2,6.10
-2 3,1.10
-2 5,2.10
-2 8,7.10
-2 1,7.10
-1štítna žľaza 7,9.10
-2 1,2.10
3 1,9.10
-3 4,1.10 7,4.10
3maternica 4,6.10
-2 6,0.10
-2 9,9.10
-2 1,6.10
-1 3,0.10
-1ostatné tkanivá 1,6.10
-1 2,4.10
-1 3,7.10
-1 5,9.10
-1 1,0
Efektívny dáv- 2,4.10 3,7.10 5,6.10 1,2.102 2,2.102kový ekvivalent(mSv/MBq)Efektívny dávkový ekvivalent (EDE) pri podaní 5,55 GBq dospelým s 55 % vychytaním štítnou žľazou je 133,200 mSv.
UPOZORNENIE
Je pravdepodobné, že väčšina chorých dostane po podaní tohto lieku vysokú radiačnú dávku.
Podanie vysokej dávky rádioaktívneho jódu môže spôsobiť výrazné nebezpečie pre okolie.
V závislosti od množstva podanej aktivity sa to môže bezprostredne týkať rodiny chorého, ktorý je liečený alebo i širokej verejnosti. Je potrebné dodržiavať vhodné bezpečnostné opatrenia týkajúce sa aktivity, ktorú pacient vylučuje, aby sa zabránilo akejkoľvek kontaminácii.
Aj pri širokom používaní rádioaktívneho jódu existuje u chorých pri liečbe benígnych ochorení štítnej žľazy málo dôkazov, týkajúcich sa zvýšeného výskytu rakoviny, leukémie alebo mutácií. Pri liečení detí a mladistvých sa musí brať do úvahy väčšia senzitivita tkaniva dieťaťa a väčšia predpokladaná dĺžka života týchto chorých.
Rovnako sa musí zvážiť riziko oproti iným možným spôsobom liečby. V jednej štúdii bol hlásený vyšší výskyt karcinómu močového mechúra u chorých, liečených pre malígne ochorenie štítnej žľazy dávkou
131I väčšou ako 3700 MBq. V inej štúdii bol hlásený mierny vzostup výskytu leukémie u chorých, ktorí dostali veľmi vysoké dávky. Súhrnná celková aktivita väčšia ako 25900 MBq nie je preto vhodná.
Zvláštnu pozornosť je treba venovať terapeutickému podaniu kapsúl s jodidom (
131I) sodným pacientom s významnou poruchou obličiek, kedy je nutné upraviť dávkovanie aktivít. V prevencii zápalu slinných žliaz ako možnej komplikácie liečby vysokými dávkami rádioaktívneho jódu sa odporúča zvýšený príjem potravín alebo nápojov, ktoré stimulujú vylučovanie slín (nápoje obsahujúce kyselinu citrónovú, sladkosti).
Strava s nízkym obsahom jódu, podávaná pred terapiou, uľahčí jeho vychytávanie vo funkčnom tkanive štítnej žľazy. Aby sa zabezpečilo dostatočné vychytávanie rádioaktívneho jódu, odporúča sa pred jeho podaním pri liečbe karcinómu štítnej žľazy prerušenie substitučnej liečby. Pre trijódtyronín sa odporúča doba 10 dní, pre tyroxín 6 týždňov.
Obdobne sa odporúča prerušenie liečby propyltiouracilom 5 dní pred aplikáciou rádioaktívneho jódu pri liečbe hypertyreóz. Podávanie týchto liečiv sa môže obnoviť niekoľko dní po aplikácii
131I.
1,3 %
131I sa rozpadá cez xenón (
131mXe) a tým môže byť následkom difúzie
131mXe prítomné v balení malé množstvo jeho aktivity. Odporúča sa preto cez noc transportný obal otvoriť, vybrať kapsulu a vetrať, aby sa absorbovaný
131mXe uvoľnil.
Uvoľňovanie aktivity jódu
131I z kapsuly sa môže obmedziť. Kontajner obsahuje vo viečku plastickú vložku s malým diskom z aktívneho uhlia, ktoré je schopné absorbovať jód unikajúci z kapsuly. Disk s aktívnym uhlím sa môže kontaminovať až na 1,3 MBq
131I. V dôsledku prítomnosti disku s aktívnym uhlím môže byť v balení len malé množstvo
131I (obvykle menej ako 1,5 kBq).
Toto rádiofarmakum môže byť dodávané, používané a podávané len oprávnenou osobou v určenom klinickom zariadení. Jeho dodávanie, skladovanie, používanie, manipulácia a rozdeľovanie musí byť v súlade s predpismi alebo príslušnými povoleniami kompetentných orgánov.
Rádiofarmaká musia byť pripravované spôsobom, ktorý vyhovuje požiadavkám radiačnej bezpečnosti a farmaceutickej kvality.
Potrebné je dodržiavať bezpečnostné opatrenia pri manipulácii s rádioaktívnymi látkami. V balení je priložená zvláštna informácia a inštrukcia na zaobchádzanie, používanie, skladovanie a likvidáciu tohto rádiofarmaka.
Predávkovanie
Táto látka je určená na podávanie kompetentnou osobou v nemocničnom zariadení. Riziko predávkovania je len teoretické. Spočíva v aplikácii nežiaduceho množstva rádioaktivity z nepozornosti. Radiačné zaťaženie pri predávkovaní je možné znížiť podaním látok blokujúcich štítnu žľazu, napr. chloristanu draselného, použitím emetík a podporou diurézy s častým vyprázdňovaním močového mechúra.
Podávanie u chorých s podozrením na ochorenie žalúdka
U chorých s podozrením na ochorenie žalúdka sa musí podávaniu kapsúl s jodidom (
131I) sodným venovať zvýšená pozornosť. Aby sa zabezpečil dobrý prechod kapsuly do žalúdka a hornej časti tenkého čreva, celá kapsula sa prehltne s potrebným množstvom tekutiny.
Odporúča sa súčasné použitie antagonistov H
2 receptorov alebo inhibítorov protónovej pumpy.
Pri aplikácii väčších aktivít, napríklad pri liečbe karcinómu štítnej žľazy, sa odporúčaným zvýšeným príjmom tekutín podporuje častejšie močenie s cieľom znížiť absorbovanú dávku pre močový mechúr.
Tehotenstvo a laktácia
Ženy v reprodukčnom veku: Ak je nevyhnutné podať rádiofarmakum žene vo fertilnom veku, vždy je nutné presvedčiť sa o tom, či nie je tehotná. Každá žena, ktorej vynechala menštruácia, sa má považovať za tehotnú, pokiaľ sa nepreukáže opak. Dovtedy sa majú používať len metódy bez využitia zdrojov ionizujúceho žiarenia.
V prípade diferencovaného karcinómu štítnej žľazy v tehotenstve by sa liečba rádioaktívnym jódom mala odložiť na dobu po skončení tehotenstva. Po aplikácii jodidu (
131I) sodného s aktivitou viac ako 1000 MBq sa ženám neodporúča tehotenstvo po dobu 4 mesiacov.
Tehotenstvo: Jodid (
131I) sodný je kontraindikovaný v tehotenstve (absorbovaná dávka na maternicu presahuje po podaní tejto látky 0,5 mGy a je v rozsahu 11 - 511 mGy). Štítna žľaza plodu počas druhého a tretieho trimestra koncentruje jód.
Dojčenie: Ak je aplikácia jodidu (
131I) sodného dojčiacim ženám nevyhnutná, je vzhľadom k možnému prieniku rádiofarmaka do materského mlieka nutné dojčenie prerušiť na dobu bližšie neurčenú.
Ovplyvnenie schopnosti viesť motorové vozidlá a obsluhovať stroje
Po použití tohto liečiva sa neočakáva žiadne ovplyvnenie schopnosti viesť motorové vozidlá a obsluhovať stroje.
Inkompatibility
Nie sú známe.
Táto rádioaktívna látka je určená na farmaceutické použitie. Pretože liek obsahuje malé množstvo chemických látok, je riziko z ich vlastností zanedbateľné pre osoby, ktoré s liekom manipulujú alebo ho podávajú okrem rizika z rádioaktívnych vlastností.
Aplikácie rádiofarmák predstavujú pre personál riziko vystavenia účinkom radiácie, kontaminácie stopami moča, zvratkov a pod. Pri používaní rádiofarmák a odstraňovaní odpadu je nutné dodržiavať príslušné predpisy pre ochranu zdravia pred ionizujúcim žiarením.
VAROVANIEČas použiteľnosti lieku je 14 dní od referenčného dátumu aktivity udanej na štítku.
BALENIEKaždá kapsula je uložená v polykarbonátovom puzdre. Kontajner má vo viečku malý disk s obsahom aktívneho uhlia, ktoré je schopné absorbovať jód unikajúci z kapsuly. Puzdro je v olovenom tienení.
Veľkosti balenia:
37 MBq, 74 MBq, 111 MBq, 148 MBq, 185 MBq, 222 MBq, 259 MBq, 296 MBq, 333 MBq, 370 MBq, 407 MBq, 444 MBq, 481 MBq, 518 MBq, 555 MBq, 592 MBq, 629 MBq, 666 MBq, 703 MBq, 740 MBq, 777 MBq, 814 MBq, 851 MBq, 888 MBq, 925 MBq, 962 MBq, 999 MBq, 1036 MBq, 1073 MBq, 1110 MBq, 1147 MBq, 1184 MBq, 1221 MBq, 1258 MBq, 1295 MBq, 1332 MBq, 1369 MBq, 1406 MBq, 1443 MBq, 1480 MBq, 1517 MBq, 1554 MBq, 1591 MBq, 1628 MBq, 1665 MBq, 1702 MBq, 1739 MBq, 1776 MBq, 1813 MBq, 1850 MBq, 1887 MBq, 1924 MBq, 1961 MBq, 1998 MBq, 2035 MBq, 2,220 GBq, 2,405GBq, 2,590 GBq, 2,775 GBq, 2,960 GBq, 3,145 GBq, 3,330 GBq, 3,515 GBq, 3,700 GBq, 3,885 GBq, 4,070 GBq, 4,255 GBq, 4,440 GBq, 4,625 GBq, 4,810 GBq, 4,995 GBq, 5,180 GBq, 5,365 GBq, 5,550 GBq.
UCHOVÁVANIELiek sa skladuje pri teplote do 25
0C. Neskladovať v mraze. Skladuje sa v súlade s národnými predpismi pre manipuláciu s rádioaktívnymi látkami.
DÁTUM POSLEDNEJ REVÍZIE TEXTU Apríl 2011