
e uvedenej frekvencie. Ak hladina ALT prekročí 1 x ULN alebo ak sa rozvinú symptómy alebo príznaky naznačujúce zlyhanie pečne (pretrvávajúca nevoľnosť, únava, apatia, anorexia, žltačka, tmavý moč, svrbenie, citlivosť v pravom hornom kvadrante), liečba sa musí ihneď prerušiť.
Pprerušenie liečby: U pacientov užívajúcich Tasmar, u ktorých sa prejavia známky akútneho poškodenia funkcie pečene a ktorí prestanú liek užívať, sa môže prejaviť zvýšené riziko poškodenia funkcie pečene, ak sa začne Tasmar užívať znova. Teda takíto pacienti nemajú prichádzať do úvahy pre opätovnú liečbu.
Neuroleptický malígny syndróm (NMS):
U pacientov s Parkinsonovou chorobou sa NMS zvyčajne pozoruje po prerušení alebo ukončení dopaminergnej liečby. Preto ak sa vyskytnú symptómy po znížení alebo prerušení liečby Tasmarom,
lekár má zvážiť zvýšenie dávky levodopy u pacienta (pozri časť 4.2).
Ojedinelé prípady NMS súviseli s liečbou Tasmarom. Symptómy vyskytujúce sa počas liečby alebo krátko po liečbe Tasmarom majú tendenciu vymiznúť. NMS je charakterizovaný motorickými symptómami (stuhnutosť, myoklónia a tras), zmenami mentálneho stavu (chvenie, zmätenosť, strnulosť a kóma), zvýšenou teplotou, autonómnou dysfunkciou (labilný krvný tlak, tachykardia) a zvýšenými sérovými hladinami kreatínfosfokinázy (CPK), čo môže byť následkom myolýzy. NMS sa má diagnostikovať, iba ak nie sú prítomné všetky vyššie spomenuté príznaky.
Pred začatím liečby: Na zníženie rizika NMS sa pacientom s ťažkou formou dyskinézy alebo predchádzajúcim NMS vrátane rabdomyolýzy a hypertermie Tasmar nemá predpisovať (pozri časť
4.3). U pacientov užívajúcich viaceré lieky s účinkom na rôzne dráhy centrálneho nervového systému (CNS) (napríklad antidepresíva, neuroleptiká, anticholínergné lieky) sa môže vyskytnúť vyššie riziko rozvoja NMS.
Poruchy kontroly impulzov: Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi a/alebo inou dopamínovou liečbou, ako je Tasmar v spojení s levodopou sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, hltavé jedenie a chorobné jedenie. Ak sa vyvinú takéto symptómy odporúča sa kontrola liečby.
Dyskinéza,nevoľnosťaďalšie nežiaduce reakcie spojené s užívaním levodopy: U pacientov sa môže v súvislosti s užívaním levodopy prejaviť nárast nežiaducich reakcií. Zníženie dávky levodopy (pozri časť 4.2) môže často zmierniť tieto nežiaduce reakcie.
Hnačka: Na základe klinických skúšaní sa zistilo, že u 16% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 18% pacientov užívajúcich Tasmar 200 mg trikrát denne sa objavila hnačka
v porovnaní s 8% pacientov, ktorí dostávali placebo. Hnačka spojená s užívaním Tasmaru sa zvyčajne
začala 2 až 4 mesiace po začatí liečby. Hnačka viedla u 5% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 6% pacientov užívajúcich Tasmar 200 mg trikrát denne k zastaveniu liečby
v porovnaní s 1% pacientov, ktorí dostávali placebo.
Interakcia s benserazidom: Následkom interakcie medzi vysokou dávkou benserazidu a tolkapónu (má za následok zvýšené hladiny benserazidu) si má lekár – kým sa nezíska viac skúseností, všímať nežiaduce reakcie v súvislosti s dávkou (pozri časť 4.5).
Inhibítory MAO-A: Tasmar sa namá podávať spolu s neselektívnymi inhibítormi monoaminooxidázy (MAO) (napr. fenelzín a tranylcypromín). Kombinácia s inhibítormi MAO-A a MAO-B je ekvivalentná s nonselektívnym MAO inhibíciou, pretože sa nemusia byť obaja podávané spoločne
s Tasmarom a liekmi s levodopou (pozri tiež časť 4.5). Použitie selektívnych MAO-B inhibítorov
nemusí byť vyššie ako odporučené dávky (napr. selegilín 10 mg/deň) keď sú spoločne podávané
s Tasmarom.
Warfarín: Keďže klinické informácie týkajúce sa kombinácie warfarínu a tolkapónu sú obmedzené,
majú sa sledovať parametre koagulácie, keď sa tieto lieky podávajú spoločne.
Špeciálne skupiny: Pacienti s ťažkým poškodením funkcie obličiek (klírens kreatinínu < 30 ml/min) musia byť liečení s opatrnosťou. V tejto populácii nie sú dostupné informácie o tolerancii tolkapónu (pozri časť 5.2).
Intolerancia laktózy: Tasmar obsahuje laktózu. Pacienti s hereditárnymi problémami intolerancie galaktózy, Lappovou deficienciou laktózy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Tasmar, ako inhibítor COMT je známy tým, že zvyšuje biologickú dostupnosť spoločne s podávanou levodopou. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergným nežiaducim reakciám, pozorovaných po liečbe s inhibítormi COMT. Najčastejšie sú zvýšená dyskinézia, nauzea, vracanie, bolesť brucha, synkopa, ortostatické ťažkosti, zápcha, poruchy spánku, ospalosť, halucinácie.
Levodopa sa spája s nespavosťou a epizódami náhleho nástupu spánku. Veľmi zriedkavo bol popísaný náhly nástup spánku počas denných aktivít, v niektorých prípadoch uvedomenia si alebo bez známok upozornenia. Počas liečby levodopou sa pacienti musia o tomto informovať a poradiť im cvičenia počas vedenia vozidiel alebo pri obluhovaní strojov. Pacienti, ktorí trpia ospalosťou a/alebo
epizódami náhleho spánku sa musia vyhnúť vedenie vozidiel alebo obsluhovaniu strojov (pozri časť
4.7). Navyše sa má uvažovať o znížení dávky levodopy alebo o ukončení liečby.
Katecholamíny a ďalšielieky metabolizované katechol-O-metyltransferázou (COMT): Tolkapón môže mať vplyv na farmakokinetiku liekov metabolizovaných pomocou COMT. Na farmakokinetiku substrátu COMT karbidopa sa nepozorovali žiadne účinky. Pozorovala sa interakcia s benserazidom, ktorá môže viesť k zvýšeným hladinám benserazidu a jeho aktívneho metabolitu. Rozsah tohto účinku bol závislý od dávky benserazidu. Plazmatické koncentrácie benserazidu pozorované po podaní tolkapónu a benserazidu-25 mg/levodopy boli stále v rozsahu hodnôt pozorovaných pri podávaní samotnej levodopy/benserazidu. Na druhej strane po podaní tolkapónu a benserazidu-50 mg/levodopy plazmatické koncentrácie benserazidu by mohli byť vyššie ako hladiny, ktoré sa zvyčajne pozorujú pri podávaní samotného levodopa/benserazidu. Účinok tolkapónu na farmakokinetiku ďalších liekov metabolizovaných pomocou COMT, napríklad α-metyldopa, dobutamínu, apomorfínu, adrenalínu a izoprenalínu nebol vyhodnotený. Lekár, ktorý liek predpisuje, si má všímať nežiaduce reakcie spôsobené podľa očakávania zvýšenými plazmatickými hladinami týchto liekov, keď sa kombinujú
s Tasmarom.
Účinoktolkapónu na metabolizmus iných liekov: Tolkapón vzhľadom na afinitu k cytochrómu CYP2C9 in vitro môže interferovať s liekmi, ktorých klírens je závislý od tejto metabolickej cesty, napríklad s tolbutamínom a warfarínom. V jednej štúdii o interakciách tolkapón nezmenil farmakokinetiku tolbutamínu. Preto sa klinicky významné interakcie zahŕňajúce cytochróm CYP2C9 zdajú nepravdepodobné.
Keďže klinické informácie týkajúce sa kombinácie warfarínu a tolkapónu sú obmedzené, majú sa
sledovať parametre koagulácie, keď sa tieto lieky podávajú spoločne.
Lieky, ktoré zvyšujú hladinu katecholamínov: Keďže tolkapón interferuje s metabolizmom katecholamínov, interakcie s ďalšími liekmi, ktoré ovplyvňujú hladiny katecholamínov, sú teoreticky možné.
Keď sa Tasmar podával spolu s levodopa/karbidopa a desipramínom, v krvnom tlaku, v pulzovej frekvencii ani v plazmatických koncentráciách desipramidu nenastala významná zmena. Frekvencia nežiaducich reakcií sa celkovo slabo zvýšila. Tieto nežiaduce účinky boli predvídateľné na základe známych nežiaducich reakcií na každý z týchto troch liekov jednotlivo. Preto je potrebná opatrnosť, keď sa silné inhibítory absorpcie noradrenalínu, napríklad desipramín, maprotilín alebo venlafaxin podávajú pacientom s Parkinsonovou chorobou, ktorí sú liečení Tasmarom a liekmi obsahujúcimi levodopu.
V klinických štúdiách pacienti užívajúci Tasmar/levodopa pozorovali podobné nežiaduce reakcie, bez
ohľadu na to, či súčasne dostávali alebo nedostávali selegilín (a MAO-B-inhibítor).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití tolkapónu u gravidných žien. Tasmar sa má použiť počas gravidity len ak potenciálny prínos preváži potenciálne riziko pre plod.
Laktácia
Štúdie na zvieratách dokázali vylučovanie tolkapónu do materského mlieka.
Bezpečnosť tolkapónu u dojčiat nie je známa; preto ženy, ktoré sú liečené Tasmarom nemajú dojčiť.
Fertilita
Po podaní tolkapónu potkanom a králikom sa pozorovala embryofetálna toxicita (pozri časť 5.3). Nie
je známe potenciálne riziko u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Neexistuje žiaden dôkaz na základe klinických štúdií, že Tasmar má nežiaduci vplyv na pacientovu schopnosť viesť vozidlá a obsluhovať stroje. Avšak pacientov treba informovať, že ich schopnosť viesť vozidlá a obsluhovať stroje môže byť narušená symptómami Parkinsonovej choroby.
Tasmar, ako inhibítor COMT je známy tým, že zvyšuje biologickú dostupnosť spoločne s podávanou levodopou. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergným vedľajším účinkom , pozorovaných po liečbe s inhibítormi COMT. Pacienti liečení levodopou a s prítomnosťou ospanlivosti a/alebo epizód náhleho spánku sa musia informovať aby sa vyhli vedeniu vozidiel alebo vykonávaniu aktivít, kde poškodenie bdelosti môže viesť k vážnemu poraneniu alebo smrti (napr. obsluha strojov) pokiaľ nie sú rekurentné epizódy a ospanlivosť odstránené (pozri tiež časť 4.4).
4.8 Nežiaduce účinkyNajčastejšie pozorovanými nežiaducimi reakciami spojenými s užívaním Tasmaru, ktoré boli frekventovanejšie ako v skupine pacientov, ktorí dostávali placebo, sú uvedené v tabuľke nižšie. Tasmar ako COMT inhibítor je však známy, že zvyšuje biologickú dostupnosť spolupodávanej levodopy. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergickým vedľajším účinkom, ktoré boli pozorované po liečbe COMT inhibítormi. Najbežnejšie z nich sú dyskinéza, nevoľnosť, vracanie, bolesť brucha, mdloby, ťažkosti s vylučovaním, poruchy spánku, ospalosť, halucinácie.
Jedinou nežiaducou reakciou v klinických štúdiách, ktorá viedla obvykle k prerušeniu liečby
Tasmarom, bola hnačka (pozri časť 4.4).
Veľmi časté (≥1/10)
Časté (≥1/100 až <1/10)
Menej časté (≥1/1 000 až <1/100) Zriedkavé (≥1/10 000 až <1/1 000)
Veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov)
Skúsenosti s Tasmarom získané na základe paralelných randomizovaných štúdií s použitím placeba ako kontroly u pacientov s Parkinsonovou chorobou sú uvedené v nasledujúcej tabuľke, ktorá udáva nežiaduce účinky s potenciálnym vzťahom k užívaniu Tasmaru.
Súhrn možných nežiaducich reakcií spojených s Tasmarom, s približnou mierou incidencie v III. fáze placebom kontrolovaných štúdií:
Trieda orgánových systémov
| Incidencia
| Nežiaduce udalosti
|
|
|
|
Infekcie a nákazy
| Časté
| Infekcie horných dýchacích
ciest
|
Psychické poruchy
| Veľmi časté
| Poruchy spánku
|
|
| Nadmerné snívanie
|
|
| Ospalosť
|
|
| Zmätenosť
|
|
| Halucinácie
|
| Zriedkavé
| Poruchy kontroly impulzov*
(Zvýšené libido, hypersexualita, patologické hráčstvo, chorobné míňanie alebo nakupovanie, hltavé jedenie, chorobné prejedanie sa (pozri časť 4.4)).
|
T
rieda orgánových systémov
|
Incidencia
|
N
ežiaduce udalosti
|
|
|
|
Infekcie a nákazy
|
Časté
|
Infekcie horných dýchacích
ciest
|
Poruchy nervového systému
|
Veľmi časté
|
Dyskinéza
|
|
|
Dystónia
|
|
|
Bolesti hlavy
|
|
|
Závrat
|
|
|
Somnolencia
|
|
|
Ortostatické ťažkosti
|
|
Veľmi zriedkavé
|
Symptómy komplexu
neuroleptického malígneho
syndrómu (pozri časť 4.4)
|
|
Časté
|
Hypokinéza
|
|
|
|
|
|
Synkopa
|
|
|
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
|
Nauzea
|
|
|
Diarea
|
|
Časté
|
Vracanie
|
|
|
Zápcha
|
|
|
Suchosť v ústach
|
|
|
Brušné bolesti
|
|
|
Poruchy trávenia
|
Poruchy metabolizmu a výživy
|
Veľmi časté
|
Anorexia
|
Poruchy kože a podkožného tkaniva
|
Časté
|
Zvýšené potenie
|
Poruchy obličiek a močových ciest
|
Časté
|
Zafarbenie moču
|
Celkové poruchy a reakcie v mieste
podania
|
Časté
|
Bolesti v hrudníku
|
|
|
Ochorenie podobné chrípke
|
Poruchy pečene a žlčových ciest
|
Menej časté
|
Poškodenie pečene, v
zriedkavých prípadoch so
smrteľným následkom* (pozri časť 4.4)
|
Laboratórne a funkčné vyšetrenia
|
Časté
|
Zvýšenie
alanínaminotransferázy
(ALT)
|
*: Nežiaduce účinky, pre ktoré nemožno určiť frekvenciu z klinických štúdií (t.j.
t
a
m
, kde sa špecifická nežiaduca reakcia nepozorovala v klinických štúdiách, no hlásila sa po uvedení lieku na trh) sú označené hviezdičkou (*) a kategógie frekvencií sa vypočítali pomocou EU smerníc.
Z
výšenie alanínaminotransferázy
U 1% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 3% pacientov užívajúcich Tasmar
200 mg trikrát denne sa pozorovalo viac ako trojnásobné zvýšenie hornej hranice normálu (ULN)
alanínaminotransferázy (ALT). Toto zvýšenie bolo približne dvakrát pravdepodobnejšie u žien. Nárast sa zvyčajne objavil po 6 až 12 týždňoch od začiatku liečby a nebol spojený so žiadnymi klinickými príznakmi alebo symptómami. Asi v polovici prípadov sa hladiny transamináz spontánne vrátili
k východiskovým hodnotám, zatiaľ čo pacienti pokračovali v liečbe Tasmarom. U ostatných sa po prerušení liečby hladiny transamináz vrátili k hodnotám pred liečbou.
Poškodenie
pečene
Počas užívania lieku sa vyskytli zriedkavé prípady ťažkého poškodenia buniek pečene s následkom
smrti (pozri časť 4.4).
Symptómy komplexu neuroleptického malígneho syndrómuOjedinelé prípady pacientov so symptómami pripomínajúcimi symptomatický komplex neuroleptického malígneho syndrómu (pozri časť 4.4) sa pozorovali po znížení dávky Tasmaru alebo po prerušení liečby a po opätovnej liečbe Tasmarom, čo bolo sprevádzané významným znížením dávky ďalších súčasne podávaných dopaminergných liekov. Okrem sekundárnej NMS alebo ťažkej dyskinézy sa vyskytla rabdomyolýza.
Zmenafarbymoču: Tolkapón a jeho metabolity sú žlté a môžu spôsobiť neškodné zintenzívnenie
farby pacientovho moču.
Poruchy kontroly impulzov: U pacientov liečených dopamínovými agonistmi a/alebo inou dopamínovou liečbou, ako je Tasmar v spojení s levodopou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, hltavé jedenie a chorobné prejedanie sa (pozri časť 4.4. Osobitné upozornenia a opatrenia pri používaní).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieBoli popísané prípady náhodného alebo zámerného predávkovania tabletami tolkapónu. Klinické okolnosti v týchto prípadoch však boli tak rozmanité, že sa nemôže urobiť celkový záver z týchto prípadov.
V týždňovej štúdii bola najvyššia dávka tolkapónu 800 mg trikrát denne podávaná zdravým starším dobrovoľníkom súčasne s levodopou alebo bez levodopy. Maximálne plazmatické koncentrácie tolkapónu pri tejto dávke boli priemerne 30 μg/ml (v porovnaní s 3 a 6 μg/ml pri dávke tolkapónu
100 mg trikrát denne a 200 mg trikrát denne). Pozorovala sa nevoľnosť, vracanie a závraty, najmä
v kombinácii s levodopou.
Liečbapredávkovania: Odporúča sa hospitalizácia. Je indikovaná všeobecná podporná liečba. Vzhľadom na fyzikálnochemické vlastnosti tejto zlúčeniny nie je hemodialýza pravdepodobne potrebná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiparkinsoniká, iné dopaminergické liečivá, ATC kód: NO4BX01
Mechanizmus účinkuTolkapón je perorálne aktívny, selektívny a reverzibilný inhibítor katechol-O-metyltransferázy
(COMT). Súčasné podávanie s levodopou a inhibítorom dekarboxylázy aromatických aminokyselín
(AADC-I) vedie k stabilnejším plazmatickým hladinám levodopy redukciou metabolizmu levodopy na
3-metoxy-4-hydroxy-L-fenylalanín (3-OMD).
U pacientov s Parkinsonovou chorobou sú vysoké hladiny plazmatického 3-OMD spojené so slabou
odpoveďou na levodopu. Tolkapón značne znižuje tvorbu 3-OMD.
Farmakodynamické
účinky
Štúdie vykonané u zdravých dobrovoľníkov ukázali, že tolkapón po perorálnom podaní reverzibilne inhibuje aktivitu COMT v ľudských erytrocytoch. Táto inhibícia je úzko spätá s plazmatickou koncentráciou tolkapónu. Pri dávke 200 mg tolkapónu je maximálna inhibícia aktivity COMT
v erytrocytoch priemerne vyššia ako 80 %. Pri dávke Tasmaru 200 mg trikrát denne je inhibícia
COMT v erytrocytoch 30 až 45 %, bez rozvinutia tolerancie.
Prechodné zvýšenie nad hladiny aktivity COMT v erytrocytoch pred liečbou bolo pozorované po ukončení liečby tolkapónom. Štúdia vykonaná u pacientov s Parkinsonovou chorobou však potvrdila, že po prerušení liečby nenastala žiadna významná zmena vo farmakokinetike levodopy ani v odpovedi pacientov na levodopu v porovnaní s hladinami pred liečbou.
Keď sa Tasmar podáva spolu s levodopou, zvyšuje sa relatívna biologická dostupnosť (AUC) levodopy približne dvojnásobne. To je zapríčinené poklesom klírensu L-dopa, čo má za následok predĺženie polčasu terminálnej eliminácie
(t1/2) levodopy. To vo všeobecnosti nemalo vplyv na priemernú maximálnu plazmatickú koncentráciu levodopy
(Cmax) ani na čas výskytu
(tmax). Začiatok tohto účinku sa pozoruje po prvom podaní lieku. Štúdie vykonané u zdravých dobrovoľníkov a u pacientov s Parkinsonovou chorobou potvrdili, že maximálny účinok sa pozoruje pri dávke 100 -
200 mg tolkapónu. Plazmatické hladiny 3-OMD značne klesali v závislosti od dávky tolkapónu, keď sa podával spolu s levodopou/AADC-1 (inhibítor dekarboxylázy aromatických aminokyselín) (benserazid alebo karbidopa).
Účinok tolkapónu na farmakokinetiku levodopy je podobný pri všetkých liekových formách levodopa/benserazid a levodopa/karbidopa. Je závislý od dávky levodopy, od pomeru levodopy/AADC-I (benserazid alebo karbidopa) a od použitia liekových foriem s nepretržitým uvoľňovaním.
Klinická účinnosťabezpečnosť:Dvojito zaslepené kontrolované štúdie s placebom ukázali významné zníženie času bez účinku
približne o 20 - 30 % a podobný nárast času s účinkom, čo bolo sprevádzané redukciou závažnosti
symptómov u fluktuujúcich pacientov užívajúcich Tasmar. Celkové vyhodnotenie účinnosti podľa
skúšajúcich tiež dokázalo významné zlepšenie.
Dvojito zaslepená štúdia porovnávala Tasmar s entakaponom u pacientov s Parkinsonovou chorobou, u ktorých bol počas jedného dňa najmenej trojhodinový čas bez účinku, zatiaľ čo dostávali optimalizovanú liečbu levodopou. Primárnym výsledkom bol pomer pacientov s jednohodinovým alebo viachodinovým časom účinku (pozri tabuľku 1).
Tab. 1: Primárny a sekundárny koncový ukazovateľ a následná analýza dvojito zaspelenej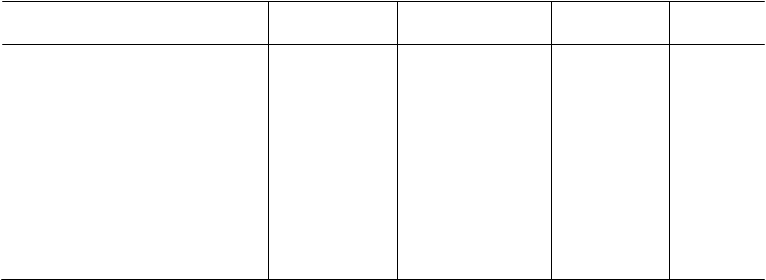 štúdie
štúdie
| Entakapon
N = 75
| Tolkapón
N = 75
| p-hodnota
| 95 % IS
|
Primárny koncový ukazovateľ
Počet (pomer) ≥ jednohodinovou
odpoveďou Sekundárny koncový ukazovateľ
Počet (pomer) so stredným alebo
značným zlepšením
|
32 (43 %)
19 (25 %)
|
40 (53 %)
29 (39 %)
|
p = 0,191
p = 0,080
|
-5,2; 26,6
-1,4; 28,1
|
Počet (pomer) u oboch zlepšení
pri primárnom a sekundárnom
koncovom ukazovateľovi
|
13 (17 %)
|
24 (32 %)
|
NA
|
NA
|
5.2 Farmakokinetické vlastnosti
Farmakokinetika tolkapónu je v terapeutickom rozsahu lineárna a nezávisí od súčasného podávania
levodopy/AADC-1 (benserazid alebo karbidopa).
Absorpcia: Tolkapón sa rýchlo absorbuje, pričom tmax je približne 2 hodiny. Absolútna biologická dostupnosť pri perorálnom podávaní je okolo 65 %. Tolkapón sa pri dávkovaní 100 mg trikrát denne alebo 200 mg trikrát denne neakumuluje. Pri takomto dávkovaní je Cmax približne 3 a 6 μg/ml. Jedlo spomaľuje a znižuje absorpciu tolkapónu, avšak relatívna biologická dostupnosť dávky tolkapónu prijatého s jedlom je stále 80 až 90 %.
Distribúcia: Distribúčný objem (Vss) tolkapónu je malý (9 l). Tolkapón sa nedistribuuje vo veľkom rozsahu do tkanív, pretože sa vo veľkej miere viaže na plazmatické proteíny (> 99,9 %). Pokusy in vitro dokázali, že tolkapón sa viaže zvlášť na sérový albumín.
Biotransformácia/Eliminácia: Tolkapón je takmer úplne metabolizovaný pred vylúčením. V moči sa zistilo nezmenené len veľmi malé množstvo (0,5% dávky). Hlavnou metabolickou dráhou tolkapónu
je konjugácia s inaktívnym glukuronidom. Okrem toho táto zlúčenina je metylovaná pomocou COMT na 3-O-metyl-tolkapón a metabolizovaná pomocou cytochrómov P450 3A4 a P450 2A6 na primárny alkohol (hydroxylácia metylovej skupiny), ktorý je potom oxidovaný na kyselinu karboxylovú.
Redukcia na predpokladaný amín ako aj následná N-acetylácia sa vyskytuje v malom rozsahu. Po perorálnom podaní sa 60 % látky spojenej s liekom vylúči močom a 40 % stolicou.
Tolkapón je liek s nízkym pomerom extrakcie (pomer extrakcie = 0,15), so stredným systémovým klírensom približne 7 l/h,t1/2 tolkapónu je približne 2 hodiny.
Poškodeniepečene: Pre riziko poškodenia pečene, ktoré sa pozorovalo po uvedení lieku na trh, je Tasmar kontraindikovaný u pacientov s ochorením pečene alebo so zvýšenými hladinami pečeňových enzýmov. Jedna štúdia vykonaná u pacientov s poškodením pečene dokázala, že stredne závažné necirhotické ochorenie pečene nemalo žiadny vplyv na farmakokinetiku tolkapónu. Avšak u pacientov so stredne závažným cirhotickým ochorením pečene bol klírens neviazaného tolkapónu znížený
takmer o 50 %. Toto zníženie môže viesť k dvojnásobnému zvýšeniu priemernej koncentrácie neviazaného lieku.
Poškodenieobličiek: Farmakokinetika tolkapónu nebola skúmaná u pacientov s poškodením obličiek. Avšak bol skúmaný vzťah funkcie obličiek a farmakokinetiky tolkapónu s využitím farmakokinetiky populácií počas klinických štúdií. Údaje od viac ako 400 pacientov potvrdili, že nad širokým
rozsahom hodnôt klírensu kreatinínu (30 – 130 ml/min) farmakokinetika tolkapónu nebola ovplyvnená
funkciou obličiek. To sa dá vysvetliť skutočnosťou, že do moču sa vylúči len zanedbateľné množstvo
nezmeneného tolkapónu a hlavný metabolit tolkapón-glukuronid sa vylúči do moču a žlče (stolica).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Karcinogenéza, mutagenéza: Na základe 24-mesačnej štúdie karcinogenicity sa dokázalo, že u 3 % a
5 % potkanov rozdelených do skupín so strednou a vysokou dávkou sa vyskytli obličkové epiteliálne
nádory (adenómy alebo karcinómy). V štúdii karcinogenicity sa nenašiel v skupine s nízkou dávkou žiadny náznak renálnej toxicity. V štúdii karcinogenicity sa zistil zvýšený výskyt uterinných adenokarcinómov v skupine potkanov s vysokou dávkou lieku.V štúdii karcinogenicity na myšiach alebo psoch sa nezískali žiadne renálne nálezy.
Mutagenéza: Na základe úplnej série štúdií o mutagenicite sa dokázalo, že tolkapón nie je genotoxický.
Reprodukčnátoxicita: Dokázalo sa, že keď sa tolkapón podáva samotný, nemá teratogénne účinky ani žiadne účinky na plodnosť.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
J
adro tablety:
Hydrogenfosforečnan vápenatý (bezvodý)
Mikrokryštalická celulóza
Povidón K30
Sodná soľ karboxymetylškrobu
Laktóza
Mastenec
Magnéziumstearát
Film tablety: Hydroxypropylmetylcelulóza Mastenec
Žltý oxid železitý (E172) Etylcelulóza
Oxid titaničitý (E171) Triacetín Nátriumlaurylsulfát
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
5 rokov
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Tasmar je dostupný v PVC/PE/PVDC blistroch (balenie obsahuje 30 alebo 60 filmom obalených tabliet) a v sklenených fľašiach jantárovej faby bez vysúšadla (balenie obsahuje 30, 60, 100 alebo multibalenie obsahuje 200 [2 balenia po 100] filmom obalených tabliet).
6.6 Pokyny na použitie a zaobchádzanie s liekom
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Meda AB Pipers väg 2A
S-170 09 Solna
Švédsko
8. REGISTRAČNÉ ČÍSLA
EU/1/97/044/001-3, 7-9
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej regitrácie: 27. august 1997
Dátum predĺženia registrácie: 31. august 2004
Dátum posledného predĺženia registrácie: 31. august 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Tasmar 200 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 200 mg tolkapónu.
Pomocné látky so známym účinkom: Každá tableta obsahuje 15 mg laktózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta.
Oranžovo žltá až hnedo žltá, hexagonálna, bikonvexná filmom obalená tableta. Na jednej strane sú vyryté nápisy „TASMAR“ a „200“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Tasmar je indikovaný v kombinácii s levodopou/benserazidom alebo levodopou/karbidopa na použitie u pacientov s idiopatickou Parkinsonovou chorobou a motorickými fluktuáciami, ktorí reagujú na liečbu levodopy a ktorí nereagujú na iné inhibítory katechol-O-metyltransferázy COMT alebo ich netolerujú (pozri časť 5.1). V dôsledku rizika potenciálne fatálneho akútneho poškodenia funkcie pečene sa Tasmar nemá považovať za doplnkovú liečbu prvej línie k liečbe levodopa/benserazidom alebo levodopa/karbidopa (pozri časti 4.4 a 4.8).
Keďže Tasmar sa má používať len v kombinácii s levodopou/benserazidom a levodopou/karbidopou, informácie o predpisovaní liekov obsahujúcich levodopu sú aplikovateľné aj pri ich súbežnom používaní s Tasmarom.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Pediatrická populáciaTasmar sa neodporúča používať u detí do veku 18 rokov z dôvodu
nedostatočných údajov o bezpečnosti alebo účinnosti. Nie je náležitá indikácia na použitie u detí a
dospievajúcich.
Starší pacienti
U starších pacientov sa neodporúča upraviť dávkovanie Tasmaru.
Pacienti s poškodením pečene (pozri časť 4.3)
Tasmar je kontraindikovaný u pacientov s ochorením pečene alebo so zvýšenými pečeňovými
enzýmami.
Pacienti s poškodením obličiek (pozri časť 5.2)
U pacientov s miernym alebo stredne závažným poškodením obličiek (klírens kreatinínu je 30 ml/min alebo vyšší) sa neodporúča upraviť dávkovanie Tasmaru. Pacienti so závažným poškodením obličiek (klírens kreatinínu <30 ml/min) sa majú liečiť s opatrnosťou. V týchto skupinách nie sú dostupné žiadne informácie o znášanlivosti tolkapónu (pozri časť 5.2)
Spôsob podávania
Podávanie Tasmaru môžu predpísať len lekári, ktorí majú skúsenosti s liečbou pokročilej
Parkinsonovej choroby a ktorí budú na liečbu dozerať.
Tasmar sa podáva perorálne trikrát denne.
Tasmar sa môže užívať s jedlom alebo bez jedla (pozri časť 5.2).
Tablety Tasmaru sú obalené filmom a majú sa prehltnúť celé, pretože tolkapón má horkú chuť. Tasmar sa môže kombinovať so všetkými liekovými formami levodopa/benserazid a
levodopa/karbidopa (pozri tiež časť 4.5).
Prvá denná dávka Tasmaru sa musí užiť spolu s prvou dennou dávkou lieku obsahujúceho levodopu a ďalšie dávky musia byť podané približne o 6 a 12 hodín neskôr. Tasmar sa môže užívať s jedlom alebo bez jedla (pozri časť 5.2).
Odporučená dávka Tasmaru je 100 mg trikrát denne, vždy ako doplnok k liečbe levodopa/benserazidom alebo levodopa/karbidopa. Dávkovanie sa môže zvýšiť na 200 mg trikrát denne len za výnimočných okolností, keď očakávaný zvýšený klinický účinok preváži zvýšené riziko účinkov na pečeň (pozri časti 4.4 a 4.8). Ak sa u pacienta pri dávke 200 mg neprejaví do 3 týždňov od začatia liečby (bez ohľadu na dávku) očakávaný zvýšený účinok, liečba Tasmarom sa má prerušiť. Keďže neexistuje dôkaz ďalšieho účinku pri vyšších dávkach, maximálna terapeutická dávka 200 mg trikrát denne sa nemá prekročiť.
Funkcia pečene sa musí skontrolovať pred začatím liečby Tasmarom a potom každé dva týždne počas prvého roka liečby, každé 4 týždne počas ďalších 6 mesiacov a potom každých 8 týždňov. Ak sa dávka zvýši na 200 mg trikrát denne, hladina pečeňových enzýmov sa musí skontrolovať pred zvýšením dávky a potom podľa vyššie uvedenej frekvencie. (pozri časti 4.4 a 4.8).
Liečba Tasmarom sa musí ukončiť ak ALT (alanínaminotransferáza) a/alebo AST (aspartátaminotransferáza) prevýši hornú hranicu normálu alebo symptómy alebo znaky predpokladajú zlyhanie pečene (pozri časť 4.4).
ÚpravadávkovanialevodopypočasliečbyTasmarom:
Na začiatku liečby Tasmarom sa môžu vyskytnúť vedľajšie účinky zapríčinené zvýšenými
koncentráciami levodopy, pretože Tasmar redukuje rozpad levodopy v tele. Na základe klinických skúšok sa zistilo, že viac ako 70% pacientov si vyžadovalo zníženie dennej dávky levodopy, ak ich
denná dávka levodopy bola >600 mg alebo ak pacienti mali pred začatím liečby dyskinézu strednej
alebo závažnej intenzity.
Priemerné zníženie dennej dávky levodopy u pacientov vyžadujúcich si zníženie dávky bolo asi 30%. Pri začatí liečby Tasmarom, musia byť všetci pacienti informovaní o symptómoch vyskytujúcich sa pri veľmi vysokej dávke levodopy a o tom, čo treba v takom prípade robiť ak sa objavia.
Úpravadávkovanialevodopy,keďsaprerušíliečbaTasmarom:
Nasledovné návrhy sa zakladajú na farmakologických úvahách a neboli vyhodnotené v klinických
štúdiách. Dávku levodopy netreba znižovať, keď sa liečba Tasmarom preruší z dôvodu vedľajších účinkov zapríčinených príliš veľkou dávkou levodopy. Ak však bola liečba Tasmarom prerušená
z iných dôvodov ako je príliš veľká dávka levodopy, dávku levodopy bude možno potrebné zvýšiť na hladiny ekvivalentné alebo vyššie ako pred začiatkom liečby Tasmarom, najmä ak mal pacient veľmi zníženú dávku levodopy pri začiatku liečby Tasmarom. Pacienti musia byť v každom prípade
sledovaní a poučení o symptómoch vyskytujúcich sa pri príliš malej dávke levodopy a o tom, čo treba
v takom prípade robiť. Úprava dávkovania levodopy je s najväčšou pravdepodobnosťou požadovaná
do 1-2 dní po ukončení liečby Tasmarom.
4.3 Kontraindikácie
● Precitlivenosť na tolkapón alebo na ktorúkoľvek z ďalších zložiek uvedených v časti 6.1.
● Ochorenie pečene alebo zvýšená hladina pečeňových enzýmov
● Ťažká dyskinéza
● Predchádzajúca anamnéza symptomatického komplexu neuroleptického malígneho syndrómu
(NMS) a/alebo netraumatická rabdomyolýza
● Feochromocytóm
● Liečba neselektívnymi inhibítormi monoaminooxidázy (MAO)
4.4 Osobitné upozornenia a opatrenia pri používaní
Liečbu Tasmarom majú začať len lekári, ktorí majú skúsenosti s liečbou pokročilej Parkinsonovej choroby, aby bolo zabezpečené stanovenie rizika v porovnaní s úžitkom z liečby. Tasmar sa nemá predpísať, kým sa nezvážia riziká takejto liečby pre pacienta.
Ak sa do 3 týždňov od začiatku liečby neprejaví podstatný klinický úžitok, liečba Tasmarom sa má prerušiť.
Poškodeniepečene:
Pre zriedkavé, ale potenciálne smrteľné akútne poškodenie pečene sa Tasmar indikuje len u pacientov
s idiopatickou Parkinsonovou chorobou odpovedajúcou na levodopu a u pacientov s motorickými fluktuáciami, ktorým chýba odpoveď alebo sú intolerantní na iné COMT inhibítory. Pravidelné sledovanie pečeňových enzýmov nemôže spoľahlivo predpovedať objavenie fulminantnej hepatitídy. Vo všeobecnosti sa však predpokladá, že skorá detekcia poškodenia pečene indukovaná liekmi popri okamžitom vysadení podozrivého lieku zvyšuje pravdepodobnosť zotavenia. Poškodenie pečene sa najčastejšie objavuje medzi 1 mesiacom a 6 mesiacmi po začatí liečby Tasmarom. Neskorší nástup hepatitídy, po liečbe dlhšej ako 18 mesiacov, bol hlásený len výnimočne.
Treba spomenúť, že pacientky môžu mať väčšie riziko poškodenia pečene (pozri časť 4.8).
Pred začatím liečby: Ak testy funkcie pečene nie sú normálne alebo ak sú náznaky poškodenia funkcie pečene, Tasmar sa nesmie predpísať. Ak sa Tasmar predpíše, musí sa pacient informovať o symptómoch, ktoré môžu naznačovať poškodenie funkcie pečene a kontaktovať okamžite lekára.
Počas liečby: Funkcia pečene sa má kontrolovať každé 2 týždne počas prvého roka liečby, každé
4 týždne počas ďalších 6 mesiacov a potom každých 8 týždňov. Ak sa dávka zvýši na 200 mg trikrát denne, musí sa kontrolovať hladina pečeňových enzýmov pred zvýšením dávky a potom podľa vyššie uvedenej frekvencie. Ak hladina ALT prekročí 1 x ULN alebo ak sa rozvinú symptómy alebo príznaky naznačujúce zlyhanie pečne (pretrvávajúca nevoľnosť, únava, apatia, anorexia, žltačka, tmavý moč, svrbenie, citlivosť v pravom hornom kvadrante), liečba sa musí ihneď prerušiť.
Pprerušenie liečby: U pacientov užívajúcich Tasmar, u ktorých sa prejavia známky akútneho poškodenia funkcie pečene a ktorí prestanú liek užívať, sa môže prejaviť zvýšené riziko poškodenia funkcie pečene, ak sa začne Tasmar užívať znova. Teda takíto pacienti nemajú prichádzať do úvahy pre opätovnú liečbu.
Neuroleptický malígny syndróm (NMS):
U pacientov s Parkinsonovou chorobou sa NMS zvyčajne pozoruje po prerušení alebo ukončení
dopaminergnej liečby. Preto ak sa vyskytnú symptómy po znížení alebo prerušení liečby Tasmarom, lekár má zvážiť zvýšenie dávky levodopy u pacienta (pozri časť 4.2).
Ojedinelé prípady NMS súviseli s liečbou Tasmarom. Symptómy vyskytujúce sa počas liečby alebo krátko po liečbe Tasmarom majú tendenciu vymiznúť. NMS je charakterizovaný motorickými symptómami (stuhnutosť, myoklónia a tras), zmenami mentálneho stavu (chvenie, zmätenosť, strnulosť a kóma), zvýšenou teplotou, autonómnou dysfunkciou (labilný krvný tlak, tachykardia) a zvýšenými sérovými hladinami kreatínfosfokinázy (CPK), čo môže byť následkom myolýzy. NMS sa má diagnostikovať, iba ak nie sú prítomné všetky vyššie spomenuté príznaky.
Pred začatím liečby: Na zníženie rizika NMS sa pacientom s ťažkou formou dyskinézy alebo
predchádzajúcim NMS vrátane rabdomyolýzy a hypertermie Tasmar nemá predpisovať (pozri časť
4.3). U pacientov užívajúcich viaceré lieky s účinkom na rôzne dráhy centrálneho nervového systému (CNS) (napríklad antidepresíva, neuroleptiká, anticholínergné lieky) sa môže vyskytnúť vyššie riziko rozvoja NMS.
Poruchy kontroly impulzov: Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov. Pacienti a opatrovatelia majú byť upovedomení, že u pacientov liečených dopamínovými agonistmi a/alebo inou dopamínovou liečbou, ako je Tasmar v spojení s levodopou sa môžu vyskytnúť behaviorálne symptómy porúch kontroly impulzov zahŕňajúce patologické hráčstvo, zvýšené libido, hypersexualitu, chorobné míňanie alebo nakupovanie, hltavé jedenie a chorobné jedenie. Ak sa vyvinú takéto symptómy odporúča sa kontrola liečby.
Dyskinéza,nevoľnosťaďalšienežiaducereakciespojenés užívaním levodopy: U pacientov sa môže v súvislosti s užívaním levodopy prejaviť nárast nežiaducich reakcií. Zníženie dávky levodopy (pozri časť 4.2) môže často zmierniť tieto nežiaduce reakcie.
Hnačka: Na základe klinických skúšaní sa zistilo, že u 16% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 18% pacientov užívajúcich Tasmar 200 mg trikrát denne sa objavila hnačka
v porovnaní s 8% pacientov, ktorí dostávali placebo. Hnačka spojená s užívaním Tasmaru sa zvyčajne
začala 2 až 4 mesiace po začatí liečby. Hnačka viedla u 5% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 6% pacientov užívajúcich Tasmar 200 mg trikrát denne k zastaveniu liečby
v porovnaní s 1% pacientov, ktorí dostávali placebo.
Interakcia s benserazidom: Následkom interakcie medzi vysokou dávkou benserazidu a tolkapónu (má za následok zvýšené hladiny benserazidu) si má lekár – kým sa nezíska viac skúseností, všímať nežiaduce účinky v súvislosti s dávkou (pozri časť 4.5).
Inhibítory MAO-A: Tasmar sa namá podávať spolu s neselektívnymi inhibítormi monoaminooxidázy (MAO) (napr. fenelzín a tranylcypromín). Kombinácia s inhibítormi MAO-A a MAO-B je ekvivalentná s nonselektívnym MAO inhibíciou, pretože sa nemusia byť obaja podávané spoločne
s Tasmarom a liekmi s levodopou (pozri tiež časť 4.5). Použitie selektívnych MAO-B inhibítorov
nemusí byť vyššie ako odporučené dávky (napr. selegilín 10 mg/deň) keď sú spoločne podávané
s Tasmarom.
Warfarín: Keďže klinické informácie týkajúce sa kombinácie warfarínu a tolkapónu sú obmedzené,
majú sa sledovať parametre koagulácie, keď sa tieto lieky podávajú spoločne.
Špeciálne skupiny: Pacienti s ťažkým poškodením funkcie obličiek (klírens kreatinínu < 30 ml/min) musia byť liečení s opatrnosťou. V tejto populácii nie sú dostupné informácie o tolerancii tolkapónu (pozri časť 5.2).
Intolerancia laktózy: Tasmar obsahuje laktózu. Pacienti s hereditárnymi problémami intolerancie galaktózy, Lappovou deficienciou laktózy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Tasmar, ako inhibítor COMT je známy tým, že zvyšuje biologickú dostupnosť spoločne s podávanou levodopou. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergným nežiaducim reakciám, pozorovaných po liečbe s inhibítormi COMT. Najčastejšie sú zvýšená dyskinézia, nauzea, vracanie, bolesť brucha, synkopa, ortostatické ťažkosti, zápcha, poruchy spánku, ospalosť, halucinácie.
Levodopa sa spáaja s nespavosťou a epizódami náhleho nástupu spánku. Veľmi zriedkavo bol popísaný náhly nástup spánku počas denných aktivít, v niektorých prípadoch uvedomenia si alebo bez známok upozornenia. Počas liečby levodopou sa pacienti musia o tomto informovať a poradiť im cvičenia počas vedenia vozidiel alebo pri obluhovaní strojov. Pacienti, ktorí trpia ospalosťou a/alebo
epizódami náhleho spánku sa musia vyhnúť vedenie vozidiel alebo obsluhovaniu strojov (pozri časť
4.7). Navyše sa má uvažovať o znížení dávky levodopy alebo o ukončení liečby.
Katecholamíny a ďalšieliekymetabolizovanékatechol-O-metyltransferázou (COMT): Tolkapón môže mať vplyv na farmakokinetiku liekov metabolizovaných pomocou COMT. Na farmakokinetiku substrátu COMT karbidopa sa nepozorovali žiadne účinky. Pozorovala sa interakcia s benserazidom, ktorá môže viesť k zvýšeným hladinám benserazidu a jeho aktívneho metabolitu. Rozsah tohto účinku bol závislý od dávky benserazidu. Plazmatické koncentrácie benserazidu pozorované po podaní tolkapónu a benserazidu-25 mg/levodopy boli stále v rozsahu hodnôt pozorovaných pri podávaní samotnej levodopy/benserazidu. Na druhej strane po podaní tolkapónu a benserazidu-50 mg/levodopy plazmatické koncentrácie benserazidu by mohli byť vyššie ako hladiny, ktoré sa zvyčajne pozorujú pri podávaní samotného levodopa/benserazidu. Účinok tolkapónu na farmakokinetiku ďalších liekov metabolizovaných pomocou COMT, napríklad α-metyldopa, dobutamínu, apomorfínu, adrenalínu a izoprenalínu nebol vyhodnotený. Lekár, ktorý liek predpisuje, si má všímať nežiaduce účinky spôsobené podľa očakávania zvýšenými plazmatickými hladinami týchto liekov, keď sa kombinujú
s Tasmarom.
Účinoktolkapónu na metabolizmus iných liekov: Tolkapón vzhľadom na afinitu k cytochrómu CYP2C9 in vitro môže interferovať s liekmi, ktorých klírens je závislý od tejto metabolickej cesty, napríklad s tolbutamínom a warfarínom. V jednej štúdii o interakciách tolkapón nezmenil farmakokinetiku tolbutamínu. Preto sa klinicky významné interakcie zahŕňajúce cytochróm CYP2C9 zdajú nepravdepodobné.
Keďže klinické informácie týkajúce sa kombinácie warfarínu a tolkapónu sú obmedzené, majú sa
sledovať parametre koagulácie, keď sa tieto lieky podávajú spoločne.
Lieky, ktoré zvyšujú hladinu katecholamínov: Keďže tolkapón interferuje s metabolizmom katecholamínov, interakcie s ďalšími liekmi, ktoré ovplyvňujú hladiny katecholamínov, sú teoreticky možné.
Keď sa Tasmar podával spolu s levodopa/karbidopa a desipramínom, v krvnom tlaku, v pulzovej frekvencii ani v plazmatických koncentráciách desipramidu nenastala významná zmena. Frekvencia nežiaducich reakcií sa celkovo slabo zvýšila. Tieto nežiaduce účinky boli predvídateľné na základe známych nežiaducich reakcií na každý z týchto troch liekov jednotlivo. Preto je potrebná opatrnosť, keď sa silné inhibítory absorpcie noradrenalínu, napríklad desipramín, maprotilín alebo venlafaxin podávajú pacientom s Parkinsonovou chorobou, ktorí sú liečení Tasmarom a liekmi obsahujúcimi levodopu.'
V klinických štúdiách pacienti užívajúci Tasmar/levodopa pozorovali podobné nežiaduce reakcie, bez
ohľadu na to, či súčasne dostávali alebo nedostávali selegilín (a MAO-B-inhibítor).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití tolkapónu u gravidných žien. Tasmar sa má použiť počas gravidity len ak potenciálny prínos preváži potenciálne riziko pre plod.
Laktácia
Štúdie na zvieratách dokázali vylučovanie tolkapónu do materského mlieka.
Bezpečnosť tolkapónu u dojčiat nie je známa; preto ženy, ktoré sú liečené Tasmarom nemajú dojčiť.
Fertilita
Po podaní tolkapónu potkanom a králikom sa pozorovala embryofetálna toxicita (pozri časť 5.3). Nie
je známe potenciálne riziko u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Neexistuje žiaden dôkaz na základe klinických štúdií, že Tasmar má nežiaduci vplyv na pacientovu schopnosť viesť vozidlá a obsluhovať stroje. Avšak pacientov treba informovať, že ich schopnosť viesť vozidlá a obsluhovať stroje môže byť narušená symptómami Parkinsonovej choroby.
Tasmar, ako inhibítor COMT je známy tým, že zvyšuje biologickú dostupnosť spoločne s podávanou levodopou. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergným vedľajším účinkom , pozorovaných po liečbe s inhibítormi COMT. Pacienti liečení levodopou a s prítomnosťou ospanlivosti a/alebo epizód náhleho spánku sa musia informovať aby sa vyhli vedeniu vozidiel alebo vykonávaniu aktivít, kde poškodenie bdelosti môže viesť k vážnemu poraneniu alebo smrti (napr. obsluha strojov) pokiaľ nie sú rekurentné epizódy a ospanlivosť odstránené (pozri tiež časť 4.4).
4.8 Nežiaduce účinkyNajčastejšie pozorovanými nežiaducimi reakciami spojenými s užívaním Tasmaru, ktoré boli frekventovanejšie ako v skupine pacientov, ktorí dostávali placebo, sú uvedené v tabuľke nižšie. Tasmar ako COMT inhibítor je však známy, že zvyšuje biologickú dostupnosť spolupodávanej levodopy. Následné zvýšenie dopaminergnej stimulácie môže viesť k dopaminergickým vedľajším účinkom, ktoré boli pozorované po liečbe COMT inhibítormi. Najbežnejšie z nich sú dyskinéza, nevoľnosť, vracanie, bolesť brucha, mdloby, ťažkosti s vylučovaním, poruchy spánku, ospalosť, halucinácie.
Jedinou nežiaducou reakciou v klinických štúdiách, ktorá viedla obvykle k prerušeniu liečby
Tasmarom, bola hnačka (pozri časť 4.4).
Veľmi časté (≥1/10)
Časté (≥1/100 až <1/10)
Menej časté (≥1/1 000 až <1/100) Zriedkavé (≥1/10 000 až <1/1 000)
Veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov)
Skúsenosti s Tasmarom získané na základe paralelných randomizovaných štúdií s použitím placeba ako kontroly u pacientov s Parkinsonovou chorobou sú uvedené v nasledujúcej tabuľke, ktorá udáva nežiaduce účinky s potenciálnym vzťahom k užívaniu Tasmaru.
Súhrn možných nežiaducich reakcií spojených s Tasmarom, s približnou mierou incidencie v III. fáze placebom kontrolovaných štúdií:
Trieda orgánových systémov
| Incidencia
| Nežiaduce udalosti
|
|
|
|
Infekcie a nákazy
| Časté
| Infekcie horných dýchacích
ciest
|
Psychické poruchy
| Veľmi časté
| Poruchy spánku
|
|
| Nadmerné snívanie
|
|
| Ospalosť
|
|
| Zmätenosť
|
|
| Halucinácie
|
| Zriedkavé
| Poruchy kontroly impulzov*
(Zvýšené libido, hypersexualita, patologické hráčstvo, chorobné míňanie alebo nakupovanie, hltavé jedenie, chorobné prejedanie sa (pozri časť 4.4)).
|
T
rieda orgánových systémov
|
Incidencia
|
N
ežiaduce udalosti
|
|
|
|
Infekcie a nákazy
|
Časté
|
Infekcie horných dýchacích
ciest
|
Poruchy nervového systému
|
Veľmi časté
|
Dyskinéza
|
|
|
Dystónia
|
|
|
Bolesti hlavy
|
|
|
Závrat
|
|
|
Somnolencia
|
|
|
Ortostatické ťažkosti
|
|
Zriedkavé
|
Symptómy komplexu
neuroleptického malígneho
syndrómu (pozri časť 4.4)
|
|
Časté
|
Hypokinéza
|
|
|
Synkopa
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
|
Nauzea
|
|
|
Diarea
|
|
Časté
|
Vracanie
|
|
|
Zápcha
|
|
|
Suchosť v ústach
|
|
|
Brušné bolesti
|
|
|
Poruchy trávenia
|
Poruchy metabolizmu a výživy
|
Veľmi časté
|
Anorexia
|
Poruchy kože a podkožného tkaniva
|
Časté
|
Zvýšené potenie
|
Poruchy obličiek a močových ciest
|
Časté
|
Zafarbenie moču
|
Celkové poruchy a reakcie v mieste
podania
|
Časté
|
Bolesti v hrudníku
|
|
|
Ochorenie podobné chrípke
|
Poruchy pečene a žlčových ciest
|
Menej časté
|
Poškodenie pečene, v
zriedkavých prípadoch so
smrteľným následkom* (pozri časť 4.4)
|
Laboratórne a funkčné vyšetrenia
|
Časté
|
Zvýšenie
alanínaminotransferázy
(ALT)
|
*: Nežiaduce účinky, pre ktoré nemožno určiť frekvenciu z klinických štúdií (t.j.
t
a
m
, kde sa špecifická nežiaduca reakcia nepozorovala v klinických štúdiách, no hlásila sa po
uvedení lieku na trh) sú označené hviezdičkou (*) a kategórie frekvencií sa vypočítali pomocou EU
s
m
e
r
níc.
Z
výšenie alanínaminotransferázy
U 1% pacientov užívajúcich Tasmar 100 mg trikrát denne a u 3% pacientov užívajúcich Tasmar
200 mg trikrát denne sa pozorovalo viac ako trojnásobné zvýšenie hornej hranice normálu (ULN) alanínamínotransferázy (ALT). Toto zvýšenie bolo približne dvakrát pravdepodobnejšie u žien. Nárast sa zvyčajne objavil po 6 až 12 týždňoch od začiatku liečby a nebol spojený so žiadnymi klinickými príznakmi alebo symptómami. Asi v polovici prípadov sa hladiny transamináz spontánne vrátili
k východiskovým hodnotám, zatiaľ čo pacienti pokračovali v liečbe Tasmarom. U ostatných sa po prerušení liečby hladiny transamináz vrátili k hodnotám pred liečbou.
PoškodeniepečenePočas užívania lieku sa vyskytli zriedkavé prípady ťažkého poškodenia buniek pečene s následkom
smrti (pozri časť 4.4).
Symptómy komplexu neuroleptického malígneho syndrómu
Ojedinelé prípady pacientov so symptómami pripomínajúcimi symptomatický komplex
neuroleptického malígneho syndrómu (pozri časť 4.4) sa pozorovali po znížení dávky Tasmaru alebo po prerušení liečby a po opätovnej liečbe Tasmarom, čo bolo sprevádzané významným znížením dávky ďalších súčasne podávaných dopaminergných liekov. Okrem sekundárnej NMS alebo ťažkej dyskinézy sa vyskytla rabdomyolýza.
Zmenafarbymoču: Tolkapón a jeho metabolity sú žlté a môžu spôsobiť neškodné zintenzívnenie farby pacientovho moču.
Poruchy kontroly impulzov: U pacientov liečených dopamínovými agonistmi a/alebo inou dopamínovou liečbou, ako je Tasmar v spojení s levodopou sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, chorobné míňanie alebo nakupovanie, hltavé jedenie a chorobné prejedanie sa (pozri časť 4.4. Osobitné upozornenia a opatrenia pri používaní).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieBoli popísané prípady náhodného alebo zámerného predávkovania tabletami tolkapónu. Klinické okolnosti v týchto prípadoch však boli tak rozmanité, že sa nemôže urobiť celkový záver z týchto prípadov.
V týždňovej štúdii bola najvyššia dávka tolkapónu 800 mg trikrát denne podávaná zdravým starším dobrovoľníkom súčasne s levodopou alebo bez levodopy. Maximálne plazmatické koncentrácie tolkapónu pri tejto dávke boli priemerne 30 μg/ml (v porovnaní s 3 a 6 μg/ml pri dávke tolkapónu
100 mg trikrát denne a 200 mg trikrát denne). Pozorovala sa nevoľnosť, vracanie a závraty, najmä
v kombinácii s levodopou.
Liečbapredávkovania: Odporúča sa hospitalizácia. Je indikovaná všeobecná podporná liečba. Vzhľadom na fyzikálnochemické vlastnosti tejto zlúčeniny nie je hemodialýza pravdepodobne potrebná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiparkinsoniká, iné dopaminergické liečivá, ATC kód: NO4BX01
Mechanizmus účinku:Tolkapón je perorálne aktívny, selektívny a reverzibilný inhibítor katechol-O-metyltransferázy
(COMT). Súčasné podávanie s levodopou a inhibítorom dekarboxylázy aromatických aminokyselín
(AADC-I) vedie k stabilnejším plazmatickým hladinám levodopy redukciou metabolizmu levodopy na
3-metoxy-4-hydroxy-L-fenylalanín (3-OMD).
U pacientov s Parkinsonovou chorobou sú vysoké hladiny plazmatického 3-OMD spojené so slabou
odpoveďou na levodopu. Tolkapón značne znižuje tvorbu 3-OMD.
FarmakodynamickéúčinkyŠtúdie vykonané u zdravých dobrovoľníkov ukázali, že tolkapón po perorálnom podaní reverzibilne inhibuje aktivitu COMT v ľudských erytrocytoch. Táto inhibícia je úzko spätá s plazmatickou
koncentráciou tolkapónu. Pri dávke 200 mg tolkapónu je maximálna inhibícia aktivity COMT
v erytrocytoch priemerne vyššia ako 80%. Pri dávke Tasmaru 200 mg trikrát denne je inhibícia COMT
v erytrocytoch 30 až 45%, bez rozvinutia tolerancie.
Prechodné zvýšenie nad hladiny aktivity COMT v erytrocytoch pred liečbou bolo pozorované po ukončení liečby tolkapónom. Štúdia vykonaná u pacientov s Parkinsonovou chorobou všal potvrdila, že po prerušení liečby nenastala žiadna významná zmena vo farmakokinetike levodopy ani v odpovedi pacientov na levodopu v porovnaní s hladinami pred liečbou.
Keď sa Tasmar podáva spolu s levodopou, zvyšuje sa relatívna biologická dostupnosť (AUC) levodopy približne dvojnásobne. To je zapríčinené poklesom klírensu L-dopa, čo má za následok predĺženie polčasu terminálnej eliminácie
(t1/2) levodopy. To vo všeobecnosti nemalo vplyv na priemernú maximálnu plazmatickú koncentráciu levodopy
(Cmax) ani na čas výskytu
(tmax). Začiatok tohto účinku sa pozoruje po prvom podaní lieku. Štúdie vykonané u zdravých dobrovoľníkov a u pacientov s Parkinsonovou chorobou potvrdili, že maximálny účinok sa pozoruje pri dávke 100 -
200 mg tolkapónu. Plazmatické hladiny 3-OMD značne klesali v závislosti od dávky tolkapónu, keď sa podával spolu s levodopou/AADC-1 (inhibítor dekarboxylázy aromatických aminokyselín) (benserazid alebo karbidopa).
Účinok tolkapónu na farmakokinetiku levodopy je podobný pri všetkých liekových formách levodopa/benserazid a levodopa/karbidopa. Je závislý od dávky levodopy, od pomeru levodopy/AADC-I (benserazid alebo karbidopa) a od použitia liekových formiem s nepretržitým uvoľňovaním.
Klinická účinnosťabezpečnosť:Dvojito zaslepené kontrolované štúdie s placebom ukázali významné zníženie času bez účinku približne o 20 - 30% a podobný nárast času s účinkom, čo bolo sprevádzané redukciou závažnosti symptómov u fluktuujúcich pacientov užívajúcich Tasmar. Celkové vyhodnotenie účinnosti podľa skúšajúcich tiež dokázalo významné zlepšenie.
Dvojito zaslepená štúdia porovnávala Tasmar s entakaponom u pacientov s Parkinsonovou chorobou, u ktorých bol počas jedného dňa najmenej trojhodinový čas bez účinku, zatiaľ čo dostávali optimalizovanú liečbu levodopou. Primárnym výsledkom bol pomer pacientov s jednohodinovým alebo viachodinovým časom účinku (pozri tabuľku 1).
Tab. 1: Primárny a sekundárny koncový ukazovateľ a následná analýza dvojito zaslepenej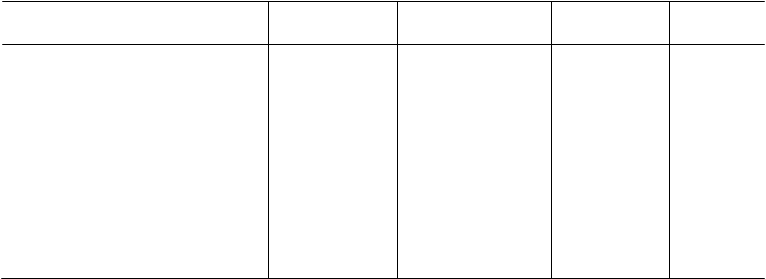 štúdie
štúdie
| Entakapon
N = 75
| Tolkapón
N = 75
| p-hodnota
| 95% IS
|
Primárny koncový ukazovateľ
Počet (pomer) ≥ jednohodinovou
odpoveďou
Sekundárny koncový
ukazovateľ
Počet (pomer) so stredným alebo značným zlepšením
|
32 (43%)
19 (25%)
|
40 (53%)
29 (39%)
|
p = 0,191
p = 0,080
|
-5,2; 26,6
-1,4; 28,1
|
Počet (pomer) u oboch zlepšení
pri primárnom a sekundárnom
koncovom ukazovateľovi
|
13 (17%)
|
24 (32%)
|
NA
|
NA
|
5.2 Farmakokinetické vlastnostiFarmakokinetika tolkapónu je v terapeutickom rozsahu lineárna a nezávisí od súčasného podávania
levodopy/AADC-1 (benserazid alebo karbidopa).
A
bsorpcia: Tolkapón sa rýchlo absorbuje, pričom tmax je približne 2 hodiny. Absolútna biologická dostupnosť pri perorálnom podávaní je okolo 65%. Tolkapón sa pri dávkovaní 100 mg trikrát denne alebo 200 mg trikrát denne neakumuluje. Pri takomto dávkovaní je Cmax približne 3 a 6 μg/ml. Jedlo spomaľuje a znižuje absorpciu tolkapónu, avšak relatívna biologická dostupnosť dávky tolkapónu prijatého s jedlom je stále 80 až 90%.
Distribúcia: Distribučný objem (Vss) tolkapónu je malý (9 l). Tolkapón sa nedistribuuje vo veľkom rozsahu do tkanív, pretože sa vo veľkej miere viaže na plazmatické proteíny (> 99,9%). Pokusy in vitro dokázali, že tolkapón sa viaže zvlášť na sérový albumín.
Biotransformácia/Eliminácia: Tolkapón je takmer úplne metabolizovaný pred vylúčením. V moči sa zistilo nezmenené len veľmi malé množstvo (0,5% dávky). Hlavnou metabolickou dráhou tolkapónu
je konjugácia s inaktívnym glukuronidom. Okrem toho táto zlúčenina je metylovaná pomocou COMT
na 3-O-metyl-tolkapón a metabolizovaná pomocou cytochrómov P450 3A4 a P450 2A6 na primárny alkohol (hydroxylácia metylovej skupiny), ktorý je potom oxidovaný na kyselinu karboxylovú. Redukcia na predpokladaný amín ako aj následná N-acetylácia sa vyskytuje v malom rozsahu. Po perorálnom podaní sa 60% látky spojenej s liekom vylúči močom a 40% stolicou.
Tolkapón je liek s nízkym pomerom extrakcie (pomer extrakcie = 0,15), so stredným systémovým klírensom približne 7 l/h,t1/2 tolkapónu je približne 2 hodiny.
Poškodeniepečene: Pre riziko poškodenia pečene, ktoré sa pozorovalo po uvedení lieku na trh, je Tasmar kontraindikovaný u pacientov s ochorením pečene alebo so zvýšenými hladinami pečeňových enzýmov. Jedna štúdia vykonaná u pacientov s poškodením pečene dokázala, že stredne závažné necirhotické ochorenie pečene nemalo žiadny vplyv na farmakokinetiku tolkapónu. Avšak u pacientov so stredne závažným cirhotickým ochorením pečene bol klírens neviazaného tolkapónu znížený
takmer o 50 %. Toto zníženie môže viesť k dvojnásobnému zvýšeniu priemernej koncentrácie neviazaného lieku.
Poškodenieobličiek: Farmakokinetika tolkapónu nebola skúmaná u pacientov s poškodením obličiek. Avšak bol skúmaný vzťah funkcie obličiek a farmakokinetiky tolkapónu s využitím farmakokinetiky populácií počas klinických štúdií. Údaje od viac ako 400 pacientov potvrdili, že nad širokým
rozsahom hodnôt klírensu kreatinínu (30 – 130 ml/min) farmakokinetika tolkapónu nebola ovplyvnená funkciou obličiek. To sa dá vysvetliť skutočnosťou, že do moču sa vylúči len zanedbateľné množstvo nezmeneného tolkapónu a hlavný metabolit tolkapón-glukuronid sa vylúči do moču a žlče (stolica).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Karcinogenéza, mutagenéza: Na základe 24. mesačnej štúdie karcinogenicity sa dokázalo, že u 3 % a
5 % potkanov rozdelených do skupín so strednou a vysokou dávkou sa vyskytli obličkové epiteliálne
nádory (adenómy alebo karcinómy). V štúdii karcinogenicity sa nenašiel v skupine s nízkou dávkou žiadny náznak renálnej toxicity. V štúdii karcinogenicity sa zistil zvýšený výskyt uterinných
adenokarcinómov v skupine potkanov s vysokou dávkou lieku.V štúdii karcinogenicity na myšiach
alebo psoch sa nezískali žiadne renálne nálezy.
Mutagenéza: Na základe úplnej série štúdií o mutagenicite sa dokázalo, že tolkapón nie je genotoxický.
Reprodukčnátoxicita: Dokázalo sa, že keď sa tolkapón podáva samotný, nemá teratogénne účinky ani žiadne účinky na plodnosť.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
J
adro tablety:
Hydrogenfosforečnan vápenatý (bezvodý) Mikrokryštalická celulóza
Povidón K30
Sodná soľ karboxymetylškrobu
Laktóza
Mastenec
Magnéziumstearát
Film tablety: Hydroxypropylmetylcelulóza Mastenec
Žltý oxid železitý (E172) Etylcelulóza
Oxid titaničitý (E171)
Triacetín
Nátriumlaurylsulfát
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
5 rokov
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Tasmar je dostupný v PVC/PE/PVDC blistroch (balenie obsahuje 30 alebo 60 filmom obalených tabliet) a v sklenených fľašiach jantárovej faby bez vysúšadla (balenie obsahuje 100 filmom obalených tabliet).
6.6 Pokyny na použitie a zaobchádzanie s liekom
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Meda AB Pipers väg 2A
S-170 09 Solna
Švédsko
8. REGISTRAČNÉ ČÍSLA
EU/1/97/044/004-6
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej regitrácie: 27. august 1997
Dátum predĺženia registrácie: 31. august 2004
Dátum posledného predĺženia registrácie: 31. august 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.