
enanie v mieste vpichu, ktoré sa vyskytlo približne po 41 % všetkých dávok a podráždenosť, ktorá sa vyskytla približne po 55 % všetkých dávok. Po podaní posilňovacej dávky boli najčastejšími nežiaducimi reakciami bolesť v mieste vpichu a podráždenosť, ktorých výskyt bol v danom poradí približne 51 % a 53 %. Väčšina týchto reakcií bola mierneho až stredne ťažkého stupňa závažnosti a neboli dlhotrvajúce.
Po podaní následných dávok základnej očkovacej schémy sa nepozorovalo zvýšenie výskytu alebo
závažnosti nežiaducich reakcií.
Lokálna reaktogenita po schéme základného očkovania bola podobná u dojčiat vo veku < 12 mesiacov a u detí vo veku > 12 mesiacov, s výnimkou bolesti v mieste vpichu, ktorej výskyt sa zvyšoval
so zvyšujúcim sa vekom: bolesť bola hlásená u viac než 39 % dojčiat vo veku < 12 mesiacov a u viac než 58 % detí vo veku > 12 mesiacov.
Po podaní posilňovacej dávky je u detí vo veku > 12 mesiacov väčšia pravdepodobnosť výskytu reakcií v mieste vpichu v porovnaní s ich výskytom pozorovaným u detí počas základného očkovania Synflorixom.
Po doočkovaní (tzv. catch-up očkovanie) u detí vo veku 12 až 23 mesiacov bola urtikária hlásená častejšie (menej častá) v porovnaní s výskytom pozorovaným u dojčiat počas základného očkovania a po podaní posilňovacej dávky.
Reaktogenita bola vyššia u detí, ktorým sa súbežne podala očkovacia látka obsahujúca celobunkovú zložku pertussis. V klinickej štúdii sa deťom súbežne s očkovacou látkou obsahujúcou DTPw podal buď Synflorix (N=603), alebo 7-valentný Prevenar (N=203). Po základnej očkovacej schéme bola horúčka ≥ 38 °C hlásená u 86,1 % detí a horúčka > 39 °C u 14,7 % detí, ktorým sa podal Synflorix a u 82,9 % a 11,6 % detí očkovaných 7-valentným Prevenarom.
V porovnávacích klinických štúdiách bol výskyt miestnych a celkových nežiaducich udalostí hlásených do 4 dní po každej dávke očkovacej látky v rovnakom rozmedzí ako po očkovaní
7-valentným Prevenarom.
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie (týkajúce sa všetkých vekových skupín) považované za prinajmenšom možno
súvisiace s očkovaním sú zoradené do kategórií podľa frekvencie.
Frekvencie sú hlásené ako: Veľmi časté: (≥ 1/10)
Časté: (≥ 1/100 až < 1/10)
Menej časté: (≥ 1/1 000 až < 1/100) Zriedkavé: (≥ 1/10 000 až < 1/1 000)
Veľmi zriedkavé: (< 1/10 000)
Trieda orgánových systémov Frekvencia Nežiaduce reakcie
Klinické skúšania
Poruchy imunitného systému Zriedkavé Alergické reakcie (akými sú alergická dermatitída, atopická dermatitída, ekzém)
Veľmi
zriedkavé
Angioedém
Poruchy metabolizmu a výživy Veľmi časté Nechutenstvo
Psychické poruchy Veľmi časté Podráždenosť
Menej časté Nezvyčajný plač
Poruchy nervového systému Veľmi časté Ospalosť
Zriedkavé Kŕče (vrátane horúčkových kŕčov)
Poruchy ciev Veľmi
zriedkavé
Kawasakiho choroba

Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Menej časté Apnoe u veľmi predčasne narodených detí (do a vrátane 28. týždňa gravidity) (pozri časť 4.4)
Menej časté Hnačka, vracanie
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Menej časté Vyrážka
Zriedkavé Urtikária
Veľmi časté Bolesť, začervenanie, opuch v mieste vpichu, horúčka ≥ 38 °C meraná rektálne (vek < 2 roky)
Časté Reakcie v mieste vpichu ako indurácia v mieste
vpichu, horúčka > 39 °C meraná rektálne
(vek< 2 roky)
Menej časté Reakcie v mieste vpichu ako hematóm, krvácanie a uzlík v mieste vpichu
N
ežiaduce reakcie dodatočne hlásené po podaní posilňovacej dávky základného očkovania a/alebo
po doočkovaní (tzv. catch-up očkovanie):
Poruchy nervového systému Menej časté Bolesť hlavy (vek od 2 do 5 rokov)
Poruchy gastrointestinálneho traktu
Celkové poruchy a reakcie v mieste podania
Menej časté Nauzea (vek od 2 do 5 rokov)
Časté Horúčka ≥ 38 °C meraná rektálne (vek od 2 do 5 rokov)
Menej časté Reakcie v mieste vpichu ako pruritus,
horúčka > 40 °C meraná rektálne (vek
< 2 roky), horúčka > 39 °C meraná rektálne
(vek od 2 do 5 rokov), difúzny opuch očkovanej končatiny, niekedy postihujúci susedný kĺb
Skúsenosti získané po uvedení očkovacej látky na trh
Poruchy imunitného systému Veľmi
zriedkavé
Anafylaxia

Poruchy nervového systému Zriedkavé Hypotonicko-hyporesponzívna epizóda
Špeciálne populácieBezpečnosť Synflorixu sa hodnotila u 83 HIV-pozitívnych (HIV+/+) dojčiat (asymptomatických alebo s miernymi príznakmi podľa klasifikácie WHO), u 101 HIV-negatívnych dojčiat narodených
HIV-pozitívnym matkám (HIV+/-) a u 50 dojčiat s kosáčikovitou anémiou (SCD), ktoré dostali
základné očkovanie. Posilňovacia dávka sa v uvedenom poradí podala 76, 96 a 49 z týchto dojčiat.
Bezpečnosť Synflorixu sa hodnotila aj u 50 detí s SCD, u ktorých sa očkovanie začalo vo veku
7 - 11 mesiacov, pričom všetkým z nich sa podala posilňovacia dávka, a u 50 detí so SCD, u ktorých sa očkovanie začalo vo veku 12 - 13 mesiacov. Výsledky ukazujú, že reaktogenita a bezpečnostný profil Synflorixu sú medzi týmito vysoko rizikovými skupinami a zdravými deťmi porovnateľné.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNebol hlásený žiaden prípad predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pneumokokové očkovacie látky, ATC kód: J07AL52
1. Epidemiologické údaje
Desať sérotypov obsiahnutých v tejto očkovacej látke predstavuje hlavné sérotypy vyvolávajúce
ochorenie v Európe a sú zodpovedné za približne 56 % až 90 % prípadov invazívneho pneumokokového ochorenia (IPO) u detí vo veku < 5 rokov. V tejto vekovej skupine sú sérotypy 1, 5
a 7F zodpovedné za 3,3 % až 24,1 % prípadov IPO v závislosti od krajiny a sledovaného časového
obdobia.
Pneumónia rôznych etiológií je z globálneho hľadiska hlavnou príčinou detskej morbidity a mortality. V prospektívnych štúdiách sa odhadlo, že Streptococcus pneumoniae je zodpovedný za 30 - 50 % prípadov pneumónie.
Akútna otitis media (AOM) je časté detské ochorenie s rôznou etiológiou. Baktérie môžu byť zodpovedné za 60 - 70 % klinických epizód AOM. Celosvetovo sú najčastejšou príčinou bakteriálnej AOM Streptococcus pneumoniae a netypizovateľný Haemophilus influenzae (NTHi).
2. Účinnosťaefektívnosťv klinických skúšaniach
V rozsiahlom, dvojito zaslepenom, klastrovo-randomizovanom, kontrolovanom klinickom skúšaní
fázy III/IV vo Fínsku (FinIP) boli deti randomizované do 4 skupín podľa dvoch dojčenských očkovacích schém [2-dávková (3-5 mesiacov veku) alebo 3-dávková (3-4-5 mesiacov veku) základná očkovacia schéma, po ktorej nasledovalo podanie posilňovacej dávky od 11 mesiacov veku] a bol im podaný buď Synflorix (dve tretiny klastrov), alebo očkovacie látky proti hepatitíde ako kontrolné očkovacie látky (jedna tretina klastrov). V kohortách s doočkovaním bol deťom, ktoré boli v čase podania prvej dávky očkovacej látky vo veku medzi 7 - 11 mesiacmi, podaný buď Synflorix, alebo očkovacia látka proti hepatitíde B za použitia 2-dávkovej základnej očkovacej schémy, po ktorej nasledovalo podanie posilňovacej dávky, a deťom, ktoré boli v čase podania prvej dávky očkovacej látky vo veku medzi 12 - 18 mesiacmi, boli podané 2 dávky buď Synflorixu, alebo očkovacej látky proti hepatitíde A. Sledovanie po prvom očkovaní trvalo v priemere 24 až 28 mesiacov a bolo zamerané na invazívne ochorenie a pneumóniu diagnostikovanú v nemocnici. Vo vnorenej (nested) štúdii boli dojčatá sledované približne až do veku 21 mesiacov, aby sa zhodnotil vplyv Synflorixu na nazofaryngálne nosičstvo a lekárom diagnostikovanú AOM hlásenú rodičmi.
V rozsiahlom, randomizovanom, dvojito zaslepenom klinickom skúšaní fázy III („Clinical Otitis Media and Pneumonia Study“ (Klinická štúdia zameraná na otitis media a pneumóniu) - COMPAS) vykonanom v Argentíne, Paname a Kolumbii bol zdravým dojčatám vo veku 6 až 16 týždňov podaný buď Synflorix, alebo kontrolná očkovacia látka proti hepatitíde B vo veku 2, 4 a 6 mesiacov
a následne buď Synflorix, alebo kontrolná očkovacia látka proti hepatitíde A vo veku
15 až 18 mesiacov.
2.1 Invazívne pneumokokové ochorenie (ktoré zahŕňa sepsu, meningitídu, pneumóniu s bakterémiou a bakterémiu)
Efektívnosť/účinnosť v kohorte dojčiat, ktoré boli v čase zaradenia do klinického skúšania mladšie ako
7 mesiacov
Preukázala sa efektívnosť alebo účinnosť očkovacej látky („vaccine effectiveness or efficacy“, VE) v prevencii IPO potvrdeného kultiváciou, ktoré bolo vyvolané pneumokokovými sérotypmi obsiahnutými v očkovacej látke, keď bol Synflorix podaný dojčatám buď v schéme 2+1, alebo
v schéme 3+1 vo FinIP alebo v schéme 3 + 1 v COMPAS (pozri tabuľku 1).
T
abuľka 1: Počet prípadov IPO vyvolaného sérotypom obsiahnutým v očkovacej látke
a efektívnosť (FinIP) alebo účinnosť (COMPAS) očkovacej látky u dojčiat, ktoré boli v čase zaradenia do klinického skúšania mladšie ako 7 mesiacov, a ktorým bola podaná aspoň jedna dávka očkovacej látky (Celková očkovaná kohorta dojčiat)
FinIP COMPAS
Počet prípadov IPO VE
(95 % IS)
Počet prípadov IPO VE
(95 % IS)
Typ IPO
IPO(1)
vyvolané sérotypom
Synflorix schéma
3+1
N
10 273
Synflorix schéma
2+1
N
10 054
Kontrola(2)
N
10 200
Schéma
3+1

(3)
Schéma
2+1
(4)
Synflorix schéma
3+1
N
11 798
Kontrola
N
11 799
Schéma
3+1
(5)
obsiahnu-
tým
v očkova- cej látke
IPO
vyvolané
0 1 12 100 %
(82,8; 100)
0 0 5 100 %
91,8 %
(58,3; 99,6)
100 %
0 18 100 %
(77,3; 100)
sérotypom
6B
IPO
(54,9; 100)
(54,5; 100) 0 2 -
vyvolané sérotypom
14
0 0 4
100 % (39,6; 100)
100 %
(43,3; 100) 0 9
100 % (49,5; 100)
IPO Invazívne pneumokokové ochorenie
VE Efektívnosť (FinIP) alebo účinnosť (COMPAS) očkovacej látky
N počet jedincov na skupinu
IS Interval spoľahlivosti
(1) Vo FinIP okrem sérotypov 6B a 14 zahŕňali prípady IPO potvrdeného kultiváciou, ktoré bolo vyvolané sérotypom obsiahnutým v očkovacej látke, sérotypy 7F (1 prípad v klastroch,
v ktorých bol podávaný Synflorix v schéme 2+1), 18C, 19F a 23F (1 prípad z každého
v kontrolných klastroch). V COMPAS sa v kontrolnej skupine zistili sérotypy 5 (2 prípady),
18C (4 prípady) a 23F (1 prípad) navyše k sérotypom 6B a 14. (2) skombinované boli 2 skupiny kontrolných klastrov
(3) p-hodnota < 0,0001
(4) p-hodnota = 0,0009
(5) v ATP kohorte bola VE 100 % (95 % IS: 74,3 - 100; 0 oproti 16 prípadom)
Vo FinIP bola celková pozorovaná VE voči IPO potvrdenému kultiváciou 100 % (95 % IS: 85,6 - 100;
0 oproti 14 prípadom) pri schéme 3+1, 85,8 % (95 % IS: 49,1 - 97,8; 2 oproti 14 prípadom) pri schéme
2+1 a 93,0 % (95 % IS: 74,9 - 98,9; 2 oproti 14 prípadom) bez ohľadu na základnú očkovaciu schému. V COMPAS bola 66,7 % (95 % IS: 21,8 – 85,9; 7 oproti 21 prípadom).
Efektívnosť po doočkovaní (tzv. catch-up očkovaní)
Medzi 15 447 deťmi v kohortách s doočkovaním sa nevyskytli žiadne prípady IPO potvrdeného kultiváciou v skupinách so Synflorixom, zatiaľ čo v kontrolných skupinách sa pozorovalo 5 prípadov IPO vyvolaného sérotypom obsiahnutým v očkovacej látke (sérotypy 4, 6B, 7F, 14 a 19F).
2.2 Pneumónia
Účinnosť voči pneumónii sa hodnotila v COMPAS. Priemerné trvanie sledovania od 2 týždňov po
podaní 3. dávky v ATP kohorte bolo 23 mesiacov (rozmedzie od 0 do 34 mesiacov) pre predbežnú analýzu („interim analysis“, IA) a 30 mesiacov (rozmedzie od 0 do 44 mesiacov) pre analýzu na konci štúdie. Na konci tejto IA bol priemerný vek 29 mesiacov (rozmedzie od 4 do 41 mesiacov) a v období sledovania ATP kohorty na konci štúdie bol priemerný vek 36 mesiacov (rozmedzie
od 4 do 50 mesiacov). Podiel jedincov, ktorým bola podaná posilňovacia dávka v ATP kohorte, bol
92,3 % v oboch analýzach.
Účinnosť Synflorixu voči prvým epizódam pravdepodobne bakteriálnej pneumónie získanej
v komunite („Community Acquired Pneumonia“, CAP) vyskytujúcim sa od 2 týždňov po podaní
3. dávky sa preukázala v ATP kohorte (P hodnota ≤ 0,002) v predbežnej analýze (podmienenej
udalosťami; primárny cieľ).
Pravdepodobne bakteriálna CAP (B-CAP) je definovaná ako rádiologicky potvrdené prípady CAP
buď s alveolárnou konsolidáciou/pleurálnym výpotkom na röntgene hrudníka, alebo bez alveolárnych infiltrátov, ale s hodnotou C-reaktívneho proteínu (CRP) ≥ 40 mg/l.
Účinnosť očkovacej látky voči B-CAP pozorovaná v predbežnej analýze je uvedená nižšie (tabuľka 2).
Tabuľka 2: Počet a percentuálny podiel jedincov s prvými epizódami B-CAP vyskytujúcimi sa od 2 týždňov po podaní 3. dávky Synflorixu alebo kontrolnej očkovacej látky a účinnosť očkovacej látky (ATP kohorta)

Synflorix
N = 10 295
Kontrolná očkovacia látka
N = 10 201 Účinnosť očkovacej
N % (n/N) n % (n/N)
látky
240 2,3 % 304 3,0 % 22,0 %
(95 % IS: 7,7; 34,2)
N počet jedincov na skupinu
n/% počet/percentuálny podiel jedincov, u ktorých bola hlásená prvá epizóda B-CAP kedykoľvek
od 2 týždňov po podaní 3. dávky
IS Interval spoľahlivosti
V predbežnej analýze (ATP kohorta) bola účinnosť očkovacej látky voči prvý epizódam CAP
s alveolárnou konsolidáciou alebo pleurálnym výpotkom (C-CAP, definícia podľa WHO) 25,7 % (95 % IS: 8,4; 39,6) a voči prvým epizódam klinicky suspektnej CAP vyžadujúcej RTG vyšetrenie
bola 6,7 % (95 % IS: 0,7; 12,3).
V analýze na konci štúdie (ATP kohorta) bola účinnosť očkovacej látky (prvé epizódy) voči B-CAP
18,2 % (95 % IS: 4,1; 30,3), voči C-CAP 22,4 % (95 % IS: 5,7; 36,1) a voči klinicky suspektnej CAP
vyžadujúcej RTG vyšetrenie 7,3 % (95 % IS: 1,6; 12,6). Účinnosť bola 100 % (95 % IS: 41,9; 100)
voči bakteremickej pneumokokovej pneumónii alebo empyému spôsobených sérotypmi obsiahnutými
v očkovacej látke. Ochrana pred B-CAP pred podaním posilňovacej dávky bola 13,6 % (95 % IS:
-11,3; 33,0) a v čase podania alebo po podaní posilňovacej dávky bola 21,7 % (95 % IS: 3,4; 36,5). Ochrana pred C-CAP bola 15,1 % (95 % IS: -15,5; 37,6) a 26,3 % (95 % IS: 4,4; 43,2), v uvedenom poradí.
Zníženie výskytu B-CAP a C-CAP bolo najväčšie u detí vo veku < 36 mesiacov (účinnosť očkovacej látky bola 20,6 % (95 % IS: 6,5; 32,6) a 24,2 % (95 % IS: 7,4; 38,0), v uvedenom poradí). Výsledky účinnosti očkovacej látky u detí vo veku > 36 mesiacov poukazujú na klesajúcu ochranu. Pretrvávanie ochrany pred B-CAP a C-CAP po viac ako 36 mesiacov veku v súčasnosti nie je stanovené.
Výsledky štúdie COMPAS, ktorá sa vykonala v Latinskej Amerike, sa majú interpretovať obozretne
kvôli možným rozdielom v epidemiológii pneumónie v rôznych zemepisných oblastiach.
V štúdii FinIP bola efektívnosť očkovacej látky v znižovaní prípadov pneumónie diagnostikovanej v nemocnici (identifikovanej na základe kódov pre pneumóniu podľa 10. revízie Medzinárodnej klasifikácie chorôb (ICD-10)) 26,7 % (95 % IS: 4,9; 43,5) pri dojčenskej schéme 3+1 a 29,3 %
(95 % IS: 7,5; 46,3) pri dojčenskej schéme 2+1. Pri doočkovaní (tzv. catch-up očkovanie) bola efektívnosť očkovacej látky 33,2 % (95 % IS: 3,0; 53,4) v kohorte 7- až 11-mesačných a 22,4 % (95 % IS: -8,7; 44,8) v kohorte 12- až 18-mesačných.
2.3 Akútna otitis media (AOM)Vykonali sa dve štúdie účinnosti, COMPAS a POET („Pneumococcal Otitis Media Efficacy Trial“ -
skúšanie overujúce účinnosť pri pneumokokovej otitis media), s konjugovanými pneumokokovými očkovacími látkami obsahujúcimi proteín D: so Synflorixom a so skúšanou 11-valentnou konjugovanou očkovacou látkou (ktorá navyše obsahovala sérotyp 3), v uvedenom poradí.
V COMPAS bolo 7 214 jedincov [celková očkovaná kohorta („Total Vaccinated cohort“, TVC)] zahrnutých do analýzy účinnosti voči AOM, z ktorých 5 989 jedincov bolo v ATP kohorte (Tabuľka 3).
 Tabuľka 3: Účinnosť očkovacej látky voči AOM(1) v COMPAS
Tabuľka 3: Účinnosť očkovacej látky voči AOM(1) v COMPASÚčinnosť očkovacej látky
Typ alebo príčina AOM
(95 % IS) ATP(2)
Klinická AOM 16,1 %
(-1,1; 30,4)
Akýkoľvek pneumokokový sérotyp 56,1 % (13,4; 77,8)
10 pneumokokových sérotypov obsiahnutých v očkovacej látke
Netypizovateľný Haemophilus influenzae
(NTHi)
CI Interval spoľahlivosti
(1) Prvá epizóda
67,1 % (17,0; 86,9)
15,0 %(4)
(-83,8; 60,7)
(2) Obdobie sledovania trvajúce maximálne 40 mesiacov, a to od 2 týždňov po tretej dávke
základného očkovania
(3) Štatisticky nevýznamná podľa vopred definovaných kritérií (jednostranná hodnota p = 0,032).
V TVC kohorte však bola účinnosť očkovacej látky voči prvej klinickej epizóde AOM 19 % (95 % IS: 4,4; 31,4).
(4) Štatisticky nevýznamné.
V ďalšom rozsiahlom, randomizovanom, dvojito zaslepenom skúšaní (POET) vykonanom v Českej republike a na Slovensku dostalo 4 907 dojčiat (ATP kohorta) buď 11-valentnú skúšanú očkovaciu látku (11Pn-PD) obsahujúcu 10 sérotypov Synflorixu (spolu so sérotypom 3, pri ktorom sa účinnosť nepreukázala), alebo kontrolnú očkovaciu látku (očkovaciu látku proti hepatitíde A) za použitia očkovacej schémy 3, 4, 5 a 12-15 mesiacov.
Účinnosť 11Pn-PD očkovacej látky voči prvému výskytu epizódy AOM vyvolanej sérotypom obsiahnutým v očkovacej látke bola 52,6 % (95 % IS: 35,0; 65,5). Sérotypovo-špecifická účinnosť voči prvej epizóde AOM sa preukázala pri sérotypoch 6B (86,5 %, 95 % IS: 54,9; 96,0), 14 (94,8 %,
95 % IS: 61,0; 99,3), 19F (43,3 %, 95 % IS: 6,3; 65,4) a 23F (70,8 %, 95 % IS: 20,8; 89,2).
Pri ostatných sérotypoch obsiahnutých v očkovacej látke bol počet prípadov AOM príliš obmedzený,
aby bolo možné vyvodiť záver o účinnosti. Účinnosť voči akejkoľvek epizóde AOM vyvolanej akýmkoľvek pneumokokovým sérotypom bola 51,5 % (95 % IS: 36,8; 62,9). Účinnosť očkovacej
látky voči prvej epizóde AOM vyvolanej NTHi bola 31,1 % (95 % IS: -3,7; 54,2, nevýznamné).
Účinnosť voči akejkoľvek epizóde AOM vyvolanej NTHi bola 35,3 % (95 % IS: 1,8; 57,4). Odhadovaná účinnosť očkovacej látky voči akýmkoľvek klinickým epizódam otitis media bez ohľadu na etiológiu bola 33,6 % (95 % IS: 20,8; 44,3).
Na základe imunologického preklenutia (bridging) funkčnej odpovede na očkovaciu látku (OPA) medzi Synflorixom a 11-valentnou očkovacou látkou použitou v POET sa očakáva, že Synflorix poskytne podobnú účinnosť ochrany pred pneumokokovou AOM.
V COMPAS (na základe malého počtu hlásených prípadov) ani v skúšaní POET sa nepozoroval zvýšený výskyt AOM vyvolanej inými bakteriálnymi patogénmi alebo sérotypmi neobsiahnutými v očkovacej látke/sérotypmi nesúvisiacimi s očkovacou látkou.
Efektívnosť voči lekárom diagnostikovanej AOM hlásenej rodičmi sa sledovala vo vnorenej (nested)
štúdii v rámci skúšania FinIP. Efektívnosť očkovacej látky bola 6,1 % (95 % IS: -2,7; 14,1) pri schéme
3+1 a 7,4 % (95 % IS: -2,8; 16,6) pri schéme 2+1 pre tento cieľový ukazovateľ týkajúci sa AOM
v očkovanej kohorte dojčiat.
2.4 Vplyv na nazofaryngálne nosičstvo (NFN)
Vplyv Synflorixu na nazofaryngálne nosičstvo sa sledoval v 2 dvojito zaslepených randomizovaných
štúdiách využívajúcich inaktívnu kontrolu: vo vnorenej (nested) štúdii v rámci FinIP vo Fínsku
(5 023 jedincov) a v COMPAS (1 700 jedincov).
V COMPAS aj vo vnorenej (nested) fínskej štúdii Synflorix znížil nosičstvo sérotypov obsiahnutých
v očkovacej látke, pričom po podaní posilňovacej dávky sa zistilo zjavné zvýšenie nosičstva sérotypov neobsiahnutých v očkovacej látke (s výnimkou sérotypov súvisiacich s očkovacou látkou). V žiadnej
z analýz vykonaných v COMPAS neboli výsledky štatisticky významné. Avšak celkovo vzaté, zistila
sa tendencia k zníženiu celkového nosičstva pneumokokových sérotypov.
V oboch štúdiách sa zistilo významné zníženie nosičstva jednotlivých sérotypov 6B a 19F.
Vo vnorenej (nested) fínskej štúdii sa tiež pozorovalo zníženie nosičstva jednotlivých sérotypov 14,
23F a pri 3-dávkovej základnej očkovacej schéme aj skrížene reagujúceho sérotypu 19A.
V klinickej štúdii sa NFN hodnotilo u HIV-pozitívnych dojčiat (N = 83) a HIV-negatívnych dojčiat
narodených HIV-pozitívnym matkám (N= 101) v porovnaní s HIV-negatívnymi dojčatami
narodenými HIV-negatívnym matkám (N = 100). Nezdalo sa, že by expozícia HIV alebo infekcia HIV
zmenili vplyv Synflorixu na nosičstvo pneumokokových sérotypov až do veku 24 - 27 mesiacov, t. j. až do 15 mesiacov po podaní posilňovacej dávky.
3. Efektívnosťv období pozorovaniapouvedeníočkovacejlátkynatrh
V Brazílii sa Synflorix zaviedol do národného imunizačného programu (NIP) za použitia schémy 3+1
u dojčiat (dávky základného očkovania podané v 2, 4 a 6 mesiacoch veku a posilňovacia dávka podaná
v 12 mesiacoch veku) spolu s kampaňou zameranou na doočkovanie (tzv. catch-up očkovanie) u detí až do 2 rokov veku. Na základe takmer 3-ročného pozorovania po zavedení Synflorixu sa
v štrukturálne vyváženej štúdii prípadov a kontrol („matched case-control study“) hlásilo významné
zníženie výskytu IPO potvrdeného kultiváciou alebo PCR, ktoré bolo vyvolané akýmkoľvek
sérotypom obsiahnutým v očkovacej látke, a IPO vyvolaného individuálnymi sérotypmi 6B, 14 a 19A.
T
abuľka 4: Súhrn efektívnosti Synflorixu voči IPO v Brazílii
T
ypy IPO
(
1)
U
pravená efektívnosť
(
2)
% (95 % IS)
IPO vyvolané akýmkoľvek sérotypom
obsiahnutým v očkovacej látke(3)
- Invazívna pneumónia alebo bakterémia
- Meningitída
IPO vyvolané individuálnymi sérotypmi(4)
- 6B
- 14
- 19A
83,8 % (65,9;92,3)
81,3 % (46,9;93,4)
87,7 % (61,4;96,1)
82,8 % (23,8;96,1)
87,7 % (60,8;96,1)
82,2 % (10,7;96,4)
(1) IPO potvrdené kultiváciou alebo PCR
(2) Upravená efektívnosť predstavuje percentuálne zníženie výskytu IPO v skupine osôb očkovaných Synflorixom v porovnaní so skupinou neočkovaných osôb, čo vedie k obmedzeniu vplyvu faktorov sťažujúcich posúdenie („zavádzajúcich faktorov“).
(3) K analýze prispeli prípady, v ktorých sa kultiváciou alebo PCR potvrdila prítomnosť sérotypov 4,
6B, 7F, 9V, 14, 18C, 19F a 23F.
(4) Individuálne sérotypy, pri ktorých sa dosiahla štatistická významnosť v analýze efektívnosti vykonanej s obmedzením vplyvu faktorov sťažujúcich posúdenie (nevykonala sa žiadna úprava vzhľadom na multiplicitu).
Vo Fínsku sa Synflorix zaviedol do NIP za použitia schémy 2+1 u dojčiat (dávky základného očkovania podané v 3 a 5 mesiacoch veku a posilňovacia dávka podaná v 12 mesiacoch veku) bez kampane zameranej na doočkovanie (tzv. catch-up očkovanie). Porovnanie výskytu IPO pred zavedením Synflorixu do NIP a po jeho zavedení svedčí o významnom znížení výskytu
akéhokoľvek IPO potvrdeného kultiváciou, IPO vyvolaného akýmkoľvek sérotypom obsiahnutým
v očkovacej látke a IPO vyvolaného sérotypom 19A.
Tabuľka 5: Výskyt IPO a zodpovedajúce zníženie jeho výskytu vo Fínsku
IPO Výskyt na 100 000 osoborokov Relatívne zníženie výskytu(1)
% (95 % IS)
akékoľvek IPO potvrdené
Pred zavedením do
NIP
Po zavedení do NIP
kultiváciou 62,9 12,9 80 % (72;85)
vyvolané akýmkoľvek
sérotypom obsiahnutým v očkovacej látke(2)
49,1 4,2 92 % (86;95)


vyvolané sérotypom 19A 5,5 2,1 62 % (20;85) (1) Relatívne zníženie výskytu ukazuje, o koľko sa znížil výskyt IPO u detí vo veku ≤ 5 rokov
v kohorte očkovanej Synflorixom (sledovanej 3 roky po zavedení Synflorixu do NIP) v porovnaní
s historickými (t.j. retrospektívne vytvorenými) kohortami neočkovaných osôb vyváženými podľa
veku a časového obdobia (každá kohorta bola sledovaná počas 3-ročného obdobia pred zavedením
Synflorixu do NIP).
(2) K analýze prispeli prípady, v ktorých sa kultiváciou potvrdila prítomnosť sérotypov 1, 4, 6B, 7F,
9V, 14, 18C, 19F a 23F.
V Quebecu, v Kanade, sa Synflorix zaviedol do dojčenského imunizačného programu (základné očkovanie 2 dávkami podanými dojčatám mladším ako 6 mesiacov a posilňovacia dávka podaná v 12 mesiacoch veku) po 4,5-ročnom používaní 7-valentného Prevenaru. Na základe 1,5-ročného pozorovania po zavedení Synflorixu, s viac než 90 % pokrytím vo vekovej skupine, v ktorej bolo podanie očkovacej látky vhodné, sa pozorovalo zníženie výskytu IPO vyvolaného sérotypom
obsiahnutým v očkovacej látke (z veľkej miery v dôsledku zmien vo výskyte ochorenia vyvolaného sérotypom 7F) bez sprievodného zvýšenia výskytu IPO vyvolaného sérotypom neobsiahnutým
v očkovacej látke. Výskyt IPO bol celkovo 35/100 000 osoborokov v kohortách očkovaných
Synflorixom a 64/100 000 osoborokov v kohortách očkovaných 7-valentným Prevenarom, čo predstavuje štatisticky významný rozdiel (p = 0,03). Z observačných štúdií tohto typu nie je možné vyvodiť priamu príčinnú súvislosť.
4. Údaje o imunogenite
4.1 Imunologická noninferiorita oproti 7-valentnému Prevenaru
Hodnotenie potenciálnej účinnosti voči IPO pred registráciou očkovacej látky je založené
na porovnaní imunitných odpovedí na sedem sérotypov, ktoré sú spoločné pre Synflorix a ďalšiu konjugovanú pneumokokovú očkovaciu látku (t.j. 7-valentný Prevenar), pri ktorej sa účinnosť ochrany
hodnotila v minulosti, a to v súlade s odporúčaniami WHO (Svetovej zdravotníckej organizácie).
Takisto sa stanovili imunitné odpovede na tri dodatočné sérotypy, ktoré sú obsiahnuté v Synflorixe.
V priamom („head-to-head“) porovnávacom skúšaní so 7-valentným Prevenarom sa noninferiorita imunitnej odpovede na Synflorix, stanovenej ELISA metódou, preukázala pri všetkých sérotypoch,
s výnimkou sérotypov 6B a 23F (horná hranica 96,5 % IS pri rozdiele medzi skupinami bola > 10 %)
(Tabuľka 6). Jeden mesiac po tretej dávke Synflorixu dosiahlo prahovú koncentráciu protilátok (t.j. 0,20 µg/ml) proti sérotypu 6B 65,9 % dojčiat a proti sérotypu 23F 81,4 % dojčiat očkovaných vo veku 2, 3 a 4 mesiacov oproti 79,0 % a 94,1 % dojčiat, v uvedenom poradí, po troch dávkach
7-valentného Prevenaru. Klinický význam týchto rozdielov je nejasný, keďže v dvojito zaslepenej, klastrovo-randomizovanej klinickej štúdii sa pozorovalo, že Synflorix je účinný voči IPO vyvolanému
sérotypom 6B (pozri tabuľku 1).
Percentuálny podiel očkovaných jedincov, ktorí dosiahli prahovú koncentráciu pri troch dodatočných
sérotypoch obsiahnutých v Synflorixe (1, 5 a 7F) bol 97,3 %, 99,0 % a 99,5 %, v uvedenom poradí, a bol minimálne tak dobrý ako súhrnná odpoveď na 7 spoločných sérotypov dosiahnutá
pri 7-valentnom Prevenare (95,8 %).
Tabuľka 6: Porovnávacia analýza medzi 7-valentným Prevenarom a Synflorixom týkajúca sa
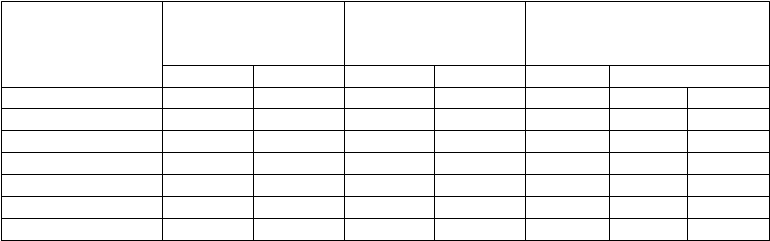
percentuálneho podielu jedincov s koncentráciou protilátok ≥ 0,20 µg/ml jeden mesiac po podaní
3. dávky
Protilátky Synflorix 7-valentný Prevenar
Rozdiel v % ≥ 0,20 µg/ml (7-valentný Prevenar mínus Synflorix)
N % N % % 96,5 % IS proti sérotypu 4 1 106 97,1 373 100 2,89 1,71 4,16 proti sérotypu 6B 1 100 65,9 372 79,0 13,12 7,53 18,28 proti sérotypu 9V 1 103 98,1 374 99,5 1,37 -0,28 2,56 proti sérotypu 14 1 100 99,5 374 99,5 -0,08 -1,66 0,71 proti sérotypu 18C 1 102 96,0 374 98,9 2,92 0,88 4,57 proti sérotypu 19F 1 104 95,4 375 99,2 3,83 1,87 5,50 proti sérotypu 23F 1 102 81,4 374 94,1 12,72 8,89 16,13
Po základnom očkovaní boli geometrické priemery koncentrácií (GMC) protilátok vyvolaných Synflorixom proti siedmim spoločným sérotypom nižšie ako GMC protilátok vyvolaných 7-valentným Prevenarom. GMC protilátok pred podaním posilňovacej dávky (8 až 12 mesiacov po poslednej dávke základného očkovania) boli zvyčajne podobné pri oboch očkovacích látkach. Po podaní posilňovacej dávky boli GMC protilátok vyvolaných Synflorixom nižšie pri väčšine sérotypov spoločných
so 7-valentným Prevenarom.
V tej istej štúdii sa preukázalo, že Synflorix vyvolal tvorbu funkčných protilátok proti všetkým
sérotypom obsiahnutým v očkovacej látke. Jeden mesiac po tretej dávke dosiahlo OPA titer ≥ 8
pri každom zo siedmich spoločných sérotypov 87,7 % až 100 % jedincov očkovaných Synflorixom
a 92,1 % až 100 % jedincov očkovaných 7-valentným Prevenarom. Rozdiel medzi oboma očkovacími látkami týkajúci sa percentuálneho podielu jedincov s OPA titrom ≥ 8 bol < 5 % pri všetkých spoločných sérotypoch, vrátane 6B a 23F. Po základnom očkovaní a po podaní posilňovacej dávky boli geometrické priemery titrov protilátok stanovených pomocou OPA (OPA GMT), ktoré vyvolal Synflorix, nižšie ako OPA GMT, ktoré vyvolal 7-valentný Prevenar, a to pri všetkých siedmich spoločných sérotypoch, s výnimkou sérotypu 19F.
Percentuálny podiel jedincov očkovaných Synflorixom, ktorí dosiahli OPA titer ≥ 8 pri sérotypoch
1, 5 a 7F bol 65,7 %, 90,9 % a 99,6 %, v uvedenom poradí, po základnej očkovacej schéme a 91,0 %,
96,3 % a 100 % po podaní posilňovacej dávky. Odpoveď na sérotypy 1 a 5 stanovená pomocou OPA
bola nižšieho stupňa ako odpoveď na každý z ostatných sérotypov. Význam týchto zistení z hľadiska účinnosti ochrany nie je známy. Odpoveď na sérotyp 7F bola v rovnakom rozmedzí ako pri siedmich sérotypoch, ktoré sú spoločné pre obe očkovacie látky.
Takisto sa preukázalo, že Synflorix vyvoláva imunitnú odpoveď na skrížene reagujúci sérotyp 19A, pričom 48,8 % (95 % IS: 42,9; 54,7) očkovaných dosiahlo OPA titer ≥ 8 jeden mesiac po podaní posilňovacej dávky.
Podanie štvrtej dávky (posilňovacej dávky) v druhom roku života vyvolalo tvorbu anamnestických
protilátok, stanovených pomocou ELISA a OPA, proti sérotypom obsiahnutým v očkovacej látke
a proti skrížene reagujúcemu sérotypu 19A, čo svedčí o navodení imunitnej pamäti po trojdávkovej
základnej očkovacej schéme.
4.2 Ďalšieúdajeoimunogenite
Dojčatávovekuod6týždňovdo6mesiacov
3-dávková základná očkovacia schéma
V klinických štúdiách sa imunogenita Synflorixu hodnotila po 3-dávkovej základnej očkovacej
schéme (6 941 jedincov) za použitia rôznych schém (zahŕňajúcich 6-10-14 týždňov, 2-3-4, 3-4-5 alebo
2-4-6 mesiacov veku) a po štvrtej (posilňovacej) dávke (5 645 jedincov) podanej po uplynutí minimálne 6 mesiacov od poslednej dávky základného očkovania a vo veku od 9 mesiacov.
Vo všeobecnosti sa pri rôznych schémach pozorovali porovnateľné odpovede na očkovaciu látku, hoci
pri schéme 2-4-6 mesiacov sa pozorovali o trocha vyššie imunitné odpovede.
2-dávková základná očkovacia schéma
V klinických štúdiách sa imunogenita Synflorixu hodnotila po 2-dávkovej základnej očkovacej
schéme (470 jedincov) za použitia rôznych schém (zahŕňajúcich 6-14 týždňov, 2-4 alebo 3-5 mesiacov veku) a po tretej (posilňovacej) dávke (470 jedincov) podanej po uplynutí minimálne 6 mesiacov
od poslednej dávky základného očkovania a vo veku od 9 mesiacov.
Klinická štúdia hodnotila imunogenitu Synflorixu u jedincov so základným očkovaním 2 dávkami alebo 3 dávkami v štyroch Európskych krajinách. Hoci sa medzi dvoma skupinami nezistil významný rozdiel v percentuálnom podiele jedincov s koncentráciou protilátok ≥ 0,20 µg/ml (ELISA), percentuálny podiel jedincov pri sérotypoch 6B a 23F bol nižší ako pri ostatných sérotypoch obsiahnutých v očkovacej látke (Tabuľka 7 a Tabuľka 8). U jedincov so základným očkovaním
2 dávkami v porovnaní s jedincami so základným očkovaním 3 dávkami bol percentuálny podiel
jedincov s OPA titrom ≥ 8 nižší pri sérotypoch 6B, 18C a 23F (74,4 %, 82,8 %, 86,3 % v danom poradí pri 2-dávkovej schéme a 88,9 %, 96,2 %, 97,7 % v danom poradí pri 3-dávkovej schéme). Celkovo bolo pretrvávanie imunitnej odpovede do podania posilňovacej dávky vo veku 11 mesiacov kratšie v skupine jedincov so základným očkovaním 2 dávkami. Pri oboch schémach sa pozorovala odpoveď na podanie posilňovacej dávky svedčiaca o imunologickej pamäti pri každom sérotype obsiahnutom v očkovacej látke (Tabuľka 7 a Tabuľka 8). Po podaní posilňovacej dávky sa pozoroval nižší percentuálny podiel jedincov s OPA titrom ≥ 8 pri 2-dávkovej schéme pri sérotype 5 (87,2 % oproti 97,5 % u jedincov so základným očkovaním 3 dávkami) a 6B (81,1 % oproti 90,3 %), všetky ostatné odpovede boli porovnateľné.
Tabuľka 7: Percentuálny podiel jedincov so základným očkovaním 2 dávkami s koncentráciami protilátok ≥ 0,20 µg/ml jeden mesiac po základnom očkovaní a jeden mesiac po podaní posilňovacej dávky
Protilátky
≥ 0,20 µg/ml (ELISA)
Po základnom očkovaní Po podaní posilňovacej dávky
% 95 % IS % 95 % IS
Proti-1 97,4 93,4 99,3 99,4 96,5 100
Proti-4 98,0 94,4 99,6 100 97,6 100
Proti-5 96,1 91,6 98,5 100 97,6 100
Proti-6B 55,7 47,3 63,8 88,5 82,4 93,0
Proti-7F 96,7 92,5 98,9 100 97,7 100
Proti-9V 93,4 88,2 96,8 99,4 96,5 100
Proti-14 96,1 91,6 98,5 99,4 96,5 100
Proti-18C 96,1 91,6 98,5 100 97,7 100
Proti-19F 92,8 87,4 96,3 96,2 91,8 98,6
Proti-23F 69,3 61,3 76,5 96,1 91,7 98,6
Tabuľka 8: Percentuálny podiel jedincov so základným očkovaním 3 dávkami s koncentráciami
protilátok ≥ 0,20 µg/ml jeden mesiac po základnom očkovaní a jeden mesiac po podaní
posilňovacej dávky
Protilátky
≥ 0,20 µg/ml (ELISA)
Po základnom očkovaní Po podaní posilňovacej dávky
% 95 % IS % 95 % IS


Proti-1 98,7 95,3 99,8 100 97,5 100
Proti-4 99,3 96,4 100 100 97,5 100
Proti-5 100 97,6 100 100 97,5 100
Proti-6B 63,1 54,8 70,8 96,6 92,2 98,9
Proti-7F 99,3 96,4 100 100 97,5 100
Proti-9V 99,3 96,4 100 100 97,5 100
Proti-14 100 97,6 100 98,6 95,2 99,8
Proti-18C 99,3 96,4 100 99,3 96,3 100
Proti-19F 96,1 91,6 98,5 98,0 94,2 99,6
Proti-23F 77,6 70,2 84,0 95,9 91,3 98,5
Pri skrížene reagujúcom sérotype 19A sa po základnom očkovaní a po podaní posilňovacej dávky pozorovali podobné GMC protilátok (ELISA) pri 2-dávkovej schéme (0,14 µg/ml (95 % IS:
0,12; 0,17) a 0,73 µg/ml (95 % IS: 0,58; 0,92)) a pri 3-dávkovej schéme (0,19 µg/ml (95 % IS:
0,16; 0,24) a 0,87 µg/ml (95 % IS: 0,69; 1,11)). Percentuálny podiel jedincov s OPA titrom ≥ 8
a OPA GMT pozorované po základnom očkovaní a po podaní posilňovacej dávky boli nižšie pri
2-dávkovej schéme ako pri 3-dávkovej schéme. Pri oboch schémach sa pozorovala odpoveď na podanie posilňovacej dávky svedčiaca o imunologickej pamäti.
Klinický význam nižších imunitných odpovedí po základnom očkovaní a po podaní posilňovacej
dávky pozorovaných po 2-dávkovej základnej očkovacej schéme nie je známy.
Klinická štúdia vykonaná v Južnej Afrike hodnotila imunogenitu Synflorixu po 3-dávkovom
(6-10-14 týždňov veku) alebo 2-dávkovom (6-14 týždňov veku) základnom očkovaní, po ktorom nasledovalo podanie posilňovacej dávky vo veku 9 - 10 mesiacov. Po základnom očkovaní bol
percentuálny podiel jedincov, ktorí dosiahli prahovú koncentráciu protilátok a OPA titer ≥ 8
pri sérotypoch obsiahnutých v očkovacej látke, po 2-dávkovej schéme v porovnaní s 3-dávkovou schémou podobný, s výnimkou nižšieho percentuálneho podielu s OPA titrom ≥ 8 pri sérotype 14. GMC protilátok a OPA GMT boli nižšie po 2-dávkovej schéme pri väčšine sérotypov obsiahnutých v očkovacej látke.
Pri skrížene reagujúcom sérotype 19A sa po základnom očkovaní pozoroval podobný percentuálny podiel jedincov, ktorí dosiahli prahovú koncentráciu protilátok a OPA titer ≥ 8, a podobné GMC
protilátok a OPA GMT v obidvoch skupinách.
Celkovo bolo pretrvávanie imunitných odpovedí pred podaním posilňovacej dávky kratšie v skupine s 2-dávkovým základným očkovaním v porovnaní so skupinou s 3-dávkovým základným očkovaním
pri väčšine sérotypov obsiahnutých v očkovacej látke a podobné pri sérotype 19A.
Podanie posilňovacej dávky vo veku 9 - 10 mesiacov
V štúdii vykonanej v Južnej Afrike vyvolala posilňovacia dávka podaná vo veku 9 - 10 mesiacov výrazné zvýšenie GMC protilátok a OPA GMT pri každom sérotype obsiahnutom v očkovacej látke a pri sérotype 19A v skupine s 2-dávkovým aj v skupine s 3-dávkovým základným očkovaním, čo svedčí o navodení imunitnej pamäti.
Podanie posilňovacej dávky vo veku 9 - 10 mesiacov verzus 15 – 18 mesiacov
Klinická štúdia vykonaná v Indii, ktorá hodnotila posilňovaciu dávku podanú vo veku 9 - 12 mesiacov u 66 detí alebo vo veku 15 - 18 mesiacov u 71 detí, nasledujúcu po základnom očkovaní vo veku
6, 10 a 14 týždňov, nezistila rozdiely medzi skupinami v zmysle GMC protilátok. V skupine detí,
ktorým sa posilňovacia dávka podala vo veku 15 - 18 mesiacov, boli zistené vyššie OPA GMT pri väčšine sérotypov obsiahnutých v očkovacej látke a pri sérotype 19A. Klinický význam tohto zistenia však nie je známy.
Imunitná pamäť
V Európskej štúdii hodnotiacej 2-dávkovú a 3-dávkovú základnú očkovaciu schému sa počas
následného sledovania preukázalo pretrvávanie protilátok vo veku 36 - 46 mesiacov u jedincov
so základným očkovaním 2 dávkami, po ktorom nasledovalo podanie posilňovacej dávky, pričom
minimálne 83,7 % jedincov zostalo séropozitívnymi na sérotypy obsiahnuté v očkovacej látke a skrížene reagujúci sérotyp 19A. U jedincov so základným očkovaním 3 dávkami, po ktorom nasledovalo podanie posilňovacej dávky, zostalo minimálne 96,5 % jedincov séropozitívnymi
na sérotypy obsiahnuté v očkovacej látke a 86,4 % jedincov zostalo séropozitívnymi na sérotyp 19A. Po jednorazovej dávke Synflorixu, ktorá bola podaná počas 4 roka života ako provokačná dávka, sa
u jedincov so základným očkovaním 2 dávkami a u jedincov so základným očkovaním 3 dávkami dosiahlo podobné násobné zvýšenie ELISA GMC protilátok a OPA GMT, a to od obdobia
pred očkovaním po obdobie po očkovaní. Tieto výsledky svedčia o imunologickej pamäti u jedincov
so základným očkovaním pri všetkých sérotypoch obsiahnutých v očkovacej látke a pri skrížene reagujúcom sérotype 19A.
N
eočkované dojčatá a deti vo veku ≥ 7 mesiacov
Imunitné odpovede vyvolané Synflorixom u predtým neočkovaných starších detí sa hodnotili v troch
klinických štúdiách.
Prvá klinická štúdia hodnotila imunitné odpovede na sérotypy obsiahnuté v očkovacej látke a na skrížene reagujúci sérotyp 19A u detí vo veku 7 - 11 mesiacov, 12 - 23 mesiacov a 2 až 5 rokov:
• Deti vo veku 7 - 11 mesiacov dostali základné očkovanie 2 dávkami, po ktorom nasledovalo podanie posilňovacej dávky v druhom roku života. V tejto vekovej skupine boli imunitné odpovede po podaní posilňovacej dávky vo všeobecnosti podobné ako imunitné odpovede pozorované po podaní posilňovacej dávky u dojčiat so základným očkovaním 3 dávkami pred dosiahnutím veku 6 mesiacov.
• U detí vo veku 12 - 23 mesiacov boli imunitné odpovede vyvolané po dvoch dávkach
porovnateľné s odpoveďami vyvolanými po troch dávkach u dojčiat pred dosiahnutím
6 mesiacov, s výnimkou sérotypov 18C a 19F obsiahnutých v očkovacej látke ako aj sérotypu 19A, pri ktorých boli odpovede vyššie u 12- až 23-mesačných detí.
• U detí vo veku 2 až 5 rokov, ktorým bola podaná 1 dávka, boli GMC protilátok (ELISA) pri 6 sérotypoch obsiahnutých v očkovacej látke ako aj pri sérotype 19A podobné ako GMC protilátok, ktoré sa dosiahli po 3-dávkovej očkovacej schéme u dojčiat pred dosiahnutím 6 mesiacov, zatiaľ čo pri 4 sérotypoch obsiahnutých v očkovacej látke (sérotypy 1, 5, 14 a 23F) boli nižšie. OPA GMT boli podobné alebo vyššie
po jednorazovej dávke ako po 3-dávkovom základnom očkovaní u dojčiat pred dosiahnutím 6 mesiacov, s výnimkou sérotypu 5.
V druhej klinickej štúdii sa zistilo, že jednorazová dávka podaná štyri mesiace po dvoch dávkach podaných v rámci doočkovania (tzv. catch-up očkovanie) vo veku 12 - 20 mesiacov vyvolala výrazné zvýšenie ELISA GMC protilátok a OPA GMT (v porovnaní s odpoveďami pred podaním poslednej dávky a po jej podaní), čo svedčí o tom, že dávky podané v rámci doočkovania zaisťujú adekvátne základné očkovanie.
Tretia klinická štúdia ukázala, že podanie 2 dávok s 2-mesačným časovým odstupom medzi dávkami, počínajúc vekom 36 - 46 mesiacov, malo za následok vyššie GMC protilátok (ELISA) a OPA GMT
v porovnaní s tými, ktoré sa pozorovali jeden mesiac po 3-dávkovom základnom očkovaní pri každom
sérotype obsiahnutom v očkovacej látke a pri skrížene reagujúcom sérotype 19A. Podiel jedincov s koncentráciou protilátok ≥ 0,20 µg/ml (ELISA) alebo OPA titrom ≥ 8 pri každom sérotype
obsiahnutom v očkovacej látke bol porovnateľný alebo vyšší v skupine s doočkovaním (tzv. catch-up
očkovanie) ako u dojčiat so základným očkovaním 3 dávkami.
Neskúmalo sa dlhodobé pretrvávanie protilátok po základnom očkovaní a podaní posilňovacej dávky
u dojčiat a po 2-dávkovej základnej očkovacej schéme u detí.
V klinickej štúdii sa preukázalo, že Synflorix sa môže bezpečne podať ako posilňovacia dávka
v druhom roku života deťom, ktorým sa v rámci základného očkovania podali 3 dávky 7-valentného
Prevenaru. Táto štúdia ukázala, že imunitné odpovede na 7 spoločných sérotypov boli porovnateľné
s imunitnými odpoveďami vyvolanými posilňovacou dávkou 7-valentného Prevenaru. Deti, ktorým sa
v rámci základného očkovania podá 7-valentný Prevenar, však nemajú základné očkovanie proti
dodatočným sérotypom obsiahnutým v Synflorixe (1, 5 a 7F). Preto stupeň a trvanie ochrany pred invazívnym pneumokokovým ochorením a otitis media vyvolanými týmito troma sérotypmi u detí tejto vekovej skupiny po podaní jedinej dávky Synflorixu nie je možné predpovedať.
4.3 Údaje o imunogenite u nedonosených
dojčiat
Imunogenita Synflorixu u veľmi nedonosených (gestačný vek 27 - 30 týždňov) (N=42), nedonosených
(gestačný vek 31 - 36 týždňov) (N=82) a donosených (gestačný vek > 36 týždňov) (N=132) dojčiat sa
hodnotila po základnom očkovaní 3 dávkami podanými vo veku 2, 4, 6 mesiacov. Imunogenita
po štvrtej dávke (posilňovacia dávka) podanej vo veku 15 až 18 mesiacov sa hodnotila u 44 veľmi
nedonosených, 69 nedonosených a 127 donosených dojčiat.
Jeden mesiac po základnom očkovaní (t.j po tretej dávke) dosiahlo koncentrácie
protilátok ≥ 0,20 µg/ml (ELISA) minimálne 92,7 % jedincov a OPA titer ≥ 8 dosiahlo minimálne
81,7 %, a to pri každom sérotype obsiahnutom v očkovacej látke, s výnimkou sérotypu 1 (OPA
titer ≥ 8 dosiahlo minimálne 58,8 %). Podobné GMC protilátok a OPA GMT sa pozorovali u všetkych
dojčiat, s výnimkou nižších GMC protilátok pri sérotypoch 4, 5, 9V a pri skrížene reagujúcom sérotype 19A u veľmi nedonosených dojčiat a pri sérotype 9V u nedonosených dojčiat a nižších OPA
GMT pri sérotype 5 u veľmi nedonosených detí. Klinický význam týchto rozdielov nie je známy.
Jeden mesiac po podaní posilňovacej dávky sa zvýšenie GMC protilátok (ELISA) a OPA GMT
pozorovalo pri každom sérotype obsiahnutom v očkovacej látke a pri skrížene reagujúcom
sérotype 19A, čo svedčí o imunologickej pamäti. Podobné GMC protilátok a OPA GMT sa pozorovali u všetkých dojčiat, s výnimkou nižších OPA GMT pri sérotype 5 u veľmi nedonosených dojčiat. Celkovo dosiahlo koncentrácie protilátok ≥ 0,20 µg/ml (ELISA) minimálne 97,6 % jedincov a OPA titer ≥ 8 dosiahlo minimálne 91,9 %, a to pri každom sérotype obsiahnutom v očkovacej látke.
4.4. Imunogenita v špeciálnych populáciách
HIV-pozitívne (HIV+/+) dojčatáa HIV-negatívnedojčatánarodené HIV-pozitívnym matkám
(HIV+/-)
V klinickej štúdii vykonanej v Južnej Afrike sa imunogenita Synflorixu podaného za použitia
3-dávkovej základnej očkovacej schémy (vo veku 6, 10 a 14 týždňov), po ktorej nasledovalo podanie posilňovacej dávky (vo veku 9 až 10 mesiacov), hodnotila u 70 HIV-pozitívnych (HIV+/+) dojčiat,
u 91 HIV-negatívnych dojčiat narodených HIV-pozitívnym matkám (HIV+/-) a u 93 HIV-negatívnych
dojčiat narodených HIV-negatívnym matkám (HIV-/-). Do štúdie boli zaradené iba HIV+/+ dojčatá,
ktoré mali podľa klasifikácie WHO ochorenie v štádiu 1 (asymptomatické) alebo 2 (mierne príznaky).
Pri väčšine sérotypov obsiahnutých v očkovacej látke sa pri porovnaniach medzi skupinami nezistili žiadne rozdiely v imunitných odpovediach po základnom očkovaní medzi HIV+/+ skupinou
a HIV-/- skupinou, alebo HIV+/- skupinou a HIV-/- skupinou, s výnimkou tendencie k nižšiemu percentuálnemu podielu jedincov, ktorí dosiahli OPA titer ≥ 8, a k nižším OPA GMT
v HIV+/+ skupine. Klinický význam tejto nižšej odpovede v zmysle OPA titra po základnom očkovaní
nie je známy. Pri skrížene reagujúcom sérotype 19A výsledky neukázali žiadne rozdiely v ELISA GMC protilátok a OPA GMT medzi skupinami.
Posilňovacia dávka Synflorixu vyvolala u HIV+/+ and HIV+/- dojčiat výrazné zvýšenie
ELISA GMC protilátok a OPA GMT pri každom sérotype obsiahnutom v očkovacej látke
a pri sérotype 19A, čo svedčí o navodení imunitnej pamäti. Pri väčšine sérotypov obsiahnutých
v očkovacej látke a pri sérotype 19A sa pri porovnaniach medzi skupinami nezistili žiadne rozdiely v ELISA GMC protilátok a OPA GMT po podaní posilňovacej dávky medzi HIV+/+ skupinou
a HIV-/- skupinou, alebo HIV+/- skupinou a HIV-/- skupinou.
Výsledky týkajúce sa proteínu D ukazujú, že imunitné odpovede po základnom očkovaní a po podaní
posilňovacej dávky sú medzi skupinami porovnateľné.
V každej skupine sa zistilo pretrvávanie imunitných odpovedí vo veku 24 - 27 mesiacov, t. j. až do
15 mesiacov po podaní posilňovacej dávky.
D
eti s kosáčikovitou anémiou
Klinická štúdia vykonaná v Burkina Faso hodnotila imunogenitu Synflorixu podaného 146 deťom
s SCD (s chorobou Hb-SS, s chorobou Hb-SC alebo s beta-talasémiou) v porovnaní so 143 deťmi rovnakého veku bez SCD. Pokiaľ ide o deti so SCD, 48 detí vo veku < 6 mesiacov dostalo základné očkovanie v 8, 12 a 16 týždňoch veku, po ktorom nasledovalo podanie posilňovacej dávky vo veku
9 - 10 mesiacov, u 50 detí vo veku 7 - 11 mesiacov a u 48 detí vo veku 12 - 23 mesiacov sa začalo doočkovanie (tzv. catch-up očkovanie) zodpovedajúce ich veku. Nezdalo sa, že by SCD mala vplyv
na imunitnú odpoveď na Synflorix pri každom sérotype obsiahnutom v očkovacej látke a pri sérotype
19A, ako aj pri proteíne D.
4.5. Imunogenita Synflorixu obsahujúcehokonzervačnúlátku 2-fenoxyetanol (2-PE)
Imunogenita Synflorixu obsahujúceho konzervačnú látku 2-PE (dodávaného v 4-dávkovom balení) sa
hodnotila u zdravých dojčiat očkovaných vo veku 6, 10 a 18 týždňov a porovnala so zdravými
dojčatami, ktorým sa podal Synflorix bez pridanej konzervačnej látky (do každej skupiny bolo zaradených 160 osôb).
Imunitné odpovede sa porovnali pomocou kritérií noninferiority v zmysle pomeru GMC protilátok (GMC v skupine osôb, ktorým sa podal Synflorix bez 2-PE, v porovnaní s GMC v skupine osôb, ktorým sa podal Synflorix s 2-PE) pri každom z 10 sérotypov obsiahnutých v očkovacej látke
a pri skrížene reagujúcom sérotype 19A.
Preukázala sa noninferiorita, pretože horná hranica obojstranného 95 % IS pre pomery GMC
protilátok bola nižšia ako 2 pri každom z 10 sérotypov obsiahnutých v očkovacej látke a pri sérotype
19A. Okrem toho sa zistilo, že OPA GMT boli v obidvoch skupinách v rovnakých rozmedziach.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií so Synflorixom v jednej alebo vo viacerých podskupinách pediatrickej populácie s ochorením spôsobeným Streptococcus pneumoniae a s akútnym zápalom stredného ucha spôsobeným Haemophilus influenzae (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Hodnotenie farmakokinetických vlastností pri očkovacích látkach nie je k dispozícii.
5.3 Predklinické údaje o bezpečnosti
Štúdie s 11-valentnou očkovacou látkou zastupujúcou Synflorix neodhalili žiadne osobitné riziko pre ľudí na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednorazovom a opakovanom podávaní.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
1-dávkové a 2-dávkové balenie chlorid sodný
voda na injekciu
4-dávkové balenie chlorid sodný
2-fenoxyetanol
voda na injekciu
Adsorbent, pozri časť 2.
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
1-dávkové a 2-dávkové balenie
4 roky
4-dávkové balenie
3 roky
Po prvom otvorení viacdávkovej injekčnej liekovky:
2-dávkováinjekčnáliekovka
Po prvom otvorení 2-dávkovej injekčnej liekovky sa odporúča očkovaciu látku ihneď použiť. Ak sa očkovacia látka nepoužije ihneď, má sa uchovávať v chladničke (2 °C - 8 °C). Ak sa nepoužije do
6 hodín, má sa zlikvidovať.
4-dávkováinjekčnáliekovka
Po prvom otvorení 4-dávkovej injekčnej liekovky sa očkovacia látka môže uchovávať v chladničke
(2 °C – 8 °C) maximálne 28 dní. Ak sa nepoužije do 28 dní, má sa zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Viacdávkováinjekčnáliekovka
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Naplnenáinjekčnástriekačka
0,5 ml suspenzie naplnenej v injekčnej striekačke (sklo typu I) pre 1 dávku, s gumovým uzáverom
(butylkaučuk), s ihlami alebo bez ihiel. Veľkosť balenia po 1, 10 alebo 50 ks.
Injekčnáliekovka
0,5 ml suspenzie v injekčnej liekovke (sklo typu I) pre 1 dávku, s uzáverom (butylkaučuk). Veľkosť
balenia po 1, 10 alebo 100 ks.
Viacdávkováinjekčnáliekovka
1 ml suspenzie v injekčnej liekovke (sklo typu I) pre 2 dávky, s uzáverom (butylkaučuk). Veľkosť
balenia po 100 ks.
2 ml suspenzie v injekčnej liekovke (sklo typu I) pre 4 dávky, s uzáverom (butylkaučuk). Veľkosť
balenia po 10 alebo 100 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
N
aplnená
i
n
j
ekčná
striekačka
Počas uchovávania naplnenej injekčnej striekačky sa môže vytvoriť jemný biely sediment a číry
bezfarebný supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah naplnenej injekčnej striekačky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Pokyny na podanieočkovacejlátky
1. Držte valec injekčnej striekačky v jednej ruke
(vyhnite sa držaniu piestu injekčnej striekačky). Odskrutkujte uzáver injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
Piest injekčnej striekačky
Valec injekčnej striekačky
Uzáver injekčnej striekačky
2. Pripojte ihlu k injekčnej striekačke tak,
že otáčajte ihlu v smere hodinových ručičiek
do injekčnej striekačky, pokým nepocítite uzamknutie.
3. Odstráňte kryt ihly, čo môže ísť občas trochu ťažšie.
InjekčnáliekovkaPočas uchovávania injekčnej liekovky sa môže vytvoriť jemný biely sediment a číry bezfarebný supernatant. Nepovažujú sa za znak znehodnotenia.

Kryt ihly

Pred podaním sa má obsah injekčnej liekovky opticky skontrolovať na prítomnosť cudzorodých častíc
a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu
sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
V
i
acdávková
i
n
j
ekčná
li
ekovka
Počas uchovávania injekčnej liekovky sa môže vytvoriť jemný biely sediment a číry bezfarebný
supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah injekčnej liekovky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Pri použití viacdávkovej injekčnej liekovky sa má každá 0,5 ml dávka odobrať pomocou sterilnej ihly
a injekčnej striekačky; majú sa dodržať opatrenia na zabránenie kontaminácie obsahu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
GlaxoSmithKline Biologicals S.A. Rue de l’Institut 89
B-1330 Rixensart, Belgicko
8. REGISTRAČNÉ ČÍSLA
Naplnenáinjekčnástriekačka
EU/1/09/508/001
EU/1/09/508/002
EU/1/09/508/003
EU/1/09/508/004
EU/1/09/508/005
EU/1/09/508/010
Injekčnáliekovka
EU/1/09/508/006
EU/1/09/508/007
EU/1/09/508/008
Viacdávkováinjekčnáliekovka
2-dávkováinjekčnáliekovka
EU/1/09/508/009
4-dávkováinjekčnáliekovka
EU/1/09/508/012
EU/1/09/508/013
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 30. marca 2009
Dátum posledného predĺženia registrácie: 21. februára 2014
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
Písomná informácia pre používateľa
Synflorix injekčná suspenzia naplnená v injekčnej striekačke
Pneumokoková polysacharidová konjugovaná očkovacia látka (adsorbovaná)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
• Táto očkovacia látka bola predpísaná len vášmu dieťaťu. Nedávajte ju nikomu inému.
• Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Synflorix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
3. Ako sa Synflorix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Synflorix
6. Obsah balenia a ďalšie informácie
1. Čo je Synflorix a na čo sa používa
Synflorix je pneumokoková konjugovaná očkovacia látka. Lekár alebo zdravotná sestra touto
očkovacou látkou vaše dieťa zaočkuje.
U vášho dieťaťa vo veku od 6 týždňov do 5 rokov sa použije na to, aby ho ochránila pred: baktériou označovanou ako „Streptococcus pneumoniae“. Táto baktéria môže vyvolať závažné ochorenia zahŕňajúce meningitídu (zápal mozgových blán), sepsu (otrava krvi) a bakterémiu (prítomnosť baktérií v krvnom riečisku) ako aj infekciu ucha alebo pneumóniu (zápal pľúc).
Ako Synflorix pôsobí
Synflorix napomáha tomu, aby si telo vytvorilo svoje vlastné protilátky. Protilátky tvoria súčasť
imunitného systému, ktorý vaše dieťa ochráni pred týmito ochoreniami.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
Synflorix sa nesmie podať:
• ak malo vaše dieťa v minulosti alergickú reakciu (je precitlivené) na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6).
Znaky alergickej reakcie môžu zahŕňať svrbivú kožnú vyrážku, namáhavé dýchanie a opuch
tváre alebo jazyka.
• ak má vaše dieťa závažnú infekciu s vysokou teplotou (nad 38 °C). Ak sa to vzťahuje na vaše dieťa, potom sa očkovanie odloží, kým sa vaše dieťa nebude cítiť lepšie. Slabá infekcia, ako napríklad nádcha, by nemala byť problémom. Najprv sa však porozprávajte s lekárom.
Ak sa na vaše dieťa vzťahuje ktorékoľvek z vyššie uvedeného, Synflorix sa mu nesmie podať. Ak si nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred tým, než vaše dieťa dostane Synflorix.
U
pozornenia a opatrenia:
Pred podaním tejto očkovacej látky sa poraďte s lekárom alebo lekárnikom:
• ak má vaše dieťa problémy so zrážanlivosťou krvi alebo sa mu ľahko tvoria krvné podliatiny.
U detí vo veku od 2 rokov môže dôjsť k omdletiu po vpichnutí ihly, alebo dokonca aj pred jej vpichnutím, preto povedzte lekárovi alebo zdravotnej sestre, ak vaše dieťa v minulosti pri injekcii omdlelo.
Tak ako všetky očkovacie látky, ani Synflorix nemusí úplne ochrániť všetky očkované deti. Synflorix chráni iba pred infekciami vyvolanými baktériami, proti ktorým bola očkovacia látka
vyvinutá.
Deťom s oslabeným imunitným systémom (napríklad v dôsledku infekcie vírusom HIV alebo
imunosupresívnej liečby) nemusí Synflorix poskytnúť úplnú ochranu.
Ak si nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred očkovaním Synflorixom.
Iné lieky a Synflorix
Ak vaše dieťa užíva alebo v poslednom čase užívalo ešte iné lieky, resp. bude užívať ďalšie lieky, povedzte to lekárovi alebo lekárnikovi. Týka sa to aj liekov, ktorých výdaj nie je viazaný na lekársky predpis alebo akejkoľvek inej, nedávno podanej očkovacej látky. Synflorix nemusí pôsobiť dostatočne, ak vaše dieťa užíva lieky, ktoré ovplyvňujú schopnosť imunitného systému zdolať infekciu.
Synflorix sa môže podať v rovnakom čase ako iné detské očkovacie látky, ako napríklad očkovacia látka proti záškrtu, tetanu, čiernemu kašľu, očkovacia látka proti Haemophilus influenzae typ b, ústami užívaná alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B, očkovacia látka proti osýpkam-príušniciam-ružienke, očkovacia látka proti ovčím kiahňam, ústami užívaná očkovacia látka proti rotavírusom, ako aj konjugovaná očkovacia látka proti meningokokom séroskupiny C a konjugovaná očkovacia látka proti meningokokom séroskupín A, C, W-135, Y.
Rôzne očkovacie látky sa podajú do rôznych miest tela.
Lekár vás môže požiadať, aby ste vášmu dieťaťu pred alebo ihneď po podaní Synflorixu dali užiť liek, ktorý znižuje horúčku (napríklad paracetamol). Môže to pomôcť zmierniť niektoré vedľajšie účinky Synflorixu (febrilné (horúčkovité) reakcie). Ak však vaše dieťa užilo paracetamol pred alebo ihneď
po podaní Synflorixu, dosiahnuté hladiny protilátok môžu byť mierne znížené. Nie je známe, či má
zníženie hladín protilátok vplyv na ochranu pred pneumokokovým ochorením.
Synflorix obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
3. Ako sa Synflorix podáva
Ako sa očkovacia látka podáva
Synflorix sa vždy podáva injekciou do svalu, a to zvyčajne do stehna alebo do hornej časti ramena.
A
ké množstvo sa podáva
Za zvyčajných okolností dostane vaše dieťa (vo veku od 6 týždňov do 6 mesiacov) očkovaciu schému pozostávajúcu zo 4 injekcií v súlade s oficiálnymi odporúčaniami, ale zdravotnícky pracovník môže použiť aj alternatívnu schému. Je dôležité riadiť sa pokynmi lekára alebo zdravotnej sestry a ukončiť celú očkovaciu schému.
• Medzi podaním jednotlivých injekcií musí uplynúť aspoň jeden mesiac, s výnimkou poslednej injekcie (posilňovacej injekcie), ktorá sa podá po uplynutí aspoň 6 mesiacov od tretej injekcie.
• Prvá injekcia sa môže podať vo veku od 6 týždňov. Posledná injekcia (posilňovacia injekcia) sa môže podať vo veku od 9 mesiacov.
• Lekár vám povie, kedy sa máte s dieťaťom dostaviť kvôli podaniu ďalšej injekcie.
Predčasne narodené deti (narodené po 27 týždňoch a pred 37. týždňom tehotenstva)
Vaše dieťa (vo veku od 2 do 6 mesiacov) dostane 3 injekcie, pričom medzi podaním jednotlivých dávok musí uplynúť aspoň jeden mesiac. Po uplynutí aspoň šiestich mesiacov od poslednej injekcie vaše dieťa dostane dodatočnú injekciu (posilňovaciu injekciu).
Dojčatá vo veku od 7 do 11 mesiacov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie musí uplynúť aspoň jeden mesiac. Tretia injekcia (posilňovacia injekcia) sa podá v druhom roku života, a to po uplynutí aspoň dvoch mesiacov od podania druhej injekcie.
Deti vo veku od 12 mesiacov do 5 rokov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie
musia uplynúť aspoň dva mesiace.
Špeciálne populácie:
Synflorix sa môže podávať deťom mladším ako 2 roky, ktoré sú vystavené vyššiemu riziku pneumokokovej infekcie (napríklad deti s infekciou spôsobenou vírusom ľudskej imunitnej nedostatočnosti (HIV) alebo s kosáčikovitou anémiou). Požiadajte, prosím, lekára o informácie týkajúce sa počtu injekcií, ktoré má vaše dieťa dostať, a o čase ich podania.
Ak vaše dieťa vynechá injekciu
Ak vaše dieťa vynechá injekciu, je dôležité, aby ste si dohovorili ďalšiu návštevu ordinácie. Je to kvôli tomu, aby ste sa s lekárom mohli poradiť o tom, čo treba urobiť, aby bolo vaše dieťa chránené.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Pri tomto lieku sa môžu objaviť nasledujúce vedľajšie účinky:
Veľmi časté (tieto sa môžu vyskytnúť pri viac než 1 z 10 dávok očkovacej látky)
• bolesť, začervenanie a opuch v mieste podania injekcie
• vysoká teplota rovná 38 °C alebo vyššia (horúčka)
• ospalosť
• podráždenosť
• nechutenstvo.
Časté (tieto sa môžu vyskytnúť až pri 1 z 10 dávok očkovacej látky)
• tvrdá zdurenina v mieste podania injekcie.
Menej časté (tieto sa môžu vyskytnúť až pri 1 zo 100 dávok očkovacej látky)
• svrbenie, krvná zrazenina, krvácanie alebo hrčka v mieste podania injekcie
• napínanie na vracanie, hnačka alebo vracanie (dávenie)
• nezvyčajný plač
• prechodné zastavenie dýchania (apnoe), ak sa dieťa narodilo predčasne (do a vrátane 28. týždňa
tehotenstva)
• bolesť hlavy
• kožná vyrážka
• difúzny (rozptýlený) opuch očkovanej končatiny, niekedy postihujúci priľahlý kĺb
• žihľavka.
Zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 1 000 dávok očkovacej látky)
• kŕče bez teploty alebo spôsobené vysokou teplotou (horúčkou)
• alergické reakcie, akými sú kožné alergické prejavy
• kolaps (náhla svalová ochabnutosť), periódy bezvedomia alebo nedostatku vedomia a bledosť
alebo modrasté sfarbenie pokožky.
Veľmi zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 10 000 dávok očkovacej látky)
• Závažné alergické reakcie, ktoré je možné rozpoznať podľa:
- vyvýšenej a svrbivej vyrážky (žihľavka)
- opuchu, ktorý niekedy postihuje tvár alebo ústa (angioedém), čo spôsobuje ťažkosti
s dýchaním
- kolaps.
Tieto reakcie sa zvyčajne objavia predtým, ako opustíte ordináciu lekára. Ak sa však u vášho
dieťaťa vyskytne ktorýkoľvek z týchto príznakov, musíte urýchlene vyhľadať lekára.
• Kawasakiho choroba (hlavné príznaky tohto ochorenia sú napríklad: horúčka, kožná vyrážka,
opuchnuté lymfatické uzliny, zápal a vyrážky postihujúce sliznicu úst a hrdla).
Posilňovacie dávky Synflorixu môžu zvýšiť riziko vzniku vedľajších účinkov.
U detí vo veku > 12 mesiacov sa riziko vzniku bolesti v mieste vpichu môže zvyšovať so zvyšujúcim sa vekom.
V priebehu 2-3 dní po očkovaní sa u veľmi predčasne narodených detí (narodené do a vrátane
28. týždňa tehotenstva) môžu vyskytovať dlhšie prestávky v dýchaní ako obvykle.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať SynflorixTento liek uchovávajte mimo dohľadu a dosahu detí.
• Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
• Uchovávajte v chladničke (2 °C - 8 °C).
• Uchovávajte v pôvodnom obale na ochranu pred svetlom.
• Neuchovávajte v mrazničke.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Č
o Synflorix obsahuje
• Liečivá sú:
Jedna 0,5 ml dávka obsahuje:
Pneumokokový polysacharid sérotyp 11,2 1 mikrogram
Pneumokokový polysacharid sérotyp 41,2 3 mikrogramy Pneumokokový polysacharid sérotyp 51,2 1 mikrogram Pneumokokový polysacharid sérotyp 6B1,2 1 mikrogram Pneumokokový polysacharid sérotyp 7F1,2 1 mikrogram Pneumokokový polysacharid sérotyp 9V1,2 1 mikrogram Pneumokokový polysacharid sérotyp 141,2 1 mikrogram Pneumokokový polysacharid sérotyp 18C1,3 3 mikrogramy Pneumokokový polysacharid sérotyp 19F1,4 3 mikrogramy Pneumokokový polysacharid sérotyp 23F1,2 1 mikrogram
1 adsorbovaný na fosforečnan hlinitý 0,5 miligramu Al3+
2 konjugovaný na proteín D (odvodený od netypizovateľného Haemophilus influenzae) ako
proteínový nosič 9 - 16 mikrogramov
3 konjugovaný na tetanový toxoid ako proteínový nosič 5 - 10 mikrogramov
4 konjugovaný na difterický toxoid ako proteínový nosič 3 - 6 mikrogramov
• Ďalšie zložky sú: chlorid sodný a voda na injekciu
Ako vyzerá Synflorix a obsah balenia
• Injekčná suspenzia naplnená v injekčnej striekačke.
• Synflorix je biela, zakalená suspenzia.
• Synflorix sa dodáva v naplnených injekčných striekačkách s ihlami alebo bez ihiel v baleniach po 1, 10 alebo 50 ks.
• Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii a výrobca
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel: +370 5 264 90 00
inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел.: + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 cz
.info@gsk.comMagyarország GlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
Ε
λλάδα
GlaxoSmithKline A.E.B.E
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 1 970 75-0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comPortugalGlaxoSmithKline - Produtos Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.com
H
rvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
România
GlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej agentúry pre lieky.
-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Počas uchovávania naplnenej injekčnej striekačky sa môže vytvoriť jemný biely sediment a číry
bezfarebný supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah naplnenej injekčnej striekačky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Očkovacia látka je určená len na intramuskulárne použitie. Nepodávajte ju intravaskulárne.
Ak sa Synflorix podáva súbežne s inými očkovacími látkami, musia sa podať do rôznych miest
vpichu.
Synflorix sa nesmie miešať s inými očkovacími látkami.
Pokyny na podanie očkovacej látky dodanej v naplnenej injekčnej striekačke1. Držte
valecinjekčnej striekačky v jednej ruke
(vyhnite sa držaniu piestu injekčnej striekačky). Odskrutkujte uzáver injekčnej striekačky otáčaním
proti smeru hodinových ručičiek.
Piest injekčnej striekačky
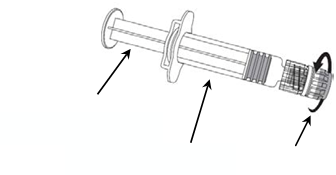
Valec injekčnej striekačky Uzáver injekčnej striekačky
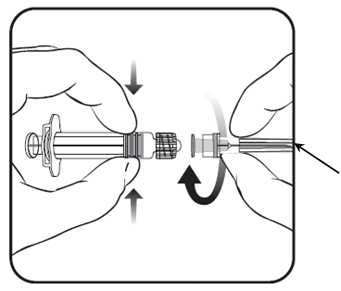
2. Pripojte ihlu k injekčnej striekačke tak,
že otáčajte ihlu v smere hodinových ručičiek
do injekčnej striekačky, pokým nepocítite uzamknutie.
3. Odstráňte kryt ihly, čo môže ísť občas trochu ťažšie.
Kryt ihly
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
Písomná informácia pre používateľa
Synflorix injekčná suspenzia
Pneumokoková polysacharidová konjugovaná očkovacia látka (adsorbovaná)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
• Táto očkovacia látka bola predpísaná len vášmu dieťaťu. Nedávajte ju nikomu inému.
• Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Synflorix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
3. Ako sa Synflorix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Synflorix
6. Obsah balenia a ďalšie informácie
1. Čo je Synflorix a na čo sa používa
Synflorix je pneumokoková konjugovaná očkovacia látka. Lekár alebo zdravotná sestra touto
očkovacou látkou vaše dieťa zaočkuje.
U vášho dieťaťa vo veku od 6 týždňov do 5 rokov sa použije na to, aby ho ochránila pred: baktériou označovanou ako „Streptococcus pneumoniae“. Táto baktéria môže vyvolať závažné ochorenia zahŕňajúce meningitídu (zápal mozgových blán), sepsu (otrava krvi) a bakterémiu (prítomnosť baktérií v krvnom riečisku) ako aj infekciu ucha alebo pneumóniu (zápal pľúc).
Ako Synflorix pôsobí
Synflorix napomáha tomu, aby si telo vytvorilo svoje vlastné protilátky. Protilátky tvoria súčasť
imunitného systému, ktorý vaše dieťa ochráni pred týmito ochoreniami.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
Synflorix sa nesmie podať:
• ak malo vaše dieťa v minulosti alergickú reakciu (je precitlivené) na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6).
Znaky alergickej reakcie môžu zahŕňať svrbivú kožnú vyrážku, namáhavé dýchanie a opuch
tváre alebo jazyka.
• ak má vaše dieťa závažnú infekciu s vysokou teplotou (nad 38 °C). Ak sa to vzťahuje na vaše dieťa, potom sa očkovanie odloží, kým sa vaše dieťa nebude cítiť lepšie. Slabá infekcia, ako napríklad nádcha, by nemala byť problémom. Najprv sa však porozprávajte s lekárom.
Ak sa na vaše dieťa vzťahuje ktorékoľvek z vyššie uvedeného, Synflorix sa mu nesmie podať. Ak si
nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred tým, než vaše dieťa dostane Synflorix.
U
pozornenia a opatrenia:
Pred podaním tejto očkovacej látky sa poraďte s lekárom alebo lekárnikom:
• ak má vaše dieťa problémy so zrážanlivosťou krvi alebo sa mu ľahko tvoria krvné podliatiny.
U detí vo veku od 2 rokov môže dôjsť k omdletiu po vpichnutí ihly, alebo dokonca aj pred jej vpichnutím, preto povedzte lekárovi alebo zdravotnej sestre, ak vaše dieťa v minulosti pri injekcii omdlelo.
Tak ako všetky očkovacie látky, ani Synflorix nemusí úplne ochrániť všetky očkované deti. Synflorix chráni iba pred infekciami vyvolanými baktériami, proti ktorým bola očkovacia látka
vyvinutá.
Deťom s oslabeným imunitným systémom (napríklad v dôsledku infekcie vírusom HIV alebo imunosupresívnej liečby) nemusí Synflorix poskytnúť úplnú ochranu.
Ak si nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred očkovaním Synflorixom.
Iné lieky a Synflorix
Ak vaše dieťa užíva alebo v poslednom čase užívalo ešte iné lieky, resp. bude užívať ďalšie lieky, povedzte to lekárovi alebo lekárnikovi. Týka sa to aj liekov, ktorých výdaj nie je viazaný na lekársky predpis alebo akejkoľvek inej, nedávno podanej očkovacej látky. Synflorix nemusí pôsobiť dostatočne, ak vaše dieťa užíva lieky, ktoré ovplyvňujú schopnosť imunitného systému zdolať infekciu.
Synflorix sa môže podať v rovnakom čase ako iné detské očkovacie látky, ako napríklad očkovacia látka proti záškrtu, tetanu, čiernemu kašľu, očkovacia látka proti Haemophilus influenzae typ b, ústami užívaná alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B, očkovacia látka proti osýpkam-príušniciam-ružienke, očkovacia látka proti ovčím kiahňam, ústami užívaná očkovacia látka proti rotavírusom, ako aj konjugovaná očkovacia látka proti meningokokom séroskupiny C a konjugovaná očkovacia látka proti meningokokom séroskupín A, C, W-135, Y.
Rôzne očkovacie látky sa podajú do rôznych miest tela.
Lekár vás môže požiadať, aby ste vášmu dieťaťu pred alebo ihneď po podaní Synflorixu dali užiť liek, ktorý znižuje horúčku (napríklad paracetamol). Môže to pomôcť zmierniť niektoré vedľajšie účinky Synflorixu (febrilné (horúčkovité) reakcie). Ak však vaše dieťa užilo paracetamol pred alebo ihneď
po podaní Synflorixu, dosiahnuté hladiny protilátok môžu byť mierne znížené. Nie je známe, či má
zníženie hladín protilátok vplyv na ochranu pred pneumokokovým ochorením.
Synflorix obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
3. Ako sa Synflorix podáva
Ako sa očkovacia látka podáva
Synflorix sa vždy podáva injekciou do svalu, a to zvyčajne do stehna alebo do hornej časti ramena.
A
ké množstvo sa podáva
Za zvyčajných okolností dostane vaše dieťa (vo veku od 6 týždňov do 6 mesiacov) očkovaciu schému pozostávajúcu zo 4 injekcií v súlade s oficiálnymi odporúčaniami, ale zdravotnícky pracovník môže použiť aj alternatívnu schému. Je dôležité riadiť sa pokynmi lekára alebo zdravotnej sestry a ukončiť celú očkovaciu schému.
• Medzi podaním jednotlivých injekcií musí uplynúť aspoň jeden mesiac, s výnimkou poslednej injekcie (posilňovacej injekcie), ktorá sa podá po uplynutí aspoň 6 mesiacov od tretej injekcie.
• Prvá injekcia sa môže podať vo veku od 6 týždňov. Posledná injekcia (posilňovacia injekcia) sa môže podať vo veku od 9 mesiacov.
• Lekár vám povie, kedy sa máte s dieťaťom dostaviť kvôli podaniu ďalšej injekcie.
Predčasne narodené deti (narodené po 27 týždňoch a pred 37. týždňom tehotenstva)
Vaše dieťa (vo veku od 2 do 6 mesiacov) dostane 3 injekcie, pričom medzi podaním jednotlivých dávok musí uplynúť aspoň jeden mesiac. Po uplynutí aspoň šiestich mesiacov od poslednej injekcie vaše dieťa dostane dodatočnú injekciu (posilňovaciu injekciu).
Dojčatá vo veku od 7 do 11 mesiacov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie musí uplynúť aspoň jeden mesiac. Tretia injekcia (posilňovacia injekcia) sa podá v druhom roku života, a to po uplynutí aspoň dvoch mesiacov od podania druhej injekcie.
Deti vo veku od 12 mesiacov do 5 rokov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie
musia uplynúť aspoň dva mesiace.
Špeciálne populácie:
Synflorix sa môže podávať deťom mladším ako 2 roky, ktoré sú vystavené vyššiemu riziku pneumokokovej infekcie (napríklad deti s infekciou spôsobenou vírusom ľudskej imunitnej nedostatočnosti (HIV) alebo s kosáčikovitou anémiou). Požiadajte, prosím, lekára o informácie týkajúce sa počtu injekcií, ktoré má vaše dieťa dostať, a o čase ich podania.
Ak vaše dieťa vynechá injekciu
Ak vaše dieťa vynechá injekciu, je dôležité, aby ste si dohovorili ďalšiu návštevu ordinácie. Je to kvôli
tomu, aby ste sa s lekárom mohli poradiť o tom, čo treba urobiť, aby bolo vaše dieťa chránené.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Pri tomto lieku sa môžu objaviť nasledujúce vedľajšie účinky:
Veľmi časté (tieto sa môžu vyskytnúť pri viac než 1 z 10 dávok očkovacej látky)
• bolesť, začervenanie a opuch v mieste podania injekcie
• vysoká teplota rovná 38 °C alebo vyššia (horúčka)
• ospalosť
• podráždenosť
• nechutenstvo.
Časté (tieto sa môžu vyskytnúť až pri 1 z 10 dávok očkovacej látky)
• tvrdá zdurenina v mieste podania injekcie.
Menej časté (tieto sa môžu vyskytnúť až pri 1 zo 100 dávok očkovacej látky)
• svrbenie, krvná zrazenina, krvácanie alebo hrčka v mieste podania injekcie
• napínanie na vracanie, hnačka alebo vracanie (dávenie)
• nezvyčajný plač
• prechodné zastavenie dýchania (apnoe), ak sa dieťa narodilo predčasne (do a vrátane 28. týždňa
tehotenstva)
• bolesť hlavy
• kožná vyrážka
• difúzny (rozptýlený) opuch očkovanej končatiny, niekedy postihujúci priľahlý kĺb
• žihľavka.
Zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 1 000 dávok očkovacej látky)
• kŕče bez teploty alebo spôsobené vysokou teplotou (horúčkou)
• alergické reakcie, akými sú kožné alergické prejavy
• kolaps (náhla svalová ochabnutosť), periódy bezvedomia alebo nedostatku vedomia a bledosť
alebo modrasté sfarbenie pokožky.
Veľmi zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 10 000 dávok očkovacej látky)
• Závažné alergické reakcie, ktoré je možné rozpoznať podľa:
- vyvýšenej a svrbivej vyrážky (žihľavka)
- opuchu, ktorý niekedy postihuje tvár alebo ústa (angioedém), čo spôsobuje ťažkosti
s dýchaním
- kolaps.
Tieto reakcie sa zvyčajne objavia predtým, ako opustíte ordináciu lekára. Ak sa však u vášho
dieťaťa vyskytne ktorýkoľvek z týchto príznakov, musíte urýchlene vyhľadať lekára.
• Kawasakiho choroba (hlavné príznaky tohto ochorenia sú napríklad: horúčka, kožná vyrážka,
opuchnuté lymfatické uzliny, zápal a vyrážky postihujúce sliznicu úst a hrdla).
Posilňovacie dávky Synflorixu môžu zvýšiť riziko vzniku vedľajších účinkov.
U detí vo veku > 12 mesiacov sa riziko vzniku bolesti v mieste vpichu môže zvyšovať so zvyšujúcim
sa vekom.
V priebehu 2-3 dní po očkovaní sa u veľmi predčasne narodených detí (narodené do a vrátane
28. týždňa tehotenstva) môžu vyskytovať dlhšie prestávky v dýchaní ako obvykle.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať SynflorixTento liek uchovávajte mimo dohľadu a dosahu detí.
• Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
• Uchovávajte v chladničke (2 °C - 8 °C).
• Uchovávajte v pôvodnom obale na ochranu pred svetlom.
• Neuchovávajte v mrazničke.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Č
o Synflorix obsahuje
• Liečivá sú:
Jedna 0,5 ml dávka obsahuje:
Pneumokokový polysacharid sérotyp 11,2 1 mikrogram
Pneumokokový polysacharid sérotyp 41,2 3 mikrogramy Pneumokokový polysacharid sérotyp 51,2 1 mikrogram Pneumokokový polysacharid sérotyp 6B1,2 1 mikrogram Pneumokokový polysacharid sérotyp 7F1,2 1 mikrogram Pneumokokový polysacharid sérotyp 9V1,2 1 mikrogram Pneumokokový polysacharid sérotyp 141,2 1 mikrogram Pneumokokový polysacharid sérotyp 18C1,3 3 mikrogramy Pneumokokový polysacharid sérotyp 19F1,4 3 mikrogramy Pneumokokový polysacharid sérotyp 23F1,2 1 mikrogram
1 adsorbovaný na fosforečnan hlinitý 0,5 miligramu Al3+
2 konjugovaný na proteín D (odvodený od netypizovateľného Haemophilus influenzae) ako
proteínový nosič 9 - 16 mikrogramov
3 konjugovaný na tetanový toxoid ako proteínový nosič 5 - 10 mikrogramov
4 konjugovaný na difterický toxoid ako proteínový nosič 3 - 6 mikrogramov
• Ďalšie zložky sú: chlorid sodný a voda na injekciu
Ako vyzerá Synflorix a obsah balenia
• Injekčná suspenzia
• Synflorix je biela, zakalená suspenzia.
• Synflorix sa dodáva v injekčných liekovkách v baleniach po 1, 10 alebo 100 ks.
• Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii a výrobca'
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel: +370 5 264 90 00
inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел.: + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 cz
.info@gsk.comMagyarország GlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
Ε
λλάδα
GlaxoSmithKline A.E.B.E
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 1 970 75-0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comPortugalGlaxoSmithKline - Produtos Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.com
H
rvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
România
GlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej agentúry pre lieky.
-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Počas uchovávania injekčnej liekovky sa môže vytvoriť jemný biely sediment a číry bezfarebný
supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah injekčnej liekovky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Očkovacia látka je určená len na intramuskulárne použitie. Nepodávajte ju intravaskulárne.
Ak sa Synflorix podáva súbežne s inými očkovacími látkami, musia sa podať do rôznych miest vpichu.
Synflorix sa nesmie miešať s inými očkovacími látkami. Ak sa dávka očkovacej látky odoberie do injekčnej striekačky, ihla použitá na odobratie sa musí nahradiť ihlou vhodnou na intramuskulárnu injekciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má byť zlikvidovať v súlade s národnými požiadavkami.
Písomná informácia pre používateľa
Synflorix injekčná suspenzia vo viacdávkovom balení (2 dávky)
Pneumokoková polysacharidová konjugovaná očkovacia látka (adsorbovaná)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
• Táto očkovacia látka bola predpísaná len vášmu dieťaťu. Nedávajte ju nikomu inému.
• Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4
V tejto písomnej informácii sa dozviete:
1. Čo je Synflorix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
3. Ako sa Synflorix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Synflorix
6. Obsah balenia a ďalšie informácie
1. Čo je Synflorix a na čo sa používa
Synflorix je pneumokoková konjugovaná očkovacia látka. Lekár alebo zdravotná sestra touto
očkovacou látkou vaše dieťa zaočkuje.
U vášho dieťaťa vo veku od 6 týždňov do 5 rokov sa použije na to, aby ho ochránila pred: baktériou označovanou ako „Streptococcus pneumoniae“. Táto baktéria môže vyvolať závažné ochorenia zahŕňajúce meningitídu (zápal mozgových blán), sepsu (otrava krvi) a bakterémiu (prítomnosť baktérií v krvnom riečisku) ako aj infekciu ucha alebo pneumóniu (zápal pľúc).
Ako Synflorix pôsobí
Synflorix napomáha tomu, aby si telo vytvorilo svoje vlastné protilátky. Protilátky tvoria súčasť
imunitného systému, ktorý vaše dieťa ochráni pred týmito ochoreniami.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
Synflorix sa nesmie podať:
• ak malo vaše dieťa v minulosti alergickú reakciu (je precitlivené) na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6).
Znaky alergickej reakcie môžu zahŕňať svrbivú kožnú vyrážku, namáhavé dýchanie a opuch
tváre alebo jazyka.
• ak má vaše dieťa závažnú infekciu s vysokou teplotou (nad 38 °C). Ak sa to vzťahuje na vaše dieťa, potom sa očkovanie odloží, kým sa vaše dieťa nebude cítiť lepšie. Slabá infekcia, ako napríklad nádcha, by nemala byť problémom. Najprv sa však porozprávajte s lekárom.
Ak sa na vaše dieťa vzťahuje ktorékoľvek z vyššie uvedeného, Synflorix sa mu nesmie podať. Ak si
nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred tým, než vaše dieťa dostane Synflorix.
U
pozornenia a opatrenia:
Pred podaním tejto očkovacej látky sa poraďte s lekárom alebo lekárnikom:
• ak má vaše dieťa problémy so zrážanlivosťou krvi alebo sa mu ľahko tvoria krvné podliatiny.
U detí vo veku od 2 rokov môže dôjsť k omdletiu po vpichnutí ihly, alebo dokonca aj pred jej vpichnutím, preto povedzte lekárovi alebo zdravotnej sestre, ak vaše dieťa v minulosti pri injekcii omdlelo.
Tak ako všetky očkovacie látky, ani Synflorix nemusí úplne ochrániť všetky očkované deti. Synflorix chráni iba pred infekciami vyvolanými baktériami, proti ktorým bola očkovacia látka
vyvinutá.
Deťom s oslabeným imunitným systémom (napríklad v dôsledku infekcie vírusom HIV alebo
imunosupresívnej liečby) nemusí Synflorix poskytnúť úplnú ochranu.
Ak si nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred očkovaním Synflorixom.
Iné lieky a Synflorix
Ak vaše dieťa užíva alebo v poslednom čase užívalo ešte iné lieky, resp. bude užívať ďalšie lieky, povedzte to lekárovi alebo lekárnikovi. Týka sa to aj liekov, ktorých výdaj nie je viazaný na lekársky predpis alebo akejkoľvek inej, nedávno podanej očkovacej látky. Synflorix nemusí pôsobiť dostatočne, ak vaše dieťa užíva lieky, ktoré ovplyvňujú schopnosť imunitného systému zdolať infekciu.
Synflorix sa môže podať v rovnakom čase ako iné detské očkovacie látky, ako napríklad očkovacia látka proti záškrtu, tetanu, čiernemu kašľu, očkovacia látka proti Haemophilus influenzae typ b, ústami užívaná alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B, očkovacia látka proti osýpkam-príušniciam-ružienke, očkovacia látka proti ovčím kiahňam, ústami užívaná očkovacia látka proti rotavírusom, ako aj konjugovaná očkovacia látka proti meningokokom séroskupiny C a konjugovaná očkovacia látka proti meningokokom séroskupín A, C, W-135, Y.
Rôzne očkovacie látky sa podajú do rôznych miest tela.
Lekár vás môže požiadať, aby ste vášmu dieťaťu pred alebo ihneď po podaní Synflorixu dali užiť liek, ktorý znižuje horúčku (napríklad paracetamol). Môže to pomôcť zmierniť niektoré vedľajšie účinky Synflorixu (febrilné (horúčkovité) reakcie). Ak však vaše dieťa užilo paracetamol pred alebo ihneď
po podaní Synflorixu, dosiahnuté hladiny protilátok môžu byť mierne znížené. Nie je známe, či má
zníženie hladín protilátok vplyv na ochranu pred pneumokokovým ochorením.
Synflorix obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
3. Ako sa Synflorix podáva
Ako sa očkovacia látka podáva
Synflorix sa vždy podáva injekciou do svalu, a to zvyčajne do stehna alebo do hornej časti ramena.
A
ké množstvo sa podáva
Za zvyčajných okolností dostane vaše dieťa (vo veku od 6 týždňov do 6 mesiacov) očkovaciu schému pozostávajúcu zo 4 injekcií v súlade s oficiálnymi odporúčaniami, ale zdravotnícky pracovník môže použiť aj alternatívnu schému. Je dôležité riadiť sa pokynmi lekára alebo zdravotnej sestry a ukončiť celú očkovaciu schému.
• Medzi podaním jednotlivých injekcií musí uplynúť aspoň jeden mesiac, s výnimkou poslednej injekcie (posilňovacej injekcie), ktorá sa podá po uplynutí aspoň 6 mesiacov od tretej injekcie.
• Prvá injekcia sa môže podať vo veku od 6 týždňov. Posledná injekcia (posilňovacia injekcia) sa môže podať vo veku od 9 mesiacov.
• Lekár vám povie, kedy sa máte s dieťaťom dostaviť kvôli podaniu ďalšej injekcie.
Predčasne narodené deti (narodené po 27 týždňoch a pred 37. týždňom tehotenstva)
Vaše dieťa (vo veku od 2 do 6 mesiacov) dostane 3 injekcie, pričom medzi podaním jednotlivých dávok musí uplynúť aspoň jeden mesiac. Po uplynutí aspoň šiestich mesiacov od poslednej injekcie vaše dieťa dostane dodatočnú injekciu (posilňovaciu injekciu).
Dojčatá vo veku od 7 do 11 mesiacov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie musí uplynúť aspoň jeden mesiac. Tretia injekcia (posilňovacia injekcia) sa podá v druhom roku života, a to po uplynutí aspoň dvoch mesiacov od podania druhej injekcie.
Deti vo veku od 12 mesiacov do 5 rokov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie
musia uplynúť aspoň dva mesiace.
Špeciálne populácie:
Synflorix sa môže podávať deťom mladším ako 2 roky, ktoré sú vystavené vyššiemu riziku pneumokokovej infekcie (napríklad deti s infekciou spôsobenou vírusom ľudskej imunitnej nedostatočnosti (HIV) alebo s kosáčikovitou anémiou). Požiadajte, prosím, lekára o informácie týkajúce sa počtu injekcií, ktoré má vaše dieťa dostať, a o čase ich podania.
Ak vaše dieťa vynechá injekciu
Ak vaše dieťa vynechá injekciu, je dôležité, aby ste si dohovorili ďalšiu návštevu ordinácie. Je to kvôli
tomu, aby ste sa s lekárom mohli poradiť o tom, čo treba urobiť, aby bolo vaše dieťa chránené.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Pri tomto lieku sa môžu objaviť nasledujúce vedľajšie účinky:
Veľmi časté (tieto sa môžu vyskytnúť pri viac než 1 z 10 dávok očkovacej látky)
• bolesť, začervenanie a opuch v mieste podania injekcie
• vysoká teplota rovná 38 °C alebo vyššia (horúčka)
• ospalosť
• podráždenosť
• nechutenstvo.
Časté (tieto sa môžu vyskytnúť až pri 1 z 10 dávok očkovacej látky)
• tvrdá zdurenina v mieste podania injekcie.
Menej časté (tieto sa môžu vyskytnúť až pri 1 zo 100 dávok očkovacej látky)
• svrbenie, krvná zrazenina, krvácanie alebo hrčka v mieste podania injekcie
• napínanie na vracanie, hnačka alebo vracanie (dávenie)
• nezvyčajný plač
• prechodné zastavenie dýchania (apnoe), ak sa dieťa narodilo predčasne (do a vrátane 28. týždňa
tehotenstva)
• bolesť hlavy
• kožná vyrážka
• difúzny (rozptýlený) opuch očkovanej končatiny, niekedy postihujúci priľahlý kĺb
• žihľavka.
Zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 1 000 dávok očkovacej látky)
• kŕče bez teploty alebo spôsobené vysokou teplotou (horúčkou)
• alergické reakcie, akými sú kožné alergické prejavy
• kolaps (náhla svalová ochabnutosť), periódy bezvedomia alebo nedostatku vedomia a bledosť
alebo modrasté sfarbenie pokožky.
Veľmi zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 10 000 dávok očkovacej látky)
• Závažné alergické reakcie, ktoré je možné rozpoznať podľa:
- vyvýšenej a svrbivej vyrážky (žihľavka)
- opuchu, ktorý niekedy postihuje tvár alebo ústa (angioedém), čo spôsobuje ťažkosti
s dýchaním
- kolaps.
Tieto reakcie sa zvyčajne objavia predtým, ako opustíte ordináciu lekára. Ak sa však u vášho
dieťaťa vyskytne ktorýkoľvek z týchto príznakov, musíte urýchlene vyhľadať lekára.
• Kawasakiho choroba (hlavné príznaky tohto ochorenia sú napríklad: horúčka, kožná vyrážka,
opuchnuté lymfatické uzliny, zápal a vyrážky postihujúce sliznicu úst a hrdla).
Posilňovacie dávky Synflorixu môžu zvýšiť riziko vzniku vedľajších účinkov.
U detí vo veku > 12 mesiacov sa riziko vzniku bolesti v mieste vpichu môže zvyšovať so zvyšujúcim
sa vekom.
V priebehu 2-3 dní po očkovaní sa u veľmi predčasne narodených detí (narodené do a vrátane
28. týždňa tehotenstva) môžu vyskytovať dlhšie prestávky v dýchaní ako obvykle.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať SynflorixTento liek uchovávajte mimo dohľadu a dosahu detí.
• Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
• Uchovávajte v chladničke (2 °C - 8 °C).
• Uchovávajte v pôvodnom obale na ochranu pred svetlom.
• Neuchovávajte v mrazničke.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Č
o Synflorix obsahuje
• Liečivá sú:
Jedna 0,5 ml dávka obsahuje:
Pneumokokový polysacharid sérotyp 11,2 1 mikrogram
Pneumokokový polysacharid sérotyp 41,2 3 mikrogramy Pneumokokový polysacharid sérotyp 51,2 1 mikrogram Pneumokokový polysacharid sérotyp 6B1,2 1 mikrogram Pneumokokový polysacharid sérotyp 7F1,2 1 mikrogram Pneumokokový polysacharid sérotyp 9V1,2 1 mikrogram Pneumokokový polysacharid sérotyp 141,2 1 mikrogram Pneumokokový polysacharid sérotyp 18C1,3 3 mikrogramy Pneumokokový polysacharid sérotyp 19F1,4 3 mikrogramy Pneumokokový polysacharid sérotyp 23F1,2 1 mikrogram
1 adsorbovaný na fosforečnan hlinitý 0,5 miligramu Al3+
2 konjugovaný na proteín D (odvodený od netypizovateľného Haemophilus influenzae) ako
proteínový nosič 9 - 16 mikrogramov
3 konjugovaný na tetanový toxoid ako proteínový nosič 5 - 10 mikrogramov
4 konjugovaný na difterický toxoid ako proteínový nosič 3 - 6 mikrogramov
• Ďalšie zložky sú: chlorid sodný a voda na injekciu
Ako vyzerá Synflorix a obsah balenia
• Injekčná suspenzia vo viacdávkovom balení (2 dávky).
• Synflorix je biela, zakalená suspenzia.
• Synflorix sa dodáva v injekčných liekovkách pre 2 dávky v balení po 100 ks.
Držiteľ rozhodnutia o registrácii a výrobca
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel: +370 5 264 90 00
inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел.: + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11
cz
.info@gsk.comMagyarországGlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
Ε
λλάδα
GlaxoSmithKline A.E.B.E
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 1 970 75-0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comPortugalGlaxoSmithKline - Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00
FI
.PT@gsk.com
H
rvatska
GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999
România
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A.
Tel:+ 39 04 59 21 81 11
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej agentúry pre lieky.
-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Počas uchovávania injekčnej liekovky sa môže vytvoriť jemný biely sediment a číry bezfarebný
supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah injekčnej liekovky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Po prvom otvorení 2-dávkovej injekčnej liekovky sa odporúča očkovaciu látku ihneď použiť. Ak sa očkovacia látka nepoužije ihneď, má sa uchovávať v chladničke (2 °C - 8 °C). Ak sa nepoužije do
6 hodín, má sa zlikvidovať.
Pri použití viacdávkovej injekčnej liekovky sa má každá 0,5 ml dávka odobrať pomocou sterilnej ihly a injekčnej striekačky; majú sa dodržať opatrenia na zabránenie kontaminácie obsahu.
Očkovacia látka je určená len na intramuskulárne použitie. Nepodávajte ju intravaskulárne.
Ak sa Synflorix podáva súbežne s inými očkovacími látkami, musia sa podať do rôznych miest
vpichu.
Synflorix sa nesmie miešať s inými očkovacími látkami. Ak sa dávka očkovacej látky odoberie do injekčnej striekačky, ihla použitá na odobratie sa musí nahradiť ihlou vhodnou na intramuskulárnu injekciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má byť zlikvidovať v súlade s národnými požiadavkami.
Písomná informácia pre používateľa
Synflorix injekčná suspenzia vo viacdávkovom balení (4 dávky)
Pneumokoková polysacharidová konjugovaná očkovacia látka (adsorbovaná)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu látku, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
• Táto očkovacia látka bola predpísaná len vášmu dieťaťu. Nedávajte ju nikomu inému.
• Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4
V tejto písomnej informácii sa dozviete:
1. Čo je Synflorix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
3. Ako sa Synflorix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Synflorix
6. Obsah balenia a ďalšie informácie
1. Čo je Synflorix a na čo sa používa
Synflorix je pneumokoková konjugovaná očkovacia látka. Lekár alebo zdravotná sestra touto
očkovacou látkou vaše dieťa zaočkuje.
U vášho dieťaťa vo veku od 6 týždňov do 5 rokov sa použije na to, aby ho ochránila pred: baktériou označovanou ako „Streptococcus pneumoniae“. Táto baktéria môže vyvolať závažné ochorenia zahŕňajúce meningitídu (zápal mozgových blán), sepsu (otrava krvi) a bakterémiu (prítomnosť baktérií v krvnom riečisku) ako aj infekciu ucha alebo pneumóniu (zápal pľúc).
Ako Synflorix pôsobí
Synflorix napomáha tomu, aby si telo vytvorilo svoje vlastné protilátky. Protilátky tvoria súčasť
imunitného systému, ktorý vaše dieťa ochráni pred týmito ochoreniami.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Synflorix
Synflorix sa nesmie podať:
• ak malo vaše dieťa v minulosti alergickú reakciu (je precitlivené) na liečivo alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6).
Znaky alergickej reakcie môžu zahŕňať svrbivú kožnú vyrážku, namáhavé dýchanie a opuch
tváre alebo jazyka.
• ak má vaše dieťa závažnú infekciu s vysokou teplotou (nad 38 °C). Ak sa to vzťahuje na vaše dieťa, potom sa očkovanie odloží, kým sa vaše dieťa nebude cítiť lepšie. Slabá infekcia, ako napríklad nádcha, by nemala byť problémom. Najprv sa však porozprávajte s lekárom.
Ak sa na vaše dieťa vzťahuje ktorékoľvek z vyššie uvedeného, Synflorix sa mu nesmie podať. Ak si
nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred tým, než vaše dieťa dostane Synflorix.
U
pozornenia a opatrenia:
Pred podaním tejto očkovacej látky sa poraďte s lekárom alebo lekárnikom:
• ak má vaše dieťa problémy so zrážanlivosťou krvi alebo sa mu ľahko tvoria krvné podliatiny.
U detí vo veku od 2 rokov môže dôjsť k omdletiu po vpichnutí ihly, alebo dokonca aj pred jej vpichnutím, preto povedzte lekárovi alebo zdravotnej sestre, ak vaše dieťa v minulosti pri injekcii omdlelo.
Tak ako všetky očkovacie látky, ani Synflorix nemusí úplne ochrániť všetky očkované deti. Synflorix chráni iba pred infekciami vyvolanými baktériami, proti ktorým bola očkovacia látka
vyvinutá.
Deťom s oslabeným imunitným systémom (napríklad v dôsledku infekcie vírusom HIV alebo
imunosupresívnej liečby) nemusí Synflorix poskytnúť úplnú ochranu.
Ak si nie ste istý, porozprávajte sa s lekárom alebo lekárnikom pred očkovaním Synflorixom.
Iné lieky a Synflorix
Ak vaše dieťa užíva alebo v poslednom čase užívalo ešte iné lieky, resp. bude užívať ďalšie lieky, povedzte to lekárovi alebo lekárnikovi. Týka sa to aj liekov, ktorých výdaj nie je viazaný na lekársky predpis alebo akejkoľvek inej, nedávno podanej očkovacej látky. Synflorix nemusí pôsobiť dostatočne, ak vaše dieťa užíva lieky, ktoré ovplyvňujú schopnosť imunitného systému zdolať infekciu.
Synflorix sa môže podať v rovnakom čase ako iné detské očkovacie látky, ako napríklad očkovacia látka proti záškrtu, tetanu, čiernemu kašľu, očkovacia látka proti Haemophilus influenzae typ b, ústami užívaná alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B, očkovacia látka proti osýpkam-príušniciam-ružienke, očkovacia látka proti ovčím kiahňam, ústami užívaná očkovacia látka proti rotavírusom, ako aj konjugovaná očkovacia látka proti meningokokom séroskupiny C a konjugovaná očkovacia látka proti meningokokom séroskupín A, C, W-135, Y.
Rôzne očkovacie látky sa podajú do rôznych miest tela.
Lekár vás môže požiadať, aby ste vášmu dieťaťu pred alebo ihneď po podaní Synflorixu dali užiť liek, ktorý znižuje horúčku (napríklad paracetamol). Môže to pomôcť zmierniť niektoré vedľajšie účinky Synflorixu (febrilné (horúčkovité) reakcie). Ak však vaše dieťa užilo paracetamol pred alebo ihneď
po podaní Synflorixu, dosiahnuté hladiny protilátok môžu byť mierne znížené. Nie je známe, či má
zníženie hladín protilátok vplyv na ochranu pred pneumokokovým ochorením.
Synflorix obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
3. Ako sa Synflorix podáva
Ako sa očkovacia látka podáva
Synflorix sa vždy podáva injekciou do svalu, a to zvyčajne do stehna alebo do hornej časti ramena.
A
ké množstvo sa podáva
Za zvyčajných okolností dostane vaše dieťa (vo veku od 6 týždňov do 6 mesiacov) očkovaciu schému pozostávajúcu zo 4 injekcií v súlade s oficiálnymi odporúčaniami, ale zdravotnícky pracovník môže použiť aj alternatívnu schému. Je dôležité riadiť sa pokynmi lekára alebo zdravotnej sestry a ukončiť celú očkovaciu schému.
• Medzi podaním jednotlivých injekcií musí uplynúť aspoň jeden mesiac, s výnimkou poslednej
injekcie (posilňovacej injekcie), ktorá sa podá po uplynutí aspoň 6 mesiacov od tretej injekcie.
• Prvá injekcia sa môže podať vo veku od 6 týždňov. Posledná injekcia (posilňovacia injekcia) sa
môže podať vo veku od 9 mesiacov.
• Lekár vám povie, kedy sa máte s dieťaťom dostaviť kvôli podaniu ďalšej injekcie.
Predčasne narodené deti (narodené po 27 týždňoch a pred 37. týždňom tehotenstva)
Vaše dieťa (vo veku od 2 do 6 mesiacov) dostane 3 injekcie, pričom medzi podaním jednotlivých dávok musí uplynúť aspoň jeden mesiac. Po uplynutí aspoň šiestich mesiacov od poslednej injekcie vaše dieťa dostane dodatočnú injekciu (posilňovaciu injekciu).
Dojčatá vo veku od 7 do 11 mesiacov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie musí uplynúť aspoň jeden mesiac. Tretia injekcia (posilňovacia injekcia) sa podá v druhom roku života, a to po uplynutí aspoň dvoch mesiacov od podania druhej injekcie.
Deti vo veku od 12 mesiacov do 5 rokov dostanú 2 injekcie. Medzi podaním prvej a druhej injekcie
musia uplynúť aspoň dva mesiace.
Špeciálne populácie:
Synflorix sa môže podávať deťom mladším ako 2 roky, ktoré sú vystavené vyššiemu riziku pneumokokovej infekcie (napríklad deti s infekciou spôsobenou vírusom ľudskej imunitnej nedostatočnosti (HIV) alebo s kosáčikovitou anémiou). Požiadajte, prosím, lekára o informácie týkajúce sa počtu injekcií, ktoré má vaše dieťa dostať, a o čase ich podania.
Ak vaše dieťa vynechá injekciu
Ak vaše dieťa vynechá injekciu, je dôležité, aby ste si dohovorili ďalšiu návštevu ordinácie. Je to kvôli
tomu, aby ste sa s lekárom mohli poradiť o tom, čo treba urobiť, aby bolo vaše dieťa chránené.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Pri tomto lieku sa môžu objaviť nasledujúce vedľajšie účinky:
Veľmi časté (tieto sa môžu vyskytnúť pri viac než 1 z 10 dávok očkovacej látky)
• bolesť, začervenanie a opuch v mieste podania injekcie
• vysoká teplota rovná 38 °C alebo vyššia (horúčka)
• ospalosť
• podráždenosť
• nechutenstvo.
Časté (tieto sa môžu vyskytnúť až pri 1 z 10 dávok očkovacej látky)
• tvrdá zdurenina v mieste podania injekcie.
Menej časté (tieto sa môžu vyskytnúť až pri 1 zo 100 dávok očkovacej látky)
• svrbenie, krvná zrazenina, krvácanie alebo hrčka v mieste podania injekcie
• napínanie na vracanie, hnačka alebo vracanie (dávenie)
• nezvyčajný plač
• prechodné zastavenie dýchania (apnoe), ak sa dieťa narodilo predčasne (do a vrátane 28. týždňa
tehotenstva)
• bolesť hlavy
• kožná vyrážka
• difúzny (rozptýlený) opuch očkovanej končatiny, niekedy postihujúci priľahlý kĺb
• žihľavka.
Zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 1 000 dávok očkovacej látky)
• kŕče bez teploty alebo spôsobené vysokou teplotou (horúčkou)
• alergické reakcie, akými sú kožné alergické prejavy
• kolaps (náhla svalová ochabnutosť), periódy bezvedomia alebo nedostatku vedomia a bledosť
alebo modrasté sfarbenie pokožky.
Veľmi zriedkavé (tieto sa môžu vyskytnúť až pri 1 z 10 000 dávok očkovacej látky)
• Závažné alergické reakcie, ktoré je možné rozpoznať podľa:
- vyvýšenej a svrbivej vyrážky (žihľavka)
- opuchu, ktorý niekedy postihuje tvár alebo ústa (angioedém), čo spôsobuje ťažkosti
s dýchaním
- kolaps.
Tieto reakcie sa zvyčajne objavia predtým, ako opustíte ordináciu lekára. Ak sa však u vášho
dieťaťa vyskytne ktorýkoľvek z týchto príznakov, musíte urýchlene vyhľadať lekára.
• Kawasakiho choroba (hlavné príznaky tohto ochorenia sú napríklad: horúčka, kožná vyrážka, opuchnuté lymfatické uzliny, zápal a vyrážky postihujúce sliznicu úst a hrdla).
Posilňovacie dávky Synflorixu môžu zvýšiť riziko vzniku vedľajších účinkov.
U detí vo veku > 12 mesiacov sa riziko vzniku bolesti v mieste vpichu môže zvyšovať so zvyšujúcim sa vekom.
V priebehu 2-3 dní po očkovaní sa u veľmi predčasne narodených detí (narodené do a vrátane
28. týždňa tehotenstva) môžu vyskytovať dlhšie prestávky v dýchaní ako obvykle.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať SynflorixTento liek uchovávajte mimo dohľadu a dosahu detí.
• Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa
vzťahuje na posledný deň v danom mesiaci.
• Uchovávajte v chladničke (2 °C - 8 °C).
• Uchovávajte v pôvodnom obale na ochranu pred svetlom.
• Neuchovávajte v mrazničke.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Č
o Synflorix obsahuje
• Liečivá sú:
Jedna 0,5 ml dávka obsahuje:
Pneumokokový polysacharid sérotyp 11,2 1 mikrogram
Pneumokokový polysacharid sérotyp 41,2 3 mikrogramy Pneumokokový polysacharid sérotyp 51,2 1 mikrogram Pneumokokový polysacharid sérotyp 6B1,2 1 mikrogram Pneumokokový polysacharid sérotyp 7F1,2 1 mikrogram Pneumokokový polysacharid sérotyp 9V1,2 1 mikrogram Pneumokokový polysacharid sérotyp 141,2 1 mikrogram Pneumokokový polysacharid sérotyp 18C1,3 3 mikrogramy Pneumokokový polysacharid sérotyp 19F1,4 3 mikrogramy Pneumokokový polysacharid sérotyp 23F1,2 1 mikrogram
1 adsorbovaný na fosforečnan hlinitý 0,5 miligramu Al3+
2 konjugovaný na proteín D (odvodený od netypizovateľného Haemophilus influenzae) ako
proteínový nosič 9 - 16 mikrogramov
3 konjugovaný na tetanový toxoid ako proteínový nosič 5 - 10 mikrogramov
4 konjugovaný na difterický toxoid ako proteínový nosič 3 - 6 mikrogramov
• Ďalšie zložky sú: chlorid sodný, 2-fenoxyetanol a voda na injekciu
Ako vyzerá Synflorix a obsah balenia
• Injekčná suspenzia vo viacdávkovom balení (4 dávky).
• Synflorix je biela, zakalená suspenzia.
• Synflorix sa dodáva v injekčných liekovkách pre 4 dávky v balení po 10 alebo 100 ks.
• Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii a výrobca
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel: +370 5 264 90 00
inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел.: + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 cz
.info@gsk.comMagyarország GlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
Ε
λλάδα
GlaxoSmithKline A.E.B.E
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 1 970 75-0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comPortugalGlaxoSmithKline - Produtos Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.com
H
rvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
România
GlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.Táto písomná informácia je dostupná vo všetkých jazykoch EÚ/EHP na webovej stránke Európskej agentúry pre lieky.
-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Počas uchovávania injekčnej liekovky sa môže vytvoriť jemný biely sediment a číry bezfarebný
supernatant. Nepovažujú sa za znak znehodnotenia.
Pred podaním sa má obsah injekčnej liekovky opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu, a to pred pretrepaním, ako aj po pretrepaní. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Pred použitím má očkovacia látka dosiahnuť izbovú teplotu.
Pred použitím sa má očkovacia látka dôkladne pretrepať.
Po prvom otvorení 4-dávkovej injekčnej liekovky sa očkovacia látka môže uchovávať v chladničke
(2 °C – 8 °C) maximálne 28 dní. Ak sa nepoužije do 28 dní, má sa zlikvidovať.
Pri použití viacdávkovej injekčnej liekovky sa má každá 0,5 ml dávka odobrať pomocou sterilnej ihly a injekčnej striekačky; majú sa dodržať opatrenia na zabránenie kontaminácie obsahu.
Očkovacia látka je určená len na intramuskulárne použitie. Nepodávajte ju intravaskulárne.
Ak sa Synflorix podáva súbežne s inými očkovacími látkami, musia sa podať do rôznych miest
vpichu.
Synflorix sa nesmie miešať s inými očkovacími látkami. Ak sa dávka očkovacej látky odoberie do injekčnej striekačky, ihla použitá na odobratie sa musí nahradiť ihlou vhodnou na intramuskulárnu injekciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má byť zlikvidovať v súlade s národnými požiadavkami.