"131" height="131" src="PublicData/Liekinfo/Spc/7972_files/image007.jpg" />
5. Uchopte HandiHaler pomôcku tak, aby náustok smeroval nahor a len jedenkrát zatlačte zelené tlačidlo, až pokiaľ je to možné, a uvoľnite. Tým sa urobia otvory v kapsule a umožnia uvoľnenie liečiva potrebného na vdýchnutie.
|  
| 6. Úplne vydýchnite. Dôležité: vždy sa vyvarujte vdýchnutiu do náustka.
|

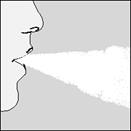
| 7. Vložte si HandiHaler do úst a zovrite pery tesne okolo náustka. Hlavu držte rovno, pomaly hlboko vdychujte, takou intenzitou, aby ste počuli alebo cítili kapsulu vibrovať. Vdychujte až kým nemáte plné pľúca, potom zadržte dych, pokiaľ vládzete a zároveň vytiahnite HandiHaler z úst. Znovu začnite normálne dýchať.
Opakujte kroky 6 a 7 ešte raz - tým sa kapsula úplne vyprázdni.
|

| 8. Opäť otvorte náustok. Vyklopte použitú kapsulu a vyhoďte ju.
Zatvorte náustok a ochranný uzáver na HandiHaleri.
|
Čistenie Vášho HandiHalera

| HandiHaler čistite raz za mesiac. Otvorte ochranný uzáver a náustok. Potom otvorte telo nadvihnutím zeleného tlačidla. Opláchnite celý inhalátor teplou vodou tak, aby sa vymyli všetky zvyšky prášku. Vyklopte HandiHaler a dôkladne ho osušte na papierovej utierke a potom nechajte dosušiť na vzduchu. Ochranný kryt, náustok a telo nechajte pritom otvorené. Suší sa na vzduchu 24 hodín, preto vyčistite HandiHaler hneď po použití, aby bol pripravený na ďalšie použitie. Vonkajšiu stranu náustka čistite vlhkou, nie mokrou utierkou.
|
Zaobchádzanie s blistrom
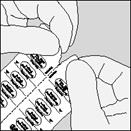
| A. Odtrhnite časť blistra pozdĺž perforácie.
|
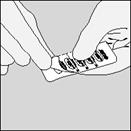
| B. Stiahnite fóliu (len tesne pred použitím) pomocou uška až kým nie je úplne vidieť jedna kapsula.
V prípade, že je aj ďalšia kapsula náhodne vystavená vzduchu, musí sa znehodnotiť.
|
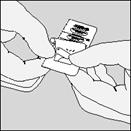
| C. Vyberte kapsulu.
|
SPIRIVA kapsuly obsahujú iba malé množstvo prášku, preto sú len čiastočne naplnené.
Špeciálne populácie:Geriatrickí pacienti môžu užívať tiotropiumbromid podľa odporúčaného dávkovania.
Pacienti s poškodením funkcie obličiek môžu užívať tiotropiumbromid podľa odporúčaného dávkovania. U pacientov so stredne ťažkým až ťažkým poškodením (klírens kreatinínu ≤ 50 ml/min) pozri 4.4 Osobitné upozornenia a opatrenia pri používaní a 5.2 Farmakokinetické vlastnosti.
Pacienti s poškodením pečeňových funkcií môžu užívať tiotropiumbromid podľa odporúčaného dávkovania (pozri 5.2 Farmakokinetické vlastnosti).
Pediatrickí pacienti: bezpečnosť a účinnosť inhalačného prášku tiotropiumbromidu u pediatrických pacientov nebola stanovená, a preto sa nemá užívať u pacientov mladších ako 18 rokov.
4.3 Kontraindikácie
Tiotropiumbromid inhalačný prášok je kontraindikovaný u pacientov s precitlivenosťou na tiotropiumbromid, atropín alebo jeho deriváty, napr. ipratropium alebo oxitropium alebo pomocnú látku monohydrát laktózy, ktorá obsahuje mliečnu bielkovinu..
4.4 Osobitné upozornenia a opatrenia pri používaní
Tiotropiumbromid, ako raz denne dávkovaný udržiavací bronchodilatans, sa nemá používať ako iniciálna liečba akútnych záchvatov bronchospazmu, t.j. ako emergentnáliečba.
Po podaní inhalačného prášku tiotropiumbromidu sa môžu vyskytnúť okamžité reakcie precitlivenosti.
Pre jeho anticholinergickú aktivitu, tiotropiumbromid sa má podávať s opatrnosťou u pacientov s glaukómom so zatvoreným uhlom, hyperpláziou prostaty alebo obštrukciou hrdla močového mechúra. (pozri 4.8 Nežiaduce účinky)
Lieky na inhaláciu môžu spôsobiť inhaláciou indukovaný bronchospazmus.
Keďže pri znížených obličkových funkciách stúpa plazmatická koncentrácia, u pacientov so stredne ťažkým až ťažkým poškodením funkcie obličiek (klírens kreatinínu ≤ ako 50 ml/min) sa tiotropiumbromid podáva len ak očakávaný prínos prevyšuje potenciálne riziko. U pacientov s ťažkým poškodením obličkových funkcií nie sú dlhodobé skúsenosti (pozri 5.2 Farmakokinetické vlastnosti).
Pacienti si majú dávať pozor, aby im roztok nevnikol do očí. Majú byť poučení, že to môže spôsobiť precipitáciu alebo zhoršenie glaukómu so zatvoreným uhlom, bolesť alebo nepohoda v očiach, prechodné neostré videnie, dúhový efekt pri pozeraní do svetla alebo farebný obrazec v spojení s červenými očami z konjuktiválnej kongescie a korneálneho edému. Ak sa objaví ktorákoľvek kombinácia týchto očných príznakov, pacienti majú prestať užívať tiotropiumbromid a okamžite konzultovať špecialistu.
Sucho v ústach, ktoré bolo zaznamenané pri anticholinergickej liečbe, môže pri dlhodobom používaní viesť k zubnému kazu.
Tiotropiumbromid sa nemá užívať častejšie než jedenkrát denne (pozri časť 4.9 Predávkovanie).
SPIRIVA kapsuly obsahujú 5,5 mg monohydrátu laktózy.
4.5 Liekové a iné interakcie
Aj keď sa nevykonali žiadne formálne štúdie zamerané na liekové interakcie, tiotropiumbromid inhalačný prášok sa používa súčasne s inými liekmi všeobecne používanými pri liečbe CHOCHP, vrátane sympatomimetických bronchodilatátorov, metylxantínov, perorálnych a inhalačných steroidov, bez klinického záznamu liekových interakcií.
Súčasné podávanie tiotropiumbromidu s inými liekmi obsahujúcimi anticholinergiká nebolo sledované, a preto sa neodporúča.
4.6 Fertilita, gravidita a laktácia
Nie sú dostupné žiadne klinické údaje pre expozíciu tiotropiumbromidu v gravidite. Štúdie na zvieratách preukázali reprodukčnú toxicitu spojenú s maternálnou toxicitou (pozri časť 5.3 Predklinické údaje). Nie je známe potenciálne riziko u ľudí. Preto sa má SPIRIVA používať počas tehotenstva, len ak je jednoznačne indikovaná.
Nie je známe, či sa tiotropiumbromid vylučuje do ľudského materského mlieka. Napriek štúdiám na hlodavcoch, ktoré dokázali, že tiotropiumbromid sa vylučuje do materského mlieka len v malých množstvách, použitie SPIRIVY sa počas dojčenia neodporúča. Tiotropiumbromid je dlhodobo účinkujúca látka. Rozhodnutie o tom, či pokračovať/ukončiť dojčenie alebo pokračovať/ukončiť liečbu SPIRIVOU sa má urobiť po zohľadnení prínosu dojčenia pre dieťa a prínosu liečby SPIRIVOU pre ženu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Výskyt závratov, neostrého videnia alebo bolesti hlavy môže ovplyvňovať schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
a)
Všeobecný opisMnohé z uvedených nežiaducich účinkov môžu byť pripísané anticholinergickým vlastnostiam SPIRIVY.
b)
Tabuľka nežiaducich účinkovFrekvencie prideľované nežiaducim účinkom uvedeným nižšie vychádzajú z približnej miery výskytu nežiaducich liekových reakcií (t.j. udalostí pripisovaných tiotropiu), pozorovaných v skupine s tiotropiom (9 149 pacientov), získaných z 26 placebom kontrolovaných klinických štúdií pri trvaní liečby od štyroch týždňov po štyri roky.
Frekvencia je uvedená použitím nasledujúcej konvencie:
Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000), neznáme (nedajú sa odhadnúť z dostupných údajov).
Preferované pomenovanie podľa MedDRA
| Frekvencia1
|
|
|
Poruchy metabolizmu a výživy
|
|
Dehydratácia
| neznáme*
|
|
|
Poruchy nervového systému
|
|
Závraty
| menej časté
|
Bolesti hlavy
| menej časté
|
Poruchy chute
| menej časté
|
Insomnia
| zriedkavé
|
|
|
Poruchy oka
|
|
Neostré videnie
| menej časté
|
Glaukóm
| zriedkavé
|
Zvýšený vnútroočný tlak
| zriedkavé
|
|
|
Poruchy srdca a srdcovej činnosti
|
|
Atriálna fibrilácia
| menej časté
|
Supraventrikulárna tachykardia
| zriedkavé
|
Tachykardia
| zriedkavé
|
Palpitácie
| zriedkavé
|
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Faryngitída
| menej časté
|
Dysfónia
| menej časté
|
Kašeľ
| menej časté
|
Bronchospazmus
| zriedkavé
|
Epistaxa
| zriedkavé
|
Laryngitída
| zriedkavé
|
Sínusitída
| zriedkavé
|
|
|
Poruchy gastrointestinálneho traktu
|
|
Sucho v ústach
| časté
|
Stomatitída
| menej časté
|
Gastroezofageálny reflux
| menej časté
|
Zápcha
| menej časté
|
Nauzea
| menej časté
|
Intestinálne obštrukcie, vrátane paralytického ilea
| zriedkavé
|
Gingivitída
| zriedkavé
|
Glositída
| zriedkavé
|
Orofaryngeálna kandidóza
| zriedkavé
|
Dysfágia
| zriedkavé
|
Zubný kaz
| neznáme*
|
|
|
Poruchy kože a podkožného tkaniva
Poruchy imunitného systému
|
|
Vyrážka
| menej časté
|
Žihľavka
| zriedkavé
|
Svrbenie
| zriedkavé
|
Precitlivenosť (vrátane okamžitých reakcií)
| zriedkavé
|
Angioneurotický edém
| neznáme*
|
Infekcia kože, vred na koži
| neznáme*
|
Suchá koža
| neznáme*
|
|
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
|
Opuch kĺbov
| neznáme*
|
|
|
Poruchy obličiek a močových ciest
|
|
Dysúria
| menej časté
|
Retencia moču
| menej časté
|
Infekcie močových ciest
| zriedkavé
|
*u 9 149 pacientov liečených tiotropiom sa nevyskytla príhoda vo vzťahu k tiotropiu; avšak za príhody sa považujú nežiaduce liekové reakcie spojené s tiotropiom
c) Informácie charakterizujúce jednotlivé závažné a/alebo často sa vyskytujúce nežiaduce účinkyV kontrolovaných klinických štúdiách boli častejšie pozorované anticholinergické nežiaduce účinky ako je sucho v ústach, ktoré sa vyskytlo približne u 4 % pacientov.
V 26 klinických štúdiách viedlo sucho v ústach k prerušeniu liečby u 18 z 9 149 pacientov liečených tiotropiom (0,2 %).
Závažné nežiaduce účinky súvisiace s anticholinergickým efektom, zahŕňali glaukóm, obstipáciu, intestinálnu obštrukciu vrátane paralytického ilea a retencie moču.
Ďalšie informácie o špeciálnej populáciiSo stúpajúcim vekom sa môže zvýšiť výskyt anticholinergických účinkov.
4.9 Predávkovanie
Vysoké dávky tiotropiumbromidu môžu viesť k anticholinergickým znakom a príznakom.
Avšak u zdravých dobrovoľníkov sa nevyskytol žiadny nežiaduci systémový anticholinergický účinok po jednej inhalačnej dávke do 340 mikrogramov tiotropiumbromidu. Naviac u zdravých dobrovoľníkov neboli pozorované žiadne relevantné nežiaduce účinky, okrem sucha v ústach po 7-dňovej liečbe pri dávkovaní do 170 mikrogramov tiotropiumbromidu. V štúdiách s opakovaním dávkovaním u pacientov s CHOCHP s maximálnou dennou dávkou 43 mikrogramov tiotropiumbromidu viac ako štyri týždne, neboli pozorované žiadne signifikantné nežiaduce účinky.
Akútna intoxikácia neúmyselným perorálnym užitím kapsuly tiotropiumbromidu je nepravdepodobná pre jeho nízku biologickú dostupnosť pri perorálnom užití.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Anticholinergiká, ATC kód: R03BB04
Tiotropiumbromid je dlhodobo účinkujúci špecifický antagonista muskarínových receptorov, v klinickej medicíne často nazývaný anticholinergikum. Väzbou na muskarínové receptory hladkého svalstva bronchov tiotropiumbromid inhibuje cholinergické (bronchokonstrikčné) účinky acetylcholínu, uvoľneného z parasympatikových nervových zakončení. Má podobnú afinitu k subtypom muskarínových receptorov M
1 – M
5 . V dýchacích cestách tiotropiumbromid kompetitívne a reverzibilne antagonizuje M
3 receptory, čo spôsobuje relaxáciu. Účinok je závislý od dávky a trvá viac než 24 hodín. Dlhotrvajúci účinok je spôsobený pravdepodobne veľmi pomalou disociáciou z M
3 receptorov a má preukázateľne dlhší polčas disociácie než ipratropium. Tiotropiumbromid, ako N-kvartérne anticholinergikum je topicky (broncho-) selektívny pri inhalačnom podávaní, čím je daný akceptovateľný terapeutický rozsah, skôr než sa prejavia systémové anticholinergické účinky. Bronchodilatácia je prevažne lokálna (v dýchacích cestách), nie systémová. Uvoľňovanie z receptorov M
2 je rýchlejšie ako z receptorov M
3, čo vo funkčných
in vitro štúdiách viedlo ku (kineticky kontrolovanej) M
3-receptorovej selektivite oproti M
2 receptorom. Vysoká potencia a pomalé uvoľňovanie majú klinický korelát v signifikantnej a dlhodobej bronchodilatácii u pacientov s CHOCHP.
Elektrofyziológia: V špecializovanej QT štúdii, zahŕňajúcej 53 zdravých dobrovoľníkov, sa podávala SPIRIVA 18 mikrogramov a 54 mikrogramov (tj. trojnásobná terapeutická dávka) viac ako 12 dní, sa významne nepredĺžil QT interval EKG.
Program klinických vývojových štúdií pozostával zo štyroch jednoročných a dvoch šesťmesačných randomizovaných, dvojito zaslepených štúdii u 2663 pacientov (1308 užívalo tiotropiumbromid). Jednoročný program pozostával z dvoch placebom kontrolovaných štúdií a dvoch štúdií s aktívnou kontrolou (ipratropium). Obidve šesťmesačné štúdie boli kontrolované salmeterolom a placebom. Tieto štúdie zahŕňali hodnotenie pľúcnych funkcií a mieru dyspnoe, exacerbácie a posúdenie kvality života.
V spomínaných štúdiách sa pľúcne funkcie (forsírovaný expiračný objem v 1. sekunde - FEV
1 a forsírovaná vitálna kapacita FVC) zlepšili pri podávaní tiotropiumbromidu jedenkrát denne, pričom zlepšenie trvalo od 30 minút po podaní prvej dávky až do 24 hodín. Farmakodynamicky rovnovážny stav bol dosiahnutý počas prvého týždňa s maximom bronchodilatácie na tretí deň. Podľa záznamov v pacientských denníkoch sa ukázalo, že tiotropiumbromid signifikantne zlepšuje ranný a večerný PEFR (peak expiratory flow rate). Bronchodilatačný efekt tiotropiumbromidu bol pozorovaný počas jedného roka podávania bez znakov tolerancie.
Randomizovaná placebom kontrolovaná klinická štúdia u 105 pacientov s CHOCHP demonštrovala bronchodilatačný efekt počas 24-hodinového dávkovacieho intervalu v porovnaní s placebom bez ohľadu na dobu použitia, ráno alebo večer.
Nasledovné zdravotné účinky boli preukázané v dlhodobých (šesťmesačných a jednoročných) štúdiách:
Tiotropiumbromid signifikantne zlepšuje dyspnoe (použitý Transition Dyspnoea Index). Toto zlepšenie bolo udržiavané počas celého obdobia liečby.
Dopad zlepšenia dyspnoe na toleranciu fyzickej záťaže bol skúmaný v dvoch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách u 433 pacientov so stredne ťažkou až ťažkou CHOCHP. V týchto štúdiách, počas bicyklovej ergometrie, šesť týždňová liečba SPIRIVOU výrazne predĺžila symptómom limitovaný čas tolerancie fyzickej záťaže o 19,7 % (štúdia A: 640 sekúnd so SPIRIVOU vs. 535 sekúnd s placebom v porovnaní s liečbou na začiatku štúdie v trvaní 492 sekúnd) a o 28,3 % (štúdia B: 741 sekúnd so SPIRIVOU vs. 577 sekúnd s placebom v porovnaní s liečbou na začiatku štúdie v trvaní 537 sekúnd) na 75 % maximálnej funkčnej kapacity.
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u 1829 pacientov so stredne ťažkou až veľmi ťažkou CHOCHP tiotropium štatisticky významne znížilo počet pacientov, u ktorých sa prejavili exacerbácie CHOCHP (z 32,2 % na 27,8 %) a štatisticky významne znížilo počet exacerbácií o 19 % (z 1,05 na 0,85 prípadov na jedného pacienta pri jednoročnej liečbe). Navyše, 7,0 % pacientov zo skupiny s tiotropiom a 9,5 % pacientov zo skupiny s placebom bolo hospitalizovaných kvôli exacerbácii CHOCHP (p=0,056). Počet hospitalizácii kvôli CHOCHP sa znížil o 30 % (z 0,25 na 0,18 prípadov na jedného pacienta pri jednoročnej liečbe). '
V 9-mesačnej randomizovanej, dvojito zaslepenej, placebom kontrolovanej klinickej štúdii u 492 pacientov, SPIRIVA zlepšila celkové skóre, kvalitu života ovplyvnenú zdravím, meranú celkovým skóre dotazníka „St. George’s Respiratory Questionnaire“ (SGRQ). Podiel pacientov užívajúcich SPIRIVU, ktorí dosiahli významné zlepšenie v celkovom hodnotení SGRQ (t.j. > 4 jednotky) bol o 10,9 % vyšší v porovnaní s pacientmi užívajúcimi placebo (59,1 % v skupinách užívajúcich SPIRIVU v porovnaní
s 48,2 % v skupine užívajúcej placebo (p= 0,029)). Priemerný rozdiel medzi skupinami bol 4,19 jednotiek (p=0,001; interval spoľahlivosti (CI): 1,69 – 6,68).
Zlepšenie podoblastí SGRQ skóre bolo 8,19 jednotiek v podoblasti “symptómy“; 3,91 jednotiek v podoblasti “aktivita” a 3,61 jednotiek v podoblasti “vplyv na každodenný život”. Zlepšenie všetkých jednotlivých podoblastí bolo štatisticky významné.
V 4 ročnej randomizovanej, dvojito zaslepenej, placebom kontrolovanej klinickej štúdii u 5 993 pacientov (3 006 pacientov dostávalo placebo a 2 987 dostávalo SPIRIVU), SPIRIVA trvalo zlepšovala FEV
1 počas 4 rokov ale neovplyvnila každoročnú mieru poklesu FEV
1. V porovnaní so skupinou užívajúcou placebo, v skupine užívajúcej SPIRIVU dokončilo ≥ 45 mesačnú liečbu väčší počet pacientov (63,8 % vs. 55,4 %, p<0.001). Medziročný pomer poklesu FEV
1 bol u placeba a SPIRIVY podobný. Počas liečby sa o 16 % znížilo riziko úmrtia. Výskyt miery úmrtia bol v placebovej skupine 4,79 na 100 pacientov za rok v porovnaní so skupinou užívajúcou tiotropium 4,10 na 100 pacientov ročne (pomer rizika (tiotropium/placebo) = 0.84; 95 % CI=0.73; 0.97). Liečba tiotropiom znižuje riziko respiračného zlyhania o 19 % (2,09 vs. 1,68 prípadov na 100 pacientov ročne, relatívne riziko (tiotropium/placebo) = 0,81; 95 % CI = 0,65; 0,999).
5.2 Farmakokinetické vlastnosti
a) Všeobecný úvodTiotropiumbromid je nechirálna kvartérna amónna látka a je slabo rozpustná vo vode. Tiotropiumbromid sa podáva inhaláciou suchého prášku. Všeobecne sa pri inhalačnej ceste podania väčšina podanej látky ukladá v gastrointestinálnom trakte a v menšej miere v cieľovom orgáne v pľúcach. Mnohé nižšie popísané farmakokinetické údaje boli získané s použitím vyšších dávok ako sú dávky odporúčané na terapiu.
b) Všeobecná charakteristika aktívnej látky po podaní liekuAbsorpcia: po inhalácii prášku u mladých zdravých dobrovoľníkov absolútna biologická dostupnosť 19,5 % poukázala na to, že frakcia dosahujúca pľúca je vysoko biodostupná. Z chemickej štruktúry látky (kvartérna amónna látka) a z experimentov
in vitro vyplýva, že tiotropiumbromid je slabo absorbovaný z gastrointestinálneho traktu (10 – 15 %). Perorálny roztok tiotropiumbromidu má absolútnu biodostupnosť 2 – 3 %. Maximálna plazmatická koncentrácia tiotropiumbromidu bola dosiahnutá päť minút po inhalácii. Predpokladá sa, že potrava neovplyvňuje absorpciu kvartérnej amónnej látky.
Distribúcia: väzba na plazmatické bielkoviny je 72 % a distribučný objem je 32 l/kg. Pri rovnovážnom stave plazmatické hladiny tiotropiumbromidu u pacientov s CHOCHP boli 17–19 pg/ml po inhalácii 18 mikrogramov prášku po 5 minútach a rýchlo sa znižovali v mnohokompartmentovom prostredí. Rovnovážny stav plazmatických koncentrácií bol 3 – 4 pg/ml. Lokálna koncentrácia v pľúcach nie je známa, ale spôsob podávania poukazuje na podstatne vyššie koncentrácie v pľúcach. Štúdie na potkanoch ukazujú, že tiotropiumbromid v relevantnom rozmedzí neprechádza hematoencefalickou bariérou.
Biotransformácia: rozsah biotransformácie je malý. Je to zrejmé z vylučovania močom 74 % nezmenenej látky po intravenóznom podaní u mladých zdravých dobrovoľníkov. Ester tiotropiumbromidu je neenzymaticky štiepený na alkohol (N-metylskopín) a kyslú zložku (kyselinu dietylénglykolovú), ktoré sú na muskarínových receptoroch inaktívne.
In vitro experimenty na mikrozómoch ľudskej pečene a ľudských hepatocytoch dokázali, že určité množstvo látky (< 20 % dávky po intravenóznom podaní) je metabolizované oxidáciou závislou na cytochróme P450 (CYP) a následnou konjugáciou s glutationom na rôzne metabolity fázy II.
V
in vitro štúdiách na pečeňových mikrozómoch sa zistilo, že enzymatická cesta môže byť inhibovaná CYP 2D6 (a 3A4) inhibítormi, chinidínom, ketokonazolom a gestodenom. Tieto CYP 2D6 a 3A4 sú zahrnuté do metabolickej cesty zodpovednej za elimináciu malého množstva dávky. Tiotropiumbromid aj pri veľmi vysokých terapeutických koncentráciách neinhibuje CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 alebo 3A v mikrozómoch ľudskej pečene.
Eliminácia: terminálny eliminačný polčas tiotropiumbromidu po inhalácii je medzi 5 až 6 dňami. Celkový klírens kreatinínu po intravenóznej dávke u mladých zdravých dobrovoľníkov bol 880 ml/min s individuálnymi rozdielmi do 22 %. Intravenózne podaný tiotropiumbromid je väčšinou nezmenený vylúčený močom (74 %). Po inhalácii prášku renálne vylučovanie je 14 % dávky, zvyšok predstavuje nezmenenú látku vylúčenú stolicou. Renálny klírens tiotropiumbromidu prevyšuje klírens kreatinínu, indikujúci vylučovanie močom. Pri dlhodobej inhalácii jedenkrát denne pacientmi s CHOCHP bol farmakokinetický rovnovážny stav dosiahnutý po 2-3 týždňoch bez nahromadenia.
Linearita/nelinearita: tiotropiumbromid vykazoval lineárnu farmakokinetiku v terapeutickom rozsahu po intravenóznom podaní a inhalácii suchého prášku.
c) Osobitné skupiny pacientovGeriatrickí pacienti: tak ako sa očakáva pri všetkých prevažne renálne vylučovaných liekoch, v závislosti od veku dochádza k zníženiu renálneho klírensu tiotropiumbromidu (326 ml/min u pacientov s CHOCHP < ako 58-ročných, oproti 163 ml/min u pacientov s CHOCHP > ako 70-ročných), čo sa môže vysvetliť znížením renálnych funkcií. Vylučovanie tiotropiumbromidu močom pri inhalácii klesá zo 14 % (u mladých zdravých dobrovoľníkov) na okolo 7 % (u pacientov s CHOCHP), hoci nedochádza k signifikantnej zmene plazmatických koncentrácií v závislosti od veku u CHOCHP pacientov, v porovnaní s interindividuálnou a intraindividuálnou variabilitou (43 %-né zvýšenie AUC
0-4h po inhalácii suchého prášku).
Pacienti s poškodením funkcie obličiek: tak ako u všetkých liekov prednostne sa vylučujúcich obličkami, dochádza pri poškodení funkcie obličiek k zvýšeniu plazmatickej koncentrácie lieku a redukcii jeho renálneho klírensu, po intravenóznej infúzii aj inhalácii suchého prášku. Mierne renálne poškodenie (CL
CR 50 – 80 ml/min), ktoré sa často pozoruje u starších pacientov ľahko zvyšuje plazmatickú koncentráciu tiotropiumbromidu (39 % zvýšenie AUC
0-4h po intravenóznom podaní). U pacientov s CHOCHP, ktorí majú stredne ťažké až ťažké poškodenie obličiek (CL
CR < 50 ml/min) intravenózne podávanie tiotropiumbromidu zdvojnásobuje jeho plazmatickú koncentráciu (82 % zvýšenie AUC
0-4h), to sa potvrdilo aj pri plazmatických koncentráciách po inhalácii suchého prášku.
Pacienti s poškodením pečene: neočakáva sa, že by pečeňová nedostatočnosť mala relevantný vplyv na farmakokinetiku tiotropiumbromidu. Tiotropiumbromid sa eliminuje prevažne renálnou exkréciou (74 % u mladých zdravých dobrovoľníkov) a jednoduchý ester sa neenzymaticky štiepi na farmakokinetické neaktívne látky.
Pediatrickí pacienti: pozri 4.2 Dávkovanie a spôsob podávania
d) Vzťah farmakokinetika/farmakodynamikaNie je priamy vzťah medzi farmakokinetikou a farmakodynamikou.
5.3 Predklinické údaje o bezpečnosti
Mnohé účinky pozorované v konvenčných štúdiách, týkajúce sa bezpečnosti farmakológie, toxicity opakovanej dávky a reprodukčnej toxicity, sa dajú vysvetliť anticholinergickými vlastnosťami tiotropiumbromidu. U zvierat sa pozorovala znížená spotreba potravy, nižší váhový prírastok, sucho v ústach a nose, znížená lakrimácia a salivácia, mydriáza a zvýšená srdcová frekvencia. Ostatné relevantné účinky sledované pri štúdiách toxicity opakovanej dávky boli: mierne dráždenie dýchacích ciest u potkanov a myší v zmysle rinitídy a zmien epitelu v nosovej dutine a v hrtane, prostatitída s proteínovými depozitmi, litiáza močového mechúra u potkanov.
Škodlivý vplyv na tehotenstvo, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj sa zistil len pri materno-toxických dávkach. Tiotropiumbromid nie je teratogénny u potkanov alebo králikov. Zmeny na respiračnom (iritácia) a urogenitálnom (prostatitída) systéme a reprodukčná toxicita sa zistili pri lokálnom a systémovom podávaní dávok vyšších ako päťnásobok terapeutickej dávky. Štúdie zamerané na genotoxicitu a karcinogénny potenciál nepreukázali u ľudí žiadne výnimočné riziko.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Lactosum monohydricum (obsahuje mliečnu bielkovinu)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Po prvom otvorení blistra: 9 dní.
Zlikvidujte HandiHaler pomôcku po 12 mesiacoch od začiatku používania.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Nezmrazujte.
6.5 Druh obalu a obsah balenia
Hliník/PVC/hliníkové blistre obsahujúce 10 kapsúl, škatuľa, písomná informácia pre používateľov.
HandiHaler je pomôcka určená na inhaláciu jednotlivej dávky, vyrobená z plastu (ABS) a nehrdzavejúcej ocele.
Veľkosť balenia: · škatuľa obsahujúca 30 kapsúl (3 blistre )
· škatuľa obsahujúca 60 kapsúl (6 blistrov )
· škatuľa obsahujúca 90 kapsúl (9 blistrov )
· škatuľa obsahujúca pomôcku HandiHaler
· škatuľa obsahujúca pomôcku HandiHaler a 10 kapsúl (1 blister)
· škatuľa obsahujúca pomôcku HandiHaler a 30 kapsúl (3 blistre)
· Nemocničné balenie: spoločné balenie obsahujúce 5 papierových škatúľ po 30 kapsúl plus pomôcka Handihaler
· Nemocničné balenie: spoločné balenie obsahujúce 5 papierových škatúľ po 60 kapsúl.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Boehringer Ingelheim International GmbH
Binger Strasse 173
D-55216 Ingelheim nad Rýnom
Nemecko
8. REGISTRAČNÉ ČÍSLO
14/0415/11-S
9. DÁTUM REGISTRÁCIE / DÁTUM PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU