
pozícii zodpovedajúca liečba a lekársky dohľad.
Tak ako pri iných očkovacích látkach, očkovanie Shingrixom sa má odložiť u osôb so závažným akútnym horúčkovým ochorením. Prítomnosť miernej infekcie, akou je nádcha, by však nemala viesť k odloženiu očkovania.
Tak ako pri každej očkovacej látke, ochranná imunitná odpoveď sa nemusí vyvolať u všetkých očkovaných.
Táto očkovacia látka je určená iba na profylaktické použitie a nie je určená na liečbu potvrdeného klinického ochorenia.
Túto očkovaciu látku nepodávajte intravaskulárne ani intradermálne. Subkutánne podávanie sa neodporúča.
Nesprávne podanie subkutánnou cestou môže viesť k zvýšenému výskytu prechodných lokálnych reakcií.
Shingrix sa má podávať opatrne osobám s trombocytopéniou alebo s akoukoľvek poruchou zrážanlivosti krvi, pretože po intramuskulárnom podaní môže u týchto osôb nastať krvácanie.
Po akomkoľvek očkovaní, alebo dokonca aj pred ním, sa môže vyskytnúť synkopa (strata vedomia) ako psychogénna reakcia na vpich ihly. Synkopa môže byť spojená s niekoľkými neurologickými prejavmi, akými sú prechodné poruchy videnia, parestézia a tonicko-klonické pohyby končatín, objavujúcimi sa počas opätovného nadobúdania vedomia. Je dôležité urobiť opatrenia, aby sa zabránilo zraneniu následkom straty vedomia.
K dispozícii nie sú žiadne údaje o bezpečnosti, imunogenite alebo účinnosti, ktoré by podporovali možnosť nahradenia dávky Shingrixu dávkou inej očkovacej látky proti HZ.
K dispozícii sú obmedzené údaje podporujúce použitie Shingrixu u osôb s HZ v anamnéze
a u zraniteľných osôb vrátane osôb s viacerými komorbiditami (pozri časť 5.1). Zdravotnícki pracovníci preto musia individuálne zvážiť prínosy a riziká očkovania proti HZ.
Systémové imunosupresíva a imunodeficiencia
K dispozícii sú údaje o bezpečnosti a imunogenite u obmedzeného počtu osôb s oslabeným imunitným
systémom, ktoré mali vírus ľudskej imunitnej nedostatočnosti (HIV) alebo podstúpili transplántáciu hematopoetických kmeňových buniek (HCT) (pozri časť 5.1). Použitie Shingrixu u osôb s inými potvrdenými alebo suspektnými imunosupresívnymi alebo imunodeficientnými stavmi je predmetom skúmania.
Tak ako pri iných očkovacích látkach, u týchto osôb sa nemusí vyvolať adekvátna imunitná odpoveď. Podanie Shingrixu osobám s oslabeným imunitným systémom sa má zakladať na starostlivom zvážení možných prínosov a rizík.
4.5 Liekové a iné interakcie
Shingrix sa môže podať súbežne s inaktivovanou očkovacou látkou proti sezónnej chrípke, ktorá neobsahuje adjuvanty. Očkovacie látky sa majú podať do odlišných miest vpichu.
V kontrolovanej, otvorenej klinickej štúdii fázy III (Zoster-004) bolo 828 dospelých
vo veku ≥ 50 rokov randomizovaných na podanie 2 dávok Shingrixu s 2-mesačným časovým odstupom, a to buď súbežne s prvou dávkou (N = 413) inaktivovanej očkovacej látky proti sezónnej
chrípke, ktorá neobsahovala adjuvant, alebo bez jej súbežného podania (N = 415). Tvorba protilátok
po podaní obidvoch očkovacích látok bola podobná, či už pri ich súbežnom podaní, alebo v prípade, keď sa nepodali súbežne.
Súbežné podanie s inými očkovacími látkami sa neodporúča vzhľadom na nedostatok údajov.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne údaje o použití Shingrixu u gravidných žien. Štúdie na zvieratách
nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývin, pôrod alebo postnatálny vývin (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa použitiu Shingrixu počas gravidity. Dojčenie
Vplyv Shingrixu na dojčené deti po jeho podaní ich matkám sa neskúmal.
Nie je známe, či sa Shingrix vylučuje do ľudského mlieka.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame účinky na fertilitu samcov alebo samíc
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch Shingrixu na schopnosť viesť vozidlá a obsluhovať stroje. Shingrix môže mať malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje v priebehu 2 - 3 dní
po očkovaní. Po podaní sa môže vyskytnúť únava a malátnosť (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce reakcie boli bolesť v mieste vpichu (68,1 % celkový výskyt/dávka;
3,8 % výskyt závažnej bolesti v mieste vpichu/dávka), myalgia (32,9 % celkový výskyt/dávka;
2,9 % výskyt závažnej myalgie/dávka), únava (32,2 % celkový výskyt/dávka; 3,0 % výskyt závažnej únavy/dávka) a bolesť hlavy (26,3 % celkový výskyt/dávka; 1,9 % výskyt závažnej bolesti hlavy/dávka). Väčšina týchto reakcií nepretrvávala dlhodobo (medián trvania bol 2 až 3 dni). Reakcie hlásené ako závažné trvali 1 až 2 dni.
Výskyt nežiaducich reakcií bol vyšší u osôb vo veku 50 - 69 rokov v porovnaní s osobami
vo veku ≥ 70 rokov, najmä pokiaľ ide o celkové nežiaduce reakcie, akými sú myalgia, únava, bolesť hlavy, triaška, horúčka a gastrointestinálne príznaky.
Tabuľkový zoznamnežiaducichreakcií
Nižšie uvedený bezpečnostný profil je založený na analýze súhrnných údajov získaných v placebom
kontrolovaných klinických štúdiách u 5 887 dospelých vo veku 50 - 69 rokov a 8 758 dospelých vo veku ≥ 70 rokov.
Hlásené nežiaduce reakcie sú uvedené podľa nasledujúcej frekvencie výskytu: Veľmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (< 1/10 000)
Trieda orgánových systémov Frekvencia Nežiaduce reakcie
Poruchy krvi a lymfatického systému Menej časté lymfadenopatia
Poruchy nervového systému Veľmi časté bolesť hlavy
Poruchy gastrointestinálneho traktu Veľmi časté gastrointestinálne príznaky (vrátane nauzey, vracania, hnačky a/alebo bolesti
brucha)
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva Veľmi časté myalgia
Menej časté artralgia
Celkové poruchy a reakcie v mieste podania
Veľmi časté reakcie v mieste vpichu (ako napríklad bolesť, začervenanie, opuch), únava,
zimnica, horúčka
Časté pruritus v mieste vpichu, celkový pocit choroby
 H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieHlásený nebol žiaden prípad predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Očkovacie látky proti pásovému oparu, ATC kód: J07BK03.
Mechanizmus účinku
Vďaka skombinovaniu špecifického antigénu VZV (gE) s adjuvantným systémom (AS01B) je Shingrix
navrhnutý tak, aby navodil antigénovo špecifickú bunkovú a humorálnu imunitnú odpoveď u osôb
s už existujúcou imunitou proti VZV.
Predklinické údaje ukazujú, že AS01B spôsobuje lokálnu a prechodnú aktiváciu nešpecifického (vrodeného) imunitného systému prostredníctvom špecifických molekulárnych dráh. To umožňuje pritiahnutie („recruitment“) a aktiváciu buniek prezentujúcich antigén, ktoré prenesú antigény odvodené od gE do drenážnej oblasti lymfatickej uzliny, čo následne vedie k tvorbe gE-špecifických CD4+ T-lymfocytov a protilátok. Adjuvantný efekt AS01B je výsledkom interakcií medzi MPL
a QS-21 inkorporovaných do lipozómov.
Účinnosť Shingrixu
Účinnosťproti pásovému oparu (herpes zoster, HZ) a postherpetickej neuralgii (PHN)
Dve placebom kontrolované, pre pozorovateľa zaslepené štúdie fázy III so Shingrixom:
- ZOE-50 (Zoster-006): 15 405 dospelých vo veku ≥ 50 rokov bolo randomizovaných na podanie dvoch dávok buď Shingrixu (N = 7 695), alebo placeba (N = 7 710), podaných s 2-mesačným časovým odstupom.
- ZOE-70 (Zoster-022): 13 900 dospelých vo veku ≥ 70 rokov bolo randomizovaných na podanie dvoch dávok buď Shingrixu (N = 6 950), alebo placeba (N = 6 950), podaných s 2-mesačným časovým odstupom.
Štúdie neboli usporiadané tak, aby preukázali účinnosť v podskupinách zraniteľných osôb vrátane osôb s viacerými komorbiditami, hoci tieto osoby neboli vylúčené z účasti na štúdiách.
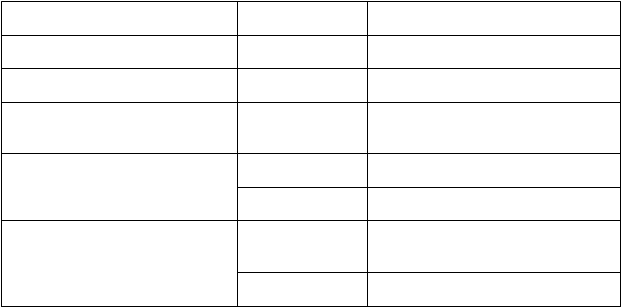
Výsledky účinnosti proti HZ a PHN pozorované v modifikovanej celej očkovanej kohorte (modified Total Vaccinated Cohort, mTVC), t. j. z ktorej boli vylúčení dospelí, ktorým nebola podaná druhá dávka očkovacej látky alebo u ktorých sa v priebehu jedného mesiaca po druhej dávke potvrdila diagnóza HZ, sú uvedené v tabuľke 1 (účinnosť proti HZ) a v tabuľke 2 (účinnosť proti PHN).
Shingrix v porovnaní s placebom významne znížil výskyt HZ u osôb vo veku ≥ 50 rokov (6 prípadov v porovnaní s 210 prípadmi v ZOE-50) a u osôb vo veku ≥ 70 rokov (25 prípadov v porovnaní
s 284 prípadmi v súhrnnej analýze ZOE-50 a ZOE-70).
T
abuľka 1: Účinnosť Shingrixu proti HZ
S
hingrix Placebo
Ú
činnosť
V
ek
(roky)
P
očet
hodnoti- teľných osôb
P
očet
prípadov
HZ
V
ýskyt
na 1 000 osobo- rokov
P
očet
hodnoti- teľných osôb
P
očet
prípadov
HZ
V
ýskyt
na 1 000 osobo- rokov
očkovacej látky
(%)
[95 % IS]
 ZOE-50*
≥ 50
ZOE-50*
≥ 50 7 344 6 0,3 7 415 210 9,1
97,2[93,7; 99,0]
50-59 3 492 3 0,3 3 525 87 7,8
96,6[89,6; 99,4]
≥ 60 3 852 3 0,2 3 890 123 10,2
97,6[92,7; 99,6]
60-69 2 141 2 0,3 2 166 75 10,8
97,4[90,1; 99,7]
ZOE-50 a ZOE-70 posudzované súhrnne**≥ 70 8 250 25 0,8 8 346 284 9,3
91,3[86,8 ; 94,5]
70-79 6 468 19 0,8 6 554 216 8,9
91,3[86,0; 94,9]
≥ 80 1 782 6 1,0 1 792 68 11,1
91,4[80,2; 97,0]
IS Interval spoľahlivosti
* Pri mediáne obdobia sledovania 3,1 roka
** Pri mediáne obdobia sledovania 4,0 roky
Údaje týkajúce sa osôb vo veku ≥ 70 rokov pochádzajú z vopred špecifikových súhrnných analýz ZOE-50
a ZOE-70 (mTVC), pretože tieto analýzy poskytujú najrobustnejšie odhady účinnosti očkovacej látky v tejto vekovej skupine.
Do ZOE-50 a ZOE-70 bolo zaradených približne 13 000 osôb so základnými ochoreniami, ktoré zahŕňali ochorenia súvisiace s vyšším rizikom vzniku HZ. Post-hoc analýza účinnosti
proti potvrdenému HZ vykonaná u pacientov s bežnými ochoreniami (chronické ochorenie obličiek, chronická obštrukčná choroba pľúc, ischemická choroba srdca, depresia alebo diabetes mellitus)
ukazuje, že účinnosť očkovacej látky sa zhoduje s celkovou účinnosťou proti HZ.
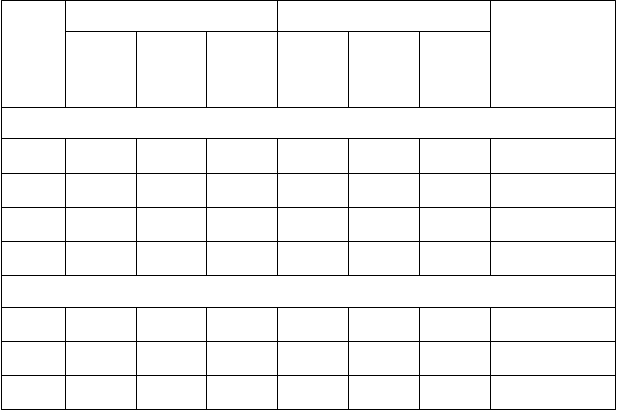
Shingrix v porovnaní s placebom významne znížil výskyt PHN u dospelých vo veku ≥ 50 rokov
(0 prípadov v porovnaní s 18 prípadmi v ZOE-50) a u dospelých vo veku ≥ 70 rokov
(4 prípady v porovnaní s 36 prípadmi v súhrnnej analýze ZOE-50 a ZOE-70).
T
abuľka 2: Účinnosť Shingrixu proti PHN
S
hingrix Placebo
Ú
činnosť
V
ek
(roky)
P
očet
hodnoti- teľných osôb
P
očet
prípadov
PHN*
V
ýskyt
na 1 000 osobo- rokov
P
očet
hodnoti- teľných osôb
P
očet
prípadov
PHN
V
ýskyt
na 1 000 osobo- rokov
očkovacej látky
(%)
[95 % IS]
 ZOE-50**
≥ 50
ZOE-50**
≥ 50 7 340 0 0,0 7 413 18 0,6
100[77,1; 100]
50-59 3 491 0 0,0 3 523 8 0,6
100[40,8; 100]
≥ 60 3 849 0 0,0 3 890 10 0,7
100[55,2; 100]
60-69 2 140 0 0,0 2 166 2 0,2
100§[< 0; 100]
ZOE-50 a ZOE-70 posudzované súhrnne***≥ 70 8 250 4 0,1 8 346 36 1,2
88,8[68,7; 97,1]
70-79 6 468 2 0,1 6 554 29 1,2
93,0[72,4; 99,2]
≥ 80 1 782 2 0,3 1 792 7 1,1
71,2§[< 0; 97,1]
* PHN bola definovaná ako bolesť súvisiaca s pásovým oparom so skóre ≥ 3 (na škále od 0 do 10), ktorá pretrváva viac ako 90 dní alebo sa objavuje po viac ako 90 dňoch od nástupu zosterovej vyrážky, pričom sa hodnotila pomocou dotazníka Zoster Brief Pain Inventory (ZBPI; dotazník na stručné hodnotenie bolesti súvisiacej s pásovým oparom).
IS Interval spoľahlivosti
** Pri mediáne obdobia sledovania 4,1 roka
*** Pri mediáne obdobia sledovania 4,0 roky
Údaje týkajúce sa osôb vo veku ≥ 70 rokov pochádzajú z vopred špecifikových súhrnných analýz ZOE-50
a ZOE-70 (mTVC), pretože tieto analýzy poskytujú najrobustnejšie odhady účinnosti očkovacej látky v tejto vekovej skupine
.§ Štatisticky nevýznamné
Prínos Shingrixu v prevencii PHN je možné prisúdiť vplyvu očkovacej látky na prevenciu HZ. Ďalšie zníženie výskytu PHN u osôb s potvrdeným HS nebolo možné preukázať kvôli obmedzenému počtu prípadov HZ v skupine, ktorej bola podaná očkovacia látka.
V štvrtom roku po očkovaní bola účinnosť proti HZ 93,1 % (95 % IS: 81,2; 98,2) u dospelých vo veku ≥ 50 rokov a 87,9 % (95 % IS: 73,3; 95,4) u dospelých vo veku ≥ 70 rokov. Pretrvávanie ochrany po 4 rokoch je v súčasnosti predmetom skúmania.
Účinnosť proti komplikáciám súvisiacim s HZ iným ako PHNHodnotené komplikácie súvisiace s HZ boli: vaskulitída súvisiaca s HZ, diseminovaný zoster,
postihnutie oka, postihnutie nervového systému, postihnutie vnútorných orgánov a náhla cievna mozgová príhoda. Podľa súhrnnej analýzy ZOE-50 a ZOE-70 Shingrix významne znížil výskyt týchto
komplikácií súvisiacich s HZ, a to o 93,7 % (95 % IS: 59,5; 99,9) u dospelých vo veku ≥ 50 rokov
(1 prípad v porovnaní so 16 prípadmi) a o 91,6 % (95 % IS: 43,3; 99,8) u dospelých
vo veku ≥ 70 rokov (1 prípad v porovnaní s 12 prípadmi). Počas týchto štúdií neboli hlásené žiadne prípady postihnutia vnútorných orgánov ani náhla cievna mozgová príhoda.
Vplyv Shingrixu
nabolesťsúvisiacusHZ
Celkovo sa zistil všeobecný trend k menej závažnej bolesti súvisiacej s HZ u osôb očkovaných
Shingrixom v porovnaní s osobami očkovanými placebom. V dôsledku vysokej účinnosti očkovacej látky proti HZ sa vyskytol nízky počet prípadov prelomenia ochrany pred HZ, a preto nebolo možné vyvodiť závery týkajúce sa týchto cieľov štúdie.
U osôb vo veku ≥ 70 rokov s aspoň jednou potvrdenou epizódou HZ (ZOE-50 a ZOE-70 posudzované súhrnne) Shingrix významne znížil spotrebu liekov proti bolesti súvisiacej s HZ o 39,0 %
(95 % IS: 11,9; 63,3) a skrátil dobu ich užívania o 50,6 % (95 % IS: 8,8; 73,2). Medián doby užívania
liekov proti bolesti bol 32,0 dní v skupine so Shingrixom a 44,0 dní v skupine s placebom.
U osôb s aspoň jednou potvrdenou epizódou HZ Shingrix v porovnaní s placebom významne znížil maximálne priemerné skóre bolesti počas celej epizódy HZ (priemer = 3,9 v porovnaní s 5,5,
P-hodnota = 0,049 u osôb vo veku ≥ 50 rokov (ZOE-50) a priemer = 4,5 v porovnaní s 5,6,
P-hodnota = 0,043 u osôb vo veku ≥ 70 rokov (ZOE-50 a ZOE-70 posudzované súhrnné)). Okrem toho, u osôb vo veku ≥ 70 rokov (ZOE-50 a ZOE-70 posudzované súhrnné) Shingrix v porovnaní
s placebom významne znížil maximálne skóre najhoršej bolesti počas celej epizódy HZ
(priemer = 5,7 v porovnaní so 7,0, P-hodnota = 0,032).
Skóre záťaže ochorením (burden-of-illness, BOI) zahŕňa výskyt HZ a závažnosť a dĺžku trvania akútnej a chronickej bolesti súvisiacej s HZ počas 6-mesačného obdobia po nástupe vyrážky. Účinnosť v znižovaní BOI bola 98,4 % (95 % IS: 92,2; 100) u osôb vo veku ≥ 50 rokov (ZOE-50)
a 92,1 % (95 % IS: 90,4; 93,8) u osôb vo veku ≥ 70 rokov (ZOE-50 a ZOE-70 posudzované súhrnné).
Imunogenita Shingrixu
Imunologický korelát ochrany sa nestanovil; úroveň imunitnej odpovede, ktorá poskytuje ochranu
pred HZ, preto nie je známa.
Imunitné odpovede na Shingrix sa hodnotili v podskupine osôb zo štúdií účinnosti fázy III, ZOE-50
[humorálna imunita a bunkami sprostredkovaná imunita (cell-mediated immunity, CMI)] a ZOE-70 (humorálna imunita). Shingrix vyvolal silnejšie gE-špecifické imunitné odpovede (humorálnu imunitu
a CMI) 1 mesiac po podaní 2. dávky v porovnaní s imunitnými odpoveďami pred očkovaním.
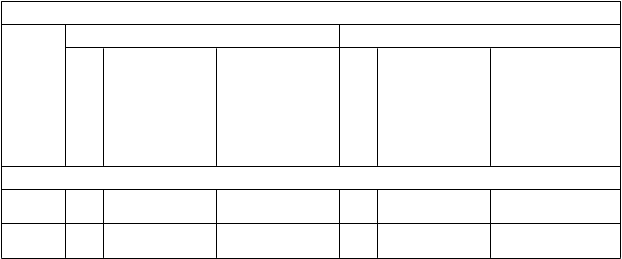
Výsledky týkajúce sa humorálnej imunogenity a CMI sú v uvedenom poradí uvedené v tabuľke 3 a 4.
T
abuľka 3: Humorálna imunogenita Shingrixu u dospelých vo veku ≥ 50 rokov (ATP kohorta
pre hodnotenie imunogenity)
V
eková
Imunitná odpoveď v zmysle protilátok proti gE^
3. mesiac* 38. mesiac**
skupina
(roky)
N
G
MC (mIU/ml)
(95 % IS)
Medián násobného vzostupu koncentrácií v porovnaní
s koncentráciami pred očkovaním (Q1; Q3)
ZOE-50
N
G
MC (mIU/ml)
(95 % IS)
Medián násobného vzostupu koncentrácií v porovnaní
s koncentráciami pred očkovaním (Q1; Q3)
≥ 50 1 070 52 376,6
(50 264,1; 54 577,9)
41,9 (20,8; 86,9)
967 11 919,6
(11 345,6; 12 522,7)
9,3 (4,9; 19,5)
ZOE-50 a ZOE-70 posudzované súhrnne
≥ 70 742 49 691,5
(47 250,8; 52 258,2)
34,3 (16,7; 68,5)
648 10 507,7
(9 899,2; 11 153,6)
7,2 (3,5; 14,5)
ATP Podľa protokolu (According-To-Protocol)
^ Imunitná odpoveď v zmysle protilátok proti gE = koncentrácie protilátok proti gE, merané pomocou enzýmovej imunosorbentovej analýzy zameranej na protilátky proti gE (gE ELISA)
* 3. mesiac = 1 mesiac po podaní 2. dávky
** 38. mesiac = 3 roky po podaní 2. dávky
N Počet hodnotiteľných osôb v špecifickom časovom bode (pre GMC) IS Interval spoľahlivosti'
GMC Geometrický priemer koncentrácií
Q1; Q3 Prvý kvartil a tretí kvartil
Tabuľka 4: Bunkami sprostredkovaná imunogenita Shingrixu u dospelých vo veku ≥ 50 rokov
(ATP kohorta pre hodnotenie imunogenity)
Odpoveď v zmysle gE-špecifických CD4[2+] T-lymfocytov^
3. mesiac* 38. mesiac**
V
eková skupina
(roky) N
Medián výskytu
(Q1; Q3)
Medián násobného vzostupu výskytu
v porovnaní N
s výskytom pred očkovaním (Q1; Q3)
 ZOE-50
Medián výskytu
(Q1; Q3)
Medián násobného vzostupu výskytu v porovnaní
s výskytom pred očkovaním (Q1; Q3)
ZOE-50
Medián výskytu
(Q1; Q3)
Medián násobného vzostupu výskytu v porovnaní
s výskytom pred očkovaním (Q1; Q3)
≥ 50 164 1 844,1
(1 253,6; 2 932,3)
≥ 70*** 52 1 494,6 (922,9; 2 067,1)
ATP podľa protokolu
24,6
(9,9; 744,2) 152
33,2
(10,0; 1 052,0) 46
738,9 (355,7; 1 206,5)
480,2 (196,1; 972,4)
7,9 (2,7; 31,6)
7,3 (1,7; 31,6)
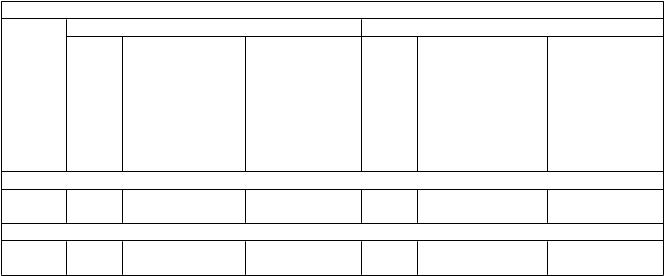
^ Odpoveď v zmysle gE-špecifických CD4[2+] T-lymfocytov = aktivita gE-špecifických
CD4+ T-lymfocytov, hodnotená pomocou metódy intracelulárneho farbenia cytokínov (intracellular cytokine staining, ICS) (CD4[2+] T-lymfocyty = CD4+ T-lymfocyty exprimujúce aspoň
2 zo 4 vybraných imunitných markerov)
* 3. mesiac = 1 mesiac po podaní 2. dávky
** 38. mesiac = 3 roky po podaní 2. dávky
N Počet hodnotiteľných osôb v špecifickom časovom bode
Q1; Q3 Prvý kvartil a tretí kvartil
*** Údaje o gE-špecifických CD4[2+] týkajúce sa vekovej skupiny ≥ 70-ročných sa získali v ZOE-50,
pretože aktivita CD4+ T-lymfocytov sa v ZOE-70 nehodnotila.
Údaje z otvorenej, observačnej (follow-up) klinickej štúdie fázy II s jednou skupinou, ktorá sa uskutočnila u dospelých vo veku ≥ 60 rokov (Zoster-024), svedčia o tom, že imunitná odpoveď (humorálna a CMI) navodená očkovacou látkou pretrváva približne až 6 rokov po očkovaní podľa schémy 0-2 mesiace (N = 119). Medián koncentrácie protilátok proti gE bol viac ako 7-násobne vyšší ako medián ich východiskovej koncentrácie pred očkovaním. Medián výskytu gE-špecifických CD4[2+]-T-lymfocytov bol viac ako 3,7-násobne vyšší ako medián ich východiskového výskytu
pred očkovaním.
Imunogenita u osôb, ktorým boli podané 2 dávky Shingrixu so 6-mesačným časovým odstupom
Účinnosť sa nehodnotila po očkovaní podľa schémy 0-6 mesiacov.
V otvorenej klinickej štúdii fázy III (Zoster-026), v ktorej bolo 238 dospelých vo veku ≥ 50 rokov rovnomerne randomizovaných na podanie 2 dávok Shingrixu s 2-mesačných alebo 6-mesačným
časovým odstupom, sa preukázalo, že humorálna imunitná odpoveď po očkovaní podľa
schémy 0-6 mesiacov bola noninferiórna v porovnaní s odpoveďou po očkovaní podľa schémy
0-2 mesiacov. GMC protilátok proti gE 1 mesiac po poslednej dávke očkovacej látky bol
38 153,7 mIU/ml (95 % IS: 34 205,8; 42 557,3) po očkovaní podľa schémy 0-6 mesiacov
a 44 376,3 mIU/ml (9 5% IS: 39 697,0; 49 607,2) po očkovaní podľa schémy 0-2 mesiacov.
Imunogenita u osôb s HZ v anamnéze pred očkovaním
Osoby s HZ v anamnéze boli vylúčené z účasti na ZOE-50 a ZOE-70. V nekontrolovanej, otvorenej
klinickej štúdii fázy III (Zoster-033) boli 96 dospelým vo veku ≥ 50 rokov, u ktorých bol výskyt HZ v anamnéze zdokumentovaný lekárom, podané 2 dávky Shingrixu s 2-mesačným časovým odstupom. Laboratórne potvrdenie prípadov HZ nebolo súčasťou postupov uplatňovaných v štúdii. GMC protilátok proti gE 1 mesiac po poslednej dávke očkovacej látky bol 47 758,7 mIU/ml
(95 % IS: 42 258,8; 53 974,4).
V priebehu jednoročného obdobia sledovania sa zaznamenalo 9 hlásení podozrenia na HZ u 6 osôb.
Je to vyšší opakovaný výskyt HZ ako je výskyt zvyčajne hlásený v observačných štúdiách u neočkovaných osôb s HZ v anamnéze (pozri časť 4.4).
Osoby s oslabeným imunitným systémom
Dve klinické štúdie fázy I/II, Zoster-001 a Zoster-015, sa uskutočnili u osôb, ktoré podstúpili
autológnu transplantáciu hematopoetických kmeňových buniek alebo ktoré mali infekciu HIV. Celkovo 135 dospelým, z ktorých 73 bolo vo veku ≥ 50 rokov, bola podaná aspoň jedna dávka Shingrixu, ktorá bola preukázateľne imunogénna a dobre znášaná.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií so Shingrixom
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri prevencii reaktivácie vírusu varicella-zoster (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií akútnej toxicity a toxicity po opakovanom podávaní, lokálnej tolerancie, bezpečnosti pre kardiovaskulárny/respiračný systém
a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
(antigén
gE):
Sacharóza
Polysorbát 80
Dihydrát dihydrogenfosforečnanu sodného
Hydrogenfosforečnan draselný

Suspenzia (adjuvantný systém AS01B):
Dioleoylfosfatidylcholín
Cholesterol
Chlorid sodný
Bezvodý hydrogenfosforečnan sodný
Dihydrogenfosforečnan draselný
Voda na injekcie
Adjuvanty, pozri aj časť 2.
6.2 InkompatibilityTento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky
Po rekonštitúcii:Chemická a fyzikálna stabilita je preukázaná na 24 hodín pri teplote 30 °C.
Z mikrobiologického hľadiska sa má očkovacia látka použiť ihneď. Ak sa nepoužije ihneď, za čas a podmienky uchovávania pred použitím je zodpovedný používateľ a za normálnych okolnosti to nemá byť dlhšie ako 6 hodín pri teplote 2 °C až 8 °C.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia• Prášok na 1 dávku v injekčnej liekovke (sklo typu 1) so zátkou (butylkaučuk).
• Suspenzia na 1 dávku v injekčnej liekovke (sklo typu 1) so zátkou (butylkaučuk).
Shingrix sa dodáva v balení obsahujúcom 1 injekčnú liekovku s práškom a 1 injekčnú liekovku so suspenziou alebo v balení obsahujúcom 10 injekčných liekoviek s práškom a 10 injekčných liekoviek so suspenziou.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Shingrix sa dodáva ako injekčná liekovka s hnedým vyklápacím viečkom obsahujúca prášok (antigén)
a injekčná liekovka s modrozeleným vyklápacím viečkom obsahujúca suspenziu (adjuvant). Pred podaním sa prášok a suspenzia musia rekonštituovať.
A
n
ti
g
én
Prášok
A
d
j
u
v
ant
Suspenzia
 1 dávka (0,5 ml)
1 dávka (0,5 ml)
Prášok a suspenzia sa majú zrakom skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu
vzhľadu. V prípade ich výskytu očkovaciu látku nerekonštituujte.
Ako pripraviťShingrix:Pred podaním sa Shingrix musí rekonštituovať.
1. Natiahnite celý obsah injekčnej liekovky obsahujúcej suspenziu do injekčnej striekačky.
2. Pridajte celý obsah injekčnej striekačky do injekčnej liekovky obsahujúcej prášok.
3. Jemne pretrepávajte, až kým sa prášok úplne nerozpustí.
Rekonštituovaná očkovacia látka je opaleskujúca, bezfarebná až svetlohnedastá kvapalina. Rekonštituovaná očkovacia látka sa má zrakom skontrolovať na prítomnosť cudzorodých častíc
a/alebo zmenu vzhľadu. V prípade ich výskytu očkovaciu látku nepodajte.
Po rekonštitúcii sa má očkovacia látka použiť okamžite; ak to nie je možné, očkovacia látka sa má uchovávať v chladničke (2 °C - 8 °C). Ak sa nepoužije do 6 hodín, má sa zlikvidovať.
Pred podaním:1. Natiahnite celý obsah injekčnej liekovky obsahujúcej rekonštituovanú očkovaciu látku
do injekčnej striekačky.
2. Zmeňte ihlu, aby ste na podanie očkovacej látky použili novú ihlu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlaxoSmithKline Biologicals S.A. Rue de l’Institut 89
B-1330 Rixensart
Belgicko
8. REGISTRAČNÉ ČÍSLO
EU/1/18/1272/001
EU/1/18/1272/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.