súčasnosti nie sú k dispozícii dostatočné klinické údaje, aby bolo možné odporúčať použitie salmeterolu u detí mladších ako 4 roky.
Zvláštne skupiny pacientov:U starších pacientov a u pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania.
4.3 KontraindikáciePrecitlivenosť na salmeteroliumhydroxynaftoát alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozorneniaa opatrenia pri používaníLiečba astmy má prebiehať za normálnych okolností postupnými krokmi.
Serevent sa nemá používať (a nie je dostatočný) ako počiatočná liečba astmy.
Serevent nie je náhradou perorálnych alebo inhalačných kortikosteroidov pri liečbe astmy. Jeho použitie dopĺňa ich účinok. Pacienti trpiaci astmou musia byť upozornení na to, že bez konzultácie s lekárom nesmú ukončiť liečbu steroidmi ani znížiť ich dávku, dokonca ani vtedy, ak sa po používaní salmeterolu budú cítiť lepšie.
Zvýšené užívanie krátkodobo pôsobiacich bronchodilatancií na zmiernenie astmatických príznakov svedčí o zhoršení kontroly príznakov astmy.
Aj keď Serevent môže byť nasadený ako prídavná terapia, ak inhalačné kortikosteroidy neposkytujú dostatočnú kontrolu príznakov astmy, Serevent sa pacientom nemá nasadiť počas ťažkej akútnej exacerbácie astmy, ani ak majú významne alebo akútne sa zhoršujúcu astmu.
Počas liečby Sereventom sa môžu vyskytnúť závažné exacerbácie a nežiaduce účinky spojené s astmou. Ak po nasadení Sereventu príznaky astmy zostanú naďalej nekontrolované alebo ak sa zhoršia, má sa pacientom odporučiť, aby pokračovali v liečbe a súčasne vyhľadali lekársku pomoc.
Náhle a progresívne zhoršovanie kontroly príznakov astmy je potenciálne život ohrozujúce a pacient má podstúpiť urgentné lekárske vyšetrenie. Má sa zvážiť zvýšenie dávky kortikosteroidov. Za týchto okolností môže byť vhodné každodenné sledovanie maximálneho výdychového prietoku. Na udržiavaciu liečbu astmy sa má salmeterol podávať v kombinácii s inhalačnými alebo perorálnymi kortikosteroidmi. Dlhodobo pôsobiace bronchodilatanciá nemajú byť jediným alebo hlavným liekom v udržiavacej liečbe astmy (pozri časť 4.1).
O postupnom znižovaní dávky Sereventu sa môže uvažovať ihneď ako budú príznaky astmy pod kontrolou. Pri postupnom znižovaní dávky je dôležitá pravidelná kontrola pacientov. Má sa použiť najnižšia účinná dávka Sereventu.
Paradoxný bronchospazmusTak ako pri inej inhalačnej liečbe, môže dôjsť k paradoxnému bronchospazmu s okamžitým zhoršením piskotu a poklesom maximálneho výdychového prietoku (peak expiratory flow rate, PEFR) po podaní dávky. Tento stav sa má okamžite liečiť rýchlo pôsobiacim bronchodilatanciom. Používanie Sereventu Diskus sa musí ihneď prerušiť, pacient vyšetriť a v prípade potreby treba začať alternatívnu liečbu (pozri časť 4.8).
Hlásené boli farmakologické vedľajšie účinky liečby beta
2‑agonistami, akými sú tremor, subjektívne palpitácie a bolesť hlavy, ale zvyčajne sú prechodné a pri pravidelnej liečbe ustupujú (pozri časť 4.8).
Kardiovaskulárne účinkyKardiovaskulárne účinky, akými sú zvýšený systolický krvný tlak a zvýšená srdcová frekvencia, môžu byť ojedinelo pozorované pri používaní všetkých sympatomimetík, hlavne pri vyšších ako terapeutických dávkach. Z tohto dôvodu sa má salmeterol opatrne používať u pacientov s už existujúcim kardiovaskulárnym ochorením.
TyreotoxikózaSerevent sa má podávať opatrne pacientom s tyreotoxikózou.
Hladiny glukózy v krviVeľmi zriedkavo boli hlásené prípady zvýšených hladín glukózy v krvi (pozri časť 4.8) a je potrebné na to myslieť pri predpisovaní tohto lieku pacientom s diabetom mellitus v anamnéze.
HypokaliémiaDôsledkom liečby beta
2‑agonistami môže byť potenciálne závažná hypokaliémia. Zvláštna opatrnosť sa odporúča pri akútnej ťažkej astme, pretože tento účinok môže byť zosilnený hypoxiou a súbežnou liečbou xantínovými derivátmi, steroidmi a diuretikami. V takýchto prípadoch sa majú sledovať hladiny draslíka v sére.
Respiračné príhodyÚdaje z veľkej klinickej štúdie (Salmeterol Multi‑Center Astma Research Trial, SMART /multicentrická výskumná štúdia skúmajúca salmeterol na liečbu astmy/) poukázali na to, že afroamerickí pacienti boli vystavení zvýšenému riziku závažných respiračných príhod alebo respiračného úmrtia pri používaní salmeterolu v porovnaní s placebom (pozri časť 5.1). Nie je známe, či to spôsobili farmakogenetické alebo iné faktory. Pacientom, černochom afrického pôvodu alebo afrokaribského pôvodu sa má preto odporučiť, aby pokračovali v liečbe, ale aby vyhľadali lekársku pomoc, ak počas používania Sereventu zostanú príznaky astmy naďalej nekontrolované alebo ak sa zhoršia.
KetokonazolSúbežné podávanie ketokonazolu významne zvyšuje systémovú expozíciu salmeterolu. Môže to viesť k zvýšenému výskytu systémových účinkov (napr. predĺženie QTc intervalu a palpitácie). Preto je potrebné vyhnúť sa súbežnej liečbe ketokonazolom alebo inými silnými inhibítormi CYP3A4, pokiaľ prínosy neprevažujú nad potenciálne zvýšeným rizikom vedľajších systémovývh účinkov liečby salmeterolom (pozri časť 4.5).
4.5 Liekové a iné interakcieBeta-adrenergné blokátory môžu oslabiť alebo antagonizovať účinok salmeterolu. Má sa vyhnúť podávaniu neselektívnych a selektívnych betablokátorov, pokiaľ nie sú závažné dôvody na ich použitie.
Dôsledkom liečby beta
2-agonistami môže byť potenciálne závažná hypokaliémia. Zvláštna opatrnosť sa odporúča pri akútnej ťažkej astme, pretože tento účinok môže byť zosilnený hypoxiou a súbežnou liečbou xantínovými derivátmi, steroidmi a diuretikami.
Silne účinné inhibítory CYP3A4Súbežné podávanie ketokonazolu (400 mg perorálne jedenkrát denne) a salmeterolu (50 µg inhalačne dvakrát denne) 15 zdravým jedincom počas 7 dní malo za následok významné zvýšenie plazmatickej expozície salmeterolu (1,4‑násobný vzostup C
max a 15‑násobný vzostup AUC). Môže to viesť k zvýšenému výskytu niektorých sytémových účinkov liečby salmeterolom (napr. predĺženie QTc intervalu a palpitácie) v porovnaní s podávaním salmeterolu alebo ketakonazolu v monoterapii (pozri časť 4.4).
Nezaznamenali sa klinicky významné účinky na krvný tlak, srdcovú frekvenciu, glykémiu a hladiny draslíka v krvi. Súbežné podávanie ketokonazolu nepredĺžilo polčas eliminácie salmeterolu ani nezvýšilo kumuláciu salmeterolu pri jeho opakovanom podávaní.
Je potrebné vyhnúť sa súbežnému podávaniu ketokonazolu, pokiaľ prínosy neprevažujú potenciálne zvýšené riziko systémových vedľajších účinkov liečby salmeterolom. Podobné riziko interakcie pravdepodobne existuje aj pri iných silne účinných inhibítoroch CYP3A4 (napr. itrakonazol, telitromycín, ritonavir).
Stredne účinné inhibítory CYP3A4Súbežné podávanie erytromycínu (500 mg perorálne trikrát denne) a salmeterolu (50 µg inhalačne dvakrát denne) 15 zdravým jedincom počas 6 dní malo za následok malé, ale štatisticky nevýznamné zvýšenie expozície salmeterolu (1,4‑násobný vzostup C
max a 1,2‑násobný vzostup AUC). Súbežné podávanie erytromycínu sa nespájalo so žiadnymi závažnými nežiaducimi účinkami.
4.6 Fertilita, gravidita a laktáciaGraviditaMalé množstvo klinických údajov u gravidných žien (300 až 1 000 ukončených gravidít) nepoukazuje na malformácie alebo fetálnu/neonatálnu toxicitu salmeterolu.
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity, okrem dôkazov o niekoľkých škodlivých účinkoch na plod pri podávaní veľmi vysokých dávok (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa používaniu Sereventu počas gravidity.
LaktáciaDostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie salmeterolu do mlieka. Riziko pre dojčené dieťa nemôže byť vylúčené.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu Sereventom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Štúdie HFA-134a neodhalili žiadne vplyvy na reproduktivitu a laktáciu dospelých potkanov alebo dvoch následných generácií potkanov, ani na vývoj plodu potkanov alebo králikov.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinku na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNežiaduce reakcie sú uvedené nižšie podľa triedy orgánových systémov a frekvencie. Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000) a veľmi zriedkavé (< 1/10 000), zahŕňajúc jednotlivé hlásenia. Časté a menej časté nežiaduce účinky boli zvyčajne určené z údajov z klinických štúdií. Výskyt u placeba sa nebral do úvahy. Veľmi zriedkavé nežiaduce účinky sú zvyčajne stanovené z údajov spontánne hlásených z postmarketingovej praxe.
Nasledujúce frekvencie sa odhadujú pre štandardnú dávku 50 mikrogramov dvakrát denne. Frekvencie pre vyššiu dávku 100 mikrogramov dvakrát denne boli taktiež zohľadnené tam, kde to bolo vhodné.
Trieda orgánových systémov
| Nežiaduca reakcia
| Frekvencia
|
Poruchy imunitného systému
| Reakcie z precitlivenosti s nasledujúcimi prejavmi:
Vyrážka (svrbiaca a červená)
Anafylaktické reakcie zahŕňajúce edém a angioedém, bronchospazmus a anafylaktický šok
|
Menej časté
Veľmi zriedkavé
|
Poruchy metabolizmu a výživy
| Hypokaliémia
Hyperglykémia
| Zriedkavé
Veľmi zriedkavé
|
Psychické poruchy
| Nervozita
Insomnia
| Menej časté
Zriedkavé
|
Poruchy nervového systému
| Bolesť hlavy (pozri časť 4.4)
Tremor (pozri časť 4.4)
Závrat
| Časté
Časté
Zriedkavé
|
Poruchy srdca a srdcovej činnosti
| Palpitácie (pozri časť 4.4)
Tachykardia
Srdcové arytmie (zahŕňajúce fibriláciu predsiení, supraventrikulárnu tachykardiu a extrasystoly).
| Časté
Menej časté
Veľmi zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Orofaryngálne podráždenie
Paradoxný bronchospazmus (pozri časť 4.4)
| Veľmi zriedkavé
Veľmi zriedkavé
|
Poruchy gastrointestinálneho traktu
| Nauzea
| Veľmi zriedkavé
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Svalové kŕče
Artralgia
| Časté
Veľmi zriedkavé
|
Celkové poruchy a reakcie v mieste podania
| Nešpecifická bolesť na hrudníku
| Veľmi zriedkavé
|
Hlásené boli farmakologické vedľajšie účinky liečby beta
2‑agonistami, akými sú tremor, bolesť hlavy a palpitácie, ale zvyčajne sú prechodné a pri pravidelnej liečbe ustupujú. Tremor a tachykardia sa vyskytujú častejšie pri podávaní dávok vyšších ako 50 µg dvakrát denne.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby
hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia
uvedeného v
Prílohe V.
4.9 PredávkovanieSymptómy a príznakyPríznaky a symptómy predávkovania salmeterolom sú rovnaké ako tie, ktoré sú typické pre nadmernú stimuláciu beta
2‑adrenergných receptorov, vrátane závratov, zvýšeného systolického krvného tlaku, tremoru, bolesti hlavy a tachykardie. Okrem toho môže dôjsť k hypokaliémii, a preto sa majú sledovať hladiny draslíka v sére. Má sa zvážiť suplementácia draslíka.
LiečbaAk dôjde k predávkovaniu, pacient má podľa potreby dostať podpornú liečbu s náležitým sledovaním. Ďalšia liečba sa má riadiť klinickým stavom pacienta alebo odporúčaniami poskytnutými národným toxikologickým informačným centrom, pokiaľ sú k dispozícii.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiastmatikum, bronchodilatancium.
ATC kód: R03AC12.
Mechanizmus účinku:Salmeterol je selektívny dlhodobo pôsobiaci (12 hodín) agonista beta2‑ adrenoreceptorov s dlhým bočným reťazcom, ktorý sa viaže na exo‑miesto receptora.
Tieto farmakologické vlastnosti salmeterolu poskytujú účinnejšiu ochranu pred histamínom indukovanou bronchokonstrikciou a vytvárajú dlhodobejšiu bronchodilatáciu, trvajúcu aspoň 12 hodín, v porovnaní s odporúčanými dávkami obvyklých, krátkodobo pôsobiacich beta2‑ agonistov.
In vitro testy ukázali, že salmeterol je silný a dlhodobo účinkujúci inhibítor uvoľňovania mediátorov z mastocytov v pľúcach, akými sú histamín, leukotriény a prostaglandín D2. U človeka salmeterol inhibuje včasnú aj neskorú fázu odpovede na inhalačný alergén; ovplyvnenie neskorej fázy pretrváva viac ako 30 hodín po podaní jednotlivej dávky aj keď už bronchodilatačný účinok nie je prítomný. Podanie jednotlivej dávky salmeterolu znižuje bronchiálnu hyperreaktivitu. Tieto vlastnosti naznačujú, že salmeterol má prídavné nebronchodilatačné účinky, ktorých celkový klinický význam však nie je ešte objasnený. Mechanizmus je odlišný od protizápalového účinku kortikosteroidov, ktoré sa nemajú vysadiť ani sa nemá znížiť ich dávka pri predpísaní salmeterolu.
Salmeterol bol skúmaný v liečbe stavov spojených s CHOCHP a ukázalo sa, že zlepšuje symptómy, funkciu pľúc a kvalitu života. Salmeterol pôsobí ako beta2‑ agonista na reverzibilnú zložku ochorenia.
In vitro sa tiež dokázalo, že salmeterol zvyšuje frekvenciu pohybu cílií ľudských bronchiálnych epitelových buniek a taktiež redukuje acidotoxický účinok pseudomonádového toxínu na bronchiálny epitel pacientov s cystickou fibrózou.
Multicentrická výskumná štúdia skúmajúca salmeterol na liečbu astmy (Salmeterol Multi-center Asthma Research Trial,SMART) SMART bola multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná, 28‑týždňová štúdia s paralelnými skupinami v USA, v ktorej bolo 13 176 pacientov randomizovaných do skupiny so salmeterolom (50 μg dvakrát denne) a 13 179 pacientov do skupiny s placebom, ktoré sa pridali k obvyklej terapii astmy pacientov. Pacienti boli zaradení, ak boli vo veku ≥ 12 rokov, mali astmu a ak v súčasnej dobe používali liek na astmu (ale nie LABA /dlhodobo pôsobiace beta2 ‑agonisty/). Zaznamenalo sa, ak pacienti pri zaradení do štúdie používali inhalačné kortikosteroidy, ale nebolo to požiadavkou štúdie. Primárnym cieľovým ukazovateľom v štúdii SMART bol kombinovaný počet respiračných úmrtí a respiračných život ohrozujúcich príhod.
Hlavné zistenia zo štúdie SMART: primárny cieľový ukazovateľ
Skupina pacientov
| Počet udalostí predstavujúcich primárny cieľový ukazovateľ /počet pacientov
| Relatívne riziko
(interval spoľahlivosti 95 %)
|
salmeterol
| placebo
|
Všetci pacienti
| 50/13 176
| 36/13 179
| 1,40 (0,91 až 2,14)
|
Pacienti používajúci inhalačné steroidy
| 23/6 127
| 19/6 138
| 1,21 (0,66 až 2,23)
|
Pacienti nepoužívajúci inhalačné steroidy
| 27/7 049
| 17/7 041
| 1,60 (0,87 až 2,93)
|
Afroamerickí pacienti
| 20/2 366
| 5/2 319
| 4,10 (1,54 až 10,90)
|
(Riziko uvedené tučným písmom je štatisticky významné s 95 % spoľahlivosťou.)
Hlavné zistenia zo štúdie SMART podľa používania inhalačných steroidov pri zaradení do štúdie: sekundárne cieľové ukazovatele
| Počet udalostí predstavujúcich sekundárne cieľové ukazovatele/počet pacientov
| Relatívne riziko
(95 % intervaly spoľahlivosti)
|
salmeterol
| placebo
|
Respiračné úmrtie
|
Pacienti používajúci inhalačné steroidy
| 10/6 127
| 5/6 138
| 2,01 (0,69 až 5,86)
|
Pacienti nepoužívajúci inhalačné steroidy
| 14/7 049
| 6/7 041
| 2,28 (0,88 až 5,94)
|
Kombinované úmrtie spojené s astmou alebo život ohrozujúca príhoda
spojená s astmou
|
Pacienti používajúci inhalačné steroidy
| 16/6 127
| 13/6 138
| 1,24 (0,60 až 2,58)
|
Pacienti nepoužívajúci inhalačné steroidy
| 21/7 049
| 9/7 041
| 2,39 (1,10 až 5,22)
|
Úmrtie spojené s astmou
|
Pacienti používajúci inhalačné steroidy
| 4/6 127
| 3/6 138
| 1,35 (0,30 až 6,04)
|
Pacienti nepoužívajúci inhalačné steroidy
| 9/7 049
| 0/7 041
| *
|
(*=výpočet nebol možný kvôli tomu, že v skupine s placebom nebol žiadny prípad. Údaje uvedené tučným písmom je štatisticky významné na 95 % úrovni. Sekundárne cieľové ukazovatele vo vyššie uvedenej tabuľke dosiahli štatistickú významnosť v celej populácii.) Sekundárne cieľové ukazovatele, ktorými boli kombinované úmrtie alebo život ohrozujúca príhoda z akejkoľvek príčiny, úmrtie z akejkoľvek príčiny, alebo hospitalizácia z akejkoľvek príčiny, nedosiahli štatistickú významnosť v celej populácii.
CHOCHPŠtúdia TORCHTORCH bola 3‑ročná štúdia hodnotiaca účinok liečby s liekom Seretidom Diskus 50/500 µg dvakrát denne, Diskusom so salmeterolom 50 µg dvakrát denne, Diskusom s flutikazónompropionátom (FP) 500 µg dvakrát denne alebo placebom na úmrtnosť z akejkoľvek príčiny (celkovú úmrtnosť) u pacientov s CHOCHP. Pacientom s CHOCHP, ktorí mali pri zaradení do štúdie (pred podaním bronchodilatancia) FEV
1 < 60 % náležitých hodnôt, pridelili náhodným výberom dvojito zaslepenú liečbu. Počas štúdie bola u pacientov povolená obvyklá liečba CHOCHP s výnimkou iných inhalačných kortikosteroidov, dlhodobo pôsobiacich bronchodilatancií a dlhodobo užívaných systémových kortikosteroidov. Stav prežívania po 3 rokoch bol zisťovaný u všetkých pacientov bez ohľadu na prerušenie užívania skúšaného lieku. Primárnym cieľovým ukazovateľom bolo zníženie úmrtnosti z akejkoľvek príčiny po 3 rokoch pre Seretide oproti placebu.
| Placebo
n = 1 524
| Salmeterol 50
n = 1 521'
| FP 500
n = 1 534
| Seretide 50/500
n = 1 533
|
Úmrtnosť z akejkoľvek príčiny po 3 rokoch
|
Počet úmrtí (%)
| 231
(15,2 %)
| 205
(13,5 %)
| 246
(16,0 %)
| 193
(12,6 %)
|
Pomer rizika oproti placebu
(IS)
p‑hodnota
| N/A
| 0,879
(0,73; 1,06)
0,180
| 1,060
(0,89; 1,27)
0,525
| 0,825
(0,68; 1,00 )
0,0521
|
Pomer rizika pre Seretide 50/500 oproti jeho zložkám (IS)
p‑hodnota
| N/A
|
0,932
(0,77; 1,13)
0,481
|
0,774
(0,64; 0,93)
0,007
| N/A
|
1.Nevýznamná p‑hodnota po úprave vzhľadom na 2 priebežné analýzy porovnávajúce primárnu účinnosť z log‑rank analýzy stratifikovanej podľa stavu fajčenia resp. nefajčenia
|
U jedincov liečených Seretidom bol počas 3 rokov trend k zlepšenému prežívaniu v porovnaní s placebom, avšak v tomto parametri sa nedosiahla hladina štatistickej významnosti p≤ 0,05.
Percento pacientov, ktorí zomreli počas 3 rokov kvôli príčinám spojeným s CHOCHP, bolo 6,0 % u placeba, 6,1 % u salmeterolu, 6,9 % u FP a 4,7 % u Seretidu.
Priemerný počet stredne ťažkých až ťažkých exacerbácií ročne bol významne znížený pri liečbe so Seretidom v porovnaní s liečbou salmeterolom, FP a placebom (v skupine so Seretidom bola priemerná hodnota výskytu 0,85 oproti 0,97 v skupine so salmeterolom, 0,93 v skupine s FP a 1,13 v skupine s placebom). Toto zodpovedá zníženiu výskytu stredne ťažkých až ťažkých exacerbácií o 25 % (95 % IS: 19 % až 31 %; p < 0,001) v porovnaní s placebom, o 12 % v porovnaní so salmeterolom (95 % IS: 5 % až 19 %, p = 0,002) a o 9 % v porovnaní s FP (95 % IS: 1 % až 16 %, p = 0,024). Salmeterol a FP významne znížili výskyt exacerbácií v porovnaní s placebom, salmeterol o 15 % (95 % IS: 7 % až 22 %; p < 0,001) a FP o 18 % (95 % IS: 11 % až 24 %; p < 0,001).
Kvalitu života spojenú so zdravotným stavom, meranú pomocou dotazníka SGRQ (St George’s Respiratory Questionnaire /dotazník hodnotiaci kvalitu života pri respiračných ochoreniach/), zlepšili všetky aktívne lieky v porovnaní s placebom. Priemerné zlepšenie počas troch rokov so Seretidom v porovnaní s placebom bolo ‑3,1 jednotiek (95 % IS: ‑4,1 až ‑2,1; p < 0,001), v porovnaní so salmeterolom bolo ‑2,2 jednotiek (p < 0,001) a v porovnaní s FP bolo ‑1,2 jednotiek (p = 0,017). Zníženie o 4 jednotky sa považuje za klinicky významné.
Odhadovaná pravdepodobnosť vzniku pneumónie, hlásenej ako nežiaduca udalosť, počas 3 rokov bola 12,3 % u placeba, 13,3 % u salmeterolu, 18,3 % u FP a 19,6 % u Seretidu (pomer rizík u Seretidu oproti placebu: 1,64, 95 % IS: 1,33 až 2,01, p < 0,001). Nedošlo k zvýšeniu výskytu úmrtí spojených s pneumóniou; počet úmrtí počas liečby, ktoré sa posudzovali ako primárne spôsobené pneumóniou, bol 7 u placeba, 9 u salmeterolu, 13 u FP a 8 u Seretidu. Nebol žiadny významný rozdiel v pravdepodobnosti vzniku zlomeniny kosti (5,1 % u placeba, 5,1 % u salmeterolu, 5,4 % u FP a 6,3 % u Seretidu; pomer rizík u Seretidu oproti placebu: 1,22, 95 % IS: 0,87 až 1,72, p = 0,248).
5.2 Farmakokinetické vlastnostiSalmeterol pôsobí lokálne v pľúcach, preto plazmatické hladiny nie sú indikátorom terapeutického účinku. Okrem toho sú údaje o farmakokinetike salmeterolu obmedzené, vzhľadom na technické ťažkosti so stanovením liečiva v plazme z dôvodu nízkych plazmatických koncentrácií (približne 200 pikogramov/ml alebo menej) po inhalačnom podávaní terapeutických dávok.
V placebom kontrolovanej štúdii so skríženou terapiou („crossover“), ktorá skúmala liekové interakcie u 15 zdravých jedincov, viedlo 7‑dňové súbežné podávanie salmeterolu (50 µg dvakrát denne formou inhalácie) a inhibítora CYP3A4, ketokonazolu (400 mg jedenkrát denne perorálne), k významnému zvýšeniu plazmatickej expozície salmeterolu (1,4‑násobné zvýšenie C
max a 15‑násobné zvýšenie AUC). Po opakovanom podávaní nedošlo k zvýšenej kumulácii salmeterolu. U troch jedincov bolo súbežné podávanie salmeterolu a ketokonazolu prerušené kvôli predĺženiu QTc intervalu alebo palpitáciám so sínusovou tachykardiou. U zvyšných 12 jedincov súbežné podávanie salmeterolu a ketokonazolu nemalo klinicky významný vplyv na srdcovú frekvenciu, hladiny draslíka v krvi a trvanie QTc intervalu (pozri časť 4.4 a časť 4.5).
AbsorpciaPo pravidelných dávkach salmeteroliumhydroxynaftoátu môže byť v systémovej cirkulácii stanovená kyselina hydroxynaftoová, dosahujúca rovnovážne koncentrácie približne 100 ng/ml. Tieto koncentrácie sú až 1 000‑násobne nižšie ako rovnovážne hladiny pozorované v toxikologických štúdiách a po dlhodobom pravidelnom podávaní (viac ako 12 mesiacov) neboli u pacientov s obštrukciou dýchacích ciest pozorované žiadne škodlivé účinky.
BiotransformáciaV
in vitro štúdii sa dokázalo, že salmeterol sa v rozsiahlej miere metabolizuje na α‑hydroxysalmeterol (alifatická oxidácia) prostredníctvom cytochrómu P450 3A4 (CYP3A4). V štúdii opakovaného podávania salmeterolu a erytromycínu u zdravých dobrovoľníkov sa nedokázali žiadne klinicky významné zmeny vo farmakodynamických účinkoch po 500 mg dávke erytromycínu podávanej trikrát denne. Štúdia liekových interakcií medzi salmeterolom a ketokonazolom však preukázala významné zvýšenie plazmatickej expozície salmeterolu (pozri časť 4.4 a časť 4.5).
5.3 Predklinické údaje o bezpečnostiV reprodukčných štúdiách na zvieratách boli pri veľmi vysokých dávkach pozorované niektoré účinky na plod typické pre beta2‑ agonistov.
V sérii štúdií na prokaryotických alebo eukaryotických bunkových systémoch
in vitro alebo
in vivo na potkanoch salmeteroliumhydroxynaftoát nespôsoboval genetickú toxicitu.
Dlhodobé štúdie so salmeteroliumhydroxynaftoátom zistili druhovo viazané benígne nádory hladkého svalstva v mezováriu potkanov a v maternici myší. Vedecká literatúra a naše vlastné farmakologické štúdie poskytujú dobré dôkazy toho, že tieto účinky sú druhovo špecifické a pre klinické použitie nie sú relevantné.
6. farmaceutické informácie6.1 Zoznam pomocných látokMonohydrát laktózy (obsahuje mliečny proteín).
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky pri uchovávaní pri teplote do 30 °C.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 30 °C.
Uchovávajte na suchom mieste.
6.5 Druh obalu a obsah baleniaPrášková zmes salmeteroliumhydroxynaftoátu a laktózy naplnená v blistroch fóliového prúžku s odnímateľnou krycou laminátovou fóliou. Fóliový prúžok je súčasťou inhalačnej pomôcky Diskus. Písomná informácia pre používateľa, papierová škatuľka.
Veľkosť balenia:
60 dávok x 50 µg
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPokyny na použitie:Keď vyberiete Serevent Diskus prvýkrát zo škatule, bude v polohe zatvorený.
V pomôcke Diskus sú blistre obsahujúce Serevent vo forme prášku. Na hornej strane Diskusu je počítač dávok, ktorý ukazuje, koľko dávok ešte zostáva. Odpočítava smerom nadol po 0 a číslice 5 až 0 sú zvýraznené červenou farbou, ktorá upozorňuje, že už zostáva len niekoľko dávok. Keď počítač dávok ukáže 0, váš inhalátor je prázdny.
Používanie inhalátoraPosunutím páčky Diskusu sa otvorí malý otvor v náustku a na fóliovom prúžku sa otvorí blister, v ktorom je prášok pripravený na inhaláciu. Pri zavretí Diskusu sa páčka automaticky vráti do svojej pôvodnej polohy a ochranný kryt chráni Diskus keď sa nepoužíva. Keď ho budete potrebovať použiť, postupujte podľa nasledujúcich krokov.
1. OTVORIŤ: Aby ste otvorili Diskus, v jednej ruke držte vonkajší kryt a palec druhej ruky vložte do jazdca. Palcom zatlačte jazdec smerom od vás tak ďaleko, ako to pôjde a budete počuť „kliknutie“.

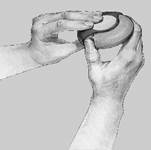
2. Posunúť: Držte Diskus tak, aby bol náustok otočený smerom k vám. Môžete ho držať buď v pravej, alebo v ľavej ruke. Posuňte páčku smerom od seba tak ďaleko ako pôjde, až pokiaľ nebudete počuť „kliknutie“. Diskus je vtedy pripravený na použitie. Po každom zatlačení páčky sa otvorí blister a pripraví sa prášok na inhaláciu. S páčkou sa nehrajte, pretože sa tým otvárajú ďalšie blistre a liek sa vyplytvá bez úžitku.

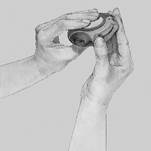
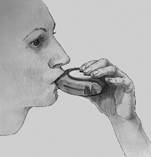
3. Inhalovať: Prečítajte si túto časť pozorne skôr, ako užijete váš liek.
- Držte Diskus mimo vašich úst a vydýchnite čo najviac ako je možné bez námahy. Nevydychujte do inhalátora Diskus.
- Priložte si náustok k perám; vdychujte plynulo a hlboko cez Diskus, nie cez nos.
- Vyberte si Diskus z úst.
- Zadržte dych asi na 10 sekúnd alebo na tak dlho ako je to možné bez námahy.
- Pomaly vydýchnite.
- Vypláchnite si ústa vodou a vodu vypľujte, pretože to môže pomôcť zabrániť vzniku kandidózy a zachrípnutiu.
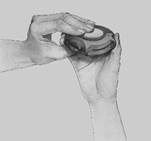
4. Zatvoriť:
- Diskus zatvoríte tak, že jazdec posuniete späť smerom k vám čo najviac ako to pôjde.
- Po zavretí Diskusu budete počuť „kliknutie“. Páčka sa vráti do pôvodnej polohy a je znovu nastavená. Váš Diskus bude pripravený na ďalšie použitie.

 Čistenie vášho inhalátora
Čistenie vášho inhalátoraNáustok Diskusu očistíte tak, že ho utriete suchou papierovou vreckovkou.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlaxoSmithKline Slovakia s.r.o., Bratislava, Slovenská republika
8. REGISTRAČNÉ ČÍSLO14/0195/98-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21.apríla 1998
Dátum posledného predĺženia registrácie: 30.mája 2007
10. DÁTUM REVÍZIE TEXTUMáj 2015