
ovania pri interakciách
V prípade súbežného podávania silných inhibítorov/induktorov CYP3A4 alebo silných inhibítorov CYP2D6 sa dávka musí upraviť. Keď sa inhibítory/induktory CYP3A4 alebo inhibítory CYP2D6 vysadia, má sa dávka vrátiť späť na pôvodnú dávku (pozri časť 4.5). V prípade nežiaducich reakcií napriek úprave dávky RXULTI je potrebné prehodnotiť nutnosť súbežného podávania RXULTI a inhibítorov CYP2D6 alebo CYP3A4.
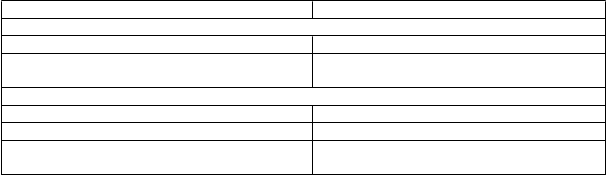
Tabuľka 1: Úprava dávky RXULTI u pacientov, ktorí sú pomalými metabolizátormi CYP2D6 a pri súbežnom podávaní s inhibítormi CYP.
Faktory Upravená dávka
Pomalí metabolizátori CYP2D6
Pomalí metabolizátori CYP2D6 Podať polovicu odporúčanej dávky
Pomalí metabolizátori CYP2D6 užívajúci silné/stredne silné inhibítory CYP3A4
Podať štvrtinu odporúčanej dávky
Pacienti užívajúci inhibítory CYP2D6 a/alebo inhibítory CYP3A4
Silné inhibítory CYP2D6 Podať polovicu odporúčanej dávky
Silné inhibítory CYP3A4 Podať polovicu odporúčanej dávky
Silné/stredne silné inhibítory CYP2D6 so silnými/stredne silnými inhibítormi CYP3A4
Podať štvrtinu odporúčanej dávky
 Pacienti
užívajúci
s
il
n
é
induktory
CYP3A4
Pacienti
užívajúci
s
il
n
é
induktory
CYP3A4
Ak sa brexpiprazol používa súbežne so silnými induktormi CYP3A4 (napr. rifampicínom),
u pacientov stabilizovaných na brexpiprazole je potrebné postupne titrovať dennú dávku brexpiprazolu na dvojnásobok odporúčanej dávky v priebehu 1 až 2 týždňov. Následne, ak sú podľa klinickej
odpovede potrebné ďalšie úpravy dávky, môže dôjsť k jej zvýšeniu až na 3-násobok odporúčanej
dennej dávky. Denná dávka nesmie prekročiť 12 mg, ak sa brexipiprazol používa súbežne so silnými induktormi CYP3A4. Vhodnejšie je rozdelené dávkovanie brexpiprazolu na dvakrát denne, pretože
dávkovanie raz denne spôsobuje vysoké kolísanie koncentrácie medzi maximom a minimom („peak to
trough” fluktuácia) (pozri časť 4.5).
Induktory CYP3A4 účinkujú v závislosti od času a môže trvať až 2 týždne, kým dosiahnu maximálny
účinok po úvodnom podaní. V opačnom prípade, pri vysadení môže indukcia CYP3A4 trvať aj
2 týždne, kým dôjde k poklesu.
Pediatrická populáciaBezpečnosť a účinnosť brexpiprazolu u detí a dospievajúcich vo veku menej ako 18 rokov nebola stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaPerorálne použitie
Filmom obalené tablety je možné užívať s jedlom alebo bez jedla.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Počas liečby antipsychotikami sa môže zlepšenie klinického stavu pacienta prejaviť po niekoľkých dňoch až niekoľkých týždňoch. Počas celého tohto obdobia majú byť pacienti starostlivo monitorovaní.
Myšlienky nasamovražduasamovražednésprávanie
Prítomnosť samovražedného správania je neoddeliteľnou súčasťou psychických chorôb a porúch
nálady a v niektorých prípadoch bola hlásená skoro po začiatku alebo zmene antipsychotickej liečby, vrátane liečby brexpiprazolom (pozri časť 4.8). Dôsledné sledovanie vysokorizikových pacientov má byť súčasťou antipsychotickej liečby.
Kardiovaskulárne poruchy
Brexpiprazol nebol hodnotený u pacientov s anamnézou infarktu myokardu/ischemickej choroby srdca
alebo s klinicky významnou kardiovaskulárnou chorobou, pretože títo pacienti boli vylúčení z
klinického skúšania.
Brexpiprazol sa má opatrne používať u pacientov so známym kardiovaskulárnym ochorením (anamnéza infarktu myokardu alebo ischemickej choroby srdca, zlyhávania srdca alebo porúch vedenia), cerebrovaskulárnou chorobou, stavmi, ktoré predisponujú pacientov na hypotenziu (dehydratácia, hypovolémia a liečba antihypertenzívnymi liekmi) alebo hypertenziu (vrátane akcelerovanej alebo malígnej).
Predĺženie QT intervalu
U pacientov liečených antipsychotikami sa môže objaviť predĺženie QT intervalu. V klinických
skúšaniach bolo pri brexpiprazole zaznamenaných iba niekoľko nezávažných prípadov predĺženia QT intervalu. Brexpiprazol sa má preto používať s opatrnosťou u pacientov s kardiovaskulárnym ochorením,predĺžením QT intervalu v rodinnej anamnéze, nerovnováhou elektrolytov alebo pri súbežnom užívaní liekov, ktoré môžu spôsobovať predĺženie QT intervalu (pozri časti 4.8 a 5.1).
Venózna tromboembólia
Pri užívaní antipsychotík boli hlásené prípady venóznej tromboembólie (VTE). Keďže pacienti liečení
antipsychotikami mali často prítomné získané rizikové faktory pre VTE,musia sa pred liečbou a počas liečby brexpiprazolom identifikovať všetky možné rizikové faktory a prijať preventívne opatrenia.
Ortostatická hypotenzia a synkopa
Nežiaduce reakcie spojené s ortostatickou hypotenziou môžu zahŕňať závrat, točenie hlavy a
tachykardiu. Tieto riziká sú vo všeobecnosti najvyššie na začiatku liečby antipsychotikami a počas
zvýšenia dávky. Pacienti so zvýšeným rizikom týchto nežiaducich reakcií (napr. staršie osoby) alebo so zvýšeným rizikom vzniku komplikácií v dôsledku hypotenzie zahŕňajú pacientov s dehydratáciou, hypovolémiou, liečených liekmi na hypertenziu, s kardiovaskulárnym ochorením v anamnéze (napr. zlyhávanie srdca, infarkt myokardu, ischémia alebo poruchy vodivosti), s cerebrovaskulárnym ochorením v anamnéze, ako aj pacientov, ktorí doteraz neboli liečení antipsychotikami. U týchto pacientov je potrebné zvážiť nižšiu úvodnú dávku a pomalšiu titráciu a je potrebné sledovať ortostatické aspekty životných funkcií (pozri časť 4.2).
N
euroleptický malígnysyndróm(NMS)
Potenciálne fatálny komplex symptómov označovaný ako neuroleptický malígny syndróm (NMS) bol
hlásený v súvislosti s antipsychotickou liečbou. Klinickými prejavmi NMS sú hyperpyrexia, stuhnutosť svalov, zmenený mentálny stav a prejavy autonómnej nestability (nepravidelný pulz alebo tlak krvi, tachykardia, diaforéza a srdcová dysrytmia). Ďalšie prejavy môžu zahŕňať zvýšenú hladinu kreatínfosfokinázy, myoglobinúriu (rabdomyolýza) a akútne zlyhanie obličiek. Ak sa u pacienta prejavia prejavy a príznaky, ktoré môžu poukazovať na NMS, alebo sa objaví nevysvetliteľná vysoká horúčka bez ďalších klinických prejavov NMS, liečba brexpiprazolom sa musí ihneď ukončiť.
Extrapyramídové symptómy (EPS)
Extrapyramídové symptómy (vrátane akútnej dystónie) sú známymi skupinovými účinkami
antipsychotík. Brexpiprazol je potrebné používať s opatrnosťou u pacientov s anamnézou EPS.
Tardívna dyskinéza
Syndróm potenciálne ireverzibilných, mimovoľných, dyskinetických pohybov, ktorý sa môže vyvinúť
u pacientov liečených antipsychotikami. Napriek tomu, že syndróm sa prevažne vyskytuje u starších osôb, obzvlášť u starších žien, pri začatí antipsychotickej liečby nie je možné predpovedať,, u ktorých pacientov sa tento syndróm vyvinie. Ak sa u pacienta liečeného brexpiprazolom objavia prejavy a príznaky tardívnej dyskinézy, má sa zvážiť zníženie dávky alebo ukončenie liečby. Tieto príznaky sa môžu dočasne zhoršovať, alebo môžu vzniknúť dokonca aj po ukončení liečby.
Cerebrovaskulárne nežiaduce reakcie
V placebom kontrolovaných klinických skúšaniach v populácii starších pacientov s demenciou bolo
pri niektorých antipsychotikách zaznamenané zvýšenie incidencie cerebrovaskulárnych nežiaducich reakcií (cievne mozgové príhody a prechodné ischemické záchvaty), vrátane fatálnych prípadov, v porovnaní s osobami na placebe.
Starší pacienti s psychózou spojenou sdemenciou
Brexpiprazol nebol skúmaný u starších pacientov s demenciou a jeho použitie u starších pacientov s
demenciou sa neodporúča z dôvodu zvýšeného rizika celkovej mortality.
Hyperglykémia a diabetes mellitus
Hyperglykémia, v niektorých prípadoch extrémna, spojená s ketoacidózou alebo hyperosmolárnou
kómou alebo smrťou bola hlásená u pacientov liečených atypickými antipsychotikami. Medzi rizikové faktory, ktoré môžu predisponovať pacientov na vážne komplikácie, patrí obezita a rodinná anamnéza
diabetu.
Pacienti liečení inými antipsychotikami zahŕňajúcimi brexpiprazol majú byť sledovaní na prejavy a príznaky hyperglykémie (ako je polydipsia, polyúria, polyfágia a slabosť). Pred alebo včas po začatí liečby antipsychotikami je potrebné vyšetriť hladinu glukózy v plazme nalačno. Počas dlhodobej liečby majú byť pravidelne monitorované hladiny glukózy v plazme pre možné zhoršenie glukózovej kontroly.
Nárast telesnej hmotnosti a dyslipidémia
Antipsychotiká, vrátane brexpiprazolu, sú spájané so zmenami v metabolizme, vrátane nárastu telesnej
hmotnosti a dyslipidémie. Zvýšenie frekvencie nárastu telesnej hmotnosti bolo pozorované pri dlhodobom trvaní liečby brexpiprazolom (pozri časť 4.8). Na začiatku liečby je potrebné vyhodnotiť
lipidový profil. Na začiatku a počas liečby sa odporúča klinické monitorovanie telesnej hmotnosti a
lipidového profilu.
Záchvaty
Ako aj pri ostatných antipsychotikách, brexpiprazol sa má používať s opatrnosťou u pacientov, ktorí
majú v anamnéze záchvaty alebo iné stavy, ktoré prípadne znižujú prah záchvatu. Počas užívania
brexpiprazolu boli hlásené záchvaty (pozri časť 4.8).
Regulácia telesnej teploty
Antipsychotikám sa pripisujú poruchy schopnosti tela znižovať teplotu telesného jadra. Je potrebná
opatrnosť pri predpisovaní brexpiprazolu pacientom, ktorí budú vystavení podmienkam, ktoré môžu
prispievať k zvyšovaniu teploty telesného jadra, napr. namáhavé cvičenie, vystavenie extrémnej horúčave, súbežné užívanie liekov s anticholinergnou aktivitou alebo podliehajú dehydratácii.
Dysfágia
S používaním antipsychotík sú spojené poruchy motility ezofágu a aspirácia. Brexpiprazol sa má
používať opatrne u pacientov s rizikom aspiračnej pneumónie.
Poruchy kontroly impulzov
U pacientov liečených brexpiprazolom boli hlásené poruchy kontroly impulzov, vrátane patologického
hráčstva. Počas užívania brexpiprazolu môžu pacienti pozorovať zvýšené nutkanie, obzvlášť pre hráčstvo a neschopnosť ovládať toto nutkanie. Ďalšie hlásené typy nutkania zahŕňajú: kompulzívne
sexuálne správanie, kompulzívne nakupovanie, prejedanie a iné impulzívne a kompulzívne správanie. U pacientov s poruchou kontroly impulzov v anamnéze môže byť zvýšené riziko a mali by byť
dôkladne sledovaní. Keďže pacienti toto správanie nemusia vnímať ako nezvyčajné, je veľmi dôležité, aby sa počas liečby brexpiprazolom predpisujúci lekár spýtal pacientov alebo ich opatrovateľov
obzvášť na vývoj nových alebo zvýšenie existujúcich porúch kontroly impulzov alebo iných kompulzívnych správaní. Je potrebné zdôrazniť, že príznaky porúch kontroly impulzov môžu súvisieť s existujúcim ochorením, v niektorých prípadoch však bolo hlásené, že po znížení dávky alebo
ukončení užívania lieku nutkania prestali. Ak nie sú identifikované, kompulzívne správania môžu
spôsobiť ujmu na zdraví pacienta alebo iných osôb (pozri časť 4.8). Ak sa u pacienta počas užívania
brexpiprazolu vyskytnú tieto typy nutkania, zvážte zníženie dávky alebo ukončenie užívania lieku
(pozri časť 4.8).
Leukopénia, neutropénia a agranulocytóza
Počas liečby antipsychotikami bola hlásená leukopénia, neutropénia a agranulocytóza (vrátane
fatálnych prípadov). Možné rizikové faktory pre leukopéniu/neutropéniu zahŕňajú predtým prítomný nízky počet bielych krviniek (WBC) a leukopéniu/neutropéniu spôsobenú liekmi v anamnéze. U
pacientov, u ktorých sa predtým vyskytoval nízky počet bielych krviniek alebo majú
leukopéniu/neutropéniu spôsobenú liekmi v anamnéze, je potrebné počas prvých mesiacov liečby často sledovať počet všetkých zložiek krvi (CBC) a brexpiprazol je potrebné vysadiť pri prvom
prejave poklesu bielych krviniek, pokiaľ nemá tento pokles inú príčinu. Pacientov s neutropéniou je
potrebné dôkladne sledovať na výskyt horúčky alebo iných príznakov a prejavov infekcie a v prípade výskytu takýchto príznakov alebo prejavov je potrebná okamžitá liečba. Pacienti so závažnou neutropéniou (celkový počet neutrofilov < 1 000/mm3) musia vysadiť brexpiprazol a ich počet bielych
krviniek je potrebné sledovať až do vyliečenia.
Prolaktín
Brexpiprazol môže zvyšovať hladiny prolaktínu. Nárasty spojené s liečbou brexpiprazolom sú vo
všeobecnosti mierne a v priebehu podávania môžu poklesnúť, v niektorých menej častých prípadoch však môže účinok pretrvávať aj počas podávania (pozri časť 4.8).
Laktóza
RXULTI filmom obalené tablety obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie,celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Brexpiprazol je prevažne metabolizovaný prostredníctvom CYP3A4 a CYP2D6.
Potenciál iných liekov ovplyvniťbrexpiprazol
Inhibítory CYP3A4
Súbežné podávanie ketokonazolu (200 mg dvakrát denne počas 7 dní), silného inhibítora CYP3A4, s jednorazovou perorálnou dávkou 2 mg brexpiprazolu zvýšilo AUC brexpiprazolu o 97 % bez zmeny
Cmax. Na základe výsledkov interakčných štúdií sa odporúča úprava dávky brexpiprazolu na polovicu odporúčanej dávky pri súbežnom podávaní so silnými inhibítormi CYP3A4 (itrakonazol, ketokonazol,
ritonavir a klaritromycín).
Induktory CYP3A4
Súbežné podávanie rifampicínu (600 mg dvakrát denne počas 12 dní), silného induktora CYP3A4 s jednorazovou perorálnou dávkou 4 mg brexpiprazolu spôsobilo približne 31 % pokles Cmax a a 73 % pokles AUC brexpiprazolu. Ak sa brexpiprazol používa súbežne so silnými induktormi CYP3A4 (napr. rifampicínom), treba zvýšiť potrebnú celkovú dennú dávku brexpiprazolu približne na trojnásobok odporúčanej dennej dávky (pozri časť 4.2).
Dávkovanie brexpiprazolu raz denne počas súbežného podávania induktorov CYP3A4 spôsobuje vysoké kolísanie jeho sérovej hladiny („peak to trough” fluktuácia), preto je vhodnejšie dávkovanie rozdeliť na dvakrát denne.
Inhibítory CYP2D6
Súbežné podávanie jednorazovej perorálnej dávky 2 mg brexpiprazolu s chinidínom (324 mg/deň počas 7 dní), potentným inhibítorom CYP2D6, zvýšilo AUC brexpiprazolu o 94 % a nespôsobilo
žiadnu zmenu Cmax. Na základe výsledkov interakčných štúdií sa odporúča úprava dávky
brexpiprazolu na polovicu odporúčanej dávky pri súbežnom podávaní so silnými inhibítormi CYP2D6
(chinidín, paroxetín a fluoxetín).
Na základe odhadu z analýzy populačnej farmakokinetiky sa pri extenzívnych metabolizátoroch CYP2D6 dostávajúcich inhibítory CYP3A4 aj CYP2D6 alebo pri pomalých metabolizátoroch CYP2D6 dostávajúcich silné inhibítory CYP3A4, očakáva približne 4-násobný až 5-násobný nárast koncentrácií brexpiprazolu a u týchto osôb sa odporúča úprava dávky na štvrtinu (pozri časť 4.2).
Potenciál brexpiprazolu ovplyvňovaťinélieky
Na základe výsledkov štúdií in vitro brexpiprazol pravdepodobne nespôsobuje klinicky významné
farmakokinetické interakcie s liekmi metabolizovanými enzýmami cytochrómu P450. Brexpiprazol neovplyvňuje absorpciu liečiv, ktoré sú substrátmi pre transportér proteínu rezistencie voči rakovine prsníka (BCRP) a transportér P-glykoproteínu (P-gp).
Ak sa brexpiprazol podáva súbežne s liekmi, o ktorých je známe, že spôsobujú predĺženie QT
intervalu alebo nerovnováhu elektrolytov, je potrebná opatrnosť.
Ak sa brexpiprazol podáva súbežne s liekmi, o ktorých je známe, že zvyšujú hladinu kreatínfosfokinázy (CPK), je potrebné zvážiť možný aditívny účinok nárastu CPK vyvolaného brexpiprazolom.
Farmakodynamické interakcie
V súčasnosti nie sú dostupné žiadne údaje o farmakodynamických interakciách brexpiprazolu. Pri
predpisovaní s inými liekmi je potrebná opatrnosť. Vzhľadom na účinky brexpiprazolu na centrálny
nervový systém (CNS) sa má brexpiprazol používať s opatrnosťou v kombinácii s alkoholom alebo inými liekmi pôsobiacimi na CNS s podobnými nežiaducimi reakciami, ako je napríklad sedácia (pozri časť 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú dostupné žiadne alebo len obmedzené množstvo údajov o použití brexpiprazolu u tehotných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Brexpiprazol sa
neodporúča počas gravidity a u žien v plodnom veku, ktoré nepoužívajú antikoncepciu.
U novorodencov vystavených pôsobeniu antipsychotík vrátane brexpiprazolu, existuje počas tretieho trimestra gravidity riziko nežiaducich reakcií vrátane extrapyramídových a/alebo abstinenčných príznakov, ktorých závažnosť a trvanie sa po pôrode môžu líšiť. Boli hlásené prípady agitácie, hypertónie, hypotónie, tremoru, somnolencie, respiračnej tiesne a problémy pri dojčení. Novorodencov je preto potrebné následne dôkladne sledovať.
Dojčenie
Nie je známe, či sa brexpiprazol/jeho metabolity vylučujú do materského mlieka. Dostupné
farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie brexpiprazolu/jeho
metabolitov do mlieka u potkanov (pozri časť 5.3). Riziko pre novorodencov/dojčatá nemožno vylúčiť. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu brexpiprazolom sa má urobiť
po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Účinok brexpiprazolu na ľudskú fertilitu nebol hodnotený. Štúdie na zvieratách preukázali zníženú
plodnosť samíc (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Brexpiprazol môže mať mierny až stredne závažný vplyv na schopnosť viesť vozidlá a obsluhovať stroje z dôvodu možných účinkov na nervový systém, ako sú napríklad sedácia a závrat, ktoré sú častými nežiaducimi reakciami na tento liek (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce liekové reakcie (ADR) boli akatízia (5,6 %) a nárast telesnej hmotnosti
(3,9 %).
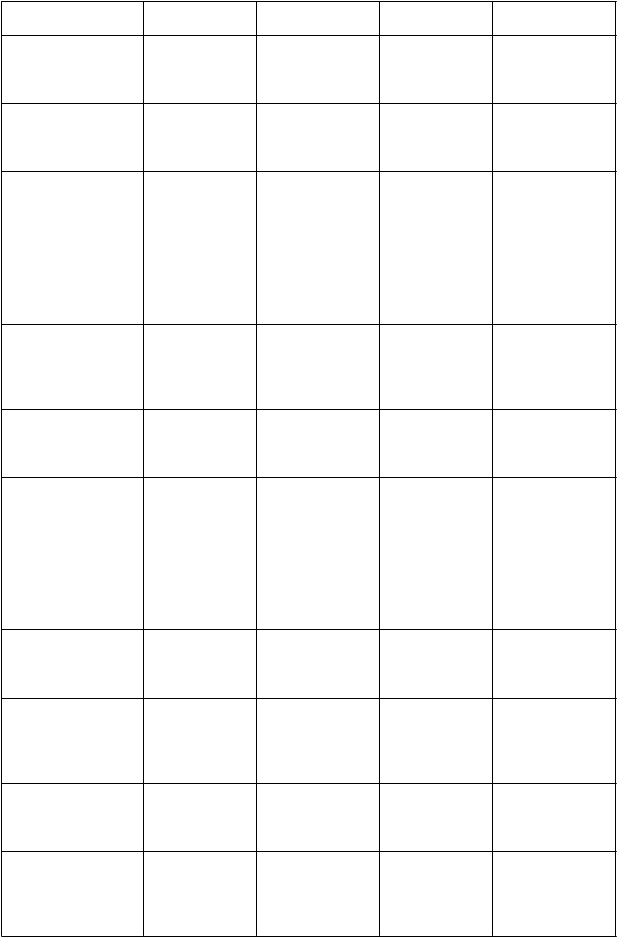
Tabuľkový zoznamnežiaducichreakcií
Výskyt nežiaducich liekových reakcií spojených s liečbou brexpiprazolom je uvedený v tabuľke
nižšie. Tabuľka vychádza z nežiaducich reakcií hlásených v krátkodobých, placebom kontrolovaných klinických štúdiách fázy 2 a 3 s relevantnými terapeutickými dávkami (2 mg až 4 mg).
Všetky nežiaduce reakcie lieku sú zoradené podľa triedy orgánových systémov (SOC) a frekvencie:
veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov). V rámci skupín frekvencií sú nežiaduce účinky uvedené v poradí klesajúcej závažnosti.
T
rieda orgánových systémov
Poruchy
im
unitného systému
V
eľmi časté Časté Menej časté Neznáme
Vyrážka Angioedém Urtikária Opuch tváre
Poruchy
m
etabolizmu a výživy
Nárast telesnej
hmotnosti
Psychické poruchy Pokus o
samovraždu Samovražedné myšlienky
Patologické
hráčstvo Impulzívne správanie Prejedanie Kompulzívne nakupovanie Kompulzívne sexuálne správanie
Poruchy nervového systému
Akatízia Závrat Tras Sedácia
Parkinsonizmus Záchvaty Neuroleptický malígny syndróm (NMS)
Poruchy srdca
a srdcovej činnosti
Predĺžený QT
interval na elektrokardiograme
Poruchy ciev Venózna
tromboembólia
(vrátane pľúcnej embólie a trombózy hlbokých žíl) Ortostatická hypotenzia
Poruchy dýchacej
sústavy, hrudníka a mediastína
Kašeľ
Poruchy
gastrointestinálneho traktu
Hnačka
Nevoľnosť
Bolesť v hornej časti brucha
Zubný kaz
Plynatosť
Poruchy kostrovej a
svalovej sústavy a spojivového tkaniva
Bolesť chrbta
Bolesti končatín
Myalgia Rabdomyolýza
 Stavy v gravidite, v
šestonedelí a perinatálnom
období
Stavy v gravidite, v
šestonedelí a perinatálnom
období
Abstinenčný
syndróm novorodenca
(pozri časť 4.6)
T
rieda orgánových systémov
V
eľmi časté Časté Menej časté Neznáme
L
aboratórne a
f
unkčné vyšetrenia
Zvýšená hladina prolaktínu v krvi1
Nárast hladiny kreatínfosfokináz y v krvi
Zvýšený krvný tlak
Zvýšená hladina
triacylglycerolo v v krvi
Nárast hladiny pečeňových enzýmov

1 Kategorizácia zvýšenej hladiny prolaktínu v krvi bola stanovená na základe potenciálne klinicky
relevantných kritérií (PCR) PCR > 1 × horná hranica normálu (Upper Limit of Normal – ULN).
Popis vybraných nežiaducich reakciíExtrapyramídové symptómy (EPS)Akatízia bola najčastejšie hlásenou nežiaducou reakciou v súvislosti s EPS v skupine s
brexpiprazolom pri dávkach 2 mg/deň až 4 mg/deň (5,6 %) v porovnaní so 4,5 % v skupine s placebom, nasledovaná trasom (2,7 %) v porovnaní s 1,2 % v skupine s placebom.
V rámci ďalších nežiaducich reakcií v súvislosti s EPS hlásených v krátkodobých, kontrolovaných
štúdiách sa vyskytovali dyskinéza (0,4 %), extrapyramídová porucha (1,8 %) a parkinsonizmus
(0,4 %).
AkatíziaV štúdiách s fixnou dávkou sa preukázala závislosť akatízie na dávke u pacientov liečených
brexpiprazolom, t.j. zvýšená frekvencia akatízie pri vyšších dávkach. Frekvencia výskytu akatízie bola
3,0 % pri dávke 1 mg/deň, 4,6 % pri dávke 2 mg/deň, 6,5 % pri dávke 4 mg/deň v porovnaní s 5,2 % v skupine s placebom.
Výskyt akatízie v krátkodobých, kontrolovaných skúšaniach (5,4 %) bol podobný ako výskyt
v dlhodobých, otvorených skúšaniach (5,7 %).
Samovražedné sklonyV krátkodobých, kontrolovaných skúšanich boli nežiaduce udalosti súvisiace s liečbou (TEAE) spojené so samovražednými sklonmi hlásené u 8 osôb (0,5 %, 2 závažné udalosti, 1 viedla k prerušeniu liečby) vo všetkých skupinách liečených brexpiprazolom a u 3 osôb (0,4 %, žiadna závažná) v skupine s placebom. V dlhodobých, otvorených skúšaniach boli nežiaduce udalosti súvisiace s liečbou (TEAE) spojené so samovražednými sklonmi hlásené u 23 osôb (1,6 %). Celkovo sa v programe klinického vývoja brexpiprazolu v liečbe schizofrénie vyskytlo jedno úmrtie spôsobené samovraždou, ktoré skúšajúci vyhodnotil ako nesúvisiace s liekom. Spontánne prípady hlásenej dokonanej samovraždy a pokusov o samovraždu boli hlásené v období po uvedení na trh.
Predĺženie QT intervaluV krátkodobých, kontrolovaných skúšaniach s brexpiprazolom boli hlásené 3 TEAE v súvislosti s predĺžením QT intervalu v skupine s 2 mg až 4 mg (0,3 %) v porovnaní s 3 TEAE (0,5 %) hlásených u osôb na placebe. Výskyt TEAE v dlhodobých skúšaniach bol podobný ako v krátkodobých
skúšaniach.
Účinky brexpiprazolu v terapeutických (4 mg) a supraterapeutických (12 mg) dávkach na QT interval
boli hodnotené u účastníkov so schizofréniou alebo schizoafektívnou poruchou v randomizovanom, dvojito-zaslepenom, placebom a aktívne kontrolovanom (moxifloxacín) skúšaní s paralelnou skupinou. Analýzy podskupín v rámci tohto skúšania naznačujú, že predĺženie QT intervalu bolo vyššie u žien ako u mužov (pozri časť 5.1).
Nárast telesnej hmotnostiV krátkodobých, kontrolovaných skúšaniach bol percentuálny podiel účastníkov s klinicky
významným nárastom telesnej hmotnosti (nárast o ≥ 7 % oproti východiskovej hodnote telesnej
hmotnosti) bol 9,1 % v skupine s dávkou brexpiprazolu 2 mg/deň až 4 mg/deň v porovnaní s 3,8 % v skupine s placebom.
Percentuálny podiel účastníkov s klinicky významným nárastom telesnej hmotnosti (nárast ≥ 7 %
telesnej hmotnosti) v dlhodobom, otvorenom skúšaní pri ktorejkoľvek návšteve bol 20,7 % a 0,4 % účastníkov prerušilo liečbu z dôvodu nárastu telesnej hmotnosti. U pacientov s nárastom telesnej hmotnosti ≥ 7 % oproti východiskovej hodnote sa časom zvýšila telesná hmotnosť s priemerným nárastom hmotnosti až do 10,2 kg v 52. týždni. Celková priemerná zmena telesnej hmotnosti pre skupinu s brexpiprazolom v dlhodobom, otvorenom skúšaní bola 2,1 kg v 52. týždni.
ProlaktínVýskyt zvýšenej hladiny prolaktínu v krvi bol 0,9 % v skupine s 2 mg až 4 mg brexpiprazolu v porovnaní s 0,5 % v skupine s placebom v krátkodobom kontrolovanom skúšaní. Vysoké frekvencie výskytu zvýšenej hladiny prolaktínu (1,5 % v porovnaní s 0,60 %) boli pozorované u žien v porovnaní s mužmi v krátkodobom skúšaní. Okrem toho, frekvencie výskytu zvýšených hladín
prolaktínu > 1 × ULN v skupine s dávkou brexpiprazolu 2 mg až 4 mg boli 13,7 % u žien
v porovnaníso 6,4 % v skupine s placebom a 11,1 % u mužov
v porovnaní s 10,3 % v skupine s placebom.
Neuroleptický malígny syndrómPotenciálne fatálny komplex symptómov označovaný ako neuroleptický malígny syndróm (NMS) bol
hlásený v súvislosti s brexpiprazolom (pozri časť 4.4).
NevoľnosťCelková frekvencia výskytu nevoľnosti v skupine s 2 mg až 4 mg brexpiprazolu 2,3 % v krátkodobom kontrolovanom skúšaní v porovnaní s 2,0 % pri placebe. Frekvencia výskytu vracania bola 1,0 % v skupine liečenej brexpiprazolom v porovnaní s 1,2 % v skupine dostávajúcej placebo.
V rámci rozdielov súvisiacich s pohlavím bola pozorovaná vyššia frekvencia výskytu nevoľnosti (4,8 %
oproti 2,8 %) a vracania (4,6 %
oproti 1,4 %) u žien v porovnaní s mužmi u pacientov liečených brexpiprazolom v krátkodobom skúšaní. U účastníkov dostávajúcich placebo bola frekvencia výskytu nevoľnosti 2,8 % u mužov
oproti 3,2 % u žien a pre vracanie bola frekvencia výskytu 3,0 % u mužov
oproti 2,6 % u žien (pozri časť 5.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieGastrická laváž a liečba emetikom môže byť účinná okamžite po predávkovaní. V prípade predávkovania je potrebné zaznamenať elektrokardiogram, a ak je prítomné predĺženie QT intervalu, je potrebné nariadiť kardiologické monitorovanie.
Liečba predávkovania by sa mala zamerať na podpornú liečbu, zabezpečenie voľných dýchacích ciest, oxygenáciu a ventiláciu a na liečbu príznakov. Starostlivý dohľad a monitorovanie majú pokračovať, až kým sa pacient nezotaví.
Perorálne aktívne uhlie a sorbitol (50 g/240 ml) podané po jednej hodine po podaní 2 mg perorálnej dávky brexpiprazolu znížilo hodnoty Cmax brexpiprazolu asi o 5 % až 23 % a hodnoty AUC asi o 31 % až 39 %, nie sú však dostupné dostatočné údaje o liečebnom potenciále aktívneho uhlia pri liečbe predávkovania brexpiprazolom.
Aj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania brexpiprazolom, nie je pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa brexpiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptiká, iné antipsychotiká, ATC kód: N05AX16
Mechanizmus účinku
Brexpiprazol je nové atypické antipsychotikum. Farmakologický účinok brexpiprazolu je
pravdepodobne sprostredkovaný moduláciou sérotonínových a dopamínových systémov kombináciou čiastočného agonizmu na sérotonínových receptoroch 5-HT1A a dopamínových receptoroch D2 a antagonistického pôsobenia na sérotonínových receptoroch 5-HT2A s podobnými vysokými afinitami ku všetkým týmto receptorom (hodnoty Ki: 0,1 nM až 0,5 nM). Brexpiprazol preukázal aj antagonistické pôsobenie na noradrenergných receptoroch α1B/2C s afinitou v rovnakom subnanomolárnom rozsahu Ki (hodnoty Ki: 0,2 nM až 0,6 nM).
Farmakodynamické účinky
Vplyvy genetických variácií na farmakodynamickú odpoveď na brexpiprazol neboli skúmané.
Účinky na QT inteval
Účinky brexpiprazolu na QT interval boli skúmané u pacientov so schizofréniou alebo
schizoafektívnou poruchou. V celkovej analýze brexpiprazol nepredlžoval QTc interval v klinicky významnom rozsahu po podaní terapeutickej ani supraterapeutickej dávky (4 mg/deň, n = 62 alebo
12 mg/deň, n = 53) a nebola pozorovaná žiadna súvislosť medzi koncentráciami brexpiprazolu a
predĺžením QTc intervalu.
Analýzy podskupín zamerané na QTc v rámci týchtoskúšaní naznačili, že predĺženie QTc intervalu bolo vyššie u žien ako u mužov. V skupine s dávkou brexpiprazolu 4 mg/deň bola maximálna placebom upravená priemerná zmena východiskovej hodnoty QTc intervalu 5,2 ms (90 % CI: 1,5; 8,9) u mužov (n = 48) a 15,0 ms (90 % CI: 7,7; 22,3) u žien (n = 14) 6 hodín po podaní dávky. V skupine s
dávkou brexpiprazolu 12 mg/deň bola maximálna placebom upravená priemerná zmena východiskovej hodnoty QTc intervalu 2,9 ms (90 % CI: −1,2, 6,9) u mužov (n = 40) 12 hodín po podaní dávky a
10,4 ms (90 % CI: 2,7, 18,2) u žien (n = 13) 24 hodín po podaní dávky. Nižší počet žien ako mužov
prijatých do účasti na štúdii neumožňuje vyvodiť definitívne závery.
Klinická účinnosť abezpečnosť
Účinnosť a bezpečnosť brexpiprazolu v liečbe schizofrénie u dospelých bola sledovaná v dvoch
medzinárodných a jednom národnom (Japonsko), 6-týždňových, randomizovaných, dvojito- zaslepených, placebom kontrolovaných klinických skúšaniach s fixnou dávkou (skúšania 1 až 3) a
v medzinárodnom, 6-týždňovom, randomizovanom, dvojito-zaslepenom, placebom kontrolovanom, klinickom skúšaní s aktívnou kontrolou (kvetiapín) s flexibilnou dávkou (skúšanie 4) a v jednom medzinárodnom, placebom kontrolovanom, 52-týždňovom skúšaní s udržiavacou dávkou (skúšanie 5).
Skúšania zahŕňali 2 690 pacientov vo veku 18 rokov až 65 rokov.
V skúšaniach 1, 2 a 3 bol brexpiprazol titrovaný podľa popisu v časti 4.2: 1 mg počas 4 dní a následne
2 mg v 5. až 7.deň. V 8. deň bola dávka v niektorých liečebných skupinách zvýšená na 4 mg.
Krátkodobé skúšania
V troch krátkodobých skúšaniach s fixnou dávkou (skúšanie 1, 2 a 3) boli účastníci randomizovaní na
brexpiprazol v dávke 2 mg raz denne, 4 mg raz denne alebo placebo.
Skúšanie 4 hodnotilo účinnosť, bezpečnosť a znášanlivosť brexpiprazolu v rozsahu flexibilnej dávky
2 mg/deň až 4 mg/deň a 400 mg až 800 mg kvetiapínu s predĺženým uvoľňovaním (XR) na overenie senzitivity. V krátkodobom skúšaní bola primárnym cieľovým ukazovateľom priemerná zmena od
začiatku po 6. týždeň v celkovom skóre na škále pozitívnych a negatívnych syndrómov (Positive and Negative Syndrome Scale [PANSS]), čo je viacbodový dotazník pozostávajúci z piatich faktorov na hodnotenie pozitívnych príznakov, negatívnych príznakov, zmätených myšlienok, nekontrolovaných prejavov nepriateľstva/vzrušenia a úzkosti/depresie.
Hlavný sekundárny cieľový ukazovateľ v skúšaní 1, 2 a 4 bola závažnosť schizofrénie hodnotená podľa Clinical Global Impressions-Severity (CGI-S), čo je sedembodový dotazník na hodnotenie závažnosti ochorenia lekárom. CGI-S bol využitý aj v skúšaniach 3 a 5 ako sekundárny ukazovateľ.
Účinky brexpiprazolu boli hodnotené aj v rámci niekoľkých vopred špecifikovaných sekundárnych cieľových ukazovateľov: špecifické aspekty príznakov schizofrénie (skóre za jednotlivé sekcie škály PANSS: pozitívne príznaky, negatívne príznaky, excitácia, faktory podľa Mardera pozitívne a negatívne, zmätené myšlienky, nekontrolované prejavy nepriateľstva a vzrušenia a úzkosť/depresia) a analýza odpovede (ktorá sa chápe ako 30 % zlepšenie v celkovom skóre PANSS oproti začatiu liečby a skóre 1 v dotazníku CGI-I (veľmi výrazné zlepšenie) alebo 2 (výrazné zlepšenie)).
Účinnosť bola preukázaná v skúšaní 1 pre obidve dávky brexpiprazolu 2 mg/deň a 4 mg/deň a zopakovaná v skúšaní 2 iba pre dávku brexpiprazolu 4 mg/deň a v skúšaní 3 iba pre dávku brexpiprazolu 2 mg/deň.
V skúšaní 4 s flexibilnou dávkou v 6. týždni účastníci v skupine liečenej brexpiprazolom mali číselne vyššie zlepšenie celkového skóre PANSS ako účastníci v skupine s placebom, napriek tomu, že rozdiel v 6. týždni nedosiahol štatistickú významnosť v primárnej analýze účinnosti (p = 0,0560) (pozri tabuľku 2). V rovnakom skúšaní mala aktívna kontrola, kvetiapín XR, (podaný na overenie senzitivity) výsledky odlišné od placeba.
Tabuľka 2: Výsledky primárnej účinnosti počas 6-týždňového skúšania v liečbe schizofrénie
Skúšanie Liečebná skupina n Primárny ukazovateľ účinnosti: PANSS
1 Brexpiprazol
Priemerné východiskové skóre (SD)
95,85
Priemerná zmena LS v porovnaní s východiskovou hodnotou (SE)
−20,73
Priemerný rozdiel LSa, b (95 % CI)
−8,72
p-hodnota
(2 mg/deň)* 180
Brexpiprazol
(4 mg/deň)* 178
(13,75)
94,70 (12,06)
(1,55)
−19,65 (1,54)
(−13,1, −4,37) < 0,0001
−7,64
(−12,0, −3,30) 0,0006
Placebo 178 95,69 (11,46)
−12,01
(1,60) -- --
Brexpiprazol
(2 mg/deň) 179
Brexpiprazol
(4 mg/deň)* 181
96,30 (12,91)
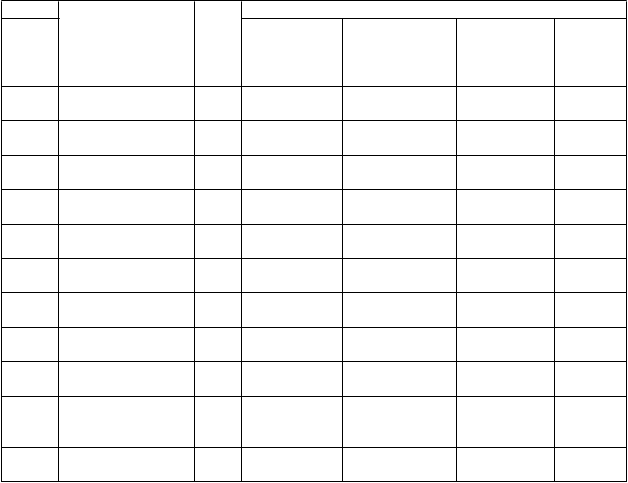
94,99 (12,38)
−16,61 (1,49)
−20,00 (1,48)
−3,08
(−7,23, 1,07) 0,1448
−6,47
(−10,6, −2,35) 0,0022
Placebo 180 94,63 (12,84)
−13,53
(1,52) -- --
Brexpiprazol
(2 mg/deň)* 113
Brexpiprazol
(4 mg/deň) 109
96,55 (19,20)
96,39 (15,73)
−14,95 (2,00)
−11,49 (2,10)
−7,32
(−13,04, −1,59) 0,0124
−3,86
(−9,71, 2,00) 0,1959
Placebo 113 97,19 (19,27)
−7,63
(2,11) -- --
Brexpiprazol
4 (2 mg/deň až 4 mg/de
ň)
150
97,82 (10,25)
−19,99
(1,51) −4,1 (−8,2, 0,1)
0,0560
Placebo 159 98,38 (10,30)
−15,93
(1,49) -- --
SE štandardná chyba'
Priemer LS priemer metódou najmenších štvorcov
CI interval spoľahlivosti
* liečba štatisticky významne lepšia ako placebo
a rozdiel (brexpiprazol mínus placebo) od začatia liečby do šiesteho týždňa, vyjadrený ako zmena priemeru spočítaného metódou najmenších štvorcov
b Priemer LS, 95 % CI a p-hodnoty pri jednotlivých skúšaniach boli odvodené z analýzy modelov
zmiešaných účinkov pre opakované merania (Mixed effect Model Repeat Measurement –
MMRM) nasledovne: ako konštanty boli použité centrum, typ liečby, návšteva a vzťah medzi návštevou a liečebnou intervenciou, kovarianciami boli vstupné hodnoty a vzťah medzi vstupnou hodnotou a danou návštevou. Bola použitá neštrukturovaná matica odchýliek a kovariancií.
Primárna štatistická analýza sa vykonala pomocou modelu MMRM s imputáciou náhodne chýbajúcich dát (Missing at Random – MAR). Výsledky analýzy citlivosti pomocou viacnásobnej imputácie podľa placeba (PMI) boli v súlade s primárnou analýzou.
Výsledky (hlavného) sekundárneho cieľového ukazovateľa a ďalšie cieľové ukazovatele zodpovedali
hodnotám primárneho ukazovateľa.
V skúšaní 1 sa štatisticky významné vyššie zlepšenie CGI-S, hlavného sekundárneho cieľového ukazovateľa účinnosti, v 6. týždni preukázalo aj pri dávke 2 mg/deň a 4 mg/deň v porovnaní so
skupinou na placebe. Vzhľadom na danú postupnosť testov sa vyššie zlepšenie CGI-S pri obidvoch
dávkach 2 mg/deň aj 4 mg/deň môže akceptovať ako podporný dôkaz iba pre skúšania 2, 3 a 4 (pozri
tabuľku 3).
Tabuľka 3: Výsledky hlavných sekundárnych ukazovateľov účinnosti počas 6 týždňového
skúšania v liečbe schizofrénie
Skúša
nie
L
i
ečebná skupina n Hlavné meradlo sekundárnej účinnosti: CGI-S
1 Brexpiprazol
Priemerné východiskové skóre (SD)
4,90
Priemerná zmena LS v porovnaní s východiskovou hodnotou (SE)
−1,15
Priemerný rozdiel LSa (95 % CI)
−0,33
p-hodnota
(2 mg/deň)* 181
Brexpiprazol
(4 mg/deň)* 178
(0,64)
4,81 (0,64)
(0,08)
−1,20 (0,08)
(−0,56, −0,10) 0,0056
−0,38
(−0,61, −0,15) 0,0012
Placebo 181 4,84 (0,66)
−0,82 (0,09)
-- --
Brexpiprazol
(2 mg/deň) 180
Brexpiprazol
(4 mg/deň)* 183
4,96 (0,65)
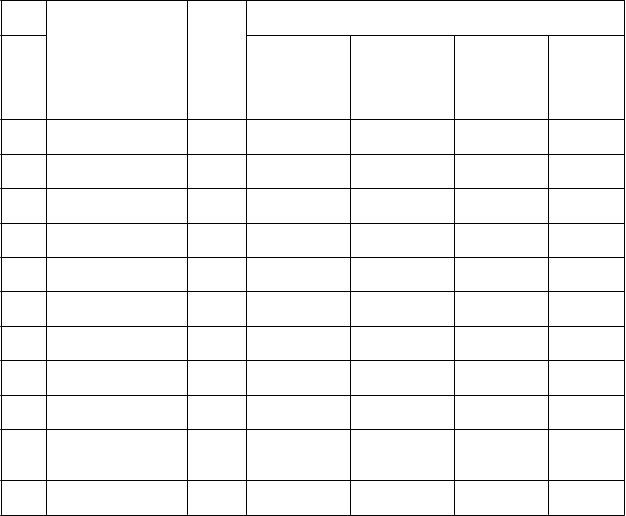
4,85 (0,64)
−0,99 (0,09)
−1,19 (0,08)
−0,19
(−0,42, 0,05) 0,1269
−0,38
(−0,62, −0,15) 0,0015
Placebo 181 4,87 (0,61)
−0,81 (0,09)
-- --
Brexpiprazol
(2 mg/deň)* 113
Brexpiprazol
(4 mg/deň) 109
4,80 (0,78)
4,71 (0,75)
−0,84 (0,11)
−0,64 (0,12)
−0,35
(−0,67, −0,03) 0,0308
−0,16
(−0,48, 0,17) 0,3461
Placebo 113 4,73 (0,71)
−0,48 (0,12)
-- --
Brexpiprazol*
4 (2 mg/deň až 4 mg/deň
)b
150
4,96 (0,59)
−1,21
(0,08) −0,27 (−0,49, −0,06)
0,0142
Placebo 159 4,94 (0,57)
−0,93 (0,08)
-- --
SE štandardná chyba
Priemer LS priemer metódou najmenších štvorcov
CI interval spoľahlivosti
* liečba štatisticky významne lepšia ako placebo
a rozdiel (brexpiprazol mínus placebo) od začatia liečby do šiesteho týždňa, vyjadrený ako zmena priemeru spočítaného metódou najmenších štvorcov
b priemerná dávka 3,5 mg/deň
Skúšanie zachovania účinnosti
V skúšaní 5, čo bolo dlhodobé klinické hodnotenie zachovania účinku brexpiprazolu sledovaním doby,
počas ktorej je oddialený hroziaci relaps schozofrénie, boli pacienti so schizofréniou, ktorí reagovali
na liečbu brexpiprazolom v dávke 1 mg/deň až 4 mg/deň, stabilizovaní počas
12 týždňov až 36 týždňov a následne randomizovaní spôsobom dvojitého zaslepenia tak, že buď pokračovali v liečbe stabilizačnou dávkou brexpiprazolu (n = 96) alebo užívali placebo (n = 104), a to
počas 52 týždňov až kým došlo k relapsu.
V primárnej analýze času do nástupu relapsu sa u pacientov s brexpiprazolom preukázala výrazne dlhšia doba do relapsu v porovnaní s pacientmi na placebe (p < 0,0001). V 52. týždni brexpiprazol (13,5 %) znížil riziko nástupu relapsu o 71 % v porovnaní s placebom (38,5 %). Počas stabilizácie brexpiprazol zlepšil klinickú symptomatológiu (podľa hodnotenia PANSS, CGI-S a CGI-I [metódou analýzy kovariancie (Analysis of Covariance – ANCOVA) posledného preneseného pozorovania (Last Observation Carried Forward – LOCF)]) a funkčný stav pacientov (podľa hodnotenia dotazníkom Global Assessment of Functioning (GAF) [metódou ANCOVA LOCF]). Tieto zlepšenia sa zachovali počas 52-týždňovej, dvojito-zaslepenej, udržiavacej fázy u pacientov na brexpiprazole, pričom
pacienti randomizovaní na placebo vykazovali zhoršenie skóre PANSS, CGI-S a CGI-I a skóre GAF
[metódou ANCOVA LOCF]). Brexpiprazol zaistil lepšiu kompenzáciu príznakov a fungovania pacientov v porovnaní s placebom.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií účinnosti a
bezpečnosti s brexpiprazolom v pediatrickej populácii vo veku 13 rokov až menej ako 18 rokov (pozri
časť 4.2 pre informácie o použití v pediatrickej populácii).
5.2 Farmakokinetické vlastnosti
Absorpcia
Brexpiprazol sa vstrebáva po podaní tablety a maximálne plazmatické koncentrácie sa dosiahnu do
4 hodín po podaní jednorazovej dávky; absolútna biologická dostupnosť tabletovej liekovej formy je
95,1 %. Rovnovážne koncentrácie brexpiprazolu sa dosiahnu v priebehu dávkovania do
10 dní až 12 dní. Podanie tablety so 4 mg brexpiprazolu s bežným jedlom s vysokým obsahom tuku
nemalo výrazný vplyv na Cmax ani AUC brexpiprazolu. Po jednorazovom a viacnásobnom podaní jednej dennej dávky sa expozícia brexpiprazolu (Cmax a AUC) zvýšila priamo úmerne k podanej dávke. Na základe štúdií in vivo brexpiprazol nie je substrátom aniinhibítorom efluxných transportérov, ako napríklad typov MDR 1 (multi drug resistence) (P-gp) a BCRP.
Distribúcia
Distribučný objem brexpiprazolu po intravenóznom podaní je vysoký (1,56 l/kg ± 0,418 l/kg), čo
naznačuje extravaskulárnu distribúciu. Brexpiprazol sa vo vysokej miere viaže na plazmatické proteíny (viac ako 99 %), na sérový albumín a α1-kyslý glykoproteín a väzba na proteíny nie je ovplyvnená poruchou funkcie obličiek alebo pečene. Na základe výsledkov štúdií in vitro viazanie brexpiprazolu na proteíny nie je ovplyvnené warfarínom, diazepamom ani digitoxínom.
Biotransformácia
Na základe štúdií metabolizmu in vitro použitím rekombinantného ľudského cytochrómu P450 sa
preukázalo, že metabolizmus brexpiprazolu prebieha cez CYP3A4 a CYP2D6 a vedie k tvorbe oxidačných metabolitov. Na základe údajov in vitro brexpiprazol preukázal malú až žiadnu inhibíciu iných izoenzýmov CYP450. Metabolizácia brexpiprazolu in vivo prebieha hlavne cez CYP3A4 a CYP2D6, čo vedie k tvorbe oxidačných metabolitov. Iba jeden z metabolitov, DM-3411, je prítomný v plazme s viac ako 10 % plazmatickou expozíciou.
DM-3411 predstavuje 23,1 % až 47,7 % plazmatickej expozície (AUC) brexpiprazolu v rovnovážnom stave. Je potrebné pripomenúť, že predklinické štúdie in vivo preukázali, že pri klinicky relevantných plazmatických koncentráciách brexpiprazolu bola koncentrácia DM-3411 v mozgu pod limitom detekcie. Nepredpokladá sa teda, že DM-3411 prispieva k liečebným účinkom brexpiprazolu.
Eliminácia
Po jednorazovej perorálnej dávke brexpiprazolu značeného izotopom [14C] bolo približne 24,6 %
podanej rádioaktívne značenej látky zistenej v moči a približne 46 % v stolici. Menej ako 1 %
nezmeneného brexpiprazolu sa vylúčilo močom a približne 14 % perorálnej dávky sa vylúčilo v nezmenenej forme stolicou. Zdanlivý perorálny klírens tablety s obsahom brexpiprazolu po podaní raz denne je 19,8 (± 11,4) ml/h/kg. Po viacnásobnom podaní brexpiprazolu raz denne je terminálny eliminačný polčas brexpiprazolu 91,4 hodín a jeho hlavného metabolitu, DM-3411, 85,7 hodín.
Linearita/nelinearita
Farmakokinetika brexpiprazolu je priamo úmerná dávke a nemení sa podľa času po jednorazovom
(0,2 mg až 8 mg) ani viacdennom (0,5 mg až 4 mg) podávaní raz denne.
Farmakokinetika u osobitnýchpopuláciípacientov
Vek
Po jednorazovom podaní brexpiprazolu (2 mg) sa u starších osôb (starších ako 65 rokov) preukázala podobná systémová expozícia brexpiprazolu (Cmax a AUC) ako u dospelých osôb (vo veku
18 rokov až 45 rokov, pozri časti 4.2 a 4.4).
Pohlavie
V populačnej farmakokinetickej (FK) analýze boli zaznamenané klinicky relevantné rozdiely vo FK
parametroch vo vzťahu k pohlaviu. Expozícia (AUC) brexpiprazolu u žien sa odhadovala o 25 %
vyššia ako u mužov (pozri časť 4.8).
Rasa
Aj keď neboli vykonané žiadne špecifické farmakokinetické štúdie, v populačnej FK analýze neboli
zaznamenané žiadne klinicky relevantné rozdiely vo farmakokinetických vlastnostiach brexpiprazolu
vo vzťahu k rase.
Genotyp CYP2D6
Farmakokinetická analýza populácie preukázala, že pomalí metabolizátori CYP2D6 majú o 47 %
vyššiu expozíciu brexpiprazolu ako extenzívnii metabolizátori (pozri časť 4.2).
Fajčenie
Na základe štúdií in vitro s ľudskými pečeňovými enzýmami brexpiprazol nie je substrátom CYP1A2;
fajčenie preto nemá vplyv na farmakokinetiku brexpiprazolu.
Porucha funkcie obličiek
U osôb (n = 10) so závažnou poruchou funkcie obličiek (CLcr < 30 ml/min) došlo k zvýšeniu AUC
perorálneho brexpiprazolu (3 mg jednorazová dávka) v porovnaní s kontrolnou skupinou zdravých osôb o 68 %, pričom Cmax bola nezmenená. U pacientov so stredne závažnou až závažnou poruchou funkcie obličiek (klírens kreatinínu CLcr < 60 ml/minúta) sa má maximálna odporúčaná dávka znížiť na 3 mg raz denne (pozri časť 4.2).
Porucha funkcie pečene
U osôb (n = 22) s rôznymi stupňami poruchy funkcie pečene (Childova-Pughova trieda A, B a C) sa AUC perorálneho brexpiprazolu (2 mg jednorazová dávka) v porovnaní s kontrolnou skupinou zdravých osôb zvýšila o 24 % pri miernej poruche funkcie pečene, o 60 % pri stredne závažnej poruche funkcie pečene a zostal nezmenený pri závažnej poruche funkcie pečene. Pacientom so stredne závažnou až závažnou poruchou funkcie pečene (Childova-Pughova trieda B a C) sa má maximálna odporúčaná dávka znížiť na 3 mg raz denne (pozri časť 4.2).
Pediatrická populácia
Bezpečnosť a účinnosť brexpiprazolu u detí a dospievajúcich vo veku menej ako 18 rokov nebola
stanovená (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Účinky pozorované v toxikologických štúdiách po opakovanom podávaní u potkanov a opíc boli spojené najmä s vystupňovaním farmakologického účinku brexpiprazolu. Pre samice ani samce potkanov a opice nebolo možné na základe hodnôt AUC0-24 h pri
maximálnej odporúčanej ľudskej dávke (MRHD) 4 mg/deň odvodiť žiadnu bezpečnostnú toleranciu.
Kardiovaskulárna toxicita
Po perorálnom podaní brexpiprazolu v štúdiách farmakologickej bezpečnosti u samcov psov pri
vedomí, v štúdiách toxicity po opakovanom podávaní u samcov a samíc opíc a v štúdiách toxicity u šteniat oboch pohlaví došlo k poklesu krvného tlaku a predĺženiu intervalu QT. Účinok
brexpiprazolu na pokles krvného tlaku sa pripisuje predpokladanej blokáde α1-adrenoceptorov v periférnych krvných cievach.
Genotoxicita, karcinogenicita
Na základe štúdií in vitro a in vivo pri klinicky relevantných expozíciách brexpiprazol nevykazoval
genotoxický potenciál. Brexpiprazol podaný perorálne nezvýšil výskyt nádorov v 2-ročnej štúdii
karcinogenicity u samcov ani samíc potkanov a u samcov myší pri expozíciách až do 4,4-násobku a
3,1-násobku MRHD. U samíc myší bol pozorovaný zvýšený výskyt adenokarcinómu mliečnych žliaz, adenoskvamózneho karcinómu a pars distalis adenómu hypofýzy pri podobnej alebo dokonca nižšej klinicky relevantnej expozícii. Tieto endokrinné nádory spôsobené prolaktínom boli pozorované aj u hlodavcov pri iných antipsychotikách a ich klinický význam nie je známy.
Reprodukčná toxicita
Brexpiprazol podávaný perorálne nemal vplyv na plodnosť samcov potkanov, predĺžil však štádium
diestru a znížil plodnosť u samíc potkanov pri podobnej alebo dokonca nižšej hladine expozície ako tie, ktoré boli dosiahnuté pri MRHD. Pri klinickej expozícii 4,1× vyššej ako MRHD bol pozorovaný významný nárast preimplantačných strát plodu. V štúdiách embryofetálnej/vývinovej toxicity nemal brexpiprazol teratogénne účinky pri perorálnom podávaní potkanom až do hodnôt expozície (na základe údajov od nebrezivých samíc) klinicky dosahovaných pri MRHD. U králikov boli zistené malformácie stavcov, a to u troch plodov z dvoch vrhov po perorálním podávaní brexpiprazolu v dávkach spôsobujúcich toxicitu u matky (približne 16,5- násobok klinickej expozície pri MRHD).
Pri perorálnych dávkach brexpiprazolu toxických pre matku sa v štúdiách prenatálnej a postnatálnej vývinovej toxicity u potkanov prejavil oneskorený rast a telesný vývin a znížená životaschopnosť potomstva.
Po perorálnom podaní brezivým potkanov bol preukázaný prenos brexpiprazolu na plod a do mlieka pri koncentráciách, ktoré boli vo všeobecnosti porovnateľné s hladinami pozorovanými v krvi matky.
Hodnotenieenvironmentálnehorizika(Environmentalriskassessment-ERA)
Brexpiprazol je vysoko perzistentný a bioakumulatívny, nie je však toxický pre životné prostredie: problémom môže byť postupný nárast koncentrácie brexpiprazolu v potravinových reťazcoch suchozemskej fauny (pozri časť 6.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
Monohydrát laktózy
Kukuričný škrob
Mikrokryštalická celulóza Hydroxypropylcelulóza, čiastočne substituovaná Hydroxypropylcelulóza
Stearan horečnatý
Čistená voda
Obal tablety
Hypromelóza
Mastenec
Oxid titaničitý
RXULTI0,25mgfilmomobalenétablety
Oxid železitý E 172 (žltý, červený, čierny)
RXULTI0,5mgfilmomobalenétablety
Oxid železitý E 172 (žltý, červený)
RXULTI1mgfilmomobalenétablety
Oxid železitý E 172 (žltý)
RXULTI2mgfilmomobalenétablety
Oxid železitý E 172 (žltý, čierny)
RXULTI3mgfilmomobalenétablety
Oxid železitý E 172 (červený, čierny)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne špeciálne podmienky pre uchovávanie.
6.5 Druh obalu a obsah balenia
RXULTI0,25mg,0,5mg,2mg,3mga4mgfilmomobalenétablety
28 filmom obalených tabliet v hliníkových/PVC blistroch.
RXU
LTI
1
mg
filmom
obalené
tablety
10 alebo 28 filmom obalených tabliet v hliníkových/PVC blistroch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomTento liek môže predstavovať riziko pre životné prostredie (pozri časť 5.3).
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOtsuka Pharmaceutical Netherlands B.V. Herikerbergweg 292
1101 CT, Amsterdam
Holandsko
8. REGISTRAČNÉ ČÍSLORXULTI0,25mgfilmomobalenétabletyEU/1/18/1294/001 (28 filmom obalené tablety)
RXULTI0,5mgfilmomobalenétabletyEU/1/18/1294/002 (28 filmom obalené tablety)
RXULTI1mgfilmomobalenétablety EU/1/18/1294/003 (10 filmom obalené tablety) EU/1/18/1294/004 (28 filmom obalené tablety)
RXULTI2mgfilmomobalenétabletyEU/1/18/1294/005 (28 filmom obalené tablety)
RXULTI3mgfilmomobalenétabletyEU/1/18/1294/006 (28 filmom obalené tablety)
RXULTI4mgfilmomobalenétabletyEU/1/18/1294/007 (28 filmom obalené tablety)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26. júla 2018
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.