
0;98,1]
69,6*
[<0,0;95,3]
70,5
[50,7;82,8]
96,5
[86,2;99,6]
89,9
[9,4;99,8]
83,1*
[<0,0;99,7]
87,3*
[<0,0;99,7]
76,8
[50,8;89,7]
Kmene s P[8] genotypom Cirkulujúce rotavírusové kmene
88,2
[80,8;93,0]
87,1
[79,6;92,1]
96,5
[90,6;99,1]
95,8
[89,6;98,7]
75,7
[65,0;83,4]
71,9
[61,2;79,8]
87,5
[77,8;93,4]
85,6
[75,8;91,9]
Ú
činnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej lekárske ošetrenie
[
95% CI]
Cirkulujúce rotavírusové kmene
91,8
[84;96,3]
76,2
[63,0;85,0]
Ú
činnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej hospitalizáciu
[
95% CI]
Cirkulujúce rotavírusové kmene
100
[81,8;100]
92,2
[65,6;99,1]
† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne
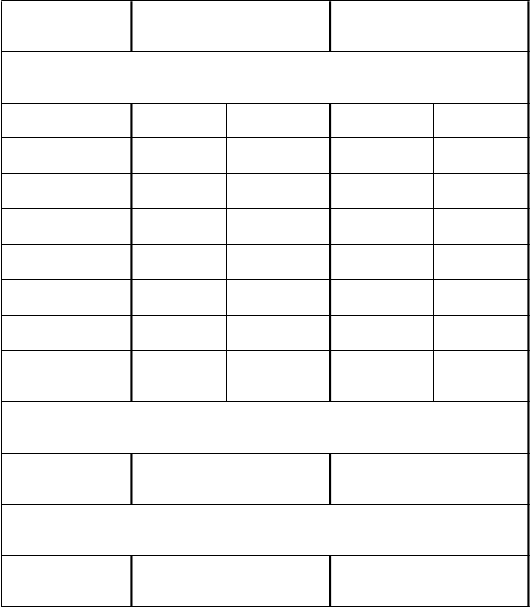
Účinnosť očkovacej látky sa počas prvého roka života progresívne zvyšovala so zvyšujúcou sa závažnosťou ochorenia a dosiahla 100% (95% CI: 84,7;100) pre Vesikariho skóre ≥17.
Účinnosť ochrany v Latinskej AmerikeKlinická štúdia vykonaná v Latinskej Amerike hodnotila Rotarix u viac ako 20 000 jedincov.
Závažnosť gastroenteritídy (GE) bola definovaná podľa kritérií SZO. Účinnosť ochrany očkovacej
látky pred ťažkou rotavírusovou (RV) gastroenteritídou vyžadujúcou hospitalizáciu a/alebo rehydratačnú liečbu v zdravotníckom zariadení a genotypovo špecifická účinnosť očkovacej látky po dvoch dávkach Rotarixu je uvedená nižšie v tabuľke.
G
enotyp Ťažká rotavírusová
gastroenteritída† (1. rok života) Rotarix N=9 009
Placebo N=8 858
Účinnosť (%)
[95% CI]
Všetky RVGE 84,7
[71,7;92,4]
G1P[8] 91,8
[74,1;98,4]
G3P[8] 87,7
[8,3;99,7]
G4P[8] 50,8#*
[<0,0;99,2]
G9P[8] 90,6
[61,7;98,9]
Kmene s genotypom P[8] 90,9
[79,2;96,8]
Ťažká rotavírusová gastroenteritída† (2. rok života) Rotarix N=7 175
Placebo N=7 062
Účinnosť (%)
[95% CI]
79,0
[66,4;87,4]
72,4
[34,5;89,9]
71,9*
[<0,0;97,1]
63,1
[0,7;88,2]
87,7
[72,9;95,3]
79,5
[67,0;87,9]
†Ťažká rotavírusová gastroenteritída bola definovaná ako epizóda hnačky s vracaním alebo bez neho, ktorá vyžadovala hospitalizáciu a/alebo rehydratačnú liečbu v zdravotníckom zariadení (podľa kritéria SZO).
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
# Počet prípadov, na ktorých sa zakladali odhady účinnosti voči G4P[8], bol veľmi malý (1 prípad
v skupine s Rotarixom a 2 prípady v skupine s placebom)
V súhrnnej analýze piatich štúdií účinnosti* sa počas prvého roka života dokázala 71,4% (95% CI:
20,1;91,1) účinnosť voči ťažkej rotavírusovej gastroenteritíde (Vesikariho skóre ≥11) spôsobenej
rotavírusom genotypu G2P[4].
*V týchto štúdiách boli bodové odhady a intervaly spoľahlivosti nasledujúce: 100% (95% CI:
-1 858,0;100), 100% (95% CI: 21,1;100), 45,4% (95% CI: -81,5;86,6), 74,7% (95% CI: -386,2;99,6). Pre zvyšnú štúdiu nebol k dispozícii žiadny bodový odhad.
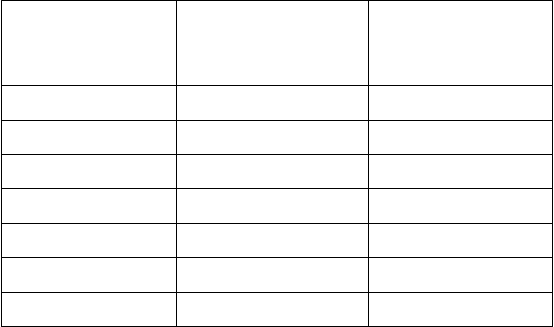
Účinnosť ochrany v AfrikeKlinická štúdia vykonaná v Afrike (Rotarix: N = 2 974; placebo: N = 1 443) hodnotila Rotarix
podávaný približne vo veku 10 a 14 týždňov (2 dávky) alebo vo veku 6, 10 a 14 týždňov (3 dávky).
Účinnosť očkovacej látky voči ťažkej rotavírusovej gastroenteritíde počas prvého roka života bola
61,2 % (95 % CI: 44,0;73,2). Zistená účinnosť ochrany očkovacej látky (kombinované dávky) pred akoukoľvek a ťažkou rotavírusovou gastroenteritídou je uvedená v nasledujúcej tabuľke:
G
enotyp Akákoľvek rotavírusová gastroenteritída Rotarix N=2 974
Placebo N=1 443
Účinnosť (%)
[95 % CI]
G1P[8] 68,3
[53,6;78,5]
G2P[4] 49,3
[4,6;73,0]
G3P[8] 43,4*
[<0,0;83,7]
G8P[4] 38,7*
[<0,0;67,8]
G9P[8] 41,8*
[<0,0;72,3]
G12P[6] 48,0
[9,7;70,0]
Ťažká rotavírusová gastroenteritída Rotarix N=2 974
Placebo N=1 443
Účinnosť (%)
[95 % CI]
56,6
[11,8;78,8]
83,8
[9,6;98,4]
51,5*
[<0,0;96,5]
63,6
[5,9;86,5]
56,9*
[<0,0;85,5]
55,5*
[<0,0;82,2]
Kmene
s genotypom P[4]
Kmene
s genotypom P[6] Kmene
s genotypom P[8]
39,3
[7,7;59,9]
46,6
[9,4;68,4]
61,0
[47,3;71,2]
70,9
[37,5;87,0]
55,2*
[<0,0;81,3]
59,1
[32,8;75,3]
† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
Pretrvávajúca účinnosťdo3rokov veku v ÁziiKlinická štúdia vykonaná v Ázii (Hong Kong, Singapur a Taiwan) (Celková očkovaná skupina:
Rotarix: N = 5 359; placebo: N = 5 349) hodnotila Rotarix podávaný podľa rôznych očkovacích schém
(2, 4 mesiace veku; 3, 4 mesiace veku).
Počas prvého roka bola ťažká rotavírusová gastroenteritída spôsobená cirkulujúcimi divokými rotavírusovými (RV) kmeňmi hlásená u významne nižšieho počtu jedincov v skupine s Rotarixom
v porovnaní s jedincami v skupine s placebom, a to v období od 2 týždňov po podaní 2. dávky až do
jedného roka veku (0,0 % oproti 0,3 %), pričom účinnosť očkovacej látky bola 100 % (95 % CI: 72,2;
100).
Účinnosť ochrany očkovacej látky pred ťažkou rotavírusovou gastroenteritídou po dvoch dávkach
Rotarixu pozorovaná do 2 rokov veku je uvedená v nasledujúcej tabuľke:
Ú
činnosť do 2 rokov veku
Rotarix N = 5 263
Placebo N = 5 256
Účinnosť očkovacej látky (%) voči ťažkej rotavírusovej gastroenteritíde [95 % CI] Genotyp Ťažká†
G1P[8] 100 [80,8;100]
G2P[4] 100* [< 0;100] G3P[8] 94,5 [64,9;99,9] G9P[8] 91,7 [43,8;99,8] Kmene s genotypom P[8] 95,8 [83,8;99,5]
Cirkulujúce rotavírusové kmene
96,1 [85;1;99,5]
Účinnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej
hospitalizáciu a/alebo rehydratačnú terapiu v zdravotníckom zariadení [95 % CI]
Cirkulujúce rotavírusové kmene
94,2 [82,2;98,8]

† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne
Počas tretieho roka života sa v skupine s Rotarixom (N = 4 222) nevyskytli žiadne prípady ťažkej RV gastroenteritídy oproti 13 prípadom (0,3 %) v skupine s placebom (N = 4 185). Účinnosť očkovacej látky bola 100 % (95 % CI: 67,5; 100). Prípady ťažkej RV gastroenteritídy boli spôsobené RV kmeňmi G1P[8], G2P[4], G3P[8] a G9P[8]. Výskyt ťažkej RV gastroenteritídy súvisiacej
s jednotlivými genotypmi bol príliš nízky, aby bolo možné vypočítať účinnosť. Účinnosť voči ťažkej
RV gastroenteritíde vyžadujúcej hospitalizáciu bola 100 % (95 % CI: 72,4; 100).
Imunitná odpoveďImunologický mechanizmus, ktorým Rotarix chráni pred rotavírusovou gastroenteritídou nie je úplne
objasnený. Vzťah medzi protilátkovými odpoveďami a očkovaním proti rotavírusom a ochranou pred rotavírusovou gastroenteritídou nebol stanovený.
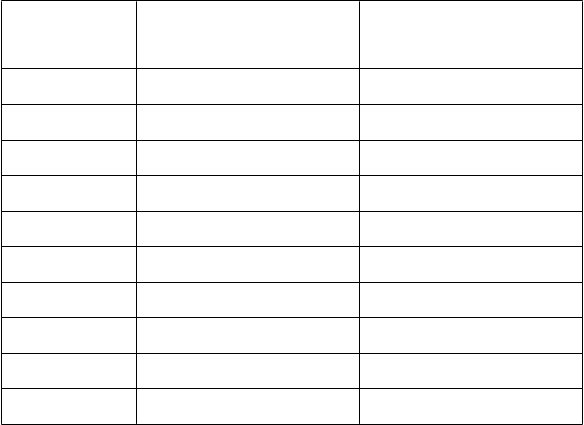
Nasledujúca tabuľka ukazuje percento jedincov, ktorí boli pôvodne séronegatívni na rotavírusy (titre
IgA protilátok < 20 U/ml) (pomocou ELISA), s titrami sérových IgA protilátok proti rotavírusom
≥ 20 U/ml po jednom až dvoch mesiacoch po druhej dávke očkovacej látky alebo placeba pozorované
v rôznych štúdiách.
O
čkovacia
schéma
Štúdia vykonaná
O
čkovacia látka Placebo
2, 3 mesiace vo Francúzsku, Nemecku
N % ≥ 20 U/ml
[95% CI]
239 82,8
[77,5;87,4]
N % ≥ 20 U/ml
[95% CI]
127 8,7
[4,4;15,0]
2, 4 mesiace v Španielsku 186 85,5
[79,6;90,2]
89 12,4
[6,3;21,0]
3, 5 mesiacov vo Fínsku, Taliansku
3, 4 mesiace v Českej
republike
180 94,4
[90,0;97,3]
182 84,6
[78,5;89,5]
114 3,5
[1,0;8,7]
90 2,2
[0,3;7,8]
2, 3 až 4
m
esiace
10, 14
t
ýždňov
a 6, 10, 14
t
ýždňov (Súhrnné údaje)
v Latinskej Amerike; v 11 krajinách Južná Afrika, Malawi
393 77,9%
[73,8;81,6]
221 58,4
[51,6;64,9]
341 15,1%
[11,7;19,0]
22,5
[15,1;31,4]
I
m
unitná
odpoveď
u
nedonosených
dojčiat
V klinickej štúdii vykonanej s nedonosenými dojčatami, ktoré sa narodili aspoň po 27. týždni
gestačného veku, sa imunogenita Rotarixu hodnotila v podskupine 147 jedincov a preukázalo sa, že Rotarix je v tejto populácii imunogénny; jeden mesiac po druhej dávke očkovacej látky sa titre sérových IgA protilátok proti rotavírusom ≥ 20 U/ml (pomocou ELISA) dosiahli u 85,7 % (95 % CI:
79,0; 90,9) jedincov.
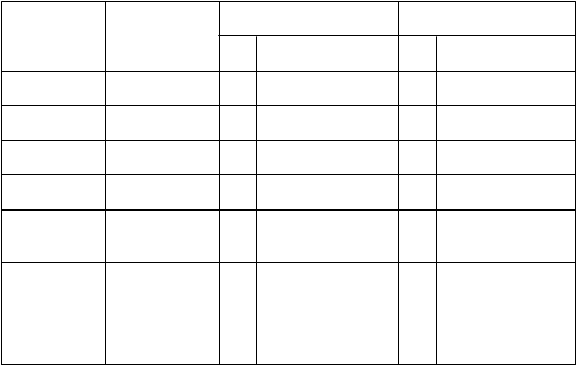
Účinnosť
V observačných štúdiách bola preukázanú účinnosť očkovacej látky voči ťažkej gastroenteritíde
vedúcej k hospitalizácii, ktorá bola spôsobená častými genotypmi rotavírusov G1P[8], G2P[4],
G3P[8], G4P[8] a G9P[8], ako aj menej častými genotypmi rotavírusov G9P[4] a G9P[6]. Všetky tieto kmene cirkulujú po celom svete.
Ú
činnosť po 2dávkach v prevencii RVGE vedúcej k hospitalizácii
K
rajiny
O
bdobie
V
ekové rozmedzie
N
(
1)
(
prípady/kontroly)
K
m
ene Účinnosť
% [95 % CI]
Belgicko
< 4 r.
Krajiny s vysokými príjmami
160/198 Všetky 90 [81;95]
2008-2010(2)
3 - 11 mes.
91 [75;97]
< 4 r. 41/53 G1P[8] 95 [78;99]
< 4 r.
3 - 11 mes.
80/103 G2P[4] 85 [64;94]
83 [11;96](3)
Singapur
2008-2010(2)
< 4 r. 12/13 G3P[8] 87* [< 0;98](3)
< 4 r. 16/17 G4P[8] 90 [19;99](3)
< 5 r. 136/272 Všetky 84 [32;96]
89/89 G1P[8] 91 [30;99]
Taiwan
2009-2011
USA
2010-2011
< 3 r. 275/1 623(4) Všetky
G1P[8]
< 2 r. 85/1 062(5) Všetky
G1P[8] G2P[4]
92 [75;98]
95 [69;100]
85 [73;92]
88 [68;95]
88 [68;95]
USA
2009-2011
8 - 11 mes. Všetky 89 [48;98]
< 5 r. 74/255(4) G3P[8] 68 [34;85]
Krajiny so strednými príjmami
Bolívia
2010-2011
< 3 r.
6 - 11 mes.
< 3 r.
6 - 11 mes.
300/974 Všetky 77 [65;84](6)
77 [51;89] G9P[8] 85 [69;93]
90 [65;97]
Brazília
2008-2011
< 3 r. G3P[8] 93 [70;98] G2P[4] 69 [14;89] G9P[6] 87 [19;98]
< 2 r. 115/1 481 Všetky 72 [44;85](6)
G1P[8] 89 [78;95] G2P[4] 76 [64;84]
Brazília
2008-2009(2)
El Salvador
2007-2009(2)
< 3 r.
3 - 11 mes.
< 3 r.
3 - 11 mes.
< 2 r.
6 - 11 mes.
249/249(5) Všetky 76 [58;86]
96 [68;99]
222/222(5) G2P[4] 75 [57;86]
95 [66;99](3)
251/770(5) Všetky 76 [64;84](6)
83 [68;91]
Guatemala
2012-2013
Mexiko
2010
Malawi
2012-2014
mes.: mesiace r.: roky
< 4 r. NA(7) Všetky 63 [23;82]
< 2 r. 9/17(5) G9P[4] 94 [16;100]
Krajina s nízkymi príjmami
< 2 r. 81/234(5) Všetky 63 [23;83]

* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
(1) Uvedený je počet kompletne očkovaných (2 dávkami) a neočkovaných prípadov a kontrol.
(2) Štúdie, ktorých zadávateľom bola spoločnosť GSK.
(3) Údaje z
post-hoc analýzy.
(4) Účinnosť očkovacej látky bola vypočítaná pomocou kontrolných osôb z nemocníc negatívnych na rotavírusy
(odhady z Taiwanu boli vypočítané pomocou skombinovania kontrolných osôb z nemocníc negatívnych na rotavírusy a kontrolných osôb z nemocníc, u ktorých nebola prítomná hnačka).
(5) Účinnosť očkovacej látky bola vypočítaná pomocou kontrolných osôb zo susedstva.
(6) U osôb, ktoré neabsolvovali kompletnú očkovaciu schému, sa účinnosť po jednej dávke pohybovala v rozmedzí od 51 % (95 % CI: 26;67, El Salvador) do 60 % (95 CI: 37;75, Brazília).
(7) NA: nie je k dispozícii. Odhad účinnosti očkovacej látky je založený na 41 kompletne očkovaných prípadoch
a 175 kompletne očkovaných kontrolách.
Vplyvnaúmrtnosť§
Štúdie overujúce vplyv očkovania Rotarixom vykonané v Paname, Brazílii a Mexiku ukázali pokles celkovej úmrtnosti v dôsledku hnačky v rozmedzí od 17 % do 73 % u detí mladších ako 5 rokov,
v priebehu 2 až 4 rokov po zavedení očkovania.
Vplyv na hospitalizáciu§
V retrospektívnej štúdii využívajúcej údaje z databáz vykonanej v Belgicku u detí vo veku 5 rokov
a mladších sa priamy a nepriamy vplyv očkovania Rotarixom na hospitalizáciu súvisiacu s rotavírusmi pohyboval v rozmedzí od 64 % (95% CI: 49;76) do 80 % (95% CI: 77;83) po dvoch rokoch od
zavedenia očkovania. Podobné štúdie v Arménsku, Austrálii, Brazílii, Kanade, El Salvadore a Zambii
ukázali zníženie potreby hospitalizácie o 45 % až 93 % po 2 až 4 rokoch od zavedenia očkovania.
Okrem toho deväť štúdií overujúcich vplyv očkovania na celkovú hospitalizáciu v dôsledku hnačky
vykonané v Afrike a Latinskej Amerike ukázali zníženie potreby hospitalizácie o 14 % až 57 %
po 2 až 5 rokoch od zavedenia očkovania.
§POZNÁMKA: Štúdie overujúce vplyv očkovania sú zamerané na stanovenie časovej súvislosti, ale nie príčinnej súvislosti medzi ochorením a očkovaním. Prirodzené výkyvy vo výskyte ochorenia môžu tiež ovplyvniť pozorovaný časový efekt.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podaní neodhalili
žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok Sacharóza Dextrán Sorbitol Aminokyseliny
Dulbeccova modifikácia Eaglovho média (DMEM)
Disperzné prostredie Uhličitan vápenatý Xantánová guma Sterilná voda
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky.
Po rekonštitúcii:
Po rekonštitúcii sa má očkovacia látka podať okamžite. Ak sa nepoužije okamžite, má sa uchovávať
najviac 24 hodín a pri teplote medzi 2 °C - 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
1 dávka prášku v sklenenom obale (sklo typu I) so zátkou (butylkaučuk).
1 ml disperzného prostredia v perorálnom aplikátore (sklo typu I) s pryžovou zátkou a ochranným krytom hrotu (butylkaučuk).
Prenosový nástavec na rekonštitúciu (1/dávka)
v nasledujúcich veľkostiach balenia:
• veľkosť balenia 1 sklenený obal s práškom a 1 perorálny aplikátor s disperzným prostredím
• veľkosť balenia 5 sklenených obalov s práškom a 5 perorálnych aplikátorov s disperzným prostredím
• veľkosť balenia 10 sklenených obalov s práškom a 10 perorálnych aplikátorov s disperzným prostredím
• veľkosť balenia 25 sklenených obalov s práškom a 25 perorálnych aplikátorov s disperzným prostredím
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred rekonštitúciou:
Počas uchovávania perorálneho aplikátora obsahujúceho disperzné prostredie sa môže vytvoriť biely sediment a číry supernatant. Pred rekonštitúciou sa disperzné prostredie musí opticky skontrolovať
na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad.
Po rekonštitúcii:
Rekonštituovaná očkovacia látka je mierne viac zakalená ako disperzné prostredie a je mliečne bieleho
vzhľadu.
Pred podaním sa rekonštituovaná očkovacia látka má taktiež opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
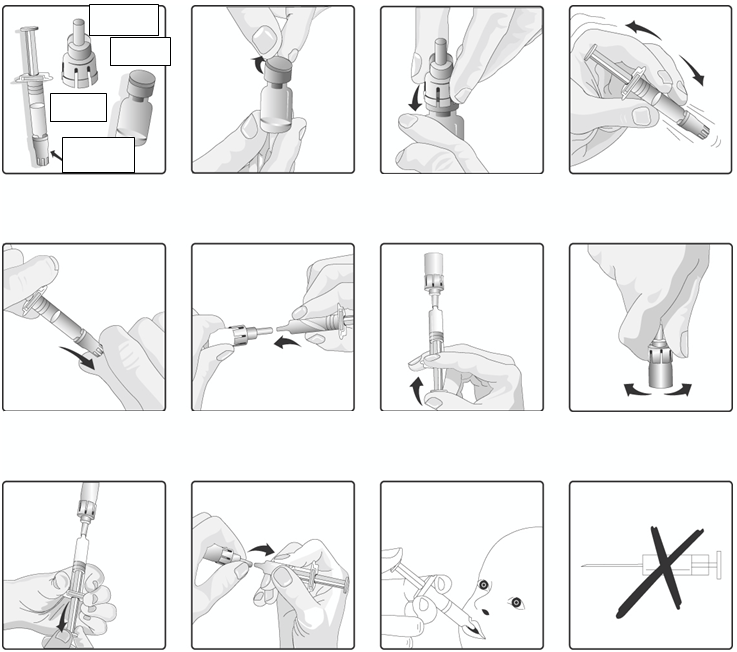
Pokynynarekonštitúciuapodanieočkovacejlátky:
Prenosový nástavec
Sklenený obal
Perorálny
aplikátor
Kryt hrotu
perorálneho
aplikátora
1. Odstráňte viečko z umelej hmoty zo
skleneného obalu obsahujúceho prášok.
2. Pripojte prenosový nástavec na sklenený obal tým, že ho budete tlačiť smerom nadol až dovtedy, kým nebude prenosový nástavec riadne a bezpečne umiestnený.
3. Silno pretrepte perorálny aplikátor obsahujúci disperzné prostredie. Pretrepaná suspenzia bude zakalená tekutina s pomaly sa usadzujúcou bielou usadeninou.
4. Odstráňte ochranný kryt z hrotu
perorálneho aplikátora.
5. Pripojte perorálny aplikátor na
prenosový nástavec tým, že ho na
nástavec silno pritlačíte.
6. Preneste celý obsah perorálneho
aplikátora do skleneného obalu obsahujúceho prášok.
7. Pretrepte sklenený obal s pripojeným
perorálnym aplikátorom a skontrolujte, či sa prášok úplne rozptýlil. Rekonštituovaná očkovacia látka bude viac zakalená ako
samotné disperzné prostredie. Tento
vzhľad je normálny.
8. Vytiahnite celý zmiešaný obsah
späť do perorálneho aplikátora.
9. Odpojte perorálny aplikátor od
prenosového nástavca.
10. Táto očkovacia látka je určená
len na perorálne podanie. Dieťa má
sedieť v zaklonenej polohe. Podajte celý obsah perorálneho aplikátora perorálne (tak, že celý obsah perorálneho aplikátora podáte na vnútornú stranu líca).
11. Nepodávajte injekčne.
Ak sa má rekonštituovaná očkovacia látka pred podaním prechodne uchovávať, vráťte ochranný kryt
na hrot
perorálneho aplikátora.
Perorálny aplikátor obsahujúci rekonštituovanú očkovaciu látku sa
musí pred
perorálnym podaním znovu mierne pretrepať.
Nepodávajte injekčne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
GlaxoSmithKline Biologicals s.a. Rue de l'Institut 89
B-1330 Rixensart, Belgicko
8. REGISTRAČNÉ ČÍSLOEU/1/05/330/001
EU/1/05/330/002
EU/1/05/330/003
EU/1/05/330/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. februára 2006
Dátum posledného predĺženia registrácie: 14. januára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Rotarix perorálna suspenzia v naplnenom perorálnom aplikátore
Rotarix perorálna suspenzia v stlačiteľnej tube
Rotarix perorálna suspenzia vo viacdávkovom obale s jednodávkovými stlačiteľnými tubami
(5 jednotlivých dávok) spojenými prúžkom
Rotavírusová očkovacia látka (živá)
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
1 dávka (1,5 ml) obsahuje:
Ľudský kmeň rotavírusu RIX4414 (živý, oslabený)*nie menej ako 106,0 CCID50
*Kultivovaný na bunkách Vero
Pomocná látka so známym účinkom:
Tento liek obsahuje sacharózu 1 073 mg (pozri časť 4.4).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA Perorálna suspenzia.
Rotarix je číra a bezfarebná tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Rotarix je indikovaný na aktívnu imunizáciu dojčiat vo veku od 6 do 24 týždňov na prevenciu gastroenteritídy spôsobenej rotavírusovou infekciou (pozri časti 4.2, 4.4 a 5.1).
Použitie Rotarixu sa má zakladať na oficiálnych odporúčaniach.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Vakcinačná schéma pozostáva z dvoch dávok. Prvá dávka sa môže podať vo veku od 6 týždňov.
Medzi dávkami má byť časový odstup najmenej 4 týždne. Vakcinačná schéma sa má prednostne podať pred dosiahnutím veku 16 týždňov, ale musí sa ukončiť do veku 24 týždňov.
Rotarix sa môže podať v rovnakej dávkovacej schéme nedonoseným dojčatám, ktoré sa narodili aspoň
po 27. týždni gestačného veku (pozri časti 4.8 a 5.1).
V klinických štúdiách bolo zriedkavo pozorované vypľutie alebo regurgitácia očkovacej látky a za takýchto okolností náhradná dávka nebola podaná. V nepravdepodobnom prípade, kedy dojča vypľuje alebo regurgituje väčšinu dávky očkovacej látky, sa môže podať jednorazová náhradná dávka na tej istej očkovacej návšteve.
Odporúča sa, aby dojčatá, ktoré dostanú prvú dávku Rotarixu, ukončili 2-dávkovú schému Rotarixom. Neexistujú žiadne údaje o bezpečnosti, imunogenite alebo účinnosti, keď sa Rotarix podá ako prvá dávka a iná rotavírusová očkovacia látka sa podá ako druhá dávka alebo naopak.
Pediatrická populácia
Rotarix sa nemá používať u detí starších ako 24 týždňov.
Spôsob podávania
Rotarix je určený len na perorálne použitie.
Rotarix sa nesmie za žiadnych okolností podať injekčne.
Pokyny na podanie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Precitlivenosť po predošlom podaní rotavírusových očkovacích látok.
Intususcepcia v anamnéze.
Jedinci s nekorigovanou vrodenou chybou gastrointestinálneho traktu, ktorá by bola predispozíciou k intususcepcii.
Jedinci s ťažkou kombinovanou imunodeficienciou (SCID) (pozri časť 4.8).
Podanie Rotarixu sa má odložiť u jedincov so závažným akútnym horúčkovitým ochorením. Prítomnosť slabej infekcie sa nepovažuje za kontraindikáciu imunizácie.
Podanie Rotarixu sa má odložiť u jedincov, ktorí trpia hnačkou alebo dávením.
4.4 Osobitné upozornenia a opatrenia pri používaní
V súlade s dobrou klinickou praxou sa má pred očkovaním urobiť podrobná zdravotná anamnéza,
najmä s ohľadom na kontraindikácie a klinické vyšetrenie očkovaného.
Neexistujú údaje o bezpečnosti a účinnosti Rotarixu u dojčiat s gastrointestinálnymi ochoreniami alebo spomalením rastu. Podanie Rotarixu sa má zvážiť s opatrnosťou u takýchto dojčiat vtedy, keď podľa názoru lekára neposkytnutie očkovacej látky znamená vyššie riziko.
Zdravotnícki pracovníci majú preventívne ďalej sledovať akékoľvek príznaky naznačujúce intususcepciu (závažnú bolesť brucha, pretrvávajúce vracanie, krv v stolici, nafúknuté brucho a/alebo vysokú horúčku), pretože údaje z observačných štúdií poukazujú na zvýšené riziko intususcepcie, väčšinou do 7 dní po očkovaní proti rotavírusom (pozri časť 4.8). Rodičia/opatrovatelia majú byť vyzvaní, aby okamžite hlásili takéto príznaky lekárovi.
Jedinci s predispozíciou na intususcepciu, pozri časť 4.3.
Neočakáva sa, že asymptomatická alebo mierne symptomatická infekcia HIV ovplyvní bezpečnosť alebo účinnosť Rotarixu. Klinická štúdia s obmedzeným počtom pozitívnych dojčiat
na asymptomatickú alebo mierne symptomatickú infekciu HIV neodhalila žiadne zjavné problémy
týkajúce sa bezpečnosti (pozri časť 4.8).
Podanie Rotarixu dojčatám so známou alebo suspektnou imunodeficienciou sa má zakladať
na starostlivom zvážení možných prínosov a rizík.
Je známe, že po podaní očkovacej látky dochádza k vylučovaniu vírusu očkovacej látky stolicou, pričom maximálne množstvo sa vylúči okolo 7. dňa. Častice vírusového antigénu detegované pomocou ELISA boli po prvej dávke lyofilizovanej formy Rotarixu zistené v 50% stolice a po druhej dávke v 4% stolice. Po testovaní stolice na prítomnosť kmeňa živého vírusu očkovacej látky bolo pozitívnych len 17%. V dvoch porovnávacích kontrolovaných štúdiách bolo vylučovanie vírusu očkovacej látky po očkovaní tekutou formou Rotarixu porovnateľné s vylučovaním vírusu očkovacej látky pozorovaným po očkovaní lyofilizovanou formou Rotarixu.
Pozorovali sa prípady prenosu takto vylúčeného vírusu očkovacej látky na séronegatívnych jedincov,
ktorí boli v kontakte s očkovanými, bez toho, že by spôsobil nejaký klinický príznak.
Rotarix sa musí podávať opatrne jedincom, ktorí sú v blízkom kontakte s imunodeficientnými jedincami, ako sú jedinci s malignitami, s inak oslabeným imunitným systémom alebo jedinci podrobujúci sa imunosupresívnej liečbe.
Jedinci, ktorí sú v kontakte s nedávno očkovanými, musia dodržiavať osobnú hygienu (napr. musia si
umyť ruky po vymenení plienky dieťaťa).
Pri podávaní základných imunizačných dávok veľmi predčasne narodeným deťom (narodené v ≤ 28. týždni gravidity) a obzvlášť deťom, ktoré majú v predchádzajúcej anamnéze nezrelosť dýchacej sústavy, sa má zvážiť potenciálne riziko apnoe a potreba monitorovania dýchacích funkcií počas
48-72 h.
Vzhľadom k tomu, že prínos očkovania je v tejto skupine detí vysoký, očkovanie sa nemá odoprieť alebo odložiť.
Ochranná imunitná odpoveď sa nemusí dosiahnuť u všetkých očkovaných (pozri časť 5.1).
Miera ochrany pred inými rotavírusovými kmeňmi, ktoré necirkulovali v klinických štúdiách, ktorú by Rotarix mohol poskytnúť, nie je v súčasnosti známa. Klinické štúdie, z ktorých sa získali údaje o účinnosti, boli vykonané v Európe, Strednej a Južnej Amerike, Afrike a Ázii (pozri časť 5.1).
Rotarix nechráni pred gastroenteritídou spôsobenou inými patogénmi ako je rotavírus. Nie sú k dispozícii údaje o použití Rotarixu na profylaxiu po expozícii.
Rotarix sa nesmie za žiadnych okolností podať injekčne.
Očkovacia látka obsahuje sacharózu ako pomocnú látku. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovej malabsorpcie alebo deficitu sacharázy a izomaltázy nesmú užiť túto očkovaciu látku.
4.5 Liekové a iné interakcie
Rotarix sa môže podať súbežne s niektorou z nasledujúcich monovalentných alebo kombinovaných očkovacích látok [vrátane hexavalentných očkovacích látok (DTPa-HBV-IPV/Hib)]: očkovacia látka proti diftérii-tetanu-pertussis (celobunková) (DTPw), očkovacia látka proti diftérii-tetanu-pertussis (acelulárna zložka) (DTPa), očkovacia látka proti Haemophilus influenzae typ b (Hib), inaktivovaná očkovacia látka proti poliomyelitíde (IPV), očkovacia látka proti hepatitíde B (HBV),
pneumokoková konjugovaná očkovacia látka a konjugovaná očkovacia látka proti meningokokom
séroskupiny C. Klinické štúdie preukázali, že to nemalo vplyv na imunitnú odpoveď na podané očkovacie látky a ich profil bezpečnosti.
Súbežné podanie Rotarixu a perorálnej očkovacej látky proti poliomyelitíde (OPV) nemá vplyv na imunitnú odpoveď na antigény poliomyelitídy. Aj keď súbežné podanie OPV môže mierne znížiť imunitnú odpoveď na rotavírusovú očkovaciu látku, klinická ochrana pred ťažkou rotavírusovou
infekciou je zachovaná, čo sa preukázalo v klinickej štúdii zahŕňajúcej viac ako 4 200 jedincov, ktorí dostali Rotarix súbežne s OPV.
Nie sú žiadne obmedzenia týkajúce sa jedla alebo tekutín, ktoré dojča konzumuje, pred očkovaním ani po ňom.
4.6 Fertilita, gravidita a laktácia
Rotarix nie je určený na použitie u dospelých. Neexistujú údaje o použití očkovacej látky Rotarix počas gravidity a laktácie.
Na základe dôkazov získaných v klinických štúdiách, dojčenie neznižuje Rotarixom poskytnutú ochranu pred rotavírusovou gastroenteritídou. Z tohto dôvodu sa počas vakcinačnej schémy môže pokračovať v dojčení.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Netýka sa.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Bezpečnostný profil zobrazený nižšie je na základe údajov z klinických skúšaní vykonaných buď
s lyofilizovanou alebo tekutou formou Rotarixu.
V celkovo štyroch klinických skúšaniach bolo podaných približne 3 800 dávok tekutej formy Rotarixu približne 1 900 dojčatám. Tieto skúšania preukázali, že bezpečnostný profil tekutej formy je porovnateľný s lyofilizovanou formou.
V celkovo dvadsiatich troch klinických skúšaniach bolo podaných približne 106 000 dávok Rotarixu
(lyofilizovaná alebo tekutá forma) približne 51 000 dojčatám.
V troch placebom-kontrolovaných klinických skúšaniach (Fínsko, India, Bangladéš), v ktorých bol Rotarix podaný samostatne (podanie bežných pediatrických očkovacích látok bolo časovo rozvrhnuté), sa výskyt a závažnosť sledovaných účinkov (zozbieraných 8 dní po očkovaní), hnačky, vracania, zníženej chuti do jedla, horúčky, podráždenosti a kašľa/nádchy významne nelíšili v skupine, ktorá dostala Rotarix, v porovnaní so skupinou, ktorá dostala placebo. Po druhej dávke nebolo pozorované žiadne zvýšenie výskytu alebo závažnosti týchto prípadov.
V spoločnej analýze zo sedemnástich placebom-kontrolovaných klinických skúšaní (Európa, Severná Amerika, Latinská Amerika, Ázia, Afrika) vrátane skúšaní, v ktorých sa Rotarix podával súbežne s bežnými pediatrickými očkovacími látkami (pozri časť 4.5) sa spojitosť medzi nasledujúcimi nežiaducimi reakciami (zozbieranými 31 dní po očkovaní) a očkovaním považuje za možnú.
Tabuľkový zoznam nežiaducich reakcií
Hlásené nežiaduce reakcie sú uvedené podľa nasledujúcej frekvencie:
Frekvencie sú hlásené ako:
Veľmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Menej časté (≥1 /1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (< 1/10 000)
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Celkové poruchy a reakcie v mieste podania
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Hnačka
Menej časté Bolesť brucha, plynatosť Veľmi zriedkavé Intususcepcia (pozri časť 4.4) Neznáme* Hematochézia
Neznáme* Gastroenteritída s vylučovaním vírusu očkovacej látky u dojčiat s ťažkou kombinovanou imunodeficienciou (SCID)
Menej časté Dermatitída
Časté Podráždenosť
Neznáme* Apnoe u veľmi predčasne
narodených detí (narodené
v ≤ 28. týždni gravidity) (pozri
časť 4.4)
* Pretože tieto prípady boli hlásené spontánne, nie je možné spoľahlivo stanoviť ich frekvenciu.
Popis vybraných nežiaducich reakciíIntususcepciaÚdaje z observačných štúdií bezpečnosti vykonaných v niekoľkých krajinách naznačujú, že
rotavírusové očkovacie látky nesú zvýšené riziko intususcepcie, väčšinou do 7 dní od očkovania. V týchto krajinách sa pozorovalo až 6 dodatočných prípadov na 100 000 dojčiat v porovnaní
s prirodzenou (referenčnou) incidenciou 25 až 101 na 100 000 dojčiat (vo veku mladších ako jeden
rok) ročne.
K dispozícii sú obmedzené dôkazy o menej zvýšenom riziku po podaní druhej dávky.
Zostáva nejasné, či rotavírusové očkovacie látky ovplyvňujú celkovú incidenciu intususcepcie
na základe dlhších období sledovania (pozri časť 4.4).
Ďalšie osobitné skupiny pacientovBezpečnosť unedonosenýchdojčiatV klinickej štúdii sa 670 nedonoseným dojčatám narodeným od 27. do 36. týždňa gestačného veku
podal Rotarix a 339 dostalo placebo. Prvá dávka sa podala 6 týždňov po narodení. Závažné nežiaduce udalosti sa pozorovali u 5,1 % dojčiat, ktoré dostali Rotarix v porovnaní so 6,8 % dojčiat, ktoré dostali placebo. U dojčiat, ktoré dostali Rotarix a u tých, ktoré dostali placebo, sa pozorovala rovnaká miera výskytu ďalších nežiaducich udalostí. Neboli hlásené žiadne prípady intususcepcie.
Bezpečnosť udojčiatsinfekciouvírusomľudskejimunitnejnedostatočnosti(HIV)V klinickej štúdii sa 100 dojčatám s infekciou HIV podal Rotarix alebo placebo. Bezpečnostný profil
bol podobný u dojčiat, ktoré dostali Rotarix a u tých, ktoré dostali placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby
hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Bolo hlásených niekoľko prípadov predávkovania. Profil nežiaducich udalostí hlásený v týchto prípadoch bol vo všeobecnosti podobný tým, ktoré sa pozorovali po podaní odporúčanej dávky Rotarixu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: rotavírusové očkovacie látky proti hnačke, ATC kód: J07BH01
Účinnosť ochrany lyofilizovanej formy
V klinických štúdiách bola preukázaná účinnosť voči gastroenteritíde spôsobenej rotavírusom
najčastejších genotypov G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8]. Okrem toho bola preukázaná
účinnosť voči menej častým genotypom rotavírusu G8P[4] (ťažká gastroenteritída) a G12P[6] (akákoľvek gastroenteritída). Tieto kmene cirkulujú po celom svete.
Klinické štúdie hodnotiace účinnosť ochrany Rotarixu pred akoukoľvek rotavírusovou gastroenteritídou a ťažkou rotavírusovou gastroenteritídou boli vykonané v Európe, Latinskej Amerike, Afrike a Ázii.
Závažnosť gastroenteritíd bola definovaná podľa dvoch rôznych kritérií:
- 20-bodovej Vesikariho škály, ktorá hodnotí úplný klinický obraz rotavírusovej gastroenteritídy tým, že zohľadňuje závažnosť a dĺžku trvania hnačky a vracania, závažnosť horúčky a dehydratácie ako aj potrebu liečby
alebo
- klinickej definície prípadu založenej na kritériách Svetovej zdrovatníckej organizácie (SZO)
Klinická ochrana bola hodnotená v skupine pre analýzu účinnosti podľa protokolu (ATP), ktorá zahŕňala všetkých jedincov z ATP skupiny pre analýzu bezpečnosti, u ktorých sa sledovala účinnosť počas stanovenej doby.
Účinnosť ochrany v Európe
Klinická štúdia vykonaná v Európe hodnotila Rotarix podávaný podľa rôznych Európskych
očkovacích schém (2, 3 mesiace; 2, 4 mesiace; 3, 4 mesiace; 3, 5 mesiacov) u 4 000 jedincov.
Účinnosť ochrany očkovacej látky po dvoch dávkach Rotarixu pozorovaná počas prvého a druhého roka života je uvedená v nasledujúcej tabuľke:
1. rok života
Rotarix N=2 572
Placebo N=1 302
2. rok života
Rotarix N=2 554
Placebo N=1 294
Ú
činnosť očkovacej látky (%) voči akejkoľvek a ťažkej rotavírusovej gastroenteritíde
[
95% CI]
G
enotyp Akákoľvek závažnosť
Ť
ažkᆠAkákoľvek závažnosť
Ťažká†
G1P[8] 95,6
[87,9;98,8]
G2P[4] 62,0*
[<0,0;94,4]
G3P[8] 89,9
[9,5;99,8]
G4P[8] 88,3
[57,5;97,9]
G9P[8] 75,6
[51,1;88,5]
96,4
[85,7;99,6]
74,7*
[<0,0;99,6]
100
[44,8;100]
100
[64,9;100]
94,7
[77,9;99,4]
82,7
[67,8;91,3]
57,1
[<0,0;82,6]
79,7
[<0,0;98,1]
69,6*
[<0,0;95,3]
70,5
[50,7;82,8]
96,5
[86,2;99,6]
89,9
[9,4;99,8]
83,1*
[<0,0;99,7]
87,3*
[<0,0;99,7]
76,8
[50,8;89,7]
Kmene s P[8] genotypom Cirkulujúce rotavírusové kmene
88,2
[80,8;93,0]
87,1
[79,6;92,1]
96,5
[90,6;99,1]
95,8
[89,6;98,7]
75,7
[65,0;83,4]
71,9
[61,2;79,8]
87,5
[77,8;93,4]
85,6
[75,8;91,9]
Ú
činnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej lekárske ošetrenie
[
95% CI]
Cirkulujúce rotavírusové kmene
91,8
[84;96,3]
76,2
[63,0;85,0]
Ú
činnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej hospitalizáciu
[
95% CI]
Cirkulujúce rotavírusové kmene
100
[81,8;100]
92,2
[65,6;99,1]
† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne
Účinnosť očkovacej látky sa počas prvého roka života progresívne zvyšovala so zvyšujúcou sa závažnosťou ochorenia a dosiahla 100% (95% CI: 84,7;100) pre Vesikariho skóre ≥17.
Účinnosť ochrany v Latinskej AmerikeKlinická štúdia vykonaná v Latinskej Amerike hodnotila Rotarix u viac ako 20 000 jedincov.
Závažnosť gastroenteritídy (GE) bola definovaná podľa kritérií SZO. Účinnosť ochrany očkovacej látky pred ťažkou rotavírusovou (RV) gastroenteritídou vyžadujúcou hospitalizáciu a/alebo
rehydratačnú liečbu v zdravotníckom zariadení a genotypovo špecifická účinnosť očkovacej látky po
dvoch dávkach Rotarixu je uvedená nižšie v tabuľke.
G
enotyp Ťažká rotavírusová
gastroenteritída† (1. rok života) Rotarix N=9 009
Placebo N=8 858
Účinnosť (%)
[95% CI]
Všetky RVGE 84,7
[71,7;92,4]
G1P[8] 91,8
[74,1;98,4]
G3P[8] 87,7
[8,3;99,7]
G4P[8] 50,8#*
[<0,0;99,2]
G9P[8] 90,6
[61,7;98,9]
Kmene s genotypom P[8] 90,9
[79,2;96,8]
Ťažká rotavírusová gastroenteritída† (2. rok života) Rotarix N=7 175
Placebo N=7 062
Účinnosť (%)
[95% CI]
79,0
[66,4;87,4]
72,4
[34,5;89,9]
71,9*
[<0,0;97,1]
63,1
[0,7;88,2]
87,7
[72,9;95,3]
79,5
[67,0;87,9]

†Ťažká rotavírusová gastroenteritída bola definovaná ako epizóda hnačky s vracaním alebo bez neho, ktorá vyžadovala hospitalizáciu a/alebo rehydratačnú liečbu v zdravotníckom zariadení (podľa kritéria SZO).
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
# Počet prípadov, na ktorých sa zakladali odhady účinnosti voči G4P[8], bol veľmi malý (1 prípad
v skupine s Rotarixom a 2 prípady v skupine s placebom)
V súhrnnej analýze piatich štúdií účinnosti* sa počas prvého roka života dokázala 71,4% (95% CI:
20,1;91,1) účinnosť voči ťažkej rotavírusovej gastroenteritíde (Vesikariho skóre ≥11) spôsobenej
rotavírusom genotypu G2P[4].
*V týchto štúdiách boli bodové odhady a intervaly spoľahlivosti nasledujúce: 100% (95% CI:
-1 858,0;100), 100% (95% CI: 21,1;100), 45,4% (95% CI: -81,5;86,6), 74,7% (95% CI: -386,2;99,6). Pre zvyšnú štúdiu nebol k dispozícii žiadny bodový odhad.
Účinnosť ochrany v AfrikeKlinická štúdia vykonaná v Afrike (Rotarix: N = 2 974; placebo: N = 1 443) hodnotila Rotarix
podávaný približne vo veku 10 a 14 týždňov (2 dávky) alebo vo veku 6, 10 a 14 týždňov (3 dávky).
Účinnosť očkovacej látky voči ťažkej rotavírusovej gastroenteritíde počas prvého roka života bola
61,2 % (95 % CI: 44,0;73,2). Zistená účinnosť ochrany očkovacej látky (kombinované dávky) pred akoukoľvek a ťažkou rotavírusovou gastroenteritídou je uvedená v nasledujúcej tabuľke:
G
enotyp Akákoľvek rotavírusová gastroenteritída Rotarix N=2 974
Placebo N=1 443
Účinnosť (%)
[95 % CI]
G1P[8] 68,3
[53,6;78,5]
G2P[4] 49,3
[4,6;73,0]
G3P[8] 43,4*
[<0,0;83,7]
G8P[4] 38,7*
[<0,0;67,8]
G9P[8] 41,8*
[<0,0;72,3]
G12P[6] 48,0
[9,7;70,0]
Ťažká rotavírusová gastroenteritída† Rotarix N=2 974
Placebo N=1 443
Účinnosť (%)
[95 % CI]
56,6
[11,8;78,8]
83,8
[9,6;98,4]
51,5*
[<0,0;96,5]
63,6
[5,9;86,5]
56,9*
[<0,0;85,5]
55,5*
[<0,0;82,2]
Kmene
s genotypom P[4]
Kmene
s genotypom P[6]
Kmene
s genotypom P[8]
39,3
[7,7;59,9]
46,6
[9,4;68,4]
61,0
[47,3;71,2]
70,9
[37,5;87,0]
55,2*
[<0,0;81,3]
59,1
[32,8;75,3]
† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
Pretrvávajúca účinnosťdo3rokov veku v ÁziiKlinická štúdia vykonaná v Ázii (Hong Kong, Singapur a Taiwan) (Celková očkovaná skupina:
Rotarix: N = 5 359; placebo: N = 5 349) hodnotila Rotarix podávaný podľa rôznych očkovacích schém
(2, 4 mesiace veku; 3, 4 mesiace veku).
Počas prvého roka bola ťažká rotavírusová gastroenteritída spôsobená cirkulujúcimi divokými rotavírusovými (RV) kmeňmi hlásená u významne nižšieho počtu jedincov v skupine s Rotarixom
v porovnaní s jedincami v skupine s placebom, a to v období od 2 týždňov po podaní 2. dávky až do
jedného roka veku (0,0 % oproti 0,3 %), pričom účinnosť očkovacej látky bola 100 % (95 % CI: 72,2;
100).
Účinnosť ochrany očkovacej látky pred ťažkou rotavírusovou gastroenteritídou po dvoch dávkach
Rotarixu pozorovaná do 2 rokov veku je uvedená v nasledujúcej tabuľke:
Ú
činnosť do 2 rokov veku
Rotarix N = 5 263
Placebo N = 5 256
Účinnosť očkovacej látky (%) voči ťažkej rotavírusovej gastroenteritíde [95 % CI] Genotyp Ťažká†
G1P[8] 100 [80,8;100]
G2P[4] 100* [< 0;100] G3P[8] 94,5 [64,9;99,9] G9P[8] 91,7 [43,8;99,8] Kmene s genotypom P[8] 95,8 [83,8;99,5]
Cirkulujúce rotavírusové kmene
96,1 [85;1;99,5]
Účinnosť očkovacej látky (%) voči rotavírusovej gastroenteritíde vyžadujúcej
hospitalizáciu a/alebo rehydratačnú terapiu v zdravotníckom zariadení [95 % CI]
Cirkulujúce rotavírusové kmene
94,2 [82,2;98,8]

† Ťažká gastroenteritída bola definovaná ako skóre ≥ 11 na Vesikariho škále
* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne
Počas tretieho roka života sa v skupine s Rotarixom (N = 4 222) nevyskytli žiadne prípady ťažkej RV gastroenteritídy oproti 13 prípadom (0,3 %) v skupine s placebom (N = 4 185). Účinnosť očkovacej látky bola 100 % (95 % CI: 67,5; 100,0). Prípady ťažkej RV gastroenteritídy boli spôsobené RV kmeňmi G1P[8], G2P[4], G3P[8] a G9P[8]. Výskyt ťažkej RV gastroenteritídy súvisiacej
s jednotlivými genotypmi bol príliš nízky, aby bolo možné vypočítať účinnosť. Účinnosť voči ťažkej
RV gastroenteritíde vyžadujúcej hospitalizáciu bola 100 % (95 % CI: 72,4; 100).
Účinnosť ochrany tekutej formyKeďže imunitná odpoveď pozorovaná po podaní 2 dávok tekutej formy Rotarixu bola porovnateľná
s imunitnou odpoveďou pozorovanou po podaní 2 dávok lyofilizovanej formy Rotarixu, hladiny účinnosti pozorované pri lyofilizovanej forme možno extrapolovať na tekutú formu.
Imunitná odpoveďImunologický mechanizmus, ktorým Rotarix chráni pred rotavírusovou gastroenteritídou nie je úplne
objasnený. Vzťah medzi protilátkovými odpoveďami a očkovaním proti rotavírusom a ochranou pred rotavírusovou gastroenteritídou nebol stanovený.
Nasledujúca tabuľka ukazuje percento jedincov, ktorí boli pôvodne séronegatívni na rotavírusy (titre
IgA protilátok < 20 U/ml) (pomocou ELISA), s titrami sérových IgA protilátok proti rotavírusom
≥ 20 U/ml po jednom až dvoch mesiacoch po druhej dávke očkovacej látky alebo placeba pozorované v rôznych štúdiách s lyofilizovanou formou Rotarixu.
O
čkovacia
schéma
Štúdia vykonaná
O
čkovacia látka Placebo
2, 3 mesiace vo Francúzsku, Nemecku
N % ≥ 20 U/ml
[95% CI]
239 82,8
[77,5;87,4]
N % ≥ 20 U/ml
[95% CI]
127 8,7
[4,4;15,0]
2, 4 mesiace v Španielsku 186 85,5
[79,6;90,2]
89 12,4
[6,3;21,0]
3, 5 mesiacov vo Fínsku, Taliansku
3, 4 mesiace v Českej
republike
180 94,4
[90,0;97,3]

182 84,6
[78,5;89,5]
114 3,5
[1,0;8,7]
90 2,2
[0,3;7,8]
2, 3 až 4
m
esiace
10, 14
t
ýždňov
a 6, 10, 14
t
ýždňov (Súhrnné údaje)
v Latinskej Amerike; v 11 krajinách Južná Afrika, Malawi
393 77,9%
[73,8;81,6]
221 58,4
[51,6;64,9]
341 15,1%
[11,7;19,0]
22,5
[15,1;31,4]
V troch porovnávacích kontrolovaných štúdiách bola imunitná odpoveď vyvolaná tekutou formou
Rotarixu porovnateľná s imunitnou odpoveďou vyvolanou lyofilizovanou formou Rotarixu.
Imunitná odpoveď u nedonosenýchdojčiat
V klinickej štúdii vykonanej s nedonosenými dojčatami, ktoré sa narodili aspoň po 27. týždni
gestačného veku, sa imunogenita Rotarixu hodnotila v podskupine 147 jedincov a preukázalo sa, že
Rotarix je v tejto populácii imunogénny; jeden mesiac po druhej dávke očkovacej látky sa titre
sérových IgA protilátok proti rotavírusom ≥ 20 U/ml (pomocou ELISA) dosiahli u 85,7 % (95 % CI:
79,0; 90,9) jedincov.
Účinnosť
V observačných štúdiách bola preukázanú účinnosť očkovacej látky voči ťažkej gastroenteritíde
vedúcej k hospitalizácii, ktorá bola spôsobená častými genotypmi rotavírusov G1P[8], G2P[4],
G3P[8], G4P[8] a G9P[8], ako aj menej častými genotypmi rotavírusov G9P[4] a G9P[6]. Všetky tieto kmene cirkulujú po celom svete.
Ú
činnosť po 2dávkach v prevencii RVGE vedúcej k hospitalizácii
K
rajiny
O
bdobie
V
ekové rozmedzie
N
(
1)
(
prípady/kontroly)
K
m
ene Účinnosť
% [95 % CI]
Belgicko
< 4 r.
Krajiny s vysokými príjmami
160/198 Všetky 90 [81;95]
2008-2010(2)
3 - 11 mes.
91 [75;97]
< 4 r. 41/53 G1P[8] 95 [78;99]
< 4 r.
3 - 11 mes.
80/103 G2P[4] 85 [64;94]
83 [11;96](3)
Singapur
2008-2010(2)
< 4 r. 12/13 G3P[8] 87* [< 0;98](3)
< 4 r. 16/17 G4P[8] 90 [19;99](3)
< 5 r. 136/272 Všetky 84 [32;96]
89/89 G1P[8] 91 [30;99]
Taiwan
2009-2011
USA
2010-2011
< 3 r. 275/1 623(4) Všetky
G1P[8]
< 2 r. 85/1 062(5) Všetky
G1P[8] G2P[4]
92 [75;98]
95 [69;100]
85 [73;92]
88 [68;95]
88 [68;95]
USA
2009-2011
8 - 11 mes. Všetky 89 [48;98]
< 5 r. 74/255(4) G3P[8] 68 [34;85]
Krajiny so strednými príjmami
Bolívia
2010-2011
< 3 r.
6 - 11 mes.
< 3 r.
6 - 11 mes.
300/974 Všetky 77 [65;84](6)
77 [51;89] G9P[8] 85 [69;93]
90 [65;97]
Brazília
2008-2011
< 3 r. G3P[8] 93 [70;98] G2P[4] 69 [14;89] G9P[6] 87 [19;98]
< 2 r. 115/1 481 Všetky 72 [44;85](6)
G1P[8] 89 [78;95] G2P[4] 76 [64;84]
Brazília
2008-2009(2)
El Salvador
2007-2009(2)
< 3 r.
3 - 11 mes.
< 3 r.
3 - 11 mes.
< 2 r.
6 - 11 mes.
249/249(5) Všetky 76 [58;86]
96 [68;99]
222/222(5) G2P[4] 75 [57;86]
95 [66;99](3)
251/770(5) Všetky 76 [64;84](6)
83 [68;91]
Guatemala
2012-2013
Mexiko
2010
Malawi
2012-2014
mes.: mesiace r.: roky
< 4 r. NA(7) Všetky 63 [23;82]
< 2 r. 9/17(5) G9P[4] 94 [16;100]
Krajina s nízkymi príjmami
< 2 r. 81/234(5) Všetky 63 [23;83]

* Štatisticky nevýznamná (p ≥ 0,05). Tieto údaje sa majú interpretovať obozretne.
(1) Uvedený je počet kompletne očkovaných (2 dávkami) a neočkovaných prípadov a kontrol.
(2) Štúdie, ktorých zadávateľom bola spoločnosť GSK.
(3) Údaje z
post-hoc analýzy.
(4) Účinnosť očkovacej látky bola vypočítaná pomocou kontrolných osôb z nemocníc negatívnych na rotavírusy
(odhady z Taiwanu boli vypočítané pomocou skombinovania kontrolných osôb z nemocníc negatívnych na rotavírusy a kontrolných osôb z nemocníc, u ktorých nebola prítomná hnačka).
(5) Účinnosť očkovacej látky bola vypočítaná pomocou kontrolných osôb zo susedstva.
(6) U osôb, ktoré neabsolvovali kompletnú očkovaciu schému, sa účinnosť po jednej dávke pohybovala
v rozmedzí od 51 % (95 % CI: 26;67, El Salvador) do 60 % (95 CI: 37;75, Brazília).
(7) NA: nie je k dispozícii. Odhad účinnosti očkovacej látky je založený na 41 kompletne očkovaných prípadoch
a 175 kompletne očkovaných kontrolách.
Vplyvnaúmrtnosť§
Štúdie overujúce vplyv očkovania Rotarixom vykonané v Paname, Brazílii a Mexiku ukázali pokles celkovej úmrtnosti v dôsledku hnačky v rozmedzí od 17 % do 73 % u detí mladších ako 5 rokov,
v priebehu 2 až 4 rokov po zavedení očkovania.
Vplyv na hospitalizáciu§
V retrospektívnej štúdii využívajúcej údaje z databáz vykonanej v Belgicku u detí vo veku 5 rokov
a mladších sa priamy a nepriamy vplyv očkovania Rotarixom na hospitalizáciu súvisiacu s rotavírusmi pohyboval v rozmedzí od 64 % (95% CI: 49;76) do 80 % (95% CI: 77;83) po dvoch rokoch od zavedenia očkovania. Podobné štúdie v Arménsku, Austrálii, Brazílii, Kanade, El Salvadore a Zambii ukázali zníženie potreby hospitalizácie o 45 % až 93 % po 2 až 4 rokoch od zavedenia očkovania.
Okrem toho tri štúdie overujúce vplyv očkovania na celkovú hospitalizáciu v dôsledku hnačky
vykonané v Latinskej Amerike ukázali zníženie potreby hospitalizácie o 14 % až 57 %
po 2 až 5 rokoch od zavedenia očkovania.
§POZNÁMKA: Štúdie overujúce vplyv očkovania sú zamerané na stanovenie časovej súvislosti, ale nie príčinnej súvislosti medzi ochorením a očkovaním. Prirodzené výkyvy vo výskyte ochorenia môžu tiež ovplyvniť pozorovaný časový efekt.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podaní neodhalili
žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Sacharóza
Adipan disodný
Dulbeccova modifikácia Eaglovho média (DMEM) Sterilná voda
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
- Naplnený perorálny aplikátor: 3 roky
- Stlačiteľná tuba vybavená membránou a krytom tuby: 3 roky
- Viacdávkový obal s jednodávkovými stlačiteľnými tubami (5 jednotlivých dávok) spojenými prúžkom: 2 roky
Po otvorení sa má očkovacia látka použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaNaplnený perorálny aplikátor1,5 ml
perorálnej suspenzie v naplnenom
perorálnom applikátore (sklo typu I) s pryžovou zátkou
(butylkaučuk) a ochranným krytom hrotu (butylkaučuk) vo veľkostiach balenia po 1, 5, 10 alebo
25 ks.
Stlačiteľnátuba1,5 ml
perorálnej suspenzie v stlačiteľnej tube (polyetylén) vybavenej membránou a krytom tuby
(polypropylén) vo veľkostiach balenia po 1, 10 alebo 50 ks.
Viacdávkový obal s jednodávkovýmistlačiteľnýmitubami(5jednotlivých dávok) spojenými prúžkom1,5 ml
perorálnej suspenzie v stlačiteľnej tube (polyetylén) dodávanej vo viacdávkovom obale s jednodávkovými stlačiteľnými tubami (5 jednotlivých dávok) spojenými prúžkom vo veľkosti balenia po 50 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomOčkovacia látka sa dodáva ako číra, bezfarebná tekutina, bez viditeľných častíc, určená na
perorálnepodanie.
Očkovacia látka je pripravená na použitie (nevyžaduje sa rekonštitúcia ani zriedenie).
Očkovacia látka sa podáva
perorálne bez zmiešania s akýmikoľvek inými očkovacími látkami alebo roztokmi.
Očkovacia látka sa má opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na podanie očkovacej látky v naplnenom perorálnom aplikátore:
Kryt hrotu
 perorálneho
perorálneho
aplikátora

1. Odstráňte ochranný kryt z hrotu
perorálneho aplikátora.
2. Táto očkovacia látka je určená len na
perorálne podanie. Dieťa má sedieť v zaklonenej polohe. Podajte
perorálne (t.j. do úst dieťaťa, smerom k vnútornej strane líca) celý obsah
perorálneho aplikátora.
3.
Nepodávajte injekčne.
Zlikvidujte prázdny perorálny aplikátor a kryt hrotu v nádobách určených na biologický odpad
v súlade s miestnymi predpismi.
Pokyny na podanie očkovacej látky v stlačiteľnejtube:
Pred podaním očkovacej látky si prečítajte, prosím, všetky nižšie uvedené pokyny.
A Čo potrebujete urobiť pred podaním Rotarixu

• Skontrolujte dátum exspirácie.
• Skontrolujte, či tuba nie je poškodená alebo otvorená.
• Skontrolujte, či je tekutina číra a bezfarebná, bez akýchkoľvek čiastočiek v nej.
Ak si všimnete čokoľvek nezvyčajné, nepoužívajte očkovaciu
látku.
• Očkovacia látka sa podáva perorálne (ústami) – priamo z tuby.
• Je pripravená na podanie – nepotrebujete ju miešať
s ničím.
B Pripravte tubu na použitie 1. Potiahnutím odstráňte kryt
1. Potiahnutím odstráňte kryt• Kryt si ponechajte – potrebujete ho na prepichnutie membrány.
• Držte tubu vo zvislej polohe.
2. Opakovane poklepkajte prstom po hornej časti tuby, aby ste z nej odstránili akúkoľvek tekutinu• Odstráňte akúkoľvek tekutinu z najužšej časti tuby tak, že poklepkáte prstom tesne pod membránou.
3. Dajte kryt do polohy, v ktorej otvorí tubu• Tubu stále držte vo zvislej polohe.
• Držte tubu po stranách.
• Vo vnútri hornej časti krytu je malý hrot – v strede.
• Obráťte kryt hornou časťou nadol (180°).
Membrána

Tuba Hrot Kryt

Membrána

Hrot
4. Otvorte tubu
• Nie je potrebné, aby ste krytom točili. Zatlačte kryt
smerom nadol, aby ste prepichli membránu.
• Potom kryt vytiahnite.
Zatlačte kryt
smerom nadol
C Skontrolujte, či sa tuba otvorila správne.
 1. Skontrolujte prepichnutie membrány
1. Skontrolujte prepichnutie membrány
• Na vrchu tuby by mal byť otvor.
2. Čo treba robiť, ak sa membrána neprepichla.• Ak sa membrána neprepichla, vráťte sa k časti B
a opakujte kroky 2, 3 a 4.
D Podajte očkovaciu látku
• Po otvorení tuby skontrolujte, či je tekutina číra, bez akýchkoľvek čiastočiek v nej.
Ak si všimnete čokoľvek nezvyčajné, očkovaciu látku
nepoužívajte.
• Ihneď podajte očkovaciu látku.
1. Poloha dieťaťa pri podaní očkovacej látky• Posaďte dieťa jemne zaklonené dozadu.
2. Podanie očkovacej látky• Jemne vytlačte tekutinu do úst dieťaťa – smerom do
vnútornej strany líca.
• Možno bude potrebné stlačiť tubu niekoľkokrát, aby ste všetku tekutinu dostali von – je v poriadku, ak v ústí
tuby zostane kvapka.

Otvor
Len na perorálne podanie

Zlikvidujte prázdnu tubu a kryt v nádobách určených na biologický odpad v súlade s miestnymi
predpismi.
Pokynynapodanieočkovacejlátkyvo viacdávkovom obale s jednodávkovýmistlačiteľnýmitubami(5 jednotlivých dávok) spojenými prúžkom:
Pred podaním očkovacej látky si prečítajte, prosím, všetky nižšie uvedené pokyny.
• Táto očkovacia látka sa podáva perorálne (ústami) priamo z jednotlivej tuby.
• Jedna perorálna tuba obsahuje jednu dávku očkovacej látky.
• Táto očkovacia látka je pripravená na použitie – nemiešajte ju s ničím.
 A
. Čo potrebujete urobiť pred podaním Rotarixu
A
. Čo potrebujete urobiť pred podaním Rotarixu
1. Skontrolujte dátum exspirácie na spojovacom prúžku.
2. Skontrolujte, či je tekutina v perorálnych tubách číra a bezfarebná, bez akýchkoľvek čiastočiek v nej.
-
Ak si všimnete čokoľvek nezvyčajné, nepoužívajte žiadnu z perorálnych túb na spojovacom prúžku.3. Skontrolujte, či každá jednotlivá perorálna tuba nie je poškodená a či je stále uzatvorená.
-
Ak si na niektorej perorálnej tube všimnetečokoľvek nezvyčajné, nepoužívajte ju.Spojovací prúžokHrdlo Telo ÚchytkaDátum exspirácie: DD/MM/RRJednodávková perorálna tuba
 B. Pripravte si perorálnu tubu
B. Pripravte si perorálnu tubu
1. Oddeľte jednu perorálnu tubu od ostatných, pričom
začnite od kraja:
a) Chyťte úchytku jednej z krajných perorálnych túb, aby ste ju oddelili od ostatných.
b) Druhou rukou chyťte úchytku perorálnej tuby, ktorá je vedľa nej.
c) Potiahnite úchytku a odtrhnite ju od vedľajšej perorálnej tuby.
Dátum exspirácie: D/MM/RR Potiahnuť
Potiahnuť
2. Otvorte oddelenú perorálnu tubu:
d) Držte oddelenú perorálnu tubu vo zvislej polohe. e) Držte úchytku oddelenej perorálnej tuby jednou rukou a spojovací prúžok druhou rukou.
Nedržte telo perorálnej tuby, mohli by ste vytlačiť trochu očkovacej látky.f) Otočte oddelenú perorálnu tubu.
g) Vytiahnite ju zo spojovacieho prúžka.
Otočiť Vytiah-nuť
C
. Podajte očkovaciu látku perorálne ihneď po otvorení
 tuby
tuby
1. Poloha dieťaťa pri podaní očkovacej látky:
• Posaďte dieťa jemne zaklonené dozadu.
2. Perorálne podanie očkovacej látky:
• Jemne vytlačte tekutinu do úst dieťaťa, smerom
do vnútornej strany líca.
• Možno bude potrebné stlačiť tubu niekoľkokrát, aby ste všetku tekutinu dostali von – je
v poriadku, ak v perorálnej tube zostane kvapka.
Len naperorálnepodanie
 D
. Zvyšné dávky ihneď uchovávajte v chladničke
D
. Zvyšné dávky ihneď uchovávajte v chladničke
Nepoužité perorálne tuby, ktoré sú stále pripojené
k spojovaciemu prúžku, sa po použití perorálnej tuby musia ihneď vložiť späť do chladničky. Je to dôležité kvôli tomu, aby sa nepoužité perorálne tuby mohli použiť na ďalšie očkovanie.
Zlikvidujte použité perorálne tuby v nádobách určených na biologický odpad
v súlade s miestnymi predpismi.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlaxoSmithKline Biologicals s.a. Rue de l'Institut 89
B-1330 Rixensart, Belgicko
8. REGISTRAČNÉ ČÍSLANaplnený perorálny aplikátorEU/1/05/330/005
EU/1/05/330/006
EU/1/05/330/007
EU/1/05/330/008
StlačiteľnátubaEU/1/05/330/009
EU/1/05/330/010
EU/1/05/330/011
Ihneď vložte späť do chladničky2°C až 8°C
V
i
acdávkový obal s jednodávkovými
stlačiteľnými
t
ubami
(
5
jednotlivých dávok) spojenými prúžkom
EU/1/05/330/012
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. februára 2006
Dátum posledného predĺženia registrácie: 14. januára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Písomná informácia pre používateľa
R
otarix prášok a disperzné prostredie na perorálnu suspenziu
Rotavírusová očkovacia látka (živá)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Táto očkovacia látka bola predpísaná iba vášmu dieťaťu. Nedávajte ju nikomu inému.
- Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Rotarix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
3. Ako sa Rotarix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Rotarix
6. Obsah balenia a ďalšie informácie
1. Čo je Rotarix a na čo sa používa
Rotarix je vírusová očkovacia látka, obsahujúca živý, oslabený ľudský rotavírus, ktorá pomáha chrániť
vaše dieťa, od 6 týždňov života, pred gastroenteritídou (hnačkou a dávením) spôsobenou rotavírusovou infekciou.
Ako Rotarix účinkuje:
Rotavírusová infekcia je najčastejšou príčinou ťažkej hnačky u dojčiat a malých detí. Rotavírus sa ľahko šíri z ruky do úst v dôsledku kontaktu so stolicou infikovanej osoby. Väčšina detí s rotavírusovou hnačkou sa uzdraví sama. U niektorých detí sa však vyvinie závažné ochorenie s ťažkým vracaním, hnačkou a stratou tekutín ohrozujúcou život, ktoré vyžaduje hospitalizáciu.
Keď jedinec dostane očkovaciu látku, imunitný systém (prirodzená obrana tela) si vytvorí protilátky proti najčastejšie sa vyskytujúcim typom rotavírusu. Tieto protilátky chránia pred ochorením spôsobeným týmito typmi rotavírusu.
Tak ako všetky očkovacie látky, Rotarix nemusí úplne chrániť všetkých ľudí, ktorí sú preventívne očkovaní proti rotavírusovým infekciám.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
Nepoužívajte Rotarix:
• ak vaše dieťa malo v minulosti alergickú reakciu na rotavírusovú očkovaciu látku alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6). Prejavy alergickej reakcie môžu zahrňovať svrbivé kožné vyrážky, dýchacie ťažkosti a opuch tváre alebo jazyka.
• ak vaše dieťa malo v minulosti intususcepciu (črevná nepriechodnosť, pri ktorej sa jedna časť čreva vsunie do susednej časti).
• ak sa vaše dieťa narodilo s chybou čreva, ktorá by mohla viesť k intususcepcii.
• ak má vaše dieťa zriedkavé dedičné ochorenie, ktoré postihuje jeho imunitný systém, nazývané
ťažká kombinovaná imunodeficiencia (SCID).
• ak vaše dieťa má ťažkú infekciu s vysokou horúčkou. Možno bude potrebné odložiť očkovanie až dovtedy, kým sa neuzdraví. Slabá infekcia ako napríklad nádcha by nemala byť problémom, ale porozprávajte sa o tom najskôr s vaším lekárom.
• ak vaše dieťa má hnačku alebo vracia. Možno bude potrebné odložiť očkovanie až dovtedy,
kým sa neuzdraví.
Upozornenia a opatrenia
Predtým, ako vaše dieťa dostane Rotarix, obráťte sa na svojho lekára/zdravotníckeho pracovníka, ak:
• on/ona je v blízkom kontakte s jedincom, napríklad s členom domácnosti, ktorý má oslabený imunitný systém, napr. s jedincom s rakovinou alebo ktorý užíva lieky, ktoré môžu oslabiť imunitný systém.
• on/ona má akúkoľvek poruchu žalúdočno-črevného systému.
• on/ona nepriberá a nerastie tak, ako sa očakáva.
• on/ona má akékoľvek ochorenie alebo užíva akýkoľvek liek, ktorý znižuje jeho odolnosť voči
infekcii.
Ak vaše dieťa pociťuje závažnú bolesť brucha, stále vracia, má krv v stolici, opuch brucha a/alebo vysokú horúčku potom ako dostalo Rotarix, ihneď kontaktujte lekára/zdravotníckeho pracovníka (pozri tiež časť 4 „Možné vedľajšie účinky“).
Tak ako vždy, dbajte, prosím, na dôkladné umytie rúk po výmene zašpinených plienok.
Iné lieky a Rotarix
Ak vaše dieťa teraz užíva, alebo v poslednom čase užívalo, či práve bude užívať ďalšie lieky alebo
v poslednom čase dostalo ešte inú očkovaciu látku, povedzte to svojmu lekárovi.
Rotarix sa môže vášmu dieťaťu podať súčasne s ďalšími bežne odporúčanými očkovacími látkami, ako sú očkovacia látka proti záškrtu, tetanu, pertussis (dávivému kašľu), očkovacia látka proti Haemophilus influenzae typ b, perorálna alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B ako aj konjugovaná očkovacia látka proti pneumokokom a konjugovaná očkovacia látka proti meningokokom séroskupiny C.
Rotarix a jedlo a nápoje
Nie sú žiadne obmedzenia týkajúce sa jedla alebo tekutín, ktoré dojča konzumuje, pred očkovaním ani
po ňom.
Dojčenie
Na základe dôkazov získaných v klinických štúdiách, dojčenie neznižuje Rotarixom poskytnutú
ochranu pred rotavírusovou gastroenteritídou. Z tohto dôvodu sa počas očkovacej schémy môže pokračovať v dojčení.
Rotarix obsahuje sacharózu a sorbitol
Ak vám lekár povedal, že dieťa, ktoré má byť očkované, zle znáša niektoré cukry, obráťte sa na svojho
lekára skôr, ako vaše dieťa dostane túto očkovaciu látku.
3. Ako sa Rotarix podáva
Odporúčanú dávku Rotarixu podá vášmu dieťaťu lekár alebo zdravotná sestra. Vaše dieťa užije očkovaciu látku (1 ml tekutiny) ústami. Táto očkovacia látka sa nesmie za žiadnych okolností podať injekciou.
Vaše dieťa dostane dve dávky očkovacej látky. Každá dávka bude podaná na osobitnej návšteve
a medzi podaním dvoch dávok bude časový odstup najmenej 4 týždne. Prvá dávka sa môže podať vo veku od 6 týždňov. Obidve dávky očkovacej látky sa musia podať do veku 24 týždňov, aj keď sa prednostne majú podať pred dosiahnutím veku 16 týždňov.
Rotarix sa môže podať podľa rovnakej očkovacej schémy dojčatám, ktoré sa narodili predčasne, pod podmienkou, že tehotenstvo trvalo aspoň 27 týždňov.
V prípade, že vaše dieťa vypľuje alebo po prehltnutí okamžite vyvracia väčšinu očkovacej látky, môže sa na tej istej očkovacej návšteve podať jednorazová náhradná dávka.
Keď sa Rotarix podá vášmu dieťaťu ako prvá dávka, odporúča sa, aby vaše dieťa dostalo Rotarix (a
nie inú rotavírusovú očkovaciu látku) aj ako druhú dávku.
Je dôležité, aby ste sa riadili pokynmi vášho lekára alebo zdravotnej sestry týkajúcimi sa naplánovaných návštev. Ak zabudnete prísť k lekárovi v naplánovanom čase, požiadajte ho o radu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto očkovacia látka môže spôsobovať vedľajšie účinky, hoci sa neprejavia
u každého.
Pri tejto očkovacej látke sa môžu objaviť nasledujúce vedľajšie účinky:
♦ Časté (môžu sa vyskytovať pri menej ako 1 z 10 dávok očkovacej látky):
• hnačka
• podráždenosť
♦ Menej časté (môžu sa vyskytovať pri menej ako 1 zo 100 dávok očkovacej látky):
• bolesť brucha (pozri tiež príznaky veľmi zriedkavého vedľajšieho účinku – intususcepcie)
• plynatosť
• zápal kože
Vedľajšie účinky, ktoré sa hlásili počas používania Rotarixu na trhu zahŕňajú:
• Veľmi zriedkavé: intususcepcia (časť čreva sa zablokuje alebo skrúti). Príznaky môžu zahŕňať závažnú bolesť žalúdka, pretrvávajúce vracanie, krv v stolici, opuchnuté brucho a/alebo vysokú horúčku. Ak u vášho dieťaťa spozorujete jeden z týchto príznakov, ihneď kontaktujte lekára/zdravotníckeho pracovníka.
• krv v stolici
• u veľmi predčasne narodených detí (narodené pred alebo vrátane 28. týždňa tehotenstva) sa môžu v priebehu 2-3 dní po očkovaní vyskytovať dlhšie prestávky v dýchaní ako obvykle.
• deti so zriedkavým dedičným ochorením, nazývaným ťažká kombinovaná imunodeficiencia (SCID), môžu mať zapálený žalúdok alebo črevo (gastroenteritída) a stolicou môžu vylučovať vírus očkovacej látky. Príznaky gastroenteritídy môžu zahŕňať pocit nevoľnosti, vracanie, žalúdočné kŕče alebo hnačku.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať Rotarix
Túto očkovaciu látku uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na škatuli. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Po rekonštitúcii sa má očkovacia látka v perorálnom aplikátore podať okamžite. Ak sa rekonštituovaná očkovacia látka nepoužije do 24 hodín, musí sa zlikvidovať.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Rotarix obsahuje
- Liečivo je:
Ľudský kmeň rotavírusu RIX4414 (živý, oslabený)* nie menej ako 106,0 CCID50
*Kultivovaný na bunkách Vero
- Ďalšie zložky Rotarixu sú:
Prášok: dextrán, sacharóza, sorbitol (pozri tiež časť 2, Rotarix obsahuje sacharózu a sorbitol), aminokyseliny, Dulbeccova modifikácia Eaglovho média (DMEM)
Rozpúšťadlo: uhličitan vápenatý, xantánová guma, sterilná voda
Ako vyzerá Rotarix a obsah balenia
Prášok a disperzné prostredie na perorálnu suspenziu
Rotarix sa dodáva ako belavý prášok v jednodávkovom sklenenom obale a samostatný perorálny aplikátor s disperzným prostredím, ktorý obsahuje pomaly sa usadzujúcu bielu usadeninu a bezfarebný supernatant. Dodáva sa s prenosovým nástavcom, ktorý umožňuje ľahký prenos disperzného
prostredia do skleneného obalu obsahujúceho prášok a zmiešanie rôznych zložiek očkovacej látky.
Obe zložky sa musia spolu zmiešať skôr, ako vaše dieťa dostane očkovaciu látku. Zmiešaná očkovacia
látka bude viac zakalená ako samotné disperzné prostredie. Rotarix je dostupný v balení po 1, 5, 10 alebo 25 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutiaoregistráciiavýrobca
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gique/ België/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel. +370 5 264 90 00
info
.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika
GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11
cz
.info@gsk.comMagyarországGlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
E
esti
GlaxoSmithKline Eesti OÜ
Tel: +372 667 6900
estonia@gsk.comNorgeGlaxoSmithKline AS
Tlf: + 47 22 70 20 00
Ε
λλάδα
GlaxoSmithKline A.E.B.E.
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 (0)1 97075 0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comHrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999
PortugalSmith Kline & French Portuguesa, Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.comRomâniaGlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf
Sími : +354 535 7000
Slovenská republika GlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11 recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A.
Tel:+ 39 (0)45 9218 111
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií:
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Pred rekonštitúciou:
Počas uchovávania
perorálneho aplikátora obsahujúceho disperzné prostredie sa môže vytvoriť biely
sediment a číry supernatant. Pred rekonštitúciou sa disperzné prostredie musí opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad.
Po rekonštitúcii:
Rekonštituovaná očkovacia látka je mierne viac zakalená ako disperzné prostredie a je mliečne bieleho vzhľadu.
Pred podaním sa rekonštituovaná očkovacia látka má taktiež opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
Pokynynarekonštitúciuapodanieočkovacejlátky:
Prenosový nástavec
Sklenený obal
Perorálny
aplikátor
Kryt hrotu
perorálneho
aplikátora
1. Odstráňte viečko z umelej hmoty zo
skleneného obalu obsahujúceho prášok.
2. Pripojte prenosový nástavec na sklenený obal tým, že ho budete tlačiť smerom nadol až dovtedy, kým nebude prenosový nástavec riadne a bezpečne umiestnený.
3. Silno pretrepte perorálny aplikátor obsahujúci disperzné prostredie. Pretrepaná suspenzia bude zakalená tekutina s pomaly sa usadzujúcou bielou usadeninou.
4. Odstráňte ochranný kryt z hrotu
perorálneho aplikátora.
5. Pripojte
perorálny aplikátor na
prenosový nástavec tým, že ho na
nástavec silno pritlačíte.
6. Preneste celý obsah
perorálneho
aplikátora do skleneného obalu obsahujúceho prášok.
7. Pretrepte sklenený obal s pripojeným
perorálnym aplikátorom a skontrolujte, či
sa prášok úplne rozptýlil. Rekonštituovaná očkovacia látka bude viac zakalená ako samotné disperzné prostredie. Tento vzhľad je normálny.
8. Vytiahnite celý zmiešaný obsah späť
do perorálneho aplikátora.
9. Odpojte perorálny aplikátor od
prenosového nástavca.
10. Táto očkovacia látka je určená
len na perorálne podanie. Dieťa má
sedieť v zaklonenej polohe. Podajte celý obsah perorálneho aplikátora perorálne (tak, že celý obsah perorálneho aplikátora podáte na vnútornú stranu líca).
11. Nepodávajte injekčne.
Ak sa má rekonštituovaná očkovacia látka pred podaním prechodne uchovávať, vráťte ochranný kryt na hrot perorálneho
aplikátora. Perorálny aplikátor obsahujúci rekonštituovanú očkovaciu látku sa musí pred perorálnym podaním znovu
mierne pretrepať. Nepodávajte injekčne.
Písomná informácia pre používateľa
R
otarix perorálna suspenzia v naplnenom perorálnom aplikátore
Rotavírusová očkovacia látka (živá)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Táto očkovacia látka bola predpísaná iba vášmu dieťaťu. Nedávajte ju nikomu inému.
- Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej
informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Rotarix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
3. Ako sa Rotarix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Rotarix
6. Obsah balenia a ďalšie informácie
1. Čo je Rotarix a na čo sa používa
Rotarix je vírusová očkovacia látka, obsahujúca živý, oslabený ľudský rotavírus, ktorá pomáha chrániť
vaše dieťa, od 6 týždňov života, pred gastroenteritídou (hnačkou a dávením) spôsobenou
rotavírusovou infekciou.
Ako Rotarix účinkuje:
Rotavírusová infekcia je najčastejšou príčinou ťažkej hnačky u dojčiat a malých detí. Rotavírus sa ľahko šíri z ruky do úst v dôsledku kontaktu so stolicou infikovanej osoby. Väčšina detí s rotavírusovou hnačkou sa uzdraví sama. U niektorých detí sa však vyvinie závažné ochorenie s ťažkým vracaním, hnačkou a stratou tekutín ohrozujúcou život, ktoré vyžaduje hospitalizáciu.
Keď jedinec dostane očkovaciu látku, imunitný systém (prirodzená obrana tela) si vytvorí protilátky proti najčastejšie sa vyskytujúcim typom rotavírusu. Tieto protilátky chránia pred ochorením spôsobeným týmito typmi rotavírusu.
Tak ako všetky očkovacie látky, Rotarix nemusí úplne chrániť všetkých ľudí, ktorí sú preventívne očkovaní proti rotavírusovým infekciám.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
Nepoužívajte Rotarix:
• ak vaše dieťa malo v minulosti alergickú reakciu na rotavírusovú očkovaciu látku alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6). Prejavy alergickej reakcie môžu zahrňovať svrbivé kožné vyrážky, dýchacie ťažkosti a opuch tváre alebo jazyka.
• ak vaše dieťa malo v minulosti intususcepciu (črevná nepriechodnosť, pri ktorej sa jedna časť čreva vsunie do susednej časti).
• ak sa vaše dieťa narodilo s chybou čreva, ktorá by mohla viesť k intususcepcii.
• ak má vaše dieťa zriedkavé dedičné ochorenie, ktoré postihuje jeho imunitný systém, nazývané ťažká kombinovaná imunodeficiencia (SCID).
• ak vaše dieťa má ťažkú infekciu s vysokou horúčkou. Možno bude potrebné odložiť očkovanie až dovtedy, kým sa neuzdraví. Slabá infekcia ako napríklad nádcha by nemala byť problémom, ale porozprávajte sa o tom najskôr s vaším lekárom.
• ak vaše dieťa má hnačku alebo vracia. Možno bude potrebné odložiť očkovanie až dovtedy,
kým sa neuzdraví.
Upozornenia a opatrenia
Predtým, ako vaše dieťa dostane Rotarix, obráťte sa na svojho lekára/zdravotníckeho pracovníka, ak:
• on/ona je v blízkom kontakte s jedincom, napríklad s členom domácnosti, ktorý má oslabený imunitný systém, napr. s jedincom s rakovinou alebo ktorý užíva lieky, ktoré môžu oslabiť imunitný systém.
• on/ona má akúkoľvek poruchu žalúdočno-črevného systému.
• on/ona nepriberá a nerastie tak, ako sa očakáva.
• on/ona má akékoľvek ochorenie alebo užíva akýkoľvek liek, ktorý znižuje jeho odolnosť voči
infekcii.
Ak vaše dieťa pociťuje závažnú bolesť brucha, stále vracia, má krv v stolici, opuch brucha a/alebo vysokú horúčku potom ako dostalo Rotarix, ihneď kontaktujte lekára/zdravotníckeho pracovníka (pozri tiež časť 4 „Možné vedľajšie účinky“).
Tak ako vždy, dbajte, prosím, na dôkladné umytie rúk po výmene zašpinených plienok.
Iné lieky a Rotarix
Ak vaše dieťa teraz užíva, alebo v poslednom čase užívalo, či práve bude užívať ďalšie lieky alebo
v poslednom čase dostalo ešte inú očkovaciu látku, povedzte to svojmu lekárovi.
Rotarix sa môže vášmu dieťaťu podať súčasne s ďalšími bežne odporúčanými očkovacími látkami, ako sú očkovacia látka proti záškrtu, tetanu, pertussis (dávivému kašľu), očkovacia látka proti Haemophilus influenzae typ b, perorálna alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B ako aj konjugovaná očkovacia látka proti pneumokokom a konjugovaná očkovacia látka proti meningokokom séroskupiny C.
Rotarix a jedlo a nápoje
Nie sú žiadne obmedzenia týkajúce sa jedla alebo tekutín, ktoré dojča konzumuje, pred očkovaním ani
po ňom.
Dojčenie
Na základe dôkazov získaných v klinických štúdiách, dojčenie neznižuje Rotarixom poskytnutú
ochranu pred rotavírusovou gastroenteritídou. Z tohto dôvodu sa počas očkovacej schémy môže
pokračovať v dojčení.
Rotarix obsahuje sacharózu
Ak vám lekár povedal, že dieťa, ktoré má byť očkované, zle znáša niektoré cukry, obráťte sa na svojho
lekára skôr, ako vaše dieťa dostane túto očkovaciu látku.
3. Ako sa Rotarix podáva
Odporúčanú dávku Rotarixu podá vášmu dieťaťu lekár alebo zdravotná sestra. Vaše dieťa užije očkovaciu látku (1,5 ml tekutiny) ústami. Táto očkovacia látka sa nesmie za žiadnych okolností podať injekciou.
Vaše dieťa dostane dve dávky očkovacej látky. Každá dávka bude podaná na osobitnej návšteve
a medzi podaním dvoch dávok bude časový odstup najmenej 4 týždne. Prvá dávka sa môže podať vo veku od 6 týždňov. Obidve dávky očkovacej látky sa musia podať do veku 24 týždňov, aj keď sa prednostne majú podať pred dosiahnutím veku 16 týždňov.
Rotarix sa môže podať podľa rovnakej očkovacej schémy dojčatám, ktoré sa narodili predčasne, pod podmienkou, že tehotenstvo trvalo aspoň 27 týždňov.
V prípade, že vaše dieťa vypľuje alebo po prehltnutí okamžite vyvracia väčšinu očkovacej látky, môže
sa na tej istej očkovacej návšteve podať jednorazová náhradná dávka.
Keď sa Rotarix podá vášmu dieťaťu ako prvá dávka, odporúča sa, aby vaše dieťa dostalo Rotarix (a
nie inú rotavírusovú očkovaciu látku) aj ako druhú dávku.
Je dôležité, aby ste sa riadili pokynmi vášho lekára alebo zdravotnej sestry týkajúcimi sa
naplánovaných návštev. Ak zabudnete prísť k lekárovi v naplánovanom čase, požiadajte ho o radu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto očkovacia látka môže spôsobovať vedľajšie účinky, hoci sa neprejavia
u každého.
Pri tejto očkovacej látke sa môžu objaviť nasledujúce vedľajšie účinky:
♦ Časté (môžu sa vyskytovať pri menej ako 1 z 10 dávok očkovacej látky):
• hnačka
• podráždenosť
♦ Menej časté (môžu sa vyskytovať pri menej ako 1 zo 100 dávok očkovacej látky):
• bolesť brucha (pozri tiež príznaky veľmi zriedkavého vedľajšieho účinku – intususcepcie)
• plynatosť
• zápal kože
Vedľajšie účinky, ktoré sa hlásili počas používania Rotarixu na trhu zahŕňajú:
• Veľmi zriedkavé: intususcepcia (časť čreva sa zablokuje alebo skrúti). Príznaky môžu zahŕňať závažnú bolesť žalúdka, pretrvávajúce vracanie, krv v stolici, opuchnuté brucho a/alebo vysokú horúčku. Ak u vášho dieťaťa spozorujete jeden z týchto príznakov, ihneď kontaktujte lekára/zdravotníckeho pracovníka.
• krv v stolici
• u veľmi predčasne narodených detí (narodené pred alebo vrátane 28. týždňa tehotenstva) sa môžu v priebehu 2-3 dní po očkovaní vyskytovať dlhšie prestávky v dýchaní ako obvykle.
• deti so zriedkavým dedičným ochorením, nazývaným ťažká kombinovaná imunodeficiencia (SCID), môžu mať zapálený žalúdok alebo črevo (gastroenteritída) a stolicou môžu vylučovať vírus očkovacej látky. Príznaky gastroenteritídy môžu zahŕňať pocit nevoľnosti, vracanie, žalúdočné kŕče alebo hnačku.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať Rotarix
Túto očkovaciu látku uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na škatuli. Dátum
exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Po otvorení sa má očkovacia látka použiť okamžite.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.'
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Rotarix obsahuje
- Liečivo je:
Ľudský kmeň rotavírusu RIX4414 (živý, oslabený)*nie menej ako 106,0 CCID50
*Kultivovaný na bunkách Vero
- Ďalšie zložky Rotarixu sú sacharóza (pozri tiež časť 2. Rotarix obsahuje sacharózu), adipan disodný, Dulbeccova modifikácia Eaglovho média (DMEM), sterilná voda
Ako vyzerá Rotarix a obsah balenia
Perorálna suspenzia v naplnenom perorálnom aplikátore.
Rotarix sa dodáva ako číra a bezfarebná tekutina v jednodávkovom naplnenom perorálnom aplikátore
(1,5 ml).
Rotarix je dostupný v balení po 1, 5, 10 alebo 25 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutiaoregistráciiavýrobca
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gique/België/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB Tel. +370 5 264 90 00 inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД Тел. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Č
eská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
E
esti
GlaxoSmithKline Eesti OÜ Tel: +372 667 6900
estonia@gsk.comNorgeGlaxoSmithKline AS Tlf: + 47 22 70 20 00
Ε
λλάδα
GlaxoSmithKline A.E.B.E. Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH. Tel: + 43 (0)1 97075 0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A. Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comHrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999
PortugalSmith Kline & French Portuguesa, Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.comRomâniaGlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími : +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A.
Tel:+ 39 (0) 45 9218 111
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií:
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Očkovacia látka sa dodáva ako číra, bezfarebná tekutina, bez viditeľných častíc, určená na
perorálnepodanie.
Očkovacia látka je pripravená na použitie (nevyžaduje sa rekonštitúcia ani zriedenie).
Očkovacia látka sa podáva
perorálne bez zmiešania s akýmikoľvek inými očkovacími látkami alebo
roztokmi.
Očkovacia látka sa má opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na podanie očkovacej látky:
Kryt hrotu
 perorálneho
perorálneho
aplikátora

1. Odstráňte ochranný kryt z hrotu
perorálneho aplikátora.
2. Táto očkovacia látka je určená len na
perorálne podanie. Dieťa má sedieť v zaklonenej polohe. Podajte
perorálne (t.j. do úst dieťaťa, smerom k vnútornej strane líca) celý obsah
perorálneho aplikátora.
3.
Nepodávajte injekčne.
Zlikvidujte prázdny perorálny aplikátor a kryt hrotu v nádobách určených na biologický odpad
v súlade s miestnymi predpismi.
Písomná informácia pre používateľa
R
otarix perorálna suspenzia v stlačiteľnej tube
Rotavírusová očkovacia látka (živá)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Táto očkovacia látka bola predpísaná iba vášmu dieťaťu. Nedávajte ju nikomu inému.
- Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Rotarix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
3. Ako sa Rotarix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Rotarix
6. Obsah balenia a ďalšie informácie
1. Čo je Rotarix a na čo sa používa
Rotarix je vírusová očkovacia látka, obsahujúca živý, oslabený ľudský rotavírus, ktorá pomáha chrániť
vaše dieťa, od 6 týždňov života, pred gastroenteritídou (hnačkou a dávením) spôsobenou
rotavírusovou infekciou.
Ako Rotarix účinkuje:
Rotavírusová infekcia je najčastejšou príčinou ťažkej hnačky u dojčiat a malých detí. Rotavírus sa ľahko šíri z ruky do úst v dôsledku kontaktu so stolicou infikovanej osoby. Väčšina detí s rotavírusovou hnačkou sa uzdraví sama. U niektorých detí sa však vyvinie závažné ochorenie s ťažkým vracaním, hnačkou a stratou tekutín ohrozujúcou život, ktoré vyžaduje hospitalizáciu.
Keď jedinec dostane očkovaciu látku, imunitný systém (prirodzená obrana tela) si vytvorí protilátky proti najčastejšie sa vyskytujúcim typom rotavírusu. Tieto protilátky chránia pred ochorením spôsobeným týmito typmi rotavírusu.
Tak ako všetky očkovacie látky, Rotarix nemusí úplne chrániť všetkých ľudí, ktorí sú preventívne očkovaní proti rotavírusovým infekciám.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
Nepoužívajte Rotarix:
• ak vaše dieťa malo v minulosti alergickú reakciu na rotavírusovú očkovaciu látku alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6). Prejavy alergickej reakcie môžu zahrňovať svrbivé kožné vyrážky, dýchacie ťažkosti a opuch tváre alebo jazyka.
• ak vaše dieťa malo v minulosti intususcepciu (črevná nepriechodnosť, pri ktorej sa jedna časť čreva vsunie do susednej časti).
• ak sa vaše dieťa narodilo s chybou čreva, ktorá by mohla viesť k intususcepcii.
• ak má vaše dieťa zriedkavé dedičné ochorenie, ktoré postihuje jeho imunitný systém, nazývané
ťažká kombinovaná imunodeficiencia (SCID).
• ak vaše dieťa má ťažkú infekciu s vysokou horúčkou. Možno bude potrebné odložiť očkovanie až dovtedy, kým sa neuzdraví. Slabá infekcia ako napríklad nádcha by nemala byť problémom, ale porozprávajte sa o tom najskôr s vaším lekárom.
• ak vaše dieťa má hnačku alebo vracia. Možno bude potrebné odložiť očkovanie až dovtedy,
kým sa neuzdraví.
Upozornenia a opatrenia
Predtým, ako vaše dieťa dostane Rotarix, obráťte sa na svojho lekára/zdravotníckeho pracovníka, ak:
• on/ona je v blízkom kontakte s jedincom, napríklad s členom domácnosti, ktorý má oslabený imunitný systém, napr. s jedincom s rakovinou alebo ktorý užíva lieky, ktoré môžu oslabiť imunitný systém.
• on/ona má akúkoľvek poruchu žalúdočno-črevného systému.
• on/ona nepriberá a nerastie tak, ako sa očakáva.
• on/ona má akékoľvek ochorenie alebo užíva akýkoľvek liek, ktorý znižuje jeho odolnosť voči
infekcii.
Ak vaše dieťa pociťuje závažnú bolesť brucha, stále vracia, má krv v stolici, opuch brucha a/alebo vysokú horúčku potom ako dostalo Rotarix, ihneď kontaktujte lekára/zdravotníckeho pracovníka (pozri tiež časť 4 „Možné vedľajšie účinky“).
Tak ako vždy, dbajte, prosím, na dôkladné umytie rúk po výmene zašpinených plienok.
Iné lieky a Rotarix
Ak vaše dieťa teraz užíva, alebo v poslednom čase užívalo, či práve bude užívať ďalšie lieky alebo
v poslednom čase dostalo ešte inú očkovaciu látku, povedzte to svojmu lekárovi.
Rotarix sa môže vášmu dieťaťu podať súčasne s ďalšími bežne odporúčanými očkovacími látkami, ako sú očkovacia látka proti záškrtu, tetanu, pertussis (dávivému kašľu), očkovacia látka proti Haemophilus influenzae typ b, perorálna alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B ako aj konjugovaná očkovacia látka proti pneumokokom a konjugovaná očkovacia látka proti meningokokom séroskupiny C.
Rotarix a jedlo a nápoje
Nie sú žiadne obmedzenia týkajúce sa jedla alebo tekutín, ktoré dojča konzumuje, pred očkovaním ani
po ňom.
Dojčenie
Na základe dôkazov získaných v klinických štúdiách, dojčenie neznižuje Rotarixom poskytnutú
ochranu pred rotavírusovou gastroenteritídou. Z tohto dôvodu sa počas očkovacej schémy môže pokračovať v dojčení.
Rotarix obsahuje sacharózu
Ak vám lekár povedal, že dieťa, ktoré má byť očkované, zle znáša niektoré cukry, obráťte sa na svojho
lekára skôr, ako vaše dieťa dostane túto očkovaciu látku.
3. Ako sa Rotarix podáva
Odporúčanú dávku Rotarixu podá vášmu dieťaťu lekár alebo zdravotná sestra. Vaše dieťa užije očkovaciu látku (1,5 ml tekutiny) ústami. Táto očkovacia látka sa nesmie za žiadnych okolností podať injekciou.
Vaše dieťa dostane dve dávky očkovacej látky. Každá dávka bude podaná na osobitnej návšteve
a medzi podaním dvoch dávok bude časový odstup najmenej 4 týždne. Prvá dávka sa môže podať vo veku od 6 týždňov. Obidve dávky očkovacej látky sa musia podať do veku 24 týždňov, aj keď sa prednostne majú podať pred dosiahnutím veku 16 týždňov.
Rotarix sa môže podať podľa rovnakej očkovacej schémy dojčatám, ktoré sa narodili predčasne, pod podmienkou, že tehotenstvo trvalo aspoň 27 týždňov.
V prípade, že vaše dieťa vypľuje alebo po prehltnutí okamžite vyvracia väčšinu očkovacej látky, môže
sa na tej istej očkovacej návšteve podať jednorazová náhradná dávka.
Keď sa Rotarix podá vášmu dieťaťu ako prvá dávka, odporúča sa, aby vaše dieťa dostalo Rotarix (a
nie inú rotavírusovú očkovaciu látku) aj ako druhú dávku.
Je dôležité, aby ste sa riadili pokynmi vášho lekára alebo zdravotnej sestry týkajúcimi sa naplánovaných návštev. Ak zabudnete prísť k lekárovi v naplánovanom čase, požiadajte ho o radu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto očkovacia látka môže spôsobovať vedľajšie účinky, hoci sa neprejavia
u každého.
Pri tejto očkovacej látke sa môžu objaviť nasledujúce vedľajšie účinky:
♦ Časté (môžu sa vyskytovať pri menej ako 1 z 10 dávok očkovacej látky):
• hnačka
• podráždenosť
♦ Menej časté (môžu sa vyskytovať pri menej ako 1 zo 100 dávok očkovacej látky):
• bolesť brucha (pozri tiež príznaky veľmi zriedkavého vedľajšieho účinku – intususcepcie)
• plynatosť
• zápal kože
Vedľajšie účinky, ktoré sa hlásili počas používania Rotarixu na trhu zahŕňajú:
• Veľmi zriedkavé: intususcepcia (časť čreva sa zablokuje alebo skrúti). Príznaky môžu zahŕňať závažnú bolesť žalúdka, pretrvávajúce vracanie, krv v stolici, opuchnuté brucho a/alebo vysokú horúčku. Ak u vášho dieťaťa spozorujete jeden z týchto príznakov, ihneď kontaktujte lekára/zdravotníckeho pracovníka.
• krv v stolici
• u veľmi predčasne narodených detí (narodené pred alebo vrátane 28. týždňa tehotenstva) sa môžu v priebehu 2-3 dní po očkovaní vyskytovať dlhšie prestávky v dýchaní ako obvykle.
• deti so zriedkavým dedičným ochorením, nazývaným ťažká kombinovaná imunodeficiencia (SCID), môžu mať zapálený žalúdok alebo črevo (gastroenteritída) a stolicou môžu vylučovať vírus očkovacej látky. Príznaky gastroenteritídy môžu zahŕňať pocit nevoľnosti, vracanie, žalúdočné kŕče alebo hnačku.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať Rotarix
Túto očkovaciu látku uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na škatuli. Dátum
exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Po otvorení sa má očkovacia látka použiť okamžite.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Rotarix obsahuje
- Liečivo je:
Ľudský kmeň rotavírusu RIX4414 (živý, oslabený)* nie menej ako 106,0 CCID50
*Kultivovaný na bunkách Vero
- Ďalšie zložky Rotarixu sú sacharóza (pozri tiež časť 2, Rotarix obsahuje sacharózu), adipan disodný, Dulbeccova modifikácia Eaglovho média (DMEM), sterilná voda
Ako vyzerá Rotarix a obsah balenia
Perorálna suspenzia.
Rotarix sa dodáva ako číra a bezfarebná tekutina v jednodávkovej stlačiteľnej tube (1,5 ml). Rotarix je dostupný v balení po 1, 10 alebo 50 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutiaoregistráciiavýrobca
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gique/België/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB
Tel. +370 5 264 90 00
inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД
Тел. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Tél/Tel: + 32 10 85 52 00
Č
eská republika
GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11
cz
.info@gsk.comMagyarországGlaxoSmithKline Kft. Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
E
esti
GlaxoSmithKline Eesti OÜ
Tel: +372 667 6900
estonia@gsk.comNorgeGlaxoSmithKline AS
Tlf: + 47 22 70 20 00
Ε
λλάδα
GlaxoSmithKline A.E.B.E.
Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH.
Tel: + 43 (0)1 97075 0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comHrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999
PortugalSmith Kline & French Portuguesa, Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.comRomâniaGlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00 medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími : +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11 recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 (0)45 9218 111
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií:
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.-------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Očkovacia látka sa dodáva ako číra, bezfarebná tekutina, bez viditeľných častíc, určená na
perorálnepodanie.
Očkovacia látka je pripravená na použitie (nevyžaduje sa rekonštitúcia ani zriedenie).
Očkovacia látka sa podáva
perorálne bez zmiešania s akýmikoľvek inými očkovacími látkami alebo
roztokmi.
Očkovacia látka sa má opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na podanie očkovacej látky:
Pred podaním očkovacej látky si prosím prečítajte všetky nižšie uvedené pokyny.
A Čo potrebujete urobiť pred podaním Rotarixu

• Skontrolujte dátum exspirácie.
• Skontrolujte, či tuba nie je poškodená alebo otvorená.
• Skontrolujte, či je tekutina číra a bezfarebná, bez akýchkoľvek čiastočiek v nej.
Ak si všimnete čokoľvek nezvyčajné, nepoužívajte očkovaciu
látku.
• Očkovacia látka sa podáva perorálne (ústami) – priamo z tuby.
• Je pripravená na podanie – nepotrebujete ju miešať
s ničím.
B Pripravte tubu na použitie 1. Potiahnutím odstráňte kryt
1. Potiahnutím odstráňte kryt• Kryt si ponechajte – potrebujete ho na prepichnutie membrány.
• Držte tubu vo zvislej polohe.
2. Opakovane poklepkajte prstom po hornej časti tuby, aby ste z nej odstránili akúkoľvek tekutinu• Odstráňte akúkoľvek tekutinu z najužšej časti tuby tak, že poklepkáte prstom tesne pod membránou.
Membrána

Tuba Hrot Kryt
3. Dajte kryt do polohy, v ktorej otvorí tubu
• Tubu stále držte vo zvislej polohe.
• Držte tubu po stranách.
• Vo vnútri hornej časti krytu je malý hrot – v strede.
• Obráťte kryt hornou časťou nadol (180°).
Membrána
Hrot
4. Otvorte tubu
• Nie je potrebné, aby ste krytom točili. Zatlačte kryt smerom nadol, aby ste prepichli membránu.
• Potom kryt vytiahnite.
C Skontrolujte, či sa tuba otvorila správne. 1. Skontrolujte prepichnutie membrány
1. Skontrolujte prepichnutie membrány• Na vrchu tuby by mal byť otvor.
2. Čo treba robiť, ak sa membrána neprepichla.• Ak sa membrána neprepichla, vráťte sa k časti B
a opakujte kroky 2, 3 a 4.
D Podanie očkovacej látky
• Po otvorení tuby skontrolujte, či je tekutina číra, bez akýchkoľvek čiastočiek v nej.
Ak si všimnete čokoľvek nezvyčajné, očkovaciu látku
nepoužívajte.
• Ihneď podajte očkovaciu látku.
1. Poloha dieťaťa pri podaní očkovacej látky• Posaďte dieťa jemne zaklonené dozadu.
2. Podanie očkovacej látky• Vytlačte tekutinu do úst dieťaťa – smerom do vnútornej strany líca.
• Možno bude potrebné stlačiť tubu niekoľkokrát, aby ste všetku tekutinu dostali von – je v poriadku, ak v ústí
tuby zostane kvapka
Zatlačte kryt smerom nadol
Otvor
Len na perorálne podanie

Zlikvidujte prázdnu tubu a kryt v nádobách určených na biologický odpad v súlade s miestnymi
predpismi.
Písomná informácia pre používateľa
R
otarix perorálna suspenzia vo viacdávkovom obale s jednodávkovými stlačiteľnými tubami
(
5 jednotlivých dávok) spojenými prúžkom
Rotavírusová očkovacia látka (živá)
Pozorne si prečítajte celú písomnú informáciu predtým, ako vaše dieťa dostane túto očkovaciu
látku, pretože obsahuje pre vás dôležité informácie.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znova prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Táto očkovacia látka bola predpísaná iba vášmu dieťaťu. Nedávajte ju nikomu inému.
- Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej
informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:
1. Čo je Rotarix a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
3. Ako sa Rotarix podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Rotarix
6. Obsah balenia a ďalšie informácie
1. Čo je Rotarix a na čo sa používa
Rotarix je vírusová očkovacia látka, obsahujúca živý, oslabený ľudský rotavírus, ktorá pomáha chrániť
vaše dieťa, od 6 týždňov života, pred gastroenteritídou (hnačkou a dávením) spôsobenou
rotavírusovou infekciou.
Ako Rotarix účinkuje:
Rotavírusová infekcia je najčastejšou príčinou ťažkej hnačky u dojčiat a malých detí. Rotavírus sa ľahko šíri z ruky do úst v dôsledku kontaktu so stolicou infikovanej osoby. Väčšina detí s rotavírusovou hnačkou sa uzdraví sama. U niektorých detí sa však vyvinie závažné ochorenie s ťažkým vracaním, hnačkou a stratou tekutín ohrozujúcou život, ktoré vyžaduje hospitalizáciu.
Keď jedinec dostane očkovaciu látku, imunitný systém (prirodzená obrana tela) si vytvorí protilátky proti najčastejšie sa vyskytujúcim typom rotavírusu. Tieto protilátky chránia pred ochorením spôsobeným týmito typmi rotavírusu.
Tak ako všetky očkovacie látky, Rotarix nemusí úplne chrániť všetkých ľudí, ktorí sú preventívne očkovaní proti rotavírusovým infekciám.
2. Čo potrebujete vedieť predtým, ako vaše dieťa dostane Rotarix
Nepoužívajte Rotarix:
• ak vaše dieťa malo v minulosti alergickú reakciu na rotavírusovú očkovaciu látku alebo na ktorúkoľvek z ďalších zložiek tejto očkovacej látky (uvedených v časti 6). Prejavy alergickej reakcie môžu zahrňovať svrbivé kožné vyrážky, dýchacie ťažkosti a opuch tváre alebo jazyka.
• ak vaše dieťa malo v minulosti intususcepciu (črevná nepriechodnosť, pri ktorej sa jedna časť čreva vsunie do susednej časti).
• ak sa vaše dieťa narodilo s chybou čreva, ktorá by mohla viesť k intususcepcii.
• ak má vaše dieťa zriedkavé dedičné ochorenie, ktoré postihuje jeho imunitný systém, nazývané ťažká kombinovaná imunodeficiencia (SCID).
• ak vaše dieťa má ťažkú infekciu s vysokou horúčkou. Možno bude potrebné odložiť očkovanie až dovtedy, kým sa neuzdraví. Slabá infekcia ako napríklad nádcha by nemala byť problémom, ale porozprávajte sa o tom najskôr s vaším lekárom.
• ak vaše dieťa má hnačku alebo vracia. Možno bude potrebné odložiť očkovanie až dovtedy,
kým sa neuzdraví.
Upozornenia a opatrenia
Predtým, ako vaše dieťa dostane Rotarix, obráťte sa na svojho lekára/zdravotníckeho pracovníka, ak:
• on/ona je v blízkom kontakte s jedincom, napríklad s členom domácnosti, ktorý má oslabený imunitný systém, napr. s jedincom s rakovinou alebo ktorý užíva lieky, ktoré môžu oslabiť imunitný systém.
• on/ona má akúkoľvek poruchu žalúdočno-črevného systému.
• on/ona nepriberá a nerastie tak, ako sa očakáva.
• on/ona má akékoľvek ochorenie alebo užíva akýkoľvek liek, ktorý znižuje jeho odolnosť voči
infekcii.
Ak vaše dieťa pociťuje závažnú bolesť brucha, stále vracia, má krv v stolici, opuch brucha a/alebo vysokú horúčku potom ako dostalo Rotarix, ihneď kontaktujte lekára/zdravotníckeho pracovníka (pozri tiež časť 4 „Možné vedľajšie účinky“).
Tak ako vždy, dbajte, prosím, na dôkladné umytie rúk po výmene zašpinených plienok.
Iné lieky a Rotarix
Ak vaše dieťa teraz užíva, alebo v poslednom čase užívalo, či práve bude užívať ďalšie lieky alebo
v poslednom čase dostalo ešte inú očkovaciu látku, povedzte to svojmu lekárovi.
Rotarix sa môže vášmu dieťaťu podať súčasne s ďalšími bežne odporúčanými očkovacími látkami, ako sú očkovacia látka proti záškrtu, tetanu, pertussis (dávivému kašľu), očkovacia látka proti Haemophilus influenzae typ b, perorálna alebo inaktivovaná očkovacia látka proti detskej obrne, očkovacia látka proti hepatitíde B ako aj konjugovaná očkovacia látka proti pneumokokom a konjugovaná očkovacia látka proti meningokokom séroskupiny C.
Rotarix a jedlo a nápoje
Nie sú žiadne obmedzenia týkajúce sa jedla alebo tekutín, ktoré dojča konzumuje, pred očkovaním ani
po ňom.
Dojčenie
Na základe dôkazov získaných v klinických štúdiách, dojčenie neznižuje Rotarixom poskytnutú
ochranu pred rotavírusovou gastroenteritídou. Z tohto dôvodu sa počas očkovacej schémy môže
pokračovať v dojčení.
Rotarix obsahuje sacharózu
Ak vám lekár povedal, že dieťa, ktoré má byť očkované, zle znáša niektoré cukry, obráťte sa na svojho
lekára skôr, ako vaše dieťa dostane túto očkovaciu látku.
3. Ako sa Rotarix podáva
Odporúčanú dávku Rotarixu podá vášmu dieťaťu lekár alebo zdravotná sestra. Vaše dieťa užije očkovaciu látku (1,5 ml tekutiny) ústami. Táto očkovacia látka sa nesmie za žiadnych okolností podať injekciou.
Vaše dieťa dostane dve dávky očkovacej látky. Každá dávka bude podaná na osobitnej návšteve
a medzi podaním dvoch dávok bude časový odstup najmenej 4 týždne. Prvá dávka sa môže podať vo veku od 6 týždňov. Obidve dávky očkovacej látky sa musia podať do veku 24 týždňov, aj keď sa prednostne majú podať pred dosiahnutím veku 16 týždňov.
Rotarix sa môže podať podľa rovnakej očkovacej schémy dojčatám, ktoré sa narodili predčasne, pod podmienkou, že tehotenstvo trvalo aspoň 27 týždňov.
V prípade, že vaše dieťa vypľuje alebo po prehltnutí okamžite vyvracia väčšinu očkovacej látky, môže
sa na tej istej očkovacej návšteve podať jednorazová náhradná dávka.
Keď sa Rotarix podá vášmu dieťaťu ako prvá dávka, odporúča sa, aby vaše dieťa dostalo Rotarix (a nie inú rotavírusovú očkovaciu látku) aj ako druhú dávku.
Je dôležité, aby ste sa riadili pokynmi vášho lekára alebo zdravotnej sestry týkajúcimi sa
naplánovaných návštev. Ak zabudnete prísť k lekárovi v naplánovanom čase, požiadajte ho o radu.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj táto očkovacia látka môže spôsobovať vedľajšie účinky, hoci sa neprejavia
u každého.
Pri tejto očkovacej látke sa môžu objaviť nasledujúce vedľajšie účinky:
♦ Časté (môžu sa vyskytovať pri menej ako 1 z 10 dávok očkovacej látky):
• hnačka
• podráždenosť
♦ Menej časté (môžu sa vyskytovať pri menej ako 1 zo 100 dávok očkovacej látky):
• bolesť brucha (pozri tiež príznaky veľmi zriedkavého vedľajšieho účinku – intususcepcie)
• plynatosť
• zápal kože
Vedľajšie účinky, ktoré sa hlásili počas používania Rotarixu na trhu zahŕňajú:
• Veľmi zriedkavé: intususcepcia (časť čreva sa zablokuje alebo skrúti). Príznaky môžu zahŕňať závažnú bolesť žalúdka, pretrvávajúce vracanie, krv v stolici, opuchnuté brucho a/alebo vysokú horúčku. Ak u vášho dieťaťa spozorujete jeden z týchto príznakov, ihneď kontaktujte lekára/zdravotníckeho pracovníka.
• krv v stolici
• u veľmi predčasne narodených detí (narodené pred alebo vrátane 28. týždňa tehotenstva) sa môžu v priebehu 2-3 dní po očkovaní vyskytovať dlhšie prestávky v dýchaní ako obvykle.
• deti so zriedkavým dedičným ochorením, nazývaným ťažká kombinovaná imunodeficiencia (SCID), môžu mať zapálený žalúdok alebo črevo (gastroenteritída) a stolicou môžu vylučovať vírus očkovacej látky. Príznaky gastroenteritídy môžu zahŕňať pocit nevoľnosti, vracanie, žalúdočné kŕče alebo hnačku.
Hlásenie vedľajších účinkov
Ak sa u vášho dieťaťa vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo
lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať Rotarix
Túto očkovaciu látku uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na škatuli. Dátum
exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C - 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Po otvorení sa má očkovacia látka použiť okamžite.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Rotarix obsahuje
- Liečivo je:
Ľudský kmeň rotavírusu RIX4414 (živý, oslabený)* nie menej ako 106,0 CCID50
*Kultivovaný na bunkách Vero
- Ďalšie zložky Rotarixu sú sacharóza (pozri tiež časť 2, Rotarix obsahuje sacharózu), adipan disodný, Dulbeccova modifikácia Eaglovho média (DMEM), sterilná voda
Ako vyzerá Rotarix a obsah balenia
Perorálna suspenzia.
Rotarix sa dodáva ako číra a bezfarebná tekutina v 5 jednodávkových stlačiteľných tubách
(5 x 1,5 ml).
Rotarix je dostupný v balení po 50 túb.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutiaoregistráciiavýrobca
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgicko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gique/België/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
LietuvaGlaxoSmithKline Lietuva UAB Tel. +370 5 264 90 00 inf
o.lt@gsk.com
Б
ъл
гария
ГлаксоСмитКлайн ЕООД Тел. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Č
eská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
D
anmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00
dk-info@gsk.comMaltaGlaxoSmithKline (Malta) Ltd
Tel: + 356 21 238131
D
eutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701
produkt
.info@gsk.comNederlandGlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100
nlinfo@gsk.com
E
esti
GlaxoSmithKline Eesti OÜ Tel: +372 667 6900
estonia@gsk.comNorgeGlaxoSmithKline AS Tlf: + 47 22 70 20 00
Ε
λλάδα
GlaxoSmithKline A.E.B.E. Tηλ: + 30 210 68 82 100
ÖsterreichGlaxoSmithKline Pharma GmbH. Tel: + 43 (0)1 97075 0
at
.info@gsk.com
E
spaña
GlaxoSmithKline, S.A. Tel: + 34 902 202 700
es-ci@gsk.comPolskaGSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000
F
rance
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
diam@gsk.comHrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999
PortugalSmith Kline & French Portuguesa, Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
FI
.PT@gsk.comRomâniaGlaxoSmithKline (GSK) SRL
Tel: +40 (0)21 3028 208
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
SlovenijaGlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00
medical
.x.si@gsk.com
Ísland
Vistor hf.
Sími : +354 535 7000
Slovenská republikaGlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11
recepci
a.sk@gsk.com
Italia
GlaxoSmithKline S.p.A.
Tel:+ 39 (0)45 9218 111
Suomi/FinlandGlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Finl
and.tuoteinfo@gsk.com
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií:
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.------------------------------------------------------------------------------------------------------------------------- Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Očkovacia látka sa dodáva ako číra, bezfarebná tekutina, bez viditeľných častíc, určená na
perorálnepodanie.
Očkovacia látka je pripravená na použitie (nevyžaduje sa rekonštitúcia ani zriedenie).
Očkovacia látka sa podáva
perorálne bez zmiešania s akýmikoľvek inými očkovacími látkami alebo
roztokmi.
Očkovacia látka sa má opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálny fyzikálny vzhľad. V prípade ich výskytu sa musí očkovacia látka zlikvidovať.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na podanie očkovacej látky:
Pred podaním očkovacej látky si prečítajte, prosím, všetky nižšie uvedené pokyny.
• Táto očkovacia látka sa podáva perorálne (ústami) priamo z jednotlivej tuby.
• Jedna perorálna tuba obsahuje jednu dávku očkovacej látky.
• Táto očkovacia látka je pripravená na použitie – nemiešajte ju s ničím.
 A
. Čo potrebujete urobiť pred podaním Rotarixu
A
. Čo potrebujete urobiť pred podaním Rotarixu
1. Skontrolujte dátum exspirácie na spojovacom prúžku.
2. Skontrolujte, či je tekutina v perorálnych tubách číra a bezfarebná, bez akýchkoľvek čiastočiek v nej.
-
Ak si všimnete čokoľvek nezvyčajné, nepoužívajtežiadnu z perorálnych túb na spojovacom prúžku.3. Skontrolujte, či každá jednotlivá perorálna tuba nie je poškodená a či je stále uzatvorená.
-
Ak si na niektorej perorálnej tube všimnete čokoľvek nezvyčajné, nepoužívajte ju.Spojovací prúžokHrdlo Telo ÚchytkaDátum exspirácie: DD/MM/RRJednodávková perorálna tuba
 B. Pripravte si perorálnu tubu
B. Pripravte si perorálnu tubu
1. Oddeľte jednu perorálnu tubu od ostatných, pričom
začnite od kraja:
a) Chyťte úchytku jednej z krajných perorálnych túb, aby ste ju oddelili od ostatných.
b) Druhou rukou chyťte úchytku perorálnej tuby, ktorá
je vedľa nej.
c) Potiahnite úchytku a odtrhnite ju od vedľajšej perorálnej tuby.
Dátum exspirácie: D/MM/RR Potiahnuť
Potiahnuť
2. Otvorte oddelenú perorálnu tubu:
d) Držte oddelenú perorálnu tubu vo zvislej polohe. e) Držte úchytku oddelenej perorálnej tuby jednou rukou a spojovací prúžok druhou rukou.
Nedržte telo perorálnej tuby, mohli by ste vytlačiť trochu očkovacej látky.f) Otočte oddelenú perorálnu tubu.
g) Vytiahnite ju zo spojovacieho prúžka.
Otočiť Vytiah-nuť
C
. Podajte očkovaciu látku perorálne ihneď po otvorení
 tuby
tuby
1. Poloha dieťaťa pri podaní očkovacej látky:
• Posaďte dieťa jemne zaklonené dozadu.
2. Perorálne podanie očkovacej látky:
• Jemne vytlačte tekutinu do úst dieťaťa, smerom
do vnútornej strany líca.
• Možno bude potrebné stlačiť tubu niekoľkokrát, aby ste všetku tekutinu dostali von – je
v poriadku, ak v perorálnej tube zostane kvapka.
Len naperorálnepodanie
 D
. Zvyšné dávky ihneď uchovávajte v chladničke
D
. Zvyšné dávky ihneď uchovávajte v chladničke
Nepoužité perorálne tuby, ktoré sú stále pripojené
k spojovaciemu prúžku, sa po použití perorálnej tuby musia ihneď vložiť späť do chladničky. Je to dôležité kvôli tomu, aby sa nepoužité perorálne tuby mohli použiť na ďalšie očkovanie.
Zlikvidujte použité perorálne tuby v nádobách určených na biologický odpad
v súlade s miestnymi predpismi.
Ihneď vložte späť do chladničky2°C až 8°C