nických štúdiách sa preukázalo, že zníženie dávky levodopy môže zlepšiť dyskinézu (pozri tiež časť 4.8).
Ak sa prechádza na liečbu ropinirolom z liečby iným agonistom dopamínu, pred začatím liečby ropinirolom sa majú dodržať pokyny výrobcu týkajúce sa vysadenia lieku.
Tak ako u iných dopamínových agonistov, ropinirol má byť postupne redukovaný znižovaním počtu denných dávok v priebehu 1 týždňa.
Pre dávky, ktoré sa nedajú uskutočniť s týmto liekom, sú k dispozícii iné sily tohto lieku.
Syndróm nepokojných nôh (RLS)Ropinirol sa má užívať bezprostredne pred spaním, avšak dávku je možné užiť až do 3 hodín pred uložením sa na spanie. Ropinirol je možné užiť s jedlom, aby sa zlepšila gastrointestinálna znášanlivosť.
Začiatok liečby (1. týždeň)Odporúčaná začiatočná dávka je 0,25 mg jedenkrát denne (podaná tak, ako je uvedené vyššie) po dobu 2 dní. Ak je táto dávka dobre znášaná, má sa zvýšiť na 0,5 mg jedenkrát denne po zvyšok prvého týždňa.
Terapeutický režim (od 2. týždňa)Po začiatku liečby sa má denná dávka zvyšovať, až kým sa nedosiahne optimálny terapeutický účinok. Priemerná dávka v klinických štúdiách u pacientov so stredne závažným až závažným syndrómom nepokojných nôh bola 2 mg jedenkrát denne.
Dávku je možné v 2. týždni zvýšiť na 1 mg jedenkrát denne. Následne možno dávku zvyšovať o 0,5 mg týždenne počas nasledujúcich dvoch týždňov až po dávku 2 mg jedenkrát denne. U niektorých pacientov je na dosiahnutie optimálneho zlepšenia možné postupne zvyšovať dávku až po maximálne 4 mg jedenkrát denne. V klinických štúdiách bola dávka zvyšovaná o 0,5 mg každý týždeň na 3 mg jedenkrát denne a potom o 1 mg až po maximálnu odporúčanú dávku 4 mg jedenkrát denne, ako je uvedené v Tabuľke 1.
Dávky vyššie ako 4 mg jedenkrát denne neboli skúmané u pacientov so syndrómom nepokojných nôh.
Tabuľka 1: Titrácia dávky Týždeň
| 2
| 3
| 4
| 5*
| 6*
| 7*
|
Dávka (mg) / jedenkrát denne
| 1
| 1,5
| 2
| 2,5
| 3
| 4
|
* Na dosiahnutie optimálneho zlepšenia u niektorých pacientov.
Účinnosť liečby ropinirolom sa nepreukázala dlhšie ako 12 týždňov (pozri časť 5.1). Odpoveď pacienta na liečbu ropinirolom sa má vyhodnotiť po 12-týždňovej liečbe a potreba pokračujúcej liečby sa má zvážiť. V prípade, ak sa liečba preruší na viac ako niekoľko dní, má sa začať opätovnou titráciou dávky tak, ako je uvedené vyššie.
Pediatrická populácia
Ropinirol sa neodporúča používať u detí a dospievajúcich mladších ako 18 rokov kvôli chýbajúcim údajom o bezpečnosti a účinnosti.
Starší pacienti
U pacientov vo veku 65 alebo viac rokov je klírens ropinirolu znížený o približne 15 %. Aj keď sa úprava dávky nevyžaduje, dávku ropinirolu treba titrovať individuálne, so starostlivým sledovaním znášanlivosti, až do optimálnej klinickej odpovede.
Porucha funkcie obličiekU pacientov s miernou až stredne závažnou poruchou funkcie obličiek (klírens kreatinínu 30‑50 ml/min) sa nepozorovali žiadne zmeny klírensu ropinirolu, čo preukazuje, že v tejto populácii nie je potrebná žiadna úprava dávkovania.
Parkinsonova chorobaŠtúdia zameraná na používanie ropinirolu u pacientov v terminálnom štádiu ochorenia obličiek (pacienti podstupujúci hemodialýzu) preukázala, že u týchto pacientov je potrebná úprava dávky nasledovným spôsobom: úvodná dávka ropinirolu má byť 0,25 mg trikrát denne. Ďalšie zvyšovanie dávky má byť na základe znášanlivosti a účinnosti. Odporúčaná maximálna dávka je u pacientov podstupujúcich pravidelnú hemodialýzu 18 mg/deň. Dodatočné dávky po hemodialýze sa nevyžadujú (pozri časť 5.2).
Syndróm nepokojných nôhŠtúdia zameraná na používanie ropinirolu u pacientov v terminálnom štádiu ochorenia obličiek (pacienti podstupujúci hemodialýzu) preukázala, že u týchto pacientov je potrebná úprava dávky nasledovným spôsobom: odporúčaná úvodná dávka ropinirolu je 0,25 mg jedenkrát denne. Ďalšie zvyšovanie dávky má byť na základe znášanlivosti a účinnosti. Odporúčaná maximálna dávka ropinirolu je u pacientov podstupujúcich pravidelnú hemodialýzu 3 mg/deň. Dodatočné dávky po hemodialýze sa nevyžadujú (pozri časť 5.2).
Používanie ropinirolu u pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu menej ako 30 ml/min) bez pravidelnej hemodialýzy sa neštudovalo.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Závažné poškodenie funkcie obličiek (klírens kreatinínu < 30 ml/min) bez pravidelnej hemodialýzy
- Poškodenie funkcie pečene.
4.4
Osobitné upozornenia a opatrenia pri používaní Ropinirol sa spája so somnolenciou a epizódami náhleho nástupu spánku, obzvlášť u pacientov s Parkinsonovou chorobou. Zaznamenali sa (menej často) hlásenia náhleho nástupu spánku počas denných aktivít. V niektorých prípadoch sa takéto epizódy objavili bez akýchkoľvek varovných príznakov alebo bez povedomia pacienta. Pacienti musia byť o tejto skutočnosti poučení a upozornení, aby boli opatrní pri vedení vozidiel alebo obsluhe strojov počas liečby ropinirolom. Pacienti, u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho nástupu spánku, nesmú viesť vozidlo alebo obsluhovať stroje. Okrem toho je potrebné zvážiť zníženie dávkovania alebo prerušenie liečby.
Pacienti so závažnými psychiatrickými alebo psychotickými poruchami, alebo tí, ktorí majú tieto poruchy v anamnéze, sa majú liečiť dopamínovými agonistami len vtedy, ak potenciálne prínosy prevažujú riziká.
Impulzívne poruchyPacientov je potrebné pravidelne sledovať z dôvodu rozvoja impulzívnych porúch. Pacienti a opatrovatelia majú byť upozornení na to, že u pacientov liečených dopamínovými agonistami, vrátane ropinirolu, sa môžu vyskytnúť behaviorálne príznaky impulzívnych porúch, vrátane patologického hráčstva, zvýšeného libida, hypersexuality, nadmerného míňania alebo nakupovania, prejedania sa a chorobnej chuti do jedla. Ak sa rozvinú takéto príznaky, je potrebné zvážiť zníženie dávky/ukončenie liečby postupným redukovaním dávky.
Z dôvodu rizika hypotenzie sa u pacientov so závažným kardiovaskulárnym ochorením (obzvlášť s koronárnou insuficienciou) odporúča monitorovanie krvného tlaku, najmä na začiatku liečby.
Súbežné podávanie ropinirolu s antihypertenzívami a antiarytmikami sa neštudovalo. Tak ako pri iných dopaminergných liekoch, pri súbežnom podávaní týchto liečiv s ropinirolom je potrebná opatrnosť z dôvodu neznámeho potenciálu pre výskyt hypotenzie, bradykardie alebo iných arytmií.
Ropinirol sa nemá používať na liečbu akatízie spôsobenej neuroleptikami, tazikinézie (neuroleptikami indukovanej nutkavej potreby chodiť) alebo sekundárneho syndrómu nepokojných nôh (napr. vyvolaného v dôsledku renálneho zlyhania, anémie z nedostatku železa, alebo gravidity).
Počas liečby ropinirolom sa môže pozorovať paradoxné zhoršenie príznakov syndrómu nepokojných nôh s včasným nástupom (augmentácia), a opätovný výskyt príznakov v skorých ranných hodinách (včasný ranný rebound). V prípade výskytu takýchto ťažkostí je potrebné prehodnotiť liečbu a zvážiť úpravu dávkovania alebo prerušenie liečby.
Ropinirol sa má u pacientov so stredne závažnou poruchou funkcie pečene podávať s opatrnosťou. Nežiaduce účinky sa majú pozorne sledovať.
Tento liek obsahuje laktózu. Pacienti so zriedkavými dedičnými poruchami intolerancie galaktózy, laponským deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nemajú užívať tento liek.
4.5 Liekové a iné interakcie
Medzi ropinirolom a levodopou alebo domperidónom nie je žiadna farmakokinetická interakcia, ktorá by vyžadovala úpravu dávkovania niektorého z týchto liečiv. Domperidón antagonizuje dopaminergné účinky ropinirolu periférne a neprestupuje cez hematoencefalickú bariéru. Preto má u pacientov liečených centrálne pôsobiacimi agonistami dopamínu význam ako antiemetikum.
Neuroleptiká a iní centrálne pôsobiaci antagonisti dopamínu, ako sú sulpirid a metoklopramid, môžu znižovať účinnosť ropinirolu, a preto sa má vyhnúť súbežnému užívaniu týchto liečiv s ropinirolom.
U pacientiek užívajúcich vysoké dávky estrogénov boli pozorované zvýšené hladiny ropinirolu v plazme. U pacientiek, ktoré už dostávajú hormonálnu substitučnú liečbu (HRT), sa liečba ropinirolom môže začať obvyklým spôsobom. Ak sa však HRT ukončí alebo ak sa zavádza v priebehu liečby ropinirolom, môže byť potrebná úprava dávky ropinirolu na základe odpovede na liečbu.
Ropinirol sa metabolizuje hlavne prostredníctvom izoenzýmu CYP 1A2 cytochrómu P450. Jedna farmakokinetická štúdia u pacientov s Parkinsonovou chorobou (ktorí dostávali dávku 2 mg ropinirolu trikrát denne) preukázala, že po súbežnom podávaní ciprofloxacínu sa zvýšili hodnoty ropinirolu C
max o 60 % a AUC o 84 %. Z tohto dôvodu existuje potenciálne riziko nežiaducich účinkov. Pri súbežnom podávaní liečiv, ktoré inhibujú CYP 1A2 (ako sú ciprofloxacín, enoxacín alebo fluvoxamín), môže byť preto u pacientov, ktorí už užívajú ropinirol, potrebné zníženie dávky ropinirolu. To platí taktiež pri vysadzovaní týchto liekov.
Farmakokinetická interakčná štúdia u pacientov s Parkinsonovou chorobou medzi ropinirolom (pri dávke 2 mg trikrát denne) a teofylínom (substrátom CYP 1A2) neodhalila žiadne zmeny vo farmakokinetike ropinirolu ani teofylínu.
Na základe
in vitro údajov má ropinirol malý potenciál inhibovať cytochróm P450 pri terapeutických dávkach. Preto je nepravdepodobné, že by ropinirol ovplyvňoval farmakokinetiku iných liečiv prostredníctvom mechanizmu cytochrómu P450.
Je známe, že fajčenie indukuje metabolizmus CYP 1A2, preto ak pacienti prestanú alebo začnú fajčiť v priebehu liečby ropinirolom, môže byť potrebná úprava dávky.
4.6
Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii dostatočné údaje o použití ropinirolu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Keďže potenciálne riziko u ľudí nie je známe, neodporúča sa užívať ropinirol počas gravidity, pokiaľ potenciálny prínos liečby pre pacientku nepreváži možné riziko pre plod.
LaktáciaDojčiace matky nemajú užívať ropinirol, pretože môže inhibovať laktáciu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacienti liečení ropinirolom, u ktorých sa prejavila somnolencia a/alebo epizódy náhleho spánku musia byť poučení, aby sa vyhli vedeniu vozidiel a zapájaniu sa do činností, pri ktorých narušená bdelosť môže pre nich alebo pre ostatné osoby predstavovať riziko závažných zranení alebo úmrtia (napr. obsluha strojov) až dovtedy, kým sa takéto opakované epizódy a somnolencia nevyriešia (pozri tiež časť 4.4).
4.8 Nežiaduce účinky
Nežiaduce účinky sú uvedené nižšie podľa triedy orgánových systémov a frekvencie. Frekvencia nežiaducich účinkov je zoradená podľa nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000) a veľmi zriedkavé (< 1/10 000), neznáme: z dostupných údajov.
V rámci jednotlivých skupín frekvencie sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Užívanie ropinirolu pri syndróme nepokojných nôh Najčastejšou nežiaducou reakciou v klinických štúdiách týkajúcich sa syndrómu nepokojných nôh bola nauzea (približne u 30 % pacientov). Nežiaduce účinky boli zvyčajne mierne až stredne závažné a vyskytovali sa na začiatku liečby alebo pri zvýšení dávkovania, niekoľko pacientov muselo v dôsledku nežiaducich účinkov zo štúdie odstúpiť.
Tabuľka 2 uvádza nežiaduce reakcie lieku hlásené pri ropinirole v rámci klinických štúdií počas 12 týždňov s výskytom o ³ 1,0 % vyšším v porovnaní s placebom alebo nežiaduce účinky hlásené menej často, u ktorých je ale známa súvislosť s ropinirolom.
Tabuľka 2 Nežiaduce reakcie lieku hlásené v 12-týždňových klinických štúdiách syndrómu nepokojných nôh (ropinirol n=309, placebo n=307)
Psychické poruchy |
Časté
| Nervozita
|
Menej časté
| Zmätenosť
|
Poruchy nervového systému |
Časté
| Synkopa, somnolencia, závraty (vrátane vertiga)
|
Poruchy ciev |
Menej časté
| Posturálna hypotenzia, hypotenzia
|
Poruchy gastrointestinálneho traktu |
Veľmi časté
| Vracanie, nauzea
|
Časté
| Abdominálna bolesť
|
Celkové poruchy a reakcie v mieste podania |
Časté
| Únava
|
Tabuľka 3 Nežiaduce reakcie lieku hlásené v iných klinických štúdiách syndrómu nepokojných nôh
Psychické poruchy |
Menej časté
| Halucinácie
|
Poruchy nervového systému |
Časté
| Augmentácia, včasný ranný rebound (pozri časť 4.4)
|
Liečba nežiaducich účinkovU pacientov, u ktorých sa zaznamenajú významné nežiaduce účinky, sa má zvážiť zníženie dávky. Ak sa nežiaduci účinok zmierni, je možné opätovne zahájiť postupnú titráciu dávky smerom nahor. V prípade potreby je možné použiť antiemetiká, ako je domperidón, ktoré nie sú centrálne pôsobiaci antagonisti dopamínu,
Halucinácie boli v dlhodobých otvorených (open label) štúdiách pozorované menej často.
Počas liečby ropinirolom sa môže pozorovať paradoxné zhoršenie príznakov syndrómu nepokojných nôh, vyskytujúce sa s včasným nástupom (augmentácia) a opätovný výskyt príznakov v skorých ranných hodinách (včasný ranný rebound).
Ropinirol je indikovaný aj na liečbu Parkinsonovej choroby. Nežiaduce reakcie lieku hlásené u pacientov s Parkinsonovou chorobou liečených monoterapiou ropinirolom a prídavnou liečbou v dávkach až do 24 mg/deň v incidencii vyššej ako bolo pozorované pri placebe sú opísané nižšie.
|
| Použitie v štúdiách monoterapie
| Použitie v štúdiách prídavnej liečby
|
Poruchy imunitného systému
|
Neznáme
| Reakcie z precilivenosti vrátane urtikárie, angioedému, vyrážky, pruritu
|
|
|
Psychické poruchy
|
Časté
| Halucinácie
|
| Zmätenosť
|
Menej časté
| Psychotické reakcie (iné než halucinácie) vrátane delíria, bludov, paranoje.
Impulzívne poruchy vrátane patologického hráčstva, hypersexuality a zvýšeného libida boli hlásené po uvedení lieku na trh (pozri časť 4.4).
|
|
|
Poruchy nervového systému
|
Veľmi časté
| Somnolencia
| Synkopa
| Dyskinéza
U pacientov s pokročilou Parkinsonovou chorobou sa dyskinézy môžu vyskytnúť počas úvodnej titrácie ropinirolu. V klinických skúšaniach sa preukázalo, že zníženie dávky levodopy môže zlepšiť dyskinézu (pozri časť 4.2).
|
Časté
| Závraty (vrátane vertiga)
|
|
|
Menej časté
| Nadmerná somnolencia počas dňa, náhly nástup spánku.
Ropinirol sa spája so somnolenciou a menej často s nadmernou somnolenciou počas dňa a epizódami náhleho nástupu spánku.
|
|
|
Poruchy ciev
|
Menej časté
| Hypotenzia, posturálna hypotenzia
Hypotenzia alebo posturálna hypotenzia je zriedkavo závažná.
|
|
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
| Nauzea
|
|
|
Časté
| Pálenie záhy
| Vracanie, bolesť brucha
|
|
Poruchy pečene a žlčových ciest
|
Neznáme
| Hepatálne reakcie, hlavne zvýšená hladina pečeňových enzýmov
|
|
|
Celkové poruchy a reakcie v mieste podania
|
Časté
|
| Edém nôh
|
|
Hypersenzitívne reakcie (vrátane urtikárie, angioedému, vyrážky, pruritu).
Boli hlásené psychotické reakcie (iné než halucinácie), vrátane delíria, bludov a paranoje.
Impulzívne poruchyU pacientov liečených dopamínovými agonistami, vrátane ropinirolu, sa môže vyskytnúť patologické hráčstvo, zvýšené libido, hypersexualita, nadmerné míňanie alebo nakupovanie, prejedanie sa a chorobná chuť do jedla (pozri časť 4.4 „Osobitné upozornenia a opatrenia pri používaní“).
Ropinirol sa spája so somnolenciou a veľmi zriedkavo s nadmernou somnolenciou počas dňa a epizódami náhleho nástupu spánku.
Veľmi zriedkavo boli hlásené hepatálne reakcie, najmä zvýšené hladiny pečeňových enzýmov.
4.9 Predávkovanie
Predpokladá sa, že príznaky predávkovania ropinirolom budú súvisieť s jeho dopaminergnou aktivitou.
Tieto príznaky je možné zmierniť vhodnou liečbou dopamínovými antagonistami, ako sú neuroleptiká alebo metoklopramid.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: dopamínergné liečivá, agonista dopamínu, ATC kód: N04BC04
Mechanizmus účinku
Ropinirol je neergolínový D
2/D
3 agonista dopamínu, ktorý stimuluje striatálne dopamínové receptory.
Ropinirol zmierňuje príznaky nedostatku dopamínu, ktorý je charakteristický pre Parkinsonovu chorobu, prostredníctvom stimulácie dopamínových receptorov v striate. '
V dôsledku svojej aktivity v hypotalame a hypofýze ropinirol inhibuje sekréciu prolaktínu.
Klinická účinnosť
Syndróm nepokojných nôh Ropinirol sa má predpisovať len pacientom so stredne závažným až závažným idiopatickým syndrómom nepokojných nôh. Stredne závažný až závažný idiopatický syndróm nepokojných nôh typicky predstavuje skupina pacientov, ktorí trpia nespavosťou alebo ťažkým dyskomfortom v končatinách.
V štyroch 12-týždňových štúdiách účinnosti boli pacienti so syndrómom nepokojných nôh randomizovaní na skupiny, ktorým sa podával ropinirol alebo placebo; a účinky na IRLS skóre v 12. týždni sa porovnávali s východiskovými hodnotami. Priemerná dávka ropinirolu bola u pacientov so stredne závažným až závažným ochorením 2,0 mg/deň. V kombinovanej analýze pacientov so stredne závažným až závažným syndrómom nepokojných nôh zo štyroch 12-týždňových štúdií bol upravený rozdiel v liečbe pre zmenu celkového skóre v rámci skóre IRLS od východiskových hodnôt v 12. týždni metódou LOCF (Last Observation Carried Forward) analýzou Intention To Treat (ITT) ‑ 4,0 body (95 % CI - 5,6, - 2,4, p<0,0001; východiskové hodnoty a hodnoty v 12. týždni LOCF priemerných bodov IRLS: ropinirol 28,4 a 13,5; placebo 28,2 a 17,4).
Dvanásťtýždňová placebom kontrolovaná štúdia s využitím polysomnografie u pacientov so syndrómom nepokojných nôh sledovala účinok liečby ropinirolom na periodické pohyby nôh počas spánku. Medzi ropinirolom a placebom bol od začiatku do 12. týždňa pozorovaný štatisticky významný rozdiel v periodických pohyboch nôh počas spánku.
Kombinovaná analýza údajov u pacientov so stredne závažným až závažným syndrómom nepokojných nôh počas štyroch 12-týždňových placebom kontrolovaných štúdií ukázala, že u pacientov liečených ropinirolom sa pozorovalo významné zlepšenie v parametroch Škály lekárskych záverov štúdie porúch spánku (Medical Outcome Study Sleep Scale) (skóre v rozsahu 0
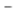
100 okrem kvantity spánku) v porovnaní s placebom. Upravené rozdiely medzi liečbou ropinirolom a placebom boli: porucha spánku (- 15,2, 95 % CI - 19,37, - 10,94; p<0,0001), kvantita spánku (0,7 hodín, 95 % CI 0,49, 0,94; p<0,0001), dostatočnosť spánku (18,6, 95 % CI 13,77, 23,45; p<0,0001) a somnolencia počas dňa (- 7,5, 95 % CI - 10,86, - 4,23; p<0,0001).
Dlhodobá účinnosť bola sledovaná v randomizovanom, dvojito zaslepenenom, placebom kontrolovanom klinickom skúšaní v trvaní 26 týždňov. Celkové výsledky bolo ťažké vysvetliť vzhľadom na významnú interakciu v strede liečby a vysoký podiel chýbajúcich údajov. Nie je možné preukázať udržanie účinnosti v porovnaní s placebom po 26 týždňoch.
Väčšina pacientov, ktorí sa zúčastnili klinických štúdií, bola kaukazského pôvodu.
Štúdia vplyvu ropinirolu na repolarizáciu srdcaCielená štúdia zameraná na QT interval vykonaná u zdravých dobrovoľníkov a dobrovoľníčok, ktorým sa podávali filmom obalené tablety (s okamžitým uvoľňovaním) ropinirolu v dávke 0,5 mg, 1 mg, 2 mg a 4 mg jedenkrát denne preukázala maximálne predĺženie QT intervalu o 3,46 milisekúnd (bodový odhad) pri 1 mg dávke oproti placebu. Horná hranica jednostranného 95 % intervalu spoľahlivosti pre najväčší priemerný vplyv bola menej ako 7,5 milisekúnd. Vplyv ropinirolu pri vyšších dávkach sa systematicky nehodnotil.
Dostupné klinické údaje z cielenej štúdie zameranej na QT interval nepoukazujú na riziko predĺženia QT intervalu pri dávkach ropinirolu do 4 mg/deň. Riziko predĺženia QT intervalu nemožno vylúčiť, keďže cielená štúdia zameraná na QT interval pri dávkach do 24 mg/deň sa neuskutočnila.
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia ropinirolu po perorálnom podaní je rýchla. Biologická dostupnosť ropinirolu je približne 50% (36 až 57%) a priemerné maximálne koncentrácie ropinirolu sa dosiahnu v priemere po 1,5 hodine po podaní dávky. Jedlo s vysokým obsahom tukov znižuje absorpciu ropinirolu, čo sa prejavuje oneskorením strednej hodnoty T
max o 2,6 hodiny a priemerným poklesom C
max o 25 %.
Distribúcia
Väzba ropinirolu na plazmatické bielkoviny je nízka (10 – 40 %).
Ropinirol preukazuje veľký distribučný objem (cca 7 l/kg) v súlade s jeho vysokou lipofilitou.
Biotransformácia
Ropinirol sa primárne odstraňuje prostredníctvom enzýmu CYP 1A2 cytochrómu P450 a jeho metabolity sa vylučujú prevažne močom. Hlavný metabolit je najmenej 100-krát menej účinný ako ropinirol u zvieracích modelov dopaminergnej funkcie.
Eliminácia
Ropinirol sa odstraňuje zo systémového obehu s priemerným polčasom eliminácie približne 6 hodín. Zvýšenie systémovej expozície (C
max a AUC) ropinirolu je približne úmerné nad rozsah terapeutických dávok. Po jednorazovanom a opakovanom podaní ropinirolu sa nepozorovala žiadna zmena perorálneho klírensu ropinirolu. Pozorovala sa široká inter-individuálna variabilita farmakokinetických parametrov.
LinearitaFarmakokinetika ropinirolu je po jednorazovom a opakovanom podaní celkovo lineárna (C
max a AUC) v terapeutickom rozmedzí dávok medzi 0,25 mg a 4 mg.
Charakteristiky súvisiace s populáciouPerorálny klírens ropinirolu je u starších pacientov (vo veku 65 alebo viac rokov) znížený približne o 15 % v porovnaní s mladšími pacientmi. Úprava dávkovania u starších pacientov nie je potrebná.
Porucha funkcie obličiekU pacientov s miernou až stredne závažnou poruchou funkcie obličiek (klírens kreatinínu medzi 30 a 50 ml/min) sa nepozorovala žiadna zmena vo farmakokinetike ropinirolu.
Perorálny klírens ropinirolu je u pacientov s terminálnym štádiom ochorenia obličiek, ktorí podstupujú pravidelnú hemodialýzu, znížený o približne 30 %. Perorálny klírens metabolitov SKF 104557 a SKF 89124 bol tiež znížený o približne 80 % a 60 %, v tomto poradí. Z toho dôvodu je odporúčaná maximálna dávka limitovaná na 3 mg/deň u pacientov so syndrómom nepokojných nôh a na 18 mg/deň u pacientov s Parkinsonovou chorobou (pozri časť 4.2).
Pediatrická populáciaObmedzené farmakokinetické údaje získané u dospievajúcich (vo veku 12-17 rokov, n= 9) ukázali, že systémová expozícia po podaní jednorazových dávok 0,125 mg a 0,25 mg bola podobná tej, aká sa pozorovala u dospelých pacientov (pozri tiež časť 4.2; pododsek „Deti a dospievajúci“).
5.3 Predklinické údaje o bezpečnosti
Toxikológia
Toxilogický profil je určený hlavne farmakologickou aktivitou ropinirolu: zmeny správania, hypoprolaktinémia, pokles krvného tlaku a srdcovej frekvencie, ptóza a salivácia. V dlhodobej štúdii bola po vysokých dávkach (50 mg/kg/deň) pozorovaná degenerácia sietnice len u albinických potkanov, pravdepodobne súvisiaca so zvýšenou expozíciou svetlu.
Genotoxicita
Vo zvyčajnom súbore
in vitro a
in vivo testov sa genotoxicita nepozorovala.
Karcinogenicita
V dvojročných štúdiách vykonaných na myšiach a potkanoch s dávkovaním do 50 mg/kg/deň sa u myší nezistili žiadne dôkazy o karcinogénnom účinku. U potkanov boli jedinými léziami súvisiacimi s ropinirolom hyperplázia Leydigových buniek a testikulárny adenóm, ktoré boli dôsledkom hypoprolaktinemického účinku ropinirolu. Tieto lézie sa pokladajú za druhovo špecifický jav a nepredstavujú nebezpečenstvo v súvislosti s klinickým používaním ropinirolu.
Reprodukčná toxicita
Podávanie ropinirolu gravidným potkanom v dávkach toxických pre matku viedlo k zníženej fetálnej hmotnosti po dávke 60 mg/kg/deň (približne rovnaká ako AUC pri maximálnej dávke u ľudí), k zvýšenému počtu prípadov úmrtí plodu po dávke 90 mg/kg/deň (približne 2-násobok AUC pri maximálnej dávke u ľudí) a k malformáciám prstov po dávke 150 mg/kg/deň (približne 3-násobok AUC pri maximálnej dávke u ľudí). Po dávke 120 mg/kg/deň (približne 2,5-násobok AUC pri maximálnej dávke u ľudí) sa u potkanov nepozorovali žiadne teratogénne účinky a u králikov sa nezistil žiadny vplyv na vývoj.
Farmakologické štúdie bezpečnostiIn vitro štúdie preukázali, že ropinirol inhibuje prestup sprostredkovaný hERG kanálom. Hodnota IC
50 je minimálne 30-násobne vyššia ako predpokladaná maximálna plazmatická koncentrácia u pacientov liečených najvyššou odporúčanou dávkou (4 mg/deň) (pozri časť 5.1).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety:
Celulóza, mikrokryštalická
Monohydrát laktózy
Sodná soľ kroskarmelózy
Hypromelóza
Magnéziumstearát
Obal tablety
1 mg:
Hypromelóza
Makrogol 400
Oxid železitý (E 172)
Oxid titaničitý (E 171)
Hlinitý lak indigokarmínu (E 132)
2 mg:
Hypromelóza
Oxid titaničitý (E 171)
Makrogol 400
Červený oxid železitý (E 172)
Žltý oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3
Čas použiteľnosti3 roky
6.4
Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
HDPE viacdávkový obal s uzáverom s detskou poistkou (PP)
Nádoba zo silikagélu
Ropinirol Mylan 1 mg: 21, 28, 84 a 126 filmom obalených tabliet
Ropinirol Mylan 2 mg: 21, 28, 84 a 126 filmom obalených tabliet
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6
Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Ltd. Station Close, Potters Bar, Hertfordshire, EN6 1TL, Veľká Británia
8. REGISTRAČNÉ ČÍSLA:
Ropinirol Mylan 1 mg: 27/0069/08-S
Ropinirol Mylan 2 mg: 27/0070/08-S
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 28.02.2008
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTU
December 2014