
eboli stanovené.
K dispozícii nie sú žiadne údaje.
Spôsob podávania
Na podanie do oka.
V súčasnosti nie sú k dispozícii žiadne údaje o potenciálnych interakciách špecifických pre netarsudil
(pozri časť 4.5). Ak sa bude netarsudil používať súbežne s inými topickými oftalmologickými liekmi,
medzi podaním jednotlivých liekov má byť časový odstup aspoň päť (5) minút. Vzhľadom na vazodilatačné vlastnosti netarsudilu sa iné očné kvapky majú podávať skôr. Očné masti sa majú podávať ako posledné.
Pred podaním instilácie netarsudilu je potrebné vybrať kontaktné šošovky a znova ich možno vložiť 15
minút po podaní lieku (pozri časť 4.4).
Je potrebné vyhnúť sa kontaktu špičky dávkovača s okom, okolitými štruktúrami, prstami alebo s akýmkoľvek iným povrchom, aby sa predišlo kontaminácii roztoku. Použitie kontaminovaných roztokov môže spôsobiť závažné poškodenie oka a následnú stratu videnia.
4.3 Kontraindikácie
Precitlivenosť na liečivo (liečivá) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Účinky na oči
Dávkovanie dvakrát denne nie je dobre tolerované a neodporúča sa. Netarsudil podávaný dvakrát
denne viedol k trochu väčším zníženiam IOP, ale mal menej priaznivý bezpečnostný profil, čo sa odzrkadlilo vo vyššej miere a zvýšenej závažnosti očných nežiaducich reakcií. Dávkovanie dvakrát
denne počas 12-mesačnej štúdie bolo tiež spojené s vyššou mierou ukončenia liečby v dôsledku
nežiaducich reakcií (53,8 %). Preto sa odporúča podávať netarsudil raz denne.
Obsah benzalkóniumchloridu
Tento liek obsahuje benzalkóniumchlorid.
Bolo hlásené, že benzalkóniumchlorid spôsobuje podráždenie očí, symptómy suchých očí a môže ovplyvniť slzný film a povrch rohovky. Takisto je známe, že mení sfarbenie mäkkých kontaktných šošoviek. Liek sa má používať opatrne u pacientov so suchými očami a u pacientov, ktorí môžu mať poškodenú rohovku.
V prípade dlhodobého používania lieku je potrebné pacientov sledovať.
Účinnosť netarsudilu sa neskúmala dlhšie ako 12 mesiacov.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne alebo je iba obmedzené množstvo údajov o použití netarsudilu u gravidných
žien. Nepredpokladajú sa žiadne účinky počas gravidity, pretože systémová expozícia netarsudilu je zanedbateľná (pozri časť 5.2). V štúdiách na zvieratách, v ktorých sa liek podával intravenózne v klinicky relevantných expozíciách, sa nepreukázali priame alebo nepriame škodlivé účinky, pokiaľ ide o reprodukčnú toxicitu (pozri časť 5.3). Liek Rhokiinsa sa nemá používať počas gravidity, pokiaľ si klinický stav ženy nevyžaduje liečbu netarsudilom.
Dojčenie
Nie je známe, či sa netarsudil/metabolity vylučujú do ľudského mlieka. Aj keď sa nepredpokladajú
žiadne účinky na dojčeného novorodenca/dojča, pretože sa očakáva, že systémová expozícia dojčiacich žien netarsudilu je zanedbateľná, nie sú k dispozícii relevantné klinické údaje (pozri časť
5.2). Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu liekom Rhokiinsa, alebo sa takejto liečby zdržať, je potrebné urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
FertilitaK dispozícii nie sú žiadne údaje o účinkoch netarsudilu na mužskú alebo ženskú fertilitu.
Nepredpokladajú sa však žiadne účinky, pretože systémová expozícia netarsudilu je zanedbateľná
(pozri časť 5.2).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeLiek Rhokiinsa má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Ak sa po podaní instilácie vyskytne prechodné rozmazané videnie, pacient má pred vedením vozidla
alebo obsluhovaním strojov počkať, kým sa mu zrak nevyjasní.
4.8 Nežiaduce účinkySúhrn bezpečnostnéhoprofiluNajčastejšia pozorovaná očná nežiaduca reakcia je hyperémia spojoviek, ktorá bola hlásená u 51 %
pacientov. Ďalšie hlásené nežiaduce očné reakcie sú: cornea verticillata (17 %), bolesť v mieste podania instilácie (17 %) a hemorágia spojoviek (8 %). Bol tiež hlásený erytém v mieste podania
instilácie (8 %), zafarbenie rohovky (7 %), rozmazané videnie (6 %), zvýšené slzenie (6 %) a erytém
očného viečka (5 %).
Tabuľka s prehľadom nežiaducich reakciíPri podávaní netarsudilu raz denne boli hlásené nasledujúce nežiaduce reakcie. Reakcie sú
klasifikované podľa konvencie ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov).
Trieda orgánových systémov Frekvencia Nežiaduce reakcie Poruchy imunitného systému Menej časté precitlivenosť Poruchy nervového systému Časté bolesť hlavy
Menej časté závrat,
porucha zorného poľa
Poruchy oka Veľmi časté hyperémia spojoviek1, cornea verticillata1,
bolesť v mieste podania instilácie
Časté hemorágia spojoviek, rozmazané videnie, zvýšené slzenie, erytém očného viečka, očný pruritus, podráždenie oka,
znížená zraková ostrosť, edém očného viečka, bodkovitá keratitída, edém spojoviek,
pocit cudzieho telieska v očiach,
konjunktivitída,
alergická konjunktivitída, fotofóbia,
pruritus očného viečka, bolesť oka, nepriehľadnosť rohovky, suché oko,
výtok z oka,
 T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
erytém v mieste podania instilácie, nepríjemný pocit v mieste podania instilácie,
pruritus v mieste podania instilácie, prítomné zafarbenie rohovky vitálnym farbivom, zvýšený vnútroočný tlak
Menej časté očná hyperémia, blefaritída, porucha rohovky,
krusty na okraji očného viečka, očná alergia,
folikuly na spojovke, nepríjemný pocit v oku, opuch oka,
korneálne depozity,
porucha očného viečka,
dysfunkcia Meibomových žliazok, pigmentácia rohovky,
diplopia, ektropium, lentikulárne opacity,
neinfekčná konjunktivitída,
abnormálny pocit v oku, astenopia,
episklerálna hyperémia, videnie s haló efektom, keratitída,
refrakčná porucha,
žiara v prednej očnej komore, zápal prednej očnej komory, slepota,
podráždenie spojoviek, chalázia spojoviek, diabetická retinopatia, ekzém na očných viečkach,
suchosť kože na očných viečkach,
glaukóm,
rast očných rias, adhézie dúhovky, iris bombata, iritída,
očná hypertenzia, porucha videnia, dystrofia rohovky,
pocit cudzieho telieska v mieste podania instilácie, podráždenie v mieste podania instilácie
sklené oči,
únava,
suchosť v mieste podania instilácie, edém v mieste podania instilácie, parestézia v mieste podania instilácie, zafarbenie spojoviek,
zvýšený pomer šálky/disku očného nervu,
madaróza
Poruchy dýchacej sústavy, hrudníka a mediastína Menej časté nepríjemný pocit v nose, rinalgia
Poruchy kože a podkožného tkaniva Menej časté alergická dermatitída, kontaktná dermatitída, lichenifikácia,
petechie
Poruchy kostrovej a svalovej sústavy a Menej časté polychondritída
 T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
spojivového tkaniva
Úrazy, otravy a komplikácie liečebného postupu Menej časté exkoriácia
1 Ďalšie informácie sú uvedené v
Opise vybraných nežiaducich reakciíOpis vybraných nežiaducich reakciíHyperémia spojoviekV klinických skúšaniach bola najčastejšie hlásenou nežiaducou reakciou súvisiacou s liečbou netarsudilom hyperémia spojoviek, ktorá sa pripisuje vazodilatačnému účinku liečiv z triedy inhibítorov Rho kinázy. Hyperémia spojoviek bola zvyčajne mierne závažná a sporadická. Pomerne malý podiel účastníkov so stredne závažnou alebo závažnou hyperémiou však ukončil liečbu pre túto nežiaducu reakciu (6,0 % v klinických štúdiách vo fáze 3).
Cornea verticillataCornea verticillata sa vyskytovala v kontrolovaných klinických štúdiách vo fáze 3 približne u 20 % pacientov. Cornea verticillata pozorovaná u pacientov liečených netarsudilom sa prvý raz zaznamenala po 4 týždňoch denného podávania lieku. Táto reakcia neviedla u pacientov k zjavným funkčným zmenám vo videní. Väčšina prípadov cornea verticillata odznela po ukončení liečby. Výskyt cornea verticillata bol vyšší v určitých subpopuláciách: u starších pacientov (≥ 65 rokov) v porovnaní s mladšími pacientmi (24,8 % vs. 15,9 %); u mužov v porovnaní so ženami (24,4 % vs. 18,4 %) a u belochov v porovnaní s inými rasami (25,6 % vs. 7,0 %).
Osobitné populácieStaršie osobyS výnimkou cornea verticillata (pozri vyššie) sa nepozoroval žiadny rozdiel v bezpečnostnom profile lieku Rhokiinsa medzi osobami vo veku < 65 alebo ≥ 65 rokov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePreukázalo sa, že systémová expozícia netarsudilu po topickom očnom podaní je zanedbateľná. Ak sa vyskytne topické predávkovanie netarsudilu, oko (oči) možno vypláchnuť vodou z vodovodu. Liečba predávkovania by zahŕňala podpornú a symptomatickú liečbu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Oftalmologiká, antiglaukomatiká a miotiká, ATC kód: S01EX05
Mechanizmus účinkuPredpokladá sa, že netarsudil, inhibítor Rho kinázy, znižuje IOP zvýšením odtoku komorového moku.
Zo štúdií na zvieratách a u ľudí vyplýva, že hlavným mechanizmom účinku je zvýšený trabekulárny
odtok. Z týchto štúdií takisto vyplýva, že netarsudil znižuje IOP znížením episklerálneho venózneho tlaku.
Klinickáúčinnosťabezpečnosť
V randomizovanom, dvojito zaslepenom, multicentrickom klinickom skúšaní vo fáze 3 sa porovnávala
účinnosť a bezpečnosť netarsudilu podávaného raz denne s účinnosťou a bezpečnosťou timolol maleátu 0,5 % podávaného dvakrát denne pri znížení IOP celkovo u 708 pacientov s glaukómom s otvoreným uhlom alebo s očnou hypertenziou. Priemerný vek účastníkov štúdie bol 65,5 roka (rozsah
18 až 91 rokov).
Štúdia bola navrhnutá tak, aby sa v nej preukázala porovnateľná účinnosť netarsudilu podávaného raz
denne večer s timolol maleátom 0,5 % podávaným dvakrát denne u pacientov s východiskovým IOP >
20 mm Hg a < 25 mm Hg. Hlavným meradlom výsledku účinnosti bol priemerný IOP v každom z 9
časových bodov nameraný o 8.00, 10.00 a 16.00 hod. v 15., 43. a 90. deň. Použitou hranicou porovnateľnej účinnosti bol rozdiel v priemernom IOP ≤ 1,5 mm Hg pre všetky časové body pri všetkých návštevách počas 3 mesiacov a ≤ 1,0 mm Hg vo väčšine týchto časových bodov. Zníženie IOP pomocou netarsudilu podávaného raz denne bolo porovnateľné s účinkom timololu 0,5 % podávaného dvakrát denne u pacientov s východiskovým IOP < 25 mm Hg (tabuľka 1). Skúmala sa tiež účinnosť u pacientov s východiskovým IOP ≥ 25 mm Hg a < 30 mm Hg. Netarsudil vykazoval klinicky významné zníženia IOP vo všetkých časových bodoch, porovnateľná účinnosť s timololom sa však nepreukázala v tejto populácii s východiskovým IOP ≥ 25 mm Hg a < 30 mm Hg (tabuľka 2).
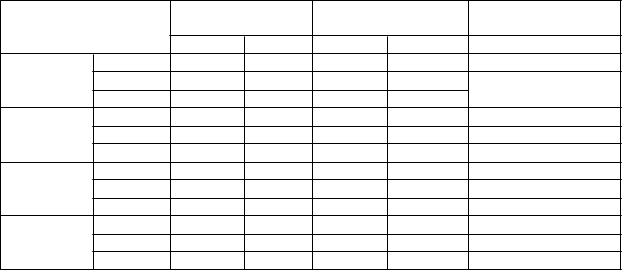
Tabuľka 1: Priemerný IOP pri návšteve: Populácia PP s východiskovým IOP < 25 mm Hg
Návšteva v rámci štúdie a
časový bod
Netarsudil 0,02 % raz denne
T
i
m
o
lol 0,5 % dvakrát denne
Rozdiel (95 % IS)
Netarsudil – Timolol
Východiskový bod
N IOP N IOP
08:00 186 22,40 186 22,44
10:00 186 21,06 186 21,27
16:00 186 20,69 186 20,69
15. deň 08:00 184 17,68 183 17,51 0,17 (-0,43; 0,77)
10:00 181 16,55 183 16,71 -0,16 (-0,73; 0,41)
16:00 181 16,32 183 16,92 -0,60 (-1,16; -0,04)
43. deň 08:00 177 17,84 183 17,60 0,25 (-0,34; 0,83)
10:00 177 16,75 182 16,98 -0,22 (-0,82; 0,37)
16:00 176 16,57 182 16,67 -0,10 (-0,66; 0,46)
90. deň 08:00 167 17,86 179 17,29 0,56 (-0,02; 1,15)
10:00 166 16,90 179 16,69 0,21 (-0,37; 0,79)
16:00 165 16,73 179 16,80 -0,07 (-0,68; 0,55)
Tabuľka 2: Priemerný IOP pri návšteve: Populácia PP s východiskovým IOP ≥ 25 mm Hg a < 30 mm Hg
Návšteva v rámci štúdie a
časový bod
Netarsudil 0,02 % raz denne
'
T
i
m
o
lol 0,5 % dvakrát denne
Rozdiel (95 % IS)
Netarsudil – Timolol
Východiskový bod
N IOP N IOP
08:00 120 26,30 130 25,96
10:00 120 25,18 130 24,91
16:00 120 24,48 130 23,99
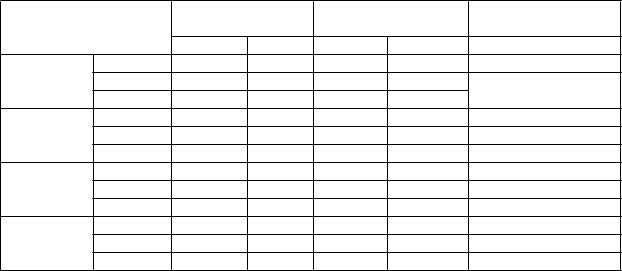
15. deň 08:00 118 21,57 129 20,15 1,42 (0,51; 2,34)
10:00 116 20,09 129 19,34 0,75 (-0,15; 1,64)
16:00 116 20,01 129 19,17 0,83 (0,00; 1,67)
43. deň 08:00 112 21,99 127 19,84 2,14 (1,16; 3,13)
10:00 109 20,33 127 19,19 1,15 (0,30; 1,99)
16:00 109 20,03 127 19,63 0,41 (-0,47; 1,29)
90. deň 08:00 94 21,71 121 19,91 1,79 (0,74; 2,85)
10:00 93 20,80 120 18,95 1,85 (0,89; 2,81)
16:00 93 20,31 120 18,94 1,37 (0,46; 2,28)
Bezpečnosť netarsudilu sa hodnotila v klinických štúdiách vrátane štyroch dobre kontrolovaných štúdií
vo fáze 3.
Približne 75 % účastníkov zaradených do skupín liečených netarsudilom v štúdiách v 3. fáze boli belosi a 24 % boli černosi alebo Afroameričania. Vyše polovica účastníkov bola vo veku ≥ 65 rokov. S výnimkou výskytu cornea verticillata sa nepozoroval žiadny iný rozdiel v bezpečnostnom profile medzi rasami alebo vekovými skupinami (pozri časť 4.8).
Miery dokončenia liečby v štúdiách v 3. fáze boli nižšie v skupine liečenej netarsudilom ako v skupine liečenej timolol maleátom. Účastníci so známymi kontraindikáciami alebo s precitlivenosťou na timolol boli zo štúdií vylúčení. Miery ukončenia liečby v dôsledku nežiaducich reakcií boli 19,3 % pre skupinu liečenú netarsudilom v porovnaní s 1,7 % pre skupinu liečenú timolol maleátom. Väčšina prípadov ukončenia liečby v skupine liečenej netarsudilom súvisela s očnými nežiaducimi reakciami, zatiaľ čo väčšina prípadov ukončenia liečby v skupine liečenej timololom súvisela s inými ako očnými nežiaducimi reakciami. Najčastejšie hlásené nežiaduce reakcie súvisiace s ukončením liečby v skupinách liečených liekom Rhokiinsa boli hyperémia spojoviek (5,8 %), cornea verticillata (3,7 %) a rozmazané videnie (1,4 %). Výskyt hyperémie a rozmazaného videnia bol sporadický.
Účinnosť a bezpečnosť netarsudilu u účastníkov s poškodeným epitelom rohovky alebo so súbežne existujúcimi očnými patológiami, ako je napr. pseudoexfoliácia a syndróm pigmentovej disperzie, neboli stanovené.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
Rhokiinsa vo všetkých podskupinách pediatrickej populácie pre zníženie zvýšeného vnútroočného
tlaku u pacientov s glaukómom s otvoreným uhlom alebo s očnou hypertenziou. (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Systémová expozícia netarsudilu a jeho aktívnemu metabolitu AR-13503 sa hodnotila u 18 zdravých
účastníkov po topickom očnom podávaní netarsudilu raz denne (jedna kvapka do obidvoch očí podávaná ráno) počas 8 dní. Po podaní dávky v 1. deň a 8. deň neboli plazmatické koncentrácie netarsudilu kvantifikovateľné (nižší limit kvantifikácie (LLOQ) 0,100 ng/ml). Len u jedného účastníka sa pozorovala jedna plazmatická koncentrácia 0,11 ng/ml aktívneho metabolitu na 8. deň 8 hodín po podaní dávky.
Biotransformácia
Po topickom očnom podaní sa netarsudil metabolizuje esterázami v oku na aktívny metabolit AR-
13503.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a toxicity vývinu neodhalili žiadne osobitné riziko pre ľudí. Účinky v predklinických štúdiách sa pozorovali iba pri expozíciách považovaných za dostatočne vyššie ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
Intravenózne podávanie netarsudil mezylátu gravidným potkanom a králikom počas organogenézy neviedlo k nežiaducim embryofetálnym účinkom pri klinicky relevantných systémových expozíciách. U gravidných potkanov dávka 0,3 mg/kg/deň (1 000-násobok odporúčanej oftalmologickej dávky) a vyššia vykazovali zvýšenú postimplantačnú stratu a zníženú životaschopnosť plodu. U gravidných králikov dávka 3 mg/kg/deň (10 000-násobok odporúčanej oftalmologickej dávky) a vyššia vykazovali zvýšenú postimplantačnú stratu a zníženú hmotnosť plodu.
Neuskutočnili sa dlhodobé štúdie na zvieratách na vyhodnotenie karcinogénneho potenciálu netarsudilu.
Netarsudil nebol mutagénny v teste bakteriálnej mutácie, v teste myšieho lymfómu ani v teste tvorby mikrojadier u potkanov.
V modifikovanom in vitro teste 3T3 NRU-PT, v ktorom sa vlnová dĺžka predĺžila tak, aby zahŕňala UVB svetlo, sa zistilo, že netarsudil a jeho aktívny metabolit AR-13503 majú možný fototoxický potenciál.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Benzalkóniumchlorid, manitol,
kyselina boritá,
hydroxid sodný (na úpravu pH), voda na injekcie.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
Otvorená fľaša: 4 týždne po prvom otvorení fľaše. Uchovávajte pri teplote do 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
Do otvorenia uchovávajte v chladničke (2 C – 8 C).
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Liek Rhokiinsa sa dodáva sterilný v nepriehľadných bielych fľašiach z polyetylénu s nízkou hustotou
(2,5 ml náplň v 4 ml nádobke) so špičkou s bielym polypropylénovým uzáverom a poistným tesnením.
Škatuľka obsahujúca 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Aerie Pharmaceuticals Ireland, Limited Athlone Business and Technology Park, Dublin Road,
Garrycastle,
Athlone, Co Westmeath,
N37 DW40, Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/19/1400/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu