vanie dojčiat v prvom roku života (napr. vypuknutie epidémie alebo cestovanie do endemických oblastí), druhá dávka PRIORIXu sa má podať v druhom roku života, najlepšie do troch mesiacov po prvej dávke. Časový odstup medzi dávkami nesmie byť za žiadnych okolností kratší ako štyri týždne (pozri časti 4.4 a 5.1).
Dojčatá mladšie ako 9 mesiacovBezpečnosť a účinnosť PRIORIXu u dojčiat mladších ako 9 mesiacov neboli stanovené.
Spôsob podávaniaPRIORIX sa podáva subkutánnou injekciou, hoci sa tiež môže podať intramuskulárnou injekciou (pozri časti 4.4 a 5.1).
U pacientov s trombocytopéniou alebo s akoukoľvek poruchou zrážanlivosti krvi sa má uprednostniť subkutánne podanie očkovacej látky (pozri časť 4.4).
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na neomycín. Kontaktná dermatitída na neomycín v anamnéze nie je kontraindikáciou. Reakcie z precitlivenosti na vaječné bielkoviny, pozri časť 4.4.
Závažná humorálna alebo bunková (primárna alebo získaná) imunodeficiencia, napr. závažná kombinovaná imunodeficiencia, agamaglobulinémia a AIDS alebo symptomatická infekcia HIV alebo vekovo špecifické percentuálne zastúpenie CD4+ T‑lymfocytov u detí mladších ako 12 mesiacov: CD4+ < 25 %; detí od 12 do 35 mesiacov: CD4+ < 20 %; detí od 36 do 59 mesiacov: CD4+ < 15 % (pozri časť 4.4).
Gravidita. Okrem toho sa treba gravidite vyhnúť počas 1 mesiaca po očkovaní (pozri časť 4.6).
Tak ako pri iných očkovacích látkach sa podanie PRIORIXu musí odložiť u jedincov trpiacich závažným akútnym febrilným ochorením. Prítomnosť miernej infekcie, akou je nádcha, by nemalo viesť k odloženiu očkovania.
4.4 Osobitné upozornenia a opatrenia pri používaníTak ako pri všetkých injekčne podávaných očkovacích látkach musí byť pre prípad zriedkavej anafylaktickej reakcie vyskytujúcej sa po podaní očkovacej látky vždy okamžite k dispozícii zodpovedajúca liečba a lekársky dohľad.
Alkohol a iné dezinfekčné látky sa pred podaním očkovacej látky musia nechať odpariť z kože, pretože môžu inaktivovať oslabené vírusy v očkovacej látke.
Dojčatá v prvom roku života nemusia dostatočne odpovedať na zložky očkovacej látky z dôvodu možnej interferencie s materskými protilátkami (pozri časti 4.2 a 5.1).
Pri podávaní PRIORIXu jedincom s poruchou centrálneho nervového systému (CNS), s náchylnosťou na febrilné kŕče alebo s kŕčmi v rodinnej anamnéze, treba postupovať s náležitou obozretnosťou. Očkovaných jedincov s febrilnými kŕčmi v anamnéze treba po očkovaní pozorne sledovať.
Zložka osýpok a zložka príušníc očkovacej látky sú vyrábané na bunkovej kultúre kuracích embryí, a preto môžu obsahovať stopy vaječnej bielkoviny. Osoby, ktoré majú v anamnéze anafylaktické, anafylaktoidné alebo iné okamžité reakcie (napr. generalizovanú urtikáriu, opuch úst a hrdla, ťažkosti s dýchaním, hypotenziu alebo šok), ktoré sa objavili po požití vajca, môžu byť vystavené zvýšenému riziku vzniku reakcií z precitlivenosti okamžitého typu po očkovaní, aj keď sa dokázalo, že tieto typy reakcií sú veľmi zriedkavé. Jedinci, ktorí mali anafylaxiu po požití vajca, musia byť očkovaní s mimoriadnou obozretnosťou a pre prípad výskytu takejto reakcie musí byť k dispozícii zodpovedajúca liečba anafylaxie.
Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy nesmú byť očkovaní PRIORIXom, pretože obsahuje sorbitol.
Podaním očkovacej látky do 72 hodín po expozícii prirodzenému vírusu osýpok je možné získať obmedzenú ochranu pred osýpkami.
Synkopa (strata vedomia) sa môže vyskytnúť po, alebo dokonca pred akýmkoľvek očkovaním zvlášť u dospievajúcich ako psychogénna odpoveď na vpich ihlou. Môže to byť sprevádzané viacerými neurologickými symptómami ako je prechodná vizuálna porucha, parestézia a tonicko-klonické pohyby končatín počas zotavovania. Je dôležité, aby sa zaviedli postupy na predchádzanie zranenia zo straty vedomia.
Tak ako pri každej očkovacej latke sa ochranná imunitná odpoveď nemusí vyvolať u všetkých očkovaných jedincov.
priorix sa nesmie za žiadnych okolností podať intravaskulárne.
TrombocytopéniaPo očkovaní živými očkovacími látkami proti osýpkam, príušniciam a ružienke boli u jedincov s trombocytopéniou po podaní prvej dávky hlásené prípady zhoršenia trombocytopénie a prípady opakovaného výskytu trombocytopénie. Trombocytopénia súvisiaca s očkovaním proti MMR (z anglického: measles, mumps and rubella t.j. osýpky, príušnice a ružienka) je zriedkavá a zvyčajne prechodná. U pacientov s už existujúcou trombocytopéniou, alebo ktorí majú v anamnéze trombocytopéniu vyskytujúcu sa po očkovaní proti osýpkam, príušniciam a ružienke, sa má starostlivo zhodnotiť pomer medzi rizikom a prínosom podania PRIORIXu. Títo jedinci majú byť očkovaní s obozretnosťou a má sa u nich uprednostniť subkutánne podanie očkovacej látky.
Pacienti s oslabeným imunitným systémomOčkovanie sa môže zvážiť u pacientov s vybranými imunodeficienciami, kedy prínosy prevážia riziká (napr. asymptomatickí pacienti s HIV, deficiencie podtriedy IgG, vrodená neutropénia, chronická granulomatózna choroba a ochorenia nedostatočnosti komplementu).
Pacienti s oslabeným imunitným systémom, u ktorých sa nevyskytuje žiadna kontraindikácia tohto očkovania (pozri časť 4.3), nemusia na očkovanie odpovedať tak dobre ako imunokompetentní pacienti, a preto niektorí z týchto pacientov môžu dostať osýpky, príušnice alebo ružienku v prípade, že s nimi dôjdu do kontaktu, a to aj napriek náležitému podaniu očkovacej látky. Týchto pacientov treba starostlivo sledovať kvôli prejavom osýpok, príušníc a ružienky.
PrenosPrenos vírusu osýpok a príušníc z očkovaných jedincov na vnímavé kontakty nebol nikdy zaznamenaný. Je známe, že dochádza k vylučovaniu vírusu ružienky a osýpok z hltana, a to po približne 7 až 28 dňoch od očkovania, pričom maximálne množstvo sa vylúči okolo 11. dňa. Nie sú však žiadne dôkazy o prenose týchto vylúčených vakcinálnych vírusov na vnímavé kontakty. Zaznamenal sa prenos vakcinálneho vírusu ružienky na dojčatá cez materské mlieko ako aj transplacentárny prenos bez toho, že by sa u nich preukázali klinické prejavy ochorenia.
4.5 Liekové a iné interakciePRIORIX sa môže podať súbežne (ale do rôznych miest vpichu) s ktoroukoľvek z nasledujúcich monovalentných alebo kombinovaných očkovacích látok [vrátane hexavalentných očkovacích látok (DTPa‑HBV‑IPV/Hib)]: s očkovacou látkou proti záškrtu‑tetanu‑čiernemu kašľu (acelulárna zložka pertussis) (DTPa), očkovacou látkou proti
Haemophilus influenzae typ b (Hib), inaktivovanou očkovacou látkou proti poliomyelitíde (IPV), očkovacou látkou proti hepatitíde B (HBV), očkovacou látkou proti hepatitíde A (HAV), konjugovanou očkovacou látkou proti meningokokom sérotypu C (MenC), očkovacou látkou proti vírusu varicella‑zoster (VZV), perorálnou očkovacou látkou proti poliomyelitíde (OPV) a s 10‑valentnou pneumokokovou konjugovanou očkovacou látkou v súlade s národnými odporúčaniami.
Ak sa PRIORIX a iné živé atenuované očkovacie látky nepodajú v rovnakom čase, medzi ich podaním sa odporúča minimálne jednomesačný časový odstup.
K dispozícii nie sú údaje podporujúce použitie PRIORIXu s nejakými inými očkovacími látkami.
Ak sa musí urobiť tuberkulínový test, má sa vykonať pred očkovaním alebo súbežne s očkovaním, pretože bolo hlásené, že kombinované očkovacie látky proti osýpkam, príušniciam a ružienke môžu spôsobiť prechodne zníženú citlivosť tuberkulínového testu. Keďže táto anergia môže pretrvávať maximálne až 6 týždňov, tuberkulínový test sa nemá vykonať počas tejto doby po očkovaní, aby sa zabránilo falošne negatívnym výsledkom.
U jedincov, ktorým bol podaný ľudský gamaglobulín alebo transfúzia krvi, sa má očkovanie odložiť o tri mesiace alebo dlhšie (až o 11 mesiacov) v závislosti od podanej dávky ľudského globulínu kvôli pravdepodobnosti zlyhania účinnosti očkovacej látky v dôsledku pasívne získaných protilátok proti osýpkam, príušniciam a ružienke.
4.6 Fertilita, gravidita a laktáciaFertilitaPRIORIX nebol hodnotený v štúdiách fertility.
GraviditaGravidné ženy nesmú byť očkované očkovacou látkou PRIORIX.
Pri podaní očkovacích látok proti osýpkam, príušniciam, ružienke alebo ovčím kiahňam gravidným ženám sa však nezaznamenalo poškodenie plodu.
I keď teoretické riziko zatiaľ nie je možné vylúčiť, neboli hlásené žiadne prípady kongenitálneho ružienkového syndrómu u viac ako 3 500 vnímavých žien, ktoré v čase očkovania očkovacími látkami obsahujúcicmi vírus ružienky nevedeli o tom, že sú v skorom štádiu gravidity. Neúmyselné očkovanie žien, ktoré nevedia o tom, že sú gravidné, očkovacími látkami obsahujúcimi vírusy osýpok, príušníc a ružienky preto nemá byť dôvodom na ukončenie gravidity.
Gravidite sa má zabrániť počas 1 mesiaca po očkovaní. Ženy, ktoré plánujú otehotnieť, majú byť poučené, aby s otehotnením počkali.
LaktáciaK dispozícii sú obmedzené skúsenosti s podávaním PRIORIXu počas dojčenia. Štúdie preukázali, že u dojčiacich žien, ktoré boli po pôrode očkované živými atenuovanými očkovacími látkami proti ružienke, sa môže vírus vylúčiť do materského mlieka a preniesť sa na dojčené deti bez toho, že by sa u nich preukázalo symptomatické ochorenie. Riziká a prínosy očkovania matky sa musia zhodnotiť iba v prípade, keď sa potvrdí alebo keď existuje podozrenie, že dieťa je imunodeficientné (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePRIORIX nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluNižšie uvedený bezpečnostný profil je založený na údajoch získaných od celkovo približne 12 000 jedincov, ktorým bol PRIORIX podaný v klinických štúdiách.
Nežiaduce reakcie, ktoré sa môžu vyskytnúť po použití kombinovanej očkovacej látky proti príušniciam, osýpkam a ružienke zodpovedajú tým, ktoré sú pozorované po monovalentných očkovacích látkach podaných samostatne alebo v kombinácií.
V kontrolovaných klinických štúdiách boli prejavy a príznaky aktívne sledované počas 42‑dňového obdobia sledovania po očkovaní. Očkovaní jedinci boli požiadaní, aby hlásili akékoľvek klinické udalosti počas obdobia sledovania.
Najčastejšími nežiaducimi reakciami po podaní PRIORIXu boli začervenanie v mieste vpichu a horúčka ³ 38 °C (meraná v konečníku) alebo ³ 37,5 °C (meraná v podpazuší/v ústach).
Zoznam nežiaducich reakciíHlásené nežiaduce reakcie sú uvedené podľa nasledujúcej frekvencie výskytu:
Veľmi časté (³ 1/10)
Časté (³ 1/100 až < 1/10)
Menej časté (³ 1/1 000 až < 1/100)
Zriedkavé (³ 1/10 000 až < 1/1 000)
Údaje z klinických štúdiíInfekcie a nákazy:Časté: infekcia horných dýchacích ciest
Menej časté: otitis media
Poruchy krvi a lymfatického systému:Menej časté: lymfadenopatia
Poruchy imunitného systému:Zriedkavé: alergické reakcie
Poruchy metabolizmu a výživy:Menej časté: anorexia
Psychické poruchy:Menej časté: nervozita, abnormálny plač, insomnia
Poruchy nervového systému:Zriedkavé: febrilné kŕče
Poruchy oka:Menej časté: konjunktivitída
Poruchy dýchacej sústavy, hrudníka a mediastína:Menej časté: bronchitída, kašeľ
Poruchy gastrointestinálneho traktu:Menej časté: zväčšenie príušnej žľazy, hnačka, vracanie
Poruchy kože a podkožného tkaniva:Časté: vyrážka
Celkové poruchy a reakcie v mieste podania:Veľmi časté: začervenanie v mieste vpichu, horúčka ³ 38 °C (meraná v konečníku) alebo ³ 37,5 °C (meraná v podpazuší/v ústach)
Časté: bolesť a opuch v mieste vpichu, horúčka > 39,5 °C (meraná v konečníku) alebo > 39 °C (meraná v podpazuší/v ústach)
Vo všeobecnosti bola kategória frekvencie výskytu nežiaducich reakcií zistená po podaní prvej a druhej dávky očkovacej látky podobná. Výnimkou bola bolesť v mieste vpichu, ktorá bola „častá“ po prvej dávke očkovacej látky a „veľmi častá“ po druhej dávke očkovacej látky.
Údaje z obdobia po uvedení lieku na trhV rámci sledovania po uvedení lieku na trh boli po očkovaní PRIORIXom navyše hlásené nasledujúce nežiaduce reakcie.
Keďže tieto nežiaduce reakcie boli hlásené spontánne, nie je možné spoľahlivo odhadnúť ich frekvenciu výskytu.
Infekcie a nákazy:Meningitída, orchitída, epididymitída, atypické mierne alebo oslabené príznaky osýpok, syndróm podobný príušniciam
Poruchy krvi a lymfatického systému:Trombocytopénia, trombocytopenická purpura
Poruchy imunitného systému:Anafylaktické reakcie
Poruchy nervového systému:Transverzná myelitída, Guillainov‑Barrého syndróm, periférna neuritída, encefalitída*
Poruchy kože a podkožného tkaniva:Multiformný erytém
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva:Artralgia, artritída
Celkové poruchy a reakcie v mieste podania:Kawasakiho syndróm
* Encefalitída bola hlásená s frekvenciou výskytu nižšou ako 1 na 10 miliónov dávok. Riziko vzniku encefalitídy po podaní očkovacej látky je oveľa nižšie ako riziko vzniku encefalitídy spôsobenej prirodzeným ochorením (osýpky: 1 na 1 000 až 2 000 prípadov; príušnice: 2 ‑ 4 na 1 000 prípadov; ružienka: približne 1 na 6 000 prípadov).
Náhodné intravaskulárne podanie môže spôsobiť ťažké reakcie alebo dokonca šok. Okamžité opatrenia závisia od závažnosti reakcie (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovaniePrípady predávkovania (až 2‑násobkom odporúčanej dávky) boli hlásené v rámci sledovania po uvedení lieku na trh. S predávkovaním sa nespájali žiadne nežiaduce reakcie.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: vírusová očkovacia látka, ATC kód: J07BD52'
Imunitná odpoveď u detí vo veku od 12 mesiacov a staršíchV klinických štúdiách s deťmi vo veku od 12 mesiacov do 2 rokov sa preukázala vysoká imunogenita PRIORIXu.
Očkovanie jednorázovou dávkou PRIORIXu vyvolalo tvorbu protilátok proti osýpkam u 98,1 % očkovaných jedincov, proti príušniciam u 94,4 % očkovaných jedincov a proti ružienke u 100 % očkovaných jedincov, ktorí boli predtým séronegatívni.
Dva roky po základnom očkovaní bola miera sérokonverzie 93,4 % pri osýpkach, 94,4 % pri príušniciach a 100 % pri ružienke.
Hoci nie sú k dispozícii údaje týkajúce sa účinnosti ochrany PRIORIXu, imunogenita sa akceptuje ako dôkaz účinnosti ochrany. Niektoré terénne štúdie však hlásili, že účinnosť voči príušniciam môže byť nižšia ako zistená miera sérokonverzie proti príušniciam.
Imunitná odpoveď u detí vo veku od 9 do 10 mesiacovDo klinickej štúdie bolo zaradených 300 zdravých detí vo veku od 9 do 10 mesiacov v čase podania prvej dávky očkovacej látky. 147 jedincom z nich bol súbežne podaný PRIORIX a VARILRIX. Miera sérokonverzie bola 92,6 % pri osýpkach, 91,5 % pri príušniciach a 100 % pri ružienke. Miera sérokonverzie hlásená po druhej dávke podanej 3 mesiace po prvej dávke bola 100 % pri osýpkach, 99,2 % pri príušniciach a 100 % pri ružienke. Na zaistenie optimálnych imunitných odpovedí sa má preto druhá dávka PRIORIXu podať do troch mesiacov.
Dospievajúci a dospelíBezpečnosť a imunogenita PRIORIXu u dospievajúcich a dospelých neboli špecificky sledované v klinických štúdiách.
Intramuskulárny spôsob podaniaV klinických štúdiách bol obmedzenému počtu jedincov PRIORIX podaný intramuskulárne. Miery sérokonverzie proti trom zložkách očkovacej látky boli porovnateľné s mierami sérokonverzie pozorovanými po subkutánnom podaní.
5.2 Farmakokinetické vlastnostiHodnotenie farmakokinetiky nie je pri očkovacích látkach potrebné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých štúdií bezpečnosti neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok:Aminokyseliny
Laktóza (bezvodá)
Manitol
Sorbitol
Rozpúšťadlo:Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti2 roky.
Očkovacia látka sa má podať ihneď po rekonštitúcii. Ak to nie je možné, musí sa uchovávať pri teplote 2 °C ‑ 8 °C a použiť do 8 hodín od rekonštitúcie.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte a prepravujte v chlade (2 °C – 8 °C)
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaPrášok v injekčnej liekovke (sklo typu I) s gumovou zátkou.
0,5 ml roztok v naplnenej injekčnej striekačke (sklo typu I) s gumovou piestovou zátkou s ihlami alebo bez ihiel, v nasledujúcich veľkostiach balenia:
- s 1 oddelenou ihlou: veľkosť balenia po 20 alebo 40 ks.
- s 2 oddelenými ihlami: veľkosť balenia po 1, 10, 25 alebo 100 ks.
- bez ihly: veľkosť balenia po 1, 10, 20, 25, 40 alebo 100 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPred podaním sa má rozpúšťadlo a rekonštituovaná očkovacia látka opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu. V prípade ich výskytu sa má rozpúšťadlo alebo rekonštituovaná očkovacia látka zlikvidovať.
Očkovacia látka sa musí rekonštituovať pridaním celého obsahu naplnenej injekčnej striekačky s rozpúšťadlom do injekčnej liekovky obsahujúcej prášok.
Pripojte ihlu k injekčnej striekačke tak, ako je znázornené na obrázku. Injekčná striekačka dodávaná s očkovacou látkou PRIORIX môže byť však trochu odlišná (bez skrutkovacieho závitu), ako je injekčná striekačka popísaná nižšie.
V tomto prípade sa má ihla pripojiť bez skrutkovania.
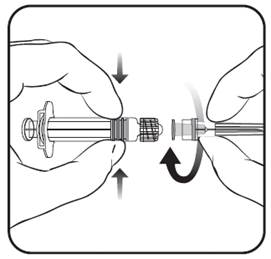
 IhlaInjekčná striekačka
IhlaInjekčná striekačka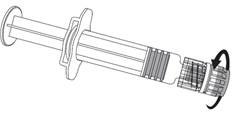

piest injekčnej striekačky
|
|
1. Držte
valec injekčnej striekačky v jednej ruke (vyhnite sa držaniu piestu injekčnej striekačky). Odskrutkujte uzáver injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
2. Pripojte ihlu k injekčnej striekačke tak, že otáčajte ihlu v smere hodinových ručičiek do injekčnej striekačky, pokým nepocítite uzamknutie (pozri obrázok).
3.
Odstráňte chránič ihly,čo môže ísť občas trochu ťažšie.
Pridajte rozpúšťadlo k prášku. Po pridaní rozpúšťadla k prášku sa má zmes dobre pretrepať, až kým sa prášok v rozpúšťadle úplne nerozpustí.
Farba rekonštituovanej očkovacej látky sa kvôli miernym zmenám jej pH môže meniť od číro ružovkastožltej po fuksiovo ružovú bez toho, že by to nepriaznivo ovplyvnilo účinnosť očkovacej látky.
Na podanie očkovacej látky sa má použiť nová ihla.
Treba podať celý obsah injekčnej liekovky.
Je potrebné vyhnúť sa kontaktu s dezinfekčnými látkami (pozri časť 4.4).
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlaxoSmithKline Biologicals S.A., rue de l´Institut 89, 1330 Rixensart, Belgicko
8. REGISTRAČNÉ ČÍSLO59/0069/99-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 29. jún 1999
Dátum posledného predĺženia registrácie: 24. august 2007
10. DÁTUM REVÍZIE TEXTUDecember 2013